引用本文: 曹靖靖, 韓菲菲, 寇振宇, 東莉潔, 李文博, 梁景黎. 缺氧狀態下SB431542對視網膜血管內皮細胞的作用. 中華眼底病雜志, 2023, 39(12): 1004-1009. doi: 10.3760/cma.j.cn511434-20221107-00590 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
病理性視網膜新生血管是早產兒和工作年齡成人視力喪失的主要原因[1]。研究發現,缺氧可促使血管內皮生長因子(VEGF)的增加進而誘導視網膜內皮細胞的通透性和增殖,從而導致視網膜新生血管生成[2-3]。盡管抗VEGF藥物治療是目前的主要治療方式,但長期抗VEGF藥物治療可能導致結締組織生長因子增加,加重視網膜纖維化[4]。氧誘導視網膜病變(OIR)模型可用于對眼部疾病潛在抗VEGF藥物驗證研究[5]。轉化生長因子-β(TGF-β)信號傳導的分子途徑在新生血管形成方面發揮重要作用[6]。SB431542為TGF-β信號傳導抑制劑,可抑制脂多糖誘導的人臍靜脈內皮細胞血管生成的能力[7-8]。另有研究發現,SB431542可通過阻斷Smad2/3通路抑制乳腺癌細胞系和異種移植物中的血管模擬生成[9]。目前尚無有關SB431542在視網膜新生血管方面的研究。本研究通過體內OIR模型聯合體外細胞實驗分析SB431542在缺氧環境中對人視網膜微血管內皮細胞(hRMEC)增殖、遷移、管腔形成以及糖酵解水平的影響,旨在確定SB431542在hRMEC中的作用。現將結果報道如下。
1 材料和方法
1.1 體內動物實驗
本研究經天津醫科大學眼科醫院動物倫理委員會審批(批準號:TJYY20190103002);實驗動物飼養及操作均遵循國家科學技術委員會《實驗動物管理條例》的規定。
OIR模型建立和分組。C57BLKS/J小鼠,雌雄不限,無特定病原體級;北京維通利華實驗動物技術有限公司提供。將小鼠分為正常組、OIR組、OIR組+二甲基亞砜(DMSO)組、OIR+SB431542組。正常組小鼠在正常氧環境下飼養。其余3組小鼠參照文獻[10]的方法構建OIR模型。小鼠12日齡時,OIR+DMSO組、OIR+SB431542組小鼠按體重腹腔注射10 mg/kg DMSO溶液或SB431542儲備溶液。正常組小鼠不作任何處理。小鼠17日齡時,頸椎脫臼法處死小鼠后摘除眼球,進行后續實驗,實驗重復6次。
作視網膜鋪片觀察視網膜新生血管情況。用0.3% Triton X-100(北京索萊寶科技有限公司)和5%牛血清白蛋白(美國Sigma公司)處理視網膜。將視網膜置入IB4熒光染料(0.2 mg/ml,美國Invitrogen公司)中孵育過夜。采用共聚焦顯微鏡觀察并記錄小鼠視網膜新生血管面積、無灌注區面積。
蘇木精-伊紅(HE)染色計數突破視網膜內界膜(ILM)的血管內皮細胞核數。每組隨機選取2只小鼠眼球,4%多聚甲醛中4 ℃固定過夜;常規脫水、透明、浸蠟,石蠟包埋,作6 μm厚度連續切片。每只眼球取切片10張常規脫蠟后行HE染色[11]。40倍光學顯微鏡下觀察拍照。全視野雙盲法計數突破ILM的血管內皮細胞核數。計數血管內皮細胞核時僅計數與ILM有緊密聯系的細胞核,不含玻璃體腔內與ILM無聯系的其他血管內皮細胞核。
1.2 體外細胞實驗
細胞培養和分組。原代hRMEC(美國Cell Systems Corpor公司)置于含20%胎牛血清、50 U/ml內皮細胞生長因子以及1%胰島素轉鐵蛋白硒組合的內皮細胞基礎生長培養基中[12],37 ℃、5% CO2細胞培養箱培養。將細胞分為正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組。正常組細胞常規培養。其余3組細胞置于專用培養箱,2% O2中培養(通過注入N2)。細胞缺氧3 h后更換培養基,正常條件下進行后續實驗。缺氧刺激后,缺氧+DMSO組、缺氧+SB431542組分別加入10 μmol/L DMSO、SB431542處理細胞48 h。實驗重復3次。
噻唑藍(MTT)比色法檢測細胞增殖情況。各組細胞以1×105個/ml的密度接種于96孔板[13],加入MTT前,在顯微鏡下每組隨機拍攝5張不同視野照片。其后按照說明書加入MTT孵育4 h,棄上清液,加入150 μl DMSO,室溫靜置15 min,酶聯免疫檢測儀在490 nm波長下測定各孔細胞吸光度[A,舊稱光密度(OD)]值。實驗重復3次。
Matrigel體外三維成型法檢測SB431542對hRMEC管腔形成的影響。24孔板中每孔加入50 μl Matrigel膠,于37 ℃敷箱中放置30 min[14]。每孔加入1×105個細胞,37 ℃培養箱中孵育。6 h后,蔡司數碼相機拍攝管腔形成情況。每組隨機選取5張不同視野照片,計數管腔形成數量并取平均值。
細胞劃痕實驗檢測hRMEC內細胞遷移情況。以細胞密度6×105個/孔接種于6孔板,每孔最終體系為2 ml,待生長融合為單層細胞后,用100~1 000 μl微量加樣槍頭于每孔中央行“十”字形劃痕[15],磷酸鹽緩沖液沖洗后拍照。按實驗分組給予干預刺激,常規培養24 h后于相同位置再次拍照,觀察各孔細胞向裸區遷移情況,采用CellSens Standard軟件測量裸區面積。實驗重復3次,按以下公式計算遷移率。遷移率=(S0-St)/ S0×100%(S0:原始裸區面積;St:各時間點裸區面積)。每組隨機選取5張不同視野照片,計數遷移情況并取平均值。
Seahorse XFe 96細胞能量代謝儀檢測細胞外酸化率(ECAR)。hRMEC以細胞密度2×104個/孔接種于XFe 96孔微孔板中,各組進行相應處理后,依次添加10 mmo/L葡萄糖、1 μmo/L寡霉素、50 mmo/L 2-脫氧葡萄糖,測定糖酵解、糖酵解能力、糖酵解儲備的ECAR。每個標繪值≥3個一式三份孔的平均值,根據基線ECAR和總蛋白水平進行標準化。
1.3 統計學方法
采用SPSS18.0軟件進行統計學分析。計量資料以均數±標準差(x±s)表示。兩組間比較行獨立樣本t檢驗;三組間比較行單因素方差分析。采用Graph-Prism軟件對數據進行圖表整理。P<0.05為差異有統計學意義。
2 結果
2.1 OIR模型建立成功
視網膜鋪片結果顯示,OIR組中視網膜新生血管面積(t=41.621)、無灌注區面積(t=32.182)均顯著高于正常組,差異有統計學意義(P<0.001)(圖1)。
 圖1
OIR組和正常組小鼠視網膜新生血管情況比較(n=6)
圖1
OIR組和正常組小鼠視網膜新生血管情況比較(n=6)
1A示正常組視網膜鋪片共聚焦顯微鏡像,無新生血管生成(標尺:200 μm );1B、1C示OIR組視網膜鋪片共聚焦顯微鏡像(標尺:200 μm ),可見視網膜新生血管區(1B白色區域)及無灌注區(1C白色區域);1D示兩組小鼠視網膜新生血管面積比較,***
2.2 SB431542抑制OIR小鼠模型視網膜新生血管形成
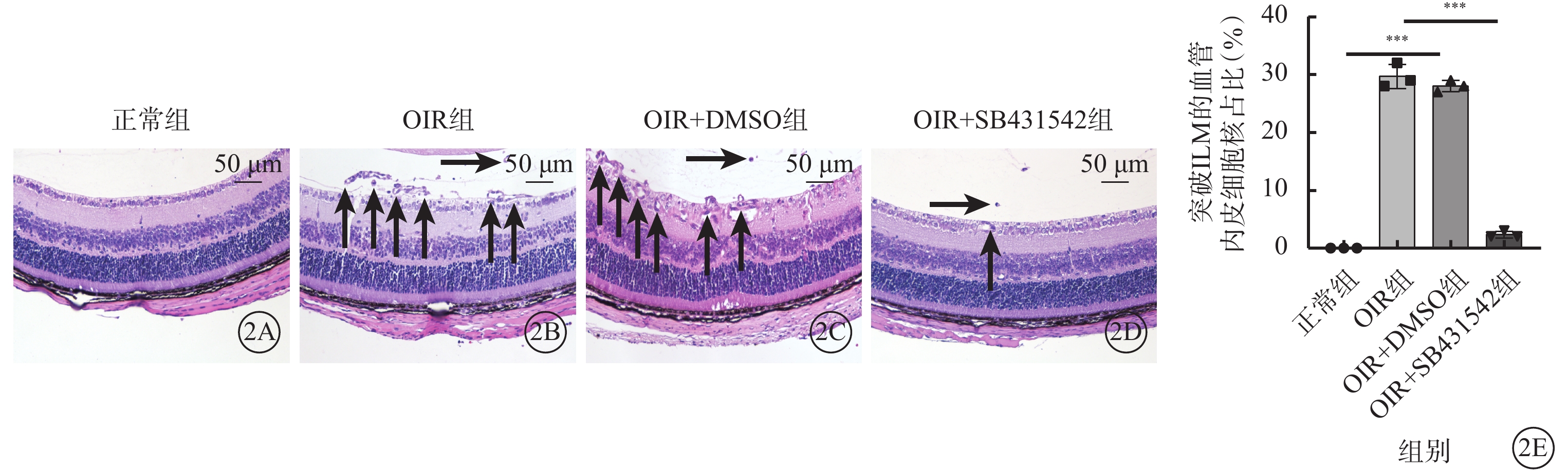
光學顯微鏡觀察發現,正常組小鼠視網膜中未見突破ILM的血管內皮細胞核;OIR組、OIR+DMSO組小鼠視網膜中均可見大量突破ILM的血管內皮細胞核;OIR+SB431542組小鼠視網膜中可見少量突破ILM的血管內皮細胞核(圖2A~2D)。正常組、OIR組、OIR+DMSO組、OIR+SB431542組突破ILM的血管內皮細胞核數比較,差異有統計學意義(F=36.183,P<0.001)(圖2E)。
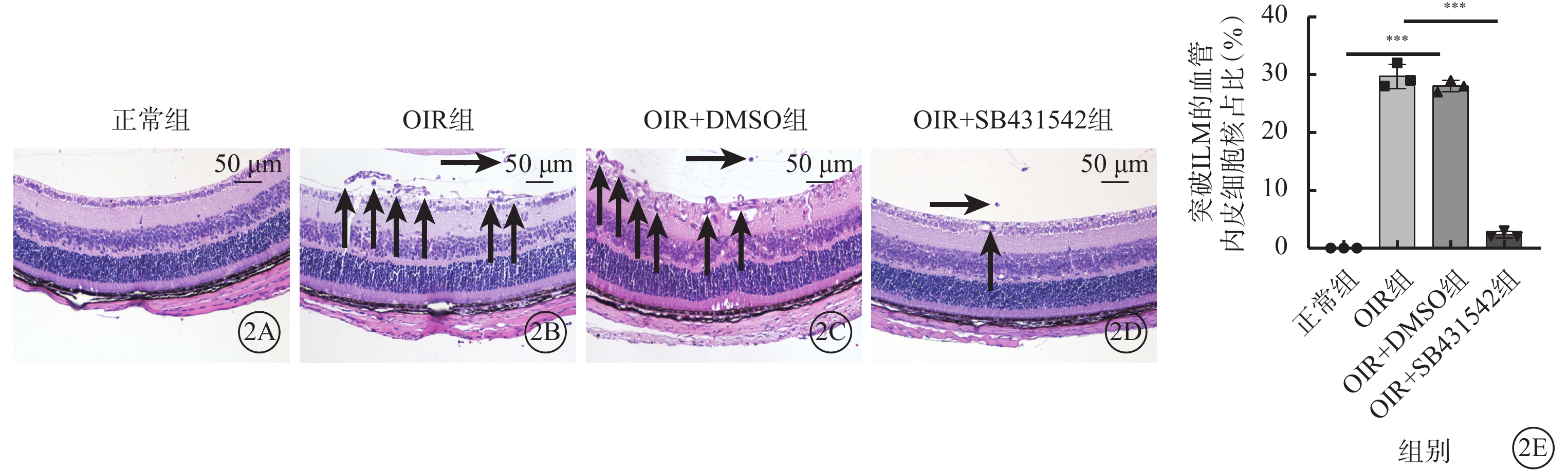 圖2
正常組、OIR組、OIR+DMSO組、OIR+SB431542組小鼠視網膜中突破ILM的血管內皮細胞核數比較(n=6)
圖2
正常組、OIR組、OIR+DMSO組、OIR+SB431542組小鼠視網膜中突破ILM的血管內皮細胞核數比較(n=6)
2A~2D分別示正常組、OIR組、OIR+DMSO組、OIR+SB431542組視網膜切片光學顯微鏡像(蘇木精-伊紅染色,標尺:50 μm)。正常組小鼠視網膜中未見突破ILM的血管內皮細胞核;OIR組、OIR+DMSO組小鼠視網膜中可見大量突破ILM的血管內皮細胞核(黑箭);OIR+SB431542組小鼠視網膜中可見少量突破ILM的血管內皮細胞核(黑箭)。2E示各組突破ILM的血管內皮細胞核數量比較,***
2.3 SB431542抑制缺氧誘導的hRMEC細胞增殖
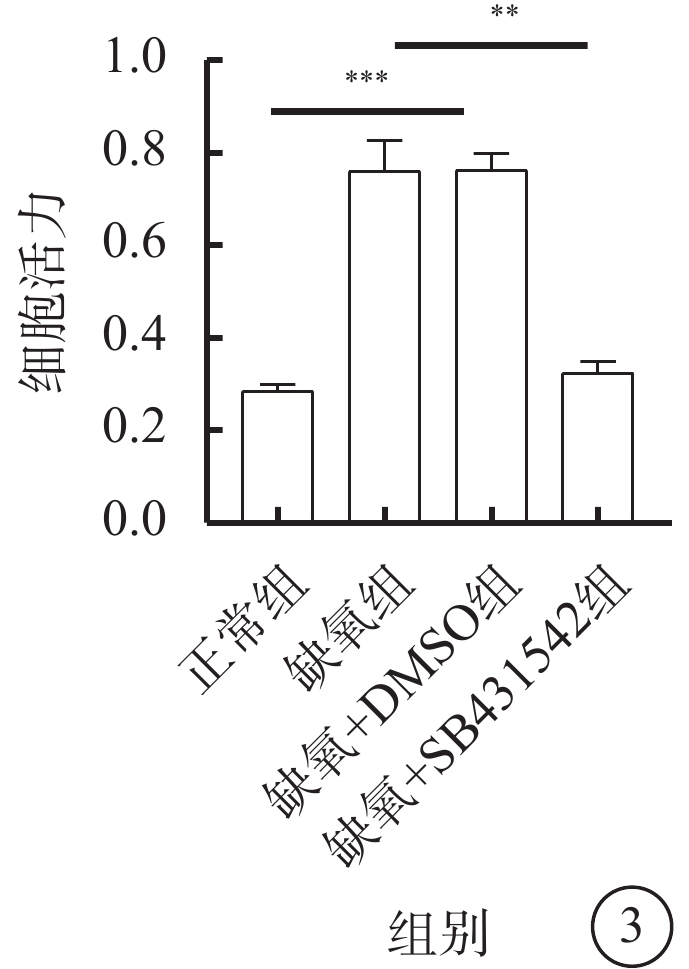
MTT比色法檢測結果顯示,與正常組、缺氧+SB431542組比較,缺氧組、缺氧+DMSO組細胞增殖顯著增多,差異有統計學意義(F=39.316,P<0.01)。缺氧+SB431542組細胞增殖較缺氧+DMSO組顯著降低,差異有統計學意義(t=26.182,P<0.001)(圖3)。
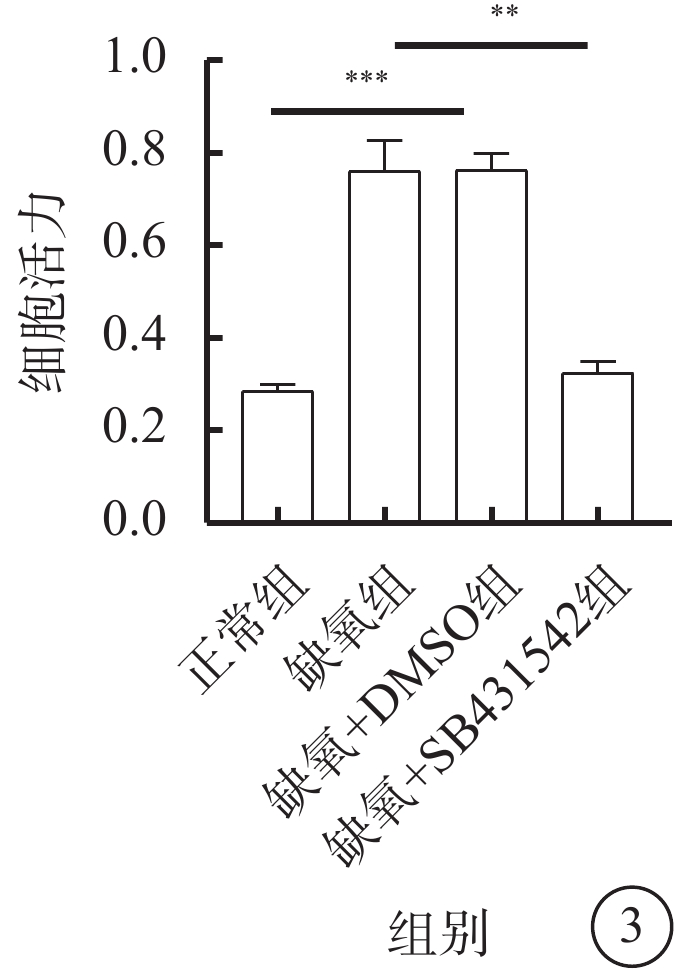 圖3
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞增殖情況比較(n=3)
圖3
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞增殖情況比較(n=3)
hRMEC:人視網膜微血管內皮細胞;DMSO:二甲基亞砜;**
2.4 SB431542抑制缺氧誘導的hRMEC血管生成、細胞遷移
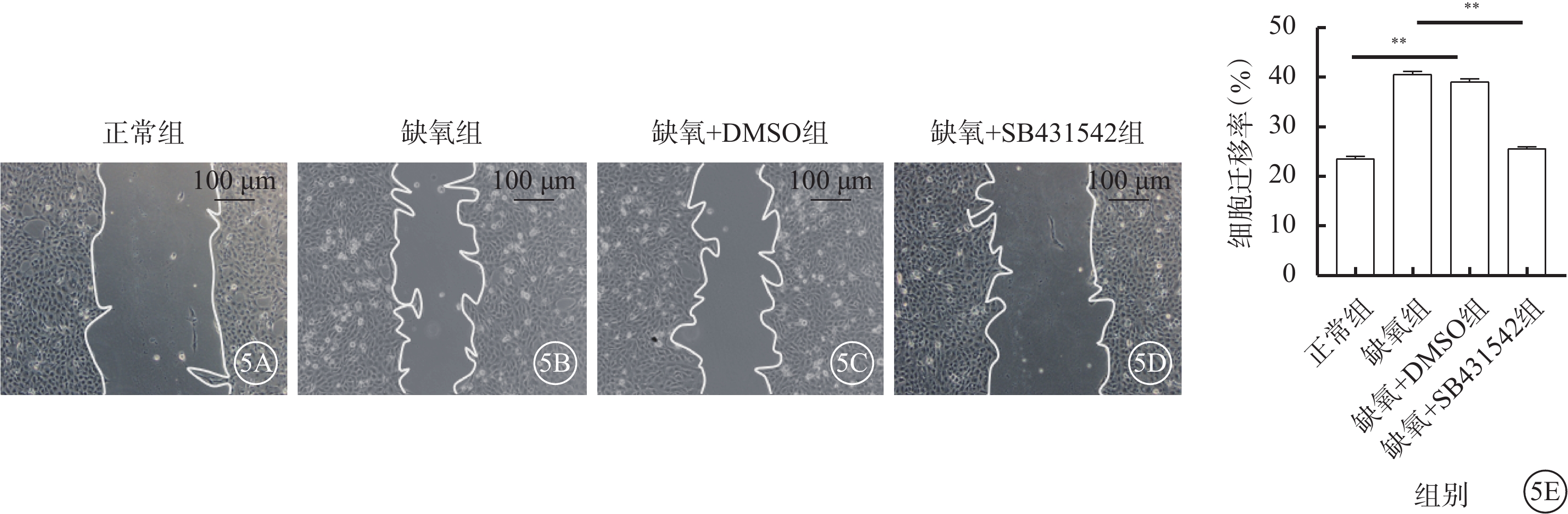
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞完整管腔形成數分別為(2.0±0.4)、(18.4±1.09)、(16.13±3.43)、(4.2±0.16)個,遷移細胞數分別為(23.04±1.24)%、(40.27±2.03)%、(39.7±1.23)%、(25.17±0.17)%;四組完整管腔形成數、遷移細胞數比較,差異均有統計學意義(F=34.513、41.862,P<0.001、<0.01)。與缺氧+DMSO組比較,缺氧+SB431542組細胞完整管腔形成數、遷移細胞數明顯下降,差異有統計學意義(t=44.723、31.178,P<0.001、<0.01)(圖4,5)。
 圖4
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞完整管腔形成數比較(n=3)
圖4
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞完整管腔形成數比較(n=3)
4A~4D分別示正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組倒置相差顯微鏡像(標尺:100 μm)。與缺氧組、缺氧+DMSO組比較,正常組、缺氧+SB431542組細胞完整管腔形成數明顯減少。4E示各組細胞完整管腔形成數比較,***
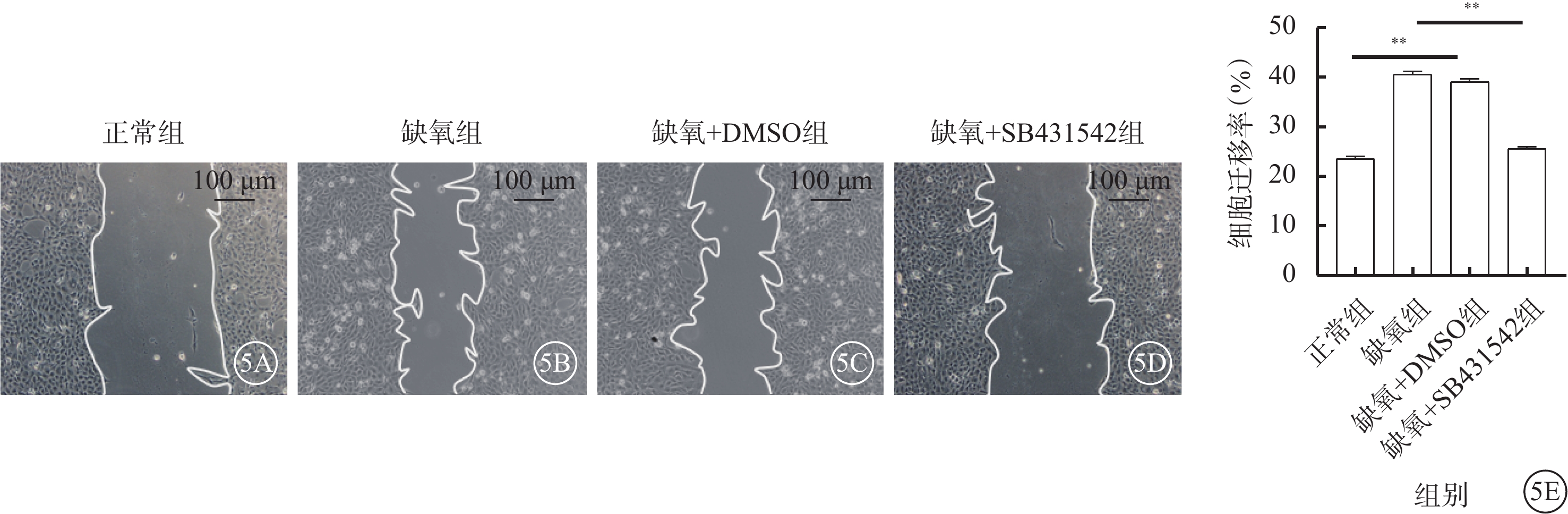 圖5
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組遷移細胞數比較(n=3)
圖5
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組遷移細胞數比較(n=3)
5A~5D分別示正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞顯微鏡像(標尺:100 μm)。正常組、缺氧+SB431542組僅有少量細胞遷移進入裸區,缺氧組、缺氧+DMSO組可見大量細胞遷移進入裸區。5E示各組細胞遷移率比較,**
2.5 SB431542導致缺氧條件下線粒體糖酵解能力的改變
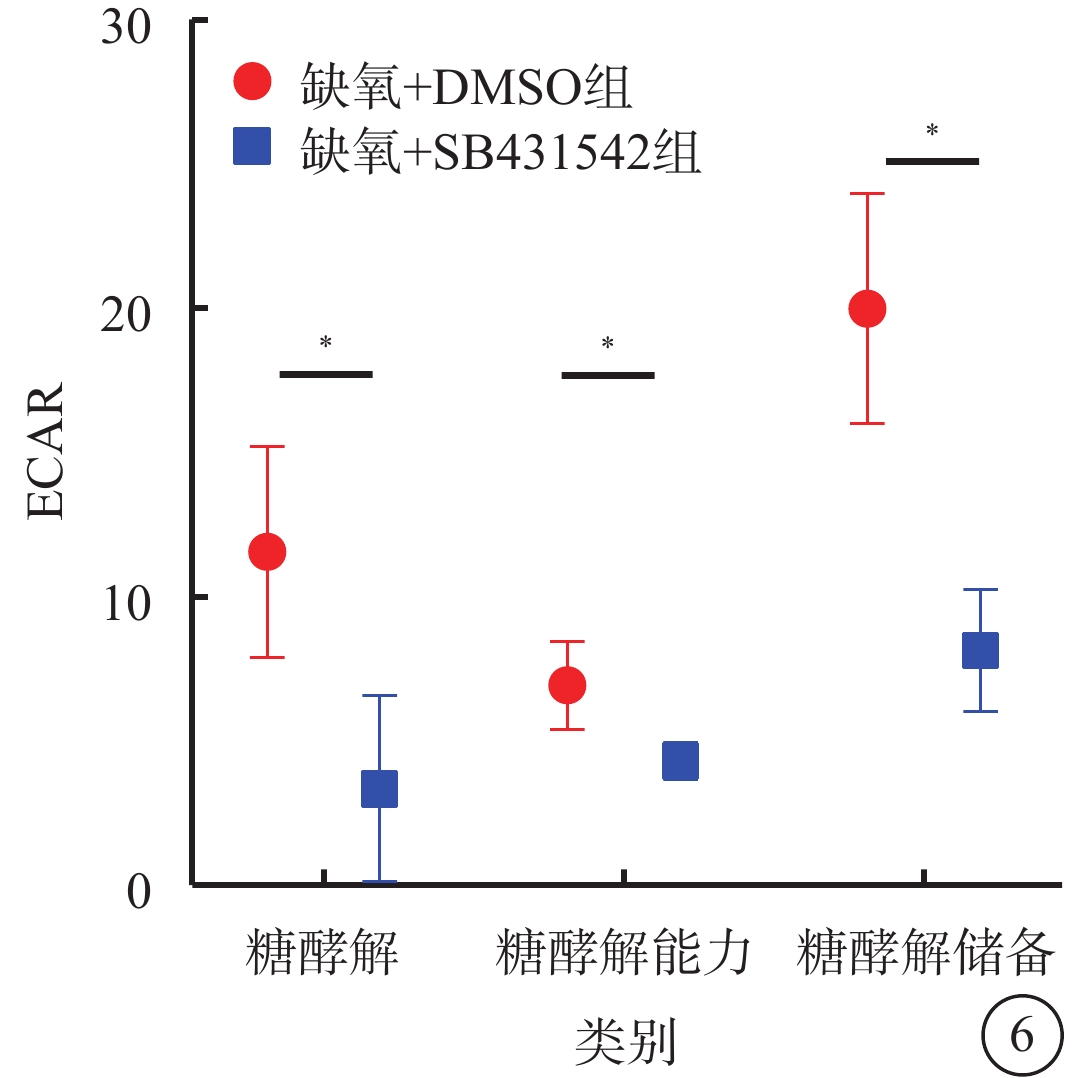
細胞能量代謝測定結果顯示,缺氧+DMSO組、缺氧+SB431542組細胞內糖酵解、糖酵解儲備、糖酵解容量的ECAR分別為(10.27±3.99)%、(8.01±2.05)%,(20.17±4.82)%、(4.04±3.54)%,(5.05±0.28)%、(8.02±2.15)%;與缺氧+DMSO組比較,缺氧+SB431542組細胞內糖酵解、糖酵解儲備的ECAR降低,糖酵解容量的ECAR增高,差異均有統計學意義(t=26.175、33.623、37.276,P<0.05)(圖6)。
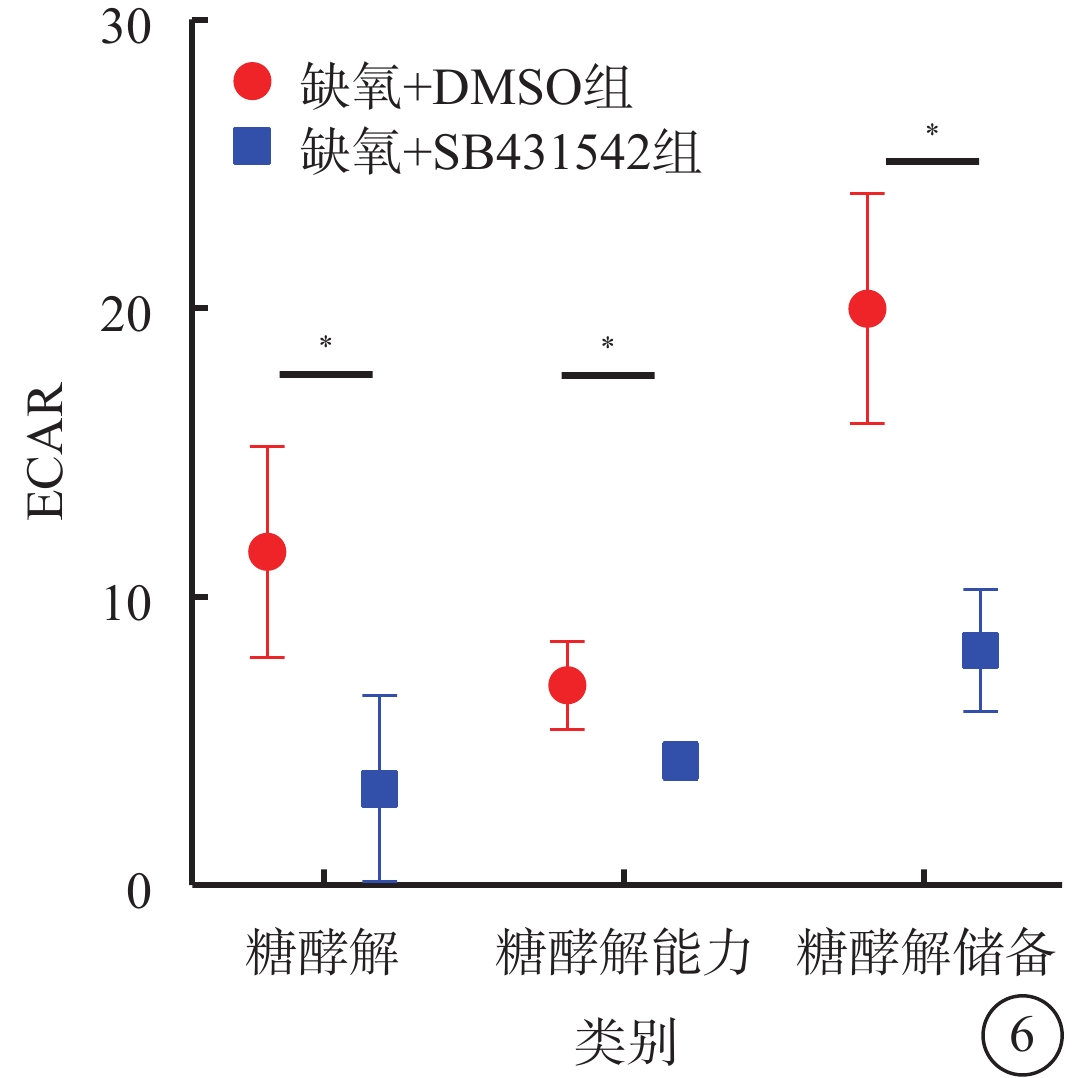 圖6
缺氧+DMSO組、缺氧+SB431542組hRMEC內糖酵解水平比較(n=3)hRMEC:人視網膜微血管內皮細胞;DMSO:二甲基亞砜;ECAR:細胞外酸化率;*P<0.01
圖6
缺氧+DMSO組、缺氧+SB431542組hRMEC內糖酵解水平比較(n=3)hRMEC:人視網膜微血管內皮細胞;DMSO:二甲基亞砜;ECAR:細胞外酸化率;*P<0.01
3 討論
研究顯示TGF-β家族可促進新生血管形成[16]。在缺血小鼠腦內發現了TGF-β相關通路的激活,并促進小鼠血管生成及抑制細胞凋亡[17]。在黑色素瘤進展中,亦發現有TGF-β的參與,可通過直接影響腫瘤細胞運動性和侵襲性以發揮其促瘤功能,同時伴有血管形成[18]。TGF-β誘導眼眶成纖維細胞促血管生成活性可被姜黃素抑制[19]。本研究中體內實驗發現,TGF-β信號傳導抑制劑SB431542可降低OIR小鼠視網膜新生血管數量;體外細胞實驗發現,SB431542可抑制hRMEC的增殖、遷移以及侵襲能力,其與新生血管形成相關。
視網膜是生物體內代謝最活躍的組織之一,對氧水平變化極為敏感[20]。TGF-β信號通路在調節葡萄糖和能量穩態中發揮重要作用,通過阻斷其信號傳導可預防肥胖和糖尿病[21]。TGF-β被發現可誘導癌癥在上皮間充質轉化(EMT)過程中發生代謝重編程,伴有糖酵解水平的增加[22]。在眼部疾病中,TGF-β可抑制視網膜色素上皮細胞的線粒體呼吸,與糖酵解水平增加相關[23]。本研究通過檢測TGF-β信號傳導抑制劑SB431542對hRMEC中ECAR指標以表征糖酵解水平的變化,發現SB431542可抑制缺氧條件下誘導的hRMEC中糖酵解水平的升高。
本研究體內實驗結果顯示,給予SB431542處理后可以抑制OIR小鼠模型視網膜新生血管生成;體外細胞實驗結果顯示,SB431542可降低缺氧誘導的細胞成管能力、細胞增殖及細胞遷移率。這表明SB431542可能在抑制視網膜新生血管形成中發揮重要作用。此外,本研究還證實在hRMEC中SB431542可以抑制糖酵解水平,這可能在調節hRMEC對缺氧反應的變化中起著至關重要的作用。因此,本研究結果表明SB431542或許是新生血管相關眼病的潛在治療靶點。
SB431542是TGF-β信號傳導過程中的抑制劑,本研究目前僅主要通過細胞實驗觀察了SB431542對細胞增殖、遷移及糖酵解水平的影響。未來我們將通過體內實驗進行驗證,并深入探索SB431542對TGF-β相關信號通路的影響,旨在多方位、更全面的為臨床應用提供理論基礎。
病理性視網膜新生血管是早產兒和工作年齡成人視力喪失的主要原因[1]。研究發現,缺氧可促使血管內皮生長因子(VEGF)的增加進而誘導視網膜內皮細胞的通透性和增殖,從而導致視網膜新生血管生成[2-3]。盡管抗VEGF藥物治療是目前的主要治療方式,但長期抗VEGF藥物治療可能導致結締組織生長因子增加,加重視網膜纖維化[4]。氧誘導視網膜病變(OIR)模型可用于對眼部疾病潛在抗VEGF藥物驗證研究[5]。轉化生長因子-β(TGF-β)信號傳導的分子途徑在新生血管形成方面發揮重要作用[6]。SB431542為TGF-β信號傳導抑制劑,可抑制脂多糖誘導的人臍靜脈內皮細胞血管生成的能力[7-8]。另有研究發現,SB431542可通過阻斷Smad2/3通路抑制乳腺癌細胞系和異種移植物中的血管模擬生成[9]。目前尚無有關SB431542在視網膜新生血管方面的研究。本研究通過體內OIR模型聯合體外細胞實驗分析SB431542在缺氧環境中對人視網膜微血管內皮細胞(hRMEC)增殖、遷移、管腔形成以及糖酵解水平的影響,旨在確定SB431542在hRMEC中的作用。現將結果報道如下。
1 材料和方法
1.1 體內動物實驗
本研究經天津醫科大學眼科醫院動物倫理委員會審批(批準號:TJYY20190103002);實驗動物飼養及操作均遵循國家科學技術委員會《實驗動物管理條例》的規定。
OIR模型建立和分組。C57BLKS/J小鼠,雌雄不限,無特定病原體級;北京維通利華實驗動物技術有限公司提供。將小鼠分為正常組、OIR組、OIR組+二甲基亞砜(DMSO)組、OIR+SB431542組。正常組小鼠在正常氧環境下飼養。其余3組小鼠參照文獻[10]的方法構建OIR模型。小鼠12日齡時,OIR+DMSO組、OIR+SB431542組小鼠按體重腹腔注射10 mg/kg DMSO溶液或SB431542儲備溶液。正常組小鼠不作任何處理。小鼠17日齡時,頸椎脫臼法處死小鼠后摘除眼球,進行后續實驗,實驗重復6次。
作視網膜鋪片觀察視網膜新生血管情況。用0.3% Triton X-100(北京索萊寶科技有限公司)和5%牛血清白蛋白(美國Sigma公司)處理視網膜。將視網膜置入IB4熒光染料(0.2 mg/ml,美國Invitrogen公司)中孵育過夜。采用共聚焦顯微鏡觀察并記錄小鼠視網膜新生血管面積、無灌注區面積。
蘇木精-伊紅(HE)染色計數突破視網膜內界膜(ILM)的血管內皮細胞核數。每組隨機選取2只小鼠眼球,4%多聚甲醛中4 ℃固定過夜;常規脫水、透明、浸蠟,石蠟包埋,作6 μm厚度連續切片。每只眼球取切片10張常規脫蠟后行HE染色[11]。40倍光學顯微鏡下觀察拍照。全視野雙盲法計數突破ILM的血管內皮細胞核數。計數血管內皮細胞核時僅計數與ILM有緊密聯系的細胞核,不含玻璃體腔內與ILM無聯系的其他血管內皮細胞核。
1.2 體外細胞實驗
細胞培養和分組。原代hRMEC(美國Cell Systems Corpor公司)置于含20%胎牛血清、50 U/ml內皮細胞生長因子以及1%胰島素轉鐵蛋白硒組合的內皮細胞基礎生長培養基中[12],37 ℃、5% CO2細胞培養箱培養。將細胞分為正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組。正常組細胞常規培養。其余3組細胞置于專用培養箱,2% O2中培養(通過注入N2)。細胞缺氧3 h后更換培養基,正常條件下進行后續實驗。缺氧刺激后,缺氧+DMSO組、缺氧+SB431542組分別加入10 μmol/L DMSO、SB431542處理細胞48 h。實驗重復3次。
噻唑藍(MTT)比色法檢測細胞增殖情況。各組細胞以1×105個/ml的密度接種于96孔板[13],加入MTT前,在顯微鏡下每組隨機拍攝5張不同視野照片。其后按照說明書加入MTT孵育4 h,棄上清液,加入150 μl DMSO,室溫靜置15 min,酶聯免疫檢測儀在490 nm波長下測定各孔細胞吸光度[A,舊稱光密度(OD)]值。實驗重復3次。
Matrigel體外三維成型法檢測SB431542對hRMEC管腔形成的影響。24孔板中每孔加入50 μl Matrigel膠,于37 ℃敷箱中放置30 min[14]。每孔加入1×105個細胞,37 ℃培養箱中孵育。6 h后,蔡司數碼相機拍攝管腔形成情況。每組隨機選取5張不同視野照片,計數管腔形成數量并取平均值。
細胞劃痕實驗檢測hRMEC內細胞遷移情況。以細胞密度6×105個/孔接種于6孔板,每孔最終體系為2 ml,待生長融合為單層細胞后,用100~1 000 μl微量加樣槍頭于每孔中央行“十”字形劃痕[15],磷酸鹽緩沖液沖洗后拍照。按實驗分組給予干預刺激,常規培養24 h后于相同位置再次拍照,觀察各孔細胞向裸區遷移情況,采用CellSens Standard軟件測量裸區面積。實驗重復3次,按以下公式計算遷移率。遷移率=(S0-St)/ S0×100%(S0:原始裸區面積;St:各時間點裸區面積)。每組隨機選取5張不同視野照片,計數遷移情況并取平均值。
Seahorse XFe 96細胞能量代謝儀檢測細胞外酸化率(ECAR)。hRMEC以細胞密度2×104個/孔接種于XFe 96孔微孔板中,各組進行相應處理后,依次添加10 mmo/L葡萄糖、1 μmo/L寡霉素、50 mmo/L 2-脫氧葡萄糖,測定糖酵解、糖酵解能力、糖酵解儲備的ECAR。每個標繪值≥3個一式三份孔的平均值,根據基線ECAR和總蛋白水平進行標準化。
1.3 統計學方法
采用SPSS18.0軟件進行統計學分析。計量資料以均數±標準差(x±s)表示。兩組間比較行獨立樣本t檢驗;三組間比較行單因素方差分析。采用Graph-Prism軟件對數據進行圖表整理。P<0.05為差異有統計學意義。
2 結果
2.1 OIR模型建立成功
視網膜鋪片結果顯示,OIR組中視網膜新生血管面積(t=41.621)、無灌注區面積(t=32.182)均顯著高于正常組,差異有統計學意義(P<0.001)(圖1)。
 圖1
OIR組和正常組小鼠視網膜新生血管情況比較(n=6)
圖1
OIR組和正常組小鼠視網膜新生血管情況比較(n=6)
1A示正常組視網膜鋪片共聚焦顯微鏡像,無新生血管生成(標尺:200 μm );1B、1C示OIR組視網膜鋪片共聚焦顯微鏡像(標尺:200 μm ),可見視網膜新生血管區(1B白色區域)及無灌注區(1C白色區域);1D示兩組小鼠視網膜新生血管面積比較,***
2.2 SB431542抑制OIR小鼠模型視網膜新生血管形成
光學顯微鏡觀察發現,正常組小鼠視網膜中未見突破ILM的血管內皮細胞核;OIR組、OIR+DMSO組小鼠視網膜中均可見大量突破ILM的血管內皮細胞核;OIR+SB431542組小鼠視網膜中可見少量突破ILM的血管內皮細胞核(圖2A~2D)。正常組、OIR組、OIR+DMSO組、OIR+SB431542組突破ILM的血管內皮細胞核數比較,差異有統計學意義(F=36.183,P<0.001)(圖2E)。
 圖2
正常組、OIR組、OIR+DMSO組、OIR+SB431542組小鼠視網膜中突破ILM的血管內皮細胞核數比較(n=6)
圖2
正常組、OIR組、OIR+DMSO組、OIR+SB431542組小鼠視網膜中突破ILM的血管內皮細胞核數比較(n=6)
2A~2D分別示正常組、OIR組、OIR+DMSO組、OIR+SB431542組視網膜切片光學顯微鏡像(蘇木精-伊紅染色,標尺:50 μm)。正常組小鼠視網膜中未見突破ILM的血管內皮細胞核;OIR組、OIR+DMSO組小鼠視網膜中可見大量突破ILM的血管內皮細胞核(黑箭);OIR+SB431542組小鼠視網膜中可見少量突破ILM的血管內皮細胞核(黑箭)。2E示各組突破ILM的血管內皮細胞核數量比較,***
2.3 SB431542抑制缺氧誘導的hRMEC細胞增殖
MTT比色法檢測結果顯示,與正常組、缺氧+SB431542組比較,缺氧組、缺氧+DMSO組細胞增殖顯著增多,差異有統計學意義(F=39.316,P<0.01)。缺氧+SB431542組細胞增殖較缺氧+DMSO組顯著降低,差異有統計學意義(t=26.182,P<0.001)(圖3)。
 圖3
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞增殖情況比較(n=3)
圖3
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞增殖情況比較(n=3)
hRMEC:人視網膜微血管內皮細胞;DMSO:二甲基亞砜;**
2.4 SB431542抑制缺氧誘導的hRMEC血管生成、細胞遷移
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞完整管腔形成數分別為(2.0±0.4)、(18.4±1.09)、(16.13±3.43)、(4.2±0.16)個,遷移細胞數分別為(23.04±1.24)%、(40.27±2.03)%、(39.7±1.23)%、(25.17±0.17)%;四組完整管腔形成數、遷移細胞數比較,差異均有統計學意義(F=34.513、41.862,P<0.001、<0.01)。與缺氧+DMSO組比較,缺氧+SB431542組細胞完整管腔形成數、遷移細胞數明顯下降,差異有統計學意義(t=44.723、31.178,P<0.001、<0.01)(圖4,5)。
 圖4
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞完整管腔形成數比較(n=3)
圖4
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞完整管腔形成數比較(n=3)
4A~4D分別示正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組倒置相差顯微鏡像(標尺:100 μm)。與缺氧組、缺氧+DMSO組比較,正常組、缺氧+SB431542組細胞完整管腔形成數明顯減少。4E示各組細胞完整管腔形成數比較,***
 圖5
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組遷移細胞數比較(n=3)
圖5
正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組遷移細胞數比較(n=3)
5A~5D分別示正常組、缺氧組、缺氧+DMSO組、缺氧+SB431542組細胞顯微鏡像(標尺:100 μm)。正常組、缺氧+SB431542組僅有少量細胞遷移進入裸區,缺氧組、缺氧+DMSO組可見大量細胞遷移進入裸區。5E示各組細胞遷移率比較,**
2.5 SB431542導致缺氧條件下線粒體糖酵解能力的改變
細胞能量代謝測定結果顯示,缺氧+DMSO組、缺氧+SB431542組細胞內糖酵解、糖酵解儲備、糖酵解容量的ECAR分別為(10.27±3.99)%、(8.01±2.05)%,(20.17±4.82)%、(4.04±3.54)%,(5.05±0.28)%、(8.02±2.15)%;與缺氧+DMSO組比較,缺氧+SB431542組細胞內糖酵解、糖酵解儲備的ECAR降低,糖酵解容量的ECAR增高,差異均有統計學意義(t=26.175、33.623、37.276,P<0.05)(圖6)。
 圖6
缺氧+DMSO組、缺氧+SB431542組hRMEC內糖酵解水平比較(n=3)hRMEC:人視網膜微血管內皮細胞;DMSO:二甲基亞砜;ECAR:細胞外酸化率;*P<0.01
圖6
缺氧+DMSO組、缺氧+SB431542組hRMEC內糖酵解水平比較(n=3)hRMEC:人視網膜微血管內皮細胞;DMSO:二甲基亞砜;ECAR:細胞外酸化率;*P<0.01
3 討論
研究顯示TGF-β家族可促進新生血管形成[16]。在缺血小鼠腦內發現了TGF-β相關通路的激活,并促進小鼠血管生成及抑制細胞凋亡[17]。在黑色素瘤進展中,亦發現有TGF-β的參與,可通過直接影響腫瘤細胞運動性和侵襲性以發揮其促瘤功能,同時伴有血管形成[18]。TGF-β誘導眼眶成纖維細胞促血管生成活性可被姜黃素抑制[19]。本研究中體內實驗發現,TGF-β信號傳導抑制劑SB431542可降低OIR小鼠視網膜新生血管數量;體外細胞實驗發現,SB431542可抑制hRMEC的增殖、遷移以及侵襲能力,其與新生血管形成相關。
視網膜是生物體內代謝最活躍的組織之一,對氧水平變化極為敏感[20]。TGF-β信號通路在調節葡萄糖和能量穩態中發揮重要作用,通過阻斷其信號傳導可預防肥胖和糖尿病[21]。TGF-β被發現可誘導癌癥在上皮間充質轉化(EMT)過程中發生代謝重編程,伴有糖酵解水平的增加[22]。在眼部疾病中,TGF-β可抑制視網膜色素上皮細胞的線粒體呼吸,與糖酵解水平增加相關[23]。本研究通過檢測TGF-β信號傳導抑制劑SB431542對hRMEC中ECAR指標以表征糖酵解水平的變化,發現SB431542可抑制缺氧條件下誘導的hRMEC中糖酵解水平的升高。
本研究體內實驗結果顯示,給予SB431542處理后可以抑制OIR小鼠模型視網膜新生血管生成;體外細胞實驗結果顯示,SB431542可降低缺氧誘導的細胞成管能力、細胞增殖及細胞遷移率。這表明SB431542可能在抑制視網膜新生血管形成中發揮重要作用。此外,本研究還證實在hRMEC中SB431542可以抑制糖酵解水平,這可能在調節hRMEC對缺氧反應的變化中起著至關重要的作用。因此,本研究結果表明SB431542或許是新生血管相關眼病的潛在治療靶點。
SB431542是TGF-β信號傳導過程中的抑制劑,本研究目前僅主要通過細胞實驗觀察了SB431542對細胞增殖、遷移及糖酵解水平的影響。未來我們將通過體內實驗進行驗證,并深入探索SB431542對TGF-β相關信號通路的影響,旨在多方位、更全面的為臨床應用提供理論基礎。