引用本文: 顧競賽, 陳震, 徐奕爽, 鄭紅梅, 花蒂豪. 過表達Krüppel樣因子7對小鼠視神經鉗夾后視網膜神經節細胞保護作用及機制研究. 中華眼底病雜志, 2024, 40(4): 303-310. doi: 10.3760/cma.j.cn511434-20230504-00196 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
視網膜神經節細胞(RGC)可以接收和整合來自視網膜中其他神經元的信號,但其受損后不易再生[1]。此外,RGC為單向軸突傳遞途徑,只有當其受損部位的神經纖維再生或修復后才能傳導視覺信息,而不能依靠側支軸突傳導信號[2]。青光眼、缺血性視神經病變和視神經挫傷常伴有RGC損傷,但此類疾病一直缺乏成效的治療方法,所以促進神經細胞修復、再生是目前研究熱點。Krüppel樣因子(KLF)是一組高度保守的鋅指蛋白轉錄因子家族,在調節細胞分化、生長和發育等生物學過程中發揮重要作用[3-4]。文獻報道,KLF4、KLF5、KLF7等可能參與調節神經元存活、軸突生長和引導以及突觸形成[5-8]。此外,神經元成熟后KLF7表達下調,阻礙KLF7發揮保護神經和促神經軸突再生的功能[9]。KLF7在視神經、視網膜損傷中研究較少且機制尚未明確。視神經鉗夾損傷(ONC)是一種建立視神經和RGC急性損傷模型的成熟方法,具有手術操作簡單、建模周期短、成功率高等特點[10]。本研究建立小鼠ONC模型,通過重組腺相關病毒(rAAV)載體過表達小鼠視網膜KLF7,初步探索KLF7對小鼠ONC后RGC的保護作用及其保護機制。現將結果報道如下。
1 材料和方法
1.1 材料
健康C57BL/6J小鼠87只,10周齡,體重18~22 g,無特定病原體(SPF)級(武漢大學A3實驗動物中心),飼養于湖北省人民醫院動物中心SPF級環境中,所有流程嚴格按照《武漢大學實驗動物護理與使用指南》規定,并獲得武漢大學實驗動物倫理委員會許可[倫理編號:WDRM動(福)第20190113號]。過表達KLF7的rAAV載體[rAVV- KLF7-重組增強綠色熒光蛋白(EGFP)]、僅攜帶EGFP的空白腺相關病毒載體(AAV2-EGFP)(上海吉凱基因有限公司);KLF7、神經生長因子(NGF)、生長相關蛋白43(GAP43)、腦源性神經營養因子(BNDF)、胱天蛋白酶3(Caspase-3)、B淋巴細胞瘤-2(Bcl-2)(美國Abcam公司);甘油醛-3-磷酸脫氫酶(GAPDH)、抗綠色熒光蛋白抗體(武漢賽維爾公司);酪氨酸激酶A(TrkA)、磷酸化TrkA(pTrkA)(美國Affinity Biosciences公司);酪氨酸激酶B(TrkB)(武漢三鷹生物技術有限公司),磷酸化TrkB(pTrkB)(北京博奧森生物技術公司);Bcl-2相關X蛋白(BAX)(美國CST公司)。
1.2 病毒構建
rAVV-KLF7-EGFP載體為GV388,序列元件CMV bGlobin-MCS-EGFP-3FLAG-WPRE-hGH polyA,構建針對KLF7的小發夾(sh)RNA-rAAV2。基因插入位點為KpnI/BamHI。KLF7目的基因片段,正向引物:GGAGGTAGTGGAATGGATCCCGCCACCATGGACGTGTTGGCTAGTTATAG;反向引物:TCACCATGGTGGCGGGATCGATATGTCTCTTCATAT GGAGCG。提純并使用稀釋梯度法測量病毒滴度。rAVV2-EGFP、rAVV2-shRNA(KLF7)-EGFP滴度分別為3.34×1012、1.20×1012 vg/ml。分裝凍存于-80 ℃冰箱。
1.3 實驗動物分組和ONC模型建立
采用隨機數字表法將小鼠分為對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組,每組分別為7、2、4只小鼠;ONC后3 d組(ONC-3組)、7 d組(ONC-7組)、14 d組(ONC-14組),每組各3只小鼠;空白對照組(A組)、玻璃體腔注射(IVT)rAVV2-KLF7-EGFP后4周組(B組)、IVT磷酸鹽緩沖液(PBS)后4周ONC組(C組)、IVT rAVV2-KLF7-EGF后4周ONC(D組)、IVT rAVV2-EGFP后4周ONC組(E組),每組各13只小鼠。
ONC-3 d組、ONC-7組、ONC-14 d組建立ONC模型。小鼠10周齡時,參照文獻[10]的方法雙眼建立ONC模型。小鼠腹腔注射戊巴比妥鈉麻醉后,鹽酸奧布卡因點眼表面麻醉,于顳側角鞏緣后2~3 mm處剪開球結膜,鈍性分離暴露視神經,恒壓反向鑷于球后視神經近端2 mm處鉗夾視神經并持續10 s,過程中可觀察到模型眼瞳孔逐漸散大,直接對光反射消失。剔除ONC建模失敗、手術中視神經周圍血管出血、手術后眼底出血的小鼠。
rAVV2-EGFP組、E組和rAVV2-KLF7-EGFP組、B組、D組小鼠雙眼分別于角鞏膜緣下2.0 mm處行IVT rAVV2-EGFP、rAVV2-shRNA(KLF7)-EGFP 1 μl,病毒滴度分別為3.34×1012、1.20×1012 vg/ml。C組小鼠雙眼IVT等體積PBS。IVT后4周,C組、D組、E組建立ONC模型。
1.4 激光共聚焦顯微鏡觀察病毒轉染情況
IVT后4周,分別隨機選取對照組、rAVV2-KLF7-EGFP組小鼠各2只,頸椎脫臼法處死摘除眼球。眼球扎孔后在脂肪酸合成酶眼球固定液中固定1 h,取視網膜置于30%蔗糖溶液過夜脫水,OCT膠包埋后用冰切機切成厚度為14 μm的切片,用抗綠色熒光蛋白抗體(1∶1 000)孵育,激光共聚焦顯微鏡觀察病毒轉染情況。
1.5 全視網膜鋪片免疫熒光染色計數RGC存活率
ONC建模后7 d,隨機選取A組、B組、C組、D組、E組小鼠各3只,頸椎脫臼法處死小鼠。參照文獻[11]的方法,取出眼球置于組織固定液中固定1 h。手術顯微鏡下完整分離視網膜組織,并將其置于PBS中漂洗5 min,3次,室溫環境下牛血清白蛋白洗膜緩沖液(含5%牛血清白蛋白,0.4%的Triton X-100的PBS)封閉2 h;Brn3a一抗(1∶500)4 ℃孵育48 h,PBS漂洗后AlexaFluor594 免疫球蛋白G二抗(1∶500)4 ℃孵育24 h,PBS漂洗后視網膜上剪4個切口呈“四葉草狀”鋪平,抗熒光淬滅封片劑封片,熒光顯微鏡觀察拍攝,10×40倍視野下,分別在距視盤約1/6、1/2、5/6半徑處取3個視野,4個視網膜瓣共12個視野,拍照并應用ImageJ軟件對存活RGC進行計數。
1.6 蛋白質免疫印跡法(Western blot)檢測視網膜組織中蛋白表達
隨機選取對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組小鼠各2只,對照組、ONC-3組、ONC-7組、ONC-14組小鼠各3只,ONC建模后7 d,A組、B組、C組、D組、E組小鼠各10只,頸椎脫臼法處死并摘除眼球,提取視網膜總蛋白,二喹啉甲酸法測定蛋白濃度。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳、制膠與上樣、轉膜、抗體孵育,孵育盒分別孵育KLF7(1∶10 000)、NGF(1∶1 000)、TrkA(1∶2 000)、pTrkA(1∶500)、TrkB(1∶1 000)、pTrkB(1∶5 000)、GAP43(1∶500)、BNDF(1∶1 000)、GAPDH(1∶10 000)、Bcl-2(1∶10 000)、BAX抗體(1∶2 000)、Caspase-3。其后加入辣根過氧化物偶聯的二抗,化學發光底物試劑盒制備免疫反應條帶,使用ImageJ軟件分析每個條帶的灰度值,以GAPDH作為內參照,評估目的蛋白的相對表達量。
1.7 統計學方法
采用GraphPad Prism 8.0進行統計分析。計量資料以均數±標準差(x±s)表示。符合正態分布的數據,組間比較采用單因素方差分析,并使用Tukey校正檢驗;不符合正態分布的數據,組間比較采用Kruskal-Wallis檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 rAAV2-KLF7-EGFP成功轉染至視網膜
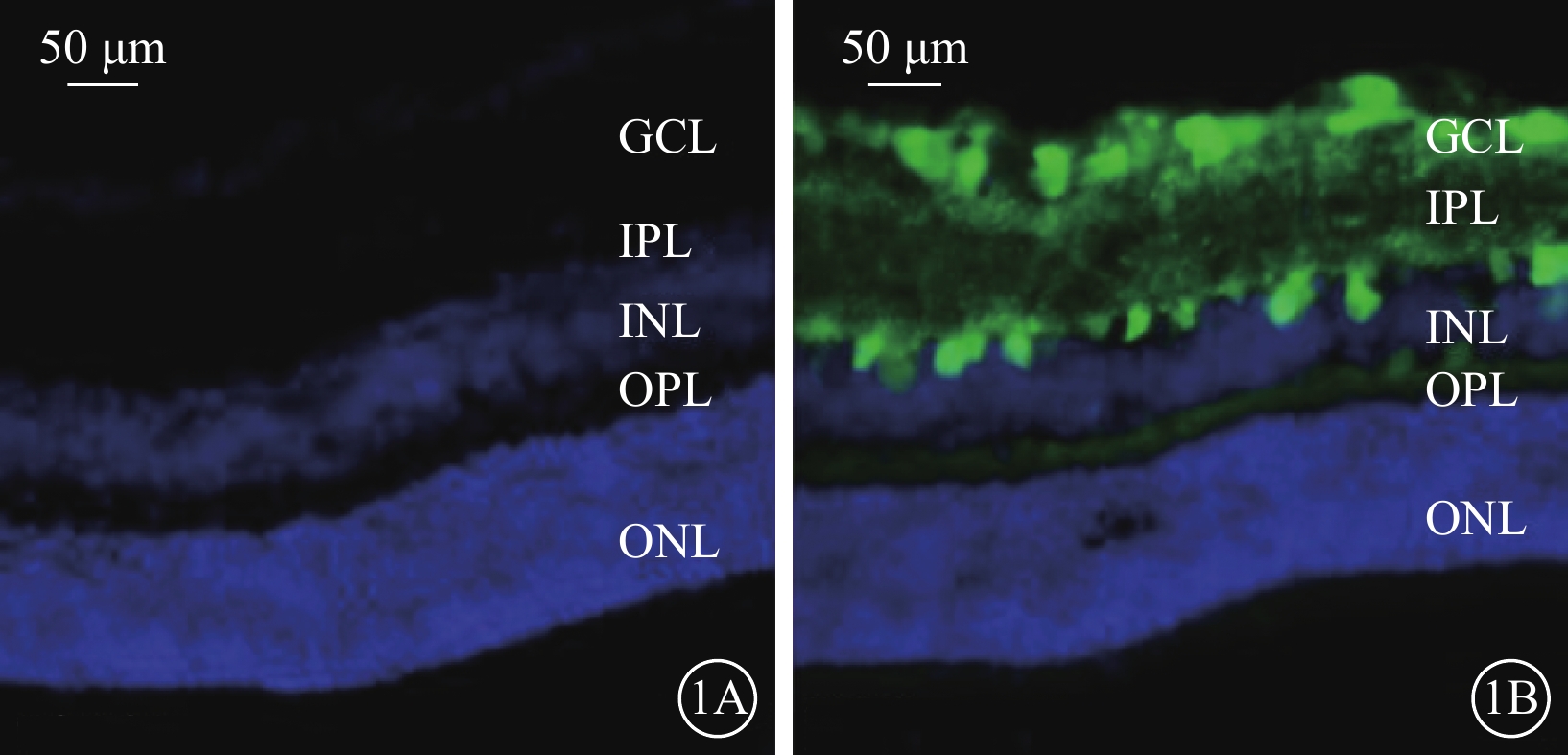
熒光顯微鏡觀察結果顯示,對照組小鼠視網膜各細胞層未見綠色熒光染色(圖1A)。rAVV2-KLF7-EGFP組小鼠視網膜神經節細胞層、內叢狀層(IPL)可見強熒光;內核層、外叢狀層熒光較弱;外核層未見明顯熒光(圖1B)。
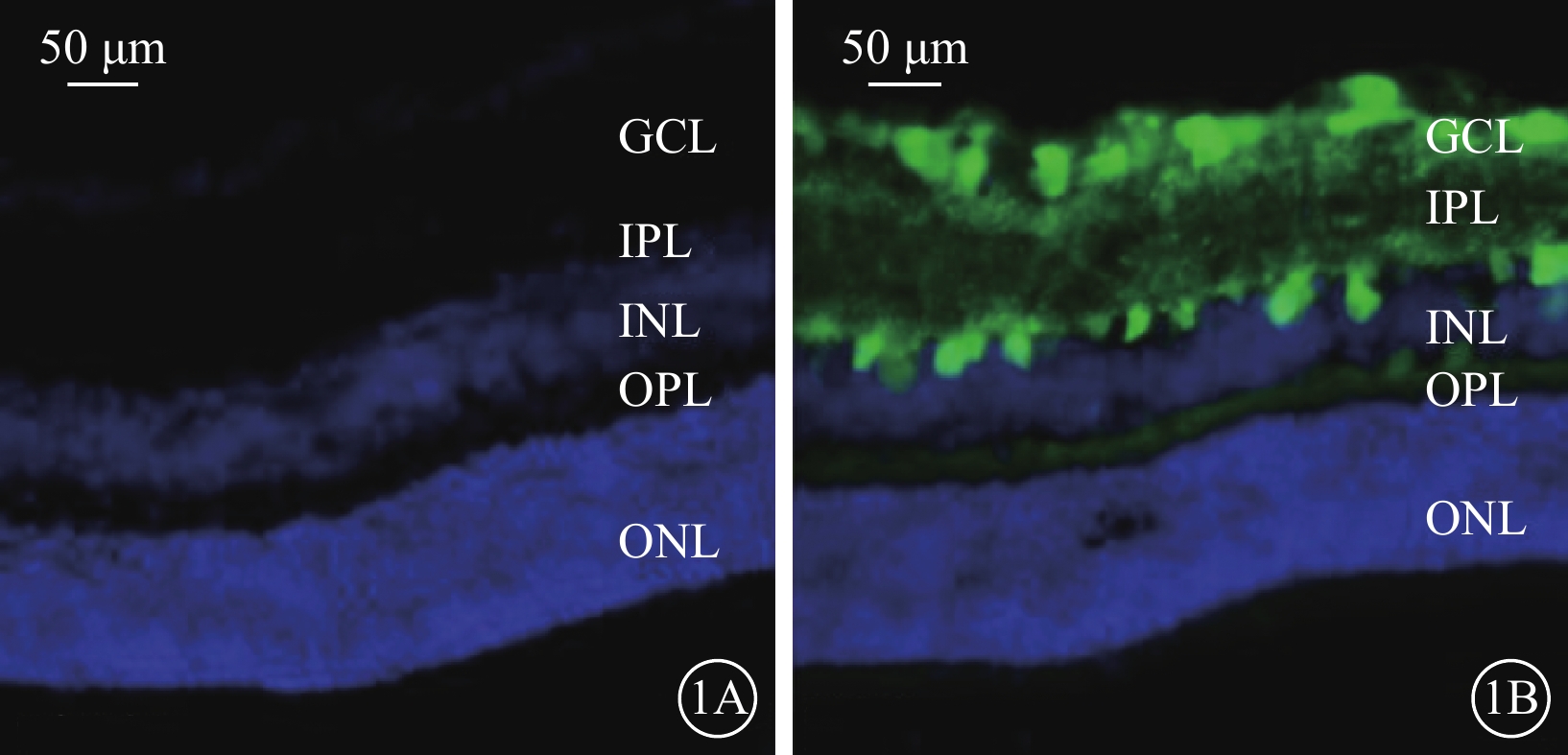 圖1
對照組、rAVV2-KLF7-EGFP組小鼠視網膜組織熒光顯微鏡像(EGFP+DAPI,標尺:50 μm)
圖1
對照組、rAVV2-KLF7-EGFP組小鼠視網膜組織熒光顯微鏡像(EGFP+DAPI,標尺:50 μm)
1A示對照組,視網膜各細胞層未見綠色熒光染色;1B示rAVV2-KLF7-EGFP組,GCL、IPL可見綠色強熒光,INL、OPL僅見微弱綠色熒光,ONL未見綠色熒光染色 rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;GCL:神經節細胞層;IPL:內叢狀層;INL:內核層;OPL:外叢狀層;DAPI:4',6-二脒基-2-苯基吲哚;對照組:不做任何處理;rAVV2-KLF7-EGFP組:玻璃體腔注射rAVV2-小發夾RNA(KLF7)-EGFP
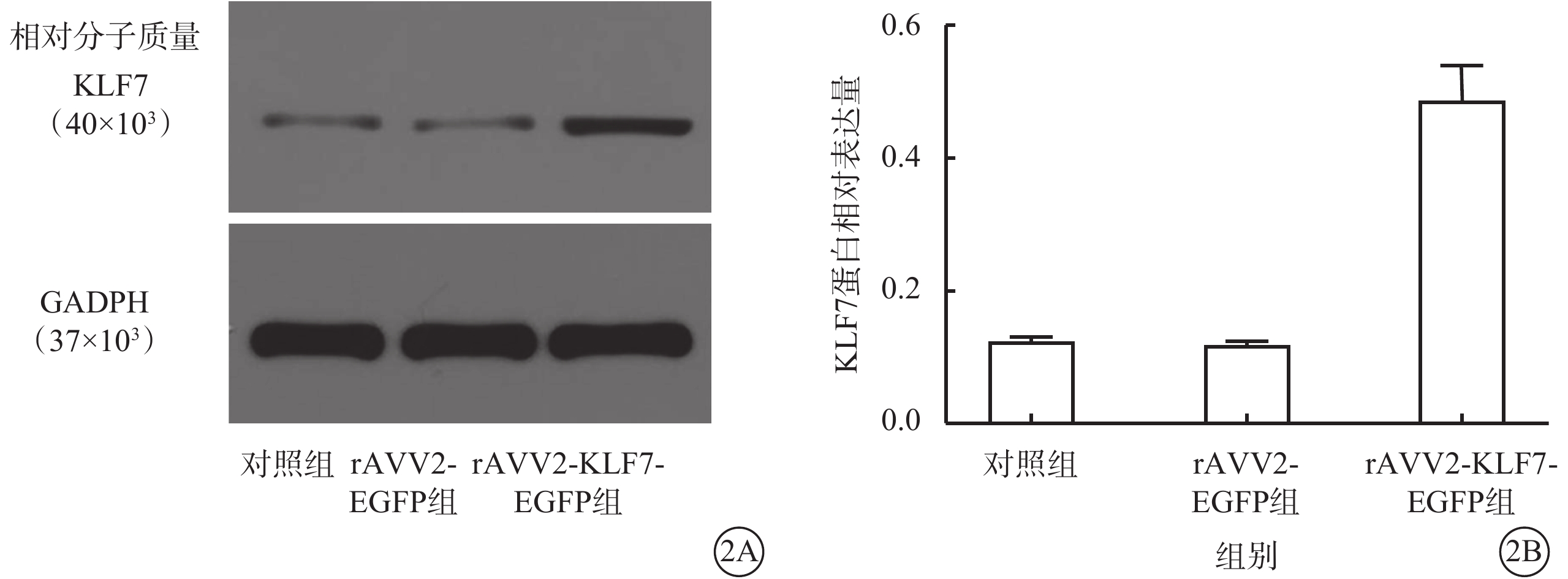
Western blot檢測結果顯示,rAVV2-KLF7-EGFP組、AVV2-EGFP組、對照組小鼠視網膜中KLF7蛋白相對表達量分別為0.489±0.051、0.120±0.004、0.124±0.007;與AVV2-EGFP組、對照組比較,rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白相對表達量顯著升高,差異有統計學意義(F=203.44,P<0.01)(圖2)。組間兩兩比較,rAVV2-KLF7-EGFP組與AVV2-EGFP組、對照組,差異均有統計學意義(P<0.01);對照組與AVV2-EGFP組,差異無統計學意義(P>0.05)。
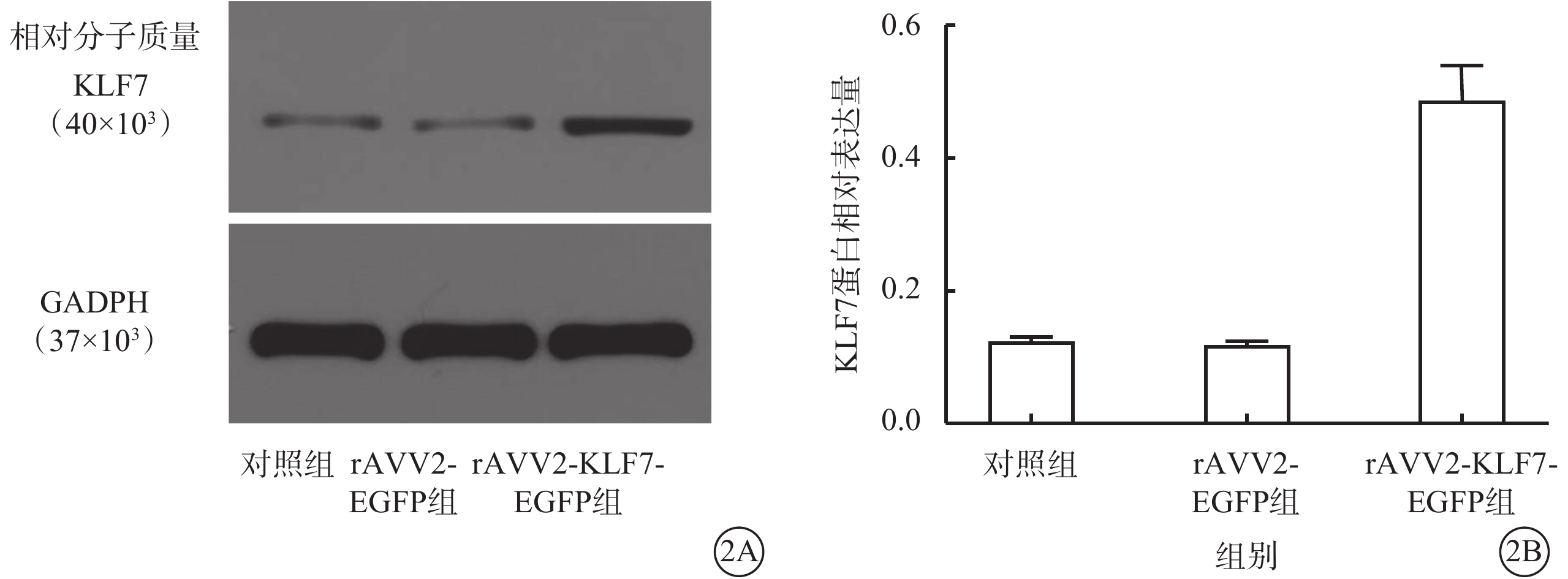 圖2
對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白表達情況(n=2)
圖2
對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白表達情況(n=2)
2A示電泳圖;2B示3組視網膜中KLF7蛋白表達結果,與對照組、rAVV2-EGFP組比較,rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白表達顯著升高 rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;GAPDH:甘油醛-3-磷酸脫氫酶;對照組:不做任何處理;rAVV2-EGFP組、rAVV2-KLF7-EGFP組:玻璃體腔分別注射rAVV2-EGFP、rAVV2-小發夾RNA(KLF7)-EGFP
2.2 ONC后KLF7表達結果
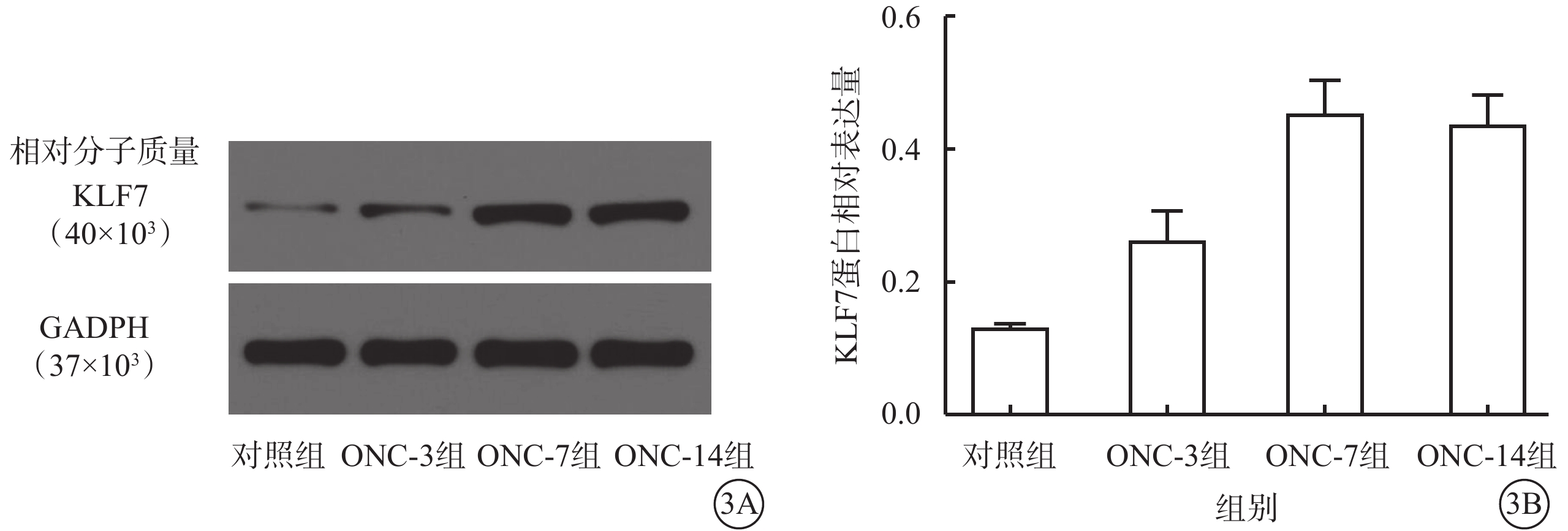
Western blot檢測結果顯示,對照組、ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白相對表達量分別為0.13±0.01、0.26±0.04、0.46±0.04、0.44±0.04;與對照組比較,ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白相對表達量顯著增高,差異均有統計學意義(F=43.52,P<0.01)(圖3)。組間兩兩比較,對照組分別與ONC-3組、ONC-7組、ONC-14組比較,差異均有統計學意義(P<0.01)。
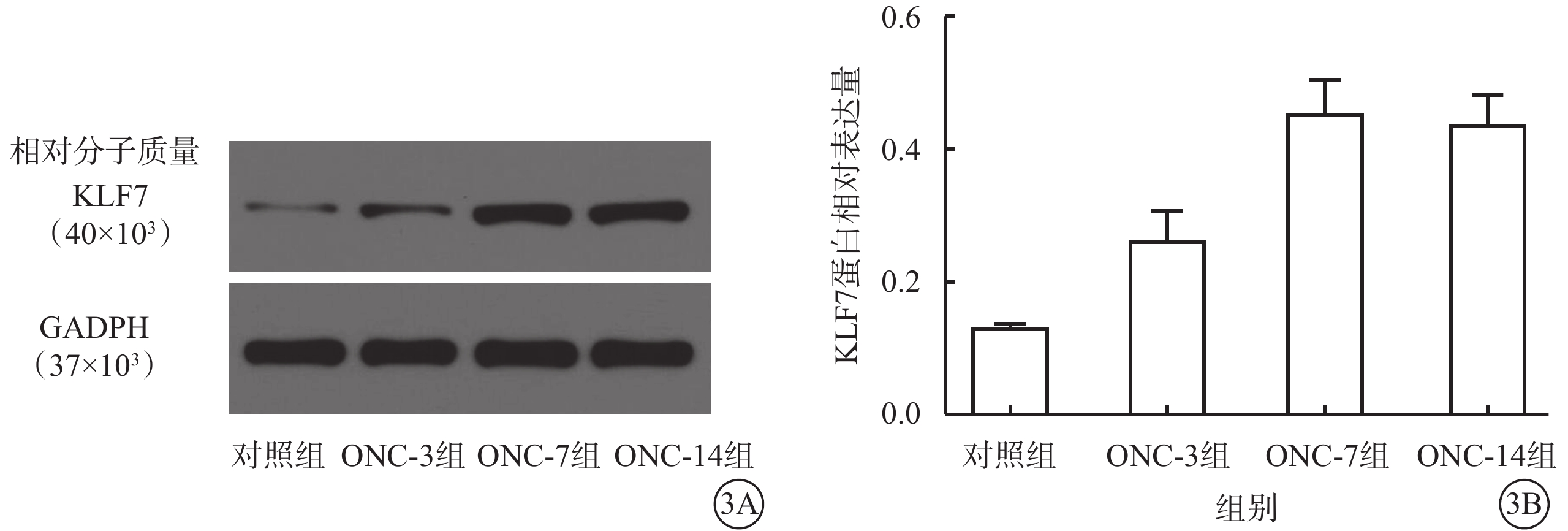 圖3
對照組、ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白表達情況(n=3)
圖3
對照組、ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白表達情況(n=3)
3A示電泳圖;3B示4組視網膜中KLF7蛋白表達結果,與對照組比較,ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白相對表達量顯著增高 KLF7:Krüppel樣因子7;ONC:視神經鉗夾損傷;GAPDH:甘油醛-3-磷酸脫氫酶;對照組:不做任何處理;ONC-3組、ONC-7組、ONC-14組:ONC后3、7、14 d
2.3 RGC存活率檢測結果
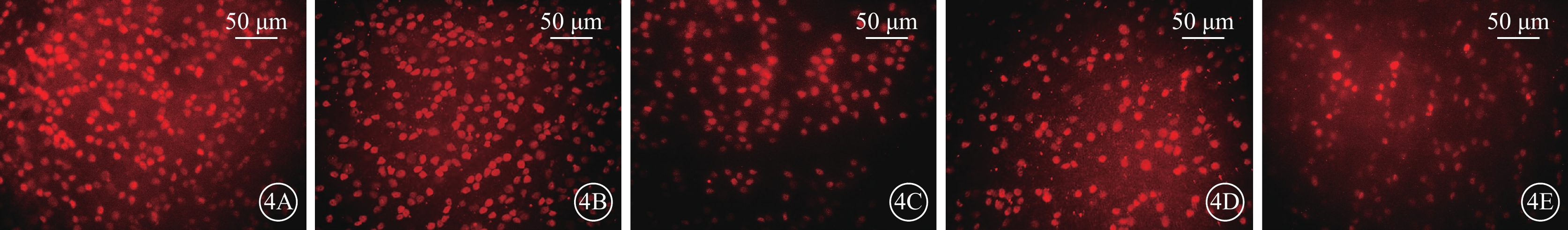
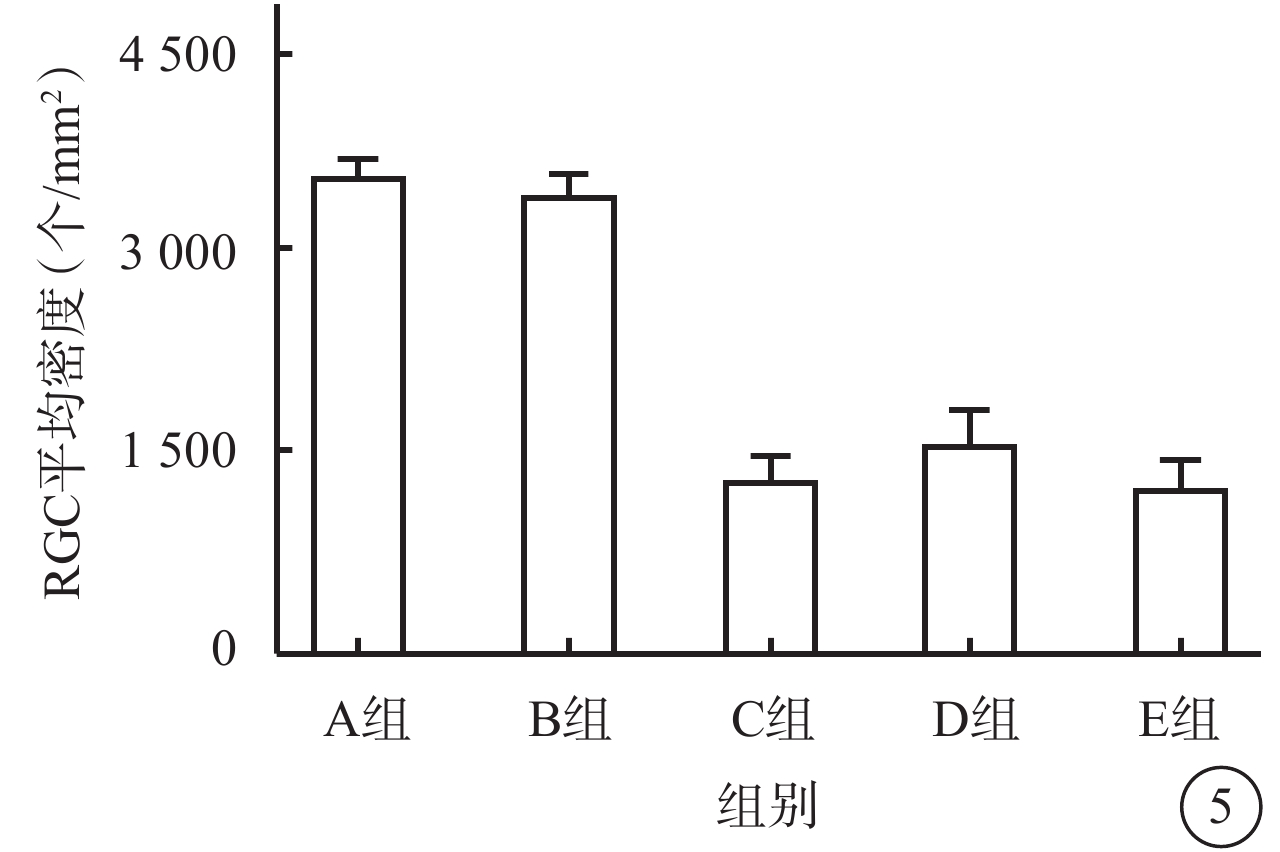
熒光顯微鏡觀察結果顯示,ONC后7 d,A組、B組RGC邊界及細胞亞結構清楚,染色明亮;C組、D組、E組RGC邊界較為模糊,染色較淡,RGC數量較對照組下降,且D組RGC數量較C組、E組相對升高(圖4A~4E)。A組、B組、C組、D組、E組視網膜中RGC密度分別為(3 707.4±12.8)、(3 582.4±13.3)、(1 396.3±16.1)、(1 658.3±22.2)、(1 323.6±16.9)個/mm2;5組RGC密度比較,差異有統計學意義(F=206.90,P<0.01)(圖5);C組、E組RGC存活率較A組、B組顯著減少約65%;D組RGC存活率較C組、E組提高約10%。組間兩兩比較,C組、D組、E組分別與A組、B組,差異均有統計學意義(P<0.01);D組與C組、E組,差異有統計學意義(P=0.028、0.007);其余組間差異均無統計學意義(P>0.05)。
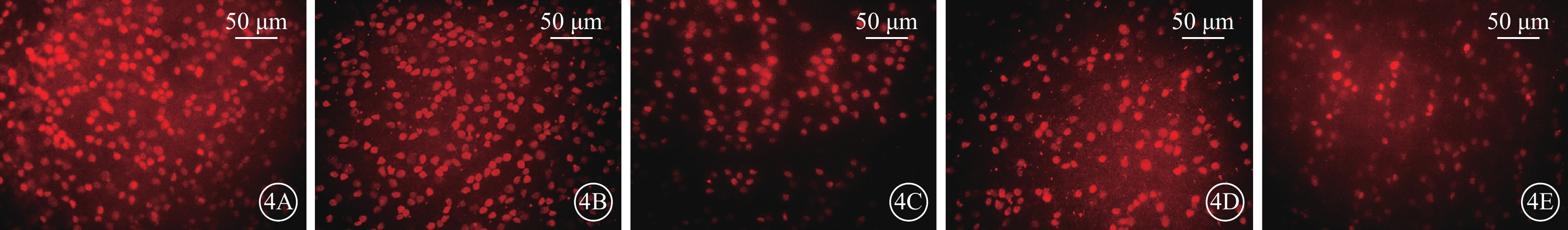 圖4
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜熒光顯微鏡像(Brn3a免疫熒光染色,標尺:50 μm)
圖4
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜熒光顯微鏡像(Brn3a免疫熒光染色,標尺:50 μm)
4A~4E分別示A組、B組、C組、D組、E組,A組、B組RGC邊界及細胞亞結構清楚,染色明亮;C組、D組、E組RGC邊界較為模糊,染色較淡,RGC數量較對照組下降,且D組RGC數量較C組、E組相對升高 RGC:視網膜神經節細胞;rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;ONC:視神經鉗夾損傷;IVT:玻璃體腔注射;A組:空白對照組;B組:IVT rAVV2- KLF7-EGFP后4周;C組:IVT磷酸鹽緩沖液后4周建立ONC模型;D組:IVT rAVV2-KLF7-EGFP后4周建立ONC模型;E組:IVT rAVV2-EGFP后4周建立ONC模型
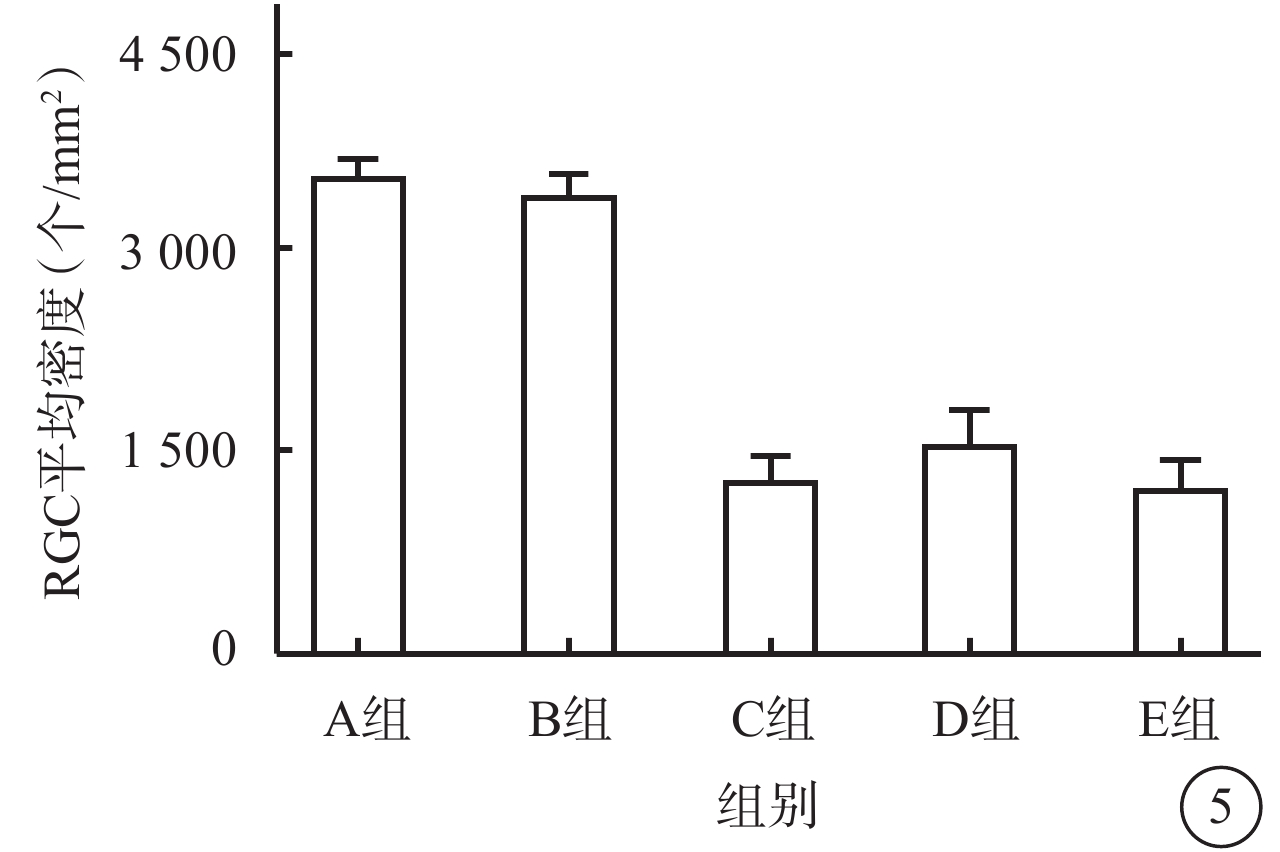 圖5
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中RGC密度比較(n=3)
圖5
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中RGC密度比較(n=3)
RGC:視網膜神經節細胞;rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;ONC:視神經鉗夾損傷;IVT:玻璃體腔注射;A組:空白對照組;B組:IVT rAVV2- KLF7-EGFP后4周;C組:IVT磷酸鹽緩沖液后4周建立ONC模型;D組:IVT rAVV2-KLF7-EGFP后4周建立ONC模型;E組:IVT rAVV2-EGFP后4周建立ONC模型
2.4 視網膜中蛋白表達結果
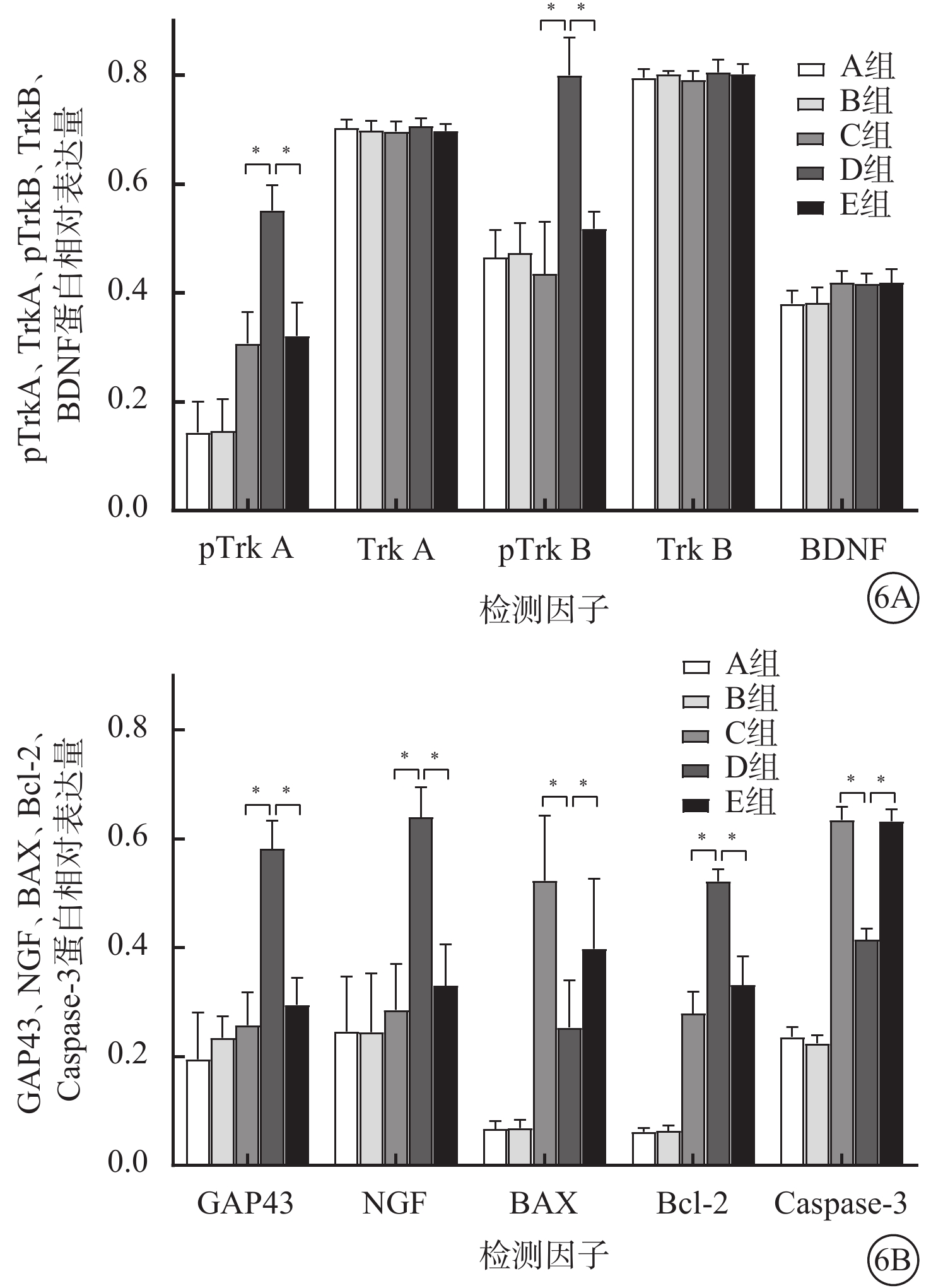
Western blot檢測結果顯示,ONC后7 d,A組、B組、C組、D組、E組小鼠視網膜中NGF、pTrkA、pTrkB、GAP43、Bcl-2、BAX、Caspase-3蛋白相對表達量比較,差異均有統計學意義(F=18.214、44.380、27.559、45.476、193.140、26.160、522.180,P<0.01);TrkA、BDNF、TrkB蛋白相對表達量比較,差異均無統計學意義(F=0.328、1.699、0.600,P>0.05)(圖6)。組間兩兩比較:NGF:D組與A組、B組、C組、E組,差異有統計學意義(P<0.01)。pTrkA:C組、E組、D組分別與A組、B組,差異有統計學意義(P<0.01);D組與C組、E組,差異有統計學意義(P<0.01)。pTrkB、GAP43:D組與A組、B組、C組、E組,差異有統計學意義(P<0.01)。Bcl-2:C組、E組、D組分別與A組、B組,差異均有統計學(P<0.01);D組與C組、E組,差異有統計學意義(P<0.01)。BAX:C組、E組、D組分別與A組、B組,差異均有統計學意義(P<0.05);D組與C組,差異有統計學意義(P<0.01)。Caspase-3:C組、E組、D組分別與A組、B組,差異均有統計學意義(P<0.01);D組與C組、E組,差異均有統計學意義(P<0.01)。
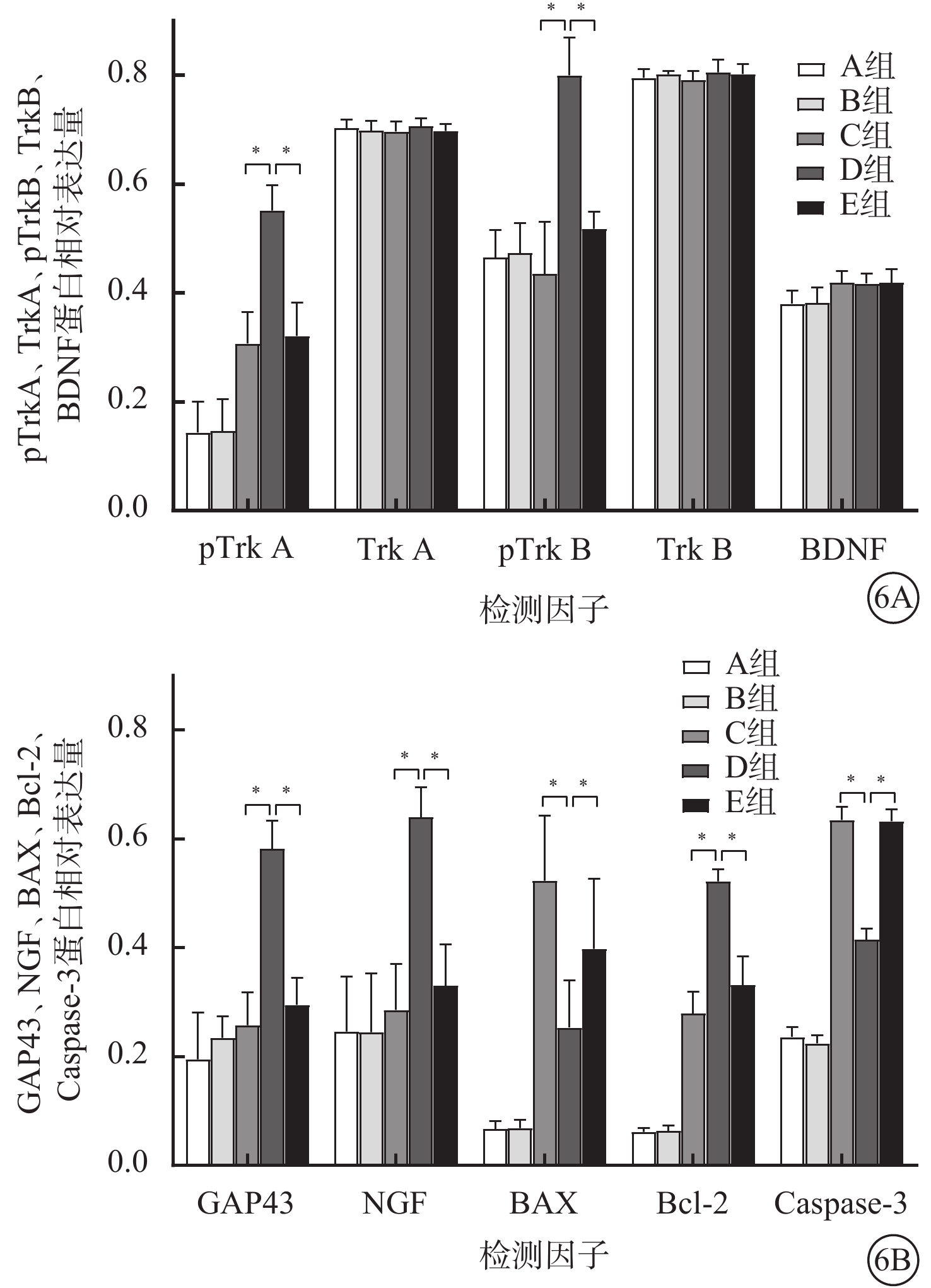 圖6
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中各檢測因子蛋白相對表達量比較(n=10)
圖6
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中各檢測因子蛋白相對表達量比較(n=10)
6A示pTrkA、TrkA、pTrkB、TrkB、BNDF,*
3 討論
KLF7是一種重要的鋅指轉錄因子,在神經系統損傷后對軸突再生和神經元存活具有積極影響[12-14]。本研究成功將KLF7目的基因轉染至視網膜,尤其是在RGC、內叢狀層,并檢測到小鼠視網膜中KLF7蛋白相對表達量提高;ONC后14 d內,KLF7蛋白表達隨ONC建模時間延長而上升,其中ONC后7 d達到高峰。ONC后7 d,過表達的KLF7相對提高了RGC存活率,并發現NGF-TrkA、NGF-TrkB信號通路被激活,凋亡相關因子Bcl-2表達上升,BAX和Caspase-3表達顯著下降。
本研究結果顯示,ONC后7 d,C組、E組RGC存活率較A組、B組顯著減少約65%。該結果與既往研究結果類似,說明小鼠視神經橫斷或擠壓后會導致RGC凋亡、死亡[15-16]。D組RGC存活率較C組、E組提高約10%。KLF7在神經眼科領域研究較少,通過既往KLF7在中樞神經系統損傷后具有保護作用的研究,可以提供一些D組RGC存活率相對提高的可能機制。既往研究發現,坐骨神經損傷后,過表達KLF7可上調NGF、睫狀神經營養因子、BDNF的表達,從而降低神經細胞死亡并維持其功能作用[17]。同時,KLF7也可能通過激活NGF-TrkA、NGF-TrkB信號通路途徑,維持神經的存活和促進其再生[18]。因此,D組RGC存活率相對提高,可能是通過激活NGF-TrkA、NGF-TrkB信號通路,促進軸突生長、神經細胞存活。
NGF和BDNF是在神經元發育和存活過程中起到關鍵作用的因子,分別通過結合其高親和受體TrkA、TrkB促進神經元生存,為治療部分神經退行性疾病帶來巨大希望[19-20]。本研究結果顯示,D組NGF、pTrkA、pTrkB、GAP43蛋白相對表達量均較其他4組增高。既往研究發現,NGF、TrkA、TrkB、GAP43都是KLF7的直接靶基因[21-22],KLF7通過激活這些生長因子及其通路,從而在復雜的神經損傷反應中促使神經元的生長和修復。近期研究發現,在坐骨神經損傷中,KLF7可通過提高NGF表達,激活TrkA、TrkB通路,起到促進坐骨神經軸突再生和增強其髓鞘形成的作用[18]。此外,在ONC小鼠模型中通過外源性給予NGF,可以刺激軸突再生并且干擾細胞凋亡通路,減少RGC損傷。其原因可能是因為NGF與TrkA受體結合后促使TrkA磷酸化,并激活下游細胞外調節蛋白激酶(ERK)信號通路,從而起到保護RGC的作用[23]。TrkA作為KLF7的單獨直接靶基因,也可能是直接通過KLF7刺激使TrkA磷酸化,從而起到保護RGC的作用。既往文獻報道,單純選擇TrkA激動劑即可對ONC或高眼壓模型RGC產生保護作用,而不一定需要NGF[24-25]。以上研究結果說明,在ONC模型中,通過NGF間接激活TrkA信號通路或直接激活TrkA信號通路可能是KLF7保護RGC的其中一種機制。本研究僅發現D組小鼠pTrkB蛋白相對表達量較其他4組增高,然而BDNF在5組間的差異并無統計學意義。這可能表明KLF7是直接激活TrkB信號通路,而并非依靠BDNF間接激活TrkB信號通路,起到對RGC的保護作用。此結果和既往研究類似,TrkB是KLF7的直接靶基因,而BDNF不是KLF7的直接靶基因[22],所以過表達KLF7未能促使BDNF表達量升高。既往研究已證實TrkB信號通路的激活,既可以激活磷脂酰肌醇-3-激酶/蛋白激酶B信號通路又可以激活ERK信號通路;前者也可使得多種基因轉錄促進神經元的存活[26-27]。此外,D組BDNF蛋白相對表達量無提高的另一可能原因:小鼠ONC后,因為激活的視網膜星形膠質細胞與神經細胞發生接觸,影響到BDNF循環,使得BDNF表達量無明顯提升,從而影響到BDNF-TrkB信號通路[28]。本研究結果顯示,D組GAP43蛋白相對表達量較其他4組增高。GAP43表達量是評估軸突損傷和再生的重要指標,正常情況下GAP43表達水平較低,當中樞神經損傷后并伴有神經再生時GAP43表達將增多,軸突再生完成后GAP43的表達將再次回到基本表達水平[29-30],這可能是。ONC后GAP43表達量大幅增加,表明KLF7可能有刺激軸突再生、保護RGC的作用。然而,本研究未能通過RGC軸突染色來證明KLF7具有軸突保護、促進軸突生長的作用,是本研究的不足之處。
Bcl-2家族成員在青光眼、視神經損傷、視網膜缺血等疾病中RGC凋亡或抑制凋亡過程中扮演重要角色[31]。本研究結果顯示,D組較C組、E組Bcl-2蛋白相對表達量增高,而BAX蛋白相對表達量降低,這與既往研究結果類似。兔視神經離斷后,提高Bcl-2蛋白表達即可挽救部分RGC免于死亡;青光眼模型中,提高Bcl-2蛋白水平,具有視神經保護作用[32-33]。這些結果表明,提高Bcl-2表達對RGC具有保護作用。BAX是介導RGC凋亡的重要機制。既往研究發現,在ONC或視神經離斷模型中,通過誘導BAX缺乏,可以防止RGC大量凋亡;與正常小鼠比較,BAX缺乏的小鼠成長至成年,其RGC數量增加了220%[34]。綜上,KLF7可能通過調控Bcl-2和BAX蛋白的表達,從而起到保護RGC的作用。此外,隨著BAX改變了線粒體外膜通透性,可激活Caspase家族,導致細胞內蛋白水解和細胞死亡。既往研究證實,在ONC模型中通過抑制Caspase-3能有效降低RGC死亡率[15]。本研究也發現,D組較C組、E組Caspase-3蛋白相對表達量降低。這或許可以說明,KLF7是通過提高Bcl-2蛋白表達與降低BAX蛋白表達,從而降低Caspase-3表達,起到保護RGC的作用。
本研究的局限性在于:(1)僅觀察了KLF7在RGC損傷保護機制的部分信號通路以及作用因子,而未針對以上各通路之間是否具有相互作用以及各通路在RGC損傷后的保護作用的強弱占比進行深入研究;(2)未對RGC和視神經軸突形態和密度進行染色觀察,缺乏以此來評估KLF7對RGC和視神經軸突的保護作用。以上不足,值得在今后的研究中深入豐富細化。
視網膜神經節細胞(RGC)可以接收和整合來自視網膜中其他神經元的信號,但其受損后不易再生[1]。此外,RGC為單向軸突傳遞途徑,只有當其受損部位的神經纖維再生或修復后才能傳導視覺信息,而不能依靠側支軸突傳導信號[2]。青光眼、缺血性視神經病變和視神經挫傷常伴有RGC損傷,但此類疾病一直缺乏成效的治療方法,所以促進神經細胞修復、再生是目前研究熱點。Krüppel樣因子(KLF)是一組高度保守的鋅指蛋白轉錄因子家族,在調節細胞分化、生長和發育等生物學過程中發揮重要作用[3-4]。文獻報道,KLF4、KLF5、KLF7等可能參與調節神經元存活、軸突生長和引導以及突觸形成[5-8]。此外,神經元成熟后KLF7表達下調,阻礙KLF7發揮保護神經和促神經軸突再生的功能[9]。KLF7在視神經、視網膜損傷中研究較少且機制尚未明確。視神經鉗夾損傷(ONC)是一種建立視神經和RGC急性損傷模型的成熟方法,具有手術操作簡單、建模周期短、成功率高等特點[10]。本研究建立小鼠ONC模型,通過重組腺相關病毒(rAAV)載體過表達小鼠視網膜KLF7,初步探索KLF7對小鼠ONC后RGC的保護作用及其保護機制。現將結果報道如下。
1 材料和方法
1.1 材料
健康C57BL/6J小鼠87只,10周齡,體重18~22 g,無特定病原體(SPF)級(武漢大學A3實驗動物中心),飼養于湖北省人民醫院動物中心SPF級環境中,所有流程嚴格按照《武漢大學實驗動物護理與使用指南》規定,并獲得武漢大學實驗動物倫理委員會許可[倫理編號:WDRM動(福)第20190113號]。過表達KLF7的rAAV載體[rAVV- KLF7-重組增強綠色熒光蛋白(EGFP)]、僅攜帶EGFP的空白腺相關病毒載體(AAV2-EGFP)(上海吉凱基因有限公司);KLF7、神經生長因子(NGF)、生長相關蛋白43(GAP43)、腦源性神經營養因子(BNDF)、胱天蛋白酶3(Caspase-3)、B淋巴細胞瘤-2(Bcl-2)(美國Abcam公司);甘油醛-3-磷酸脫氫酶(GAPDH)、抗綠色熒光蛋白抗體(武漢賽維爾公司);酪氨酸激酶A(TrkA)、磷酸化TrkA(pTrkA)(美國Affinity Biosciences公司);酪氨酸激酶B(TrkB)(武漢三鷹生物技術有限公司),磷酸化TrkB(pTrkB)(北京博奧森生物技術公司);Bcl-2相關X蛋白(BAX)(美國CST公司)。
1.2 病毒構建
rAVV-KLF7-EGFP載體為GV388,序列元件CMV bGlobin-MCS-EGFP-3FLAG-WPRE-hGH polyA,構建針對KLF7的小發夾(sh)RNA-rAAV2。基因插入位點為KpnI/BamHI。KLF7目的基因片段,正向引物:GGAGGTAGTGGAATGGATCCCGCCACCATGGACGTGTTGGCTAGTTATAG;反向引物:TCACCATGGTGGCGGGATCGATATGTCTCTTCATAT GGAGCG。提純并使用稀釋梯度法測量病毒滴度。rAVV2-EGFP、rAVV2-shRNA(KLF7)-EGFP滴度分別為3.34×1012、1.20×1012 vg/ml。分裝凍存于-80 ℃冰箱。
1.3 實驗動物分組和ONC模型建立
采用隨機數字表法將小鼠分為對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組,每組分別為7、2、4只小鼠;ONC后3 d組(ONC-3組)、7 d組(ONC-7組)、14 d組(ONC-14組),每組各3只小鼠;空白對照組(A組)、玻璃體腔注射(IVT)rAVV2-KLF7-EGFP后4周組(B組)、IVT磷酸鹽緩沖液(PBS)后4周ONC組(C組)、IVT rAVV2-KLF7-EGF后4周ONC(D組)、IVT rAVV2-EGFP后4周ONC組(E組),每組各13只小鼠。
ONC-3 d組、ONC-7組、ONC-14 d組建立ONC模型。小鼠10周齡時,參照文獻[10]的方法雙眼建立ONC模型。小鼠腹腔注射戊巴比妥鈉麻醉后,鹽酸奧布卡因點眼表面麻醉,于顳側角鞏緣后2~3 mm處剪開球結膜,鈍性分離暴露視神經,恒壓反向鑷于球后視神經近端2 mm處鉗夾視神經并持續10 s,過程中可觀察到模型眼瞳孔逐漸散大,直接對光反射消失。剔除ONC建模失敗、手術中視神經周圍血管出血、手術后眼底出血的小鼠。
rAVV2-EGFP組、E組和rAVV2-KLF7-EGFP組、B組、D組小鼠雙眼分別于角鞏膜緣下2.0 mm處行IVT rAVV2-EGFP、rAVV2-shRNA(KLF7)-EGFP 1 μl,病毒滴度分別為3.34×1012、1.20×1012 vg/ml。C組小鼠雙眼IVT等體積PBS。IVT后4周,C組、D組、E組建立ONC模型。
1.4 激光共聚焦顯微鏡觀察病毒轉染情況
IVT后4周,分別隨機選取對照組、rAVV2-KLF7-EGFP組小鼠各2只,頸椎脫臼法處死摘除眼球。眼球扎孔后在脂肪酸合成酶眼球固定液中固定1 h,取視網膜置于30%蔗糖溶液過夜脫水,OCT膠包埋后用冰切機切成厚度為14 μm的切片,用抗綠色熒光蛋白抗體(1∶1 000)孵育,激光共聚焦顯微鏡觀察病毒轉染情況。
1.5 全視網膜鋪片免疫熒光染色計數RGC存活率
ONC建模后7 d,隨機選取A組、B組、C組、D組、E組小鼠各3只,頸椎脫臼法處死小鼠。參照文獻[11]的方法,取出眼球置于組織固定液中固定1 h。手術顯微鏡下完整分離視網膜組織,并將其置于PBS中漂洗5 min,3次,室溫環境下牛血清白蛋白洗膜緩沖液(含5%牛血清白蛋白,0.4%的Triton X-100的PBS)封閉2 h;Brn3a一抗(1∶500)4 ℃孵育48 h,PBS漂洗后AlexaFluor594 免疫球蛋白G二抗(1∶500)4 ℃孵育24 h,PBS漂洗后視網膜上剪4個切口呈“四葉草狀”鋪平,抗熒光淬滅封片劑封片,熒光顯微鏡觀察拍攝,10×40倍視野下,分別在距視盤約1/6、1/2、5/6半徑處取3個視野,4個視網膜瓣共12個視野,拍照并應用ImageJ軟件對存活RGC進行計數。
1.6 蛋白質免疫印跡法(Western blot)檢測視網膜組織中蛋白表達
隨機選取對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組小鼠各2只,對照組、ONC-3組、ONC-7組、ONC-14組小鼠各3只,ONC建模后7 d,A組、B組、C組、D組、E組小鼠各10只,頸椎脫臼法處死并摘除眼球,提取視網膜總蛋白,二喹啉甲酸法測定蛋白濃度。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳、制膠與上樣、轉膜、抗體孵育,孵育盒分別孵育KLF7(1∶10 000)、NGF(1∶1 000)、TrkA(1∶2 000)、pTrkA(1∶500)、TrkB(1∶1 000)、pTrkB(1∶5 000)、GAP43(1∶500)、BNDF(1∶1 000)、GAPDH(1∶10 000)、Bcl-2(1∶10 000)、BAX抗體(1∶2 000)、Caspase-3。其后加入辣根過氧化物偶聯的二抗,化學發光底物試劑盒制備免疫反應條帶,使用ImageJ軟件分析每個條帶的灰度值,以GAPDH作為內參照,評估目的蛋白的相對表達量。
1.7 統計學方法
采用GraphPad Prism 8.0進行統計分析。計量資料以均數±標準差(x±s)表示。符合正態分布的數據,組間比較采用單因素方差分析,并使用Tukey校正檢驗;不符合正態分布的數據,組間比較采用Kruskal-Wallis檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 rAAV2-KLF7-EGFP成功轉染至視網膜
熒光顯微鏡觀察結果顯示,對照組小鼠視網膜各細胞層未見綠色熒光染色(圖1A)。rAVV2-KLF7-EGFP組小鼠視網膜神經節細胞層、內叢狀層(IPL)可見強熒光;內核層、外叢狀層熒光較弱;外核層未見明顯熒光(圖1B)。
 圖1
對照組、rAVV2-KLF7-EGFP組小鼠視網膜組織熒光顯微鏡像(EGFP+DAPI,標尺:50 μm)
圖1
對照組、rAVV2-KLF7-EGFP組小鼠視網膜組織熒光顯微鏡像(EGFP+DAPI,標尺:50 μm)
1A示對照組,視網膜各細胞層未見綠色熒光染色;1B示rAVV2-KLF7-EGFP組,GCL、IPL可見綠色強熒光,INL、OPL僅見微弱綠色熒光,ONL未見綠色熒光染色 rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;GCL:神經節細胞層;IPL:內叢狀層;INL:內核層;OPL:外叢狀層;DAPI:4',6-二脒基-2-苯基吲哚;對照組:不做任何處理;rAVV2-KLF7-EGFP組:玻璃體腔注射rAVV2-小發夾RNA(KLF7)-EGFP
Western blot檢測結果顯示,rAVV2-KLF7-EGFP組、AVV2-EGFP組、對照組小鼠視網膜中KLF7蛋白相對表達量分別為0.489±0.051、0.120±0.004、0.124±0.007;與AVV2-EGFP組、對照組比較,rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白相對表達量顯著升高,差異有統計學意義(F=203.44,P<0.01)(圖2)。組間兩兩比較,rAVV2-KLF7-EGFP組與AVV2-EGFP組、對照組,差異均有統計學意義(P<0.01);對照組與AVV2-EGFP組,差異無統計學意義(P>0.05)。
 圖2
對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白表達情況(n=2)
圖2
對照組、rAVV2-EGFP組、rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白表達情況(n=2)
2A示電泳圖;2B示3組視網膜中KLF7蛋白表達結果,與對照組、rAVV2-EGFP組比較,rAVV2-KLF7-EGFP組小鼠視網膜中KLF7蛋白表達顯著升高 rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;GAPDH:甘油醛-3-磷酸脫氫酶;對照組:不做任何處理;rAVV2-EGFP組、rAVV2-KLF7-EGFP組:玻璃體腔分別注射rAVV2-EGFP、rAVV2-小發夾RNA(KLF7)-EGFP
2.2 ONC后KLF7表達結果
Western blot檢測結果顯示,對照組、ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白相對表達量分別為0.13±0.01、0.26±0.04、0.46±0.04、0.44±0.04;與對照組比較,ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白相對表達量顯著增高,差異均有統計學意義(F=43.52,P<0.01)(圖3)。組間兩兩比較,對照組分別與ONC-3組、ONC-7組、ONC-14組比較,差異均有統計學意義(P<0.01)。
 圖3
對照組、ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白表達情況(n=3)
圖3
對照組、ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白表達情況(n=3)
3A示電泳圖;3B示4組視網膜中KLF7蛋白表達結果,與對照組比較,ONC-3組、ONC-7組、ONC-14組小鼠視網膜中KLF7蛋白相對表達量顯著增高 KLF7:Krüppel樣因子7;ONC:視神經鉗夾損傷;GAPDH:甘油醛-3-磷酸脫氫酶;對照組:不做任何處理;ONC-3組、ONC-7組、ONC-14組:ONC后3、7、14 d
2.3 RGC存活率檢測結果
熒光顯微鏡觀察結果顯示,ONC后7 d,A組、B組RGC邊界及細胞亞結構清楚,染色明亮;C組、D組、E組RGC邊界較為模糊,染色較淡,RGC數量較對照組下降,且D組RGC數量較C組、E組相對升高(圖4A~4E)。A組、B組、C組、D組、E組視網膜中RGC密度分別為(3 707.4±12.8)、(3 582.4±13.3)、(1 396.3±16.1)、(1 658.3±22.2)、(1 323.6±16.9)個/mm2;5組RGC密度比較,差異有統計學意義(F=206.90,P<0.01)(圖5);C組、E組RGC存活率較A組、B組顯著減少約65%;D組RGC存活率較C組、E組提高約10%。組間兩兩比較,C組、D組、E組分別與A組、B組,差異均有統計學意義(P<0.01);D組與C組、E組,差異有統計學意義(P=0.028、0.007);其余組間差異均無統計學意義(P>0.05)。
 圖4
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜熒光顯微鏡像(Brn3a免疫熒光染色,標尺:50 μm)
圖4
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜熒光顯微鏡像(Brn3a免疫熒光染色,標尺:50 μm)
4A~4E分別示A組、B組、C組、D組、E組,A組、B組RGC邊界及細胞亞結構清楚,染色明亮;C組、D組、E組RGC邊界較為模糊,染色較淡,RGC數量較對照組下降,且D組RGC數量較C組、E組相對升高 RGC:視網膜神經節細胞;rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;ONC:視神經鉗夾損傷;IVT:玻璃體腔注射;A組:空白對照組;B組:IVT rAVV2- KLF7-EGFP后4周;C組:IVT磷酸鹽緩沖液后4周建立ONC模型;D組:IVT rAVV2-KLF7-EGFP后4周建立ONC模型;E組:IVT rAVV2-EGFP后4周建立ONC模型
 圖5
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中RGC密度比較(n=3)
圖5
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中RGC密度比較(n=3)
RGC:視網膜神經節細胞;rAVV:重組腺相關病毒;KLF7:Krüppel樣因子7;EGFP:增強綠色熒光蛋白;ONC:視神經鉗夾損傷;IVT:玻璃體腔注射;A組:空白對照組;B組:IVT rAVV2- KLF7-EGFP后4周;C組:IVT磷酸鹽緩沖液后4周建立ONC模型;D組:IVT rAVV2-KLF7-EGFP后4周建立ONC模型;E組:IVT rAVV2-EGFP后4周建立ONC模型
2.4 視網膜中蛋白表達結果
Western blot檢測結果顯示,ONC后7 d,A組、B組、C組、D組、E組小鼠視網膜中NGF、pTrkA、pTrkB、GAP43、Bcl-2、BAX、Caspase-3蛋白相對表達量比較,差異均有統計學意義(F=18.214、44.380、27.559、45.476、193.140、26.160、522.180,P<0.01);TrkA、BDNF、TrkB蛋白相對表達量比較,差異均無統計學意義(F=0.328、1.699、0.600,P>0.05)(圖6)。組間兩兩比較:NGF:D組與A組、B組、C組、E組,差異有統計學意義(P<0.01)。pTrkA:C組、E組、D組分別與A組、B組,差異有統計學意義(P<0.01);D組與C組、E組,差異有統計學意義(P<0.01)。pTrkB、GAP43:D組與A組、B組、C組、E組,差異有統計學意義(P<0.01)。Bcl-2:C組、E組、D組分別與A組、B組,差異均有統計學(P<0.01);D組與C組、E組,差異有統計學意義(P<0.01)。BAX:C組、E組、D組分別與A組、B組,差異均有統計學意義(P<0.05);D組與C組,差異有統計學意義(P<0.01)。Caspase-3:C組、E組、D組分別與A組、B組,差異均有統計學意義(P<0.01);D組與C組、E組,差異均有統計學意義(P<0.01)。
 圖6
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中各檢測因子蛋白相對表達量比較(n=10)
圖6
ONC后7 d A組、B組、C組、D組、E組小鼠視網膜中各檢測因子蛋白相對表達量比較(n=10)
6A示pTrkA、TrkA、pTrkB、TrkB、BNDF,*
3 討論
KLF7是一種重要的鋅指轉錄因子,在神經系統損傷后對軸突再生和神經元存活具有積極影響[12-14]。本研究成功將KLF7目的基因轉染至視網膜,尤其是在RGC、內叢狀層,并檢測到小鼠視網膜中KLF7蛋白相對表達量提高;ONC后14 d內,KLF7蛋白表達隨ONC建模時間延長而上升,其中ONC后7 d達到高峰。ONC后7 d,過表達的KLF7相對提高了RGC存活率,并發現NGF-TrkA、NGF-TrkB信號通路被激活,凋亡相關因子Bcl-2表達上升,BAX和Caspase-3表達顯著下降。
本研究結果顯示,ONC后7 d,C組、E組RGC存活率較A組、B組顯著減少約65%。該結果與既往研究結果類似,說明小鼠視神經橫斷或擠壓后會導致RGC凋亡、死亡[15-16]。D組RGC存活率較C組、E組提高約10%。KLF7在神經眼科領域研究較少,通過既往KLF7在中樞神經系統損傷后具有保護作用的研究,可以提供一些D組RGC存活率相對提高的可能機制。既往研究發現,坐骨神經損傷后,過表達KLF7可上調NGF、睫狀神經營養因子、BDNF的表達,從而降低神經細胞死亡并維持其功能作用[17]。同時,KLF7也可能通過激活NGF-TrkA、NGF-TrkB信號通路途徑,維持神經的存活和促進其再生[18]。因此,D組RGC存活率相對提高,可能是通過激活NGF-TrkA、NGF-TrkB信號通路,促進軸突生長、神經細胞存活。
NGF和BDNF是在神經元發育和存活過程中起到關鍵作用的因子,分別通過結合其高親和受體TrkA、TrkB促進神經元生存,為治療部分神經退行性疾病帶來巨大希望[19-20]。本研究結果顯示,D組NGF、pTrkA、pTrkB、GAP43蛋白相對表達量均較其他4組增高。既往研究發現,NGF、TrkA、TrkB、GAP43都是KLF7的直接靶基因[21-22],KLF7通過激活這些生長因子及其通路,從而在復雜的神經損傷反應中促使神經元的生長和修復。近期研究發現,在坐骨神經損傷中,KLF7可通過提高NGF表達,激活TrkA、TrkB通路,起到促進坐骨神經軸突再生和增強其髓鞘形成的作用[18]。此外,在ONC小鼠模型中通過外源性給予NGF,可以刺激軸突再生并且干擾細胞凋亡通路,減少RGC損傷。其原因可能是因為NGF與TrkA受體結合后促使TrkA磷酸化,并激活下游細胞外調節蛋白激酶(ERK)信號通路,從而起到保護RGC的作用[23]。TrkA作為KLF7的單獨直接靶基因,也可能是直接通過KLF7刺激使TrkA磷酸化,從而起到保護RGC的作用。既往文獻報道,單純選擇TrkA激動劑即可對ONC或高眼壓模型RGC產生保護作用,而不一定需要NGF[24-25]。以上研究結果說明,在ONC模型中,通過NGF間接激活TrkA信號通路或直接激活TrkA信號通路可能是KLF7保護RGC的其中一種機制。本研究僅發現D組小鼠pTrkB蛋白相對表達量較其他4組增高,然而BDNF在5組間的差異并無統計學意義。這可能表明KLF7是直接激活TrkB信號通路,而并非依靠BDNF間接激活TrkB信號通路,起到對RGC的保護作用。此結果和既往研究類似,TrkB是KLF7的直接靶基因,而BDNF不是KLF7的直接靶基因[22],所以過表達KLF7未能促使BDNF表達量升高。既往研究已證實TrkB信號通路的激活,既可以激活磷脂酰肌醇-3-激酶/蛋白激酶B信號通路又可以激活ERK信號通路;前者也可使得多種基因轉錄促進神經元的存活[26-27]。此外,D組BDNF蛋白相對表達量無提高的另一可能原因:小鼠ONC后,因為激活的視網膜星形膠質細胞與神經細胞發生接觸,影響到BDNF循環,使得BDNF表達量無明顯提升,從而影響到BDNF-TrkB信號通路[28]。本研究結果顯示,D組GAP43蛋白相對表達量較其他4組增高。GAP43表達量是評估軸突損傷和再生的重要指標,正常情況下GAP43表達水平較低,當中樞神經損傷后并伴有神經再生時GAP43表達將增多,軸突再生完成后GAP43的表達將再次回到基本表達水平[29-30],這可能是。ONC后GAP43表達量大幅增加,表明KLF7可能有刺激軸突再生、保護RGC的作用。然而,本研究未能通過RGC軸突染色來證明KLF7具有軸突保護、促進軸突生長的作用,是本研究的不足之處。
Bcl-2家族成員在青光眼、視神經損傷、視網膜缺血等疾病中RGC凋亡或抑制凋亡過程中扮演重要角色[31]。本研究結果顯示,D組較C組、E組Bcl-2蛋白相對表達量增高,而BAX蛋白相對表達量降低,這與既往研究結果類似。兔視神經離斷后,提高Bcl-2蛋白表達即可挽救部分RGC免于死亡;青光眼模型中,提高Bcl-2蛋白水平,具有視神經保護作用[32-33]。這些結果表明,提高Bcl-2表達對RGC具有保護作用。BAX是介導RGC凋亡的重要機制。既往研究發現,在ONC或視神經離斷模型中,通過誘導BAX缺乏,可以防止RGC大量凋亡;與正常小鼠比較,BAX缺乏的小鼠成長至成年,其RGC數量增加了220%[34]。綜上,KLF7可能通過調控Bcl-2和BAX蛋白的表達,從而起到保護RGC的作用。此外,隨著BAX改變了線粒體外膜通透性,可激活Caspase家族,導致細胞內蛋白水解和細胞死亡。既往研究證實,在ONC模型中通過抑制Caspase-3能有效降低RGC死亡率[15]。本研究也發現,D組較C組、E組Caspase-3蛋白相對表達量降低。這或許可以說明,KLF7是通過提高Bcl-2蛋白表達與降低BAX蛋白表達,從而降低Caspase-3表達,起到保護RGC的作用。
本研究的局限性在于:(1)僅觀察了KLF7在RGC損傷保護機制的部分信號通路以及作用因子,而未針對以上各通路之間是否具有相互作用以及各通路在RGC損傷后的保護作用的強弱占比進行深入研究;(2)未對RGC和視神經軸突形態和密度進行染色觀察,缺乏以此來評估KLF7對RGC和視神經軸突的保護作用。以上不足,值得在今后的研究中深入豐富細化。