引用本文: 魏瑩瑩, Udo Bartsch. 基于干細胞的膠質細胞源性神經營養因子和睫狀神經營養因子對CLN7型神經元蠟樣脂褐質沉積癥小鼠模型視網膜退行性病變的治療研究. 中華眼底病雜志, 2024, 40(7): 526-537. doi: 10.3760/cma.j.cn511434-20231212-00482 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
神經元蠟樣脂褐質沉積癥(NCL)是一組兒童期神經退行性疾病,以癲癇、運動智力衰退及視力減退為主要特征,最終威脅生命。根據受累基因,NCL可分為CLN1~8、CLN10~14共13種亞型,均因溶酶體機制障礙而導致未消化的脂質、神經節苷脂和各種成分蛋白質的蓄積,從而導致細胞內定位的自發熒光蠟樣體存在[1-3]。CLN7型由MFSD8基因突變引起,表現為嚴重的神經系統及視網膜退化[4]。我們的前期研究已通過敲除MFSD8基因外顯子2成功構建CLN7型小鼠模型,其表現出的溶酶體功能障礙和大腦神經退行性變等神經系統缺陷以及快速進展的視網膜退行性改變,與人類CLN7型較為接近[5]。神經營養因子(NTF)是在發育期間和病理條件下促進特定類型神經細胞存活的蛋白質。其中,膠質細胞源性NTF(GDNF)或睫狀NTF(CNTF)已被證實可以挽救多種神經退行性視網膜疾病中神經節細胞(RGC)和(或)光感受器細胞[6-7],但其應用受限于血腦或血視網膜屏障穿透性差及半衰期短[8]。相比之下,神經干細胞(NSC)移植展現出長期治療潛力[9-11],且聯合NTF使用能更有效地保留光感受器細胞[8, 12]。已有研究表明,聯合過表達CNTF和GDNF的NSC在視神經損傷模型中對RGC具有協同保護作用[13-14]。基于此,本研究將焦點放在驗證過表達CNTF和GDNF的NSC共同移植到CLN7型小鼠模型中,能否對光感受器細胞發揮協同保護效應,以期為NCL提供新的治療策略。
1 材料和方法
1.1 實驗動物及主要試劑、儀器
CLN7型小鼠100只、C57BL/6J小鼠20只,鼠齡均為14 d,無特定病原體級,漢堡-埃彭多夫大學醫學中心提供;飼養于標準(12 h明/暗循環)清潔級環境中。所有流程均征得漢堡大學和漢堡州立動物保護委員會的同意并符合歐盟在研究中使用動物的相關規定,獲得當地動物倫理委員會批準(批準號:110/2019ORG842)。
表達GDNF、CNTF的克隆NSC慢病毒(GDNF-NSC、CNTF-NSC)由本實驗室構建[10-11, 13-14]。0.1%牛血清白蛋白(BSA)和0.3%Triton X-100(美國Sigma公司);抗生物素化花生凝集素(PNA)抗體(美國Vector Laboratories公司);抗蛋白激酶Cα(PKCα)抗體(美國Santa Cruz Biotechnology公司);抗鈣結合樣蛋白/神經標記物Secretagogin抗體(SCGN)(歐洲BioVendor 公司);抗兔神經膠質原纖維酸性蛋白(GFAP)一抗(德國Dako Cytomation GmbH公司);抗小鼠β-微管蛋白Ⅲ(β-TUB Ⅲ)一抗、4',6-二脒基-2-苯基吲哚(DAPI)抗體(德國Sigma公司);抗GDNF抗體、抗CNTF抗體(美國Santa Cruz Biotechnology公司);Cy3和(或)Cy5二抗(美國杰克遜免疫研究公司)。Olympus FV 1000共聚焦顯微鏡(日本Olympus公司);蔡司共聚焦熒光顯微鏡(德國蔡司公司);視覺電生理儀Ganzfeld Q450(德國Roland Consult公司);低溫恒溫器(德國LEICA公司)。
1.2 實驗動物分組和NSC的慢病毒移植
CLN7型小鼠100只隨機分為實驗組、對照組,分別為80、20只。C57BL/6J小鼠20只設定為野生型組(WT組)。對照組、WT組小鼠不作任何處理。實驗組小鼠隨機選取單側眼為實驗眼,玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物(GDNF/CNTF-NSC),并據此再分為CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組;對側眼玻璃體腔注射不含NTF的NSC 2 μl作為自身對照組。細胞密度均為8×105個/μl。
1.3 免疫組織化學染色觀察小鼠視網膜視錐細胞、視桿-雙極細胞、視錐-雙極細胞分布和數量變化以及晶狀體后表面NFT表達和NSC分化情況
小鼠2、4、6月齡時,對照組、WT組各隨機選取6只小鼠,深度麻醉處死,摘除眼球,4%多聚甲醛(PA)固定1 h,分別在質量分數為7.5%、15.0%、30.0%的蔗糖溶液中梯度脫水過夜。Tissue-Tek組織包埋盒包埋并以特定方向于液氮中速凍,以識別鼻側和顳側視網膜。低溫恒溫器連續切片,厚度25 μm,含0.1%BSA和0.3% Triton X-100的磷酸鹽緩沖液(PBS)封閉,抗生物素化PNA一抗孵育2 d,PKCα、SCGN一抗孵育24 h后,PBS充分洗滌,加入Cy3二抗室溫孵育2 h,PBS充分洗滌,DAPI染色,10 min后漂洗,轉移至載玻片上,避光自然晾干,蓋上蓋玻片于熒光顯微鏡下觀察并拍照。
采用共聚焦顯微鏡捕獲帶視神經的整個視網膜切片圖像,Fiji Image J 1.51s軟件分析。視盤距鼻側、顳側視網膜邊緣25%、50%、75%處分別設置3個長寬為250 μm的正方形框域,計數位于框內的視錐細胞及PKCα、SCGN染色呈陽性的視桿-雙極細胞、視錐-雙極細胞密度。周邊視網膜定義為距視盤75%處的位于視網膜邊緣處的正方形區域,整個視網膜定義為鼻側和顳側視網膜共6個正方形框域。在含有視神經的視網膜切片中,視盤距鼻側、顳側視網膜邊緣之間分別設置9個等距垂直線性標記,記錄光感受器細胞行數,其中最外圍3個位置定義為周邊區視網膜,最中心3個位置定義為中央區視網膜。
小鼠4月齡時,GDNF/CNTF-NSC組隨機選取6只小鼠,深度麻醉處死,摘除雙眼眼球,取出附著有NSC的晶狀體,4% PA固定1 h,兔抗GFAP(1:500)一抗、小鼠抗β-TUB Ⅲ一抗、抗GDNF一抗、抗CNTF一抗和綿羊抗兔Cy3或Cy5二抗(1:1 000)染色,載玻片制作前,DAPI復染10 min。免疫熒光顯微鏡觀察拍照。
1.4 ERG評估小鼠視網膜功能
對照組、WT組于小鼠2、4、6月齡時、實驗組不同治療亞組于小鼠2、4月齡時,各隨機選取6只小鼠行ERG檢測。采用Ganzfeld Q450視覺電生理檢測儀記錄明暗視a、b波振幅;因小鼠明視a波可忽略不計[15],僅同時記錄明視b波振幅。小鼠暗適應12 h后,采用個性化定制的內含鋼絲環的角膜電極接觸小鼠角膜表面作為記錄電極,將鉑針插入小鼠頸背處皮下作為參考電極,同時將接地電極插入小鼠背部后部區域皮下。使用光強度為9.49 cd.s/m2的白光作為閃光刺激,記錄暗適應視桿反應a、b波振幅。全視野刺激白色背景光25.0 cd.s/m2下明適應5 min后記錄明適應視錐反應a、b波振幅。a波振幅為刺激前基線至a波波谷;b波振幅為a波波谷至b波波峰。ERG記錄后,角膜表面涂凝膠防止角膜脫水。ERG記錄過程中電熱毯溫度維持在38 ℃以保持小鼠體溫,室溫控制在22~23℃。
1.5 統計學方法
采用Graphpad Prism 9.3軟件行統計學分析。定量數據以均數±標準差(x±s)表示。兩組間比較采用雙因素方差分析,采用Bonferroni或Tukey校正檢驗水準。P<0.05為差異有統計學意義。
2 結果
2.1 CLN7型小鼠多種視網膜細胞類型進行性丟失
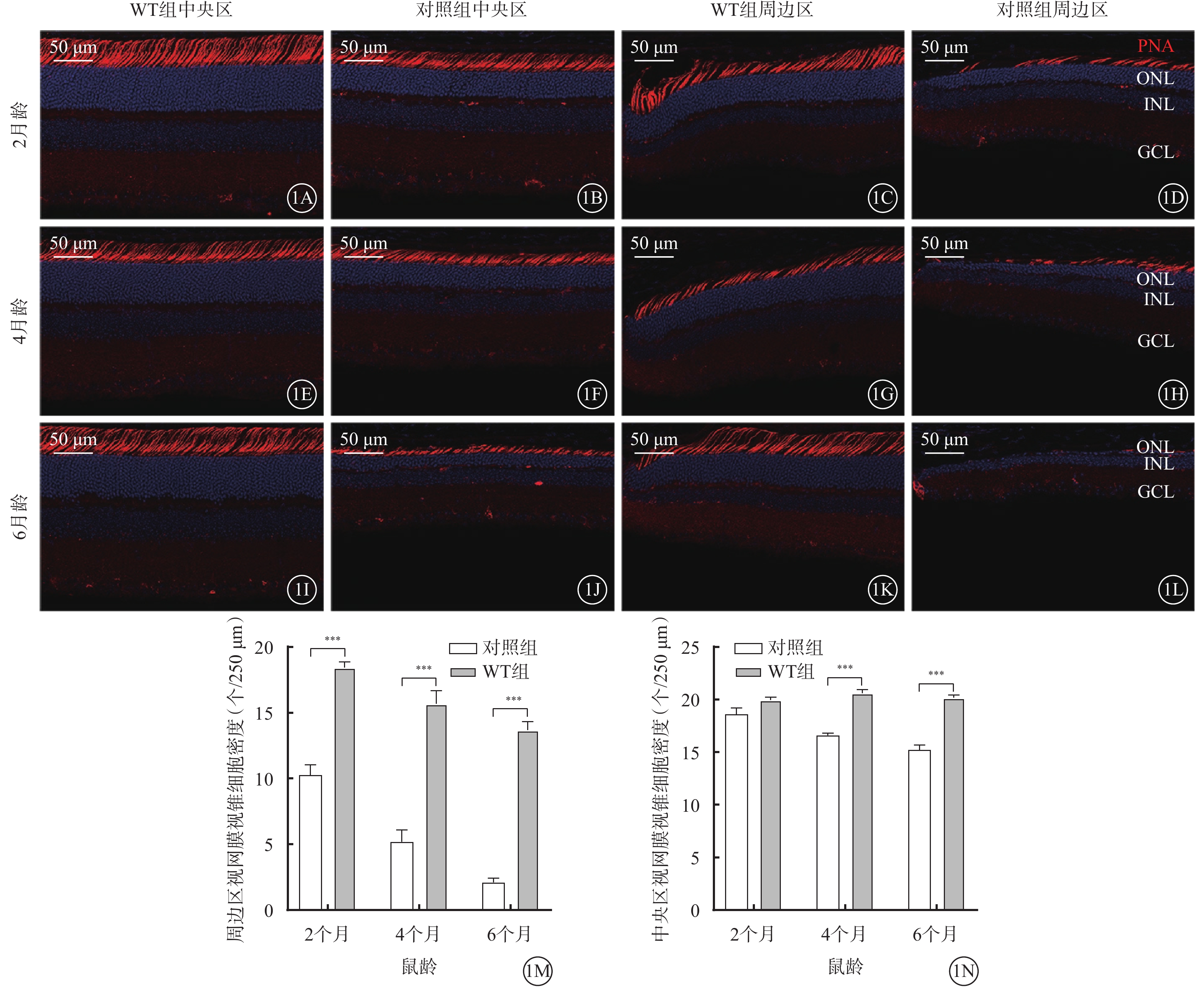
與WT組比較,對照組小鼠除2月齡時整個(6框計數平均值)視網膜視錐細胞密度差異無統計學意義外(F=127.3,P>0.05),其他月齡對照組小鼠中央區及周邊區視網膜視錐細胞密度差異均有統計學意義(F=127.3、285.1,P<0.000 1)(圖1,表1)。
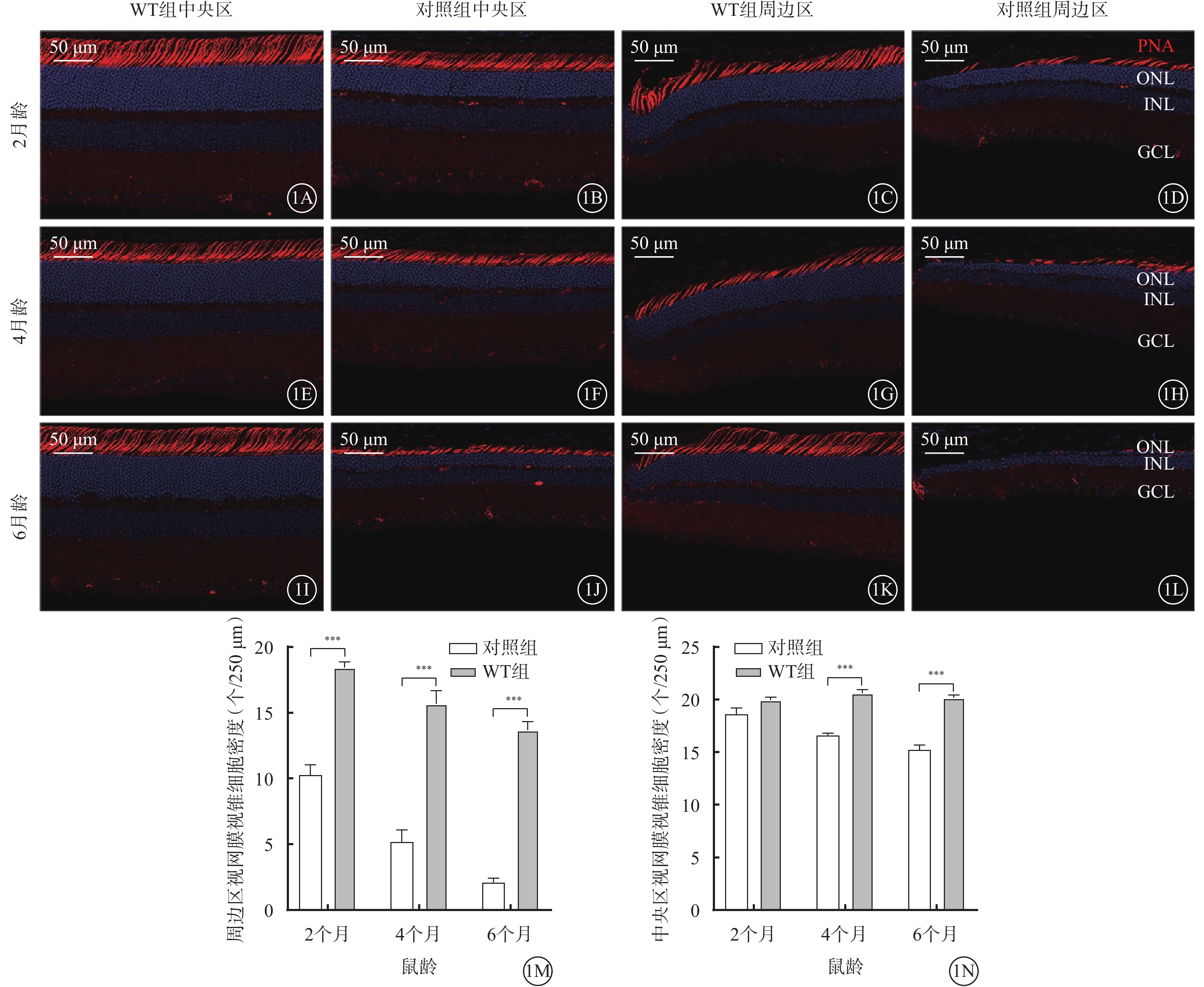 圖1
視錐細胞退行性改變 1A~1D、1E~1H、1I~1L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PNA標記視錐細胞,藍色熒光為DAPI染色的細胞核。小鼠2月齡時,WT組與對照組小鼠中央區視網膜視錐細胞密度相似(1A、1B),周邊區視網膜視錐細胞密度明顯降低(1C、1D);對照組小鼠視錐細胞內、外段長度減少(1B、1D)。小鼠4、6月齡時,與WT組比較,對照組小鼠中央區、周邊區視網膜視錐細胞出現明顯丟失。1M、1N分別示WT組、對照組小鼠周邊區、中央區視網膜視錐細胞密度比較(n=6),***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PNA:花生凝集素;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
圖1
視錐細胞退行性改變 1A~1D、1E~1H、1I~1L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PNA標記視錐細胞,藍色熒光為DAPI染色的細胞核。小鼠2月齡時,WT組與對照組小鼠中央區視網膜視錐細胞密度相似(1A、1B),周邊區視網膜視錐細胞密度明顯降低(1C、1D);對照組小鼠視錐細胞內、外段長度減少(1B、1D)。小鼠4、6月齡時,與WT組比較,對照組小鼠中央區、周邊區視網膜視錐細胞出現明顯丟失。1M、1N分別示WT組、對照組小鼠周邊區、中央區視網膜視錐細胞密度比較(n=6),***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PNA:花生凝集素;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
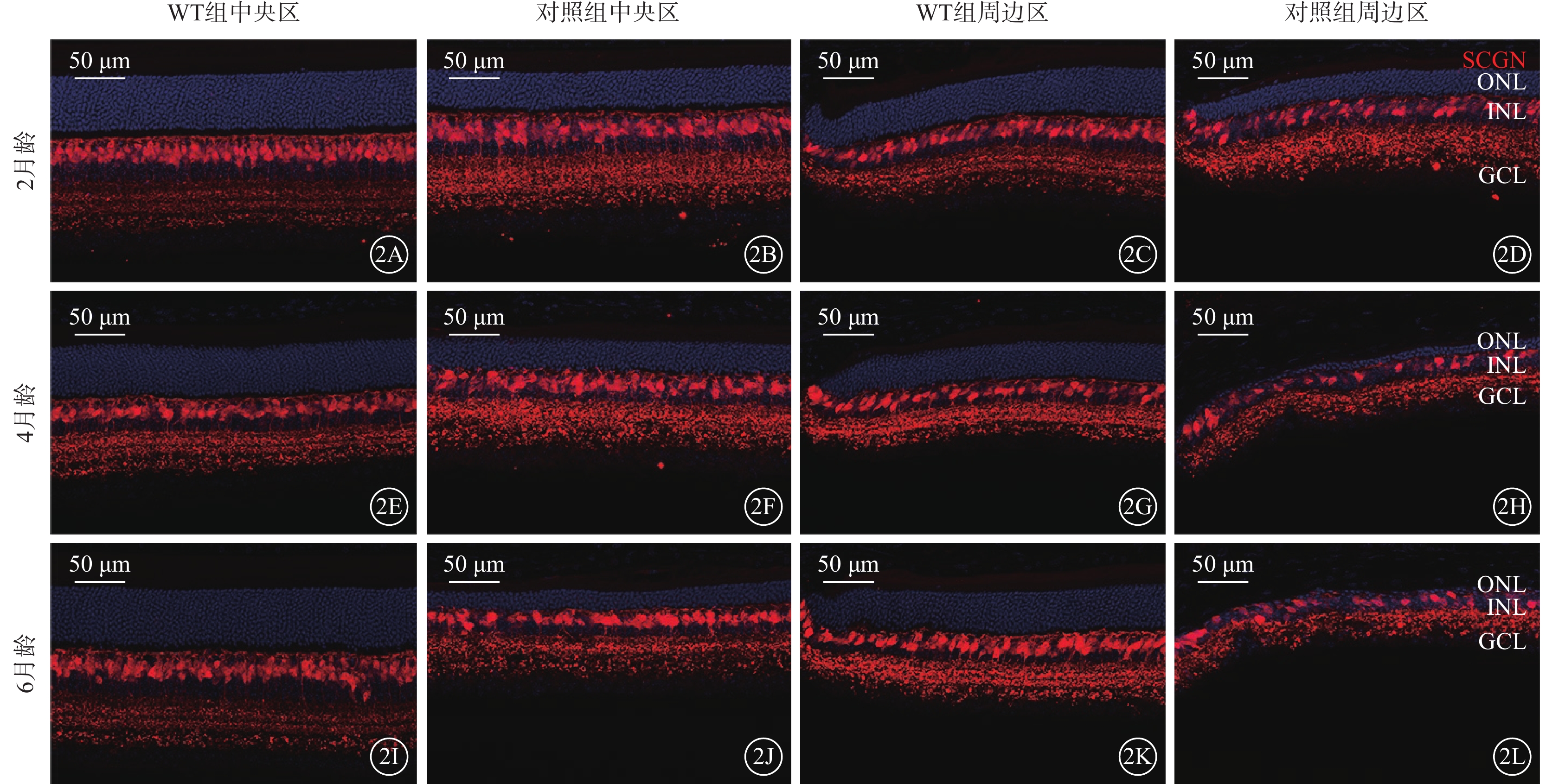
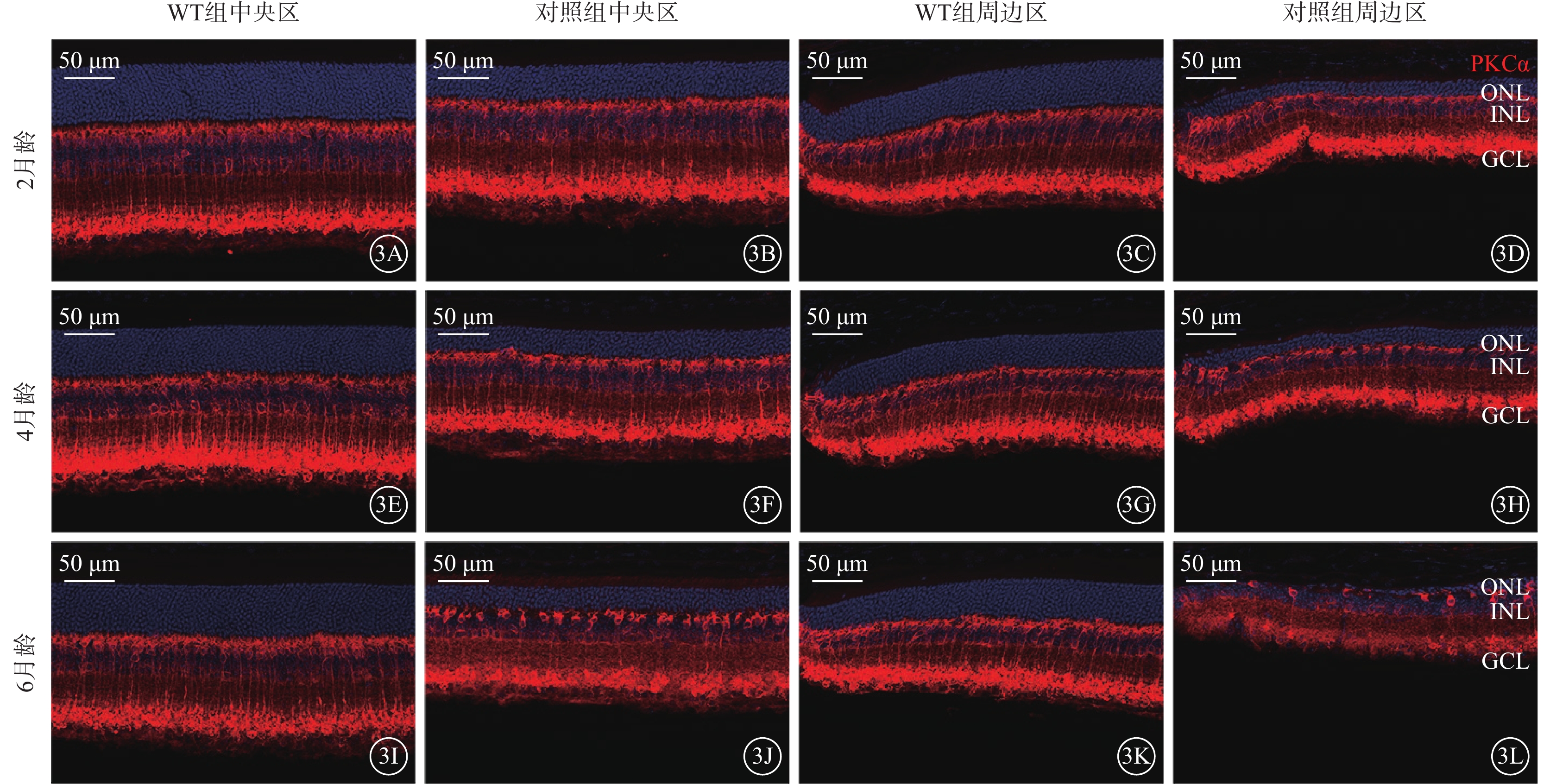
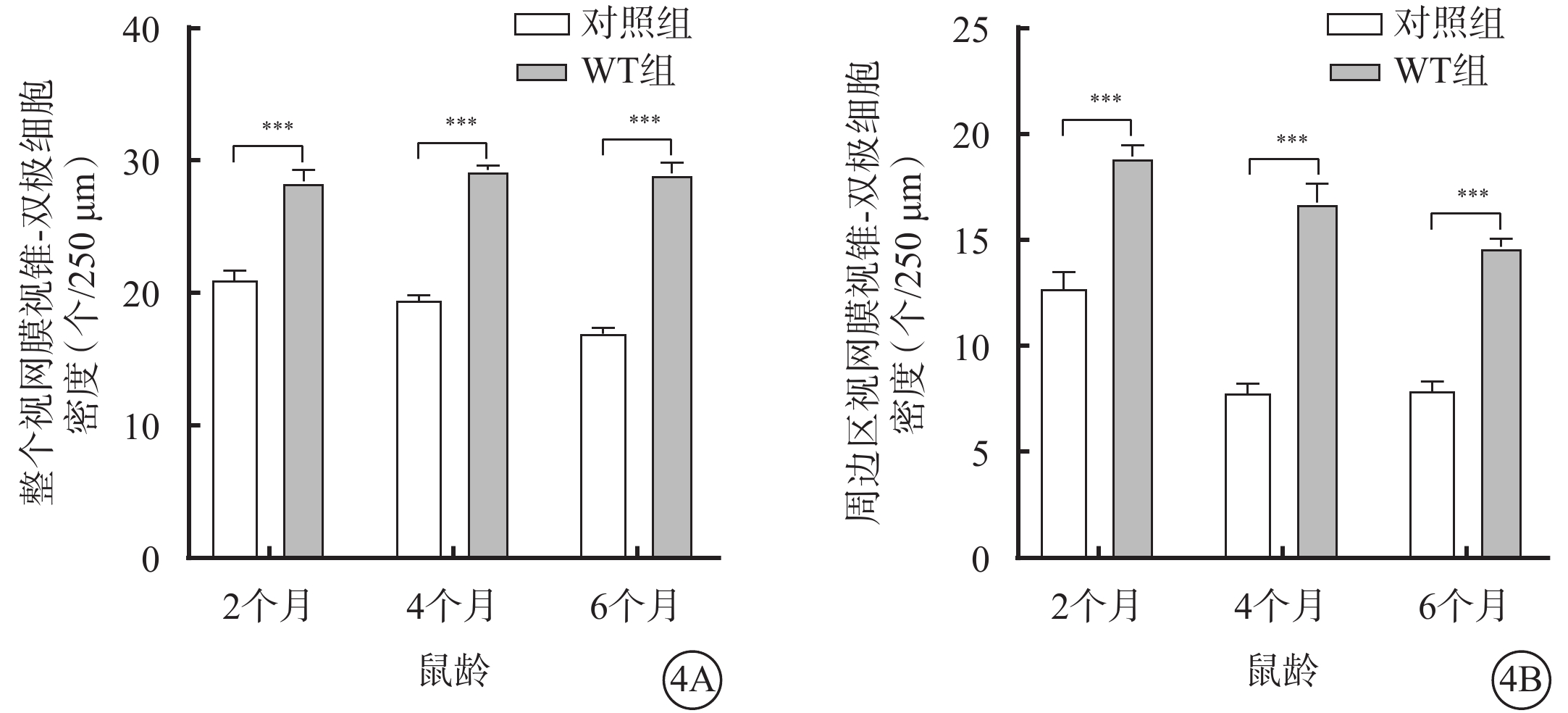
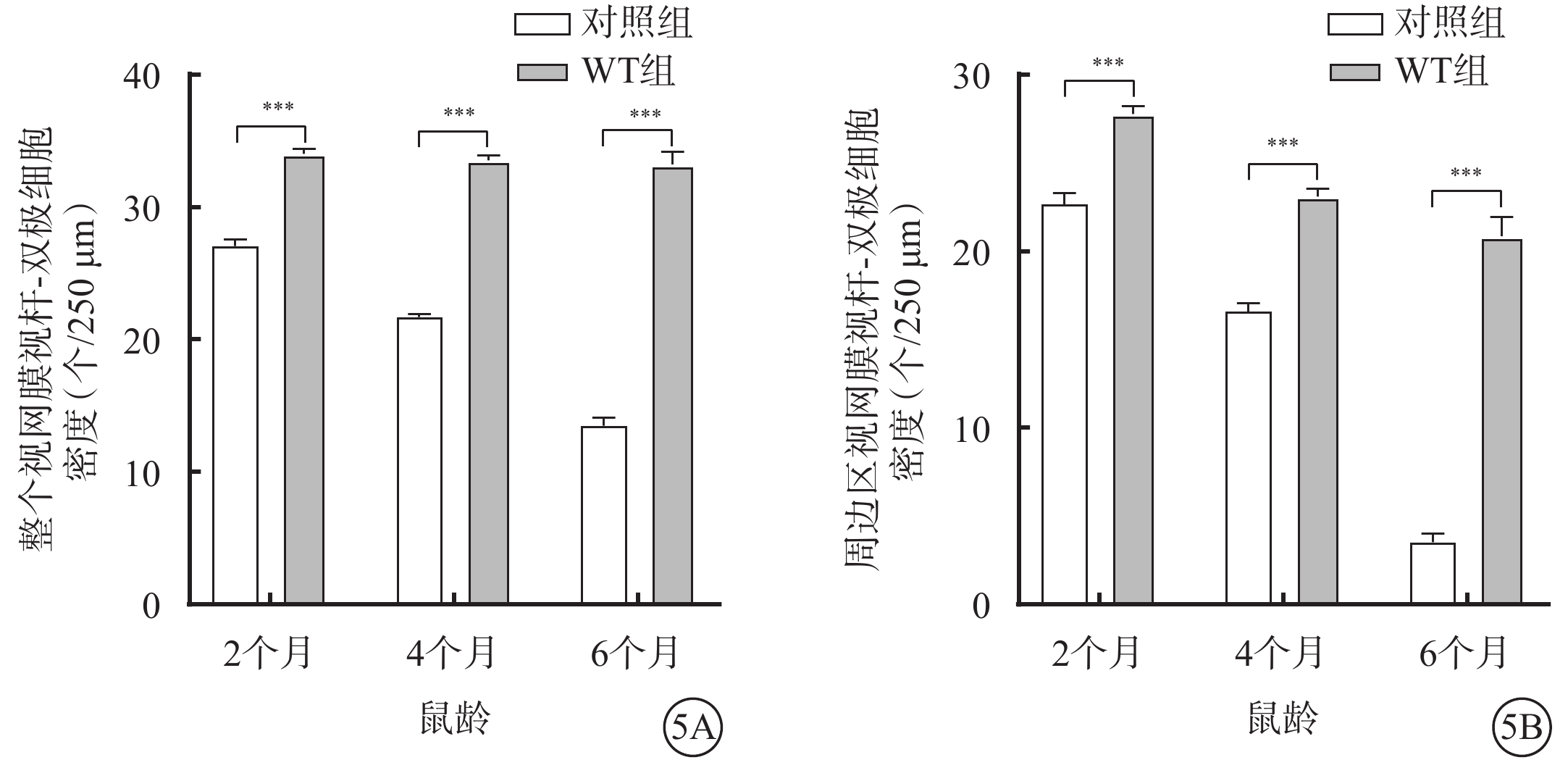
不同月齡對照組、WT組小鼠視網膜中央區、周邊區視桿-雙極細胞、視錐-雙極細胞密度比較,差異均有統計學意義(P<0.05)(圖2,3)。小鼠2、4、6月齡時,與WT組比較,對照組小鼠整個、周邊區視網膜視桿-雙極細胞(F=823.2、346.2)、視錐-雙極細胞(F=356.3、210.6)密度均顯著降低,差異均有統計學意義(P<0.000 1)(圖4,5;表2)。
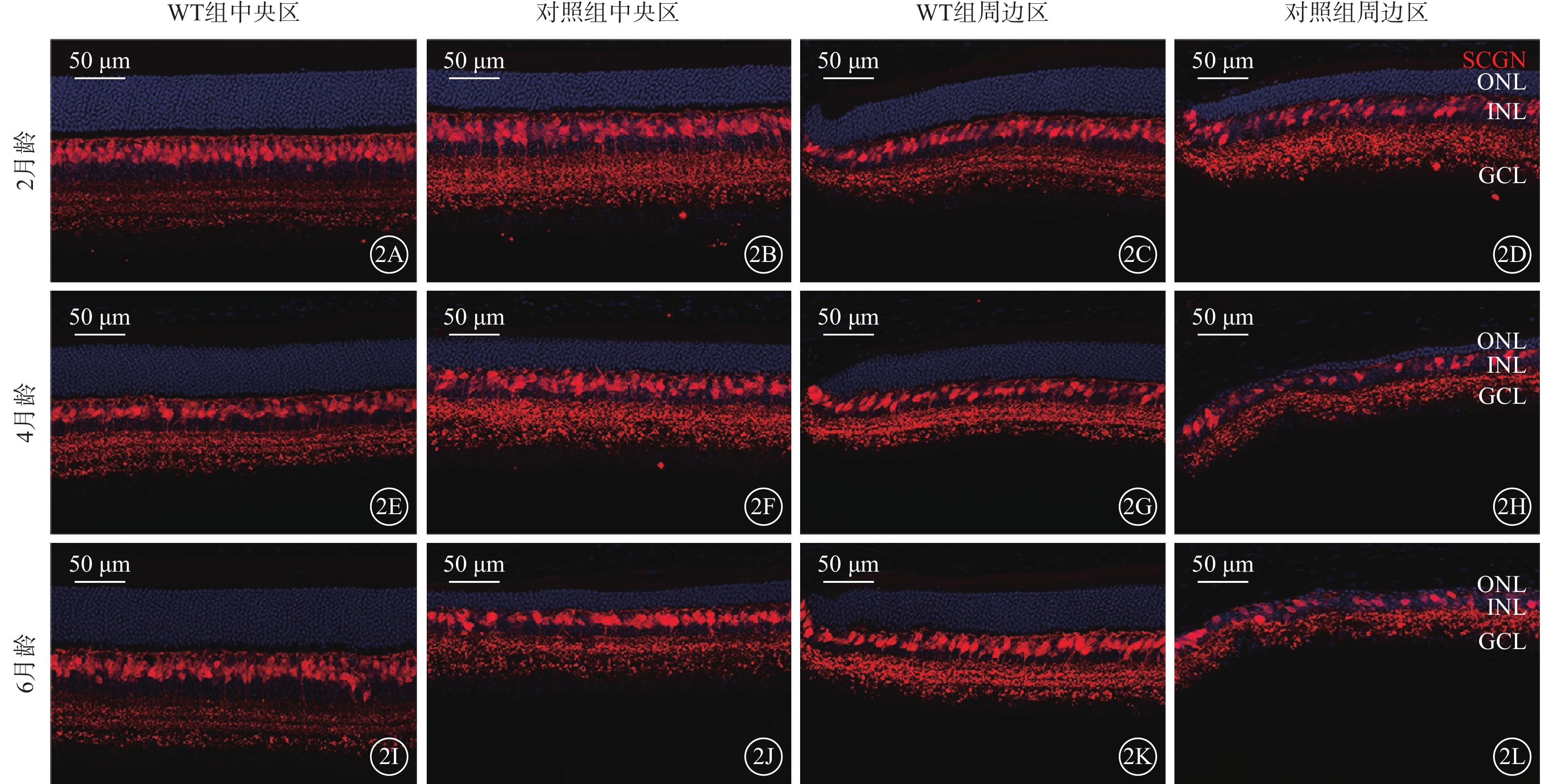 圖2
視錐-雙極細胞的退行性改變 2A~2D、2E~2H、2I~2L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為SCGN標記的視錐-雙極細胞,藍色熒光為DAPI標記的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;SCGN:抗鈣結合樣蛋白/神經標記物Secretagogin抗體;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
圖2
視錐-雙極細胞的退行性改變 2A~2D、2E~2H、2I~2L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為SCGN標記的視錐-雙極細胞,藍色熒光為DAPI標記的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;SCGN:抗鈣結合樣蛋白/神經標記物Secretagogin抗體;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
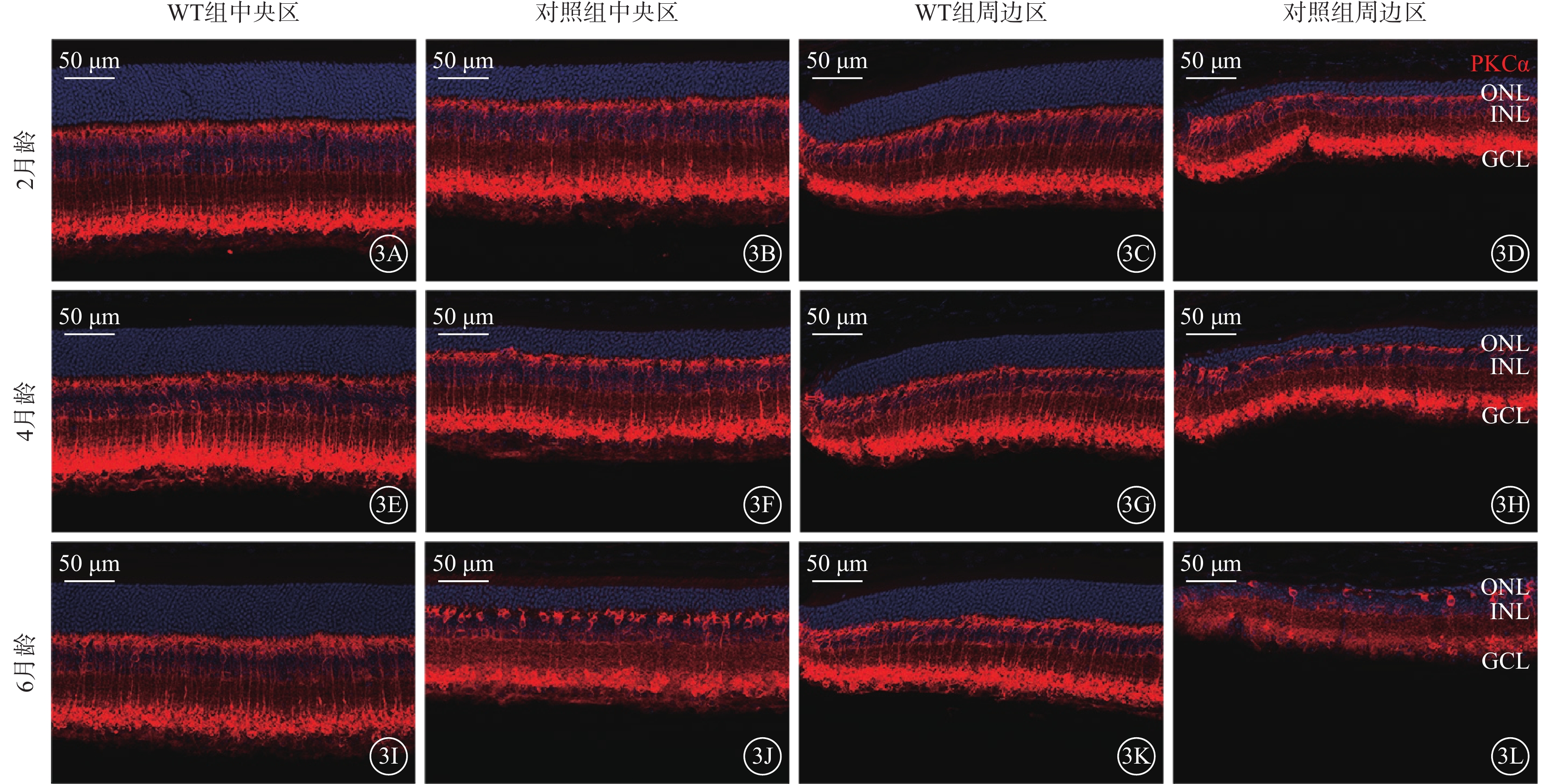 圖3
視桿-雙極細胞的退行性改變 3A~3D、3E~3H、3I~3L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PKCα標記的視桿-雙極細胞,藍色熒光為DAPI染色的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PKCα:蛋白激酶Cα;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
圖3
視桿-雙極細胞的退行性改變 3A~3D、3E~3H、3I~3L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PKCα標記的視桿-雙極細胞,藍色熒光為DAPI染色的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PKCα:蛋白激酶Cα;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
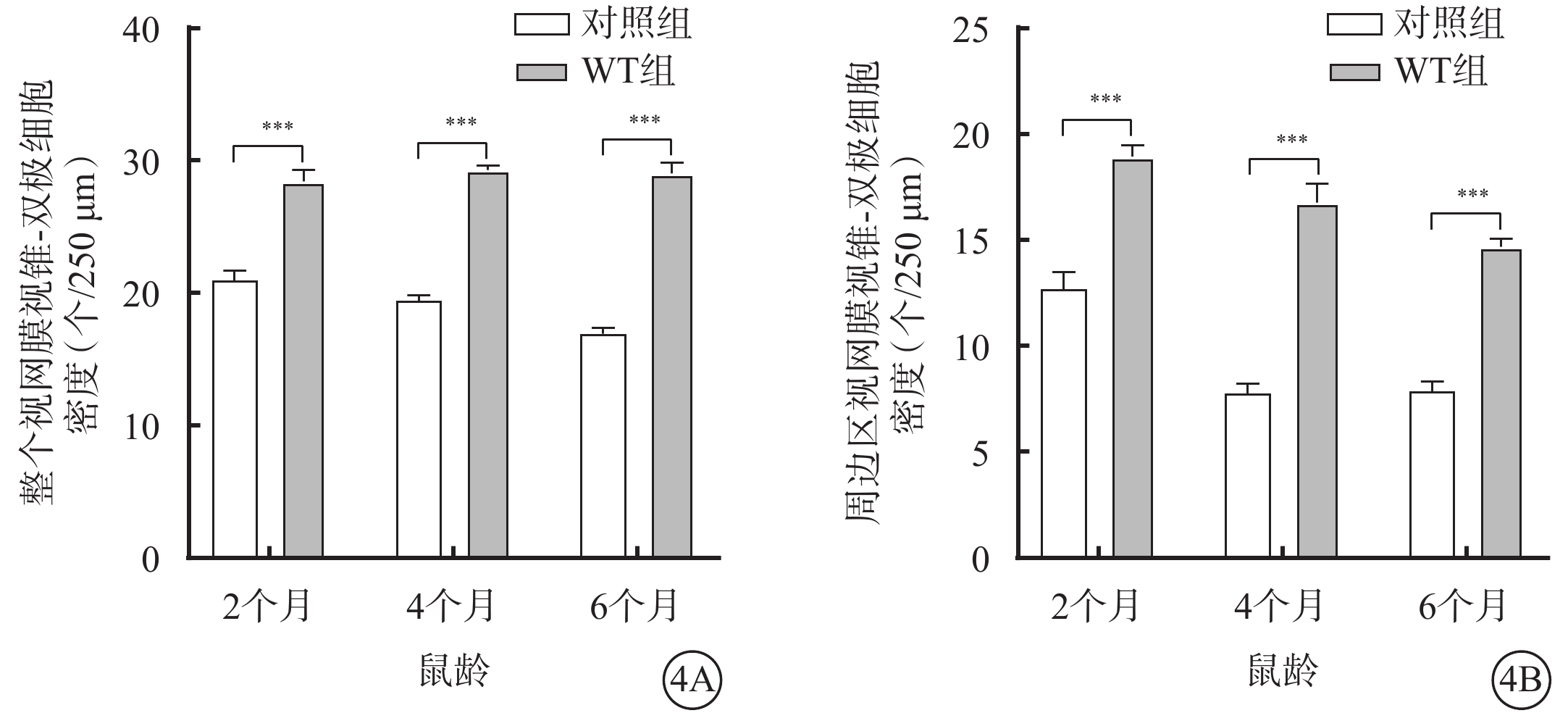 圖4
不同月齡WT組、對照組小鼠整個、周邊區視網膜視錐-雙極細胞密度比較(n=6) 4A、4B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
圖4
不同月齡WT組、對照組小鼠整個、周邊區視網膜視錐-雙極細胞密度比較(n=6) 4A、4B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
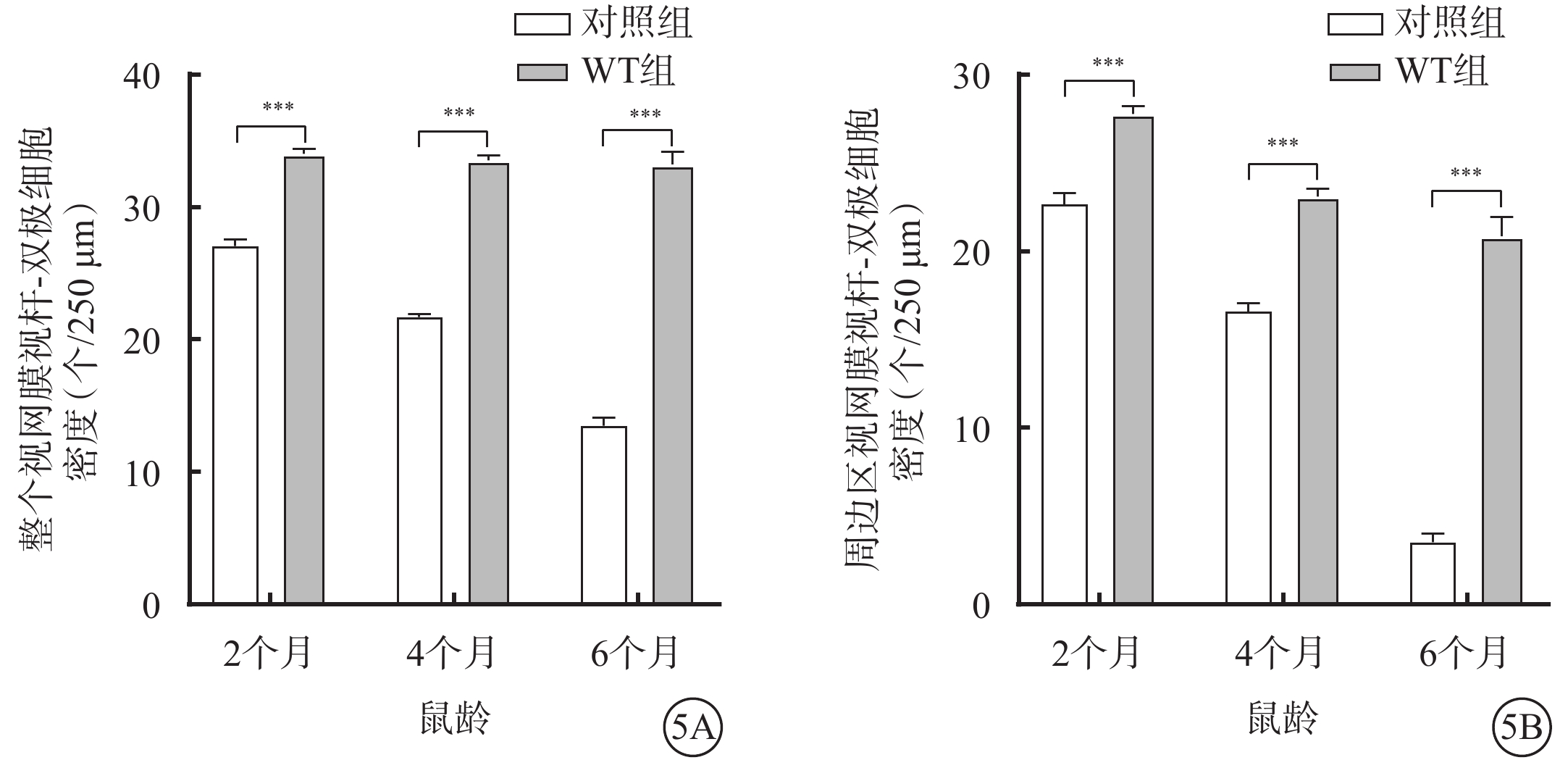 圖5
不同月齡WT組、對照組小鼠整個、周邊區視網膜視桿-雙極細胞密度比較(n=6) 5A、5B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
圖5
不同月齡WT組、對照組小鼠整個、周邊區視網膜視桿-雙極細胞密度比較(n=6) 5A、5B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
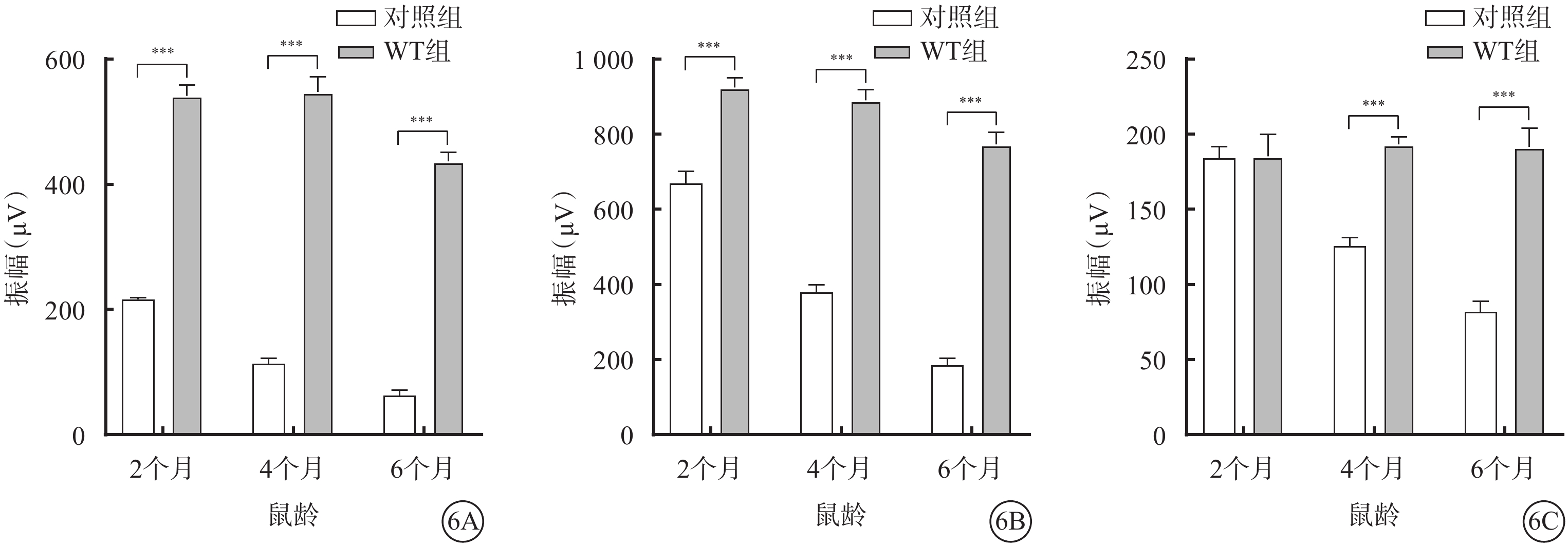
ERG檢測結果顯示,與WT組比較,對照組小鼠除2月齡時明視b波振幅差異無統計學意義外(F=51.13,P>0.05),其他月齡對照組小鼠暗視a、b波振幅及明視b波振幅差異均有統計學意義(F=1 911.0、387.1,P<0.000 1)(圖6,表3)。
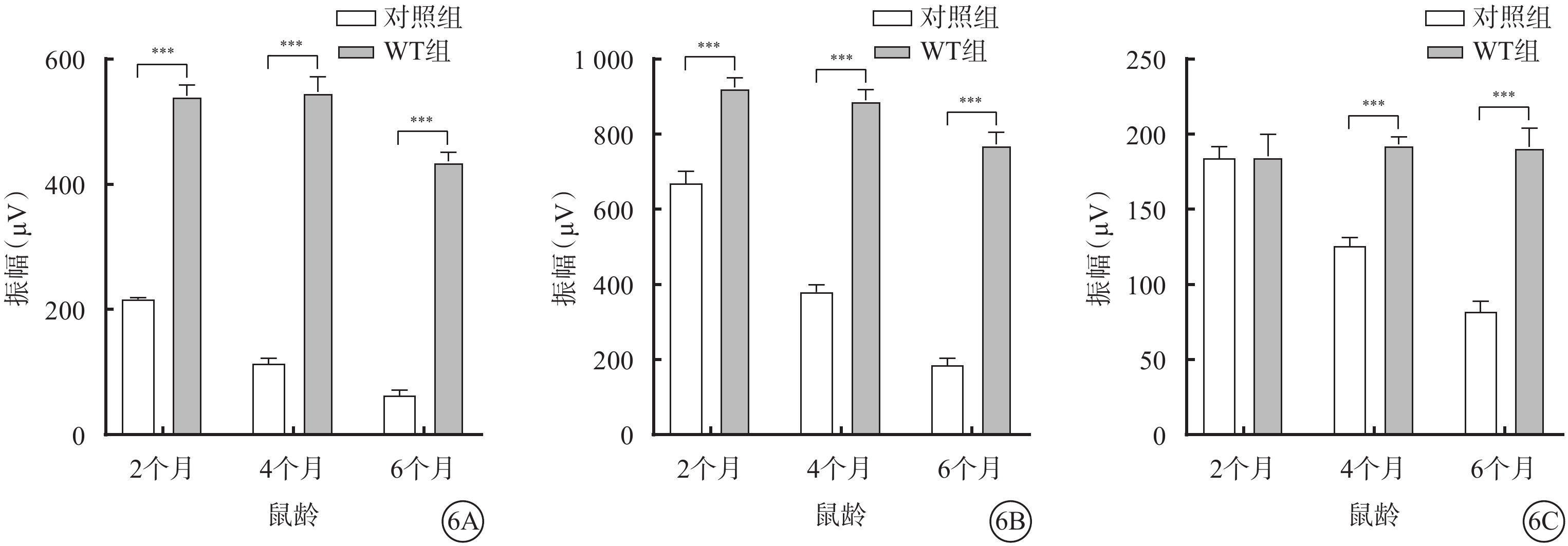 圖6
WT組、對照組不同月齡小鼠暗視a、b波及明視b波振幅比較(n=6) 6A、6B、6C分別示暗視a、b波振幅及明視b波振幅,***P<0.000 1,***P<0.00 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
圖6
WT組、對照組不同月齡小鼠暗視a、b波及明視b波振幅比較(n=6) 6A、6B、6C分別示暗視a、b波振幅及明視b波振幅,***P<0.000 1,***P<0.00 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
2.2 移植NSC在體內分化和轉基因表達
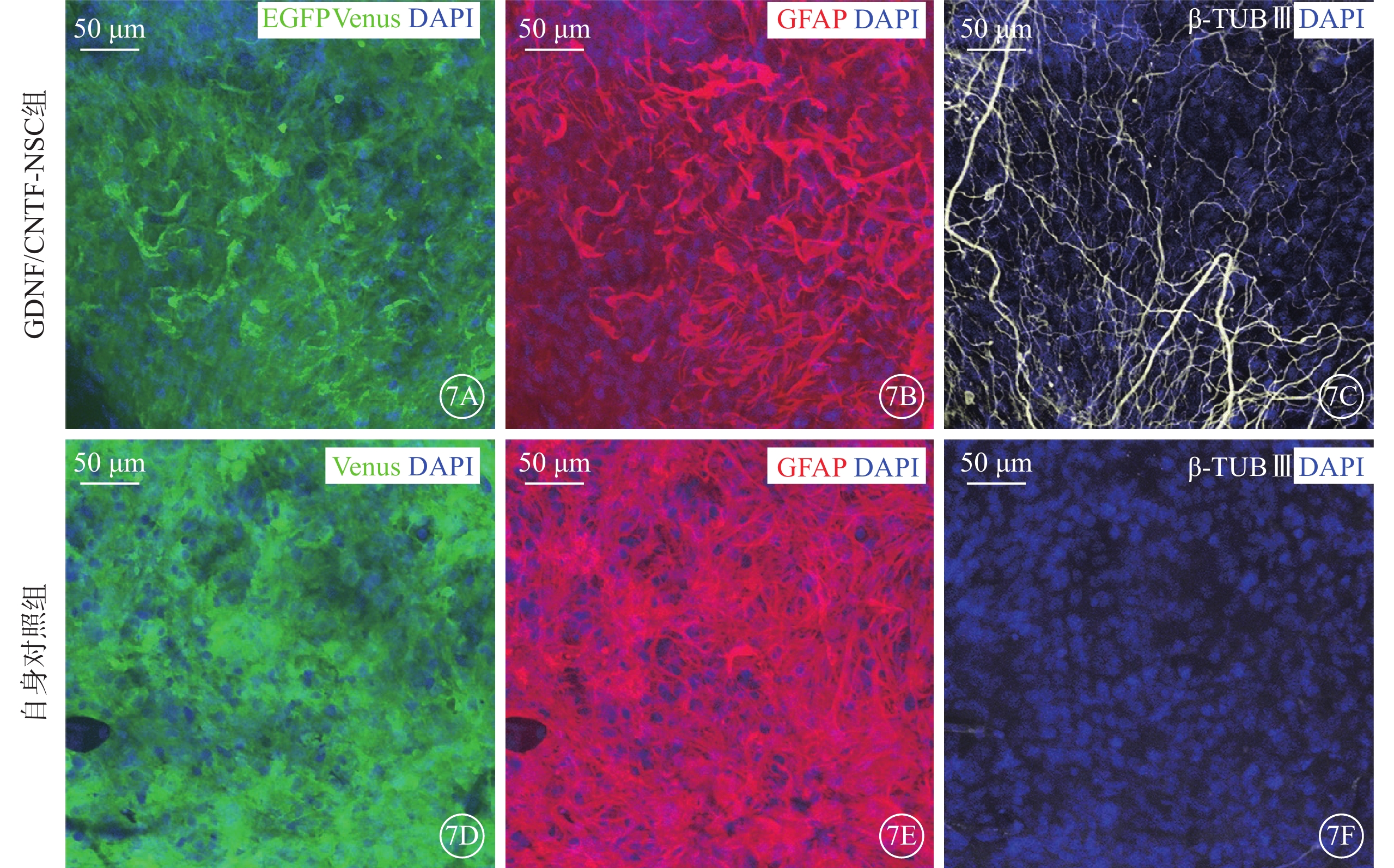
免疫熒光顯微鏡觀察發現,實驗組不同治療亞組及其自身對照組移植的NSC系分布于晶狀體后表面和視網膜前表面,均表達報告基因增強型綠色熒光蛋白(EGFP)和金星熒光蛋白(Venus);優先分化為星形膠質細胞。其中,GDNF/CNTF-NSC可更多分化為神經元,但多數仍優先分化為星形膠質細胞(圖7)。
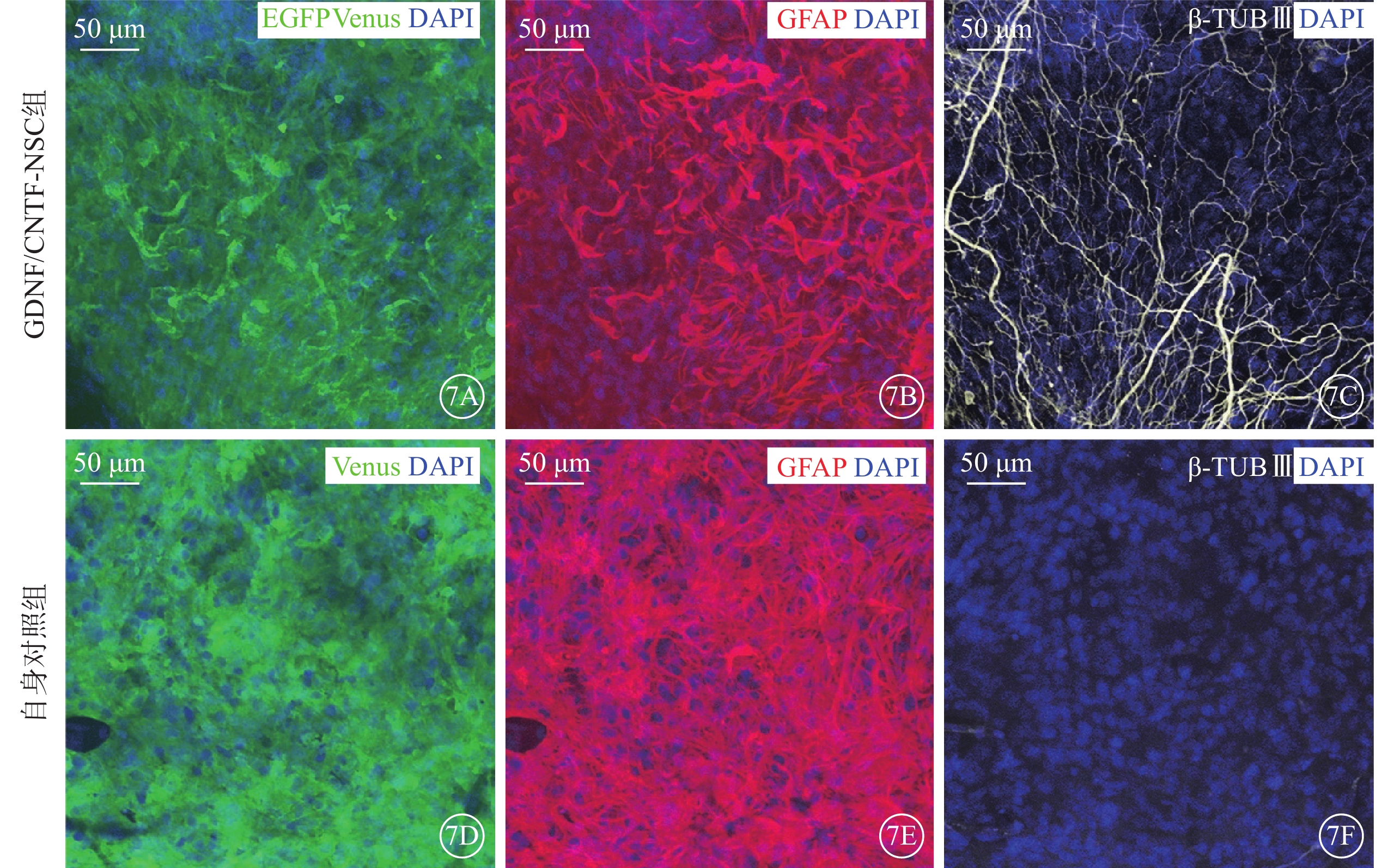 圖7
移植的NSC在玻璃體腔的分化(DAPI染色,標尺:50 μm) 7A~7C、7D~7F分別示GDNF/CNTF-NSC組與其自身對照組Venus、GFAP、β-TUB Ⅲ表達。綠色熒光為報告蛋白EGFP、Venus;紅色熒光為GFAP標記的星形膠質細胞;白色熒光為β-TUB Ⅲ標記的神經元;藍色熒光為DAPI標記的細胞核。可見NSC表達熒光報告蛋白,NSC優先分化為星形膠質細胞,部分GDNF/CNTF-NSC分化為神經元 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;GFAP:膠質原纖維酸性蛋白;β-TUB:β-微管蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖7
移植的NSC在玻璃體腔的分化(DAPI染色,標尺:50 μm) 7A~7C、7D~7F分別示GDNF/CNTF-NSC組與其自身對照組Venus、GFAP、β-TUB Ⅲ表達。綠色熒光為報告蛋白EGFP、Venus;紅色熒光為GFAP標記的星形膠質細胞;白色熒光為β-TUB Ⅲ標記的神經元;藍色熒光為DAPI標記的細胞核。可見NSC表達熒光報告蛋白,NSC優先分化為星形膠質細胞,部分GDNF/CNTF-NSC分化為神經元 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;GFAP:膠質原纖維酸性蛋白;β-TUB:β-微管蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
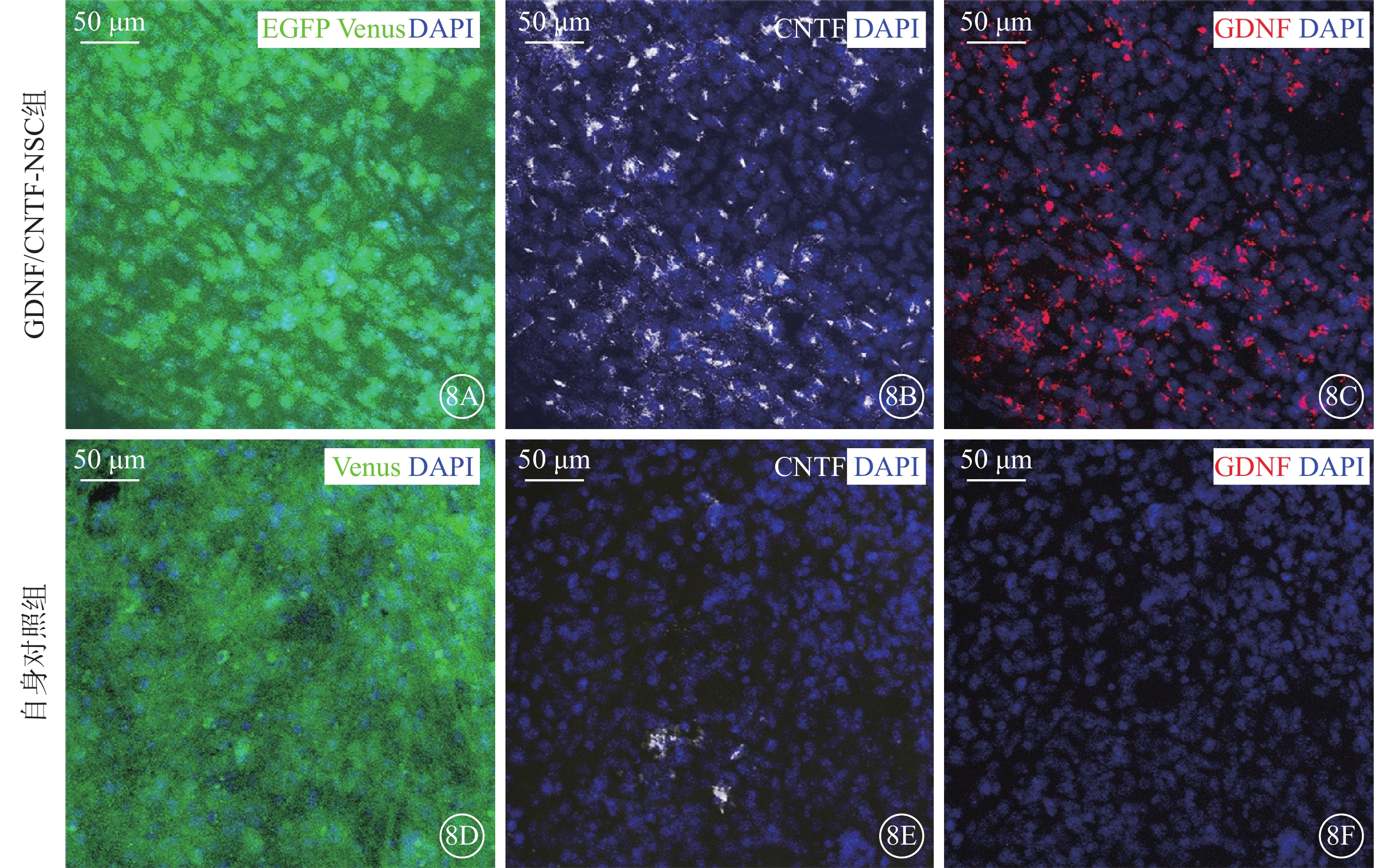
實驗組不同治療亞組穩定表達GDNF或CNTF以及報告基因EGFP或Venus(圖8A~8C);其自身對照組僅表達報告基因EGFP或Venus,未觀察到GDNF或CNTF表達(圖8D~8F)。
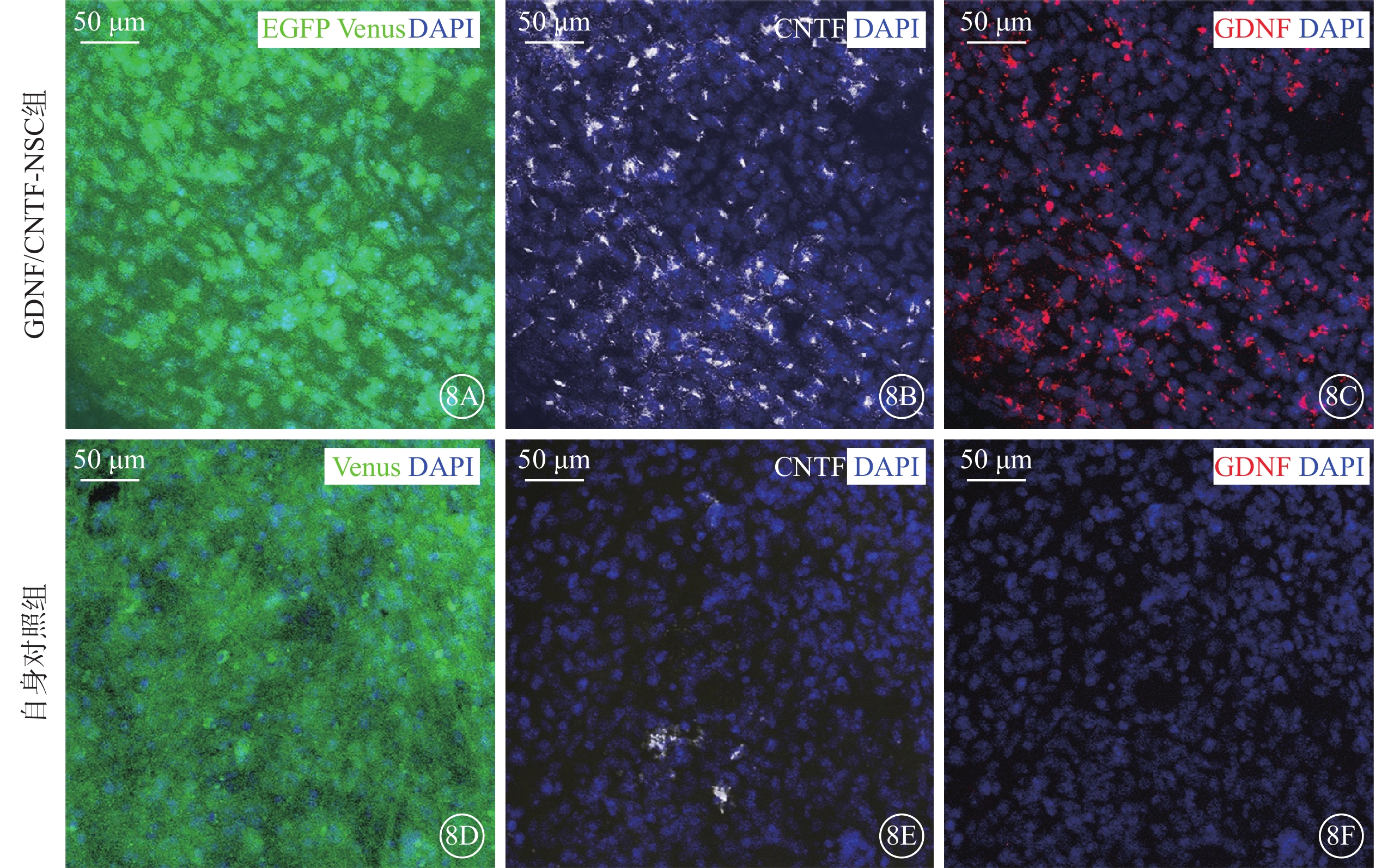 圖8
移植的NSC在玻璃體腔的轉基因表達(DAPI染色,標尺:50 μm) 8A~8C、8D~8F分別示GDNF/CNTF-NSC組與其自身對照組Venus、CNTF、GDNF表達。綠色熒光為報告基因EGFP、Venus;紅色熒光為GDNF;白色熒光為CNTF;藍色熒光為細胞核。GDNF/CNTF-NSC組穩定表達GDNF或CNTF以及報告基因EGFP或Venus;其自身對照組僅表達報告基因EGFP或Venus,未觀察到GDNF或CNTF表達 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖8
移植的NSC在玻璃體腔的轉基因表達(DAPI染色,標尺:50 μm) 8A~8C、8D~8F分別示GDNF/CNTF-NSC組與其自身對照組Venus、CNTF、GDNF表達。綠色熒光為報告基因EGFP、Venus;紅色熒光為GDNF;白色熒光為CNTF;藍色熒光為細胞核。GDNF/CNTF-NSC組穩定表達GDNF或CNTF以及報告基因EGFP或Venus;其自身對照組僅表達報告基因EGFP或Venus,未觀察到GDNF或CNTF表達 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
2.3 神經保護治療對光感受器細胞存活的影響
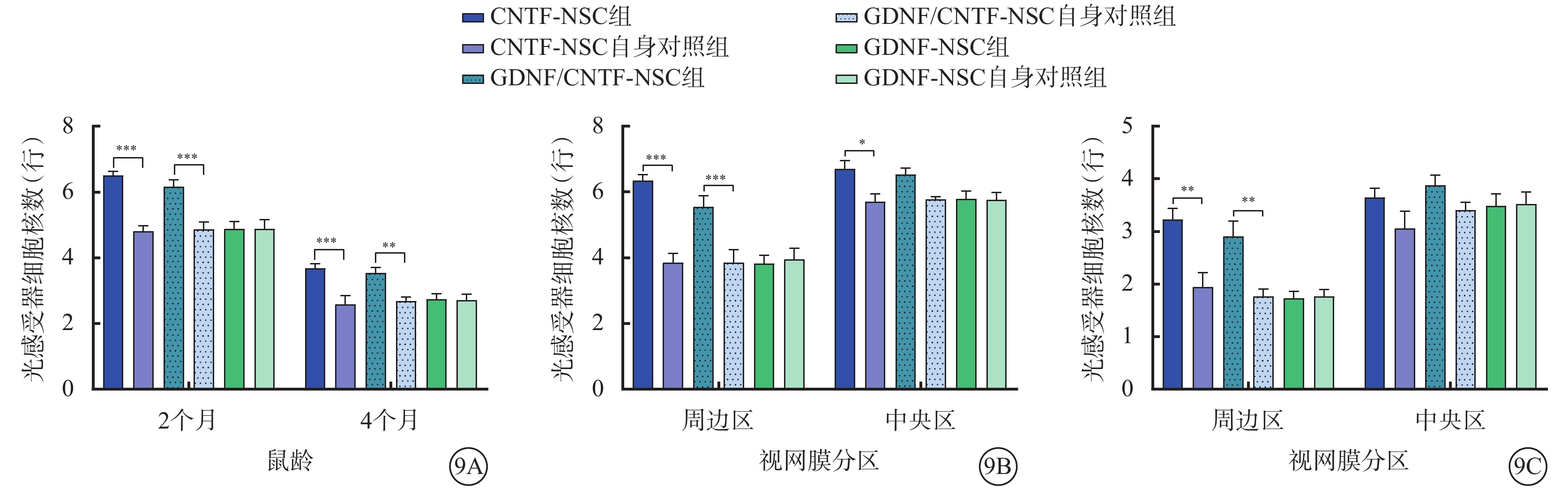
視網膜光感覺器細胞核數比較:GDNF-NSC組與其自身對照組,2、4月齡:整個(F=0.00)、中央區(F=0.02、0.02)、周邊區(F=0.02、0.02)差異無統計學意義(P>0.05)。CNTF-NSC組與其自身對照組,2月齡:整個、中央區、周邊區差異有統計學意義(F=31.73、75.06、75.06);4月齡:整個、周邊區差異有統計學意義(F=31.73、12.27,P<0.05),中央區差異無統計學意義(F=12.27,P>0.05)。GDNF/CNTF-NSC組與其自身對照組,2、4月齡:整個(F=27.26、27.26)、周邊區(F=16.01、13.55)差異有統計學意義(P<0.05),中央區差異無統計學意義(F=16.01、13.55,P>0.05)(圖9,表4)。
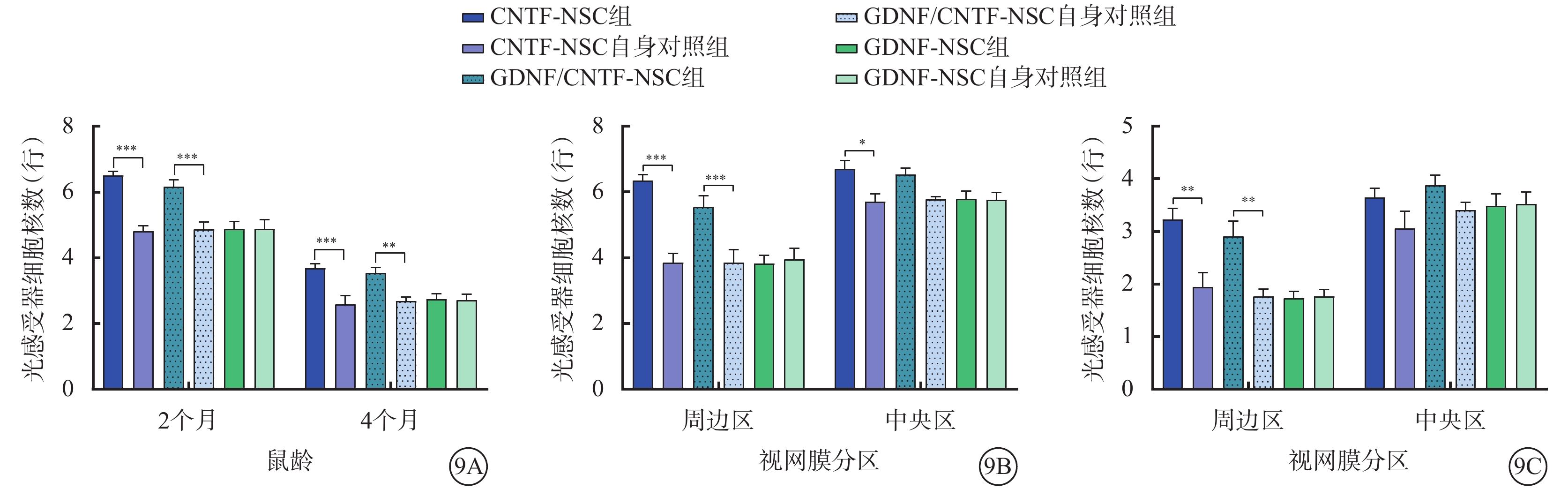 圖9
NTF對光感受器細胞存活的影響(n=6) 9A示2、4月齡小鼠整個視網膜光感受器細胞核數比較;9B示2月齡小鼠周邊區、中央區光感受器細胞核數比較;9C示4月齡小鼠周邊區、中央區光感受器細胞核數比較 *P<0.05,**P<0.001,***P<0.000 1;NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖9
NTF對光感受器細胞存活的影響(n=6) 9A示2、4月齡小鼠整個視網膜光感受器細胞核數比較;9B示2月齡小鼠周邊區、中央區光感受器細胞核數比較;9C示4月齡小鼠周邊區、中央區光感受器細胞核數比較 *P<0.05,**P<0.001,***P<0.000 1;NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
2.4 神經保護治療對視網膜功能的影響
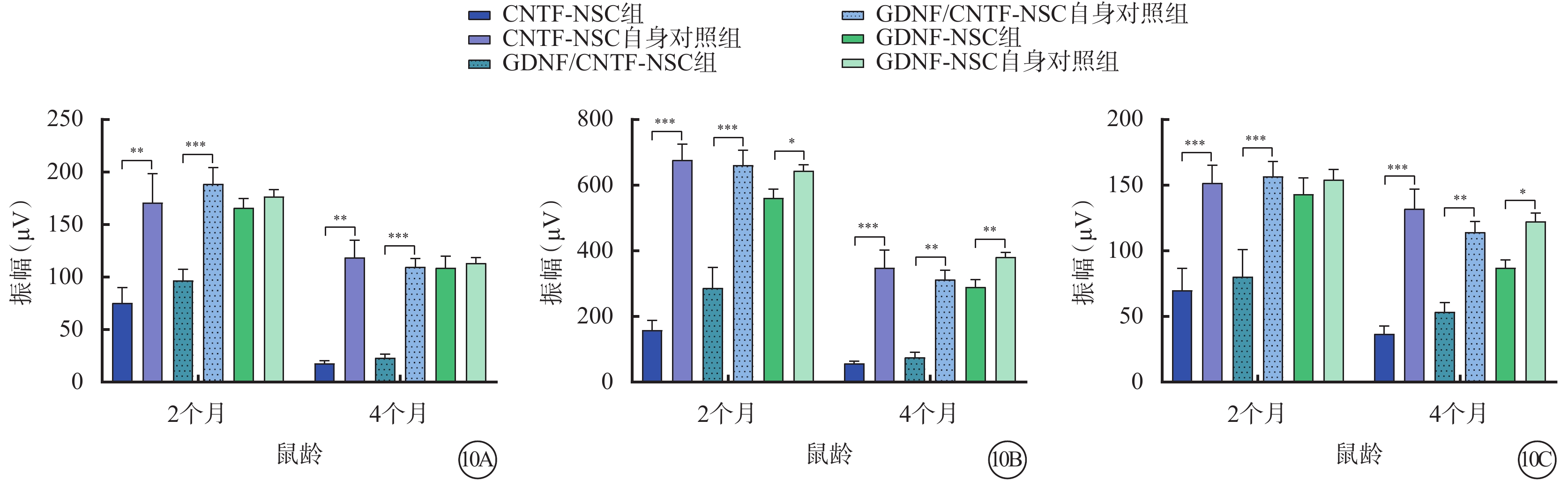
小鼠2、4月齡時,與相應自身對照組比較,CNTF-NSC組、GDNF/CNTF-NSC組小鼠視網膜暗視a、b波及明視b波振幅均下降,但GDNF/CNTF-NSC組下降幅度相對更小;GDNF-NSC組視網膜暗視a波振幅相似,暗視b波振幅降低,而明視b波振幅于2月齡時相似、4月齡時降低(圖10)。
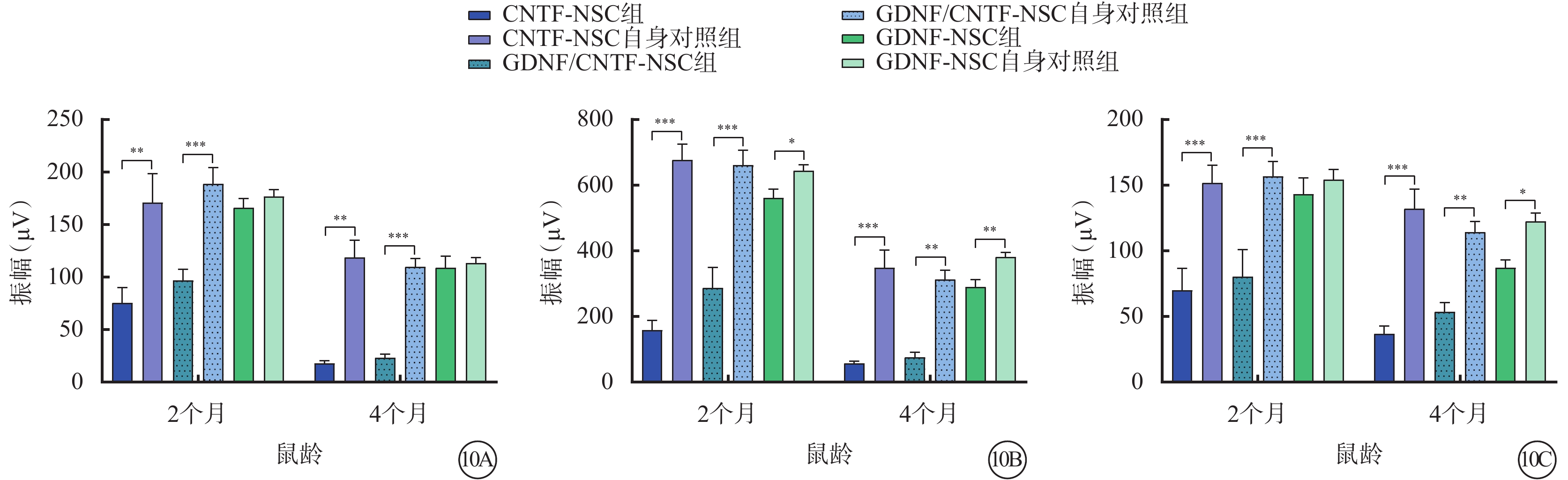 圖10
NTF對視網膜功能的影響(n=6) 10A、10B、10C分別示實驗組不同治療亞組及其自身對照組不同月齡小鼠視網膜暗視a、b波振幅和明視b波振幅比較,*P<0.05,**P<0.001,***P<0.000 1 NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖10
NTF對視網膜功能的影響(n=6) 10A、10B、10C分別示實驗組不同治療亞組及其自身對照組不同月齡小鼠視網膜暗視a、b波振幅和明視b波振幅比較,*P<0.05,**P<0.001,***P<0.000 1 NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
3 討論
CLN7為一種新型內溶酶體氯離子通道,其位于溶酶體和內質體中,調節溶酶體氯電導、管腔pH值和溶酶體膜電位,并促進溶酶體Ca2+釋放[16],因此,CLN7的致病性突變可導致氯離子滲透性降低。CLN7型患者臨床表現復雜多變,平均發病年齡2~7歲,癲癇發作和發育遲緩是最常見的早期臨床癥狀;疾病后期會出現進行性認知和行為損傷、肌陣攣、性格改變和失明等[4]。本研究團隊前期觀察了CLN7型小鼠出生至4月齡時視網膜的生化和形態特征,發現早期即出現隨年齡增長快速進展的視桿細胞退行性病變,以及反應性星形膠質細胞和小膠質細胞增生,大量溶酶體蛋白顯著失調以及儲存物質的積累[17]。本研究觀察CLN7型小鼠疾病晚期階段突變視網膜的形態和ERG特征,初步評估了基于細胞的神經保護策略,特別是CNTF和GDNF,在保護CLN7型小鼠視網膜結構和功能方面的治療潛力。
與既往研究結果[17]不同,本研究結果顯示,CLN7型小鼠視錐細胞顯著損失,尤其在視網膜周邊區域,且小鼠2月齡時已很明顯;此外,視網膜視桿-雙極細胞和視錐-雙極細胞早發退行性改變,且中間神經元數量均顯著減少。ERG檢測結果顯示,CLN7型小鼠的暗視a、b波振幅在2月齡時顯著降低,4月齡時明視b波振幅也顯著降低,與光感受器細胞和雙極細胞的形態學改變一致,表明視桿細胞和視桿-雙極細胞發生了進行性退行性改變。正常明視b波振幅表明2月齡CLN7型小鼠存在功能完整的視錐細胞到內視網膜信號傳導,然而,與WT組小鼠相比,4月齡CLN7型小鼠視錐細胞驅動的內視網膜信號顯著下降,而到6月齡時視網膜功能進一步受損。Rowe等[18]在CLN7型患者和小鼠模型中也觀察到類似結果。在多個NCL亞型中觀察到雙極細胞的退行性改變,其中CLN6型的主要特征為光感受器細胞地快速進行性退化,與CLN7型相似,在CLN6型動物模型中光感受器細胞首先丟失[19-20]。然而,采用編碼CLN6的腺相關病毒(AAV)2/8-CLN6載體靶向視網膜光感受器未能保護光感受器細胞免受死亡,而采用AAV2/2變體7m8載體靶向雙極細胞卻保留了光感受器的形態和功能[21]。上述結果表明,CLN6型動物模型中光感受器退行性病變是繼發于雙極細胞缺陷,提示我們對CLN7型小鼠模型中雙極細胞進行探索性工作是非常重要的。
目前,臨床對CLN7型患者總體以姑息治療為主。迄今為止,僅有少數臨床前研究關注CLN7型神經退行性病變治療方案的開發。近期一項研究表明,腹腔注射他莫昔芬可減少CLN7型小鼠大腦中三酰神經酰胺和線粒體三磷酸腺苷(ATP)合酶的亞基c的積累,并減弱小膠質細胞的激活,通過行為學實驗表明,該治療增強了運動協調性[22]。另一項研究表明,在CLN7型小鼠出生后7~10 d,給予鞘內注射單次高劑量(5×1011 vg)AAV9/MFSD8可減少線粒體ATP合酶的亞基c積累和GFAP免疫反應,延長小鼠壽命,增加體重以及恢復受損行為表現,美國食品與藥品監督管理局已于2020年12月批準了研究性新藥申請#19766,開始AAV9/MFSD8的Ⅰ期鞘內基因治療試驗[23]。開發針對細胞內跨膜蛋白缺陷引起的NCL形式的治療方案是一項具有挑戰性的任務,考慮到視網膜對CLN7蛋白功能障礙導致的溶酶體功能障礙的易感性,除大腦神經變性之外,針對視網膜變性的新療法值得進一步研究。
CNTF和GDNF被認為可以挽救光感受器細胞和RGC,其中CNTF已被證明可以提高各種視網膜營養不良動物模型中光感受器的存活[9, 11, 24],包括CLN6型NCL[10]。遺傳方法已證實外源重組人CNTF可以通過Müller細胞中的gp130受體發出初始信號以保護光感受器細胞[25]。與CNTF類似,GDNF也被證實可以減輕病理條件下光感受器細胞退行性改變并保留視網膜功能[26-27]。GDNF可以直接或間接通過Müller細胞對光感受器細胞發揮其保護作用[28]。我們前期研究結果已證實GDNF和CNTF的共同給藥對視神經損傷小鼠模型的RGC在長達8個月的時間內發揮協同神經保護作用,聯合給藥組RGC存活率較單純給予每種NTF的治療組高出近5倍[13-14]。基于上述結果,本研究觀察CNTF、GDNF或CNTF/GDNF-NSC在減弱CLN7型小鼠視網膜形態和功能表型方面的治療潛力。
由于NTF存在半衰期短和不能穿透血視網膜屏障的問題,本研究使用我們前期建立的過表達GDNF或CNTF的克隆NSC系。通過重復轉導構建具有高水平NTF表達的克隆衍生NSC系,每次轉導后都會對具有最強熒光報告蛋白水平的細胞進行克隆擴增,從而獲得NTF的最高表達水平[9]。選擇基于細胞的遞送策略原因之一主要是該方法具備通過封裝細胞技術實現臨床轉化的可能性。本研究結果顯示,小鼠玻璃體腔注射CNTF、GDNF或GDNF/CNTF-NCS后,其在晶狀體后表面建立了致密的細胞層并共表達EGFP、GDNF或Venus、CNTF,并且在所有實驗動物中均未觀察到移植細胞整合至宿主視網膜或腫瘤形成的不良影響。在玻璃體腔,幾乎所有對照NSC都分化為星形膠質細胞,而GDNF/CNTF-NSC則分化為星形膠質細胞和少量神經元。將CNTF-NSC移植到CLN7型小鼠視網膜后,于小鼠2、4月齡時,與自身對照組視網膜比較,光感受器細胞核行數分別增加了35.4%和42.3%。盡管在實驗組小鼠視網膜的所有區域均觀察到CNTF-NSC對光感受器細胞存活的保護作用,但我們發現其對周邊區的保護效果更明顯,可能是由于周邊存在更嚴重的退行性病變。本研究在CLN7型小鼠視網膜中觀察到CNTF對光感受器的神經保護作用與其他視網膜營養不良動物模型的報道一致[10, 28],且這種保護作用在移植后長達3.5個月時仍十分明顯。此外,盡管光感受器得到顯著保存,但玻璃體內遞送分泌CNTF的NSC并沒有導致明視或暗視ERG反應增強,而是導致其振幅降低,這與既往研究結果一致[8, 24]。出現這種矛盾結果的可能原因是:(1)CNTF通過刺激視網膜Müller細胞釋放包括堿性成纖維細胞生長因子(FGF-2)等多種其他神經保護因子,間接或至少部分間接保護光感受器細胞,CNTF還被發現可以刺激視網膜色素上皮細胞釋放FGF-2[29],而FGF-2對光感受器功能具有抑制作用[8];(2)CNTF的高濃度抑制光感受器功能,此結果已在小鼠和兔子中均有報告[8, 30];(3)視網膜內部重塑,CNTF可引起視桿細胞的多種生化和形態學改變,包括視桿細胞外節形狀不規則、外節之間距離增大以及排列雜亂的圓盤,從而導致突觸結構變化,所有這些都導致光響應性降低。然而,Lipinski等[24]研究發現,盡管ERG顯示光感受器的電生理功能受到抑制,但對視覺皮層的成像和對視覺誘發的行為反應評估表明,CNTF在疾病晚期可以保持光感受器的功能并正確地向大腦發出信號。
與CNTF-NSC治療類似,給予GDNF/CNTF-NSC干預后,視網膜光感受器存活率也表現出增加,并且在明視和暗視ERG記錄中反應降低,與自身對照組比較,GDNF/CNTF-NSC治療后,小鼠2、4月齡時,光感受器細胞核行數分別增加了26.5%和29.6%。但不足是未觀察到GDNF/CNTF-NSC聯合用藥對光感受器細胞的協同或相加的神經保護作用;相反,GDNF/CNTF-NSC組光感受器細胞存活率低于CNTF-NSC組,這可能是由于GDNF/CNTF-NSC組中含CNTF表達的細胞數量僅占移植總數量的一半所致。GDNF和CNTF聯合給藥對RGC和光感受器細胞的不同作用機制目前尚不清楚。此外,基于NSC遞送的GDNF對暗視a波振幅既沒有負面影響,也沒有正面影響,并且對暗視和明視b波振幅總體上具有較小的負面影響。本研究未觀察到GDNF對光感受器細胞形態和功能的保護作用,這一發現與既往研究結果不同,即GDNF在多種視網膜營養不良動物模型中均發現可以減緩光感受器細胞的退行性改變并維持甚至改善視網膜功能[8, 27-28]。其原因不能完全排除是由于遞送至CLN7型小鼠視網膜的GDNF量不足所引起,但此可能性不大,因為相同GDNF的克隆NSC系在青光眼模型中對RGC具有明顯且持久的保護作用[13-14]。鑒于上述部分研究中,GDNF對涉及光感受器細胞的神經退行性視網膜疾病的治療效果有限,我們建議GDNF與治療效果的相關性需仔細重新考慮。
神經元蠟樣脂褐質沉積癥(NCL)是一組兒童期神經退行性疾病,以癲癇、運動智力衰退及視力減退為主要特征,最終威脅生命。根據受累基因,NCL可分為CLN1~8、CLN10~14共13種亞型,均因溶酶體機制障礙而導致未消化的脂質、神經節苷脂和各種成分蛋白質的蓄積,從而導致細胞內定位的自發熒光蠟樣體存在[1-3]。CLN7型由MFSD8基因突變引起,表現為嚴重的神經系統及視網膜退化[4]。我們的前期研究已通過敲除MFSD8基因外顯子2成功構建CLN7型小鼠模型,其表現出的溶酶體功能障礙和大腦神經退行性變等神經系統缺陷以及快速進展的視網膜退行性改變,與人類CLN7型較為接近[5]。神經營養因子(NTF)是在發育期間和病理條件下促進特定類型神經細胞存活的蛋白質。其中,膠質細胞源性NTF(GDNF)或睫狀NTF(CNTF)已被證實可以挽救多種神經退行性視網膜疾病中神經節細胞(RGC)和(或)光感受器細胞[6-7],但其應用受限于血腦或血視網膜屏障穿透性差及半衰期短[8]。相比之下,神經干細胞(NSC)移植展現出長期治療潛力[9-11],且聯合NTF使用能更有效地保留光感受器細胞[8, 12]。已有研究表明,聯合過表達CNTF和GDNF的NSC在視神經損傷模型中對RGC具有協同保護作用[13-14]。基于此,本研究將焦點放在驗證過表達CNTF和GDNF的NSC共同移植到CLN7型小鼠模型中,能否對光感受器細胞發揮協同保護效應,以期為NCL提供新的治療策略。
1 材料和方法
1.1 實驗動物及主要試劑、儀器
CLN7型小鼠100只、C57BL/6J小鼠20只,鼠齡均為14 d,無特定病原體級,漢堡-埃彭多夫大學醫學中心提供;飼養于標準(12 h明/暗循環)清潔級環境中。所有流程均征得漢堡大學和漢堡州立動物保護委員會的同意并符合歐盟在研究中使用動物的相關規定,獲得當地動物倫理委員會批準(批準號:110/2019ORG842)。
表達GDNF、CNTF的克隆NSC慢病毒(GDNF-NSC、CNTF-NSC)由本實驗室構建[10-11, 13-14]。0.1%牛血清白蛋白(BSA)和0.3%Triton X-100(美國Sigma公司);抗生物素化花生凝集素(PNA)抗體(美國Vector Laboratories公司);抗蛋白激酶Cα(PKCα)抗體(美國Santa Cruz Biotechnology公司);抗鈣結合樣蛋白/神經標記物Secretagogin抗體(SCGN)(歐洲BioVendor 公司);抗兔神經膠質原纖維酸性蛋白(GFAP)一抗(德國Dako Cytomation GmbH公司);抗小鼠β-微管蛋白Ⅲ(β-TUB Ⅲ)一抗、4',6-二脒基-2-苯基吲哚(DAPI)抗體(德國Sigma公司);抗GDNF抗體、抗CNTF抗體(美國Santa Cruz Biotechnology公司);Cy3和(或)Cy5二抗(美國杰克遜免疫研究公司)。Olympus FV 1000共聚焦顯微鏡(日本Olympus公司);蔡司共聚焦熒光顯微鏡(德國蔡司公司);視覺電生理儀Ganzfeld Q450(德國Roland Consult公司);低溫恒溫器(德國LEICA公司)。
1.2 實驗動物分組和NSC的慢病毒移植
CLN7型小鼠100只隨機分為實驗組、對照組,分別為80、20只。C57BL/6J小鼠20只設定為野生型組(WT組)。對照組、WT組小鼠不作任何處理。實驗組小鼠隨機選取單側眼為實驗眼,玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物(GDNF/CNTF-NSC),并據此再分為CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組;對側眼玻璃體腔注射不含NTF的NSC 2 μl作為自身對照組。細胞密度均為8×105個/μl。
1.3 免疫組織化學染色觀察小鼠視網膜視錐細胞、視桿-雙極細胞、視錐-雙極細胞分布和數量變化以及晶狀體后表面NFT表達和NSC分化情況
小鼠2、4、6月齡時,對照組、WT組各隨機選取6只小鼠,深度麻醉處死,摘除眼球,4%多聚甲醛(PA)固定1 h,分別在質量分數為7.5%、15.0%、30.0%的蔗糖溶液中梯度脫水過夜。Tissue-Tek組織包埋盒包埋并以特定方向于液氮中速凍,以識別鼻側和顳側視網膜。低溫恒溫器連續切片,厚度25 μm,含0.1%BSA和0.3% Triton X-100的磷酸鹽緩沖液(PBS)封閉,抗生物素化PNA一抗孵育2 d,PKCα、SCGN一抗孵育24 h后,PBS充分洗滌,加入Cy3二抗室溫孵育2 h,PBS充分洗滌,DAPI染色,10 min后漂洗,轉移至載玻片上,避光自然晾干,蓋上蓋玻片于熒光顯微鏡下觀察并拍照。
采用共聚焦顯微鏡捕獲帶視神經的整個視網膜切片圖像,Fiji Image J 1.51s軟件分析。視盤距鼻側、顳側視網膜邊緣25%、50%、75%處分別設置3個長寬為250 μm的正方形框域,計數位于框內的視錐細胞及PKCα、SCGN染色呈陽性的視桿-雙極細胞、視錐-雙極細胞密度。周邊視網膜定義為距視盤75%處的位于視網膜邊緣處的正方形區域,整個視網膜定義為鼻側和顳側視網膜共6個正方形框域。在含有視神經的視網膜切片中,視盤距鼻側、顳側視網膜邊緣之間分別設置9個等距垂直線性標記,記錄光感受器細胞行數,其中最外圍3個位置定義為周邊區視網膜,最中心3個位置定義為中央區視網膜。
小鼠4月齡時,GDNF/CNTF-NSC組隨機選取6只小鼠,深度麻醉處死,摘除雙眼眼球,取出附著有NSC的晶狀體,4% PA固定1 h,兔抗GFAP(1:500)一抗、小鼠抗β-TUB Ⅲ一抗、抗GDNF一抗、抗CNTF一抗和綿羊抗兔Cy3或Cy5二抗(1:1 000)染色,載玻片制作前,DAPI復染10 min。免疫熒光顯微鏡觀察拍照。
1.4 ERG評估小鼠視網膜功能
對照組、WT組于小鼠2、4、6月齡時、實驗組不同治療亞組于小鼠2、4月齡時,各隨機選取6只小鼠行ERG檢測。采用Ganzfeld Q450視覺電生理檢測儀記錄明暗視a、b波振幅;因小鼠明視a波可忽略不計[15],僅同時記錄明視b波振幅。小鼠暗適應12 h后,采用個性化定制的內含鋼絲環的角膜電極接觸小鼠角膜表面作為記錄電極,將鉑針插入小鼠頸背處皮下作為參考電極,同時將接地電極插入小鼠背部后部區域皮下。使用光強度為9.49 cd.s/m2的白光作為閃光刺激,記錄暗適應視桿反應a、b波振幅。全視野刺激白色背景光25.0 cd.s/m2下明適應5 min后記錄明適應視錐反應a、b波振幅。a波振幅為刺激前基線至a波波谷;b波振幅為a波波谷至b波波峰。ERG記錄后,角膜表面涂凝膠防止角膜脫水。ERG記錄過程中電熱毯溫度維持在38 ℃以保持小鼠體溫,室溫控制在22~23℃。
1.5 統計學方法
采用Graphpad Prism 9.3軟件行統計學分析。定量數據以均數±標準差(x±s)表示。兩組間比較采用雙因素方差分析,采用Bonferroni或Tukey校正檢驗水準。P<0.05為差異有統計學意義。
2 結果
2.1 CLN7型小鼠多種視網膜細胞類型進行性丟失
與WT組比較,對照組小鼠除2月齡時整個(6框計數平均值)視網膜視錐細胞密度差異無統計學意義外(F=127.3,P>0.05),其他月齡對照組小鼠中央區及周邊區視網膜視錐細胞密度差異均有統計學意義(F=127.3、285.1,P<0.000 1)(圖1,表1)。
 圖1
視錐細胞退行性改變 1A~1D、1E~1H、1I~1L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PNA標記視錐細胞,藍色熒光為DAPI染色的細胞核。小鼠2月齡時,WT組與對照組小鼠中央區視網膜視錐細胞密度相似(1A、1B),周邊區視網膜視錐細胞密度明顯降低(1C、1D);對照組小鼠視錐細胞內、外段長度減少(1B、1D)。小鼠4、6月齡時,與WT組比較,對照組小鼠中央區、周邊區視網膜視錐細胞出現明顯丟失。1M、1N分別示WT組、對照組小鼠周邊區、中央區視網膜視錐細胞密度比較(n=6),***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PNA:花生凝集素;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
圖1
視錐細胞退行性改變 1A~1D、1E~1H、1I~1L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PNA標記視錐細胞,藍色熒光為DAPI染色的細胞核。小鼠2月齡時,WT組與對照組小鼠中央區視網膜視錐細胞密度相似(1A、1B),周邊區視網膜視錐細胞密度明顯降低(1C、1D);對照組小鼠視錐細胞內、外段長度減少(1B、1D)。小鼠4、6月齡時,與WT組比較,對照組小鼠中央區、周邊區視網膜視錐細胞出現明顯丟失。1M、1N分別示WT組、對照組小鼠周邊區、中央區視網膜視錐細胞密度比較(n=6),***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PNA:花生凝集素;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
不同月齡對照組、WT組小鼠視網膜中央區、周邊區視桿-雙極細胞、視錐-雙極細胞密度比較,差異均有統計學意義(P<0.05)(圖2,3)。小鼠2、4、6月齡時,與WT組比較,對照組小鼠整個、周邊區視網膜視桿-雙極細胞(F=823.2、346.2)、視錐-雙極細胞(F=356.3、210.6)密度均顯著降低,差異均有統計學意義(P<0.000 1)(圖4,5;表2)。
 圖2
視錐-雙極細胞的退行性改變 2A~2D、2E~2H、2I~2L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為SCGN標記的視錐-雙極細胞,藍色熒光為DAPI標記的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;SCGN:抗鈣結合樣蛋白/神經標記物Secretagogin抗體;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
圖2
視錐-雙極細胞的退行性改變 2A~2D、2E~2H、2I~2L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為SCGN標記的視錐-雙極細胞,藍色熒光為DAPI標記的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;SCGN:抗鈣結合樣蛋白/神經標記物Secretagogin抗體;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
 圖3
視桿-雙極細胞的退行性改變 3A~3D、3E~3H、3I~3L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PKCα標記的視桿-雙極細胞,藍色熒光為DAPI染色的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PKCα:蛋白激酶Cα;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
圖3
視桿-雙極細胞的退行性改變 3A~3D、3E~3H、3I~3L分別示2、4、6月齡WT組、對照組小鼠中央區、周邊區視網膜熒光顯微鏡像(標尺:50 μm),紅色熒光為PKCα標記的視桿-雙極細胞,藍色熒光為DAPI染色的細胞核。與WT組比較,不同月齡對照組小鼠中央區、周邊區視網膜中視錐-雙極細胞密度均明顯降低 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠;PKCα:蛋白激酶Cα;DAPI:4',6-二脒基-2-苯基吲哚;ONL:外核層;INL:內核層;GCL:神經節細胞層
 圖4
不同月齡WT組、對照組小鼠整個、周邊區視網膜視錐-雙極細胞密度比較(n=6) 4A、4B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
圖4
不同月齡WT組、對照組小鼠整個、周邊區視網膜視錐-雙極細胞密度比較(n=6) 4A、4B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
 圖5
不同月齡WT組、對照組小鼠整個、周邊區視網膜視桿-雙極細胞密度比較(n=6) 5A、5B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
圖5
不同月齡WT組、對照組小鼠整個、周邊區視網膜視桿-雙極細胞密度比較(n=6) 5A、5B分別示整個、周邊區視網膜,***P<0.000 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
ERG檢測結果顯示,與WT組比較,對照組小鼠除2月齡時明視b波振幅差異無統計學意義外(F=51.13,P>0.05),其他月齡對照組小鼠暗視a、b波振幅及明視b波振幅差異均有統計學意義(F=1 911.0、387.1,P<0.000 1)(圖6,表3)。
 圖6
WT組、對照組不同月齡小鼠暗視a、b波及明視b波振幅比較(n=6) 6A、6B、6C分別示暗視a、b波振幅及明視b波振幅,***P<0.000 1,***P<0.00 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
圖6
WT組、對照組不同月齡小鼠暗視a、b波及明視b波振幅比較(n=6) 6A、6B、6C分別示暗視a、b波振幅及明視b波振幅,***P<0.000 1,***P<0.00 1 WT組:C57BL/6J小鼠;對照組:CLN7型小鼠
2.2 移植NSC在體內分化和轉基因表達
免疫熒光顯微鏡觀察發現,實驗組不同治療亞組及其自身對照組移植的NSC系分布于晶狀體后表面和視網膜前表面,均表達報告基因增強型綠色熒光蛋白(EGFP)和金星熒光蛋白(Venus);優先分化為星形膠質細胞。其中,GDNF/CNTF-NSC可更多分化為神經元,但多數仍優先分化為星形膠質細胞(圖7)。
 圖7
移植的NSC在玻璃體腔的分化(DAPI染色,標尺:50 μm) 7A~7C、7D~7F分別示GDNF/CNTF-NSC組與其自身對照組Venus、GFAP、β-TUB Ⅲ表達。綠色熒光為報告蛋白EGFP、Venus;紅色熒光為GFAP標記的星形膠質細胞;白色熒光為β-TUB Ⅲ標記的神經元;藍色熒光為DAPI標記的細胞核。可見NSC表達熒光報告蛋白,NSC優先分化為星形膠質細胞,部分GDNF/CNTF-NSC分化為神經元 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;GFAP:膠質原纖維酸性蛋白;β-TUB:β-微管蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖7
移植的NSC在玻璃體腔的分化(DAPI染色,標尺:50 μm) 7A~7C、7D~7F分別示GDNF/CNTF-NSC組與其自身對照組Venus、GFAP、β-TUB Ⅲ表達。綠色熒光為報告蛋白EGFP、Venus;紅色熒光為GFAP標記的星形膠質細胞;白色熒光為β-TUB Ⅲ標記的神經元;藍色熒光為DAPI標記的細胞核。可見NSC表達熒光報告蛋白,NSC優先分化為星形膠質細胞,部分GDNF/CNTF-NSC分化為神經元 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;GFAP:膠質原纖維酸性蛋白;β-TUB:β-微管蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
實驗組不同治療亞組穩定表達GDNF或CNTF以及報告基因EGFP或Venus(圖8A~8C);其自身對照組僅表達報告基因EGFP或Venus,未觀察到GDNF或CNTF表達(圖8D~8F)。
 圖8
移植的NSC在玻璃體腔的轉基因表達(DAPI染色,標尺:50 μm) 8A~8C、8D~8F分別示GDNF/CNTF-NSC組與其自身對照組Venus、CNTF、GDNF表達。綠色熒光為報告基因EGFP、Venus;紅色熒光為GDNF;白色熒光為CNTF;藍色熒光為細胞核。GDNF/CNTF-NSC組穩定表達GDNF或CNTF以及報告基因EGFP或Venus;其自身對照組僅表達報告基因EGFP或Venus,未觀察到GDNF或CNTF表達 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖8
移植的NSC在玻璃體腔的轉基因表達(DAPI染色,標尺:50 μm) 8A~8C、8D~8F分別示GDNF/CNTF-NSC組與其自身對照組Venus、CNTF、GDNF表達。綠色熒光為報告基因EGFP、Venus;紅色熒光為GDNF;白色熒光為CNTF;藍色熒光為細胞核。GDNF/CNTF-NSC組穩定表達GDNF或CNTF以及報告基因EGFP或Venus;其自身對照組僅表達報告基因EGFP或Venus,未觀察到GDNF或CNTF表達 NSC:神經干細胞;NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;EGFP:增強型綠色熒光蛋白;Venus:金星熒光蛋白;DAPI:4',6-二脒基-2-苯基吲哚;GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔注射2 μl CNTF-NSC和GDNF-NSC 1:1細胞混合物;自身對照組:GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
2.3 神經保護治療對光感受器細胞存活的影響
視網膜光感覺器細胞核數比較:GDNF-NSC組與其自身對照組,2、4月齡:整個(F=0.00)、中央區(F=0.02、0.02)、周邊區(F=0.02、0.02)差異無統計學意義(P>0.05)。CNTF-NSC組與其自身對照組,2月齡:整個、中央區、周邊區差異有統計學意義(F=31.73、75.06、75.06);4月齡:整個、周邊區差異有統計學意義(F=31.73、12.27,P<0.05),中央區差異無統計學意義(F=12.27,P>0.05)。GDNF/CNTF-NSC組與其自身對照組,2、4月齡:整個(F=27.26、27.26)、周邊區(F=16.01、13.55)差異有統計學意義(P<0.05),中央區差異無統計學意義(F=16.01、13.55,P>0.05)(圖9,表4)。
 圖9
NTF對光感受器細胞存活的影響(n=6) 9A示2、4月齡小鼠整個視網膜光感受器細胞核數比較;9B示2月齡小鼠周邊區、中央區光感受器細胞核數比較;9C示4月齡小鼠周邊區、中央區光感受器細胞核數比較 *P<0.05,**P<0.001,***P<0.000 1;NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖9
NTF對光感受器細胞存活的影響(n=6) 9A示2、4月齡小鼠整個視網膜光感受器細胞核數比較;9B示2月齡小鼠周邊區、中央區光感受器細胞核數比較;9C示4月齡小鼠周邊區、中央區光感受器細胞核數比較 *P<0.05,**P<0.001,***P<0.000 1;NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
2.4 神經保護治療對視網膜功能的影響
小鼠2、4月齡時,與相應自身對照組比較,CNTF-NSC組、GDNF/CNTF-NSC組小鼠視網膜暗視a、b波及明視b波振幅均下降,但GDNF/CNTF-NSC組下降幅度相對更小;GDNF-NSC組視網膜暗視a波振幅相似,暗視b波振幅降低,而明視b波振幅于2月齡時相似、4月齡時降低(圖10)。
 圖10
NTF對視網膜功能的影響(n=6) 10A、10B、10C分別示實驗組不同治療亞組及其自身對照組不同月齡小鼠視網膜暗視a、b波振幅和明視b波振幅比較,*P<0.05,**P<0.001,***P<0.000 1 NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
圖10
NTF對視網膜功能的影響(n=6) 10A、10B、10C分別示實驗組不同治療亞組及其自身對照組不同月齡小鼠視網膜暗視a、b波振幅和明視b波振幅比較,*P<0.05,**P<0.001,***P<0.000 1 NSC:神經干細胞:NTF:神經營養因子;GDNF:膠質細胞源性NTF;CNTF:睫狀NTF;GDNF-NSC組、GDNF/CNTF-NSC組:CLN7型小鼠實驗眼玻璃體腔分別注射2 μl CNTF-NSC、GDNF-NSC、CNTF-NSC和GDNF-NSC 1:1細胞混合物;GDNF-NSC自身對照組、CNTF-NSC自身對照組、GDNF/CNTF-NSC自身對照組:CNTF-NSC組、GDNF-NSC組、GDNF/CNTF-NSC組小鼠對側眼玻璃體腔注射不含NTF的NSC 2 μl
3 討論
CLN7為一種新型內溶酶體氯離子通道,其位于溶酶體和內質體中,調節溶酶體氯電導、管腔pH值和溶酶體膜電位,并促進溶酶體Ca2+釋放[16],因此,CLN7的致病性突變可導致氯離子滲透性降低。CLN7型患者臨床表現復雜多變,平均發病年齡2~7歲,癲癇發作和發育遲緩是最常見的早期臨床癥狀;疾病后期會出現進行性認知和行為損傷、肌陣攣、性格改變和失明等[4]。本研究團隊前期觀察了CLN7型小鼠出生至4月齡時視網膜的生化和形態特征,發現早期即出現隨年齡增長快速進展的視桿細胞退行性病變,以及反應性星形膠質細胞和小膠質細胞增生,大量溶酶體蛋白顯著失調以及儲存物質的積累[17]。本研究觀察CLN7型小鼠疾病晚期階段突變視網膜的形態和ERG特征,初步評估了基于細胞的神經保護策略,特別是CNTF和GDNF,在保護CLN7型小鼠視網膜結構和功能方面的治療潛力。
與既往研究結果[17]不同,本研究結果顯示,CLN7型小鼠視錐細胞顯著損失,尤其在視網膜周邊區域,且小鼠2月齡時已很明顯;此外,視網膜視桿-雙極細胞和視錐-雙極細胞早發退行性改變,且中間神經元數量均顯著減少。ERG檢測結果顯示,CLN7型小鼠的暗視a、b波振幅在2月齡時顯著降低,4月齡時明視b波振幅也顯著降低,與光感受器細胞和雙極細胞的形態學改變一致,表明視桿細胞和視桿-雙極細胞發生了進行性退行性改變。正常明視b波振幅表明2月齡CLN7型小鼠存在功能完整的視錐細胞到內視網膜信號傳導,然而,與WT組小鼠相比,4月齡CLN7型小鼠視錐細胞驅動的內視網膜信號顯著下降,而到6月齡時視網膜功能進一步受損。Rowe等[18]在CLN7型患者和小鼠模型中也觀察到類似結果。在多個NCL亞型中觀察到雙極細胞的退行性改變,其中CLN6型的主要特征為光感受器細胞地快速進行性退化,與CLN7型相似,在CLN6型動物模型中光感受器細胞首先丟失[19-20]。然而,采用編碼CLN6的腺相關病毒(AAV)2/8-CLN6載體靶向視網膜光感受器未能保護光感受器細胞免受死亡,而采用AAV2/2變體7m8載體靶向雙極細胞卻保留了光感受器的形態和功能[21]。上述結果表明,CLN6型動物模型中光感受器退行性病變是繼發于雙極細胞缺陷,提示我們對CLN7型小鼠模型中雙極細胞進行探索性工作是非常重要的。
目前,臨床對CLN7型患者總體以姑息治療為主。迄今為止,僅有少數臨床前研究關注CLN7型神經退行性病變治療方案的開發。近期一項研究表明,腹腔注射他莫昔芬可減少CLN7型小鼠大腦中三酰神經酰胺和線粒體三磷酸腺苷(ATP)合酶的亞基c的積累,并減弱小膠質細胞的激活,通過行為學實驗表明,該治療增強了運動協調性[22]。另一項研究表明,在CLN7型小鼠出生后7~10 d,給予鞘內注射單次高劑量(5×1011 vg)AAV9/MFSD8可減少線粒體ATP合酶的亞基c積累和GFAP免疫反應,延長小鼠壽命,增加體重以及恢復受損行為表現,美國食品與藥品監督管理局已于2020年12月批準了研究性新藥申請#19766,開始AAV9/MFSD8的Ⅰ期鞘內基因治療試驗[23]。開發針對細胞內跨膜蛋白缺陷引起的NCL形式的治療方案是一項具有挑戰性的任務,考慮到視網膜對CLN7蛋白功能障礙導致的溶酶體功能障礙的易感性,除大腦神經變性之外,針對視網膜變性的新療法值得進一步研究。
CNTF和GDNF被認為可以挽救光感受器細胞和RGC,其中CNTF已被證明可以提高各種視網膜營養不良動物模型中光感受器的存活[9, 11, 24],包括CLN6型NCL[10]。遺傳方法已證實外源重組人CNTF可以通過Müller細胞中的gp130受體發出初始信號以保護光感受器細胞[25]。與CNTF類似,GDNF也被證實可以減輕病理條件下光感受器細胞退行性改變并保留視網膜功能[26-27]。GDNF可以直接或間接通過Müller細胞對光感受器細胞發揮其保護作用[28]。我們前期研究結果已證實GDNF和CNTF的共同給藥對視神經損傷小鼠模型的RGC在長達8個月的時間內發揮協同神經保護作用,聯合給藥組RGC存活率較單純給予每種NTF的治療組高出近5倍[13-14]。基于上述結果,本研究觀察CNTF、GDNF或CNTF/GDNF-NSC在減弱CLN7型小鼠視網膜形態和功能表型方面的治療潛力。
由于NTF存在半衰期短和不能穿透血視網膜屏障的問題,本研究使用我們前期建立的過表達GDNF或CNTF的克隆NSC系。通過重復轉導構建具有高水平NTF表達的克隆衍生NSC系,每次轉導后都會對具有最強熒光報告蛋白水平的細胞進行克隆擴增,從而獲得NTF的最高表達水平[9]。選擇基于細胞的遞送策略原因之一主要是該方法具備通過封裝細胞技術實現臨床轉化的可能性。本研究結果顯示,小鼠玻璃體腔注射CNTF、GDNF或GDNF/CNTF-NCS后,其在晶狀體后表面建立了致密的細胞層并共表達EGFP、GDNF或Venus、CNTF,并且在所有實驗動物中均未觀察到移植細胞整合至宿主視網膜或腫瘤形成的不良影響。在玻璃體腔,幾乎所有對照NSC都分化為星形膠質細胞,而GDNF/CNTF-NSC則分化為星形膠質細胞和少量神經元。將CNTF-NSC移植到CLN7型小鼠視網膜后,于小鼠2、4月齡時,與自身對照組視網膜比較,光感受器細胞核行數分別增加了35.4%和42.3%。盡管在實驗組小鼠視網膜的所有區域均觀察到CNTF-NSC對光感受器細胞存活的保護作用,但我們發現其對周邊區的保護效果更明顯,可能是由于周邊存在更嚴重的退行性病變。本研究在CLN7型小鼠視網膜中觀察到CNTF對光感受器的神經保護作用與其他視網膜營養不良動物模型的報道一致[10, 28],且這種保護作用在移植后長達3.5個月時仍十分明顯。此外,盡管光感受器得到顯著保存,但玻璃體內遞送分泌CNTF的NSC并沒有導致明視或暗視ERG反應增強,而是導致其振幅降低,這與既往研究結果一致[8, 24]。出現這種矛盾結果的可能原因是:(1)CNTF通過刺激視網膜Müller細胞釋放包括堿性成纖維細胞生長因子(FGF-2)等多種其他神經保護因子,間接或至少部分間接保護光感受器細胞,CNTF還被發現可以刺激視網膜色素上皮細胞釋放FGF-2[29],而FGF-2對光感受器功能具有抑制作用[8];(2)CNTF的高濃度抑制光感受器功能,此結果已在小鼠和兔子中均有報告[8, 30];(3)視網膜內部重塑,CNTF可引起視桿細胞的多種生化和形態學改變,包括視桿細胞外節形狀不規則、外節之間距離增大以及排列雜亂的圓盤,從而導致突觸結構變化,所有這些都導致光響應性降低。然而,Lipinski等[24]研究發現,盡管ERG顯示光感受器的電生理功能受到抑制,但對視覺皮層的成像和對視覺誘發的行為反應評估表明,CNTF在疾病晚期可以保持光感受器的功能并正確地向大腦發出信號。
與CNTF-NSC治療類似,給予GDNF/CNTF-NSC干預后,視網膜光感受器存活率也表現出增加,并且在明視和暗視ERG記錄中反應降低,與自身對照組比較,GDNF/CNTF-NSC治療后,小鼠2、4月齡時,光感受器細胞核行數分別增加了26.5%和29.6%。但不足是未觀察到GDNF/CNTF-NSC聯合用藥對光感受器細胞的協同或相加的神經保護作用;相反,GDNF/CNTF-NSC組光感受器細胞存活率低于CNTF-NSC組,這可能是由于GDNF/CNTF-NSC組中含CNTF表達的細胞數量僅占移植總數量的一半所致。GDNF和CNTF聯合給藥對RGC和光感受器細胞的不同作用機制目前尚不清楚。此外,基于NSC遞送的GDNF對暗視a波振幅既沒有負面影響,也沒有正面影響,并且對暗視和明視b波振幅總體上具有較小的負面影響。本研究未觀察到GDNF對光感受器細胞形態和功能的保護作用,這一發現與既往研究結果不同,即GDNF在多種視網膜營養不良動物模型中均發現可以減緩光感受器細胞的退行性改變并維持甚至改善視網膜功能[8, 27-28]。其原因不能完全排除是由于遞送至CLN7型小鼠視網膜的GDNF量不足所引起,但此可能性不大,因為相同GDNF的克隆NSC系在青光眼模型中對RGC具有明顯且持久的保護作用[13-14]。鑒于上述部分研究中,GDNF對涉及光感受器細胞的神經退行性視網膜疾病的治療效果有限,我們建議GDNF與治療效果的相關性需仔細重新考慮。