引用本文: 曹靖靖, 李輝, 寇振宇, 吳桂佳, 東莉潔, 焦明菲. NDRG1基因在體外對視網膜血管內皮細胞血管形成能力的影響. 中華眼底病雜志, 2024, 40(7): 538-544. doi: 10.3760/cma.j.cn511434-20230529-00240 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
糖尿病視網膜病變(DR)是全球工齡人群視力喪失的主要原因之一[1]。雖然激光光凝治療、抗血管內皮生長因子(VEGF)藥物和糖皮質激素在治療DR中取得了顯著的進展,然而部分患者的治療效果并不理想[2-3]。因此明確新的抗新生血管藥物的靶點十分必要。N-myc下游調節基因1(NDRG1)蛋白質與許多生理事件相關,如細胞分化、應激反應、發育、凋亡和脂質合成[4-6]。NDRG1基因在多種癌癥類型中具有抗腫瘤和抗轉移功能,其基因可以抑制腫瘤生長、腫瘤細胞遷移并調節血管生成[4, 7]。在新生血管實體瘤中,NDRG1基因可通過調節癌細胞和內皮細胞的行為來抑制腫瘤的生長[8]。這提示,在腫瘤中NDRG1基因能夠抑制腫瘤細胞增殖遷移及新生血管形成。目前NDRG1基因對視網膜血管內皮細胞的作用尚不明確。本研究旨在建立體外視網膜血管內皮細胞高糖模型模擬DR患者的病理環境,初步探索NDRG1基因對視網膜血管內皮細胞增殖遷移和管腔形成的影響,以期為治療DR提供新的診斷和治療的思路。現將結果報道如下。
1 材料和方法
1.1 材料
恒河猴視網膜血管內皮細胞(RF/6A)由本實驗室自行保存。Dulbecco改良eagle培養基(DMEM,L540KJ,上海源培生物科技股份有限公司);4',6-二脒基-2-苯基吲哚(DAPI,C0065)、甘露醇(SM8120)、葡萄糖(G8150)(北京索萊寶科技有限公司);NDRG1基因(DF6865)、辣根過氧化物酶(HRP,S0001)、β-肌動蛋白(actin)(AF7018)一抗和二抗(美國Affinity公司);Ttranswell共培養板(美國Corning公司);細胞計數試劑盒8(CCK-8,北京金克隆生物技術有限公司);MatrigengeL Matrix標準型含酚紅基質膠(上海諾娃醫藥科技有限公司);SYBR Premix Ex Taq試劑盒(日本Takara公司);iQ5實時熒光定量聚合酶鏈反應(qPCR)儀(美國Applied Biosystems公司)。
1.2 方法
細胞培養。RF/6A細胞株置于含10%胎牛血清和1%雙抗的DMEM培養基中常規培養。取對數生長期細胞用于實驗。
RF/6A細胞分為正常組、甘露醇組、高糖組、無靶基因的小干擾RNA(siRNA)陰性對照組(siRNA組)、30 nmol/L siRNA下調NDRG1基因組(siNDRG1組)、50 nmol/L siNDRG1組。正常組細胞常規培養;根據預實驗結果,甘露醇組細胞加入25 mmol/L甘露醇,高糖組細胞加入25 mmol/L葡萄糖培養;siRNA組細胞加入25 mmol/L葡萄糖培養,再加入空白siRNA誘導;30、50 nmol/L siNDRG1組細胞加入25 mmol/L葡萄糖培養,再分別用30、50 nmol/L siNDRG1進行誘導。所有細胞均孵育24 h進行后續實驗。
免疫熒光染色計數正常組、siRNA組、siNDRG1組細胞核數量。各組細胞以2×104個/孔的密度接種于8孔板中,每孔滴加100 μl的DAPI避光染色5 min,磷酸鹽緩沖液洗3次,5 min/次。熒光顯微鏡觀察并計數。細胞核呈藍色熒光。實驗重復3次。
CCK-8檢測正常組、甘露醇組、高糖組、siRNA組、siNDRG1組細胞活性。細胞培養24 h后,CCK-8檢測各組細胞活性。各組細胞以2×104個/ml密度接種于8孔板中,每孔滴加100 μl的CCK-8試劑孵育2 h,采用酶鏈免疫檢測儀測量波長450 nm處的吸光度[A,舊稱光密度(OD)]值。每組設3個復孔,實驗重復3次。
細胞劃痕實驗檢測正常組、甘露醇組、高糖組、siRNA組、siNDRG1組細胞遷移能力。各組細胞以2×105個/孔的密度接種于12孔板中,待細胞鋪滿后,應用10 μl微量加樣槍頭于孔板中央作“十”字形劃痕,并將此時計作0 h,繼續培養12 h后于相同劃痕位置再次拍照,觀察各孔細胞向裸區遷移情況并記錄原始裸區(S0)和24 h裸區(S24)面積。遷移率=(S0-S24)/S0×100%。實驗重復3次。
Matrigel實驗檢測正常組、甘露醇組、高糖組、siRNA組、siNDRG1組細胞管腔形成能力。4 ℃ MatrigengeL Matrix標準型含酚紅基質膠40 μl緩慢加入96孔板中,于37℃孵育箱中放置30 min。各組細胞以1.5×104個/孔的密度接種于96孔板中孵育,6 h后觀察管腔形成情況。計數相同視野面積下管腔形成數量。實驗重復3次。
qPCR檢測各組細胞中NDRG1 mRNA相對表達量。RNA提取試劑盒提取各組細胞總RNA,逆轉錄成cDNA。應用Primer 5.0軟件設計引物序列。NDRG1 正向引物:GGGCTGAAAAGCATTATTGG,反向引物:CTCCACCATCTCAGGGTTGT;β-actin正向引物:ATTGCCGACAGGATGCAGAA,反向引物:GCTGATCCACATCTGCTGGAA。置于qPCR儀中進行擴增并輸出循環閾值(Cq值),以β-actin為內參照,依照公式2-ΔΔCq計算mRNA的相對表達量。實驗重復3次。
蛋白質免疫印跡法(Western blot)檢測各組細胞中NDRG1蛋白相對表達量。參照文獻[9]的方法,收集各組細胞,提取蛋白定量。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳中上樣電泳,轉至聚偏氟乙烯膜,5%脫脂奶粉室溫封閉1 h,加入NDRG1、β-actin一抗,4℃孵育過夜,洗膜緩沖液(TBST)洗膜,加入HRP羊抗兔二抗,室溫孵育2 h,TBST洗膜,加入化學發光底物進行曝光并拍照,凝膠成像系統掃描分析蛋白條帶。Image J軟件分析蛋白條帶的灰度值,計算蛋白相對表達水平。實驗重復3次。
1.3 統計學分析
采用SPSS軟件進行統計學分析。定量數據以均數±標準差(x±s)表示。經Kolmogorov-Smirnov檢驗,數據符合正態分布且方差齊性,多組間比較采用單因素方差分析;兩組間比較采用t檢驗。采用Graphpad Prism 9.0對所獲得數據進行圖表整理。P<0.05為差異有統計學意義。
2 結果
2.1 高糖促進RF/6A細胞增殖、遷移,提高管腔形成能力
細胞培養12 h后,正常組、甘露醇組僅有少量細胞遷移進入裸區,高糖組可見大量細胞遷移進入裸區(圖1A~1C)。與正常組比較,甘露醇組細胞遷移率上升,但差異無統計學意義(t=47.154,P>0.05);與正常組、甘露醇組比較,高糖組細胞遷移率上升(t=24.745、33.638),差異均有統計學意義(P<0.01)(圖1D)。與正常組、甘露醇組比較,高糖組細胞增殖顯著增多(t=36.659、57.645),差異有統計學意義,(P<0.01)(圖1D,1E)。
 圖1
高糖促進RF/6A細胞遷移能力(n=3) 1A~1C分別示正常組、甘露醇組、高糖組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、甘露醇組僅有少量細胞遷移進入裸區,高糖組大量細胞遷移進入裸區;1D、1E分別示三組細胞遷移率、增殖率比較,**P<0.01 A值:吸光度值;RF/6A細胞:恒河猴視網膜血管內皮細胞:正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
圖1
高糖促進RF/6A細胞遷移能力(n=3) 1A~1C分別示正常組、甘露醇組、高糖組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、甘露醇組僅有少量細胞遷移進入裸區,高糖組大量細胞遷移進入裸區;1D、1E分別示三組細胞遷移率、增殖率比較,**P<0.01 A值:吸光度值;RF/6A細胞:恒河猴視網膜血管內皮細胞:正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
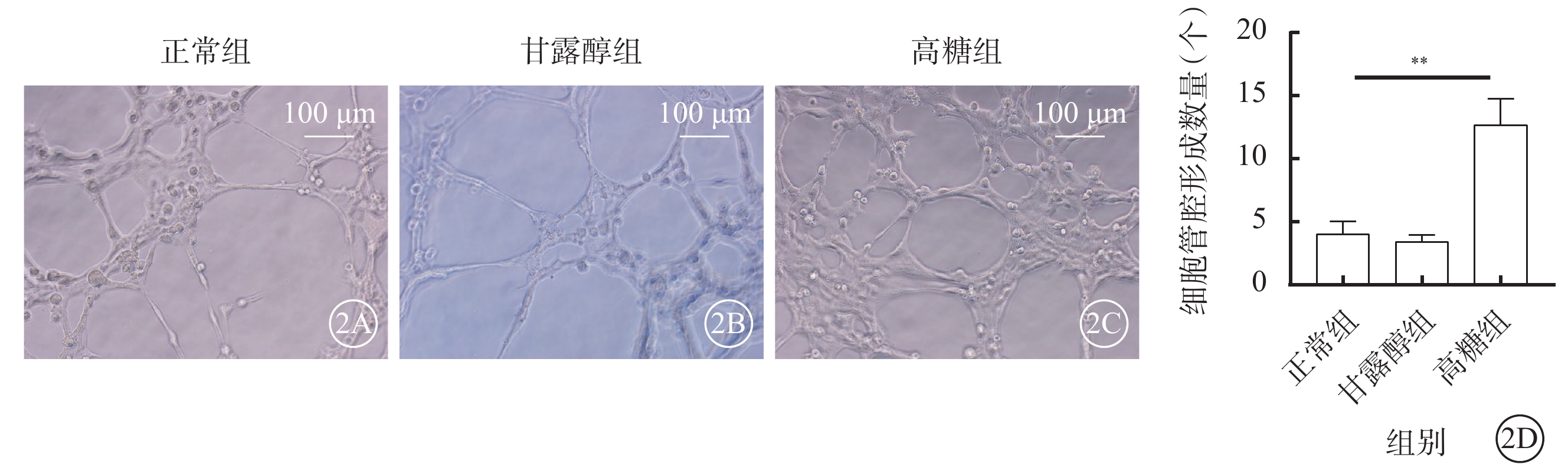
細胞接種6 h后,正常組、甘露醇組細胞管腔形成數量比較,差異無統計學意義(t=49.132,P>0.05);與正常組、甘露醇組比較,高糖組細胞管腔形成數量顯著增加,差異有統計學意義(t=41.276、22.867,P<0.01)(圖2)。
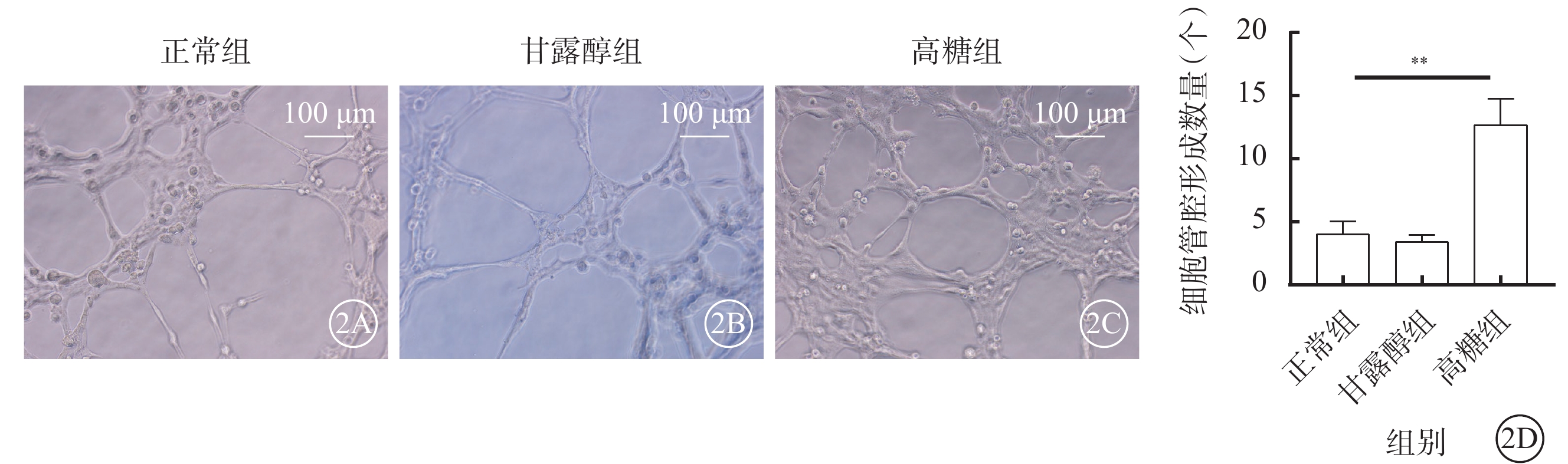 圖2
高糖促進RF/6A細胞管腔形成能力(n=3) 2A~2C分別示正常組、甘露醇組、高糖組細胞顯微鏡像(標尺:100 μm),與正常組、甘露醇組比較,高糖組細胞管腔形成數量顯著增加;2D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
圖2
高糖促進RF/6A細胞管腔形成能力(n=3) 2A~2C分別示正常組、甘露醇組、高糖組細胞顯微鏡像(標尺:100 μm),與正常組、甘露醇組比較,高糖組細胞管腔形成數量顯著增加;2D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
2.2 高糖誘導RF/6A細胞中NDRG1基因的mRNA和蛋白表達降低
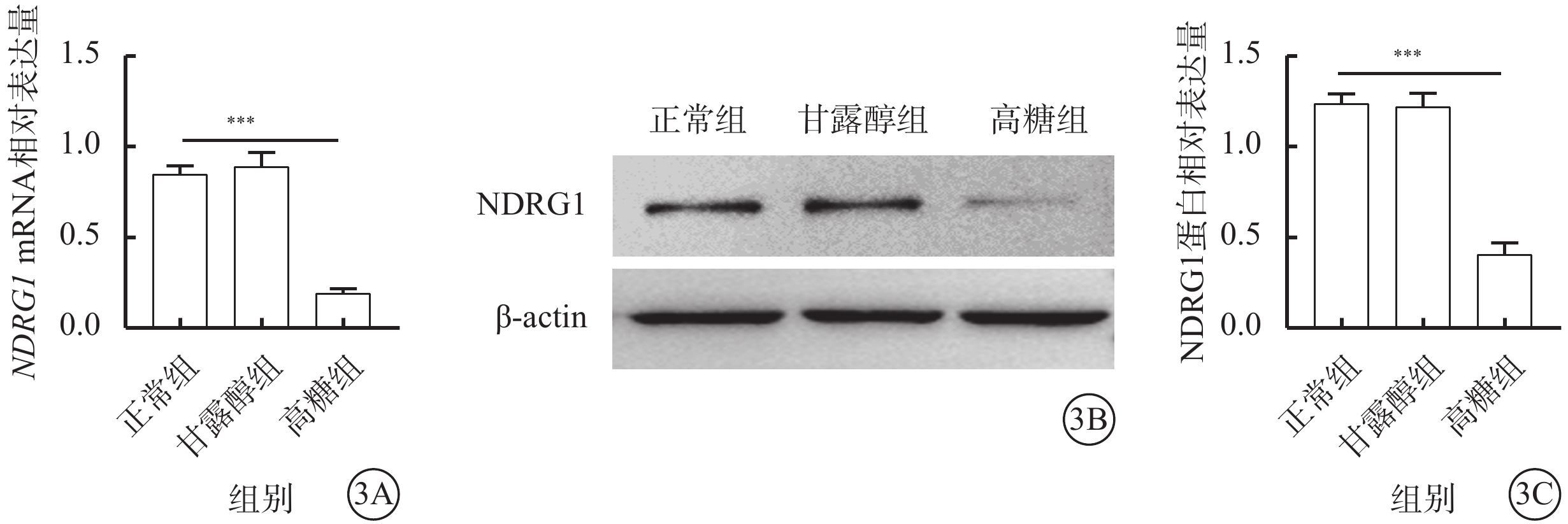
qPCR、Western blot檢測結果顯示,正常組、甘露醇組細胞中NDRG1基因的mRNA和蛋白相對表達量比較,差異無統計學意義(t=44.756、14.677,P>0.05);與正常組、甘露醇組比較,高糖組細胞中NDRG1基因的mRNA(t=36.738、32.976)、蛋白相對表達量顯著下降(t=46.145、21.541),差異有統計學意義(P<0.001)(圖3A)。
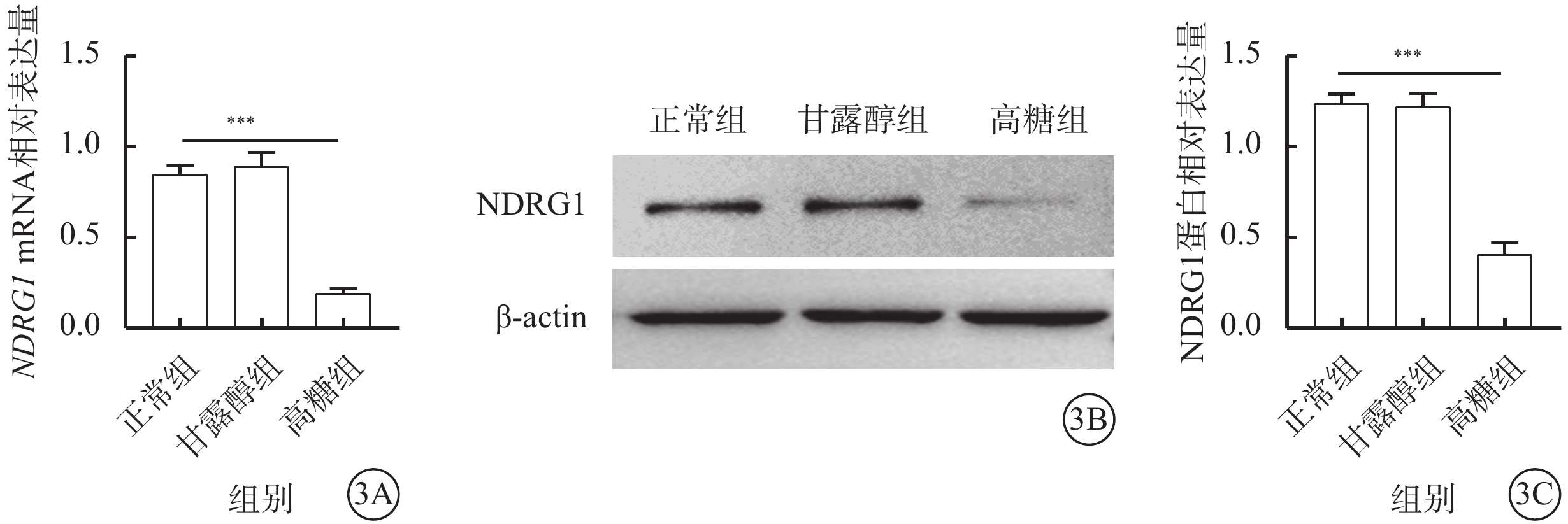 圖3
高糖誘導RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 3A示正常組、甘露醇組、高糖組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;3B示電泳圖;3C示正常組、甘露醇組、高糖組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
圖3
高糖誘導RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 3A示正常組、甘露醇組、高糖組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;3B示電泳圖;3C示正常組、甘露醇組、高糖組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
2.3 下調NDRG1基因促進RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低
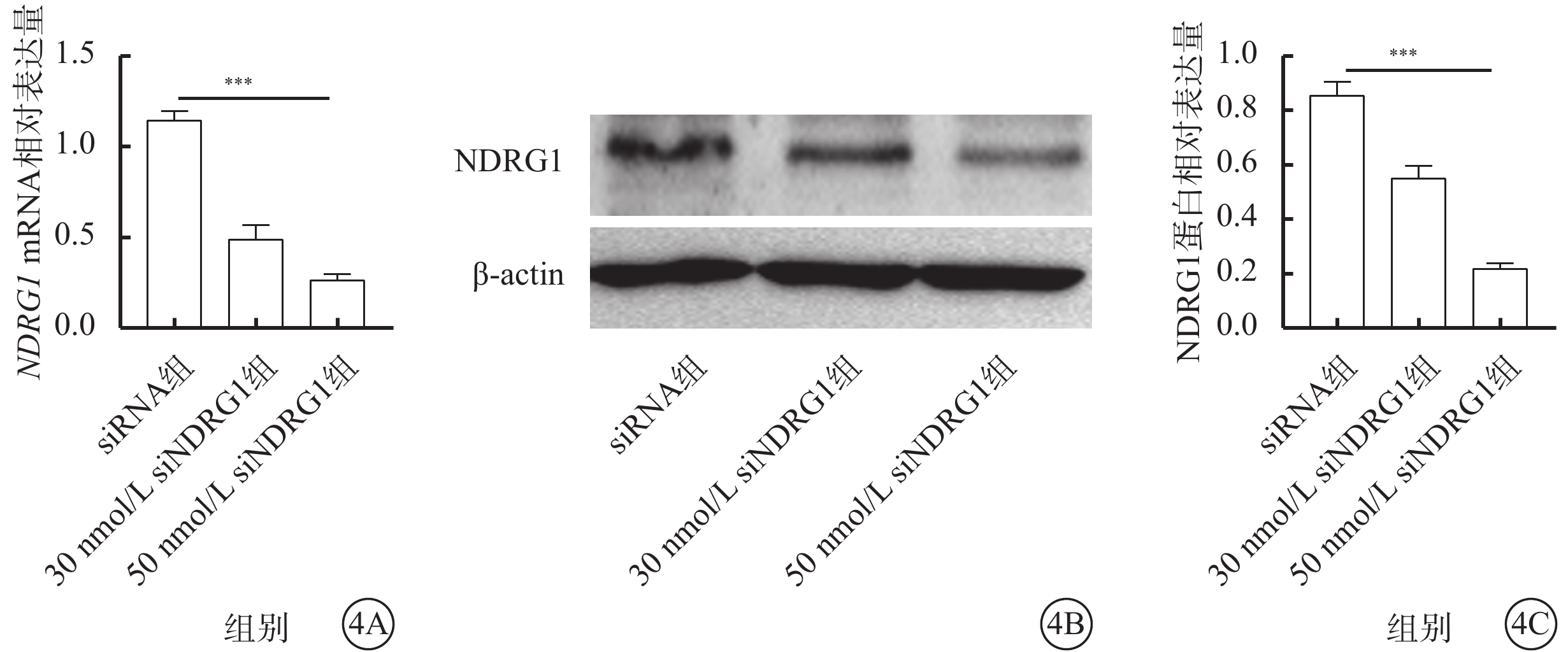
qPCR、Western blot檢測結果顯示,與siRNA組比較,30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1基因的mRNA(t=44.275、40.7577)、蛋白(t=57.167、25.877)相對表達量均下調,差異有統計學意義(P<0.001);三組細胞中NDRG1基因的mRNA和蛋白相對表達量比較,差異有統計學意義(F=73.144、64.462,P<0.001)(圖4A)。
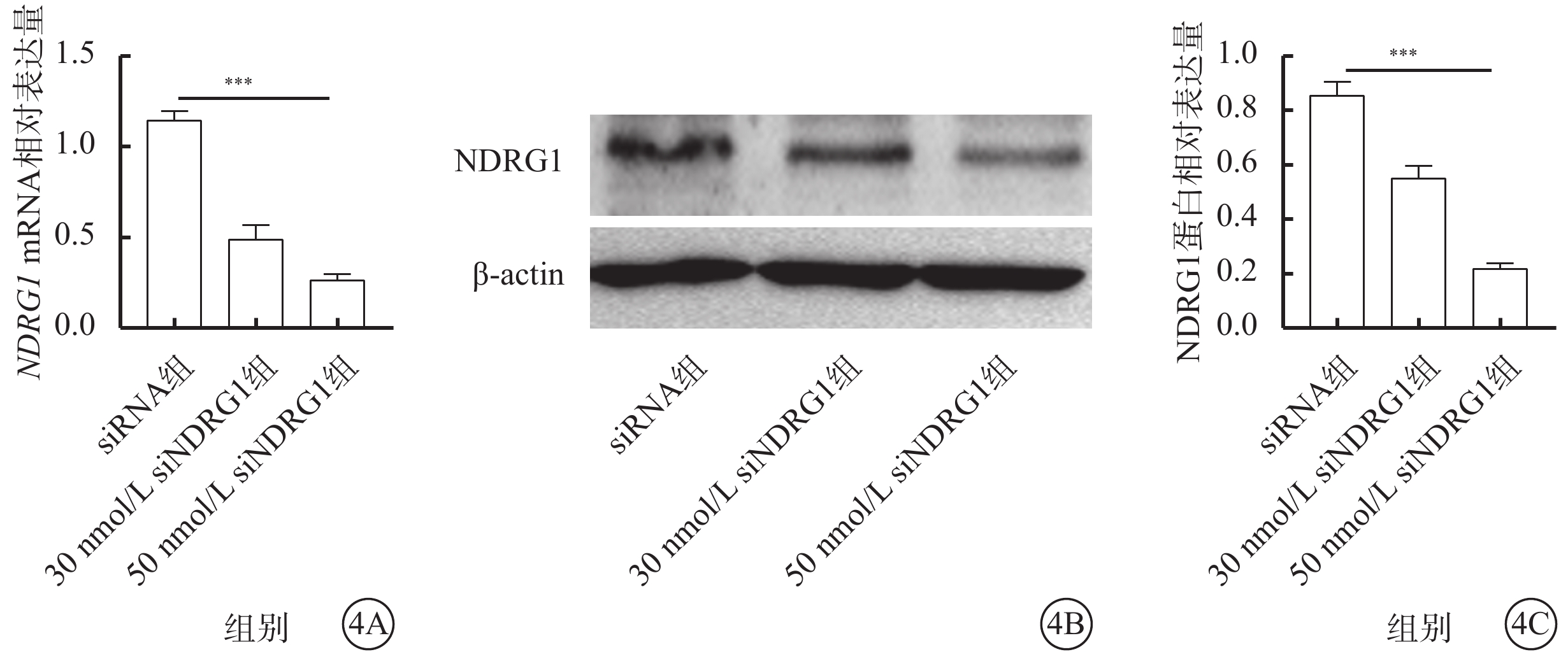 圖4
下調NDRG1基因促進RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 4A示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;4B示電泳圖;4C示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;50 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用50 nmol/L siNDRG1進行誘導
圖4
下調NDRG1基因促進RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 4A示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;4B示電泳圖;4C示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;50 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用50 nmol/L siNDRG1進行誘導
2.4 下調NDRG1基因增加RF/6A細胞活性
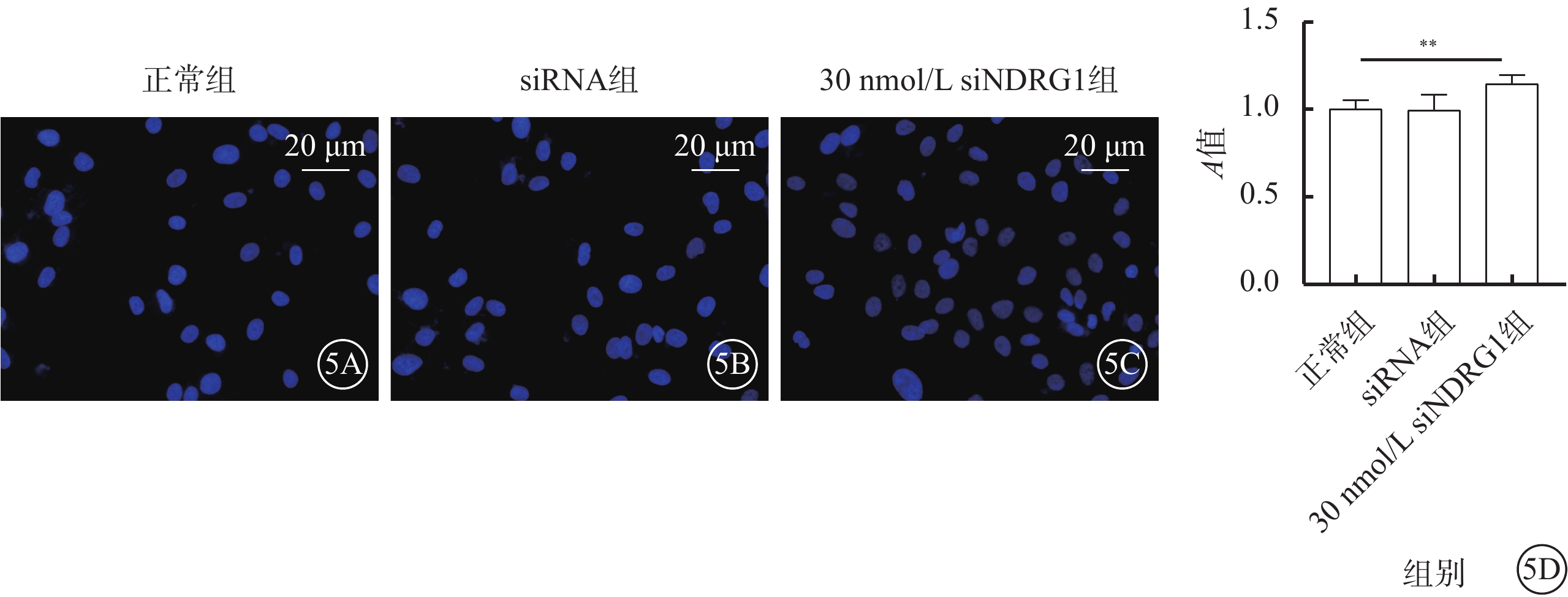
與正常組、siRNA組比較,30nmmol/L siNDRG1組細胞核數量明顯增加(圖5A~5C)。三組細胞活性比較,差異有統計學意義(F=21.162,P<0.01)(圖5D)。
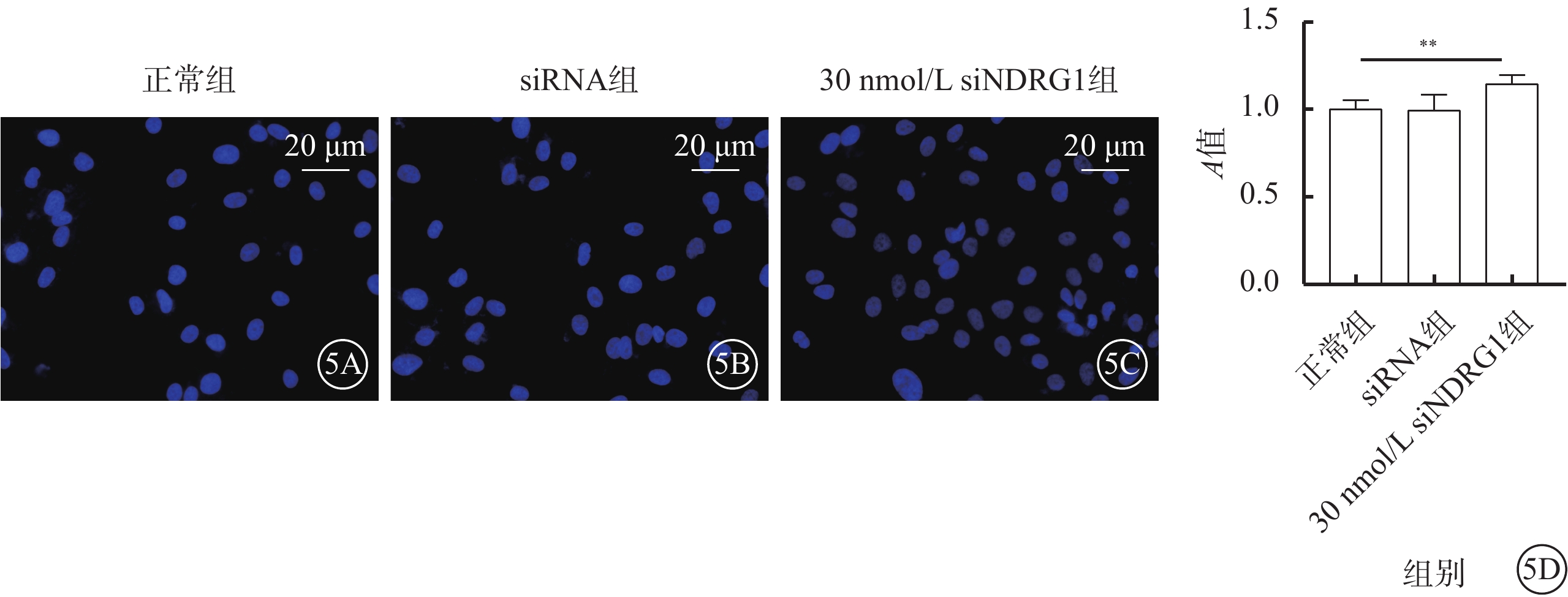 圖5
下調NDRG1基因減少RF/6A細胞凋亡、增加細胞活性(n=3) 5A~5C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞熒光顯微鏡像(DAPI,標尺:20 μm),藍色熒光代表細胞核,用來表征細胞數量,可見30 nmol/L siNDRG1組細胞核數量較正常組、siRNA組明顯增加;5D示三組細胞活性比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;DAPI:4',6-二脒基-2-苯基吲哚
圖5
下調NDRG1基因減少RF/6A細胞凋亡、增加細胞活性(n=3) 5A~5C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞熒光顯微鏡像(DAPI,標尺:20 μm),藍色熒光代表細胞核,用來表征細胞數量,可見30 nmol/L siNDRG1組細胞核數量較正常組、siRNA組明顯增加;5D示三組細胞活性比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;DAPI:4',6-二脒基-2-苯基吲哚
2.5 下調NDRG1基因促進高糖誘導的RF/6A細胞遷移
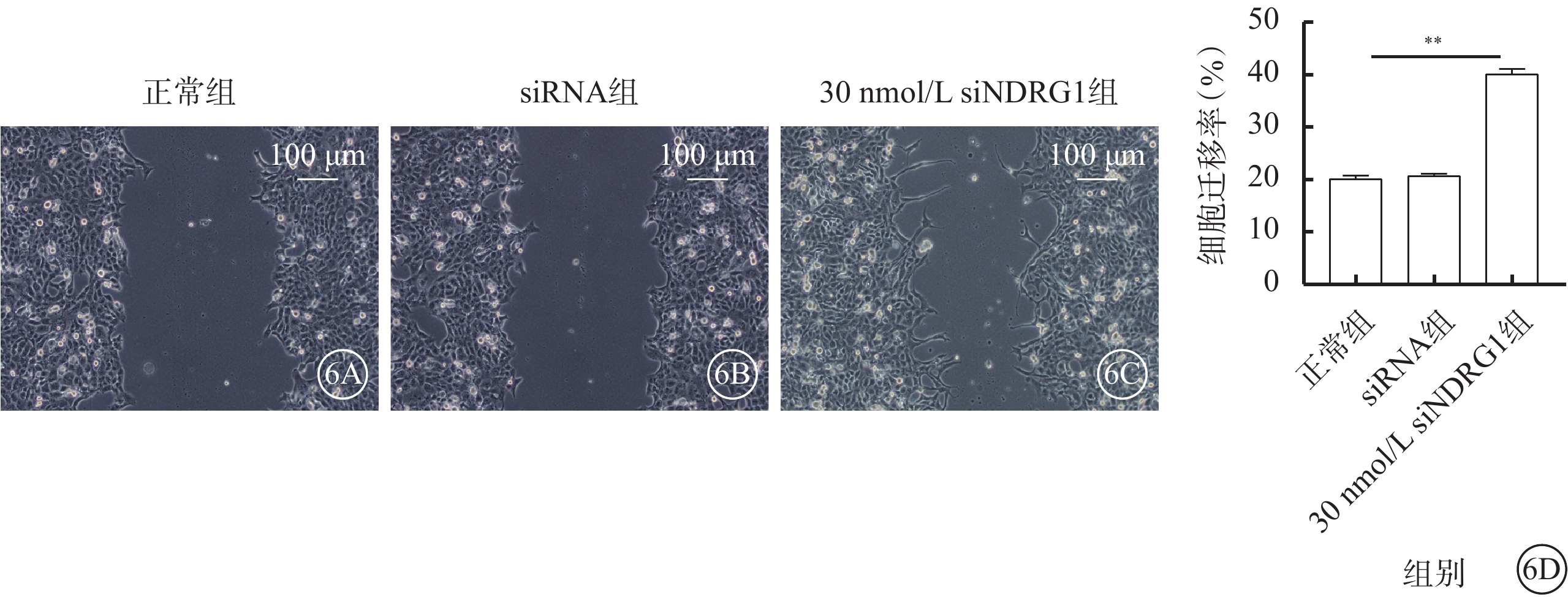
細胞培養12 h后,正常組、siRNA組僅有少量細胞遷移進入裸區,30 nmol/L siNDRG1組可見大量細胞遷移進入裸區(圖6A~6C)。三組細胞遷移率比較,差異有統計學意義(F=46.124,P<0.01)(圖6D)。
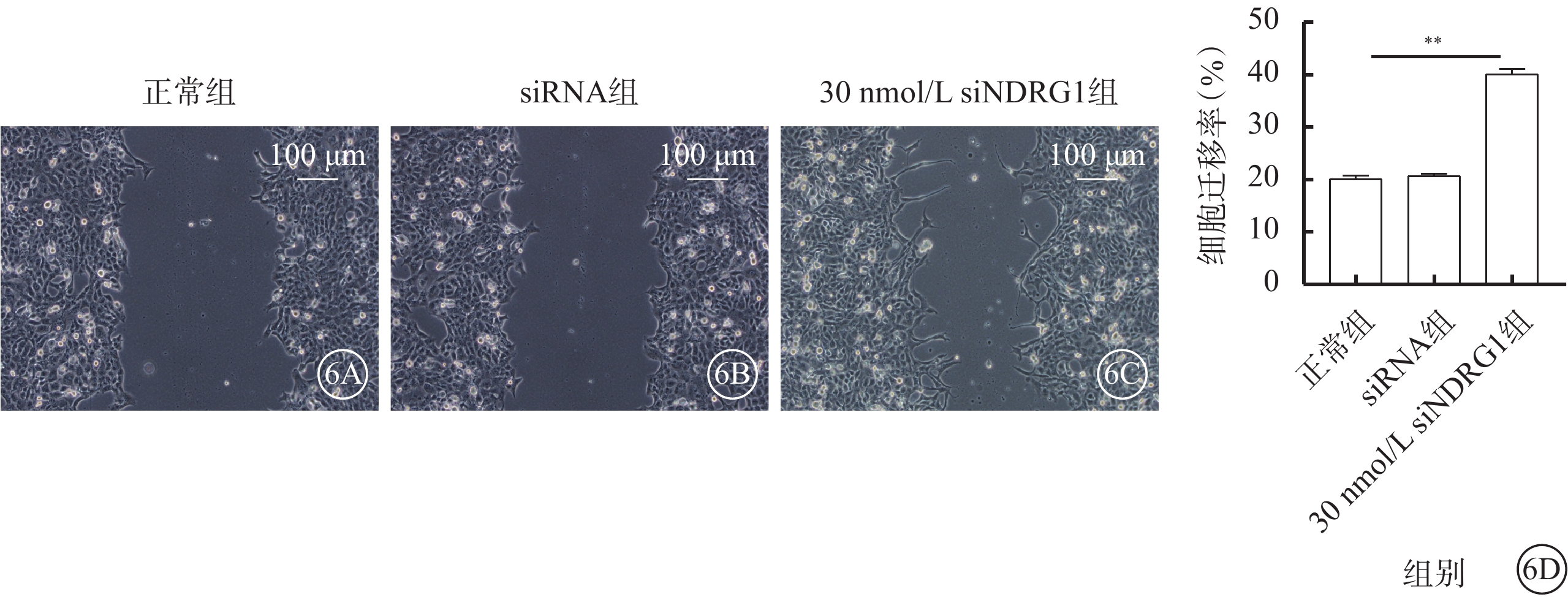 圖6
下調NDRG1基因促進RF/6A細胞遷移(n=3) 6A~6C分別示正常組、siRNA組、30 nmol/LsiNDRG1組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、siRNA組僅有少量細胞遷移進入裸區,30 nmol/L siNDRG1組可見大量細胞遷移進入裸區;6D示三組細胞遷移率比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
圖6
下調NDRG1基因促進RF/6A細胞遷移(n=3) 6A~6C分別示正常組、siRNA組、30 nmol/LsiNDRG1組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、siRNA組僅有少量細胞遷移進入裸區,30 nmol/L siNDRG1組可見大量細胞遷移進入裸區;6D示三組細胞遷移率比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
2.6 下調NDRG1基因促進細胞管腔形成
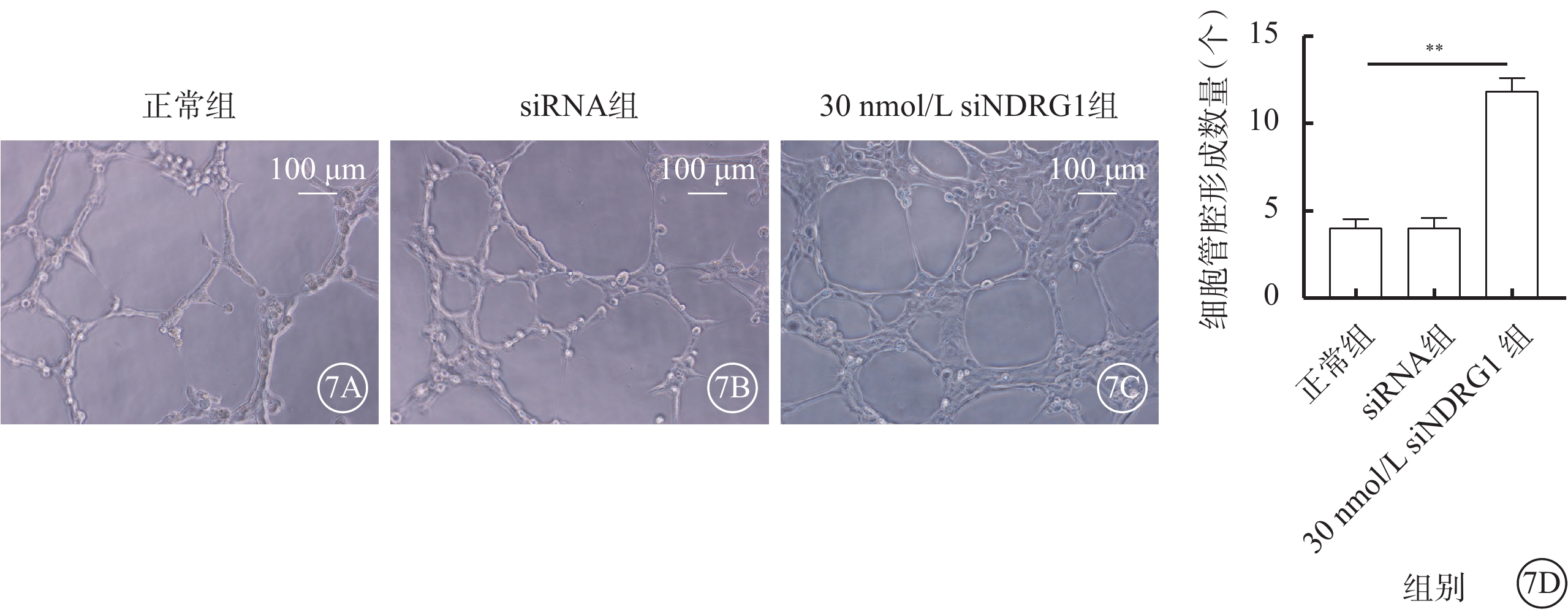
細胞接種6 h后,與正常組、siRNA組比較,30 nmol/L siNDRG1組細胞管腔形成數量明顯增加,差異有統計學意義(t=63.446、42.742,P<0.01)(圖7)。
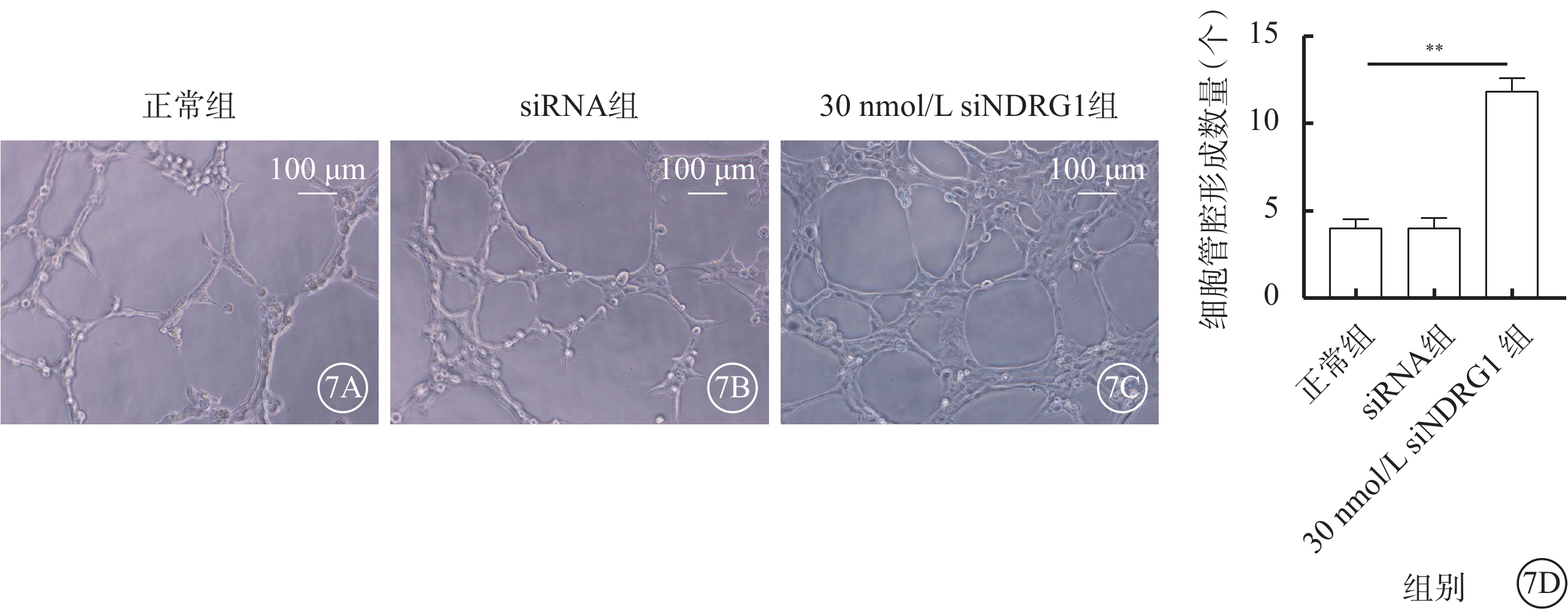 圖7
下調NDRG1基因促進RF/6A細胞管腔形成(n=3) 7A~7C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞顯微鏡像(標尺:100 μm),與正常組、siRNA組比較,30 nmol/L siNDRG1組細胞管腔形成數量顯著增加;7D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
圖7
下調NDRG1基因促進RF/6A細胞管腔形成(n=3) 7A~7C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞顯微鏡像(標尺:100 μm),與正常組、siRNA組比較,30 nmol/L siNDRG1組細胞管腔形成數量顯著增加;7D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
3 討論
研究報道,高血糖誘發的視網膜內皮細胞功能障礙與增生前DR的病理特征有關[9-10],引發新生血管形成[11-12]。體外血管生成的過程,包括內皮細胞的增殖、遷移和管腔形成等過程[11]。然而目前尚無治療DR的有效方法。本研究通過體外建立高糖模型模擬DR患者的眼部病理環境,觀察在高糖環境中RF/6A增殖、遷移及管腔形成的改變,明確抑制視網膜新生血管的新的分子靶點。
NDRG蛋白家族由4個成員NDRG1~4組成[13]。NDRG1蛋白參與胚胎發生和發育、細胞生長和分化、遷移、炎癥、氧化應激反應和免疫等生物學過程[14]。NDRG1蛋白是調節內皮炎癥,血栓形成反應的關鍵介質,參與動脈粥樣硬化血栓形成等炎癥性血管疾病的發生[15]。研究表明,NDRG1蛋白可降低胰腺癌細胞中CXC趨化因子的表達水平,在抑制胰腺癌細胞炎癥和血管生成中起重要作用[16]。在NDRG蛋白家族中,NDRG1蛋白受到缺氧引發的抑制作用最大,上調NDRG1基因表達可抑制缺氧誘導的癌細胞的氧化應激反應,并降低癌細胞的遷移率[17]。NDRG1蛋白作為腫瘤抑制因子或腫瘤啟動子的作用取決于腫瘤類型。NDRG1蛋白在胰腺癌細胞中的過表達抑制腫瘤生長和血管生成,而NDRG1蛋白在胃癌細胞中的過表達促進腫瘤生長和血管生成。研究發現,NDRG1蛋白可調節巨噬細胞系分化,促進骨重塑和血管生成的穩態平衡[13]。
NDRG1蛋白也可抑制基質金屬蛋白酶-9(MMP-9)和血管內皮生長因子(VEGF)蛋白的表達[18]。其中VEGF是參與新生血管形成的重要因子,而MMP-9可以裂解許多細胞外基質蛋白來調節細胞外基質重塑,參與上皮-間充質轉化(EMT)引發纖維化的發生[19]。NDRG1蛋白通過與細胞緊密連接的組成成分相互作用并促進其在結直腸癌中的泛素化來抑制EMT生物行為[20]。NDRG1蛋白在哺乳動物視網膜中的作用尚不明確,但研究發現,NDRG1蛋白缺乏阻礙了斑馬魚的早期視網膜血管發育,而在成年后,NDRG1蛋白的表達水平顯著降低[21],這提示NDRG1蛋白可能在視網膜的穩定性中發揮重要作用,因此本研究聚焦NDRG1對RF/6A的管腔形成能力的影響,初步發現下調NDRG1基因后可抑制RF/6A的細胞管腔形成能力,但在不同年齡階段的視網膜中NDRG1基因的作用尚需進一步的研究。
目前已知在腫瘤中,NDRG1基因在炎癥、氧化應激、新生血管與纖維化方面均發揮抑制作用,這為明確NDRG1基因在DR中的全面作用提供了重要的思路。DR患者由于持續性高血糖,可引發炎癥、氧化應激的發生,進而刺激眼部新生血管生成,后期可發展為纖維化,造成不可逆的視力損傷。本研究初步對NDRG1基因在新生血管方面的作用進行了詳細的研究,發現NDRG1基因在高糖誘導的RF/6A細胞中低表達,下調RF/6A細胞中NDRG1基因,可誘導其增殖、遷移和管腔形成,提示NDRG1基因可能在抑制視網膜新生血管方面發揮重要作用。
本研究存在局限性是僅驗證了下調NDRG1基因對RF/6A細胞的影響,未觀察上調NDRG1基因后的具體作用。未來需進一步探究上調NDRG1基因后對視網膜血管內皮細胞的保護作用以及在炎癥、氧化應激與纖維化方面的重要性,以明確治療DR的新靶點。
糖尿病視網膜病變(DR)是全球工齡人群視力喪失的主要原因之一[1]。雖然激光光凝治療、抗血管內皮生長因子(VEGF)藥物和糖皮質激素在治療DR中取得了顯著的進展,然而部分患者的治療效果并不理想[2-3]。因此明確新的抗新生血管藥物的靶點十分必要。N-myc下游調節基因1(NDRG1)蛋白質與許多生理事件相關,如細胞分化、應激反應、發育、凋亡和脂質合成[4-6]。NDRG1基因在多種癌癥類型中具有抗腫瘤和抗轉移功能,其基因可以抑制腫瘤生長、腫瘤細胞遷移并調節血管生成[4, 7]。在新生血管實體瘤中,NDRG1基因可通過調節癌細胞和內皮細胞的行為來抑制腫瘤的生長[8]。這提示,在腫瘤中NDRG1基因能夠抑制腫瘤細胞增殖遷移及新生血管形成。目前NDRG1基因對視網膜血管內皮細胞的作用尚不明確。本研究旨在建立體外視網膜血管內皮細胞高糖模型模擬DR患者的病理環境,初步探索NDRG1基因對視網膜血管內皮細胞增殖遷移和管腔形成的影響,以期為治療DR提供新的診斷和治療的思路。現將結果報道如下。
1 材料和方法
1.1 材料
恒河猴視網膜血管內皮細胞(RF/6A)由本實驗室自行保存。Dulbecco改良eagle培養基(DMEM,L540KJ,上海源培生物科技股份有限公司);4',6-二脒基-2-苯基吲哚(DAPI,C0065)、甘露醇(SM8120)、葡萄糖(G8150)(北京索萊寶科技有限公司);NDRG1基因(DF6865)、辣根過氧化物酶(HRP,S0001)、β-肌動蛋白(actin)(AF7018)一抗和二抗(美國Affinity公司);Ttranswell共培養板(美國Corning公司);細胞計數試劑盒8(CCK-8,北京金克隆生物技術有限公司);MatrigengeL Matrix標準型含酚紅基質膠(上海諾娃醫藥科技有限公司);SYBR Premix Ex Taq試劑盒(日本Takara公司);iQ5實時熒光定量聚合酶鏈反應(qPCR)儀(美國Applied Biosystems公司)。
1.2 方法
細胞培養。RF/6A細胞株置于含10%胎牛血清和1%雙抗的DMEM培養基中常規培養。取對數生長期細胞用于實驗。
RF/6A細胞分為正常組、甘露醇組、高糖組、無靶基因的小干擾RNA(siRNA)陰性對照組(siRNA組)、30 nmol/L siRNA下調NDRG1基因組(siNDRG1組)、50 nmol/L siNDRG1組。正常組細胞常規培養;根據預實驗結果,甘露醇組細胞加入25 mmol/L甘露醇,高糖組細胞加入25 mmol/L葡萄糖培養;siRNA組細胞加入25 mmol/L葡萄糖培養,再加入空白siRNA誘導;30、50 nmol/L siNDRG1組細胞加入25 mmol/L葡萄糖培養,再分別用30、50 nmol/L siNDRG1進行誘導。所有細胞均孵育24 h進行后續實驗。
免疫熒光染色計數正常組、siRNA組、siNDRG1組細胞核數量。各組細胞以2×104個/孔的密度接種于8孔板中,每孔滴加100 μl的DAPI避光染色5 min,磷酸鹽緩沖液洗3次,5 min/次。熒光顯微鏡觀察并計數。細胞核呈藍色熒光。實驗重復3次。
CCK-8檢測正常組、甘露醇組、高糖組、siRNA組、siNDRG1組細胞活性。細胞培養24 h后,CCK-8檢測各組細胞活性。各組細胞以2×104個/ml密度接種于8孔板中,每孔滴加100 μl的CCK-8試劑孵育2 h,采用酶鏈免疫檢測儀測量波長450 nm處的吸光度[A,舊稱光密度(OD)]值。每組設3個復孔,實驗重復3次。
細胞劃痕實驗檢測正常組、甘露醇組、高糖組、siRNA組、siNDRG1組細胞遷移能力。各組細胞以2×105個/孔的密度接種于12孔板中,待細胞鋪滿后,應用10 μl微量加樣槍頭于孔板中央作“十”字形劃痕,并將此時計作0 h,繼續培養12 h后于相同劃痕位置再次拍照,觀察各孔細胞向裸區遷移情況并記錄原始裸區(S0)和24 h裸區(S24)面積。遷移率=(S0-S24)/S0×100%。實驗重復3次。
Matrigel實驗檢測正常組、甘露醇組、高糖組、siRNA組、siNDRG1組細胞管腔形成能力。4 ℃ MatrigengeL Matrix標準型含酚紅基質膠40 μl緩慢加入96孔板中,于37℃孵育箱中放置30 min。各組細胞以1.5×104個/孔的密度接種于96孔板中孵育,6 h后觀察管腔形成情況。計數相同視野面積下管腔形成數量。實驗重復3次。
qPCR檢測各組細胞中NDRG1 mRNA相對表達量。RNA提取試劑盒提取各組細胞總RNA,逆轉錄成cDNA。應用Primer 5.0軟件設計引物序列。NDRG1 正向引物:GGGCTGAAAAGCATTATTGG,反向引物:CTCCACCATCTCAGGGTTGT;β-actin正向引物:ATTGCCGACAGGATGCAGAA,反向引物:GCTGATCCACATCTGCTGGAA。置于qPCR儀中進行擴增并輸出循環閾值(Cq值),以β-actin為內參照,依照公式2-ΔΔCq計算mRNA的相對表達量。實驗重復3次。
蛋白質免疫印跡法(Western blot)檢測各組細胞中NDRG1蛋白相對表達量。參照文獻[9]的方法,收集各組細胞,提取蛋白定量。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳中上樣電泳,轉至聚偏氟乙烯膜,5%脫脂奶粉室溫封閉1 h,加入NDRG1、β-actin一抗,4℃孵育過夜,洗膜緩沖液(TBST)洗膜,加入HRP羊抗兔二抗,室溫孵育2 h,TBST洗膜,加入化學發光底物進行曝光并拍照,凝膠成像系統掃描分析蛋白條帶。Image J軟件分析蛋白條帶的灰度值,計算蛋白相對表達水平。實驗重復3次。
1.3 統計學分析
采用SPSS軟件進行統計學分析。定量數據以均數±標準差(x±s)表示。經Kolmogorov-Smirnov檢驗,數據符合正態分布且方差齊性,多組間比較采用單因素方差分析;兩組間比較采用t檢驗。采用Graphpad Prism 9.0對所獲得數據進行圖表整理。P<0.05為差異有統計學意義。
2 結果
2.1 高糖促進RF/6A細胞增殖、遷移,提高管腔形成能力
細胞培養12 h后,正常組、甘露醇組僅有少量細胞遷移進入裸區,高糖組可見大量細胞遷移進入裸區(圖1A~1C)。與正常組比較,甘露醇組細胞遷移率上升,但差異無統計學意義(t=47.154,P>0.05);與正常組、甘露醇組比較,高糖組細胞遷移率上升(t=24.745、33.638),差異均有統計學意義(P<0.01)(圖1D)。與正常組、甘露醇組比較,高糖組細胞增殖顯著增多(t=36.659、57.645),差異有統計學意義,(P<0.01)(圖1D,1E)。
 圖1
高糖促進RF/6A細胞遷移能力(n=3) 1A~1C分別示正常組、甘露醇組、高糖組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、甘露醇組僅有少量細胞遷移進入裸區,高糖組大量細胞遷移進入裸區;1D、1E分別示三組細胞遷移率、增殖率比較,**P<0.01 A值:吸光度值;RF/6A細胞:恒河猴視網膜血管內皮細胞:正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
圖1
高糖促進RF/6A細胞遷移能力(n=3) 1A~1C分別示正常組、甘露醇組、高糖組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、甘露醇組僅有少量細胞遷移進入裸區,高糖組大量細胞遷移進入裸區;1D、1E分別示三組細胞遷移率、增殖率比較,**P<0.01 A值:吸光度值;RF/6A細胞:恒河猴視網膜血管內皮細胞:正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
細胞接種6 h后,正常組、甘露醇組細胞管腔形成數量比較,差異無統計學意義(t=49.132,P>0.05);與正常組、甘露醇組比較,高糖組細胞管腔形成數量顯著增加,差異有統計學意義(t=41.276、22.867,P<0.01)(圖2)。
 圖2
高糖促進RF/6A細胞管腔形成能力(n=3) 2A~2C分別示正常組、甘露醇組、高糖組細胞顯微鏡像(標尺:100 μm),與正常組、甘露醇組比較,高糖組細胞管腔形成數量顯著增加;2D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
圖2
高糖促進RF/6A細胞管腔形成能力(n=3) 2A~2C分別示正常組、甘露醇組、高糖組細胞顯微鏡像(標尺:100 μm),與正常組、甘露醇組比較,高糖組細胞管腔形成數量顯著增加;2D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
2.2 高糖誘導RF/6A細胞中NDRG1基因的mRNA和蛋白表達降低
qPCR、Western blot檢測結果顯示,正常組、甘露醇組細胞中NDRG1基因的mRNA和蛋白相對表達量比較,差異無統計學意義(t=44.756、14.677,P>0.05);與正常組、甘露醇組比較,高糖組細胞中NDRG1基因的mRNA(t=36.738、32.976)、蛋白相對表達量顯著下降(t=46.145、21.541),差異有統計學意義(P<0.001)(圖3A)。
 圖3
高糖誘導RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 3A示正常組、甘露醇組、高糖組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;3B示電泳圖;3C示正常組、甘露醇組、高糖組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
圖3
高糖誘導RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 3A示正常組、甘露醇組、高糖組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;3B示電泳圖;3C示正常組、甘露醇組、高糖組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;正常組:細胞常規培養;甘露醇組:加入25 mmol/L甘露醇;高糖組:加入25 mmol/L葡萄糖
2.3 下調NDRG1基因促進RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低
qPCR、Western blot檢測結果顯示,與siRNA組比較,30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1基因的mRNA(t=44.275、40.7577)、蛋白(t=57.167、25.877)相對表達量均下調,差異有統計學意義(P<0.001);三組細胞中NDRG1基因的mRNA和蛋白相對表達量比較,差異有統計學意義(F=73.144、64.462,P<0.001)(圖4A)。
 圖4
下調NDRG1基因促進RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 4A示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;4B示電泳圖;4C示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;50 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用50 nmol/L siNDRG1進行誘導
圖4
下調NDRG1基因促進RF/6A細胞中NDRG1基因的mRNA和蛋白表達水平降低(n=3) 4A示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1 mRNA相對表達量比較,***P<0.001;4B示電泳圖;4C示siRNA組、30 nmol/L siNDRG1組、50 nmol/L siNDRG1組細胞中NDRG1蛋白相對表達量比較,***P<0.001 RF/6A細胞:恒河猴視網膜血管內皮細胞;actin:肌動蛋白;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;50 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用50 nmol/L siNDRG1進行誘導
2.4 下調NDRG1基因增加RF/6A細胞活性
與正常組、siRNA組比較,30nmmol/L siNDRG1組細胞核數量明顯增加(圖5A~5C)。三組細胞活性比較,差異有統計學意義(F=21.162,P<0.01)(圖5D)。
 圖5
下調NDRG1基因減少RF/6A細胞凋亡、增加細胞活性(n=3) 5A~5C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞熒光顯微鏡像(DAPI,標尺:20 μm),藍色熒光代表細胞核,用來表征細胞數量,可見30 nmol/L siNDRG1組細胞核數量較正常組、siRNA組明顯增加;5D示三組細胞活性比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;DAPI:4',6-二脒基-2-苯基吲哚
圖5
下調NDRG1基因減少RF/6A細胞凋亡、增加細胞活性(n=3) 5A~5C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞熒光顯微鏡像(DAPI,標尺:20 μm),藍色熒光代表細胞核,用來表征細胞數量,可見30 nmol/L siNDRG1組細胞核數量較正常組、siRNA組明顯增加;5D示三組細胞活性比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導;DAPI:4',6-二脒基-2-苯基吲哚
2.5 下調NDRG1基因促進高糖誘導的RF/6A細胞遷移
細胞培養12 h后,正常組、siRNA組僅有少量細胞遷移進入裸區,30 nmol/L siNDRG1組可見大量細胞遷移進入裸區(圖6A~6C)。三組細胞遷移率比較,差異有統計學意義(F=46.124,P<0.01)(圖6D)。
 圖6
下調NDRG1基因促進RF/6A細胞遷移(n=3) 6A~6C分別示正常組、siRNA組、30 nmol/LsiNDRG1組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、siRNA組僅有少量細胞遷移進入裸區,30 nmol/L siNDRG1組可見大量細胞遷移進入裸區;6D示三組細胞遷移率比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
圖6
下調NDRG1基因促進RF/6A細胞遷移(n=3) 6A~6C分別示正常組、siRNA組、30 nmol/LsiNDRG1組細胞培養12 h倒置相差顯微鏡像(標尺:100 μm),正常組、siRNA組僅有少量細胞遷移進入裸區,30 nmol/L siNDRG1組可見大量細胞遷移進入裸區;6D示三組細胞遷移率比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
2.6 下調NDRG1基因促進細胞管腔形成
細胞接種6 h后,與正常組、siRNA組比較,30 nmol/L siNDRG1組細胞管腔形成數量明顯增加,差異有統計學意義(t=63.446、42.742,P<0.01)(圖7)。
 圖7
下調NDRG1基因促進RF/6A細胞管腔形成(n=3) 7A~7C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞顯微鏡像(標尺:100 μm),與正常組、siRNA組比較,30 nmol/L siNDRG1組細胞管腔形成數量顯著增加;7D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
圖7
下調NDRG1基因促進RF/6A細胞管腔形成(n=3) 7A~7C分別示正常組、siRNA組、30 nmol/L siNDRG1組細胞顯微鏡像(標尺:100 μm),與正常組、siRNA組比較,30 nmol/L siNDRG1組細胞管腔形成數量顯著增加;7D示三組細胞管腔形成數量比較,**P<0.01 RF/6A細胞:恒河猴視網膜血管內皮細胞;正常組:細胞常規培養;siRNA組:加入25 mmol/L葡萄糖,再加入空白siRNA誘導;30 nmol/L siNDRG1組:加入25 mmol/L葡萄糖,用30 nmol/L siNDRG1進行誘導
3 討論
研究報道,高血糖誘發的視網膜內皮細胞功能障礙與增生前DR的病理特征有關[9-10],引發新生血管形成[11-12]。體外血管生成的過程,包括內皮細胞的增殖、遷移和管腔形成等過程[11]。然而目前尚無治療DR的有效方法。本研究通過體外建立高糖模型模擬DR患者的眼部病理環境,觀察在高糖環境中RF/6A增殖、遷移及管腔形成的改變,明確抑制視網膜新生血管的新的分子靶點。
NDRG蛋白家族由4個成員NDRG1~4組成[13]。NDRG1蛋白參與胚胎發生和發育、細胞生長和分化、遷移、炎癥、氧化應激反應和免疫等生物學過程[14]。NDRG1蛋白是調節內皮炎癥,血栓形成反應的關鍵介質,參與動脈粥樣硬化血栓形成等炎癥性血管疾病的發生[15]。研究表明,NDRG1蛋白可降低胰腺癌細胞中CXC趨化因子的表達水平,在抑制胰腺癌細胞炎癥和血管生成中起重要作用[16]。在NDRG蛋白家族中,NDRG1蛋白受到缺氧引發的抑制作用最大,上調NDRG1基因表達可抑制缺氧誘導的癌細胞的氧化應激反應,并降低癌細胞的遷移率[17]。NDRG1蛋白作為腫瘤抑制因子或腫瘤啟動子的作用取決于腫瘤類型。NDRG1蛋白在胰腺癌細胞中的過表達抑制腫瘤生長和血管生成,而NDRG1蛋白在胃癌細胞中的過表達促進腫瘤生長和血管生成。研究發現,NDRG1蛋白可調節巨噬細胞系分化,促進骨重塑和血管生成的穩態平衡[13]。
NDRG1蛋白也可抑制基質金屬蛋白酶-9(MMP-9)和血管內皮生長因子(VEGF)蛋白的表達[18]。其中VEGF是參與新生血管形成的重要因子,而MMP-9可以裂解許多細胞外基質蛋白來調節細胞外基質重塑,參與上皮-間充質轉化(EMT)引發纖維化的發生[19]。NDRG1蛋白通過與細胞緊密連接的組成成分相互作用并促進其在結直腸癌中的泛素化來抑制EMT生物行為[20]。NDRG1蛋白在哺乳動物視網膜中的作用尚不明確,但研究發現,NDRG1蛋白缺乏阻礙了斑馬魚的早期視網膜血管發育,而在成年后,NDRG1蛋白的表達水平顯著降低[21],這提示NDRG1蛋白可能在視網膜的穩定性中發揮重要作用,因此本研究聚焦NDRG1對RF/6A的管腔形成能力的影響,初步發現下調NDRG1基因后可抑制RF/6A的細胞管腔形成能力,但在不同年齡階段的視網膜中NDRG1基因的作用尚需進一步的研究。
目前已知在腫瘤中,NDRG1基因在炎癥、氧化應激、新生血管與纖維化方面均發揮抑制作用,這為明確NDRG1基因在DR中的全面作用提供了重要的思路。DR患者由于持續性高血糖,可引發炎癥、氧化應激的發生,進而刺激眼部新生血管生成,后期可發展為纖維化,造成不可逆的視力損傷。本研究初步對NDRG1基因在新生血管方面的作用進行了詳細的研究,發現NDRG1基因在高糖誘導的RF/6A細胞中低表達,下調RF/6A細胞中NDRG1基因,可誘導其增殖、遷移和管腔形成,提示NDRG1基因可能在抑制視網膜新生血管方面發揮重要作用。
本研究存在局限性是僅驗證了下調NDRG1基因對RF/6A細胞的影響,未觀察上調NDRG1基因后的具體作用。未來需進一步探究上調NDRG1基因后對視網膜血管內皮細胞的保護作用以及在炎癥、氧化應激與纖維化方面的重要性,以明確治療DR的新靶點。