檢驗。
檢驗。 t=2.489、3.262,P<0.05)。治療前后患眼S3(t=2.871)、I1(t=2.325)、T3(t=3.446)處CRT比較,差異有統計學意義(P<0.05);S1(t=1.879)、I3(t=1.915)、N1(t=2.001)、N3(t=1.987)、T1(t=2.180)、M(t=?0.490)處CRT比較,差異均無統計學意義(P>0.05)。
t=2.489、3.262,P<0.05)。治療前后患眼S3(t=2.871)、I1(t=2.325)、T3(t=3.446)處CRT比較,差異有統計學意義(P<0.05);S1(t=1.879)、I3(t=1.915)、N1(t=2.001)、N3(t=1.987)、T1(t=2.180)、M(t=?0.490)處CRT比較,差異均無統計學意義(P>0.05)。
引用本文: 羅天一, 姚裕鋒, 宋其緣, 竇曉燕. 視網膜中央動脈阻塞患眼超選擇性眼動脈溶栓治療前后黃斑區視網膜厚度變化. 中華眼底病雜志, 2024, 40(4): 268-272. doi: 10.3760/cma.j.cn511434-20231225-00508 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
視網膜中央動脈阻塞(CRAO)是一種急性眼部缺血性卒中,可導致嚴重且不可逆視力喪失,并且也是進一步發生心腦血管事件的先兆[1-3]。目前關于CRAO急性期最佳治療方案尚未形成共識[4],但超選擇性眼動脈溶栓(IAT)治療CRAO理論上具有對血栓直接進行溶栓的優勢,同時也可降低顱內和全身出血的風險[5]。急性視網膜血流中斷可導致視網膜神經纖維層、視網膜神經節細胞(RGC)層、內核層不同程度缺血缺氧,發生細胞內水腫,視網膜神經上皮層厚度增加[6-8]。光相干斷層掃描(OCT)因其快速、便捷、非侵入、測量精準及重復性好等特點已被廣泛應用于眼底疾病的診斷、治療及預后評估,且可為臨床提供視網膜高分辨率組織學圖像。我們應用OCT對一組CRAO患者的多點位黃斑中心視網膜厚度(CRT)進行了檢測,對比觀察IAT治療前后CRT的變化情況。現將結果報道如下。
1 對象和方法
回顧性臨床研究。本研究經深圳市第二人民醫院倫理委員會審核(批準號:2023-087-02-YJ);遵循《赫爾辛基宣言》原則;所有患者均獲知情并簽署書面知情同意書。
2022年8月至2023年9月于深圳市第二人民醫院眼科檢查確診并行IAT治療的CRAO患者12例12只眼納入本研究。其中,男性8例8只眼,女性4例4只眼;年齡(47.00±15.06)(17~73)歲;均為單眼發病,右眼、左眼分別為8、4只眼。發病至IAT治療時間為(30.00±30.42)(5~120) h。治療前均給予患眼眼球按摩、局部應用降眼壓藥物、低流量吸氧、舌下含服硝酸甘油片等。患者均符合CRAO診斷標準[2]。排除標準:年齡>85歲;有溶栓禁忌證,包括顱內出血、動靜脈畸形、動脈瘤病史、嚴重出血傾向,1個月以內腦卒中、顱腦手術或外傷史;腦血管造影檢查發現CRAO患眼同側頸動脈、頸內動脈嚴重狹窄或閉塞者;既往有其他黃斑區視網膜病變者;屈光間質混濁致無法測量者;嚴重心、肺、腎、肝臟疾病者;對造影劑過敏者。
患眼均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、瞳孔直接和間接對光反射、相對性傳入性瞳孔障礙、掃描激光檢眼鏡、OCT以及全腦血管造影檢查。12只眼中,行熒光素眼底血管造影(FFA)6只眼;因夜間就診或外院轉診未行FFA檢查6只眼。采用標準對數視力表行BCVA檢查,統計時換算為最小分辨角對數(logMAR)視力,數指/10 cm、數指/6 cm、手動、光感、無光感分別記錄為2.7、2.9、3、4、5[9-10]。
采用德國Zeiss公司Cirrus HD-OCT儀對患眼黃斑區進行掃描。選擇Macular Cube 512×128模式,掃描范圍3 mm×3 mm。應用Image J軟件(version 2.0.0)測量黃斑中心凹(M,直徑0.3~0.4 mm)以及分別距中心凹小凹(中心凹中點)1、3 mm處上方(S1、S3)、下方(I1、I3)、鼻側(N1、N3)、顳側(T1、T3)CRT。CRT定義為視網膜內界膜至視網膜色素上皮層強反射帶內側界面之間的垂直距離。測量由一名具有豐富經驗的醫師操作完成。
IAT治療由深圳市第二人民醫院神經外科同一介入手術團隊完成。患者取仰臥位,Seldinger技術穿刺右股動脈,插入6F動脈鞘,經動脈鞘送入5F造影導管至升主動脈,雙側頸總動脈及雙側頸內動脈,注入對比劑行動脈造影。造影見頸內動脈清晰后,超選眼動脈開口,明確是否有遠端血管明顯減少,符合眼動脈栓塞表現后以微導管在微導絲引導下至眼動脈遠端,注入尿激酶10萬U以及罌粟堿30 mg+生理鹽水10 m1,復行造影明確是否眼動脈分支較前明顯增多。治療后右下肢制動6 h,臥床12 h。若患者CRAO同側頸動脈或頸內動脈完全閉塞,導管無法上行,則停止進一步溶栓操作。
IAT治療后24 h,采用與治療前相同設備和方法行相關檢查。對比觀察治療前后患眼logMAR BCVA以及S1、S3、I1、I3、N1、N3、T1、T3、M處CRT變化。行FFA檢查的6只眼,對比觀察動脈顯影時間的變化。動脈顯影時間定義為FFA檢查過程中開始注入熒光素鈉至視網膜動脈開始顯影時間。
采用SPSS25.0軟件行統計學分析。符合正態分布的計量資料以均數±標準差(x±s)表示。治療前后logMAR BCVA、FFA檢查動脈顯影時間以及S1、S3、I1、I3、N1、N3、T1、T3、M處CRT比較采用配對樣本 檢驗。
檢驗。 <0.05為差異有統計學意義。
<0.05為差異有統計學意義。
2 結果
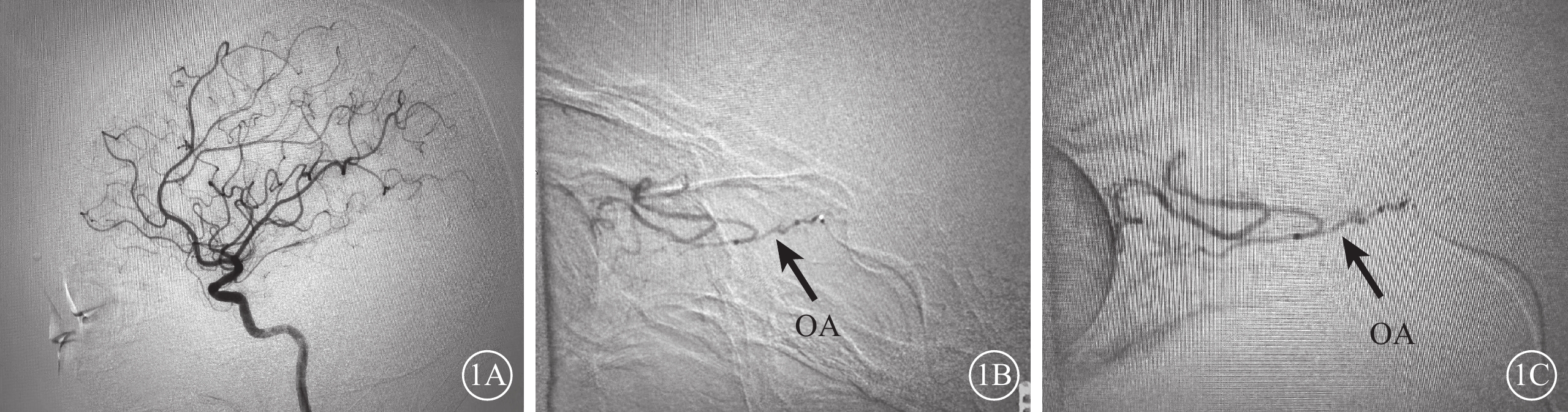
患眼IAT治療均順利完成,治療中無并發癥發生。治療后全腦血管造影檢查結果顯示,眼動脈顯影較治療前增粗、分支增多;脈絡膜環顯影較治療前明顯(圖1)。
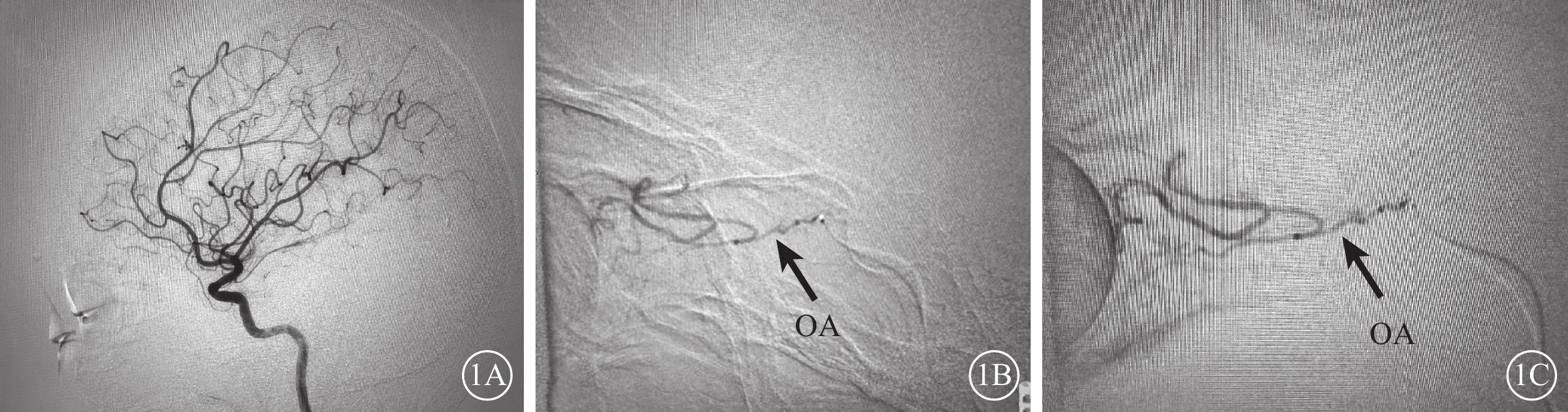 圖1
CRAO患者IAT治療前后全腦血管造影像
圖1
CRAO患者IAT治療前后全腦血管造影像
1A示IAT治療前,同側OA未見顯影;1B示IAT治療中,同側OA及其分支逐漸顯影;1C示IAT治療后,同側OA及其分支血管網顯影明顯增粗增多 CRAO:視網膜中央動脈阻塞;IAT:超選擇性眼動脈溶栓;OA:眼動脈
治療前患眼logMAR BCVA 3.48±1.42(0.2~5.0)。其中,無光感者3只眼;顳側光感、手動、數指、0.01者分別為4、1、2、1只眼;0.6者1只眼(表1)。行FFA檢查的6只眼,動脈顯影時間為(27.50±5.47)(21~35)s。
IAT治療后24 h,患眼logMAR BCVA 2.35±1.59(0.0~5.0)。其中,無光感者1只眼;顳側光感、手動、數指、0.02、0.05、0.10、0.25者分別為2、2、2、1、1、1、1只眼;1.0者1只眼(表1)。治療前后患眼logMAR BCVA比較,差異有統計學意義 t=2.489,
t=2.489, <0.05)。行FFA檢查的6只眼,動脈顯影時間為(24.17±7.28)s;與治療前動脈顯影時間比較,治療后動脈顯影時間縮短(3.33±2.50)s,差異有統計學意義(t=3.262,
<0.05)。行FFA檢查的6只眼,動脈顯影時間為(24.17±7.28)s;與治療前動脈顯影時間比較,治療后動脈顯影時間縮短(3.33±2.50)s,差異有統計學意義(t=3.262, <0.05)。
<0.05)。
IAT治療前后,患眼S3(t=2.871)、I1(t=2.325)、T3(t=3.446)處CRT比較,差異均有統計學意義( 0.05);S1、I3、N1、N3、T1、M處CRT比較,差異均無統計學意義(P>0.05)(表2,圖2)。
0.05);S1、I3、N1、N3、T1、M處CRT比較,差異均無統計學意義(P>0.05)(表2,圖2)。
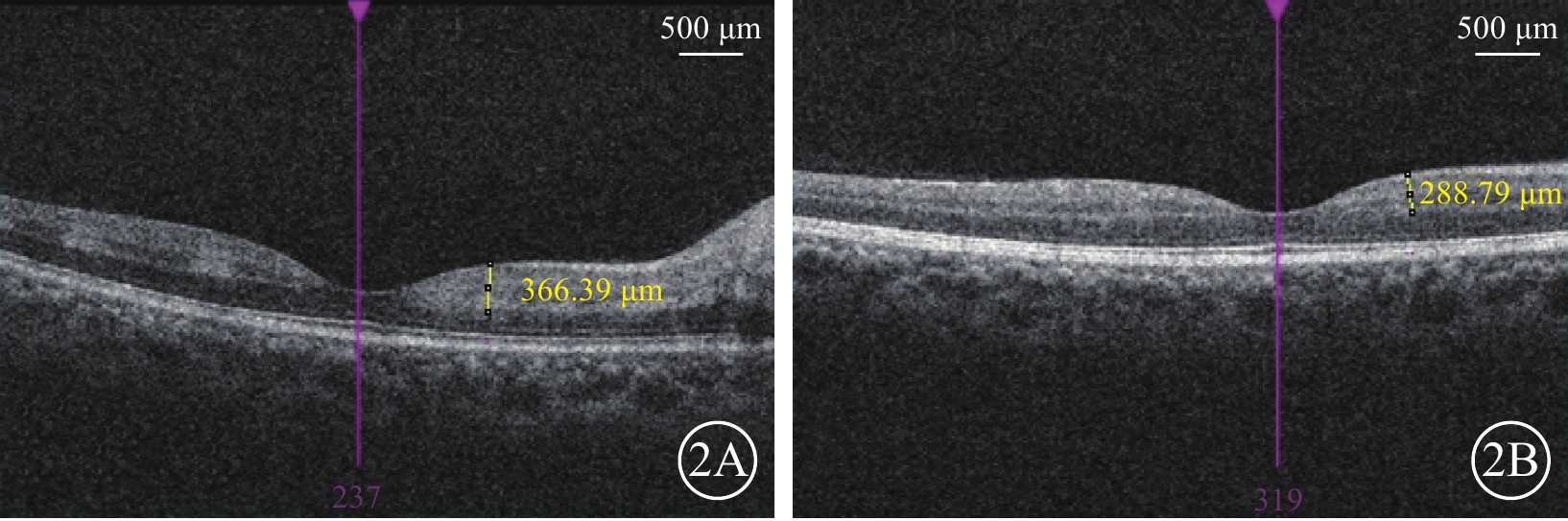
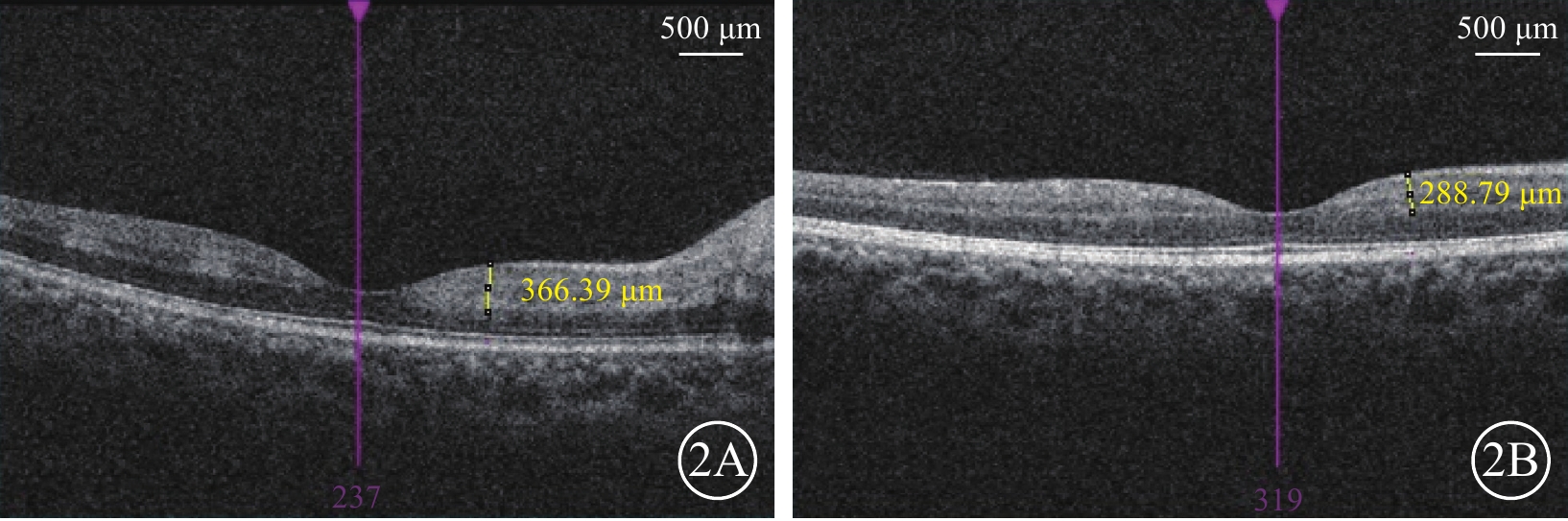 圖2
CRAO患眼IAT治療前后光相干斷層掃描像
圖2
CRAO患眼IAT治療前后光相干斷層掃描像
2A示治療前,N1處CRT為366.39 μm;2B示圖2A同眼治療后24 h,N1處CRT為288.79 μm CRAO:視網膜中央動脈阻塞;IAT:超選擇性眼動脈溶栓;CRT:黃斑中心視網膜厚度;N1:距黃斑中心凹小凹1 mm處鼻側
3 討論
眼動脈起自頸內動脈,而視網膜中央動脈是眼動脈的終末分支,任何使視網膜中央動脈血流急性中斷的因素均可導致CRAO發生,其中來自頸內動脈、主動脈弓或心臟的栓子是其發生的主要原因[4]。視網膜中央動脈血流急性中斷所致的急性視網膜缺血缺氧可引起視網膜神經上皮層細胞內水腫,使得內層視網膜廣泛增厚[7, 11-12]。既往研究表明,CRAO患者溶栓治療后,其視力預后除與疾病嚴重程度分級有關外,還與溶栓治療前基線CRT呈顯著負相關,而與發病時間呈正相關[13-16]。因此,CRT可作為CRAO患者進行任何治療前后的一個重要觀測指標。
本研究結果顯示,本組患眼治療后N1處CRT較治療前明顯降低,但差異無統計學意義。其原因可能為視網膜血管主要為視網膜內5層供血,且神經纖維層富含RGC發出的軸突、傳出纖維、神經膠質細胞和視網膜血管,RGC層富含RGC的胞體、神經膠質細胞、視網膜血管分支,若IAT治療有效,視網膜血管恢復部分血供,則該部位內層視網膜缺血缺氧狀態減輕,水腫消退。有文獻報道,CRAO患眼黃斑區內層視網膜厚度顯著萎縮變薄發生于發病180 d左右[17-18]。本組患眼行IAT治療后,S3、I1、T3處CRT較治療前顯著降低,BCVA顯著提高,動脈顯影時間顯著縮短,差異均有統計學意義。這一定程度證明IAT是治療CRAO的一種有效手段。本研究結果顯示,患眼ITA治療后N1、N3處CRT與治療前比較,差異無統計學意義,其原因可能是黃斑區鼻側視網膜中央動脈分支小動脈分布密集,且主要走行在神經纖維層和RGC層,一旦發生視網膜中央動脈急性血流中斷,黃斑區鼻側內層視網膜受累程度重,發生細胞內水腫程度也更重,且水腫消退慢[19-21]。此外,本研究結果表明僅S3、I1、T3處IAT治療后CRT較治療前下降,差異有統計學意義;S1、I3、N1、N3、T1較治療前無明顯下降,差異均無統計學意義,與本組11只眼IAT治療前或治療后僅殘留旁中心顳側視力,僅1只眼可查及中心視力結果相符。其原因可能與本組患眼均為CRAO者有關。這表明若CRAO患眼阻塞程度重,黃斑區內層視網膜神經纖維細胞、RGC及軸突發生細胞內水腫變性、壞死的程度也更重,并導致其中心視力喪失,部分僅殘留旁中心顳側視力;少數患眼阻塞程度較輕,內層視網膜結構缺血水腫也較輕,故可查及中心視力。這提示CRAO發生后,盡管采取目前最有效的治療措施,短期內黃斑區視網膜水腫消退的程度仍然有限。
本研究存在的局限性:(1)樣本量較少,后續將繼續收集符合納入標準的病例;(2)隨訪時間短,后續將延長IAT治療后的隨訪時間,觀察IAT治療CRAO的中遠期治療效果;(3)缺少CRAO患者健康眼的相關眼部資料,后續將收集符合納入標準的患者健康眼的視力、OCT圖像資料,進行患眼、健康眼對比分析,得出更為客觀的CRAO患眼IAT治療前后多點位CRT的變化數據。
視網膜中央動脈阻塞(CRAO)是一種急性眼部缺血性卒中,可導致嚴重且不可逆視力喪失,并且也是進一步發生心腦血管事件的先兆[1-3]。目前關于CRAO急性期最佳治療方案尚未形成共識[4],但超選擇性眼動脈溶栓(IAT)治療CRAO理論上具有對血栓直接進行溶栓的優勢,同時也可降低顱內和全身出血的風險[5]。急性視網膜血流中斷可導致視網膜神經纖維層、視網膜神經節細胞(RGC)層、內核層不同程度缺血缺氧,發生細胞內水腫,視網膜神經上皮層厚度增加[6-8]。光相干斷層掃描(OCT)因其快速、便捷、非侵入、測量精準及重復性好等特點已被廣泛應用于眼底疾病的診斷、治療及預后評估,且可為臨床提供視網膜高分辨率組織學圖像。我們應用OCT對一組CRAO患者的多點位黃斑中心視網膜厚度(CRT)進行了檢測,對比觀察IAT治療前后CRT的變化情況。現將結果報道如下。
1 對象和方法
回顧性臨床研究。本研究經深圳市第二人民醫院倫理委員會審核(批準號:2023-087-02-YJ);遵循《赫爾辛基宣言》原則;所有患者均獲知情并簽署書面知情同意書。
2022年8月至2023年9月于深圳市第二人民醫院眼科檢查確診并行IAT治療的CRAO患者12例12只眼納入本研究。其中,男性8例8只眼,女性4例4只眼;年齡(47.00±15.06)(17~73)歲;均為單眼發病,右眼、左眼分別為8、4只眼。發病至IAT治療時間為(30.00±30.42)(5~120) h。治療前均給予患眼眼球按摩、局部應用降眼壓藥物、低流量吸氧、舌下含服硝酸甘油片等。患者均符合CRAO診斷標準[2]。排除標準:年齡>85歲;有溶栓禁忌證,包括顱內出血、動靜脈畸形、動脈瘤病史、嚴重出血傾向,1個月以內腦卒中、顱腦手術或外傷史;腦血管造影檢查發現CRAO患眼同側頸動脈、頸內動脈嚴重狹窄或閉塞者;既往有其他黃斑區視網膜病變者;屈光間質混濁致無法測量者;嚴重心、肺、腎、肝臟疾病者;對造影劑過敏者。
患眼均行最佳矯正視力(BCVA)、裂隙燈顯微鏡、瞳孔直接和間接對光反射、相對性傳入性瞳孔障礙、掃描激光檢眼鏡、OCT以及全腦血管造影檢查。12只眼中,行熒光素眼底血管造影(FFA)6只眼;因夜間就診或外院轉診未行FFA檢查6只眼。采用標準對數視力表行BCVA檢查,統計時換算為最小分辨角對數(logMAR)視力,數指/10 cm、數指/6 cm、手動、光感、無光感分別記錄為2.7、2.9、3、4、5[9-10]。
采用德國Zeiss公司Cirrus HD-OCT儀對患眼黃斑區進行掃描。選擇Macular Cube 512×128模式,掃描范圍3 mm×3 mm。應用Image J軟件(version 2.0.0)測量黃斑中心凹(M,直徑0.3~0.4 mm)以及分別距中心凹小凹(中心凹中點)1、3 mm處上方(S1、S3)、下方(I1、I3)、鼻側(N1、N3)、顳側(T1、T3)CRT。CRT定義為視網膜內界膜至視網膜色素上皮層強反射帶內側界面之間的垂直距離。測量由一名具有豐富經驗的醫師操作完成。
IAT治療由深圳市第二人民醫院神經外科同一介入手術團隊完成。患者取仰臥位,Seldinger技術穿刺右股動脈,插入6F動脈鞘,經動脈鞘送入5F造影導管至升主動脈,雙側頸總動脈及雙側頸內動脈,注入對比劑行動脈造影。造影見頸內動脈清晰后,超選眼動脈開口,明確是否有遠端血管明顯減少,符合眼動脈栓塞表現后以微導管在微導絲引導下至眼動脈遠端,注入尿激酶10萬U以及罌粟堿30 mg+生理鹽水10 m1,復行造影明確是否眼動脈分支較前明顯增多。治療后右下肢制動6 h,臥床12 h。若患者CRAO同側頸動脈或頸內動脈完全閉塞,導管無法上行,則停止進一步溶栓操作。
IAT治療后24 h,采用與治療前相同設備和方法行相關檢查。對比觀察治療前后患眼logMAR BCVA以及S1、S3、I1、I3、N1、N3、T1、T3、M處CRT變化。行FFA檢查的6只眼,對比觀察動脈顯影時間的變化。動脈顯影時間定義為FFA檢查過程中開始注入熒光素鈉至視網膜動脈開始顯影時間。
采用SPSS25.0軟件行統計學分析。符合正態分布的計量資料以均數±標準差(x±s)表示。治療前后logMAR BCVA、FFA檢查動脈顯影時間以及S1、S3、I1、I3、N1、N3、T1、T3、M處CRT比較采用配對樣本 檢驗。
檢驗。 <0.05為差異有統計學意義。
<0.05為差異有統計學意義。
2 結果
患眼IAT治療均順利完成,治療中無并發癥發生。治療后全腦血管造影檢查結果顯示,眼動脈顯影較治療前增粗、分支增多;脈絡膜環顯影較治療前明顯(圖1)。
 圖1
CRAO患者IAT治療前后全腦血管造影像
圖1
CRAO患者IAT治療前后全腦血管造影像
1A示IAT治療前,同側OA未見顯影;1B示IAT治療中,同側OA及其分支逐漸顯影;1C示IAT治療后,同側OA及其分支血管網顯影明顯增粗增多 CRAO:視網膜中央動脈阻塞;IAT:超選擇性眼動脈溶栓;OA:眼動脈
治療前患眼logMAR BCVA 3.48±1.42(0.2~5.0)。其中,無光感者3只眼;顳側光感、手動、數指、0.01者分別為4、1、2、1只眼;0.6者1只眼(表1)。行FFA檢查的6只眼,動脈顯影時間為(27.50±5.47)(21~35)s。
IAT治療后24 h,患眼logMAR BCVA 2.35±1.59(0.0~5.0)。其中,無光感者1只眼;顳側光感、手動、數指、0.02、0.05、0.10、0.25者分別為2、2、2、1、1、1、1只眼;1.0者1只眼(表1)。治療前后患眼logMAR BCVA比較,差異有統計學意義 t=2.489,
t=2.489, <0.05)。行FFA檢查的6只眼,動脈顯影時間為(24.17±7.28)s;與治療前動脈顯影時間比較,治療后動脈顯影時間縮短(3.33±2.50)s,差異有統計學意義(t=3.262,
<0.05)。行FFA檢查的6只眼,動脈顯影時間為(24.17±7.28)s;與治療前動脈顯影時間比較,治療后動脈顯影時間縮短(3.33±2.50)s,差異有統計學意義(t=3.262, <0.05)。
<0.05)。
IAT治療前后,患眼S3(t=2.871)、I1(t=2.325)、T3(t=3.446)處CRT比較,差異均有統計學意義( 0.05);S1、I3、N1、N3、T1、M處CRT比較,差異均無統計學意義(P>0.05)(表2,圖2)。
0.05);S1、I3、N1、N3、T1、M處CRT比較,差異均無統計學意義(P>0.05)(表2,圖2)。
 圖2
CRAO患眼IAT治療前后光相干斷層掃描像
圖2
CRAO患眼IAT治療前后光相干斷層掃描像
2A示治療前,N1處CRT為366.39 μm;2B示圖2A同眼治療后24 h,N1處CRT為288.79 μm CRAO:視網膜中央動脈阻塞;IAT:超選擇性眼動脈溶栓;CRT:黃斑中心視網膜厚度;N1:距黃斑中心凹小凹1 mm處鼻側
3 討論
眼動脈起自頸內動脈,而視網膜中央動脈是眼動脈的終末分支,任何使視網膜中央動脈血流急性中斷的因素均可導致CRAO發生,其中來自頸內動脈、主動脈弓或心臟的栓子是其發生的主要原因[4]。視網膜中央動脈血流急性中斷所致的急性視網膜缺血缺氧可引起視網膜神經上皮層細胞內水腫,使得內層視網膜廣泛增厚[7, 11-12]。既往研究表明,CRAO患者溶栓治療后,其視力預后除與疾病嚴重程度分級有關外,還與溶栓治療前基線CRT呈顯著負相關,而與發病時間呈正相關[13-16]。因此,CRT可作為CRAO患者進行任何治療前后的一個重要觀測指標。
本研究結果顯示,本組患眼治療后N1處CRT較治療前明顯降低,但差異無統計學意義。其原因可能為視網膜血管主要為視網膜內5層供血,且神經纖維層富含RGC發出的軸突、傳出纖維、神經膠質細胞和視網膜血管,RGC層富含RGC的胞體、神經膠質細胞、視網膜血管分支,若IAT治療有效,視網膜血管恢復部分血供,則該部位內層視網膜缺血缺氧狀態減輕,水腫消退。有文獻報道,CRAO患眼黃斑區內層視網膜厚度顯著萎縮變薄發生于發病180 d左右[17-18]。本組患眼行IAT治療后,S3、I1、T3處CRT較治療前顯著降低,BCVA顯著提高,動脈顯影時間顯著縮短,差異均有統計學意義。這一定程度證明IAT是治療CRAO的一種有效手段。本研究結果顯示,患眼ITA治療后N1、N3處CRT與治療前比較,差異無統計學意義,其原因可能是黃斑區鼻側視網膜中央動脈分支小動脈分布密集,且主要走行在神經纖維層和RGC層,一旦發生視網膜中央動脈急性血流中斷,黃斑區鼻側內層視網膜受累程度重,發生細胞內水腫程度也更重,且水腫消退慢[19-21]。此外,本研究結果表明僅S3、I1、T3處IAT治療后CRT較治療前下降,差異有統計學意義;S1、I3、N1、N3、T1較治療前無明顯下降,差異均無統計學意義,與本組11只眼IAT治療前或治療后僅殘留旁中心顳側視力,僅1只眼可查及中心視力結果相符。其原因可能與本組患眼均為CRAO者有關。這表明若CRAO患眼阻塞程度重,黃斑區內層視網膜神經纖維細胞、RGC及軸突發生細胞內水腫變性、壞死的程度也更重,并導致其中心視力喪失,部分僅殘留旁中心顳側視力;少數患眼阻塞程度較輕,內層視網膜結構缺血水腫也較輕,故可查及中心視力。這提示CRAO發生后,盡管采取目前最有效的治療措施,短期內黃斑區視網膜水腫消退的程度仍然有限。
本研究存在的局限性:(1)樣本量較少,后續將繼續收集符合納入標準的病例;(2)隨訪時間短,后續將延長IAT治療后的隨訪時間,觀察IAT治療CRAO的中遠期治療效果;(3)缺少CRAO患者健康眼的相關眼部資料,后續將收集符合納入標準的患者健康眼的視力、OCT圖像資料,進行患眼、健康眼對比分析,得出更為客觀的CRAO患眼IAT治療前后多點位CRT的變化數據。