引用本文: 許夢涵, 劉昊, 鄭雪晶, 侯力華, 李霞波, 閆梅, 李彤, 魯鑫, 王敏. 視網膜靜脈阻塞合并視網膜動脈阻塞臨床分析. 中華眼底病雜志, 2024, 40(11): 848-853. doi: 10.3760/cma.j.cn511434-20240506-00184 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
視網膜靜脈阻塞(RVO)、視網膜動脈阻塞(RAO)臨床中并不少見,但RVO合并RAO(RVO-RAO)則不多,以病例報道為主[1-2]。其病因復雜,老年患者常伴有高血壓、高血脂、糖尿病、頸動脈粥樣硬化等心血管高危因素;年輕患者多伴有感染性與非感染性血管炎、自身免疫性疾病、血液高凝狀態等[3]。本病預后不佳,其發病特征、臨床表現不同于單純RVO、RAO,臨床工作中需及時識別,給予對癥、對因治療,盡可能改善視功能;同時及時干預高危發病因素,預防對側眼出現類似病變。本研究回顧分析了一組RVO-RAO患者的臨床資料,對其臨床表現、影像特征進行了分析。現將結果報道如下。
1 對象和方法
回顧性病例分析研究。本研究經咸陽市第一人民醫院倫理委員會提交免知情同意申請并通過審核[批文號:2022KY(L)-40];并遵循《赫爾辛基宣言》原則。
2022年2月1日至2024年1月31日于咸陽市第一人民醫院眼底病內科檢查確診的RVO-RAO合并黃斑水腫(ME)患者15例15只眼納入本研究。納入標準:(1)符合歐洲視網膜專家學會制定的RVO診療指南(2019版)中RVO合并ME診斷標準[4],并同時表現為RAO特征性眼底改變的患者;(2)首次就診者。排除標準:(1)既往有激光光凝以及玻璃體腔注射糖皮質激素、抗血管內皮生長因子(VEGF) 藥物治療史; (2)合并青光眼、高度近視、糖尿病視網膜病變、視網膜血管炎者;(3)合并腦卒中、肝腎功能缺損、免疫系統功能障礙者;(4)長期服用阿司匹林等抗凝藥物者;(5)惡性腫瘤者。
患者均行最佳矯正視力(BCVA)、眼壓、裂隙燈顯微鏡、掃描激光檢眼鏡、光相干斷層掃描(OCT)、熒光素眼底血管造影(FFA)檢查以及血清同型半胱氨酸檢測。同時行OCT血管成像(OCTA)檢查6只眼。
明確診斷后,給予患眼玻璃體腔注射抗VEGF藥物治療。治療方案為初始1次治療后,經評估按需給藥。同時口服促進眼底出血吸收、改善眼底循環、營養神經藥物。
治療后每一個月隨訪1次,連續12個月。隨訪時采用治療前相同設備和方法行相關檢查;3個月時行FFA檢查。隨訪時若發現視網膜出現無灌注區,及時給予激光光凝治療。BCVA提高2行及以上為視力提高;視力變化在1行范圍內為視力不變;視力下降2行及以上為視力下降。
觀察患眼臨床表現、影像特征、治療結果。
2 結果
15例15只眼中,男性9例9只眼,女性6例6只眼;均為單眼發病。年齡(61.0±9.7)(44~79)歲。均主訴單眼無痛性視力下降。出現癥狀至就診時病程為0~2個月,中位數0.55個月。視網膜分支靜脈阻塞合并視網膜分支動脈阻塞(BRVO-BRAO)3例3只眼(20.0%,3/15);視網膜中央靜脈阻塞合并視網膜中央動脈阻塞 (CRVO-CRAO)12例12只眼(80.0%,12/15)。BCVA光感~0.25,中位數0.02。眼壓14~16 mm Hg(1 mm Hg=0.133 kPa)。瞳孔直接對光反射減弱,間接對光反射正常;相對性傳入性瞳孔障礙(RAPD)陽性(100.0%,15/15)。老年性白內障6只眼(40.0%,6/15)。對側眼先天性視盤缺損1只眼(6.6%,1/15)。眼前節均未見明顯異常。高血壓6例(40.0%,6/15);高同型半胱氨酸血癥2例(14.3%,2/15);腦梗死3例(20.0%,3/15);冠心病1例(6.6%,1/15)。
15只眼中,RVO、RAO同時發生者10只眼;RVO在抗VEGF藥物治療過程中伴隨出現RAO者5只眼。隨訪時出現視網膜無灌注區13只眼;無灌注區出現時間為(1.14±0.95)(0~2)個月。面積為10~75個視盤面積。在治療過程中有5只眼出現視神經萎縮,出現時間為發病后平均2.21個月。
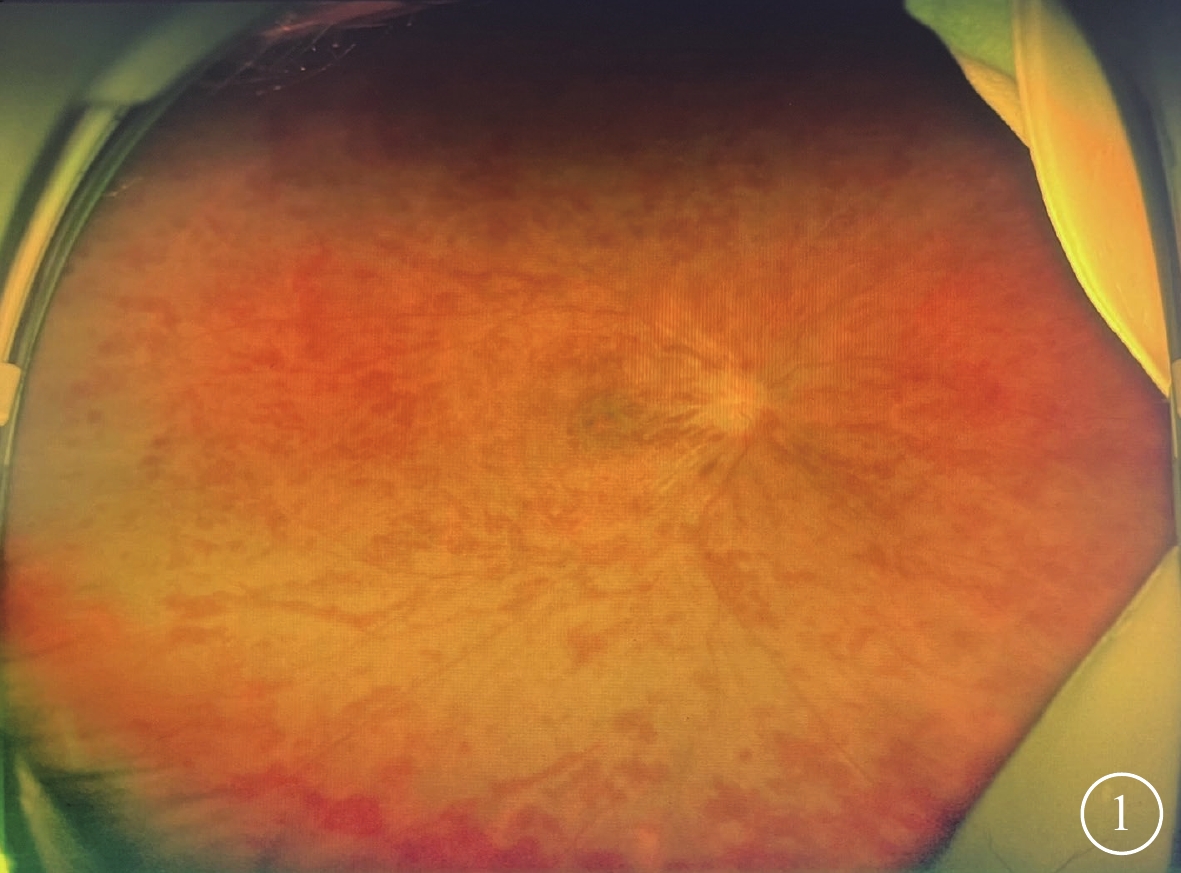
所有患眼后極部視網膜水腫,可見片狀或“火焰狀”出血;動脈纖細,走形僵直,靜脈紆曲、擴張(圖1);黃斑呈“櫻桃紅樣”改變,中心凹反光消失。后極部視網膜可見棉絨斑13只眼(86.6%,13/15)。CRVO-CRAO者12只眼,視盤水腫,邊界欠清晰;BRVO-BRAO者3只眼,視盤未見明顯異常,邊界清晰。
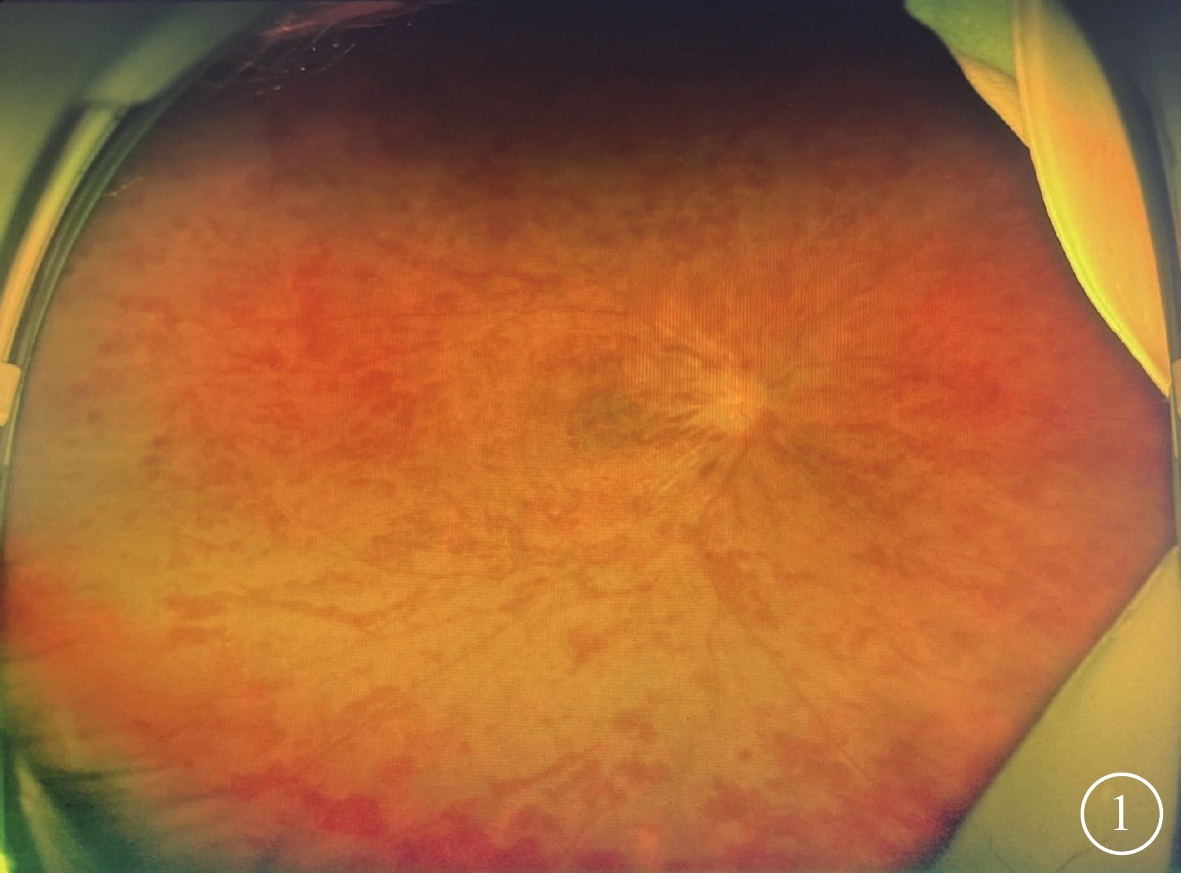 圖1
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼彩色眼底像 視盤水腫邊界欠清晰,靜脈高度紆曲、擴張,視網膜廣泛“火焰狀”出血
圖1
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼彩色眼底像 視盤水腫邊界欠清晰,靜脈高度紆曲、擴張,視網膜廣泛“火焰狀”出血
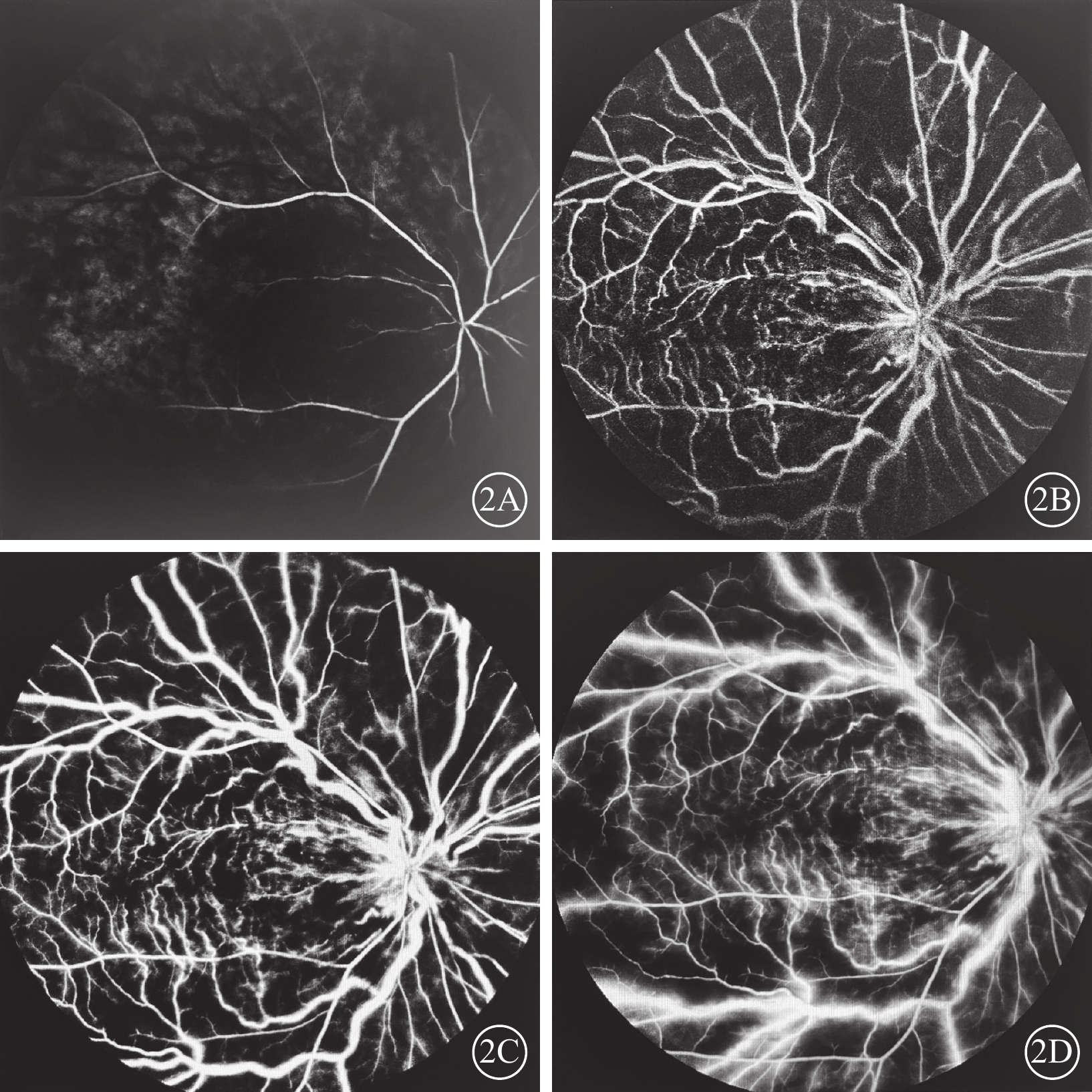
FFA檢查發現,所有患眼早期視網膜動脈無充盈或充盈時間延長、動脈纖細、走形平直,視網膜靜脈層流時間延遲,視網膜毛細血管充盈相對遲緩甚至不充盈,黃斑小動脈不同程度閉鎖、拱環結構破壞,視盤毛細血管擴張、熒光素滲漏;晚期靜脈彌漫性熒光素滲漏(圖2)。
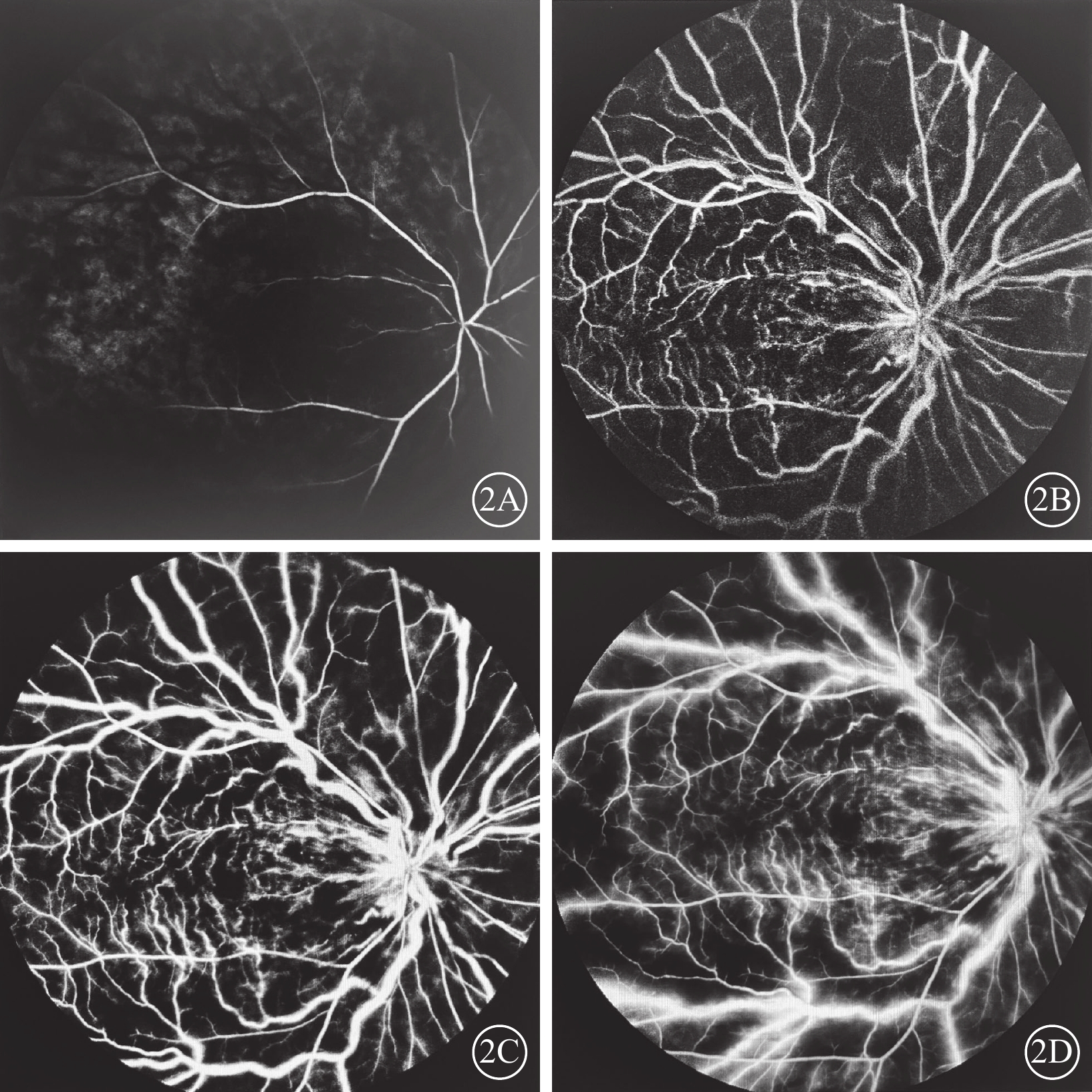 圖2
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)熒光素眼底血管造影像 2A示12.00 s,視網膜動脈充盈前鋒,血管管徑細,走形較僵直;2B示30.31 s,靜脈回流遲緩,未完全回流;2C示43.50 s,動靜脈充盈,動脈纖細,動靜脈比值約1∶3;2D示2 min 22.00 s,視網膜呈彌漫熒光素滲漏
圖2
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)熒光素眼底血管造影像 2A示12.00 s,視網膜動脈充盈前鋒,血管管徑細,走形較僵直;2B示30.31 s,靜脈回流遲緩,未完全回流;2C示43.50 s,動靜脈充盈,動脈纖細,動靜脈比值約1∶3;2D示2 min 22.00 s,視網膜呈彌漫熒光素滲漏
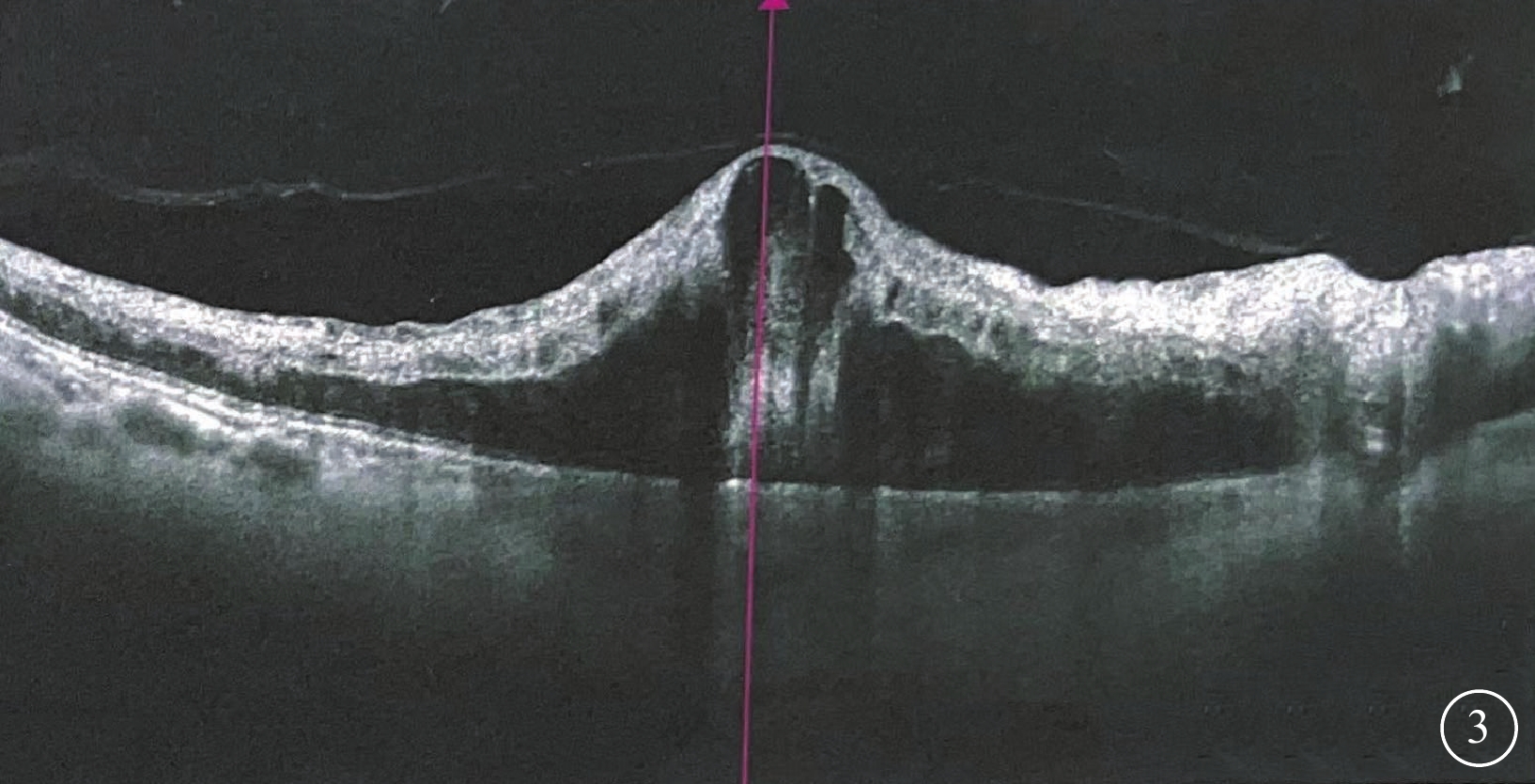
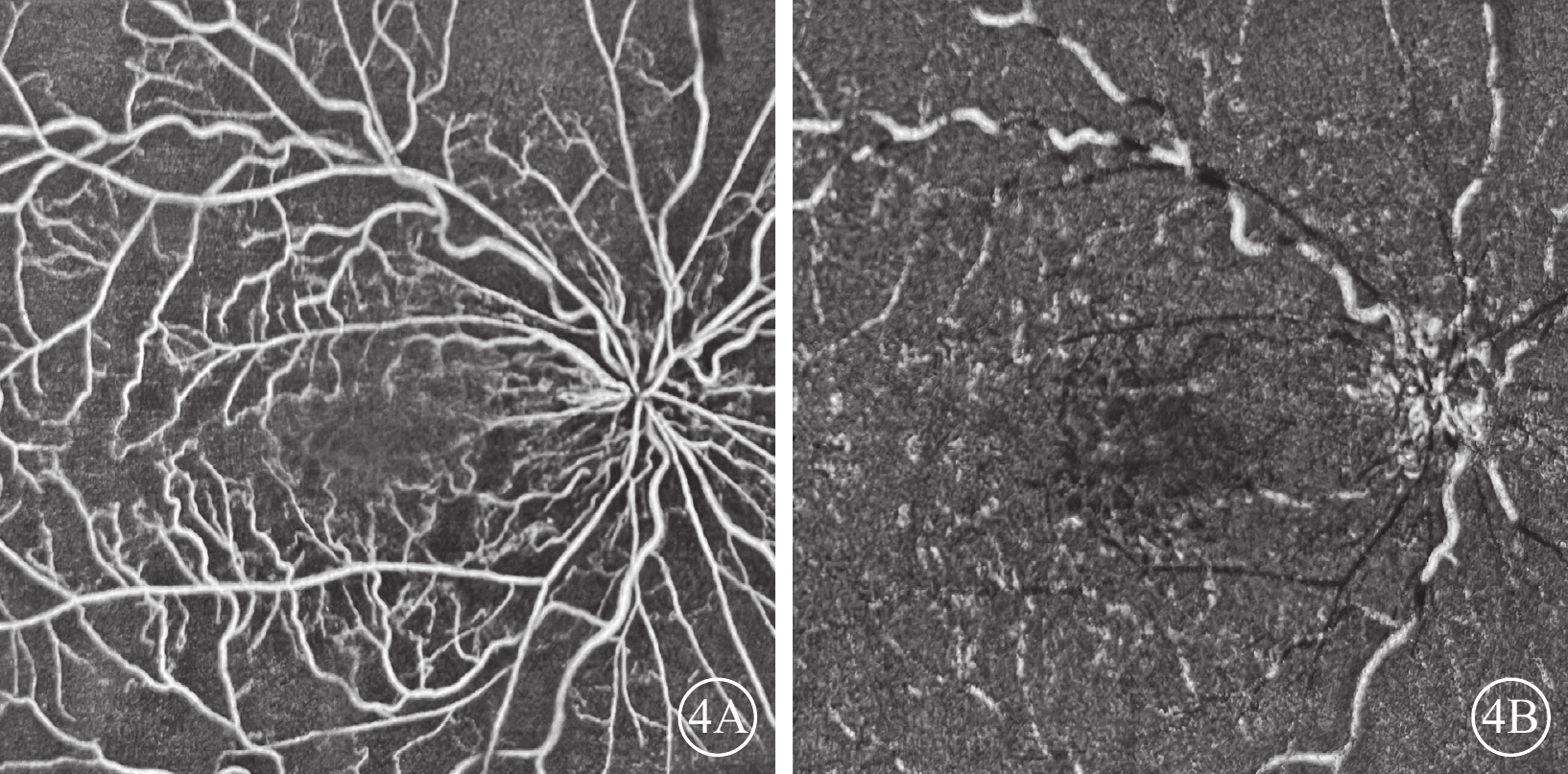
OCT檢查發現,所有患眼黃斑區視網膜增厚及黃斑囊樣改變;視網膜中內層不同程度增厚、彌漫性反射增強,層間結構欠清晰,其下視網膜組織反射減弱(圖3)。行OCTA檢查的6只眼,視網膜淺層毛細血管叢(SCP)、深層毛細血管叢(DCP)血流密度下降;DCP血管床血流減少或中斷(圖4)。
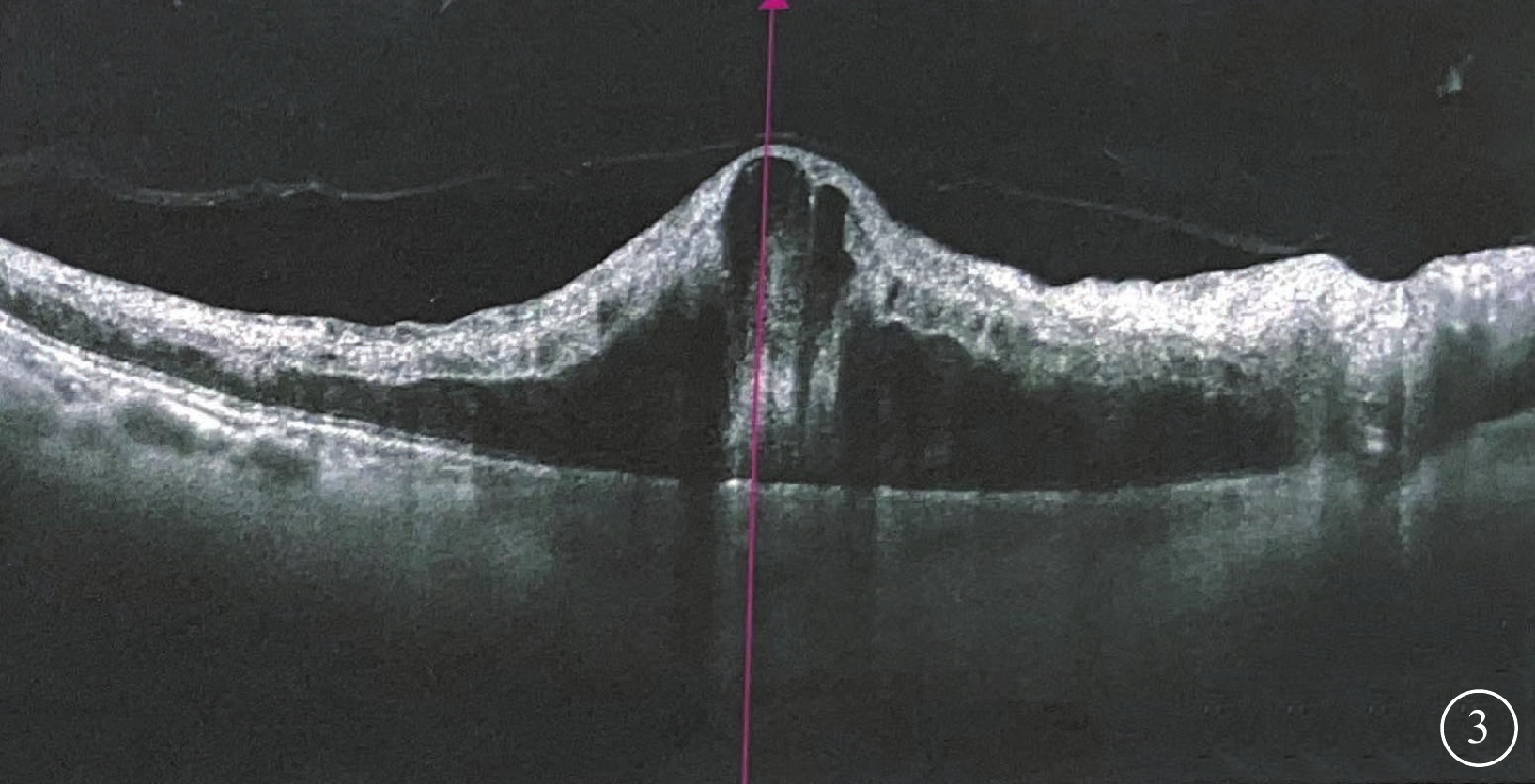 圖3
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)光相干斷層掃描像 黃斑區視網膜囊樣水腫伴高度隆起,細胞內水腫呈強反射信號,層間結構欠清,外層結構信號遮蔽
圖3
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)光相干斷層掃描像 黃斑區視網膜囊樣水腫伴高度隆起,細胞內水腫呈強反射信號,層間結構欠清,外層結構信號遮蔽
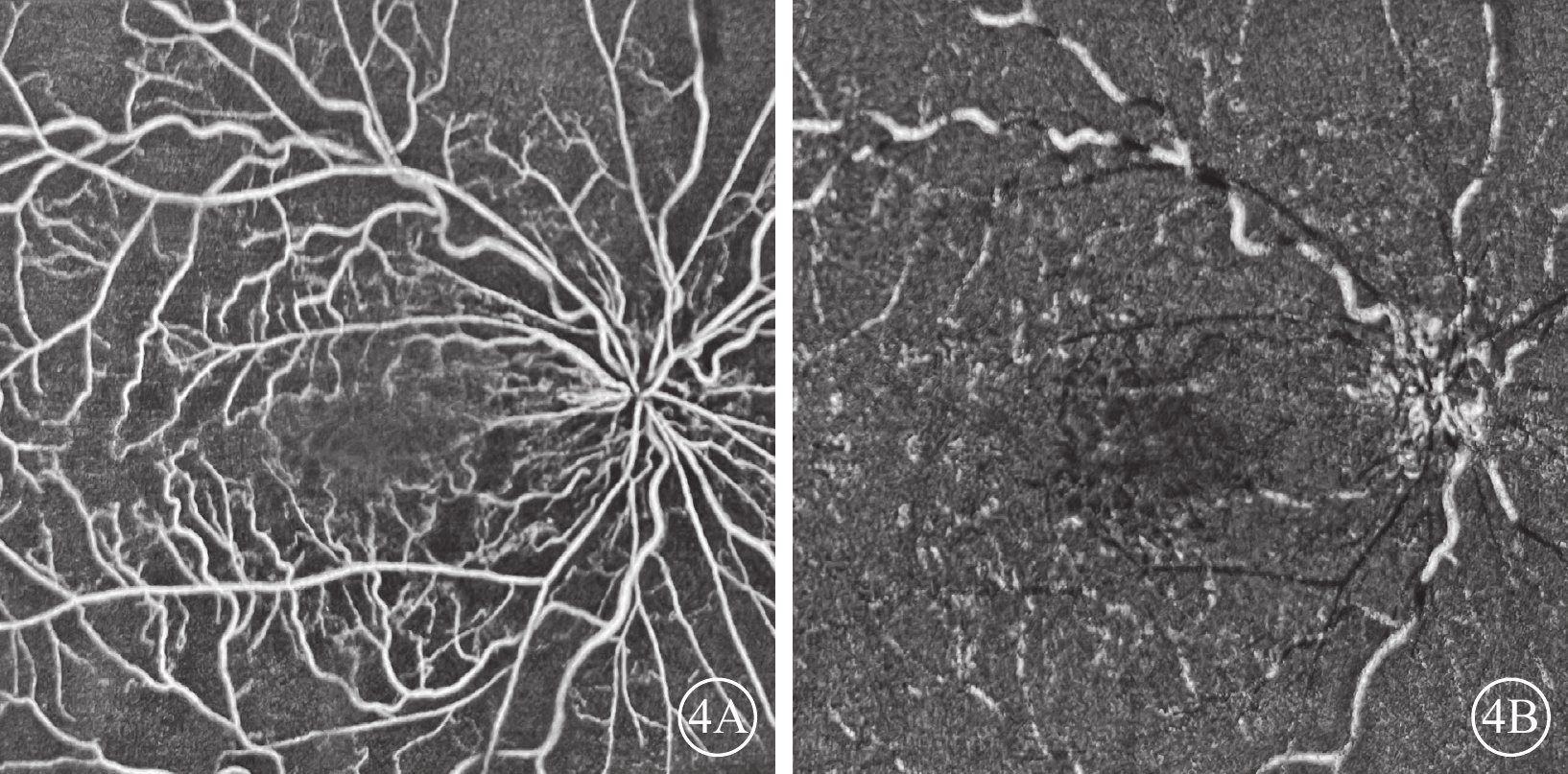 圖4
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼光相干斷層掃描血管成像圖 4A、4B分別示圖1A同眼淺層、深層毛細血管叢,淺層毛細血管血流密度降低,深層毛細血管血流密度顯著降低,血流中斷
圖4
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼光相干斷層掃描血管成像圖 4A、4B分別示圖1A同眼淺層、深層毛細血管叢,淺層毛細血管血流密度降低,深層毛細血管血流密度顯著降低,血流中斷
隨訪12個月后,15只眼中,視力提高、不變、下降分別為12、2、1只眼。出現視神經萎縮5只眼。初診、末次隨訪時,BRVO-BRAO者3只眼BCVA分別為0.1、0.4、0.25和0.25、0.5、0.4; CRVO-CRAO者12只眼BCVA為光感~0.25和0.02~0.5。
3 討論
在臨床實踐中,依據視網膜血流灌注的程度,RVO被分為缺血型和非缺血型。部分非缺血型RVO患者可能會進展為缺血型。目前,臨床治療和預防缺血型RVO-ME的主要原則是預防新生血管的生成并減輕ME[5]。由于治療方法的不同,有必要區分缺血型RVO與RVO合并RAO。以下是主要的鑒別要點:(1)缺血型RVO患者可出現在任何年齡階段,通常為單眼發病,表現為視力逐漸下降,且視力多低于0.1;而RVO合并RAO主要發生在老年人群中,同樣表現為單眼發病,但其特點是急性病程,視力在幾小時到幾天內急劇下降,甚至達光感、手動或無光感,少數患者還會伴有眼痛或眼球后疼痛。視力損害的程度與缺血區域的位置有關,如果缺血區位于黃斑,則中心視力會受到嚴重影響;反之,如果缺血區遠離黃斑,則中心視力影響較小。這兩類疾病的患者都可能出現RAPD陽性。(2)眼底表現:缺血型RVO患者的視網膜靜脈顯著紆曲且擴張,視網膜內部出血呈現沿靜脈分布的“火焰狀”,或者出現廣泛的融合性出血,同時伴有嚴重的視盤和視網膜水腫以及棉絨斑。而RVO合并RAO除了表現出上述特點外,還可見視網膜動脈變細,病灶區接近視盤周圍由于毛細血管缺血閉塞而導致的神經纖維壞死,表現為視網膜水腫伴隨棉絨斑。然而,若黃斑深層毛細血管閉塞,則不會出現棉絨斑,而在OCT上則表現為層間強反射,黃斑中心凹光反射消失,也有部分患者RAO表現被掩蓋。(3)頻域OCT表現:RVO患者常顯示出黃斑區視網膜囊樣水腫增厚,以及視網膜層間的多個液性囊腔。RVO合并RAO的患者除了這些特征外,還表現出視網膜中內層不同程度的增厚、彌漫性反射增強、層間結構模糊不清,并且在病變后期會出現視網膜內層結構萎縮變薄。(4)OCTA表現:作為一項新興技術,OCTA可以無創評估視網膜和脈絡膜各層的血流狀況[6],包括SCP、DCP以及外層視網膜和脈絡膜毛細血管,同時還能精確測量黃斑中心凹無灌注區面積(FAZ)。研究表明,RVO患者的DCP血流密度顯著降低,并且與視網膜缺血的嚴重程度密切相關。DCP血流密度小于46%可能是視網膜無灌注區形成的臨界值,這可以作為RVO患者FFA檢查的一個參考指標[7]。當RVO合并RAO時,SCP和DCP的血流密度均顯著下降,提示SCP、DCP同時受損對RVO合并RAO的診斷具有重要意義[8-9]。(5)眼底血管造影表現:缺血型RVO在造影早期可觀察到出血病灶遮擋視網膜脈絡膜熒光,靜脈回流時間延長,周邊視網膜出現大片無灌注區,周圍殘留的毛細血管擴張、形成微動脈瘤等現象。而在造影晚期,視網膜靜脈管壁著染及滲漏,黃斑區呈現“花瓣樣”熒光積存。對于RVO合并RAO患者,在造影早期可見視網膜動脈充盈不足或充盈延遲,視網膜靜脈層流出現時間延遲,視網膜大靜脈不同程度逆向充盈,視網膜毛細血管充盈遲緩甚至不充盈,黃斑小動脈閉鎖,拱環結構破壞等。在造影晚期則表現為斑片狀或整個視網膜的強熒光。
對于RVO合并RAO患者的治療方案及其使用抗VEGF藥物的具體時機與時長,目前尚缺乏明確的臨床指南及相關文獻支持。在此背景下,本研究對納入的患者實施了抗VEGF藥物治療。鑒于這類疾病與單純RVO有所不同,特別是在疾病初期,視網膜循環障礙導致靜脈紆曲、擴張,靜脈分布區域因缺血缺氧而引起視網膜血管屏障破壞及視網膜色素上皮(RPE)細胞功能受損,眼底微血管病變引發滲漏,從而導致視網膜組織水腫。當病變累及黃斑時,便會導致黃斑水腫。RVO中的血管阻塞能夠引發一系列急性連鎖反應,包括視網膜缺血以及VEGF濃度水平的升高。然而,高水平的VEGF將進一步加劇視網膜缺血,并擴大無灌注區。因此,及時阻斷VEGF的分泌或降低其濃度,可以防止無灌注區的惡化,改善血液灌注并中斷這一反饋循環。在ME得到緩解后,考慮到在玻璃體內注射過程中,眼壓的一過性升高可能導致篩板處的視網膜中央動脈受壓,進一步導致動脈管壁狹窄,動脈灌注壓力下降,以及動脈痙攣,從而加重視網膜動脈栓塞的情況。因此,在治療此類疾病的過程中,本研究采用了1+按需治療的方案,并安排患者每月進行復查。此外,患者還同時口服有助于吸收眼底出血、改善眼底循環及營養神經的藥物。
RVO合并RAO的確切原因及危險因素尚未完全明確。目前,對其病因學的研究主要集中在以下幾個方面:(1)眼球解剖因素及眶內疾病:已有文獻指出,CRVO與短眼軸可能成為RAO的誘因之一[10]。青光眼患者由于鞏膜篩板的病理性凹陷,可能影響到篩板區域的中央動脈灌注及靜脈回流[11-12]。眶內相關疾病,如球后視神經炎、特發性眼眶炎性假瘤[13],由于長期的炎癥浸潤和壓迫作用,可能導致視神經及視網膜中央血管系統的受壓,從而引發血流異常。(2)全身及血液系統疾病:心血管疾病被認為是最大的危險因素之一,其次是高血壓病、糖尿病、凝血功能障礙、特定藥物使用、劇烈運動、種族和性別等因素[14]。此外,系統性紅斑狼瘡、血小板減少性紫癜、抗磷脂綜合征以及感染性心內膜炎等也被發現與此類疾病相關[15]。王文吉[3]研究發現,動脈管壁硬化后,管腔狹窄,血流速度減慢,橫截面血流量減少,RVO發生后,篩板處的中央動靜脈受擠壓,從而導致RAO的發生。(3)炎癥及腫瘤相關疾病:CRAO發生后,血管閉塞可引發血管炎癥反應加劇,視網膜動脈受累,在炎癥因子的作用下形成血栓,最終導致RAO[16-17]。有研究發現,血纖維蛋白溶酶原活性降低與脂蛋白A水平升高共同作用,可能會導致CRVO合并睫狀視網膜動脈阻塞[18]。(4)藥物使用:某些藥物的使用也可能與此類疾病有關,如β-干擾素、孕激素、內分泌替代療法藥物、抗腫瘤藥物以及疫苗等[19]。
關于RVO合并RAO的發生順序,目前尚無定論。多數研究者認為,RVO先于RAO發生。RVO發生后引起的血管回流障礙導致毛細血管阻力增加,減少了視網膜動脈的灌注,從而引發了RAO。Schmidt[20]對RVO合并RAO患者的視網膜動脈、心臟以及頸動脈進行了檢查,未發現栓子的存在,進一步表明沒有產生栓子的基礎病變。因此,他提出RVO發生后,淤血擴張的中央靜脈在篩板處對動脈施加壓力,進一步減少動脈血流,導致RAO的發生。然而,也有部分學者持不同觀點,認為RAO先于RVO發生[11, 14]。他們認為視網膜血管灌注壓下降導致視網膜循環速度減慢,進而引起了RVO。有研究通過實驗單純結扎視網膜中央靜脈并未導致RVO的發生;而當同時結扎動脈和靜脈時,則出現了相應的癥狀。基于此,這部分研究者認為RVO是在RAO之后發生的。
在臨床實踐中,如果患者表現出RVO典型的眼底特征,但BCVA與檢查結果不符,或者在RVO的治療過程中,尤其是在接受抗VEGF藥物治療后,患者視力突然再次下降,這時應考慮是否并發了RAO或其他合并癥。通過RAPD檢查、OCT的早期特征表現以及FFA等多種影像學手段,可以幫助及時確診。一旦確診為RVO合并RAO,應在評估后按照RVO與RAO同時存在的治療方案進行處理。需要密切監測病情變化,并定期復查FFA。當出現大面積無灌注區時,應及時給予激光光凝治療,包括全視網膜激光光凝(PRP)或超全PRP等,以預防新生血管性青光眼的發生。當觀察到視網膜及視神經萎縮時,應積極給予營養神經和支持性治療,盡可能挽救視功能。同時,需要對全身性疾病及相關高危因素進行全面排查,以預防受影響眼睛的病情惡化及避免其他部位的復發。
本研究的局限性在于其單中心設計、回顧性病例分析的特點以及較小的樣本量,這些因素可能導致結果出現偏差或統計上的假陰性錯誤。因此,仍需更多的臨床研究來進一步驗證本研究的發現。
視網膜靜脈阻塞(RVO)、視網膜動脈阻塞(RAO)臨床中并不少見,但RVO合并RAO(RVO-RAO)則不多,以病例報道為主[1-2]。其病因復雜,老年患者常伴有高血壓、高血脂、糖尿病、頸動脈粥樣硬化等心血管高危因素;年輕患者多伴有感染性與非感染性血管炎、自身免疫性疾病、血液高凝狀態等[3]。本病預后不佳,其發病特征、臨床表現不同于單純RVO、RAO,臨床工作中需及時識別,給予對癥、對因治療,盡可能改善視功能;同時及時干預高危發病因素,預防對側眼出現類似病變。本研究回顧分析了一組RVO-RAO患者的臨床資料,對其臨床表現、影像特征進行了分析。現將結果報道如下。
1 對象和方法
回顧性病例分析研究。本研究經咸陽市第一人民醫院倫理委員會提交免知情同意申請并通過審核[批文號:2022KY(L)-40];并遵循《赫爾辛基宣言》原則。
2022年2月1日至2024年1月31日于咸陽市第一人民醫院眼底病內科檢查確診的RVO-RAO合并黃斑水腫(ME)患者15例15只眼納入本研究。納入標準:(1)符合歐洲視網膜專家學會制定的RVO診療指南(2019版)中RVO合并ME診斷標準[4],并同時表現為RAO特征性眼底改變的患者;(2)首次就診者。排除標準:(1)既往有激光光凝以及玻璃體腔注射糖皮質激素、抗血管內皮生長因子(VEGF) 藥物治療史; (2)合并青光眼、高度近視、糖尿病視網膜病變、視網膜血管炎者;(3)合并腦卒中、肝腎功能缺損、免疫系統功能障礙者;(4)長期服用阿司匹林等抗凝藥物者;(5)惡性腫瘤者。
患者均行最佳矯正視力(BCVA)、眼壓、裂隙燈顯微鏡、掃描激光檢眼鏡、光相干斷層掃描(OCT)、熒光素眼底血管造影(FFA)檢查以及血清同型半胱氨酸檢測。同時行OCT血管成像(OCTA)檢查6只眼。
明確診斷后,給予患眼玻璃體腔注射抗VEGF藥物治療。治療方案為初始1次治療后,經評估按需給藥。同時口服促進眼底出血吸收、改善眼底循環、營養神經藥物。
治療后每一個月隨訪1次,連續12個月。隨訪時采用治療前相同設備和方法行相關檢查;3個月時行FFA檢查。隨訪時若發現視網膜出現無灌注區,及時給予激光光凝治療。BCVA提高2行及以上為視力提高;視力變化在1行范圍內為視力不變;視力下降2行及以上為視力下降。
觀察患眼臨床表現、影像特征、治療結果。
2 結果
15例15只眼中,男性9例9只眼,女性6例6只眼;均為單眼發病。年齡(61.0±9.7)(44~79)歲。均主訴單眼無痛性視力下降。出現癥狀至就診時病程為0~2個月,中位數0.55個月。視網膜分支靜脈阻塞合并視網膜分支動脈阻塞(BRVO-BRAO)3例3只眼(20.0%,3/15);視網膜中央靜脈阻塞合并視網膜中央動脈阻塞 (CRVO-CRAO)12例12只眼(80.0%,12/15)。BCVA光感~0.25,中位數0.02。眼壓14~16 mm Hg(1 mm Hg=0.133 kPa)。瞳孔直接對光反射減弱,間接對光反射正常;相對性傳入性瞳孔障礙(RAPD)陽性(100.0%,15/15)。老年性白內障6只眼(40.0%,6/15)。對側眼先天性視盤缺損1只眼(6.6%,1/15)。眼前節均未見明顯異常。高血壓6例(40.0%,6/15);高同型半胱氨酸血癥2例(14.3%,2/15);腦梗死3例(20.0%,3/15);冠心病1例(6.6%,1/15)。
15只眼中,RVO、RAO同時發生者10只眼;RVO在抗VEGF藥物治療過程中伴隨出現RAO者5只眼。隨訪時出現視網膜無灌注區13只眼;無灌注區出現時間為(1.14±0.95)(0~2)個月。面積為10~75個視盤面積。在治療過程中有5只眼出現視神經萎縮,出現時間為發病后平均2.21個月。
所有患眼后極部視網膜水腫,可見片狀或“火焰狀”出血;動脈纖細,走形僵直,靜脈紆曲、擴張(圖1);黃斑呈“櫻桃紅樣”改變,中心凹反光消失。后極部視網膜可見棉絨斑13只眼(86.6%,13/15)。CRVO-CRAO者12只眼,視盤水腫,邊界欠清晰;BRVO-BRAO者3只眼,視盤未見明顯異常,邊界清晰。
 圖1
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼彩色眼底像 視盤水腫邊界欠清晰,靜脈高度紆曲、擴張,視網膜廣泛“火焰狀”出血
圖1
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼彩色眼底像 視盤水腫邊界欠清晰,靜脈高度紆曲、擴張,視網膜廣泛“火焰狀”出血
FFA檢查發現,所有患眼早期視網膜動脈無充盈或充盈時間延長、動脈纖細、走形平直,視網膜靜脈層流時間延遲,視網膜毛細血管充盈相對遲緩甚至不充盈,黃斑小動脈不同程度閉鎖、拱環結構破壞,視盤毛細血管擴張、熒光素滲漏;晚期靜脈彌漫性熒光素滲漏(圖2)。
 圖2
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)熒光素眼底血管造影像 2A示12.00 s,視網膜動脈充盈前鋒,血管管徑細,走形較僵直;2B示30.31 s,靜脈回流遲緩,未完全回流;2C示43.50 s,動靜脈充盈,動脈纖細,動靜脈比值約1∶3;2D示2 min 22.00 s,視網膜呈彌漫熒光素滲漏
圖2
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)熒光素眼底血管造影像 2A示12.00 s,視網膜動脈充盈前鋒,血管管徑細,走形較僵直;2B示30.31 s,靜脈回流遲緩,未完全回流;2C示43.50 s,動靜脈充盈,動脈纖細,動靜脈比值約1∶3;2D示2 min 22.00 s,視網膜呈彌漫熒光素滲漏
OCT檢查發現,所有患眼黃斑區視網膜增厚及黃斑囊樣改變;視網膜中內層不同程度增厚、彌漫性反射增強,層間結構欠清晰,其下視網膜組織反射減弱(圖3)。行OCTA檢查的6只眼,視網膜淺層毛細血管叢(SCP)、深層毛細血管叢(DCP)血流密度下降;DCP血管床血流減少或中斷(圖4)。
 圖3
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)光相干斷層掃描像 黃斑區視網膜囊樣水腫伴高度隆起,細胞內水腫呈強反射信號,層間結構欠清,外層結構信號遮蔽
圖3
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼(圖1同眼)光相干斷層掃描像 黃斑區視網膜囊樣水腫伴高度隆起,細胞內水腫呈強反射信號,層間結構欠清,外層結構信號遮蔽
 圖4
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼光相干斷層掃描血管成像圖 4A、4B分別示圖1A同眼淺層、深層毛細血管叢,淺層毛細血管血流密度降低,深層毛細血管血流密度顯著降低,血流中斷
圖4
視網膜中央靜脈阻塞合并視網膜動脈阻塞患眼光相干斷層掃描血管成像圖 4A、4B分別示圖1A同眼淺層、深層毛細血管叢,淺層毛細血管血流密度降低,深層毛細血管血流密度顯著降低,血流中斷
隨訪12個月后,15只眼中,視力提高、不變、下降分別為12、2、1只眼。出現視神經萎縮5只眼。初診、末次隨訪時,BRVO-BRAO者3只眼BCVA分別為0.1、0.4、0.25和0.25、0.5、0.4; CRVO-CRAO者12只眼BCVA為光感~0.25和0.02~0.5。
3 討論
在臨床實踐中,依據視網膜血流灌注的程度,RVO被分為缺血型和非缺血型。部分非缺血型RVO患者可能會進展為缺血型。目前,臨床治療和預防缺血型RVO-ME的主要原則是預防新生血管的生成并減輕ME[5]。由于治療方法的不同,有必要區分缺血型RVO與RVO合并RAO。以下是主要的鑒別要點:(1)缺血型RVO患者可出現在任何年齡階段,通常為單眼發病,表現為視力逐漸下降,且視力多低于0.1;而RVO合并RAO主要發生在老年人群中,同樣表現為單眼發病,但其特點是急性病程,視力在幾小時到幾天內急劇下降,甚至達光感、手動或無光感,少數患者還會伴有眼痛或眼球后疼痛。視力損害的程度與缺血區域的位置有關,如果缺血區位于黃斑,則中心視力會受到嚴重影響;反之,如果缺血區遠離黃斑,則中心視力影響較小。這兩類疾病的患者都可能出現RAPD陽性。(2)眼底表現:缺血型RVO患者的視網膜靜脈顯著紆曲且擴張,視網膜內部出血呈現沿靜脈分布的“火焰狀”,或者出現廣泛的融合性出血,同時伴有嚴重的視盤和視網膜水腫以及棉絨斑。而RVO合并RAO除了表現出上述特點外,還可見視網膜動脈變細,病灶區接近視盤周圍由于毛細血管缺血閉塞而導致的神經纖維壞死,表現為視網膜水腫伴隨棉絨斑。然而,若黃斑深層毛細血管閉塞,則不會出現棉絨斑,而在OCT上則表現為層間強反射,黃斑中心凹光反射消失,也有部分患者RAO表現被掩蓋。(3)頻域OCT表現:RVO患者常顯示出黃斑區視網膜囊樣水腫增厚,以及視網膜層間的多個液性囊腔。RVO合并RAO的患者除了這些特征外,還表現出視網膜中內層不同程度的增厚、彌漫性反射增強、層間結構模糊不清,并且在病變后期會出現視網膜內層結構萎縮變薄。(4)OCTA表現:作為一項新興技術,OCTA可以無創評估視網膜和脈絡膜各層的血流狀況[6],包括SCP、DCP以及外層視網膜和脈絡膜毛細血管,同時還能精確測量黃斑中心凹無灌注區面積(FAZ)。研究表明,RVO患者的DCP血流密度顯著降低,并且與視網膜缺血的嚴重程度密切相關。DCP血流密度小于46%可能是視網膜無灌注區形成的臨界值,這可以作為RVO患者FFA檢查的一個參考指標[7]。當RVO合并RAO時,SCP和DCP的血流密度均顯著下降,提示SCP、DCP同時受損對RVO合并RAO的診斷具有重要意義[8-9]。(5)眼底血管造影表現:缺血型RVO在造影早期可觀察到出血病灶遮擋視網膜脈絡膜熒光,靜脈回流時間延長,周邊視網膜出現大片無灌注區,周圍殘留的毛細血管擴張、形成微動脈瘤等現象。而在造影晚期,視網膜靜脈管壁著染及滲漏,黃斑區呈現“花瓣樣”熒光積存。對于RVO合并RAO患者,在造影早期可見視網膜動脈充盈不足或充盈延遲,視網膜靜脈層流出現時間延遲,視網膜大靜脈不同程度逆向充盈,視網膜毛細血管充盈遲緩甚至不充盈,黃斑小動脈閉鎖,拱環結構破壞等。在造影晚期則表現為斑片狀或整個視網膜的強熒光。
對于RVO合并RAO患者的治療方案及其使用抗VEGF藥物的具體時機與時長,目前尚缺乏明確的臨床指南及相關文獻支持。在此背景下,本研究對納入的患者實施了抗VEGF藥物治療。鑒于這類疾病與單純RVO有所不同,特別是在疾病初期,視網膜循環障礙導致靜脈紆曲、擴張,靜脈分布區域因缺血缺氧而引起視網膜血管屏障破壞及視網膜色素上皮(RPE)細胞功能受損,眼底微血管病變引發滲漏,從而導致視網膜組織水腫。當病變累及黃斑時,便會導致黃斑水腫。RVO中的血管阻塞能夠引發一系列急性連鎖反應,包括視網膜缺血以及VEGF濃度水平的升高。然而,高水平的VEGF將進一步加劇視網膜缺血,并擴大無灌注區。因此,及時阻斷VEGF的分泌或降低其濃度,可以防止無灌注區的惡化,改善血液灌注并中斷這一反饋循環。在ME得到緩解后,考慮到在玻璃體內注射過程中,眼壓的一過性升高可能導致篩板處的視網膜中央動脈受壓,進一步導致動脈管壁狹窄,動脈灌注壓力下降,以及動脈痙攣,從而加重視網膜動脈栓塞的情況。因此,在治療此類疾病的過程中,本研究采用了1+按需治療的方案,并安排患者每月進行復查。此外,患者還同時口服有助于吸收眼底出血、改善眼底循環及營養神經的藥物。
RVO合并RAO的確切原因及危險因素尚未完全明確。目前,對其病因學的研究主要集中在以下幾個方面:(1)眼球解剖因素及眶內疾病:已有文獻指出,CRVO與短眼軸可能成為RAO的誘因之一[10]。青光眼患者由于鞏膜篩板的病理性凹陷,可能影響到篩板區域的中央動脈灌注及靜脈回流[11-12]。眶內相關疾病,如球后視神經炎、特發性眼眶炎性假瘤[13],由于長期的炎癥浸潤和壓迫作用,可能導致視神經及視網膜中央血管系統的受壓,從而引發血流異常。(2)全身及血液系統疾病:心血管疾病被認為是最大的危險因素之一,其次是高血壓病、糖尿病、凝血功能障礙、特定藥物使用、劇烈運動、種族和性別等因素[14]。此外,系統性紅斑狼瘡、血小板減少性紫癜、抗磷脂綜合征以及感染性心內膜炎等也被發現與此類疾病相關[15]。王文吉[3]研究發現,動脈管壁硬化后,管腔狹窄,血流速度減慢,橫截面血流量減少,RVO發生后,篩板處的中央動靜脈受擠壓,從而導致RAO的發生。(3)炎癥及腫瘤相關疾病:CRAO發生后,血管閉塞可引發血管炎癥反應加劇,視網膜動脈受累,在炎癥因子的作用下形成血栓,最終導致RAO[16-17]。有研究發現,血纖維蛋白溶酶原活性降低與脂蛋白A水平升高共同作用,可能會導致CRVO合并睫狀視網膜動脈阻塞[18]。(4)藥物使用:某些藥物的使用也可能與此類疾病有關,如β-干擾素、孕激素、內分泌替代療法藥物、抗腫瘤藥物以及疫苗等[19]。
關于RVO合并RAO的發生順序,目前尚無定論。多數研究者認為,RVO先于RAO發生。RVO發生后引起的血管回流障礙導致毛細血管阻力增加,減少了視網膜動脈的灌注,從而引發了RAO。Schmidt[20]對RVO合并RAO患者的視網膜動脈、心臟以及頸動脈進行了檢查,未發現栓子的存在,進一步表明沒有產生栓子的基礎病變。因此,他提出RVO發生后,淤血擴張的中央靜脈在篩板處對動脈施加壓力,進一步減少動脈血流,導致RAO的發生。然而,也有部分學者持不同觀點,認為RAO先于RVO發生[11, 14]。他們認為視網膜血管灌注壓下降導致視網膜循環速度減慢,進而引起了RVO。有研究通過實驗單純結扎視網膜中央靜脈并未導致RVO的發生;而當同時結扎動脈和靜脈時,則出現了相應的癥狀。基于此,這部分研究者認為RVO是在RAO之后發生的。
在臨床實踐中,如果患者表現出RVO典型的眼底特征,但BCVA與檢查結果不符,或者在RVO的治療過程中,尤其是在接受抗VEGF藥物治療后,患者視力突然再次下降,這時應考慮是否并發了RAO或其他合并癥。通過RAPD檢查、OCT的早期特征表現以及FFA等多種影像學手段,可以幫助及時確診。一旦確診為RVO合并RAO,應在評估后按照RVO與RAO同時存在的治療方案進行處理。需要密切監測病情變化,并定期復查FFA。當出現大面積無灌注區時,應及時給予激光光凝治療,包括全視網膜激光光凝(PRP)或超全PRP等,以預防新生血管性青光眼的發生。當觀察到視網膜及視神經萎縮時,應積極給予營養神經和支持性治療,盡可能挽救視功能。同時,需要對全身性疾病及相關高危因素進行全面排查,以預防受影響眼睛的病情惡化及避免其他部位的復發。
本研究的局限性在于其單中心設計、回顧性病例分析的特點以及較小的樣本量,這些因素可能導致結果出現偏差或統計上的假陰性錯誤。因此,仍需更多的臨床研究來進一步驗證本研究的發現。