引用本文: 李萍萍, 韓夢瑤, 張睿, 陳芳雨, 李艷子, 袁景, 馬寧, 李朝輝, 李璐, 吳建華. 數據非依賴性采集分析孔源性視網膜脫離合并脈絡膜脫離患者玻璃體液的蛋白質組學變化. 中華眼底病雜志, 2024, 40(10): 758-765. doi: 10.3760/cma.j.cn511434-20240528-00210 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
孔源性視網膜脫離(RRD)合并脈絡膜脫離是一種特殊類型的RRD,通常伴隨眼壓降低、嚴重葡萄膜炎和血視網膜屏障破壞,預后較差[1]。年齡、高度近視、既往眼科手術史、多處視網膜撕裂等是其發生的危險因素[2]。關于RRDCD發病機制,一種假說認為低眼壓是其始動因素,脈絡膜血管在低眼壓狀態下失去支撐而擴張,血管屏障系統遭到破壞,使得富含蛋白質的液體滲出到脈絡膜和睫狀體上腔[3-4]。另一種理論認為,視網膜脫離后引起的眼內炎癥刺激大量液體滲出至脈絡膜和睫狀體上腔促進脈絡膜脫離[5]。但RRDCD的具體發病機制及分子學特征,目前仍無明確定論。蛋白質組學本質上是指在大規模水平上研究蛋白質的特征改變,以便在蛋白質層面獲得對疾病更為全面的了解。近年發展的數據非依賴性采集(DIA)技術是將整個掃描范圍分為多個窗口,依次選擇碎裂采集所有母離子全部子離子的信息,生成更全面的二級質譜。與傳統質譜技術比較,可以有效測定復雜樣品中低豐度蛋白質,從而提高定量分析的可信度[6]。本研究采用DIA質譜技術,分析RRDCD患者玻璃體液蛋白質組學特征改變,初步探討RRDCD的可能發病機制和病理過程。現將結果報道如下。
1 對象和方法
臨床前瞻性橫斷面研究。本研究符合《赫爾辛基宣言》原則,經武漢大學附屬愛爾眼科醫院倫理委員會審批(倫理審查號:2023IRBKY120901),并取得患者書面知情同意。
1.1 對象
2021年11月至2023年12月于武漢大學附屬愛爾眼科醫院檢查確診的RRDCD患者35例(RRDCD組)和RRD患者40例(RRD組)的玻璃體液標本納入本研究。納入標準:(1)臨床檢查確診的原發性RRD和RRDCD;(2)未經任何治療;(3)隨訪時間≥6個月。排除標準:(1)眼外傷等繼發性RRD和RRDCD;(2)近期有口服糖皮質激素或眼部用藥史;(3)合并糖尿病、高血壓性視網膜病變以及年齡相關性黃斑變性;(4)既往有內眼手術史、葡萄膜炎、全身系統性疾病史者。
患者均行裂隙燈顯微鏡聯合前置鏡、最佳矯正視力(BCVA)、光相干斷層掃描、超廣角眼底成像、B型超聲、超聲生物顯微鏡檢查以及眼軸長度(AL)測量。BCVA檢查采用標準對數視力表進行,統計分析時轉換為最小分辨角對數(logMAR)視力。將眼壓<10 mm Hg(1 mm Hg=0.133kPa)定義為低眼壓。
1.2 標本制備
患者均行經睫狀體平坦部三通道23G玻璃體切割手術(PPV)。手術由同一名資深眼底病外科醫生完成。手術開始未開放眼內灌注前,切除并抽吸玻璃體液0.3~0.5 ml,移至1 ml微量離心管中,-80 °C凍存備用。1周內,簡單隨機抽樣法分別選取RRDCD組、RRD組各4例行蛋白質組學分析;酶聯免疫吸附試驗(ELISA)驗證3例。
玻璃體樣品中加入裂解液[1%脫氧膽酸鈉、100 mmol/L Tris-鹽酸緩沖液,pH=8.5;10 mmol/L三(2-羧乙基)膦、40 mmol/L乙酰丙酮鈣],60 ℃孵育30 min進行還原烷基化反應。采用Bradford法測定蛋白濃度。取等量蛋白補齊至相同體積,加入等體積去離子水,將脫氧膽酸鈉濃度稀釋至0.5%以下,按照酶與蛋白1:50加入胰蛋白酶,37 ℃孵育振蕩過夜進行酶切。次日加入三氟乙酸終止酶切,取上清進行脫鹽柱脫鹽,真空抽干后-20 ℃凍存。
1.3 質譜分析
采用美國賽默飛世爾科技公司UltiMate 3000 RSLCnano液相色譜儀和德國布魯克公司tims TOF Pro質譜儀進行質譜分析。肽段樣品經自動進樣器吸入后結合至Trap柱(75 μm × 20 mm,填料規格2 μm,100 A),洗脫至分析柱(75 μm × 250 mm,填料規格1.6 μm,100 A)進行分離。利用兩個流動相建立分析梯度。液相流速設置為300 nl/min。肽段通過Captive Spray納升離子源進入質譜進行掃描,開啟TIMS功能,采用diaPASEF掃描模式。DIA窗口在tims Control軟件中進行定義。每個掃描循環由1個MS1掃描和定義的diaPASEF掃描組成。
1.4 差異表達蛋白篩選及鑒定
篩選標準為RRDCD組與RRD組蛋白定量比值>1.5,即差異倍數>1.5和兩組樣品蛋白定量數據進行t檢驗計算所得P<0.05篩選差異蛋白。
使用Uniprot中Human的蛋白質組參考數據庫對質譜采集的原始數據進行數據庫的搜索。通過DIA-NN中的深度學習算法預測一個譜圖庫,應用預測的譜圖庫和MBR功能得到的譜圖庫對DIA原始數據進行提取,得到蛋白定量信息。最終結果以1%錯誤發現率對母離子和蛋白水平進行篩選。
1.5 ELISA驗證
采用簡單隨機抽樣方法,對鑒定出的差異蛋白進行編號。采用電腦生成的隨機數程序,隨機選取3個差異表達蛋白行ELISA驗證。
1.6 生物信息學分析
采用eggNOG-mapper軟件對差異蛋白進行基因注釋(GO)功能富集分析和京都基因與基因組百科全書(KEGG)通路顯著性富集分析。GO功能富集分析包括生物進程、細胞組分、分子功能;KEGG通路顯著性富集分析包括分子過程、外環境信息傳遞、人類疾病、新陳代謝、生物系統。分別選擇富集程度最高的21、11個條目繪制富集直方圖和氣泡圖。
1.7 統計學分析
采用SPSS26.0軟件行統計分析。計量資料以均數±標準差(x±s)表示;組間比較采用獨立樣本t檢驗和單因素方差分析。計數資料以百分率(%)表示;組間比較采用χ2檢驗。將單因素分析中P<0.05的因素納入二元logistic回歸分析。P<0.05為差異有統計學意義。
2 結果
2.1 患者臨床特征
RRDCD組、RRD組患者間年齡、性別構成比、發病時間、高度近視率、裂孔累及黃斑、裂孔位置比較,差異無統計學意義(P>0.05);眼壓、裂孔數量、視網膜脫離范圍、AL、手術后增生性玻璃體視網膜病變(PVR)發生率、一次手術復位率、手術后6個月logMAR BCVA比較,差異均有統計學意義(P<0.05)(表1)。
Logistic回歸分析結果顯示,眼壓、AL、視網膜脫離范圍、視網膜裂孔數量是RRDCD發生的獨立危險因素(表2)。
2.2 差異表達蛋白分析
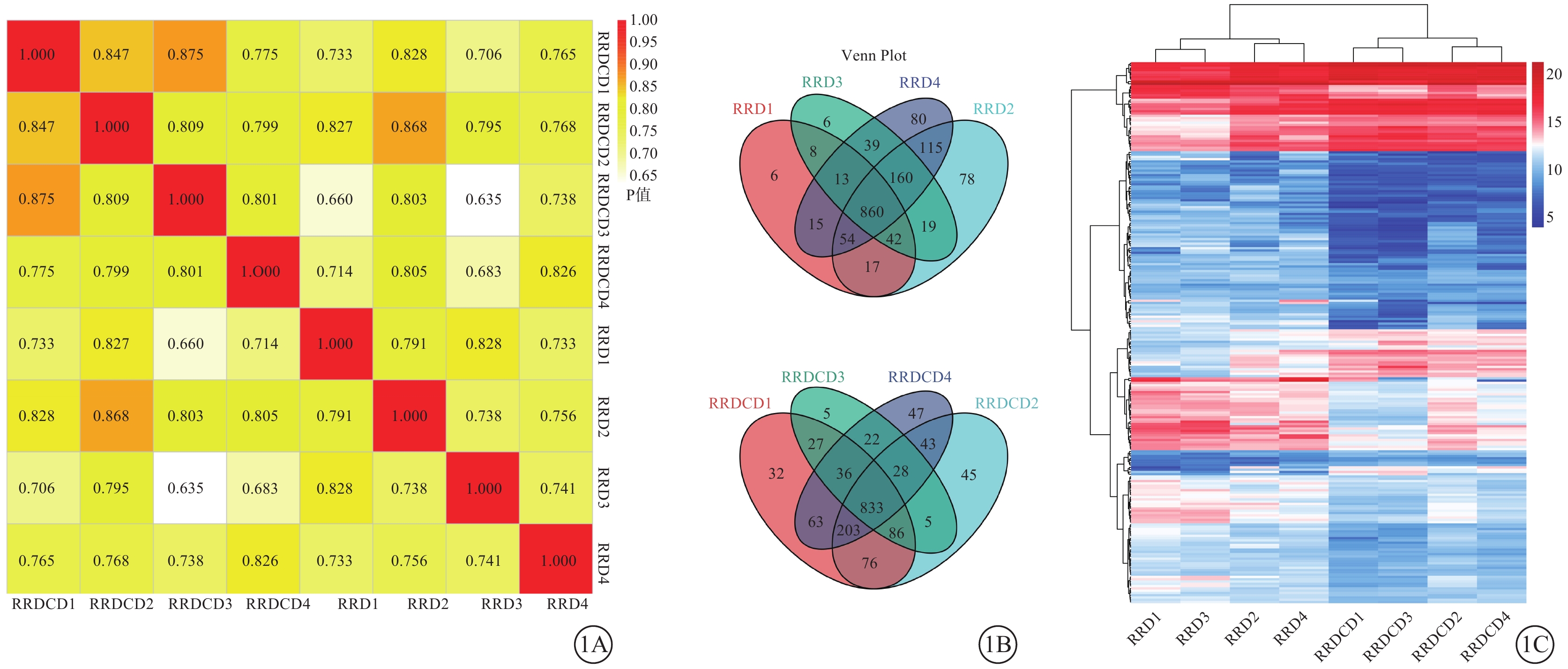
RRDCD組、RRD組樣本相關系數多數位于0.7~1.0,相關性較強,數據可重復性較高(圖1A);樣本組成相似性良好(圖1B);蛋白質表達水平具有明顯差異(圖1C)。
 圖1
RRDCD組、RRD組定量蛋白質組學分析
圖1
RRDCD組、RRD組定量蛋白質組學分析
1A示兩組差異蛋白Pearson相關系數;1B示兩組樣本中所含蛋白質定量韋恩圖,上圖、下圖分別代表RRD組、RRDCD組蛋白質數量;1C示兩組差異蛋白聚類熱圖,紅色越深表示差異表達蛋白表達水平越高,藍色越深表示差異表達蛋白表達水平越低 RRD:孔源性視網膜脫離;RRDCD:RRD合并脈絡膜脫離
RRDCD組、RRD組玻璃體液標本中蛋白質濃度分別為(5.84±1.12)、(2.36±1.96)μg/μl,差異有統計學意義(t=3.083,P=0.01)。兩組間共篩選出237個差異表達蛋白,其中上調、下調蛋白分別為63、174個。排名前10的上調蛋白為α-胰蛋白酶抑制劑(ITHI1)、載脂蛋白L1、血清淀粉樣蛋白(SAA4)、分泌型磷蛋白、玻連蛋白(VTN)等;下調蛋白為二甲基精氨酸二甲胺水解酶、粘附G蛋白偶聯受體、組蛋白酶H等(表3)。
2.3 ELISA驗證質譜結果的可靠性
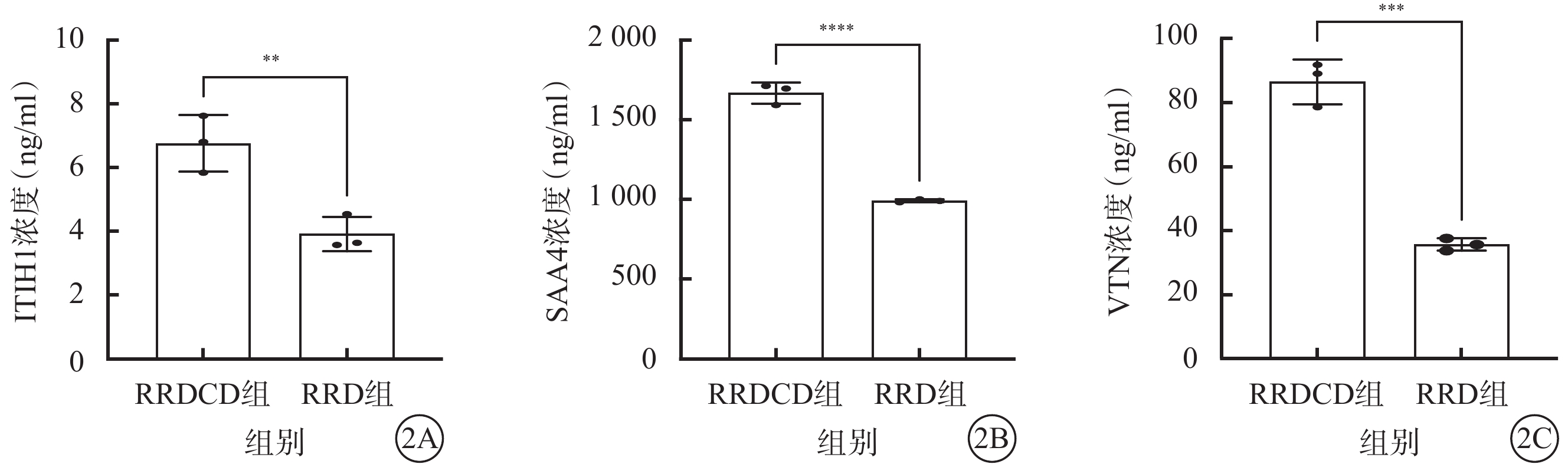
ELISA驗證結果顯示,隨機選取的3個差異表達蛋白在RRDCD組和RRD之間的表達變化趨勢均與DIA質譜分析結果一致(圖2)。
 圖2
隨機選擇的3個差異表達蛋白的ELISA驗證結果(n=3)
圖2
隨機選擇的3個差異表達蛋白的ELISA驗證結果(n=3)
2A~2C分別示ITHI1、SAA4、VTN,**
2.4 生物信息學分析
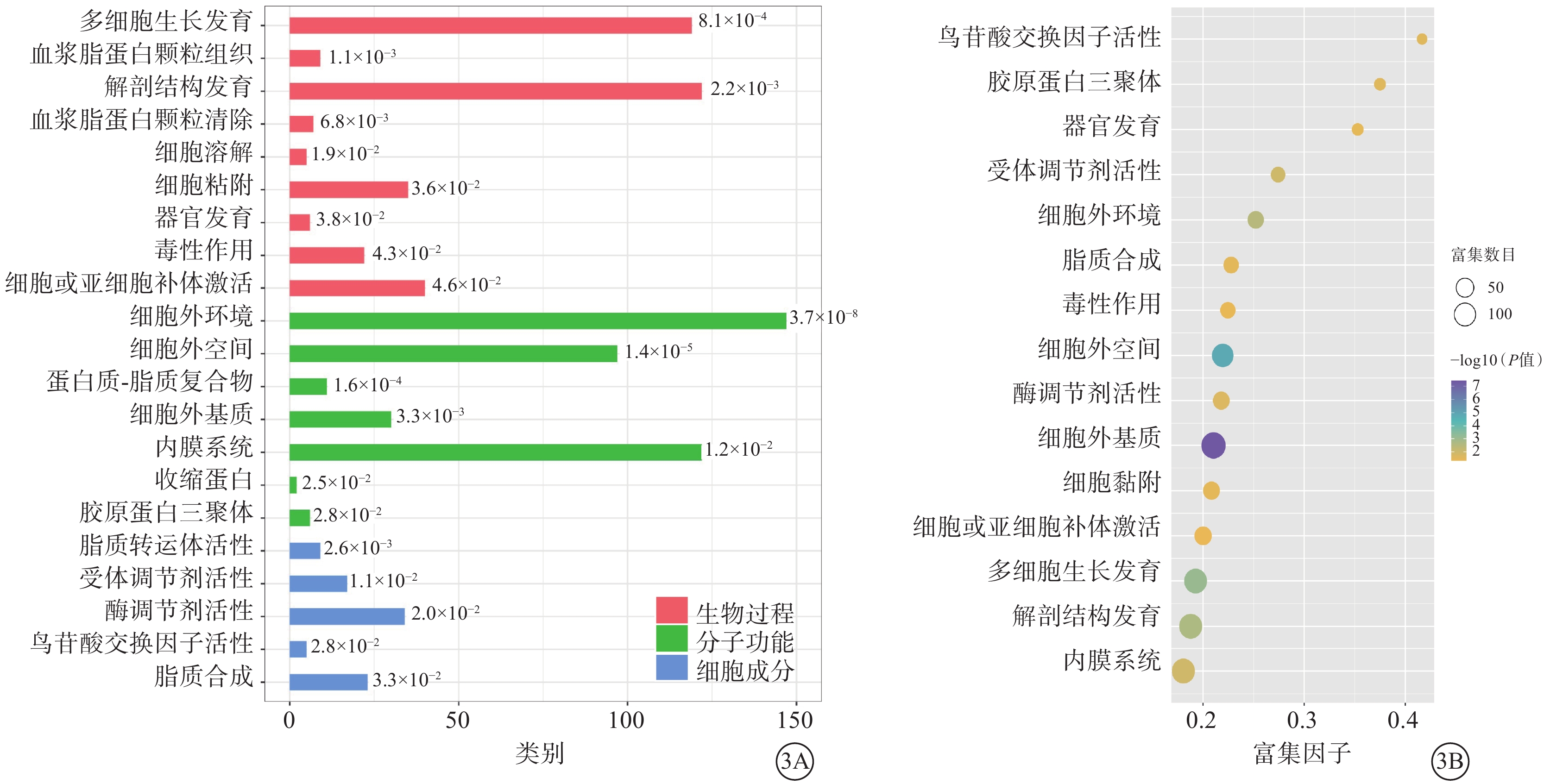
GO功能富集分析結果顯示,237個差異表達蛋白與不同的生物學進程、分子功能和細胞組分有關。生物進程方面,差異表達蛋白顯著富集在多細胞生物發育、血漿脂蛋白顆粒組織及清除、解剖結構發育等;分子功能方面,差異表達蛋白顯著富集在細胞外環境、基質、蛋白質-脂質復合物、內膜系統等;細胞成分方面,差異表達蛋白顯著富集在脂質轉運體活性、受體調節劑活性、酶調節劑活性等(圖3)。與RRD組比較,RRDCD組差異表達蛋白顯著富集于生物及細胞黏附、補體激活、細胞收縮、脂質代謝過程相關蛋白質。這些蛋白質主要分布在細胞膜、細胞基質和細胞外環境中。
 圖3
GO功能富集分析結果圖
圖3
GO功能富集分析結果圖
3A示直方圖,柱線代表富集GO條目的
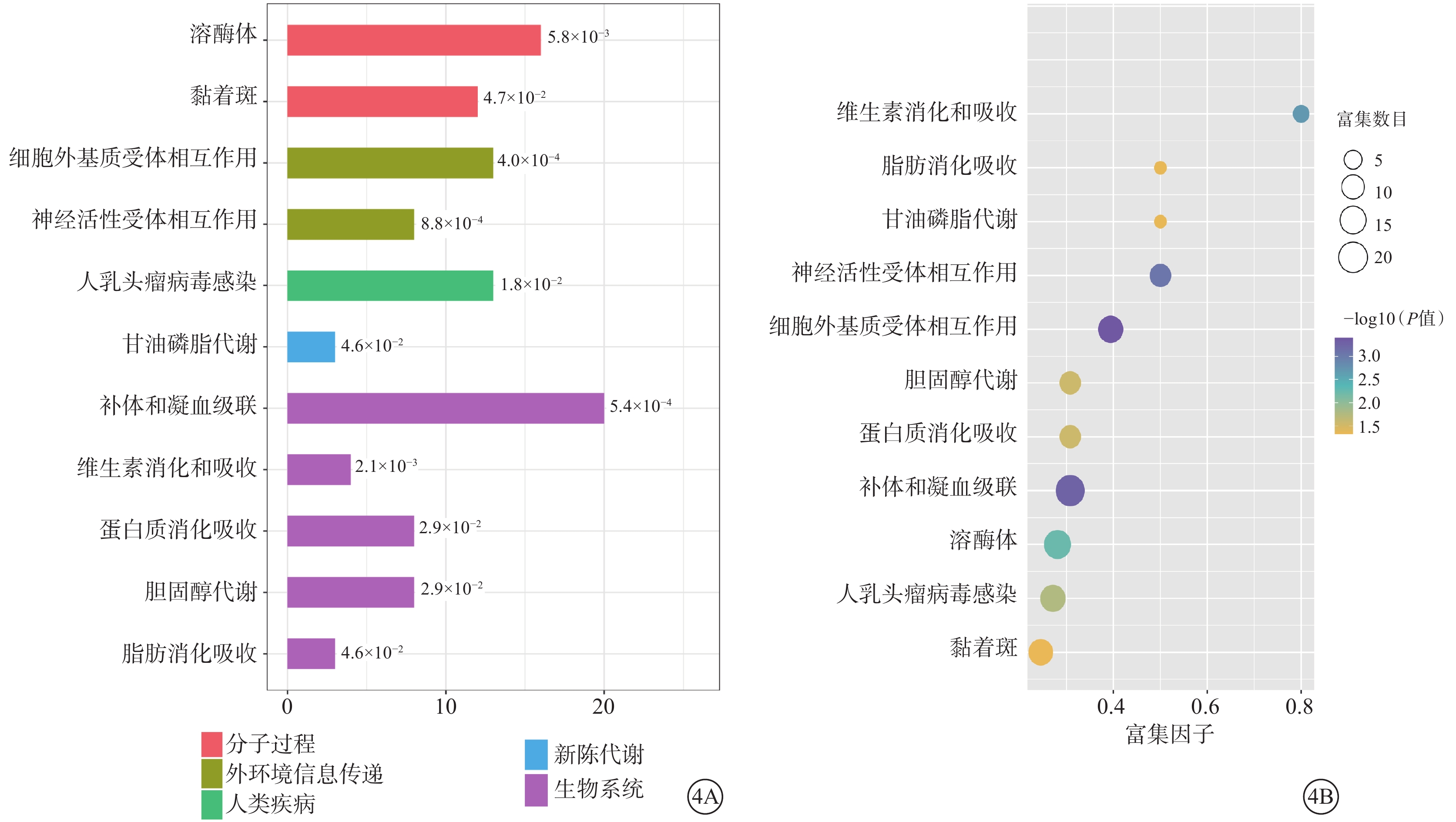
KEGG信號通路富集分析結果顯示,237個差異蛋白富集于11條代謝通路(圖4,表4)。其中,20個差異表達蛋白富集于補體和凝血級聯通路;16個差異表達蛋白富集于溶酶體通路;13個差異表達蛋白富集于細胞外環境-受體相互作用和人乳頭瘤病毒感染通路。
 圖4
KEGG信號通路富集分析結果圖
圖4
KEGG信號通路富集分析結果圖
4A示直方圖,柱線代表富集通路KEGG條目的
3 討論
目前蛋白質組學研究主要針對PVR、年齡相關性黃斑變性和糖尿病視網膜病變,而對于RRDCD研究則相對較少。既往研究發現,相較于視網膜前膜,RRDCD患者玻璃體液中鑒定出249種差異表達蛋白,上調蛋白主要涉及炎癥及補體免疫反應[7]。本研究采用精確度更高的DIA質譜技術鑒定RRD、RRDCD患者玻璃體液中蛋白質表達變化,共發現237種差異表達蛋白,其中上調、下調蛋白分別為63、174種。具有差異表達的蛋白質與細胞遷移、補體成分和細胞黏附等生物過程相關;通路富集分析發現,補體與凝血級聯、溶酶體通路和細胞外基質(ECM)重塑在RRDCD發揮重要作用。ELISA證實VTN、ITHI1、SAA4水平上調,與DIA蛋白質組學結果一致。
既往研究發現,RRDCD中炎癥和免疫反應促進補體成分激活,引起視網膜血管通透性增加,誘發血管損傷和細胞增殖[8]。本研究發現,補體 C3、C5、C6、C8、補體因子H和B等補體相關蛋白在RRDCD組中顯著上調。補體系統是體液免疫反應的主要組成部分,參與調節、炎癥、溶解和免疫復合物的清除,激活后促進細胞吞噬、趨化和免疫黏附過程[9-10]。此外,凝血相關蛋白,凝血因子1、2、10、12,纖維蛋白原A2,抗纖溶酶和激肽釋放酶在RRDCD組中顯著富集。這可能由于視網膜神經感覺層和視網膜色素上皮層物理分離創造了一個缺血環境,導致光感受器和神經元死亡,造成血視網膜屏障破壞,大量血漿蛋白滲出到玻璃體腔[11]。多種促炎因子如SAA4、胰蛋白酶抑制劑等多在RRDCD組中高表達,補體介導的炎癥過程中產生的促炎因子可以上調血管內皮細胞表達,且血管內皮細胞具有啟動、激活、放大及調控補體及凝血過程的作用,兩者相互促進,最終加重RRDCD患者的炎癥反應和凝血異常,造成組織進一步損傷[12]。
本研究首次分析了溶酶體相關通路和ECM紊亂對RRDCD的影響。溶酶體是維持細胞穩態和代謝平衡的關鍵調節劑,溶酶體通過內吞、吞噬和自噬等作用參與大分子的循環和清除,在組織分泌、細胞信號傳導、基因調控、細胞黏附等過程發揮作用[13]。既往研究發現,溶酶體蛋白功能異常對細胞生長及發育造成不良影響[14-15]。本研究觀察到RRDCD患者組蛋白V顯著下調。組蛋白V是一種溶酶體半胱氨酸蛋白酶,主要存在于角膜、胸腺和皮膚等組織[16-17]。既往研究表明,組蛋白V在角膜新生血管調節中發揮重要作用,并顯示出抗血管生成的特性[18-19]。RRDCD患者組蛋白V下調可能促進新生血管形成,加劇血視網膜屏障的破壞。組蛋白V與彈性蛋白的細胞內降解有關,組蛋白V水平降低可破壞蛋白質水解過程,導致物質在組織內積聚并加劇物質從血管內的滲出,導致大量視網膜下液[20-21]。此外,與溶酶體硫酸化相關的艾杜糖酸2-硫酸酯酶、N-乙酰半乳糖胺-6-硫酸酯酶、α-L-艾杜糖酸酶以及溶酶體α-葡萄糖苷酶在RRDCD組中顯著下調,使得葡萄糖攝取和糖酵解破壞,能量來源減少,視網膜代謝活性減弱,進一步加重光感受器細胞死亡、視網膜細胞損傷以及血視網膜屏障的破壞[22-23]。
ECM是提供細胞所需的物理支撐,并通過信號傳導影響細胞功能、形態和遷移[24-25]。ECM成分與特定細胞表面受體(如整合素、黏附素)之間相互作用促進信號傳導,引發各種細胞反應。既往研究發現絡絲蛋白(RELN)在視網膜形成過程中富集在視網膜神經節細胞(RGC)的軸突,參與視覺通路的突觸連接[26]。RRDCD組RELN的缺乏可能使得RGC結構缺陷,導致視覺信號傳輸中斷。此外,本研究發現,RRDCD組大量膠原蛋白表達異常。膠原蛋白下調和突變會導致轉化生長因子(TGF)-β信號傳導通路失調[27]。TGF-β信號通路主要調節細胞生長和增殖,細胞過度增殖造成組織纖維化,這解釋了RRDCD患者大量視網膜下膜和纖維膜的原因。各種膠原蛋白的非膠原體(NC)結構域與血管生成有關[28],如膠原蛋白Ⅳ的α1、α2、α3、α6鏈的NC1結構域可以通過蛋白水解釋放,從而抑制血管生成[29-30]。膠原蛋白下調明顯削弱了其抗血管作用。此外,膠原蛋白可以穿透玻璃體基底部視網膜內界膜,在黃斑和后極部表面與視網膜交聯,穩定視網膜結構[31]。膠原蛋白下調與RRDCD更大范圍的視網膜脫離和視網膜裂孔相關,膠原蛋白的減少使得組織間的黏附力減小,導致視網膜撕裂和脫離。
本研究存在的局限性與不足是研究主要采用玻璃體液進行蛋白質組學分析,因客觀條件限制無法納入正常視網膜組織進行研究。雖然玻璃體液和視網膜層間存在細胞的直接接觸和物質交換,但通過玻璃體液進行蛋白質組學分析所識別的蛋白質僅部分反映了視網膜神經元的生物變化。
本研究探討了RRDCD發生的獨立危險因素,并進一步分析了RRDCD患者玻璃體液的蛋白質組學變化,證實補體與凝血級聯激活與RRDCD的相關性,并首次提出RRDCD患者ECM重塑和溶酶體結構的改變也與疾病發生發展密切相關,為進一步闡明RRDCD的發病機制及干預策略提供了可能的新方向。
孔源性視網膜脫離(RRD)合并脈絡膜脫離是一種特殊類型的RRD,通常伴隨眼壓降低、嚴重葡萄膜炎和血視網膜屏障破壞,預后較差[1]。年齡、高度近視、既往眼科手術史、多處視網膜撕裂等是其發生的危險因素[2]。關于RRDCD發病機制,一種假說認為低眼壓是其始動因素,脈絡膜血管在低眼壓狀態下失去支撐而擴張,血管屏障系統遭到破壞,使得富含蛋白質的液體滲出到脈絡膜和睫狀體上腔[3-4]。另一種理論認為,視網膜脫離后引起的眼內炎癥刺激大量液體滲出至脈絡膜和睫狀體上腔促進脈絡膜脫離[5]。但RRDCD的具體發病機制及分子學特征,目前仍無明確定論。蛋白質組學本質上是指在大規模水平上研究蛋白質的特征改變,以便在蛋白質層面獲得對疾病更為全面的了解。近年發展的數據非依賴性采集(DIA)技術是將整個掃描范圍分為多個窗口,依次選擇碎裂采集所有母離子全部子離子的信息,生成更全面的二級質譜。與傳統質譜技術比較,可以有效測定復雜樣品中低豐度蛋白質,從而提高定量分析的可信度[6]。本研究采用DIA質譜技術,分析RRDCD患者玻璃體液蛋白質組學特征改變,初步探討RRDCD的可能發病機制和病理過程。現將結果報道如下。
1 對象和方法
臨床前瞻性橫斷面研究。本研究符合《赫爾辛基宣言》原則,經武漢大學附屬愛爾眼科醫院倫理委員會審批(倫理審查號:2023IRBKY120901),并取得患者書面知情同意。
1.1 對象
2021年11月至2023年12月于武漢大學附屬愛爾眼科醫院檢查確診的RRDCD患者35例(RRDCD組)和RRD患者40例(RRD組)的玻璃體液標本納入本研究。納入標準:(1)臨床檢查確診的原發性RRD和RRDCD;(2)未經任何治療;(3)隨訪時間≥6個月。排除標準:(1)眼外傷等繼發性RRD和RRDCD;(2)近期有口服糖皮質激素或眼部用藥史;(3)合并糖尿病、高血壓性視網膜病變以及年齡相關性黃斑變性;(4)既往有內眼手術史、葡萄膜炎、全身系統性疾病史者。
患者均行裂隙燈顯微鏡聯合前置鏡、最佳矯正視力(BCVA)、光相干斷層掃描、超廣角眼底成像、B型超聲、超聲生物顯微鏡檢查以及眼軸長度(AL)測量。BCVA檢查采用標準對數視力表進行,統計分析時轉換為最小分辨角對數(logMAR)視力。將眼壓<10 mm Hg(1 mm Hg=0.133kPa)定義為低眼壓。
1.2 標本制備
患者均行經睫狀體平坦部三通道23G玻璃體切割手術(PPV)。手術由同一名資深眼底病外科醫生完成。手術開始未開放眼內灌注前,切除并抽吸玻璃體液0.3~0.5 ml,移至1 ml微量離心管中,-80 °C凍存備用。1周內,簡單隨機抽樣法分別選取RRDCD組、RRD組各4例行蛋白質組學分析;酶聯免疫吸附試驗(ELISA)驗證3例。
玻璃體樣品中加入裂解液[1%脫氧膽酸鈉、100 mmol/L Tris-鹽酸緩沖液,pH=8.5;10 mmol/L三(2-羧乙基)膦、40 mmol/L乙酰丙酮鈣],60 ℃孵育30 min進行還原烷基化反應。采用Bradford法測定蛋白濃度。取等量蛋白補齊至相同體積,加入等體積去離子水,將脫氧膽酸鈉濃度稀釋至0.5%以下,按照酶與蛋白1:50加入胰蛋白酶,37 ℃孵育振蕩過夜進行酶切。次日加入三氟乙酸終止酶切,取上清進行脫鹽柱脫鹽,真空抽干后-20 ℃凍存。
1.3 質譜分析
采用美國賽默飛世爾科技公司UltiMate 3000 RSLCnano液相色譜儀和德國布魯克公司tims TOF Pro質譜儀進行質譜分析。肽段樣品經自動進樣器吸入后結合至Trap柱(75 μm × 20 mm,填料規格2 μm,100 A),洗脫至分析柱(75 μm × 250 mm,填料規格1.6 μm,100 A)進行分離。利用兩個流動相建立分析梯度。液相流速設置為300 nl/min。肽段通過Captive Spray納升離子源進入質譜進行掃描,開啟TIMS功能,采用diaPASEF掃描模式。DIA窗口在tims Control軟件中進行定義。每個掃描循環由1個MS1掃描和定義的diaPASEF掃描組成。
1.4 差異表達蛋白篩選及鑒定
篩選標準為RRDCD組與RRD組蛋白定量比值>1.5,即差異倍數>1.5和兩組樣品蛋白定量數據進行t檢驗計算所得P<0.05篩選差異蛋白。
使用Uniprot中Human的蛋白質組參考數據庫對質譜采集的原始數據進行數據庫的搜索。通過DIA-NN中的深度學習算法預測一個譜圖庫,應用預測的譜圖庫和MBR功能得到的譜圖庫對DIA原始數據進行提取,得到蛋白定量信息。最終結果以1%錯誤發現率對母離子和蛋白水平進行篩選。
1.5 ELISA驗證
采用簡單隨機抽樣方法,對鑒定出的差異蛋白進行編號。采用電腦生成的隨機數程序,隨機選取3個差異表達蛋白行ELISA驗證。
1.6 生物信息學分析
采用eggNOG-mapper軟件對差異蛋白進行基因注釋(GO)功能富集分析和京都基因與基因組百科全書(KEGG)通路顯著性富集分析。GO功能富集分析包括生物進程、細胞組分、分子功能;KEGG通路顯著性富集分析包括分子過程、外環境信息傳遞、人類疾病、新陳代謝、生物系統。分別選擇富集程度最高的21、11個條目繪制富集直方圖和氣泡圖。
1.7 統計學分析
采用SPSS26.0軟件行統計分析。計量資料以均數±標準差(x±s)表示;組間比較采用獨立樣本t檢驗和單因素方差分析。計數資料以百分率(%)表示;組間比較采用χ2檢驗。將單因素分析中P<0.05的因素納入二元logistic回歸分析。P<0.05為差異有統計學意義。
2 結果
2.1 患者臨床特征
RRDCD組、RRD組患者間年齡、性別構成比、發病時間、高度近視率、裂孔累及黃斑、裂孔位置比較,差異無統計學意義(P>0.05);眼壓、裂孔數量、視網膜脫離范圍、AL、手術后增生性玻璃體視網膜病變(PVR)發生率、一次手術復位率、手術后6個月logMAR BCVA比較,差異均有統計學意義(P<0.05)(表1)。
Logistic回歸分析結果顯示,眼壓、AL、視網膜脫離范圍、視網膜裂孔數量是RRDCD發生的獨立危險因素(表2)。
2.2 差異表達蛋白分析
RRDCD組、RRD組樣本相關系數多數位于0.7~1.0,相關性較強,數據可重復性較高(圖1A);樣本組成相似性良好(圖1B);蛋白質表達水平具有明顯差異(圖1C)。
 圖1
RRDCD組、RRD組定量蛋白質組學分析
圖1
RRDCD組、RRD組定量蛋白質組學分析
1A示兩組差異蛋白Pearson相關系數;1B示兩組樣本中所含蛋白質定量韋恩圖,上圖、下圖分別代表RRD組、RRDCD組蛋白質數量;1C示兩組差異蛋白聚類熱圖,紅色越深表示差異表達蛋白表達水平越高,藍色越深表示差異表達蛋白表達水平越低 RRD:孔源性視網膜脫離;RRDCD:RRD合并脈絡膜脫離
RRDCD組、RRD組玻璃體液標本中蛋白質濃度分別為(5.84±1.12)、(2.36±1.96)μg/μl,差異有統計學意義(t=3.083,P=0.01)。兩組間共篩選出237個差異表達蛋白,其中上調、下調蛋白分別為63、174個。排名前10的上調蛋白為α-胰蛋白酶抑制劑(ITHI1)、載脂蛋白L1、血清淀粉樣蛋白(SAA4)、分泌型磷蛋白、玻連蛋白(VTN)等;下調蛋白為二甲基精氨酸二甲胺水解酶、粘附G蛋白偶聯受體、組蛋白酶H等(表3)。
2.3 ELISA驗證質譜結果的可靠性
ELISA驗證結果顯示,隨機選取的3個差異表達蛋白在RRDCD組和RRD之間的表達變化趨勢均與DIA質譜分析結果一致(圖2)。
 圖2
隨機選擇的3個差異表達蛋白的ELISA驗證結果(n=3)
圖2
隨機選擇的3個差異表達蛋白的ELISA驗證結果(n=3)
2A~2C分別示ITHI1、SAA4、VTN,**
2.4 生物信息學分析
GO功能富集分析結果顯示,237個差異表達蛋白與不同的生物學進程、分子功能和細胞組分有關。生物進程方面,差異表達蛋白顯著富集在多細胞生物發育、血漿脂蛋白顆粒組織及清除、解剖結構發育等;分子功能方面,差異表達蛋白顯著富集在細胞外環境、基質、蛋白質-脂質復合物、內膜系統等;細胞成分方面,差異表達蛋白顯著富集在脂質轉運體活性、受體調節劑活性、酶調節劑活性等(圖3)。與RRD組比較,RRDCD組差異表達蛋白顯著富集于生物及細胞黏附、補體激活、細胞收縮、脂質代謝過程相關蛋白質。這些蛋白質主要分布在細胞膜、細胞基質和細胞外環境中。
 圖3
GO功能富集分析結果圖
圖3
GO功能富集分析結果圖
3A示直方圖,柱線代表富集GO條目的
KEGG信號通路富集分析結果顯示,237個差異蛋白富集于11條代謝通路(圖4,表4)。其中,20個差異表達蛋白富集于補體和凝血級聯通路;16個差異表達蛋白富集于溶酶體通路;13個差異表達蛋白富集于細胞外環境-受體相互作用和人乳頭瘤病毒感染通路。
 圖4
KEGG信號通路富集分析結果圖
圖4
KEGG信號通路富集分析結果圖
4A示直方圖,柱線代表富集通路KEGG條目的
3 討論
目前蛋白質組學研究主要針對PVR、年齡相關性黃斑變性和糖尿病視網膜病變,而對于RRDCD研究則相對較少。既往研究發現,相較于視網膜前膜,RRDCD患者玻璃體液中鑒定出249種差異表達蛋白,上調蛋白主要涉及炎癥及補體免疫反應[7]。本研究采用精確度更高的DIA質譜技術鑒定RRD、RRDCD患者玻璃體液中蛋白質表達變化,共發現237種差異表達蛋白,其中上調、下調蛋白分別為63、174種。具有差異表達的蛋白質與細胞遷移、補體成分和細胞黏附等生物過程相關;通路富集分析發現,補體與凝血級聯、溶酶體通路和細胞外基質(ECM)重塑在RRDCD發揮重要作用。ELISA證實VTN、ITHI1、SAA4水平上調,與DIA蛋白質組學結果一致。
既往研究發現,RRDCD中炎癥和免疫反應促進補體成分激活,引起視網膜血管通透性增加,誘發血管損傷和細胞增殖[8]。本研究發現,補體 C3、C5、C6、C8、補體因子H和B等補體相關蛋白在RRDCD組中顯著上調。補體系統是體液免疫反應的主要組成部分,參與調節、炎癥、溶解和免疫復合物的清除,激活后促進細胞吞噬、趨化和免疫黏附過程[9-10]。此外,凝血相關蛋白,凝血因子1、2、10、12,纖維蛋白原A2,抗纖溶酶和激肽釋放酶在RRDCD組中顯著富集。這可能由于視網膜神經感覺層和視網膜色素上皮層物理分離創造了一個缺血環境,導致光感受器和神經元死亡,造成血視網膜屏障破壞,大量血漿蛋白滲出到玻璃體腔[11]。多種促炎因子如SAA4、胰蛋白酶抑制劑等多在RRDCD組中高表達,補體介導的炎癥過程中產生的促炎因子可以上調血管內皮細胞表達,且血管內皮細胞具有啟動、激活、放大及調控補體及凝血過程的作用,兩者相互促進,最終加重RRDCD患者的炎癥反應和凝血異常,造成組織進一步損傷[12]。
本研究首次分析了溶酶體相關通路和ECM紊亂對RRDCD的影響。溶酶體是維持細胞穩態和代謝平衡的關鍵調節劑,溶酶體通過內吞、吞噬和自噬等作用參與大分子的循環和清除,在組織分泌、細胞信號傳導、基因調控、細胞黏附等過程發揮作用[13]。既往研究發現,溶酶體蛋白功能異常對細胞生長及發育造成不良影響[14-15]。本研究觀察到RRDCD患者組蛋白V顯著下調。組蛋白V是一種溶酶體半胱氨酸蛋白酶,主要存在于角膜、胸腺和皮膚等組織[16-17]。既往研究表明,組蛋白V在角膜新生血管調節中發揮重要作用,并顯示出抗血管生成的特性[18-19]。RRDCD患者組蛋白V下調可能促進新生血管形成,加劇血視網膜屏障的破壞。組蛋白V與彈性蛋白的細胞內降解有關,組蛋白V水平降低可破壞蛋白質水解過程,導致物質在組織內積聚并加劇物質從血管內的滲出,導致大量視網膜下液[20-21]。此外,與溶酶體硫酸化相關的艾杜糖酸2-硫酸酯酶、N-乙酰半乳糖胺-6-硫酸酯酶、α-L-艾杜糖酸酶以及溶酶體α-葡萄糖苷酶在RRDCD組中顯著下調,使得葡萄糖攝取和糖酵解破壞,能量來源減少,視網膜代謝活性減弱,進一步加重光感受器細胞死亡、視網膜細胞損傷以及血視網膜屏障的破壞[22-23]。
ECM是提供細胞所需的物理支撐,并通過信號傳導影響細胞功能、形態和遷移[24-25]。ECM成分與特定細胞表面受體(如整合素、黏附素)之間相互作用促進信號傳導,引發各種細胞反應。既往研究發現絡絲蛋白(RELN)在視網膜形成過程中富集在視網膜神經節細胞(RGC)的軸突,參與視覺通路的突觸連接[26]。RRDCD組RELN的缺乏可能使得RGC結構缺陷,導致視覺信號傳輸中斷。此外,本研究發現,RRDCD組大量膠原蛋白表達異常。膠原蛋白下調和突變會導致轉化生長因子(TGF)-β信號傳導通路失調[27]。TGF-β信號通路主要調節細胞生長和增殖,細胞過度增殖造成組織纖維化,這解釋了RRDCD患者大量視網膜下膜和纖維膜的原因。各種膠原蛋白的非膠原體(NC)結構域與血管生成有關[28],如膠原蛋白Ⅳ的α1、α2、α3、α6鏈的NC1結構域可以通過蛋白水解釋放,從而抑制血管生成[29-30]。膠原蛋白下調明顯削弱了其抗血管作用。此外,膠原蛋白可以穿透玻璃體基底部視網膜內界膜,在黃斑和后極部表面與視網膜交聯,穩定視網膜結構[31]。膠原蛋白下調與RRDCD更大范圍的視網膜脫離和視網膜裂孔相關,膠原蛋白的減少使得組織間的黏附力減小,導致視網膜撕裂和脫離。
本研究存在的局限性與不足是研究主要采用玻璃體液進行蛋白質組學分析,因客觀條件限制無法納入正常視網膜組織進行研究。雖然玻璃體液和視網膜層間存在細胞的直接接觸和物質交換,但通過玻璃體液進行蛋白質組學分析所識別的蛋白質僅部分反映了視網膜神經元的生物變化。
本研究探討了RRDCD發生的獨立危險因素,并進一步分析了RRDCD患者玻璃體液的蛋白質組學變化,證實補體與凝血級聯激活與RRDCD的相關性,并首次提出RRDCD患者ECM重塑和溶酶體結構的改變也與疾病發生發展密切相關,為進一步闡明RRDCD的發病機制及干預策略提供了可能的新方向。