引用本文: 林媛媛, 宮媛媛. 巨細胞病毒感染致黃斑中心凹壞死及黃斑裂孔1例. 中華眼底病雜志, 2024, 40(12): 960-962. doi: 10.3760/cma.j.cn511434-20240724-00280 復制
版權信息: ?四川大學華西醫院華西期刊社《中華眼底病雜志》版權所有,未經授權不得轉載、改編
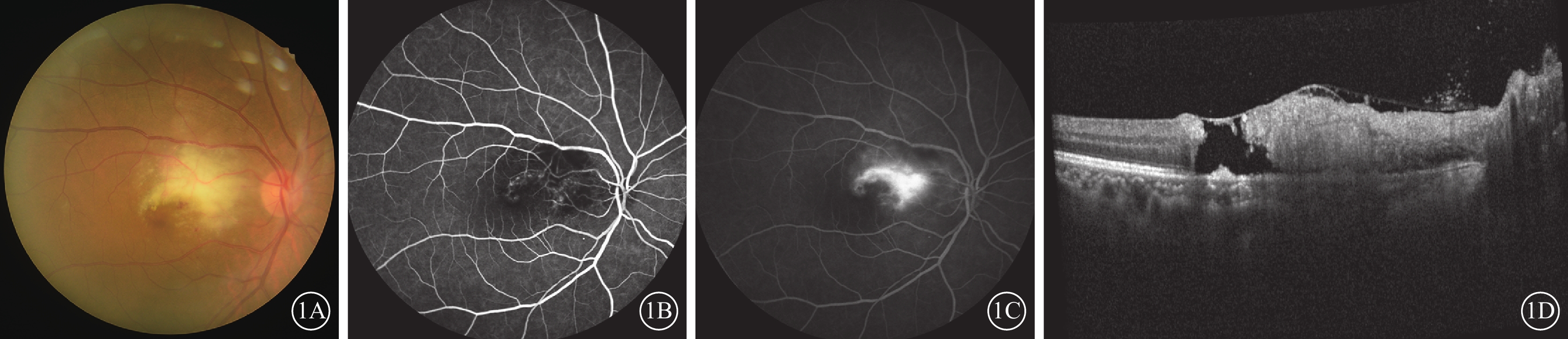
患者女,68歲。因右眼無痛性視力下降伴黑影遮擋20 d,于2023年3月4日至上海交通大學醫學院附屬第一人民醫院眼科就診。患者曾于2023年2月15日在外院診斷為“玻璃體混濁”,給予口服普羅碘銨、胰激肽酶原治療無明顯好轉。患者有糖尿病病史8年余,口服格列美脲,空腹血糖控制在6~7 mmol/L之間。否認高血壓、冠心病、惡性腫瘤等病史,否認高度近視、眼部外傷、眼部手術及家族史。患者曾于2022年11月因面部皮疹伴雙手Gottron丘疹2周在外院就診,診斷為“皮肌炎、間質性肺炎”,口服潑尼松龍(40 mg/d)、他克莫司(1 mg/次,2次/d)、托法替布(5 mg/次,2次/d),藥物劑量隨全身病情變化調整。眼科檢查:右眼、左眼視力分別為0.1、0.8。右眼、左眼眼壓分別為17、18 mm Hg(1 mm Hg=0.133 kPa)。右眼晶狀體混濁,玻璃體腔少量點狀混濁。眼底檢查,右眼黃斑中心凹片狀黃白色病灶伴個別小點狀出血(圖1A)。熒光素眼底血管造影(FFA)檢查,右眼早期黃斑中心持續弱熒光病灶(圖1B);中晚期黃斑旁中心呈不規則強熒光素滲漏(圖1C)。光相干斷層掃描(OCT)檢查,右眼黃斑中心凹玻璃體視網膜界面少量聚集的玻璃體細胞;黃斑略增厚,層間結構紊亂,中心形成裂孔,內界膜殘留;外層橢圓體帶中斷消失(圖1D)。左眼眼前節及眼底檢查未見明顯異常。實驗室檢查:巨細胞病毒(CMV)-免疫球蛋白(Ig)G>500 U/ml,風疹病毒IgG40 IU/ml。右眼前房穿刺抽取房水檢測,CMV-DNA陽性,白細胞介素(IL)-8 為75.9 pg/ml。診斷:右眼CMV視網膜炎(壞死型)(CMVR)、右眼黃斑裂孔。給予患者全身及局部抗病毒治療,靜脈注射更昔洛韋(250 mg/次,2次/d),持續5 d后改為口服伐昔洛韋(0.3 g/次,2次/d),患者后因胃腸道不適,自行改為0.15 g/次,2次/d;同時玻璃體腔注射更昔洛韋3 mg/次,2次/周,根據眼底變化,1個月后改為1次/周。
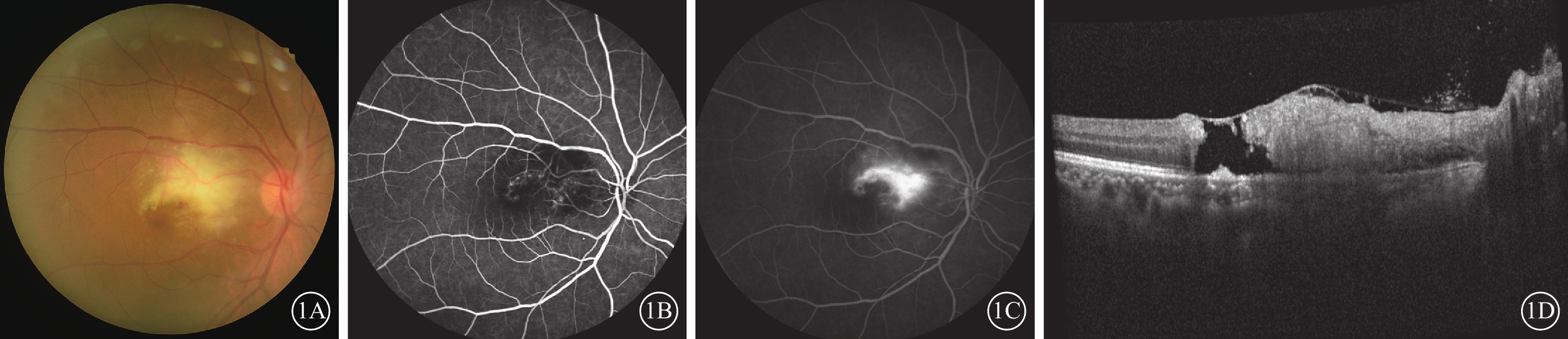 圖1
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者初診右眼眼部檢查像
圖1
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者初診右眼眼部檢查像
1A示彩色眼底像,黃斑中心凹黃白色病灶伴個別小點狀出血。1B、1C分別示熒光素眼底血管造影早期、晚期像,早期黃斑中心持續弱熒光病灶;晚期黃斑旁中心呈不規則強熒光滲漏。1D示光相干斷層掃描像,黃斑中心凹玻璃體視網膜界面可見少量炎性混濁附著;黃斑略增厚,結構紊亂,中心組織缺失形成裂孔,殘留內界膜,外層橢圓體帶中斷
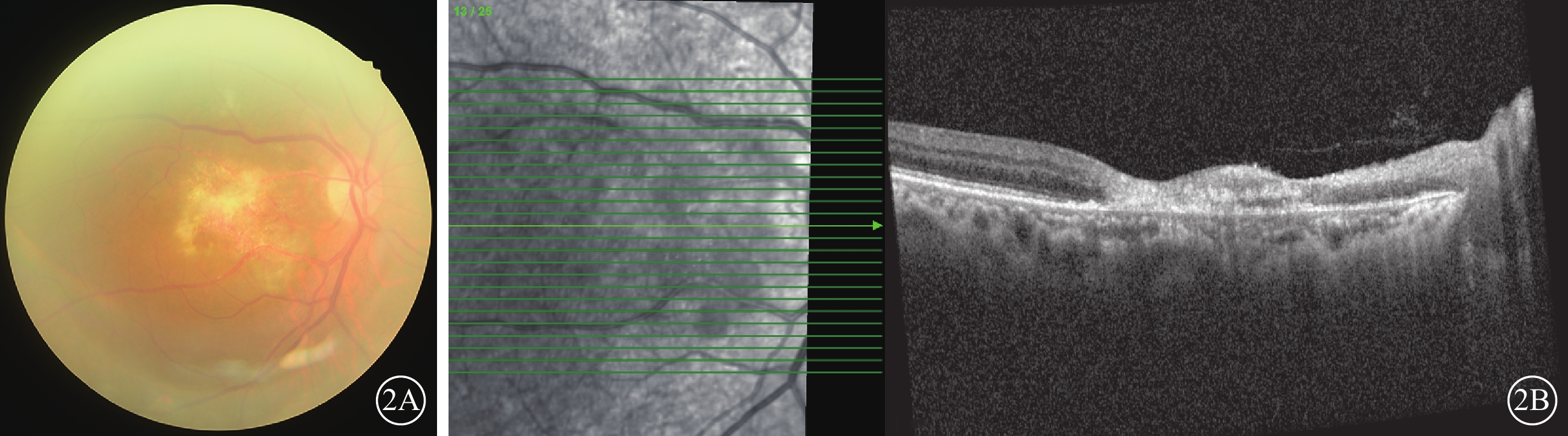
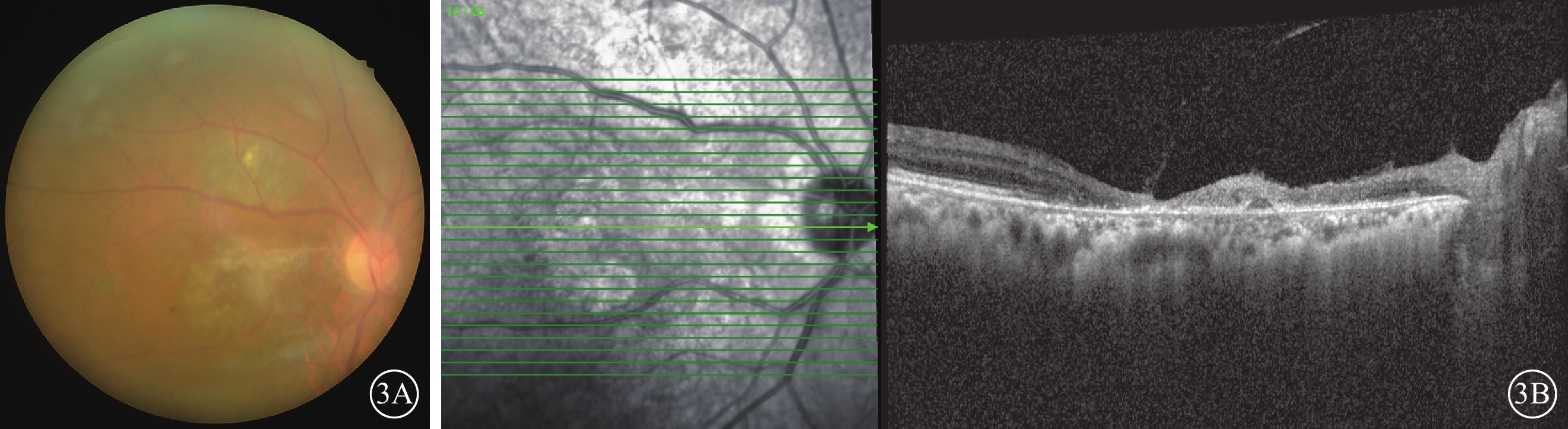
抗病毒藥物治療期間,患者于外院皮膚科隨訪,口服潑尼松龍逐漸降為15 mg/次,1次/d,他克莫司1 mg/次,1次/d,托法替布停止用藥。治療2周后于2023年4月14日到我院復查,右眼視力0.03。眼底檢查,右眼黃斑中心凹視網膜萎縮,黃白色病灶消退,顳上方小片黃白色壞死病灶(圖2A)。OCT檢查,右眼黃斑結構萎縮,黃斑裂孔自行修復封閉(圖2B)。右眼房水檢測,CMV-DNA陰性,IL-8為78.31 pg/ml。患者口服伐昔洛韋治療4個月余,自行減停藥物于2024年1月19日于我院復查。右眼視力0.01。眼底檢查,右眼黃斑中心凹及顳上方黃白色病灶消退(圖3A)。OCT檢查,右眼黃斑裂孔閉合,中心區視網膜萎縮,乳斑束區內外層均萎縮,視網膜變薄(圖3B)。
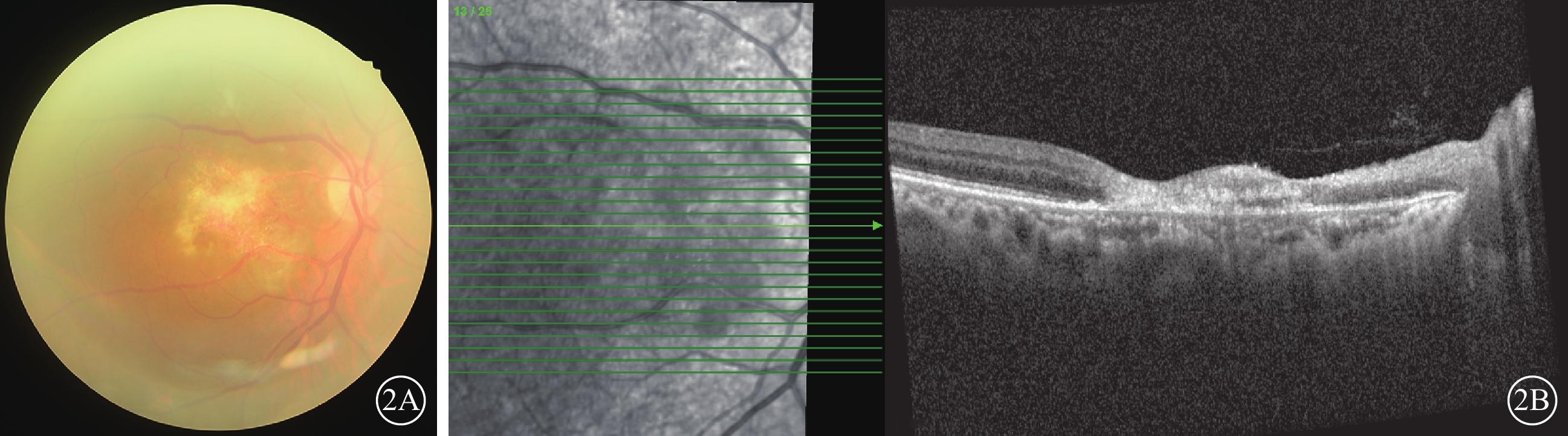 圖2
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2023年4月14日復查右眼眼部檢查像 2A示彩色眼底像,黃斑中心凹萎縮,黃白色病灶消退,顳上方有小片黃白色壞死病灶,中周部及周邊視網膜未見異常。2B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑中心區萎縮,裂孔修復封閉
圖2
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2023年4月14日復查右眼眼部檢查像 2A示彩色眼底像,黃斑中心凹萎縮,黃白色病灶消退,顳上方有小片黃白色壞死病灶,中周部及周邊視網膜未見異常。2B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑中心區萎縮,裂孔修復封閉
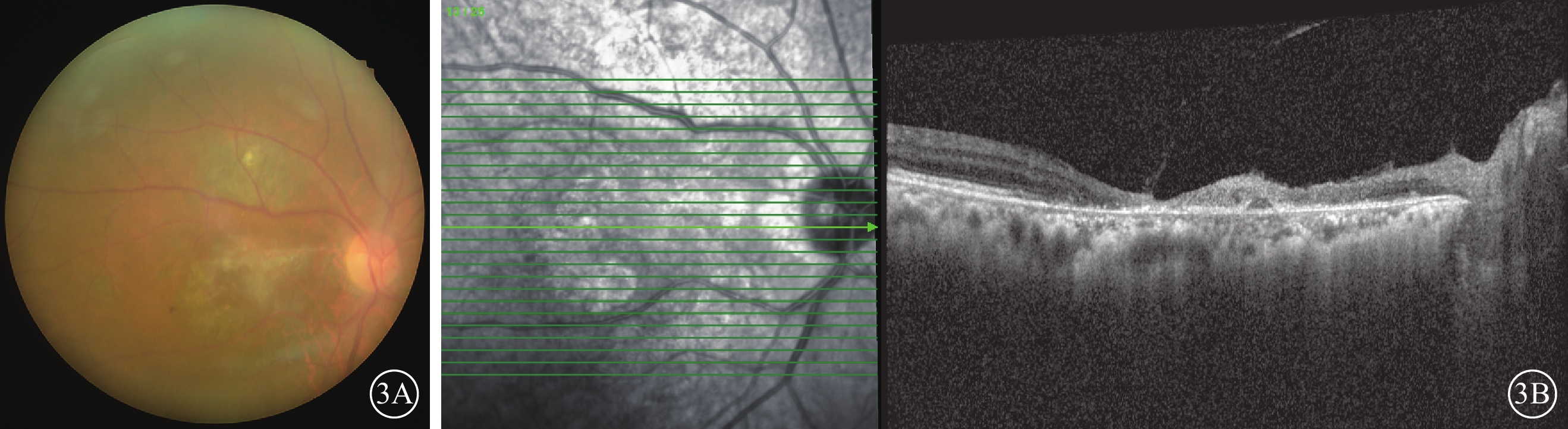 圖3
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2024年1月19日后復查右眼眼部檢查像 3A示彩色眼底像,黃斑中心凹及顳上方黃白色病灶消退。3B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑裂孔閉合,乳斑束區內外層均萎縮,視網膜變薄
圖3
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2024年1月19日后復查右眼眼部檢查像 3A示彩色眼底像,黃斑中心凹及顳上方黃白色病灶消退。3B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑裂孔閉合,乳斑束區內外層均萎縮,視網膜變薄
討論 CMVR多見于艾滋病患者,隨著免疫抑制劑的廣泛使用,CMVR越來越多地發生于非艾滋病患者。由于CMVR臨床癥狀不典型,早期多表現為無癥狀,診斷較為困難,且在缺乏有效治療的情況下,可發展為進行性全層視網膜壞死、視神經萎縮,最終導致失明[1]。CMVR的診斷依賴詳細的臨床病史詢問,結合仔細的眼科體征及眼底多模式影像學檢查,排查感染性葡萄膜炎,聯合必要的實驗室檢查以及房水或玻璃體液檢驗明確診斷。
本例患者是處于免疫抑制治療中的患者,右眼發病后僅在黃斑區出現片狀黃白色壞死病灶并很快出現裂孔,伴少量點狀出血,非常少見。眼底特征需與弓形體感染、CMVR及急性視網膜壞死(ARN)等繼發性感染病變相鑒別,結合病史及相關檢驗結果進行診斷。本例患者經房水檢測CMV-DNA陽性,根據《巨細胞病毒性視網膜炎的分型標準》[2]診斷為CMVR。急性裂孔形成可能提示ARN,但ARN以周邊視網膜壞死為特征,伴有視網膜動脈周圍炎、不同程度的玻璃體炎和血管炎[3-7]。本例患者黃斑區壞死首發導致裂孔形成,玻璃體炎輕微,周邊視網膜以及血管均未見明顯異常,臨床特征與ARN診斷標準不符。
既往文獻報道水痘-帶狀皰疹病毒(VZV)感染的ARN早期黃斑壞死患者[8-11]。Murata等[10]報道ARN患者在起病第35天出現黃斑裂孔。OCT檢查可見內層視網膜壞死先于外層視網膜,這可能與VZV再激活從外側膝狀體核沿神經節細胞軸突逆行擴散有關。CMV感染導致的ARN少有報道[12-13]。
典型的CMVR眼底改變有兩種,分別是大面積視網膜水腫和壞死并伴有出血的出血型和表現為顆粒外觀的顆粒型[2]。累及黃斑區的CMVR的報道較少[14-17]。Gupta等[16]研究報道70例CMVR患者,其中有8例10只眼累及黃斑區,僅有1例形成黃斑裂孔。OCT檢查可見視網膜炎和萎縮區域的全層黃斑裂孔和視網膜前增生。這提示黃斑裂孔繼發于CMV的萎縮,而并非板層裂孔相關性視網膜前增生的牽引。與VZV感染的ARN黃斑壞死相反,累及黃斑區的CMVR外層視網膜可能更早受到影響。未經治療的CMVR致盲率高,早期恰當的抗CMV治療改善疾病的預后。CMVR的有效治療方法為靜脈注射、口服和玻璃體腔注射抗病毒藥物,如更昔洛韋、纈更昔洛韋、膦甲酸鈉、西多福韋等[18]。本例患者經及時的玻璃體腔注射和口服抗病毒藥物病情得到控制,黃斑裂孔修復封閉,盡管患者在維持治療階段依從性欠缺,但患眼周邊視網膜及對側眼在隨訪過程中一直未累及。
CMVR在免疫力低下人群中為一種潛在的致盲性疾病。本例患者以黃斑區壞死合并裂孔首發,屬于罕見,首診眼科時應注意及時識別,盡快進行相關化驗以及房水或玻璃體液病原體檢測幫助確診,以助于早期治療,取得良好的預后。
患者女,68歲。因右眼無痛性視力下降伴黑影遮擋20 d,于2023年3月4日至上海交通大學醫學院附屬第一人民醫院眼科就診。患者曾于2023年2月15日在外院診斷為“玻璃體混濁”,給予口服普羅碘銨、胰激肽酶原治療無明顯好轉。患者有糖尿病病史8年余,口服格列美脲,空腹血糖控制在6~7 mmol/L之間。否認高血壓、冠心病、惡性腫瘤等病史,否認高度近視、眼部外傷、眼部手術及家族史。患者曾于2022年11月因面部皮疹伴雙手Gottron丘疹2周在外院就診,診斷為“皮肌炎、間質性肺炎”,口服潑尼松龍(40 mg/d)、他克莫司(1 mg/次,2次/d)、托法替布(5 mg/次,2次/d),藥物劑量隨全身病情變化調整。眼科檢查:右眼、左眼視力分別為0.1、0.8。右眼、左眼眼壓分別為17、18 mm Hg(1 mm Hg=0.133 kPa)。右眼晶狀體混濁,玻璃體腔少量點狀混濁。眼底檢查,右眼黃斑中心凹片狀黃白色病灶伴個別小點狀出血(圖1A)。熒光素眼底血管造影(FFA)檢查,右眼早期黃斑中心持續弱熒光病灶(圖1B);中晚期黃斑旁中心呈不規則強熒光素滲漏(圖1C)。光相干斷層掃描(OCT)檢查,右眼黃斑中心凹玻璃體視網膜界面少量聚集的玻璃體細胞;黃斑略增厚,層間結構紊亂,中心形成裂孔,內界膜殘留;外層橢圓體帶中斷消失(圖1D)。左眼眼前節及眼底檢查未見明顯異常。實驗室檢查:巨細胞病毒(CMV)-免疫球蛋白(Ig)G>500 U/ml,風疹病毒IgG40 IU/ml。右眼前房穿刺抽取房水檢測,CMV-DNA陽性,白細胞介素(IL)-8 為75.9 pg/ml。診斷:右眼CMV視網膜炎(壞死型)(CMVR)、右眼黃斑裂孔。給予患者全身及局部抗病毒治療,靜脈注射更昔洛韋(250 mg/次,2次/d),持續5 d后改為口服伐昔洛韋(0.3 g/次,2次/d),患者后因胃腸道不適,自行改為0.15 g/次,2次/d;同時玻璃體腔注射更昔洛韋3 mg/次,2次/周,根據眼底變化,1個月后改為1次/周。
 圖1
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者初診右眼眼部檢查像
圖1
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者初診右眼眼部檢查像
1A示彩色眼底像,黃斑中心凹黃白色病灶伴個別小點狀出血。1B、1C分別示熒光素眼底血管造影早期、晚期像,早期黃斑中心持續弱熒光病灶;晚期黃斑旁中心呈不規則強熒光滲漏。1D示光相干斷層掃描像,黃斑中心凹玻璃體視網膜界面可見少量炎性混濁附著;黃斑略增厚,結構紊亂,中心組織缺失形成裂孔,殘留內界膜,外層橢圓體帶中斷
抗病毒藥物治療期間,患者于外院皮膚科隨訪,口服潑尼松龍逐漸降為15 mg/次,1次/d,他克莫司1 mg/次,1次/d,托法替布停止用藥。治療2周后于2023年4月14日到我院復查,右眼視力0.03。眼底檢查,右眼黃斑中心凹視網膜萎縮,黃白色病灶消退,顳上方小片黃白色壞死病灶(圖2A)。OCT檢查,右眼黃斑結構萎縮,黃斑裂孔自行修復封閉(圖2B)。右眼房水檢測,CMV-DNA陰性,IL-8為78.31 pg/ml。患者口服伐昔洛韋治療4個月余,自行減停藥物于2024年1月19日于我院復查。右眼視力0.01。眼底檢查,右眼黃斑中心凹及顳上方黃白色病灶消退(圖3A)。OCT檢查,右眼黃斑裂孔閉合,中心區視網膜萎縮,乳斑束區內外層均萎縮,視網膜變薄(圖3B)。
 圖2
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2023年4月14日復查右眼眼部檢查像 2A示彩色眼底像,黃斑中心凹萎縮,黃白色病灶消退,顳上方有小片黃白色壞死病灶,中周部及周邊視網膜未見異常。2B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑中心區萎縮,裂孔修復封閉
圖2
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2023年4月14日復查右眼眼部檢查像 2A示彩色眼底像,黃斑中心凹萎縮,黃白色病灶消退,顳上方有小片黃白色壞死病灶,中周部及周邊視網膜未見異常。2B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑中心區萎縮,裂孔修復封閉
 圖3
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2024年1月19日后復查右眼眼部檢查像 3A示彩色眼底像,黃斑中心凹及顳上方黃白色病灶消退。3B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑裂孔閉合,乳斑束區內外層均萎縮,視網膜變薄
圖3
巨細胞病毒感染致黃斑中心凹壞死及裂孔患者2024年1月19日后復查右眼眼部檢查像 3A示彩色眼底像,黃斑中心凹及顳上方黃白色病灶消退。3B示光相干斷層掃描像,左圖為掃描方向和部位,右圖為檢查結果。黃斑裂孔閉合,乳斑束區內外層均萎縮,視網膜變薄
討論 CMVR多見于艾滋病患者,隨著免疫抑制劑的廣泛使用,CMVR越來越多地發生于非艾滋病患者。由于CMVR臨床癥狀不典型,早期多表現為無癥狀,診斷較為困難,且在缺乏有效治療的情況下,可發展為進行性全層視網膜壞死、視神經萎縮,最終導致失明[1]。CMVR的診斷依賴詳細的臨床病史詢問,結合仔細的眼科體征及眼底多模式影像學檢查,排查感染性葡萄膜炎,聯合必要的實驗室檢查以及房水或玻璃體液檢驗明確診斷。
本例患者是處于免疫抑制治療中的患者,右眼發病后僅在黃斑區出現片狀黃白色壞死病灶并很快出現裂孔,伴少量點狀出血,非常少見。眼底特征需與弓形體感染、CMVR及急性視網膜壞死(ARN)等繼發性感染病變相鑒別,結合病史及相關檢驗結果進行診斷。本例患者經房水檢測CMV-DNA陽性,根據《巨細胞病毒性視網膜炎的分型標準》[2]診斷為CMVR。急性裂孔形成可能提示ARN,但ARN以周邊視網膜壞死為特征,伴有視網膜動脈周圍炎、不同程度的玻璃體炎和血管炎[3-7]。本例患者黃斑區壞死首發導致裂孔形成,玻璃體炎輕微,周邊視網膜以及血管均未見明顯異常,臨床特征與ARN診斷標準不符。
既往文獻報道水痘-帶狀皰疹病毒(VZV)感染的ARN早期黃斑壞死患者[8-11]。Murata等[10]報道ARN患者在起病第35天出現黃斑裂孔。OCT檢查可見內層視網膜壞死先于外層視網膜,這可能與VZV再激活從外側膝狀體核沿神經節細胞軸突逆行擴散有關。CMV感染導致的ARN少有報道[12-13]。
典型的CMVR眼底改變有兩種,分別是大面積視網膜水腫和壞死并伴有出血的出血型和表現為顆粒外觀的顆粒型[2]。累及黃斑區的CMVR的報道較少[14-17]。Gupta等[16]研究報道70例CMVR患者,其中有8例10只眼累及黃斑區,僅有1例形成黃斑裂孔。OCT檢查可見視網膜炎和萎縮區域的全層黃斑裂孔和視網膜前增生。這提示黃斑裂孔繼發于CMV的萎縮,而并非板層裂孔相關性視網膜前增生的牽引。與VZV感染的ARN黃斑壞死相反,累及黃斑區的CMVR外層視網膜可能更早受到影響。未經治療的CMVR致盲率高,早期恰當的抗CMV治療改善疾病的預后。CMVR的有效治療方法為靜脈注射、口服和玻璃體腔注射抗病毒藥物,如更昔洛韋、纈更昔洛韋、膦甲酸鈉、西多福韋等[18]。本例患者經及時的玻璃體腔注射和口服抗病毒藥物病情得到控制,黃斑裂孔修復封閉,盡管患者在維持治療階段依從性欠缺,但患眼周邊視網膜及對側眼在隨訪過程中一直未累及。
CMVR在免疫力低下人群中為一種潛在的致盲性疾病。本例患者以黃斑區壞死合并裂孔首發,屬于罕見,首診眼科時應注意及時識別,盡快進行相關化驗以及房水或玻璃體液病原體檢測幫助確診,以助于早期治療,取得良好的預后。