本研究旨在探討采用擴散加權成像(DWI)的不同表觀擴散系數(ADC)測量方法,在評價和預測乳腺癌新輔助化療(NAC)療效中的價值。2010年3月~2012年12月收集在我院經核芯針穿刺活檢病理證實為乳腺浸潤性導管癌并術前行NAC的患者71例,在NAC前后各階段行DWI磁共振檢查,分別采用平均ADC值法及低ADC值法測量組織ADC值。NAC后按Miller&Payne病理反應性分級標準分為組織學顯著反應(MHR)組與非組織學顯著反應(NMHR)組。結果顯示,NAC前、第2周期后、全程結束后,兩種ADC測量方法的結果具有高度的相關性,Pearson相關系數分別為0.699、0.749和0.895。自NAC第2周期結束后,兩種方法測量的MHR組及NMHR組ADC值的組間差異均具有統計學意義(P值均<0.05)。采用平均ADC值法,MHR組與NMHR組間ADC值變化率于第2周期結束時未見明顯差異(P>0.05),而低ADC值法顯示第2周期結束時MHR組ADC變化率明顯高于NMHR組(P<0.05)。DWI可對NAC后乳腺癌組織的病理改變情況進行評估,而低ADC值法比平均ADC值法能更早地通過ADC值及其變化率對化療療效進行評估。
引用本文: 羅藝, 余建群, 徐忠孜, 曾涵江, 陳輝. 磁共振擴散加權成像對乳腺癌新輔助化療后病理反應的評價. 生物醫學工程學雜志, 2014, 31(6): 1336-1341. doi: 10.7507/1001-5515.20140253 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
在中國大城市,女性乳腺癌的發病率已居于女性惡性腫瘤的首位[1]。目前已認識到乳腺癌是一種全身性疾病,新輔助化療(neoadjuvant chemotherapy,NAC)作為在手術治療或放療前進行的全身性、系統性的細胞毒性藥物治療方法,已在臨床中得到越來越廣泛的應用和重視。NAC的作用在于縮小原發腫瘤以達到保乳和腫瘤降期的目的,已成為乳腺癌綜合治療的重要組成部分[2]。
繼Gilles等[3]于1994年首次報道運用磁共振成像(magnetic resonance imaging,MRI)對乳腺癌化療后的腫瘤變化情況進行觀察之后,國內外關于運用MRI評估乳腺癌NAC療效的研究報道逐漸增多。目前,乳腺常用的MRI檢查方法有擴散加權成像(diffusion weighted imaging,DWI)以及動態增強磁共振(dynamic contrast enhanced MRI,DCE-MRI)。DWI是MRI的一種功能成像,反映活體內水分子微觀運動,而表觀擴散系數(apparent diffusion coefficient,ADC)能敏感地量化微環境中水分子的擴散率[4]。腫瘤組織細胞密度大,水分子擴散受限;而化療后由于藥物破壞了腫瘤細胞膜的完整性,殺滅了腫瘤細胞,從而提高了受損腫瘤組織中的水擴散。DWI可反映腫瘤化療前后水分子擴散狀況的變化,但這種變化在化療后哪一個階段才能被DWI檢測出來,研究尚少。本研究旨在通過回顧性分析乳腺癌NAC過程中DWI圖像以及ADC值的變化情況,結合化療后病理分級資料,來探討DWI對乳腺癌NAC療效評價的價值。
1 資料與方法
1.1 臨床資料
收集2010年3月~2012年12月在四川大學華西醫院經核芯針穿刺活檢病理證實為乳腺癌并接受NAC和手術治療的患者,化療時間為4~6個周期。所有患者于化療后行乳腺外科手術,標本均由病理科按Miller & Payne分級標準進行病理反應性評級。病例的納入標準:① 術前至少在NAC前、NAC全部周期結束后兩個時間點各進行一次MRI檢查的患者;② NAC前的MRI檢查均在行核芯空針穿刺前完成。根據納入標準,最終入選患者71例,均為女性,病理類型均為浸潤性導管癌,年齡29~72歲,平均年齡46.1歲,中位年齡46歲。
1.2 掃描方法
運用Philips Achieva 3.0T超導型磁共振,乳腺表面相控陣專用線圈,患者取俯臥位,使雙乳自然懸垂于線圈洞內。常規軸位、冠狀位、矢狀位掃描后,采用T2WI加壓脂序列(TR/TE=3600 ms/85 ms)行軸位掃描,層厚6 mm,層間隔1 mm。之后再行DWI掃描,采用單次激發回波平面成像(echo plannar imaging,EPI)序列,擴散敏感系數b值采用800 s/mm2、0 s/mm2,TR/TE=4.589 ms/1.712 ms,層厚6 mm,層間隔1 mm,掃描時間約32 s。
1.3 NAC后乳腺癌病理學反應評價標準
病理反應性評價按照Miller & Payne的分級方法[5]進行,分級標準為:1級,腫瘤細胞密度較化療前無變化;2級,腫瘤細胞密度減少小于30%;3級,腫瘤細胞減少30%~90%;4級,腫瘤細胞密度減少90%以上;5級,腫瘤完全消失,鏡下未見浸潤癌殘留,但可含有導管原位癌(ductal carcinoma in situ, DCIS)。病理反應性5級為病理完全緩解(pathologic complete response,pCR);病理反應1~4級為病理學浸潤性腫瘤殘存(pathological invasive residua,pINV)。病理學反應性4及5級合稱為組織學顯著反應(major histological response,MHR);1~3級反應性為非組織學顯著反應(non-major histological response,NMHR)。
1.4 乳腺癌ADC值的測量
DWI掃描完成后,在自動生成的ADC偽彩圖像上,采用以下兩種方法對ADC值進行測量:① 平均ADC值法:在避開液化、囊變、壞死和出血的前提下,以手繪感興趣區(region of interest,ROI)測量ADC值,取三次測量的平均值為該ROI的ADC值。② 低ADC值法:同樣在避開液化、囊變、壞死和出血的前提下,將ROI放置在每層圖像上最低ADC值處,計算其平均值作為最小ADC值。腫瘤NAC后ADC值變化率(△ADC%)=(ADCn-ADC1)/ADC1×100%,其中ADCn為NAC后腫瘤ADC值,ADC1為NAC前腫瘤ADC值。
1.5 統計學分析
采用Excel 2003進行數據錄入和整理,用SPSS for windows(SPSS17.0)統計軟件進行統計分析。兩種ADC值測量方法的相關性分析采用Pearson相關分析。NAC前后各觀察期的ADC值以及治療后ADC值變化率經檢驗均符合正態分布,故進行組間獨立樣本t檢驗。P<0.05為差異有統計學意義。治療后ADC值變化率與病理反應結果作受試者工作特征曲線(receiver operating characteristic curve,ROC)分析。
2 結果
在本組中,所有患者在術前的NAC前、NAC全部周期結束后各進行一次MRI檢查,其中10例、4例分別于化療第2周期結束、第4周期結束時另行MRI檢查。NAC全程結束后有16例病灶因難以準確判定其邊界,不能測量出ADC值,因此在該階段結果中未進行分析;第4周期后MRI檢查結果因樣本量少,未進行統計學分析。
2.1 NAC前后各觀察期MRI腫瘤灶ADC值
2.1.1 兩種測量方法相關性分析
本研究中采用平均ADC值法和低ADC值法,測量結果如表 1所示。兩種ADC值測量方法在NAC前及NAC后各觀察期,對殘余腫瘤病灶的ADC值測量結果都具有高度的相關性。
2.1.2 MHR與NMHR組間ADC值比較
全部樣本按照Miller & Payne的病理分級方法進行MHR與NMHR分組,NAC前后各觀察期樣本統計結果見表 2。兩種ADC值測量方法中,NAC前MHR與NMHR組間ADC值均無明顯差異,但在NAC第二周期結束后,均能觀察到組間ADC值差異有統計學意義。
2.1.3 NAC后各觀察期與NAC前比較
NAC后各觀察周期ADC值與NAC前進行比較,統計結果如表 3所示。采用平均ADC值法和低ADC值法均顯示,無論是全組、MHR組還是NMHR組,在NAC后各觀察期病灶的ADC值與NAC前比較,差異均有統計學意義,且在化療第2周期結束時ADC值可見明顯升高。
2.1.4 MHR組與NMHR組的NAC前及全程結束后的ADC圖像對比
MHR組與NMHR組病灶的NAC前及全程結束后的ADC圖像對比分析(見圖 1~2)。
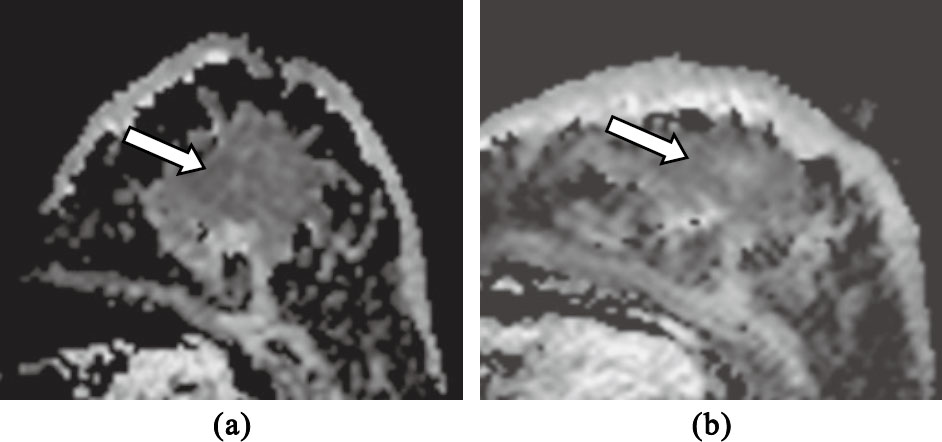
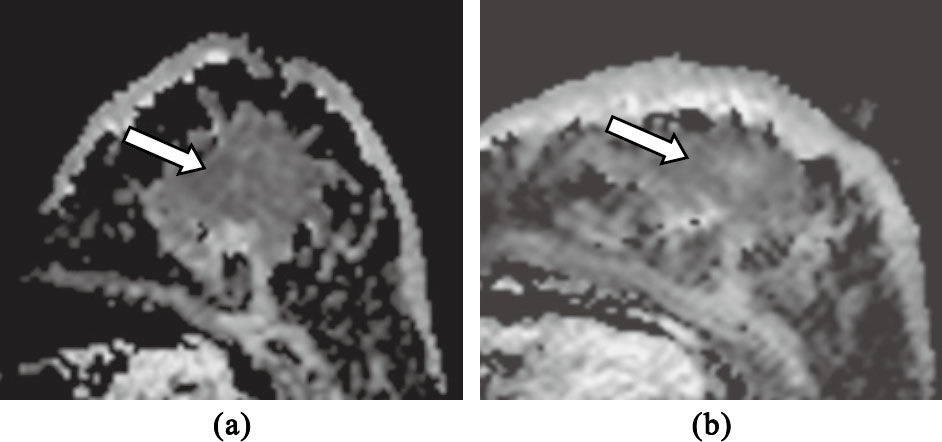 圖1
NMHR組左乳浸潤性導管癌(Miller & Payne 1級)
圖1
NMHR組左乳浸潤性導管癌(Miller & Payne 1級)
(a)NAC前擴散加權圖像,采用平均ADC值法,測得其ADC值為1.04×10-3 mm2/s;采用低ADC值法,測得其ADC值為0.94×10-3 mm2/s;(b)NAC全程結束后ADC圖像,采用平均ADC值法,測得其ADC值為1.11×10-3 mm2/s;采用低ADC值法,測得其ADC值為0.97×10-3 mm2/s
Figure1. Invasive ductal carcinoma of left breast in NMHR group (Miller & Payne grade 1)(a) this image is the ADC image before NAC,and the ADC values are 1.04×10-3 mm2/s and 0.94×10-3 mm2/s obtained with mean ADC and lower ADC methods,respectively; (b) this image is the ADC image after the end of NAC,and the ADC values are 1.11×10-3 mm2/s and 0.97×10-3 mm2/s obtained with mean ADC and lower ADC methods,respectively
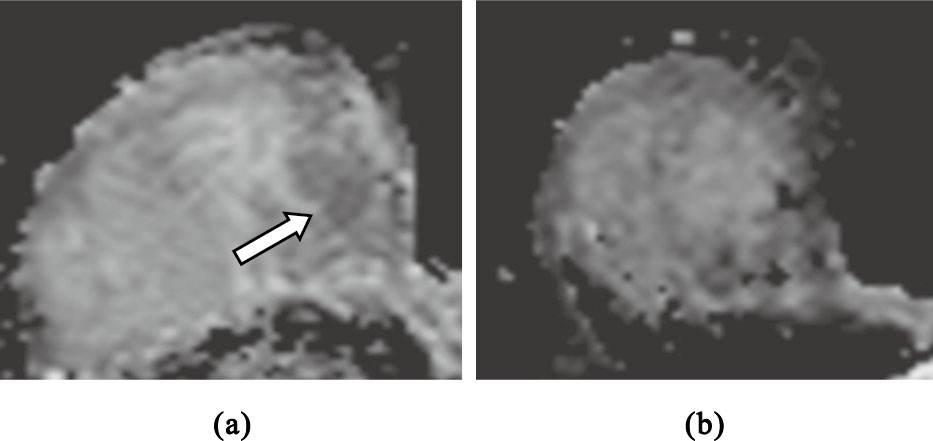
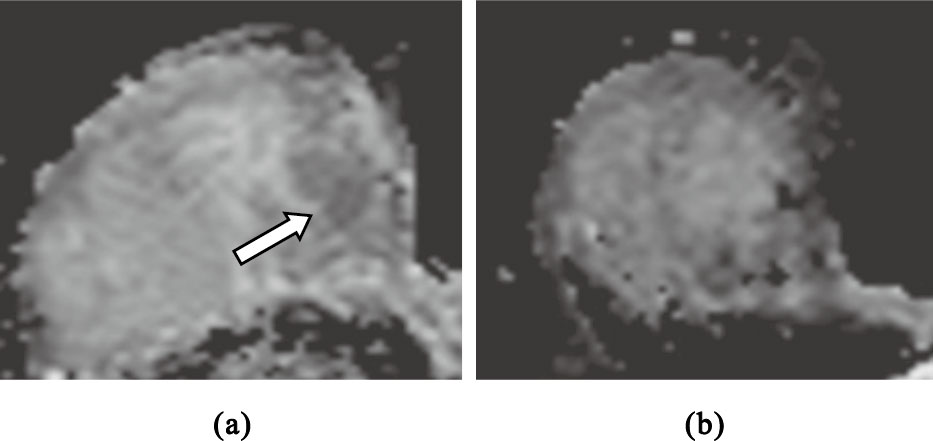 圖2
MHR組右乳浸潤性導管癌(Miller & Payne 5級)
圖2
MHR組右乳浸潤性導管癌(Miller & Payne 5級)
(a)NAC前擴散加權圖像,采用平均ADC值法,測得其ADC值為1.14×10-3 mm2/s;采用低ADC值法,測得其ADC值為0.73×10-3 mm2/s;(b)NAC全程結束后ADC圖像
Figure2. Invasive ductal carcinoma of right breast in MHR group (Miller & Payne grade 5)(a) this image is the ADC image before NAC,and the ADC values are 1.14×10-3mm2/s and 0.73×10-3mm2/s obtained with mean ADC and lower ADC methods,respectively; (b) this image is the ADC image after the end of NAC
2.2 MHR與NMHR組間NAC后ADC值變化率的比較
在NAC第2周期及全程結束后,分別采用平均ADC值法和低ADC值法測量MHR與NMHR組的△ADC%,結果見表 4。統計結果顯示,采用平均ADC值法,第2周期結束時兩組間△ADC%未見明顯差異;而采用低ADC值法時,兩組間△ADC%差異有統計學意義。
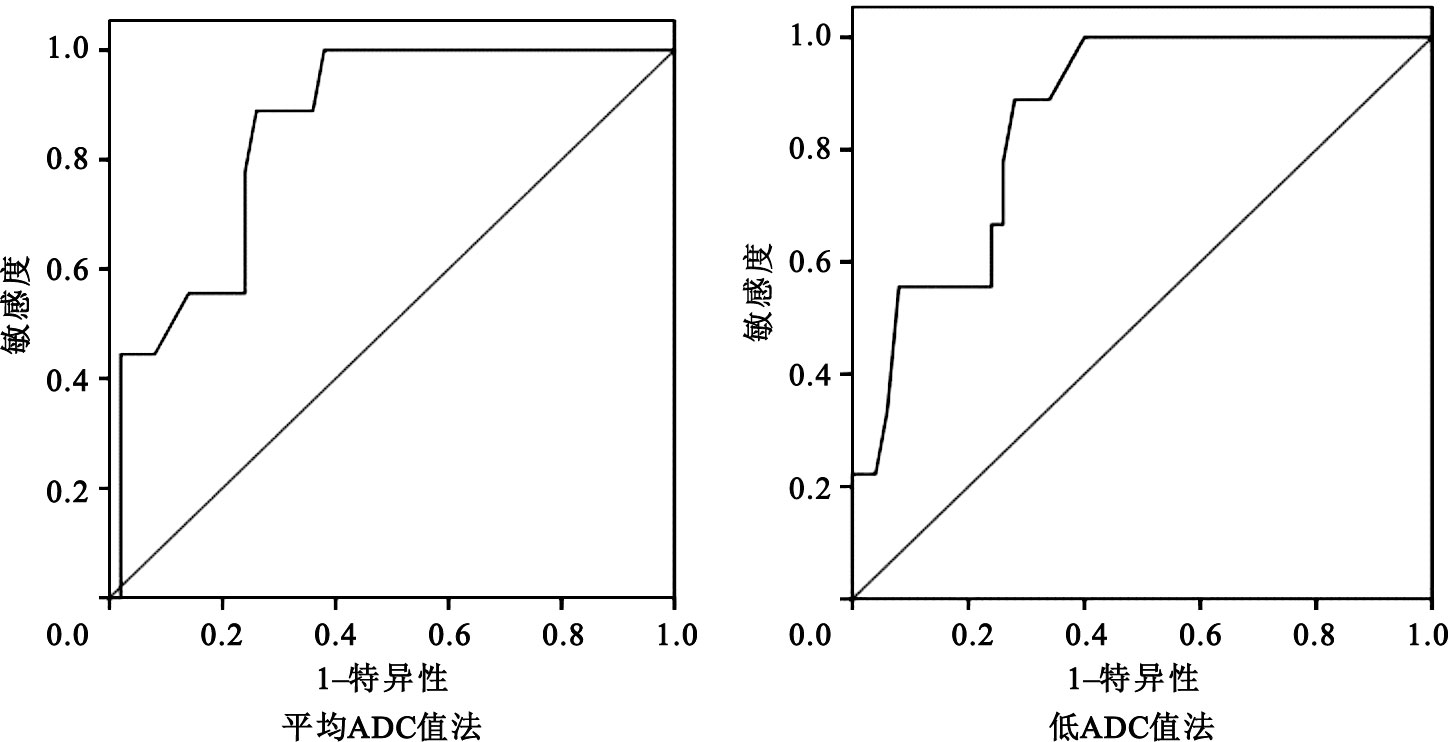
利用ROC分析方法,對兩種方法通過△ADC%推測NAC后病理反應的判斷效能進行評價,結果見圖 6。采用平均ADC值法,△ADC%最佳臨界預測值為42.5%,ROC曲線下面積0.857(P=0.001),在NAC全部周期結束后當△ADC%≥42.5%時,預測病灶療效為MHR的敏感度為88.9%,特異度為74.0%。采用低ADC值法,△ADC%最佳臨界預測值為41.6%,ROC曲線下面積0.852(P=0.001),在NAC全部周期結束后當△ADC%≥41.6%時,預測病灶療效為MHR的敏感度為88.9%,特異度為72.0%。
3 討論
DWI反映的是活體內微觀水分子運動,其ADC值能敏感地量化微環境中的水分子擴散率[4]。腫瘤組織細胞密度大,水分子擴散受限,其ADC值往往低于正常組織;而化療后由于藥物破壞了腫瘤細胞膜的完整性,殺滅了腫瘤細胞,從而提高了受損腫瘤組織中的水擴散,使其ADC值升高。本研究通過比較NAC前后ADC值的變化來判斷腫瘤細胞的活性,從而對NAC療效進行評價。
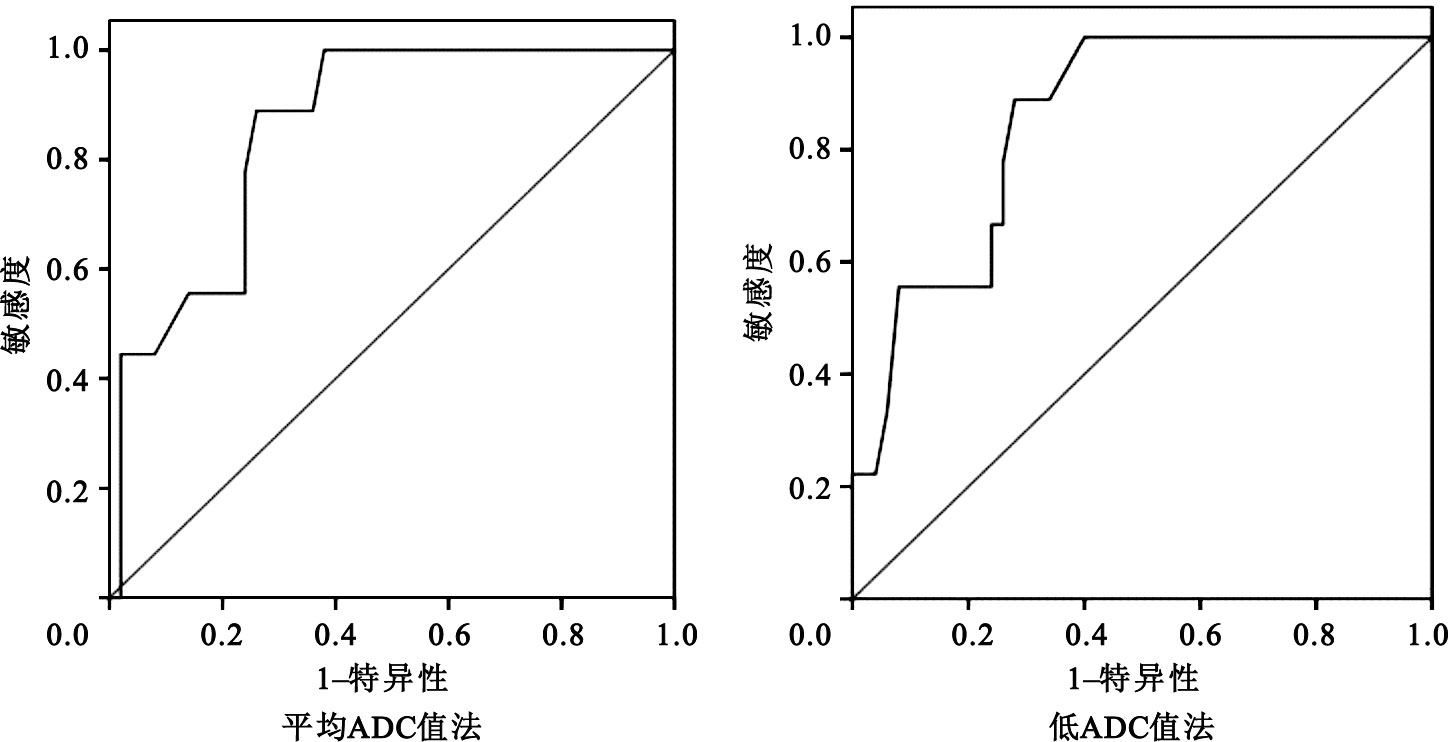 圖3
兩種方法推測NAC后乳腺癌病理反應MHR的ROC曲線
Figure3.
ROC curves for determining pathologic response of breast cancer after NAC by the two methods
圖3
兩種方法推測NAC后乳腺癌病理反應MHR的ROC曲線
Figure3.
ROC curves for determining pathologic response of breast cancer after NAC by the two methods
本研究采用了兩種方法測量ADC值,發現兩種方法的結果在NAC前后均有高度的相關性,說明兩種測量方法對腫瘤水分子擴散狀態的評估具有很好的一致性。
對不同病理反應組在NAC前的ADC值是否存在差異,國內外的研究結果還存在爭議。有的研究結果[6-9]顯示不同病理反應組之間NAC前的ADC值不存在顯著差異。但也有研究[10]認為不同病理反應組化療前的ADC值差異具有統計學意義,有效組化療前腫瘤的ADC值低于無效組。本研究結果顯示,不同病理反應組間NAC前的ADC值不存在明顯差異,但兩種方法測得的MHR組ADC值均有低于NMHR組的趨勢。將MHR組、NMHR組化療開始后的ADC值進行組間分析時,發現NAC第2周期及化療全程結束后兩種ADC值測量方法所測得的組間ADC值均有明顯差異,MHR組的ADC值高于NMHR組,與Fangberget等[11]的研究結果一致,說明化療早期就能通過對ADC值的觀察對NAC療效進行評估。本組研究結果還顯示NAC前MHR組的ADC值低于NMHR組,而NAC后則高于NMHR組。高影等[12]的研究也支持了這一結果。推測可能是NAC前ADC值低的腫瘤細胞密度及活性較高,分化較差,對化療藥物的敏感性更高[13]。
DWI能監測到腫瘤細胞活性的變化,NAC后病灶的ADC值在早期就能出現變化。Sharma等[14]和Chenevert等[15]研究顯示對NAC敏感的腫瘤在化療第一療程末便可觀察到ADC值升高。還有研究[16]顯示,在乳腺癌小鼠接受NAC治療第4、7天時腫瘤的ADC值出現明顯變化。本研究中,將MHR組和NMHR組的ADC值各自進行組內比較,發現兩個組的ADC值變化均具有統計學意義,且在化療后第2周期結束時就可觀察到,說明化療對兩個組的腫瘤都具有殺傷作用。這與張靜等[17]的研究結果不同,該研究顯示NAC有效組化療前后的ADC值變化有明顯差異,而無效組化療前后ADC值變化無明顯差異。
本研究顯示,采用平均ADC值法,在NAC第2周期結束時,MHR組與NMHR組間△ADC%未見明顯差異,而在NAC全程結束后兩組△ADC%差異有統計學意義;而采用低ADC值法,在NAC第2周期結束時就顯示MHR組與NMHR組間△ADC%存在明顯差異,說明低ADC值法能在更早期通過檢測△ADC%對NAC療效起到評估作用。
采用兩種ADC值測量方法預測乳腺癌化療后的病理反應性,ROC曲線分析顯示兩者的敏感度均為88.9%,但低ADC值法所得到的△ADC%臨界值小于平均ADC值法,即低ADC值法能在病灶△ADC%更小的情況下對乳腺癌術前NAC的療效進行評估。
引言
在中國大城市,女性乳腺癌的發病率已居于女性惡性腫瘤的首位[1]。目前已認識到乳腺癌是一種全身性疾病,新輔助化療(neoadjuvant chemotherapy,NAC)作為在手術治療或放療前進行的全身性、系統性的細胞毒性藥物治療方法,已在臨床中得到越來越廣泛的應用和重視。NAC的作用在于縮小原發腫瘤以達到保乳和腫瘤降期的目的,已成為乳腺癌綜合治療的重要組成部分[2]。
繼Gilles等[3]于1994年首次報道運用磁共振成像(magnetic resonance imaging,MRI)對乳腺癌化療后的腫瘤變化情況進行觀察之后,國內外關于運用MRI評估乳腺癌NAC療效的研究報道逐漸增多。目前,乳腺常用的MRI檢查方法有擴散加權成像(diffusion weighted imaging,DWI)以及動態增強磁共振(dynamic contrast enhanced MRI,DCE-MRI)。DWI是MRI的一種功能成像,反映活體內水分子微觀運動,而表觀擴散系數(apparent diffusion coefficient,ADC)能敏感地量化微環境中水分子的擴散率[4]。腫瘤組織細胞密度大,水分子擴散受限;而化療后由于藥物破壞了腫瘤細胞膜的完整性,殺滅了腫瘤細胞,從而提高了受損腫瘤組織中的水擴散。DWI可反映腫瘤化療前后水分子擴散狀況的變化,但這種變化在化療后哪一個階段才能被DWI檢測出來,研究尚少。本研究旨在通過回顧性分析乳腺癌NAC過程中DWI圖像以及ADC值的變化情況,結合化療后病理分級資料,來探討DWI對乳腺癌NAC療效評價的價值。
1 資料與方法
1.1 臨床資料
收集2010年3月~2012年12月在四川大學華西醫院經核芯針穿刺活檢病理證實為乳腺癌并接受NAC和手術治療的患者,化療時間為4~6個周期。所有患者于化療后行乳腺外科手術,標本均由病理科按Miller & Payne分級標準進行病理反應性評級。病例的納入標準:① 術前至少在NAC前、NAC全部周期結束后兩個時間點各進行一次MRI檢查的患者;② NAC前的MRI檢查均在行核芯空針穿刺前完成。根據納入標準,最終入選患者71例,均為女性,病理類型均為浸潤性導管癌,年齡29~72歲,平均年齡46.1歲,中位年齡46歲。
1.2 掃描方法
運用Philips Achieva 3.0T超導型磁共振,乳腺表面相控陣專用線圈,患者取俯臥位,使雙乳自然懸垂于線圈洞內。常規軸位、冠狀位、矢狀位掃描后,采用T2WI加壓脂序列(TR/TE=3600 ms/85 ms)行軸位掃描,層厚6 mm,層間隔1 mm。之后再行DWI掃描,采用單次激發回波平面成像(echo plannar imaging,EPI)序列,擴散敏感系數b值采用800 s/mm2、0 s/mm2,TR/TE=4.589 ms/1.712 ms,層厚6 mm,層間隔1 mm,掃描時間約32 s。
1.3 NAC后乳腺癌病理學反應評價標準
病理反應性評價按照Miller & Payne的分級方法[5]進行,分級標準為:1級,腫瘤細胞密度較化療前無變化;2級,腫瘤細胞密度減少小于30%;3級,腫瘤細胞減少30%~90%;4級,腫瘤細胞密度減少90%以上;5級,腫瘤完全消失,鏡下未見浸潤癌殘留,但可含有導管原位癌(ductal carcinoma in situ, DCIS)。病理反應性5級為病理完全緩解(pathologic complete response,pCR);病理反應1~4級為病理學浸潤性腫瘤殘存(pathological invasive residua,pINV)。病理學反應性4及5級合稱為組織學顯著反應(major histological response,MHR);1~3級反應性為非組織學顯著反應(non-major histological response,NMHR)。
1.4 乳腺癌ADC值的測量
DWI掃描完成后,在自動生成的ADC偽彩圖像上,采用以下兩種方法對ADC值進行測量:① 平均ADC值法:在避開液化、囊變、壞死和出血的前提下,以手繪感興趣區(region of interest,ROI)測量ADC值,取三次測量的平均值為該ROI的ADC值。② 低ADC值法:同樣在避開液化、囊變、壞死和出血的前提下,將ROI放置在每層圖像上最低ADC值處,計算其平均值作為最小ADC值。腫瘤NAC后ADC值變化率(△ADC%)=(ADCn-ADC1)/ADC1×100%,其中ADCn為NAC后腫瘤ADC值,ADC1為NAC前腫瘤ADC值。
1.5 統計學分析
采用Excel 2003進行數據錄入和整理,用SPSS for windows(SPSS17.0)統計軟件進行統計分析。兩種ADC值測量方法的相關性分析采用Pearson相關分析。NAC前后各觀察期的ADC值以及治療后ADC值變化率經檢驗均符合正態分布,故進行組間獨立樣本t檢驗。P<0.05為差異有統計學意義。治療后ADC值變化率與病理反應結果作受試者工作特征曲線(receiver operating characteristic curve,ROC)分析。
2 結果
在本組中,所有患者在術前的NAC前、NAC全部周期結束后各進行一次MRI檢查,其中10例、4例分別于化療第2周期結束、第4周期結束時另行MRI檢查。NAC全程結束后有16例病灶因難以準確判定其邊界,不能測量出ADC值,因此在該階段結果中未進行分析;第4周期后MRI檢查結果因樣本量少,未進行統計學分析。
2.1 NAC前后各觀察期MRI腫瘤灶ADC值
2.1.1 兩種測量方法相關性分析
本研究中采用平均ADC值法和低ADC值法,測量結果如表 1所示。兩種ADC值測量方法在NAC前及NAC后各觀察期,對殘余腫瘤病灶的ADC值測量結果都具有高度的相關性。
2.1.2 MHR與NMHR組間ADC值比較
全部樣本按照Miller & Payne的病理分級方法進行MHR與NMHR分組,NAC前后各觀察期樣本統計結果見表 2。兩種ADC值測量方法中,NAC前MHR與NMHR組間ADC值均無明顯差異,但在NAC第二周期結束后,均能觀察到組間ADC值差異有統計學意義。
2.1.3 NAC后各觀察期與NAC前比較
NAC后各觀察周期ADC值與NAC前進行比較,統計結果如表 3所示。采用平均ADC值法和低ADC值法均顯示,無論是全組、MHR組還是NMHR組,在NAC后各觀察期病灶的ADC值與NAC前比較,差異均有統計學意義,且在化療第2周期結束時ADC值可見明顯升高。
2.1.4 MHR組與NMHR組的NAC前及全程結束后的ADC圖像對比
MHR組與NMHR組病灶的NAC前及全程結束后的ADC圖像對比分析(見圖 1~2)。
 圖1
NMHR組左乳浸潤性導管癌(Miller & Payne 1級)
圖1
NMHR組左乳浸潤性導管癌(Miller & Payne 1級)
(a)NAC前擴散加權圖像,采用平均ADC值法,測得其ADC值為1.04×10-3 mm2/s;采用低ADC值法,測得其ADC值為0.94×10-3 mm2/s;(b)NAC全程結束后ADC圖像,采用平均ADC值法,測得其ADC值為1.11×10-3 mm2/s;采用低ADC值法,測得其ADC值為0.97×10-3 mm2/s
Figure1. Invasive ductal carcinoma of left breast in NMHR group (Miller & Payne grade 1)(a) this image is the ADC image before NAC,and the ADC values are 1.04×10-3 mm2/s and 0.94×10-3 mm2/s obtained with mean ADC and lower ADC methods,respectively; (b) this image is the ADC image after the end of NAC,and the ADC values are 1.11×10-3 mm2/s and 0.97×10-3 mm2/s obtained with mean ADC and lower ADC methods,respectively
 圖2
MHR組右乳浸潤性導管癌(Miller & Payne 5級)
圖2
MHR組右乳浸潤性導管癌(Miller & Payne 5級)
(a)NAC前擴散加權圖像,采用平均ADC值法,測得其ADC值為1.14×10-3 mm2/s;采用低ADC值法,測得其ADC值為0.73×10-3 mm2/s;(b)NAC全程結束后ADC圖像
Figure2. Invasive ductal carcinoma of right breast in MHR group (Miller & Payne grade 5)(a) this image is the ADC image before NAC,and the ADC values are 1.14×10-3mm2/s and 0.73×10-3mm2/s obtained with mean ADC and lower ADC methods,respectively; (b) this image is the ADC image after the end of NAC
2.2 MHR與NMHR組間NAC后ADC值變化率的比較
在NAC第2周期及全程結束后,分別采用平均ADC值法和低ADC值法測量MHR與NMHR組的△ADC%,結果見表 4。統計結果顯示,采用平均ADC值法,第2周期結束時兩組間△ADC%未見明顯差異;而采用低ADC值法時,兩組間△ADC%差異有統計學意義。
利用ROC分析方法,對兩種方法通過△ADC%推測NAC后病理反應的判斷效能進行評價,結果見圖 6。采用平均ADC值法,△ADC%最佳臨界預測值為42.5%,ROC曲線下面積0.857(P=0.001),在NAC全部周期結束后當△ADC%≥42.5%時,預測病灶療效為MHR的敏感度為88.9%,特異度為74.0%。采用低ADC值法,△ADC%最佳臨界預測值為41.6%,ROC曲線下面積0.852(P=0.001),在NAC全部周期結束后當△ADC%≥41.6%時,預測病灶療效為MHR的敏感度為88.9%,特異度為72.0%。
3 討論
DWI反映的是活體內微觀水分子運動,其ADC值能敏感地量化微環境中的水分子擴散率[4]。腫瘤組織細胞密度大,水分子擴散受限,其ADC值往往低于正常組織;而化療后由于藥物破壞了腫瘤細胞膜的完整性,殺滅了腫瘤細胞,從而提高了受損腫瘤組織中的水擴散,使其ADC值升高。本研究通過比較NAC前后ADC值的變化來判斷腫瘤細胞的活性,從而對NAC療效進行評價。
 圖3
兩種方法推測NAC后乳腺癌病理反應MHR的ROC曲線
Figure3.
ROC curves for determining pathologic response of breast cancer after NAC by the two methods
圖3
兩種方法推測NAC后乳腺癌病理反應MHR的ROC曲線
Figure3.
ROC curves for determining pathologic response of breast cancer after NAC by the two methods
本研究采用了兩種方法測量ADC值,發現兩種方法的結果在NAC前后均有高度的相關性,說明兩種測量方法對腫瘤水分子擴散狀態的評估具有很好的一致性。
對不同病理反應組在NAC前的ADC值是否存在差異,國內外的研究結果還存在爭議。有的研究結果[6-9]顯示不同病理反應組之間NAC前的ADC值不存在顯著差異。但也有研究[10]認為不同病理反應組化療前的ADC值差異具有統計學意義,有效組化療前腫瘤的ADC值低于無效組。本研究結果顯示,不同病理反應組間NAC前的ADC值不存在明顯差異,但兩種方法測得的MHR組ADC值均有低于NMHR組的趨勢。將MHR組、NMHR組化療開始后的ADC值進行組間分析時,發現NAC第2周期及化療全程結束后兩種ADC值測量方法所測得的組間ADC值均有明顯差異,MHR組的ADC值高于NMHR組,與Fangberget等[11]的研究結果一致,說明化療早期就能通過對ADC值的觀察對NAC療效進行評估。本組研究結果還顯示NAC前MHR組的ADC值低于NMHR組,而NAC后則高于NMHR組。高影等[12]的研究也支持了這一結果。推測可能是NAC前ADC值低的腫瘤細胞密度及活性較高,分化較差,對化療藥物的敏感性更高[13]。
DWI能監測到腫瘤細胞活性的變化,NAC后病灶的ADC值在早期就能出現變化。Sharma等[14]和Chenevert等[15]研究顯示對NAC敏感的腫瘤在化療第一療程末便可觀察到ADC值升高。還有研究[16]顯示,在乳腺癌小鼠接受NAC治療第4、7天時腫瘤的ADC值出現明顯變化。本研究中,將MHR組和NMHR組的ADC值各自進行組內比較,發現兩個組的ADC值變化均具有統計學意義,且在化療后第2周期結束時就可觀察到,說明化療對兩個組的腫瘤都具有殺傷作用。這與張靜等[17]的研究結果不同,該研究顯示NAC有效組化療前后的ADC值變化有明顯差異,而無效組化療前后ADC值變化無明顯差異。
本研究顯示,采用平均ADC值法,在NAC第2周期結束時,MHR組與NMHR組間△ADC%未見明顯差異,而在NAC全程結束后兩組△ADC%差異有統計學意義;而采用低ADC值法,在NAC第2周期結束時就顯示MHR組與NMHR組間△ADC%存在明顯差異,說明低ADC值法能在更早期通過檢測△ADC%對NAC療效起到評估作用。
采用兩種ADC值測量方法預測乳腺癌化療后的病理反應性,ROC曲線分析顯示兩者的敏感度均為88.9%,但低ADC值法所得到的△ADC%臨界值小于平均ADC值法,即低ADC值法能在病灶△ADC%更小的情況下對乳腺癌術前NAC的療效進行評估。