為了解決當前納米銀抗菌凝膠體外細胞毒性大、用光引發法制備納米銀時其顆粒尺寸和尺寸分布范圍大的問題,本研究采用了物理交聯法制備殼聚糖凝膠,由于采用泊洛沙姆作為制備納米銀的分散劑,制備出生物相容性更好且抗菌效果良好的納米銀抗菌凝膠。本研究加入泊洛沙姆作為納米銀分散劑以光引發法制備納米銀,并對制備的納米銀混合液與烘干后顆粒分別進行紫外可見吸收光譜實驗和掃描電鏡(SEM)實驗。研究采用以碳酸氫鈉對凝膠pH值進行調節的方法形成凝膠,并對其進行pH值測試、凝膠斷面的SEM測試、溶脹率測試、黏度測試、抑菌圈實驗以及體外細胞毒性實驗。測試結果顯示,當以超純水為溶劑時,以泊洛沙姆為分散劑所制備出的納米銀的最大吸收波長為414 nm,平均粒徑約為60 nm,相比于以聚乙烯吡咯烷酮(PVP)為分散劑或以蒸餾水為溶劑時所制備出的納米銀具有更小的粒徑以及更窄的粒徑分布。所制備出的凝膠的pH值介于5.8~6.1之間,呈弱酸性。干燥后的凝膠斷面具有較多孔洞,凝膠的吸水性良好,且黏度適宜,易于涂布于紗布上。此外,所制備出的凝膠在24、18、12 μg/mL的納米銀濃度下具有較好的抑制大腸桿菌與金黃色葡萄球菌的能力,且在納米銀濃度為24 μg/mL以下時均具有良好的生物相容性。基于以上特性,該納米銀抗菌凝膠有望應用于燒創傷口的治療。
引用本文: 李達恒, 余學飛, 胡云睿, 奚廷斐, 陳嘉, 張志雄. 殼聚糖-泊洛沙姆為凝膠基質的納米銀抗菌凝膠的制備與表征. 生物醫學工程學雜志, 2016, 33(6): 1124-1132. doi: 10.7507/1001-5515.20160179 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
納米銀通常指粒徑小于100 nm的金屬銀單質。由于納米銀的表面效應,同等濃度下其抑菌能力要明顯好于大顆粒的銀單質。此外,納米尺度的銀單質比銀離子具有更好的抑菌效果。在醫療領域使用的過程中,銀單質不會像抗生素那樣因為細菌的耐藥性而導致藥效喪失。正因如此,納米銀在醫療衛生領域的應用成為了近年來研究的熱點。目前,已有納米銀抗菌纖維、納米銀抗菌凝膠和納米銀抗菌敷料等醫療產品相繼問世,其應用范圍包括了痤瘡、前列腺炎、癬、婦科疾病以及燒傷、創傷等的治療。
納米銀抗菌凝膠因其具有廣譜抗菌、吸附組織滲出液等優點,常用于皮膚燒傷[1]、婦科疾病[2-3]等的治療,目前已經有多種納米銀抗菌凝膠產品面世。然而,中國市場上大多數納米銀抗菌凝膠產品都具有3級及以上的細胞毒性[4],其毒性主要來自過高的納米銀濃度以及凝膠基質本身[5]。一般來說,當納米銀劑量大于25 μg/mL時,會有比較大的細胞毒性(≥3級)[6]。因此,除了在制備過程中要保證納米銀顆粒的均勻分散外,控制納米銀的劑量、降低凝膠基質細胞毒性也是改進納米銀抗菌凝膠的重要方面。本研究一方面以保證納米銀的抗菌效果為前提,控制納米銀的濃度和粒徑分布;另一方面使用物理交聯法制備抗菌凝膠,降低凝膠基質的體外細胞毒性。
抗菌凝膠的基質材料主要有明膠、海藻酸鹽、透明質酸、羧甲基纖維素鈉、果膠、殼聚糖等[7-8]。與其他基質材料不同,殼聚糖除了具備形成凝膠基質的能力,其本身還具有一定抗菌活性[9-10],因此本研究選用殼聚糖為凝膠基質。形成殼聚糖凝膠的方法有戊二醛法[11]、物理交聯法[12](可通過調節pH值來實現)等。戊二醛法中的戊二醛細胞毒性較大,且不易去除。故本研究采用物理交聯法形成殼聚糖凝膠,不引入有毒的交聯劑,從而減少凝膠整體的細胞毒性。另外,在制備納米銀的過程中,如何均勻分散納米銀顆粒,是穩定發揮納米銀抗菌性能的關鍵。一般用作納米銀分散劑的試劑為聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)[13]等,而本研究采用了泊洛沙姆作為一種新的納米銀分散劑。因為泊洛沙姆是聚氧乙烯聚氧丙烯醚嵌段共聚物,在眼用凝膠等方面具有廣泛應用,且具有良好的生物相容性[14]。此外它還是一種表面活性劑,它能更好地把納米銀顆粒均勻分散,進而充分發揮納米銀的抑菌效果。因此,在制備納米銀和制備含納米銀抗菌凝膠兩個過程中,都添加了泊洛沙姆,分別作為形成納米銀所需的分散劑和形成抗菌凝膠的基質。
本研究首先通過光引發法制備出了納米銀,并對其混合液和烘干后的顆粒進行表征。其次,將制備好的納米銀分散液引入到凝膠體系中,分別制備出以殼聚糖和以殼聚糖-泊洛沙姆為基質的納米銀抗菌凝膠,并對其進行干凝膠斷面的掃描電鏡(scanning electron microscope,SEM)實驗和溶脹率(swelling ratio,SR)實驗,選出最佳的基質。之后,分別制備不同納米銀濃度的抗菌凝膠,并通過測試不同濃度(24、18、12、6、3、0 μg/mL)納米銀凝膠的體外細胞毒性與抑菌效果,選出最佳濃度的納米銀抗菌凝膠。最后,將選出的最佳濃度的凝膠樣品進行pH值測試和黏度測試。
1 材料與方法
1.1 材料
殼聚糖購自成都西亞化工股份有限公司,高黏度,分子量為100~300 kD。硝酸銀購自國藥集團化學試劑有限公司。泊洛沙姆407購自德國巴斯夫公司。檸檬酸三鈉購自廣東汕頭市西隴化工廠。藥用級聚維酮K-30(PVP)購自杭州普修生物科技有限公司。冰醋酸、碳酸氫鈉、丙三醇購自廣東光華科技股份有限公司。
1.2 納米銀分散液的制備
納米銀分散液的制備基于和俊等[15]的制備方法。取400 mg硝酸銀加入1 L蒸餾水或超純水中,充分攪拌均勻。磁力攪拌下(1 600 r/min),加入300 mg PVP或300 mg泊洛沙姆407作為分散劑。攪拌均勻后,加入300 mg檸檬酸三鈉,打開紫外燈,在紫外燈照射以及磁力攪拌下反應4~5 h即可得到納米銀混合液。一方面,將所得混合液用于紫外可見吸收光譜實驗。另一方面,將所得液體進行離心,棄去上清液,用蒸餾水或超純水稀釋后離心。重復上述步驟2次以洗去未反應的硝酸銀和分散劑。最后,將離心得到的納米銀沉淀進行烘干。稱取適量納米銀和泊洛沙姆,制備濃度為240 μg/mL的納米銀分散液。
1.3 納米銀抗菌凝膠的制備
物理凝膠的制備方法基于唐奚敏[16]的研究。取6個標記為0~5的50 mL燒杯,分別加入15 mL蒸餾水和200 μL冰醋酸(分析純,>99.0%)。其次,向0~5號燒杯中分別加入0、250、500、1 000、 1 500、 2 000 μL之前已制備的納米銀分散液。然后分別滴加600 μL甘油(分析純,>99.0%),攪拌使其充分溶解。之后分別向0~5號燒杯中加入50 mg泊洛沙姆407和0.42 g殼聚糖(平均分子量為Mη=200 000 D,脫乙酰度為95%),攪拌均勻后放置過夜,使其充分溶脹并使其中的氣泡排出。最后,分別向0~5號燒杯中滴加2 mL濃度為1 mol/L碳酸氫鈉溶液,攪拌均勻后,滴加蒸餾水,配制成20 mL的溶膠體系,并靜置幾天等待其形成凝膠。所制成的6個凝膠樣品的納米銀濃度分別為0、3、6、12、18、24 μg/mL。
1.4 所制備納米銀的表征
1.4.1 紫外吸收光譜實驗
為了測試不同種類的水以及不同的分散劑對納米銀生成的影響,故制備了四組納米銀混合液樣品進行紫外吸收光譜這一預實驗,分別記為泊洛沙姆-蒸餾水組、PVP-蒸餾水組、泊洛沙姆-超純水組、PVP-超純水組。使用紫外可見分光光度計測量樣品在300~500 nm紫外可見光波長范圍的吸光度。
1.4.2 SEM實驗
選取在紫外可見吸收光譜預實驗中納米銀粒徑較小的納米銀樣品組進行SEM實驗。取1~2滴納米銀分散液樣品滴加到干凈的載玻片上,在50 ℃的恒溫烘箱內烘干后,進行表面鍍金處理。之后在超高分辨率場發射掃描電子顯微鏡(儀器型號為Nova NanoSEM 430,荷蘭FEI公司制造)上觀察納米銀顆粒的微觀結構。所選取的主要參數為:高壓10 kV,高真空模式,掃描電鏡模式(mode SE)。
1.5 納米銀抗菌凝膠的表征
1.5.1 凝膠斷面的SEM實驗
為了觀察以殼聚糖(本研究所選濃度為2.1%)為凝膠基質以及以殼聚糖-泊洛沙姆(本研究所選濃度分別為2.1%、4‰)為凝膠基質的微觀結構差異,參考1.3小節的制備方法分別制備殼聚糖凝膠樣品與殼聚糖-泊洛沙姆凝膠樣品(除了泊洛沙姆的量不同,其它成分的濃度都相同)后,經常溫干燥且凝膠重量不再變化后得殼聚糖干凝膠與殼聚糖-泊洛沙姆干凝膠樣品,切取適量干凝膠并對其斷面分別進行表面鍍金處理后進行SEM實驗。實驗在超高分辨率場發射掃描電子顯微鏡(儀器型號為Nova NanoSEM 430,荷蘭FEI公司制造)上觀察凝膠斷面的微觀結構。
1.5.2 溶脹率實驗
為了測試泊洛沙姆的添加是否會影響凝膠體系的吸水能力,本項實驗同樣基于1.3小節的制備方法分別制備了殼聚糖抗菌凝膠與殼聚糖-泊洛沙姆抗菌凝膠(除了泊洛沙姆的量不同,其它成分的濃度都相同)。兩組凝膠成膠前,將凝膠平鋪于培養皿中,待其成膠后放入干燥劑使其得以充分干燥。待兩次稱量其重量不變后,將干燥后的干凝膠分割成1 cm×1 cm的薄片,每組分別取3片樣品作為平行組,做好標記后分別稱量其初始重量W0。之后將兩組干凝膠的各6個樣品置于生理鹽水中,測量其溶脹率。另外,將兩組干凝膠的另6個樣品置于PBS溶液中,測量其溶脹率。當浸泡時間分別達到5 min、30 min、1 h、2 h、6 h、12 h和24 h時,將薄片取出,并用濾紙輕拭其表面以擦除薄片表面的水分,用分析天平分別對薄片進行測重(記為WS)之后,再次放入生理鹽水或PBS溶液中等待下一次的測量。溶脹率的計算公式為SR(%)=100×(WS-W0)/W0。
1.5.3 體外細胞毒性實驗
通過以上實驗確定較適宜的凝膠基質后,為了測試不同納米銀濃度的抗菌凝膠的體外細胞毒性差異,本項實驗按照1.3小節的制備方法分別制備6種不同納米銀濃度的凝膠樣品進行測試。
① 細胞培養與接種:將L929細胞培養在含有10%胎牛血清的H-DMEM培養基中,并在5% CO2濃度、37 ℃環境下培養。培養基每三天替換一次。培養細胞貼壁使其達到80%左右的匯合度。細胞在培養基中傳代,選取第5~10代的細胞進行實驗。
把培養的細胞接種在24孔板中(5 000個/孔),在含有10%胎牛血清的H-DMEM培養基中培養24 h。之后,根據ISO 10993-12 2007的標準,按照凝膠質量與浸提介質體積之比為1 g∶10 mL制備浸提液。其中浸提介質為含有10%胎牛血清的H-DMEM培養基。在(37±2)℃條件下浸提24 h后,取其浸提液,并用此浸提液再培養L929細胞24 h。
② CCK-8實驗:在培養24 h后,使用CCK-8方法來評估凝膠的生物相容性。簡要地說,在指定的時間點,將細胞用PBS溶液沖洗3次。然后每孔加入含有35 μL CCK-8溶液的350 μL完全培養基。在37 ℃、黑暗環境下培養2 h后,將培養液轉移到新的96孔板中,每孔100 μL。使用ELISA plate reader在450 nm波長下測量溶液的光密度(optical density,OD)值。
③ 相對增殖率(relative growth rate,RGR)的計算:RGR=實驗組OD450/對照組OD450×100%。
④ 體外細胞毒性反應評級具體如下:當相對增殖率≥100%時,對應細胞毒性評級為0級;當相對增殖率為80%~99%時,對應細胞毒性評級為1級;當相對增殖率為50%~79%時,對應細胞毒性評級為2級;當相對增殖率為30%~49%時,對應細胞毒性評級為3級;當相對增殖率為0~29%時,對應細胞毒性評級為4級。
1.5.4 抑菌圈實驗
為了測試不同納米銀濃度的抗菌凝膠的抑菌能力差異,本項實驗亦按照1.3小節的制備方法分別制備6種不同納米銀濃度的凝膠樣品進行測試。將已活化好的大腸桿菌與金黃色葡萄球菌的細菌懸液(濃度各為108 CFU/mL的量級)分別取1~2 μL置于離心管中,用經過高壓蒸汽滅菌處理的PBS溶液(pH=7.4)1 mL將細菌懸濁液稀釋到105 CFU/mL的量級,輕輕振蕩均勻后置于恒溫培養箱中備用。使用平板涂布法,向已凝固冷卻的瓊脂培養基表面分別涂布稀釋過的細菌懸液。使用打孔器,將培養基打出大小一致的孔洞(本實驗所打孔洞直徑為9 mm),每個培養皿打3個孔洞,作為平行組。向打好的孔洞中注入凝膠樣品。最后,將培養皿置于恒溫培養箱中,37 ℃下培養24 h后測量抑菌圈大小。
1.5.5 pH值測試
根據2015年版《中國藥典》第三部的要求,凝膠劑一般應檢查其pH值,以防止pH值過高或過低對使用者造成損傷。通過以上實驗確定了該凝膠體系中較適宜的納米銀添加濃度后,使用筆式pH計(儀器型號為PHB-5,杭州奧立龍儀器有限公司)對含有該納米銀濃度的凝膠樣品的pH值進行測定。
1.5.6 黏度測試
本項實驗選用旋轉式黏度計(BROOKFIELD DV-Ⅱ+ Pro Viscometer)對上述確定納米銀濃度的凝膠樣品進行黏度測試。凝膠樣品選擇在28.9 ℃環境下測試,并選用2號轉子進行黏度測試。
2 結果
2.1 所制備納米銀的表征結果
2.1.1 紫外吸收光譜實驗結果
泊洛沙姆-蒸餾水組、PVP-蒸餾水組、泊洛沙姆-超純水組、PVP-超純水組的紫外吸收光譜如圖 1所示。
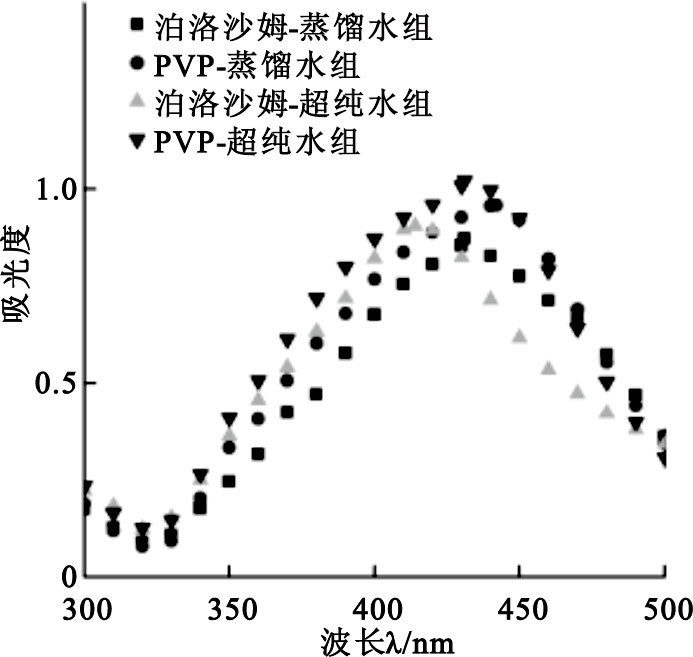 圖1
納米銀混合液的紫外吸收光譜
Figure1.
UV-Vis absorption spectra of nano silver mixed solution
圖1
納米銀混合液的紫外吸收光譜
Figure1.
UV-Vis absorption spectra of nano silver mixed solution
如圖 1所示,泊洛沙姆-蒸餾水組、PVP-蒸餾水組、泊洛沙姆-超純水組、PVP-超純水組制成的納米銀的最大吸收波長分別為431、442、414與431 nm,數據顯示以超純水為溶劑的體系具有更小的最大吸收波長(提示其粒徑較小),因此選取泊洛沙姆-超純水組與PVP-超純水組進行SEM實驗。
2.1.2 SEM實驗結果
泊洛沙姆-超純水組與PVP-超純水組的SEM圖像如圖 2所示。
 圖2
納米銀顆粒的SEM圖片
Figure2.
SEM images of silver nanoparticles
圖2
納米銀顆粒的SEM圖片
Figure2.
SEM images of silver nanoparticles
對比顯示,PVP-超純水組制成的納米銀的粒徑分布較廣,經統計計算,其粒徑分布介于50~120 nm之間,圖 2右上為被PVP包裹的納米銀顆粒;而由圖 2左下可知,泊洛沙姆-超純水組制成的納米銀的粒徑分布較窄,經統計計算,其粒徑分布介于45~85 nm之間,圖 2右下為被泊洛沙姆包裹的納米銀顆粒。
所以,在用紫外光化學法制備納米銀時,有兩個比較重要的因素能影響生成的納米銀的大小。一是溶劑的種類,使用超純水制備的納米銀與使用蒸餾水制備的納米銀相比具有更小的粒徑與粒徑范圍;二是分散劑的種類,使用泊洛沙姆作為分散劑制備出的納米銀相比于使用PVP作為分散劑制備出的納米銀具有更小的粒徑與粒徑范圍。
2.2 納米銀抗菌凝膠的表征結果
2.2.1 凝膠斷面的SEM實驗結果
以殼聚糖為凝膠基質和以殼聚糖-泊洛沙姆為凝膠基質的干凝膠的微觀結構如圖 3所示。
 圖3
干凝膠斷面的SEM圖片
Figure3.
SEM images of dried gel
圖3
干凝膠斷面的SEM圖片
Figure3.
SEM images of dried gel
由圖 3可知,殼聚糖干凝膠的斷面較為平滑平整,而殼聚糖-泊洛沙姆干凝膠的斷面具有較多孔洞結構,且孔洞大小小于20 μm。由此可知,在殼聚糖的凝膠體系中,泊洛沙姆的引入會改變凝膠內部的微觀結構,使其變得更蓬松。泊洛沙姆分子與殼聚糖分子的相互作用,會促使孔洞的形成。另外,根據殼聚糖與殼聚糖-泊洛沙姆的SEM圖片,可大致判斷,殼聚糖-泊洛沙姆凝膠的溶脹性要比殼聚糖凝膠的溶脹性好。
2.2.2 溶脹率實驗結果
殼聚糖干凝膠和殼聚糖-泊洛沙姆干凝膠在PBS溶液和生理鹽水溶液中的溶脹率如圖 4所示。
由圖 4左圖可知,兩組干凝膠在PBS溶液中浸泡時間為5 min時,兩者的溶脹率皆已高于200%。在1 h內時,兩者的溶脹率穩步上升并分別達到290%和460%的高峰。但當浸泡時間達到2 h時,開始出現下降。隨后,隨著浸泡時間的延長,其溶脹率也逐漸下降,24 h后兩者的溶脹率分別降到94%和140%。由圖還可明顯地看到,無論在哪個時間點,殼聚糖-泊洛沙姆組干凝膠的溶脹率均明顯高于殼聚糖組。
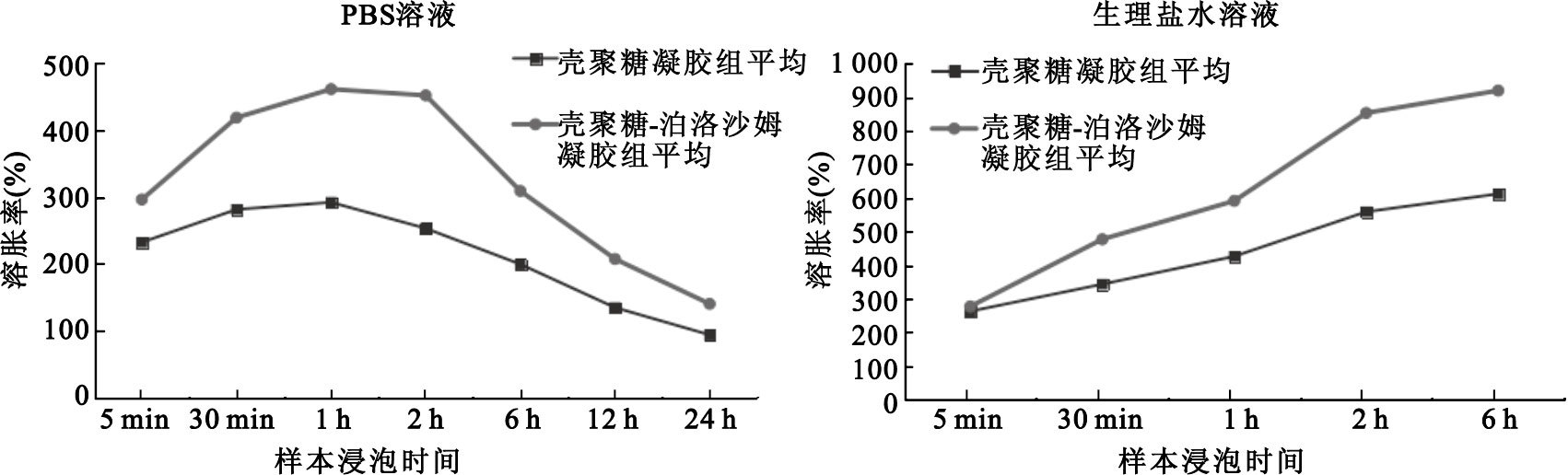 圖4
兩組干凝膠的溶脹率
Figure4.
Swelling ratio of the two groups of dried gel
圖4
兩組干凝膠的溶脹率
Figure4.
Swelling ratio of the two groups of dried gel
由圖 4右圖可知,兩組干凝膠在生理鹽水溶液中浸泡時間為5 min時,兩者的溶脹率亦皆高于200%。隨后,隨著浸泡時間的延長,兩者的溶脹率也穩步增長,當浸泡時間為6 h時,兩者的溶脹率已分別達到612%和920%。而當浸泡時間大于6 h時,由于干凝膠過度溶脹,兩組樣品均已變成非常柔軟且沒有固定形狀的膠團,因此之后的溶脹率無法繼續測量。
綜上所述,無論在PBS溶液還是生理鹽水溶液中,殼聚糖-泊洛沙姆凝膠的溶脹率均優于殼聚糖凝膠的溶脹率。在干凝膠斷面SEM實驗中的猜測得到了直接驗證。
2.2.3 體外細胞毒性實驗結果
不同納米銀濃度的抗菌凝膠的體外細胞毒性評級如圖 5所示。
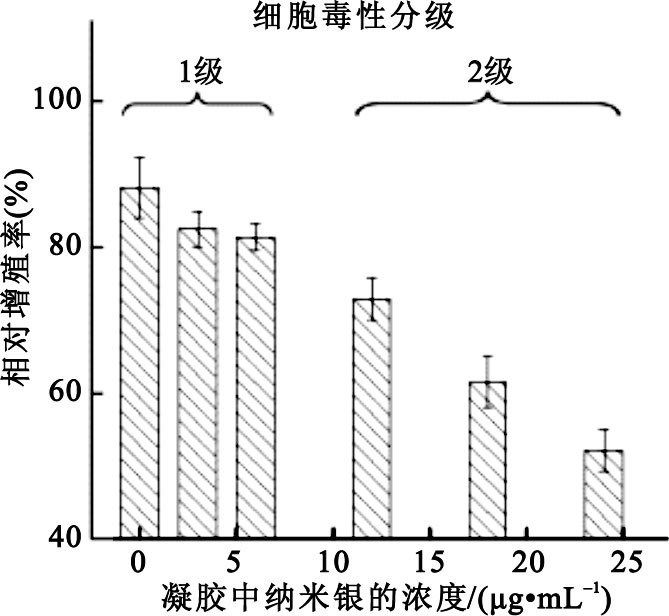 圖5
不同納米銀濃度的抗菌凝膠的體外細胞毒性
Figure5.
In vitro cytotoxicity of antibacterial hydrogel with different silver nanoparticle concentrations
圖5
不同納米銀濃度的抗菌凝膠的體外細胞毒性
Figure5.
In vitro cytotoxicity of antibacterial hydrogel with different silver nanoparticle concentrations
不同納米銀濃度的抗菌凝膠的體外細胞毒性分級都低于或等于2級,具有良好的細胞相容性。隨著凝膠中納米銀濃度的增加,凝膠的體外細胞毒性也逐漸增加。其中,納米銀濃度分別為0、3、6μg/mL的三組的體外細胞毒性分級為1級,對應的相對增殖率分別為88.1%、82.5%、81.4%;納米銀濃度分別為12、18、24 μg/mL的三組的體外細胞毒性分級為2級,對應的相對增殖率分別為72.9%、61.5%、52.2%。
2.2.4 抑菌圈實驗結果
不同納米銀濃度的抗菌凝膠在不同菌種中形成的抑菌圈的平均大小如圖 6所示。
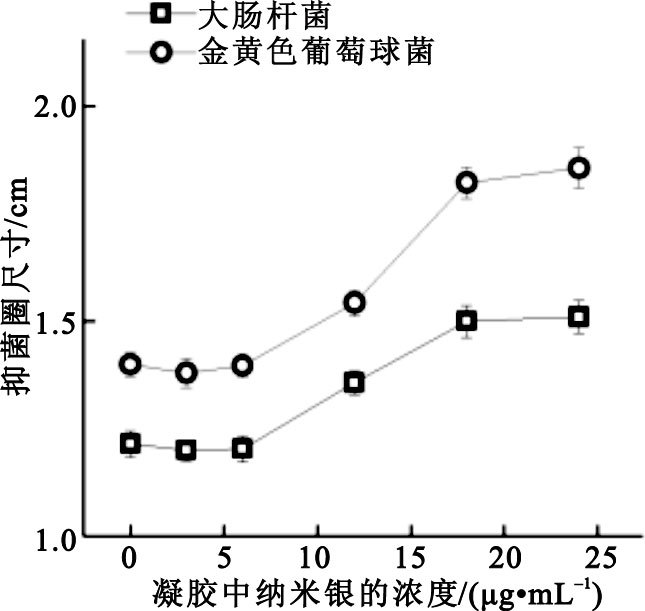 圖6
不同納米銀濃度的抗菌凝膠在不同菌種中的抗菌特性
Figure6.
Antibacterial property of antibacterial hydrogel with different silver nanoparticle concentrations
圖6
不同納米銀濃度的抗菌凝膠在不同菌種中的抗菌特性
Figure6.
Antibacterial property of antibacterial hydrogel with different silver nanoparticle concentrations
由圖 6可知,大腸桿菌組與金黃色葡萄球菌組都具有明顯的抑菌圈,且兩組數據的表現類似。在兩組抑菌圈實驗中,可以看到當凝膠樣品的納米銀濃度為24 μg/mL與18 μg/mL時,抑菌圈大小沒有明顯差異,但隨著濃度梯度的降低,抑菌圈隨之變小。12 μg/mL組的抑菌圈已有明顯縮小,而0、3、6 μg/mL三組的抑菌圈又進一步變小,且此三組對大腸桿菌或金黃色葡萄球菌的抑菌能力均無明顯差異。另外,可以看到殼聚糖-泊洛沙姆空白凝膠組也具有一定的抑制大腸桿菌和金黃色葡萄球菌的能力。
通過綜合不同納米銀濃度的抗菌凝膠在體外細胞毒性實驗和抑菌圈實驗中的結果,本研究優選出了12 μg/mL這一濃度作為殼聚糖-泊洛沙姆體系中納米銀的優選濃度。
2.2.5 pH值測試結果
所制備的納米銀抗菌凝膠的pH值為5.8~6.1,呈弱酸性。
2.2.6 黏度測試結果
以殼聚糖-泊洛沙姆為基質的抗菌凝膠的黏度如表 1所示。由表 1可知,隨著轉子轉速的增加,凝膠的表觀黏度越來越小。且轉子速度越大,爬桿效應越明顯,因此所制備的凝膠為非牛頓流體。
3 討論
金屬納米粒子的表面等離子共振吸收峰位置、半高寬和峰值強度分別與粒子大小、尺寸分布和金屬納米粒子的濃度有很大關系[13, 17]。吸收峰的位置基本上可以確定粒子的大小,在通常情況下,粒子越小,吸收峰的位置就越藍移;吸收峰的半高寬越寬,粒子尺寸分布就越廣泛;當吸收峰的位置和半高寬均不改變而吸收峰的峰值增大時,說明金屬納米粒子濃度增大,即單位體積內粒子數增多[17]。因此,在制備納米銀混合液后,可以利用紫外-可見光吸收光譜圖來反映生成物粒子大小和尺寸分布范圍。
由紫外吸收光譜實驗可知,在同種溶劑的溶液體系中,添加泊洛沙姆的溶液體系相比于添加PVP的溶液體系具有更小的最大吸收波長。因此可推斷添加泊洛沙姆的溶液體系中,生成的納米銀顆粒的平均粒徑要小于添加PVP的溶液體系的納米銀顆粒。而在添加同種試劑的溶液體系中,以超純水為溶劑的溶液體系相比于以蒸餾水為溶劑的溶液體系具有更小的最大吸收波長。因此可推斷以超純水為溶劑的溶液體系中,生成的納米銀顆粒的平均粒徑要小于以蒸餾水為溶劑的溶液體系中的納米銀顆粒。為了驗證以上推斷,需要進行SEM實驗來觀察其形態特征。
在納米銀的SEM實驗中,PVP-超純水組制成的納米銀的粒徑分布較廣,其粒徑分布介于50~120 nm之間;而泊洛沙姆-超純水組制成的納米銀的粒徑分布較窄,其粒徑分布介于45~85 nm之間。不難發現,納米銀的粒徑分布范圍與在紫外吸收光譜實驗中的半高寬基本成正比。另外,由于本研究所制備的納米銀的粒徑中等,既避免了由于納米銀粒徑過大而使其抗菌活性降低,也避免了由于其粒徑過小而導致細胞毒性的上升[18]。此外,在圖 2右側兩個圖中,添加有PVP和泊洛沙姆的兩組都可清楚地觀察到納米銀顆粒被高分子材料包裹的情況,因此可以推測,高分子材料的包裹可避免納米銀顆粒在形成過程中發生聚集與沉淀,從而形成分散的納米銀溶液。
當殼聚糖分散于稀醋酸溶液中時,主要存在兩個平衡關系,如式(1)和式(2)所示:
| $\text{C}{{\text{H}}_{\text{3}}}\text{COOH}\rightleftharpoons {{\text{H}}^{\text{+}}}\text{+C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}}$ |
此時的殼聚糖主要以Chitosan-NH3+的狀態存在,分子鏈由于靜電斥力的作用而完全舒展。當加入NaHCO3后,HCO3-與H+發生結合產生 CO2氣體,溶液體系的pH值發生改變,平衡(2)向左移動,殼聚糖分子鏈上的氨基發生去質子化,靜電斥力受到破壞,同時殼聚糖分子間的氫鍵作用和疏水作用加強[19]。隨著pH值的緩慢變大,殼聚糖分子也逐漸收縮,在收縮過程中形成交聯點,構成三維網狀結構。在殼聚糖分子間形成交聯點的過程中,泊洛沙姆分子中的羥基與殼聚糖分子中的氨基也可能會產生新的氫鍵,共同構成復雜的三維網絡結構,形成凝膠。
在殼聚糖凝膠、殼聚糖-泊洛沙姆凝膠斷面的SEM實驗中,殼聚糖干凝膠斷面結構較為致密,斷面平滑規整,沒有明顯孔洞結構。而殼聚糖-泊洛沙姆干凝膠的斷面較為疏松,斷面具有較多最大直徑小于20 μm的孔洞結構。由此可推斷,孔洞的形成可能得益于泊洛沙姆分子鏈中的某些基團(例如-CH2-)與殼聚糖分子鏈中的某些基團(例如-NH2)發生了相互作用,形成了氫鍵交聯點,從而進一步形成了孔洞。
在凝膠的溶脹率實驗中,所制備的干凝膠具有很好吸水能力,并且添加有泊洛沙姆的殼聚糖凝膠基質的吸水能力明顯優于不添加泊洛沙姆的殼聚糖凝膠基質。殼聚糖-泊洛沙姆凝膠在生理鹽水溶液中浸泡6 h后,其溶脹率已超900%,并在之后仍能繼續吸收水分,直到12 h后由于過度溶脹形成非常柔軟的膠團。基于其優良的吸水能力,可以應用于體液滲出期的燒傷創面或傷口上。因為所制備的抗菌凝膠具有一定的吸收組織滲出液的作用,并在創口上形成潮濕的環境,且其本身具有一定抑菌抗感染的作用,因此有利于燒傷創面的更快愈合[20]。
通過綜合兩組干凝膠在SEM測試和溶脹率實驗中的結果,本研究選擇了殼聚糖-泊洛沙姆凝膠體系作為優選凝膠體系。
在抑菌圈實驗結果中發現,納米銀濃度為24 μg/mL和18 μg/mL的兩組的抑菌能力最強,其次為12 μg/mL的凝膠,而0、3、6 μg/mL的三組的抑菌能力相對較差。在凝膠中,無論納米銀含量的高低,甚至不含納米銀時,都具有一定的抗菌能力。因為納米銀顆粒與殼聚糖分子都具有一定的抑菌能力[21-24]。目前,關于納米銀顆粒的抑菌機制與殼聚糖的抑菌機制都還沒有確切的結論。納米銀顆粒的抑菌機制主要有以下幾個方面[22, 24]:銀納米粒子可能通過附著到細胞膜的表面來干擾細胞的滲透性及其呼吸功能;在相同質量的情況下,納米銀顆粒能比其他大顆粒擁有更大的表面積,從而具有更大的與微生物相互作用的空間;銀納米顆粒能與細菌膜上的含硫蛋白質發生相互作用,同時也與諸如DNA上的含磷化合物發生相互作用,從而使細菌失活;納米銀顆粒可在細菌內部釋放銀離子,它可提高其抗菌活性。殼聚糖的抑菌機制主要包括以下幾個方面[24]:一是殼聚糖分子結構中存在帶有正電荷的氨基,它易與表面帶有負電荷的類脂-蛋白質、磷壁酸和莢膜多糖等的菌體發生結合,影響細菌正常的呼吸代謝和生理結構,從而使其失活;二是殼聚糖進入菌體內部通過與細菌生存所必需的成分如蛋白質等結合,破壞其代謝平衡,或選擇性地螯合對微生物生長起關鍵作用的金屬離子,尤其是酶的輔助因子,從而抑制微生物的生長和繁殖。最后,也可能同時與DNA相互作用,擾亂DNA的復制與轉錄。值得注意的是,本研究中,無論是含有納米銀的凝膠還是不含納米銀的凝膠,所實驗的凝膠對金黃色葡萄球菌的抑菌效果都要比對大腸桿菌的效果要好。
通過體外細胞毒性實驗結果發現,不含納米銀的凝膠具有優良的生物相容性,同樣,含有低納米銀濃度的凝膠也具有優良的生物相容性。但是,隨著納米銀濃度的升高,凝膠的生物相容性逐漸下降。當納米銀濃度為24 μg/mL時,L929細胞的相對增殖率進一步降至52.2%,細胞毒性評級幾乎快達到3級。因此,制備過程中需要控制納米銀的濃度,來降低其細胞毒性。
因此,通過平衡抑菌圈實驗和體外細胞毒性實驗的結果,本研究選取了12 μg/mL的納米銀濃度作為殼聚糖-泊洛沙姆凝膠體系的最佳納米銀濃度。
最后,通過pH值測試和黏度測試發現,殼聚糖-泊洛沙姆凝膠呈弱酸性,酸堿度適中,且黏度良好,可作為綜合考慮之選。
4 結論
本研究通過物理交聯法制備了一種抗菌、較好吸水特性且具有良好生物相容性的納米銀抗菌凝膠。所制備的凝膠黏度適中,易于涂抹到紗布上。基于以上特性,該凝膠有望應用于體液滲出期的燒傷創面或傷口上。另外,通過平衡凝膠的抑菌能力與生物相容性,得到在該體系中最優的納米銀濃度約為12 μg/mL。
引言
納米銀通常指粒徑小于100 nm的金屬銀單質。由于納米銀的表面效應,同等濃度下其抑菌能力要明顯好于大顆粒的銀單質。此外,納米尺度的銀單質比銀離子具有更好的抑菌效果。在醫療領域使用的過程中,銀單質不會像抗生素那樣因為細菌的耐藥性而導致藥效喪失。正因如此,納米銀在醫療衛生領域的應用成為了近年來研究的熱點。目前,已有納米銀抗菌纖維、納米銀抗菌凝膠和納米銀抗菌敷料等醫療產品相繼問世,其應用范圍包括了痤瘡、前列腺炎、癬、婦科疾病以及燒傷、創傷等的治療。
納米銀抗菌凝膠因其具有廣譜抗菌、吸附組織滲出液等優點,常用于皮膚燒傷[1]、婦科疾病[2-3]等的治療,目前已經有多種納米銀抗菌凝膠產品面世。然而,中國市場上大多數納米銀抗菌凝膠產品都具有3級及以上的細胞毒性[4],其毒性主要來自過高的納米銀濃度以及凝膠基質本身[5]。一般來說,當納米銀劑量大于25 μg/mL時,會有比較大的細胞毒性(≥3級)[6]。因此,除了在制備過程中要保證納米銀顆粒的均勻分散外,控制納米銀的劑量、降低凝膠基質細胞毒性也是改進納米銀抗菌凝膠的重要方面。本研究一方面以保證納米銀的抗菌效果為前提,控制納米銀的濃度和粒徑分布;另一方面使用物理交聯法制備抗菌凝膠,降低凝膠基質的體外細胞毒性。
抗菌凝膠的基質材料主要有明膠、海藻酸鹽、透明質酸、羧甲基纖維素鈉、果膠、殼聚糖等[7-8]。與其他基質材料不同,殼聚糖除了具備形成凝膠基質的能力,其本身還具有一定抗菌活性[9-10],因此本研究選用殼聚糖為凝膠基質。形成殼聚糖凝膠的方法有戊二醛法[11]、物理交聯法[12](可通過調節pH值來實現)等。戊二醛法中的戊二醛細胞毒性較大,且不易去除。故本研究采用物理交聯法形成殼聚糖凝膠,不引入有毒的交聯劑,從而減少凝膠整體的細胞毒性。另外,在制備納米銀的過程中,如何均勻分散納米銀顆粒,是穩定發揮納米銀抗菌性能的關鍵。一般用作納米銀分散劑的試劑為聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)[13]等,而本研究采用了泊洛沙姆作為一種新的納米銀分散劑。因為泊洛沙姆是聚氧乙烯聚氧丙烯醚嵌段共聚物,在眼用凝膠等方面具有廣泛應用,且具有良好的生物相容性[14]。此外它還是一種表面活性劑,它能更好地把納米銀顆粒均勻分散,進而充分發揮納米銀的抑菌效果。因此,在制備納米銀和制備含納米銀抗菌凝膠兩個過程中,都添加了泊洛沙姆,分別作為形成納米銀所需的分散劑和形成抗菌凝膠的基質。
本研究首先通過光引發法制備出了納米銀,并對其混合液和烘干后的顆粒進行表征。其次,將制備好的納米銀分散液引入到凝膠體系中,分別制備出以殼聚糖和以殼聚糖-泊洛沙姆為基質的納米銀抗菌凝膠,并對其進行干凝膠斷面的掃描電鏡(scanning electron microscope,SEM)實驗和溶脹率(swelling ratio,SR)實驗,選出最佳的基質。之后,分別制備不同納米銀濃度的抗菌凝膠,并通過測試不同濃度(24、18、12、6、3、0 μg/mL)納米銀凝膠的體外細胞毒性與抑菌效果,選出最佳濃度的納米銀抗菌凝膠。最后,將選出的最佳濃度的凝膠樣品進行pH值測試和黏度測試。
1 材料與方法
1.1 材料
殼聚糖購自成都西亞化工股份有限公司,高黏度,分子量為100~300 kD。硝酸銀購自國藥集團化學試劑有限公司。泊洛沙姆407購自德國巴斯夫公司。檸檬酸三鈉購自廣東汕頭市西隴化工廠。藥用級聚維酮K-30(PVP)購自杭州普修生物科技有限公司。冰醋酸、碳酸氫鈉、丙三醇購自廣東光華科技股份有限公司。
1.2 納米銀分散液的制備
納米銀分散液的制備基于和俊等[15]的制備方法。取400 mg硝酸銀加入1 L蒸餾水或超純水中,充分攪拌均勻。磁力攪拌下(1 600 r/min),加入300 mg PVP或300 mg泊洛沙姆407作為分散劑。攪拌均勻后,加入300 mg檸檬酸三鈉,打開紫外燈,在紫外燈照射以及磁力攪拌下反應4~5 h即可得到納米銀混合液。一方面,將所得混合液用于紫外可見吸收光譜實驗。另一方面,將所得液體進行離心,棄去上清液,用蒸餾水或超純水稀釋后離心。重復上述步驟2次以洗去未反應的硝酸銀和分散劑。最后,將離心得到的納米銀沉淀進行烘干。稱取適量納米銀和泊洛沙姆,制備濃度為240 μg/mL的納米銀分散液。
1.3 納米銀抗菌凝膠的制備
物理凝膠的制備方法基于唐奚敏[16]的研究。取6個標記為0~5的50 mL燒杯,分別加入15 mL蒸餾水和200 μL冰醋酸(分析純,>99.0%)。其次,向0~5號燒杯中分別加入0、250、500、1 000、 1 500、 2 000 μL之前已制備的納米銀分散液。然后分別滴加600 μL甘油(分析純,>99.0%),攪拌使其充分溶解。之后分別向0~5號燒杯中加入50 mg泊洛沙姆407和0.42 g殼聚糖(平均分子量為Mη=200 000 D,脫乙酰度為95%),攪拌均勻后放置過夜,使其充分溶脹并使其中的氣泡排出。最后,分別向0~5號燒杯中滴加2 mL濃度為1 mol/L碳酸氫鈉溶液,攪拌均勻后,滴加蒸餾水,配制成20 mL的溶膠體系,并靜置幾天等待其形成凝膠。所制成的6個凝膠樣品的納米銀濃度分別為0、3、6、12、18、24 μg/mL。
1.4 所制備納米銀的表征
1.4.1 紫外吸收光譜實驗
為了測試不同種類的水以及不同的分散劑對納米銀生成的影響,故制備了四組納米銀混合液樣品進行紫外吸收光譜這一預實驗,分別記為泊洛沙姆-蒸餾水組、PVP-蒸餾水組、泊洛沙姆-超純水組、PVP-超純水組。使用紫外可見分光光度計測量樣品在300~500 nm紫外可見光波長范圍的吸光度。
1.4.2 SEM實驗
選取在紫外可見吸收光譜預實驗中納米銀粒徑較小的納米銀樣品組進行SEM實驗。取1~2滴納米銀分散液樣品滴加到干凈的載玻片上,在50 ℃的恒溫烘箱內烘干后,進行表面鍍金處理。之后在超高分辨率場發射掃描電子顯微鏡(儀器型號為Nova NanoSEM 430,荷蘭FEI公司制造)上觀察納米銀顆粒的微觀結構。所選取的主要參數為:高壓10 kV,高真空模式,掃描電鏡模式(mode SE)。
1.5 納米銀抗菌凝膠的表征
1.5.1 凝膠斷面的SEM實驗
為了觀察以殼聚糖(本研究所選濃度為2.1%)為凝膠基質以及以殼聚糖-泊洛沙姆(本研究所選濃度分別為2.1%、4‰)為凝膠基質的微觀結構差異,參考1.3小節的制備方法分別制備殼聚糖凝膠樣品與殼聚糖-泊洛沙姆凝膠樣品(除了泊洛沙姆的量不同,其它成分的濃度都相同)后,經常溫干燥且凝膠重量不再變化后得殼聚糖干凝膠與殼聚糖-泊洛沙姆干凝膠樣品,切取適量干凝膠并對其斷面分別進行表面鍍金處理后進行SEM實驗。實驗在超高分辨率場發射掃描電子顯微鏡(儀器型號為Nova NanoSEM 430,荷蘭FEI公司制造)上觀察凝膠斷面的微觀結構。
1.5.2 溶脹率實驗
為了測試泊洛沙姆的添加是否會影響凝膠體系的吸水能力,本項實驗同樣基于1.3小節的制備方法分別制備了殼聚糖抗菌凝膠與殼聚糖-泊洛沙姆抗菌凝膠(除了泊洛沙姆的量不同,其它成分的濃度都相同)。兩組凝膠成膠前,將凝膠平鋪于培養皿中,待其成膠后放入干燥劑使其得以充分干燥。待兩次稱量其重量不變后,將干燥后的干凝膠分割成1 cm×1 cm的薄片,每組分別取3片樣品作為平行組,做好標記后分別稱量其初始重量W0。之后將兩組干凝膠的各6個樣品置于生理鹽水中,測量其溶脹率。另外,將兩組干凝膠的另6個樣品置于PBS溶液中,測量其溶脹率。當浸泡時間分別達到5 min、30 min、1 h、2 h、6 h、12 h和24 h時,將薄片取出,并用濾紙輕拭其表面以擦除薄片表面的水分,用分析天平分別對薄片進行測重(記為WS)之后,再次放入生理鹽水或PBS溶液中等待下一次的測量。溶脹率的計算公式為SR(%)=100×(WS-W0)/W0。
1.5.3 體外細胞毒性實驗
通過以上實驗確定較適宜的凝膠基質后,為了測試不同納米銀濃度的抗菌凝膠的體外細胞毒性差異,本項實驗按照1.3小節的制備方法分別制備6種不同納米銀濃度的凝膠樣品進行測試。
① 細胞培養與接種:將L929細胞培養在含有10%胎牛血清的H-DMEM培養基中,并在5% CO2濃度、37 ℃環境下培養。培養基每三天替換一次。培養細胞貼壁使其達到80%左右的匯合度。細胞在培養基中傳代,選取第5~10代的細胞進行實驗。
把培養的細胞接種在24孔板中(5 000個/孔),在含有10%胎牛血清的H-DMEM培養基中培養24 h。之后,根據ISO 10993-12 2007的標準,按照凝膠質量與浸提介質體積之比為1 g∶10 mL制備浸提液。其中浸提介質為含有10%胎牛血清的H-DMEM培養基。在(37±2)℃條件下浸提24 h后,取其浸提液,并用此浸提液再培養L929細胞24 h。
② CCK-8實驗:在培養24 h后,使用CCK-8方法來評估凝膠的生物相容性。簡要地說,在指定的時間點,將細胞用PBS溶液沖洗3次。然后每孔加入含有35 μL CCK-8溶液的350 μL完全培養基。在37 ℃、黑暗環境下培養2 h后,將培養液轉移到新的96孔板中,每孔100 μL。使用ELISA plate reader在450 nm波長下測量溶液的光密度(optical density,OD)值。
③ 相對增殖率(relative growth rate,RGR)的計算:RGR=實驗組OD450/對照組OD450×100%。
④ 體外細胞毒性反應評級具體如下:當相對增殖率≥100%時,對應細胞毒性評級為0級;當相對增殖率為80%~99%時,對應細胞毒性評級為1級;當相對增殖率為50%~79%時,對應細胞毒性評級為2級;當相對增殖率為30%~49%時,對應細胞毒性評級為3級;當相對增殖率為0~29%時,對應細胞毒性評級為4級。
1.5.4 抑菌圈實驗
為了測試不同納米銀濃度的抗菌凝膠的抑菌能力差異,本項實驗亦按照1.3小節的制備方法分別制備6種不同納米銀濃度的凝膠樣品進行測試。將已活化好的大腸桿菌與金黃色葡萄球菌的細菌懸液(濃度各為108 CFU/mL的量級)分別取1~2 μL置于離心管中,用經過高壓蒸汽滅菌處理的PBS溶液(pH=7.4)1 mL將細菌懸濁液稀釋到105 CFU/mL的量級,輕輕振蕩均勻后置于恒溫培養箱中備用。使用平板涂布法,向已凝固冷卻的瓊脂培養基表面分別涂布稀釋過的細菌懸液。使用打孔器,將培養基打出大小一致的孔洞(本實驗所打孔洞直徑為9 mm),每個培養皿打3個孔洞,作為平行組。向打好的孔洞中注入凝膠樣品。最后,將培養皿置于恒溫培養箱中,37 ℃下培養24 h后測量抑菌圈大小。
1.5.5 pH值測試
根據2015年版《中國藥典》第三部的要求,凝膠劑一般應檢查其pH值,以防止pH值過高或過低對使用者造成損傷。通過以上實驗確定了該凝膠體系中較適宜的納米銀添加濃度后,使用筆式pH計(儀器型號為PHB-5,杭州奧立龍儀器有限公司)對含有該納米銀濃度的凝膠樣品的pH值進行測定。
1.5.6 黏度測試
本項實驗選用旋轉式黏度計(BROOKFIELD DV-Ⅱ+ Pro Viscometer)對上述確定納米銀濃度的凝膠樣品進行黏度測試。凝膠樣品選擇在28.9 ℃環境下測試,并選用2號轉子進行黏度測試。
2 結果
2.1 所制備納米銀的表征結果
2.1.1 紫外吸收光譜實驗結果
泊洛沙姆-蒸餾水組、PVP-蒸餾水組、泊洛沙姆-超純水組、PVP-超純水組的紫外吸收光譜如圖 1所示。
 圖1
納米銀混合液的紫外吸收光譜
Figure1.
UV-Vis absorption spectra of nano silver mixed solution
圖1
納米銀混合液的紫外吸收光譜
Figure1.
UV-Vis absorption spectra of nano silver mixed solution
如圖 1所示,泊洛沙姆-蒸餾水組、PVP-蒸餾水組、泊洛沙姆-超純水組、PVP-超純水組制成的納米銀的最大吸收波長分別為431、442、414與431 nm,數據顯示以超純水為溶劑的體系具有更小的最大吸收波長(提示其粒徑較小),因此選取泊洛沙姆-超純水組與PVP-超純水組進行SEM實驗。
2.1.2 SEM實驗結果
泊洛沙姆-超純水組與PVP-超純水組的SEM圖像如圖 2所示。
 圖2
納米銀顆粒的SEM圖片
Figure2.
SEM images of silver nanoparticles
圖2
納米銀顆粒的SEM圖片
Figure2.
SEM images of silver nanoparticles
對比顯示,PVP-超純水組制成的納米銀的粒徑分布較廣,經統計計算,其粒徑分布介于50~120 nm之間,圖 2右上為被PVP包裹的納米銀顆粒;而由圖 2左下可知,泊洛沙姆-超純水組制成的納米銀的粒徑分布較窄,經統計計算,其粒徑分布介于45~85 nm之間,圖 2右下為被泊洛沙姆包裹的納米銀顆粒。
所以,在用紫外光化學法制備納米銀時,有兩個比較重要的因素能影響生成的納米銀的大小。一是溶劑的種類,使用超純水制備的納米銀與使用蒸餾水制備的納米銀相比具有更小的粒徑與粒徑范圍;二是分散劑的種類,使用泊洛沙姆作為分散劑制備出的納米銀相比于使用PVP作為分散劑制備出的納米銀具有更小的粒徑與粒徑范圍。
2.2 納米銀抗菌凝膠的表征結果
2.2.1 凝膠斷面的SEM實驗結果
以殼聚糖為凝膠基質和以殼聚糖-泊洛沙姆為凝膠基質的干凝膠的微觀結構如圖 3所示。
 圖3
干凝膠斷面的SEM圖片
Figure3.
SEM images of dried gel
圖3
干凝膠斷面的SEM圖片
Figure3.
SEM images of dried gel
由圖 3可知,殼聚糖干凝膠的斷面較為平滑平整,而殼聚糖-泊洛沙姆干凝膠的斷面具有較多孔洞結構,且孔洞大小小于20 μm。由此可知,在殼聚糖的凝膠體系中,泊洛沙姆的引入會改變凝膠內部的微觀結構,使其變得更蓬松。泊洛沙姆分子與殼聚糖分子的相互作用,會促使孔洞的形成。另外,根據殼聚糖與殼聚糖-泊洛沙姆的SEM圖片,可大致判斷,殼聚糖-泊洛沙姆凝膠的溶脹性要比殼聚糖凝膠的溶脹性好。
2.2.2 溶脹率實驗結果
殼聚糖干凝膠和殼聚糖-泊洛沙姆干凝膠在PBS溶液和生理鹽水溶液中的溶脹率如圖 4所示。
由圖 4左圖可知,兩組干凝膠在PBS溶液中浸泡時間為5 min時,兩者的溶脹率皆已高于200%。在1 h內時,兩者的溶脹率穩步上升并分別達到290%和460%的高峰。但當浸泡時間達到2 h時,開始出現下降。隨后,隨著浸泡時間的延長,其溶脹率也逐漸下降,24 h后兩者的溶脹率分別降到94%和140%。由圖還可明顯地看到,無論在哪個時間點,殼聚糖-泊洛沙姆組干凝膠的溶脹率均明顯高于殼聚糖組。
 圖4
兩組干凝膠的溶脹率
Figure4.
Swelling ratio of the two groups of dried gel
圖4
兩組干凝膠的溶脹率
Figure4.
Swelling ratio of the two groups of dried gel
由圖 4右圖可知,兩組干凝膠在生理鹽水溶液中浸泡時間為5 min時,兩者的溶脹率亦皆高于200%。隨后,隨著浸泡時間的延長,兩者的溶脹率也穩步增長,當浸泡時間為6 h時,兩者的溶脹率已分別達到612%和920%。而當浸泡時間大于6 h時,由于干凝膠過度溶脹,兩組樣品均已變成非常柔軟且沒有固定形狀的膠團,因此之后的溶脹率無法繼續測量。
綜上所述,無論在PBS溶液還是生理鹽水溶液中,殼聚糖-泊洛沙姆凝膠的溶脹率均優于殼聚糖凝膠的溶脹率。在干凝膠斷面SEM實驗中的猜測得到了直接驗證。
2.2.3 體外細胞毒性實驗結果
不同納米銀濃度的抗菌凝膠的體外細胞毒性評級如圖 5所示。
 圖5
不同納米銀濃度的抗菌凝膠的體外細胞毒性
Figure5.
In vitro cytotoxicity of antibacterial hydrogel with different silver nanoparticle concentrations
圖5
不同納米銀濃度的抗菌凝膠的體外細胞毒性
Figure5.
In vitro cytotoxicity of antibacterial hydrogel with different silver nanoparticle concentrations
不同納米銀濃度的抗菌凝膠的體外細胞毒性分級都低于或等于2級,具有良好的細胞相容性。隨著凝膠中納米銀濃度的增加,凝膠的體外細胞毒性也逐漸增加。其中,納米銀濃度分別為0、3、6μg/mL的三組的體外細胞毒性分級為1級,對應的相對增殖率分別為88.1%、82.5%、81.4%;納米銀濃度分別為12、18、24 μg/mL的三組的體外細胞毒性分級為2級,對應的相對增殖率分別為72.9%、61.5%、52.2%。
2.2.4 抑菌圈實驗結果
不同納米銀濃度的抗菌凝膠在不同菌種中形成的抑菌圈的平均大小如圖 6所示。
 圖6
不同納米銀濃度的抗菌凝膠在不同菌種中的抗菌特性
Figure6.
Antibacterial property of antibacterial hydrogel with different silver nanoparticle concentrations
圖6
不同納米銀濃度的抗菌凝膠在不同菌種中的抗菌特性
Figure6.
Antibacterial property of antibacterial hydrogel with different silver nanoparticle concentrations
由圖 6可知,大腸桿菌組與金黃色葡萄球菌組都具有明顯的抑菌圈,且兩組數據的表現類似。在兩組抑菌圈實驗中,可以看到當凝膠樣品的納米銀濃度為24 μg/mL與18 μg/mL時,抑菌圈大小沒有明顯差異,但隨著濃度梯度的降低,抑菌圈隨之變小。12 μg/mL組的抑菌圈已有明顯縮小,而0、3、6 μg/mL三組的抑菌圈又進一步變小,且此三組對大腸桿菌或金黃色葡萄球菌的抑菌能力均無明顯差異。另外,可以看到殼聚糖-泊洛沙姆空白凝膠組也具有一定的抑制大腸桿菌和金黃色葡萄球菌的能力。
通過綜合不同納米銀濃度的抗菌凝膠在體外細胞毒性實驗和抑菌圈實驗中的結果,本研究優選出了12 μg/mL這一濃度作為殼聚糖-泊洛沙姆體系中納米銀的優選濃度。
2.2.5 pH值測試結果
所制備的納米銀抗菌凝膠的pH值為5.8~6.1,呈弱酸性。
2.2.6 黏度測試結果
以殼聚糖-泊洛沙姆為基質的抗菌凝膠的黏度如表 1所示。由表 1可知,隨著轉子轉速的增加,凝膠的表觀黏度越來越小。且轉子速度越大,爬桿效應越明顯,因此所制備的凝膠為非牛頓流體。
3 討論
金屬納米粒子的表面等離子共振吸收峰位置、半高寬和峰值強度分別與粒子大小、尺寸分布和金屬納米粒子的濃度有很大關系[13, 17]。吸收峰的位置基本上可以確定粒子的大小,在通常情況下,粒子越小,吸收峰的位置就越藍移;吸收峰的半高寬越寬,粒子尺寸分布就越廣泛;當吸收峰的位置和半高寬均不改變而吸收峰的峰值增大時,說明金屬納米粒子濃度增大,即單位體積內粒子數增多[17]。因此,在制備納米銀混合液后,可以利用紫外-可見光吸收光譜圖來反映生成物粒子大小和尺寸分布范圍。
由紫外吸收光譜實驗可知,在同種溶劑的溶液體系中,添加泊洛沙姆的溶液體系相比于添加PVP的溶液體系具有更小的最大吸收波長。因此可推斷添加泊洛沙姆的溶液體系中,生成的納米銀顆粒的平均粒徑要小于添加PVP的溶液體系的納米銀顆粒。而在添加同種試劑的溶液體系中,以超純水為溶劑的溶液體系相比于以蒸餾水為溶劑的溶液體系具有更小的最大吸收波長。因此可推斷以超純水為溶劑的溶液體系中,生成的納米銀顆粒的平均粒徑要小于以蒸餾水為溶劑的溶液體系中的納米銀顆粒。為了驗證以上推斷,需要進行SEM實驗來觀察其形態特征。
在納米銀的SEM實驗中,PVP-超純水組制成的納米銀的粒徑分布較廣,其粒徑分布介于50~120 nm之間;而泊洛沙姆-超純水組制成的納米銀的粒徑分布較窄,其粒徑分布介于45~85 nm之間。不難發現,納米銀的粒徑分布范圍與在紫外吸收光譜實驗中的半高寬基本成正比。另外,由于本研究所制備的納米銀的粒徑中等,既避免了由于納米銀粒徑過大而使其抗菌活性降低,也避免了由于其粒徑過小而導致細胞毒性的上升[18]。此外,在圖 2右側兩個圖中,添加有PVP和泊洛沙姆的兩組都可清楚地觀察到納米銀顆粒被高分子材料包裹的情況,因此可以推測,高分子材料的包裹可避免納米銀顆粒在形成過程中發生聚集與沉淀,從而形成分散的納米銀溶液。
當殼聚糖分散于稀醋酸溶液中時,主要存在兩個平衡關系,如式(1)和式(2)所示:
| $\text{C}{{\text{H}}_{\text{3}}}\text{COOH}\rightleftharpoons {{\text{H}}^{\text{+}}}\text{+C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}}$ |
此時的殼聚糖主要以Chitosan-NH3+的狀態存在,分子鏈由于靜電斥力的作用而完全舒展。當加入NaHCO3后,HCO3-與H+發生結合產生 CO2氣體,溶液體系的pH值發生改變,平衡(2)向左移動,殼聚糖分子鏈上的氨基發生去質子化,靜電斥力受到破壞,同時殼聚糖分子間的氫鍵作用和疏水作用加強[19]。隨著pH值的緩慢變大,殼聚糖分子也逐漸收縮,在收縮過程中形成交聯點,構成三維網狀結構。在殼聚糖分子間形成交聯點的過程中,泊洛沙姆分子中的羥基與殼聚糖分子中的氨基也可能會產生新的氫鍵,共同構成復雜的三維網絡結構,形成凝膠。
在殼聚糖凝膠、殼聚糖-泊洛沙姆凝膠斷面的SEM實驗中,殼聚糖干凝膠斷面結構較為致密,斷面平滑規整,沒有明顯孔洞結構。而殼聚糖-泊洛沙姆干凝膠的斷面較為疏松,斷面具有較多最大直徑小于20 μm的孔洞結構。由此可推斷,孔洞的形成可能得益于泊洛沙姆分子鏈中的某些基團(例如-CH2-)與殼聚糖分子鏈中的某些基團(例如-NH2)發生了相互作用,形成了氫鍵交聯點,從而進一步形成了孔洞。
在凝膠的溶脹率實驗中,所制備的干凝膠具有很好吸水能力,并且添加有泊洛沙姆的殼聚糖凝膠基質的吸水能力明顯優于不添加泊洛沙姆的殼聚糖凝膠基質。殼聚糖-泊洛沙姆凝膠在生理鹽水溶液中浸泡6 h后,其溶脹率已超900%,并在之后仍能繼續吸收水分,直到12 h后由于過度溶脹形成非常柔軟的膠團。基于其優良的吸水能力,可以應用于體液滲出期的燒傷創面或傷口上。因為所制備的抗菌凝膠具有一定的吸收組織滲出液的作用,并在創口上形成潮濕的環境,且其本身具有一定抑菌抗感染的作用,因此有利于燒傷創面的更快愈合[20]。
通過綜合兩組干凝膠在SEM測試和溶脹率實驗中的結果,本研究選擇了殼聚糖-泊洛沙姆凝膠體系作為優選凝膠體系。
在抑菌圈實驗結果中發現,納米銀濃度為24 μg/mL和18 μg/mL的兩組的抑菌能力最強,其次為12 μg/mL的凝膠,而0、3、6 μg/mL的三組的抑菌能力相對較差。在凝膠中,無論納米銀含量的高低,甚至不含納米銀時,都具有一定的抗菌能力。因為納米銀顆粒與殼聚糖分子都具有一定的抑菌能力[21-24]。目前,關于納米銀顆粒的抑菌機制與殼聚糖的抑菌機制都還沒有確切的結論。納米銀顆粒的抑菌機制主要有以下幾個方面[22, 24]:銀納米粒子可能通過附著到細胞膜的表面來干擾細胞的滲透性及其呼吸功能;在相同質量的情況下,納米銀顆粒能比其他大顆粒擁有更大的表面積,從而具有更大的與微生物相互作用的空間;銀納米顆粒能與細菌膜上的含硫蛋白質發生相互作用,同時也與諸如DNA上的含磷化合物發生相互作用,從而使細菌失活;納米銀顆粒可在細菌內部釋放銀離子,它可提高其抗菌活性。殼聚糖的抑菌機制主要包括以下幾個方面[24]:一是殼聚糖分子結構中存在帶有正電荷的氨基,它易與表面帶有負電荷的類脂-蛋白質、磷壁酸和莢膜多糖等的菌體發生結合,影響細菌正常的呼吸代謝和生理結構,從而使其失活;二是殼聚糖進入菌體內部通過與細菌生存所必需的成分如蛋白質等結合,破壞其代謝平衡,或選擇性地螯合對微生物生長起關鍵作用的金屬離子,尤其是酶的輔助因子,從而抑制微生物的生長和繁殖。最后,也可能同時與DNA相互作用,擾亂DNA的復制與轉錄。值得注意的是,本研究中,無論是含有納米銀的凝膠還是不含納米銀的凝膠,所實驗的凝膠對金黃色葡萄球菌的抑菌效果都要比對大腸桿菌的效果要好。
通過體外細胞毒性實驗結果發現,不含納米銀的凝膠具有優良的生物相容性,同樣,含有低納米銀濃度的凝膠也具有優良的生物相容性。但是,隨著納米銀濃度的升高,凝膠的生物相容性逐漸下降。當納米銀濃度為24 μg/mL時,L929細胞的相對增殖率進一步降至52.2%,細胞毒性評級幾乎快達到3級。因此,制備過程中需要控制納米銀的濃度,來降低其細胞毒性。
因此,通過平衡抑菌圈實驗和體外細胞毒性實驗的結果,本研究選取了12 μg/mL的納米銀濃度作為殼聚糖-泊洛沙姆凝膠體系的最佳納米銀濃度。
最后,通過pH值測試和黏度測試發現,殼聚糖-泊洛沙姆凝膠呈弱酸性,酸堿度適中,且黏度良好,可作為綜合考慮之選。
4 結論
本研究通過物理交聯法制備了一種抗菌、較好吸水特性且具有良好生物相容性的納米銀抗菌凝膠。所制備的凝膠黏度適中,易于涂抹到紗布上。基于以上特性,該凝膠有望應用于體液滲出期的燒傷創面或傷口上。另外,通過平衡凝膠的抑菌能力與生物相容性,得到在該體系中最優的納米銀濃度約為12 μg/mL。




