竇房結鈣、膜鐘控制自律性的新機制為揭示竇性心律失常提供了幫助,但目前鈣鐘動力學模型僅處于單細胞水平。本文構建了竇房結中心和邊緣的單細胞模型,并按照指數形式改變中心到邊緣細胞的膜電容、大小、電導及細胞間偶聯電導,根據解剖結構構建了竇房結和心房二維非勻質模型。采用五點差分和有限元方法分別對組織內細胞網格和邊界進行處理。通過分段構造試函數的方法確定不規則的組織邊界。定量實驗表明,構建的中心和邊緣單細胞模型的動作電位在幅度、周期、最大舒張期電位以及上升速率等方面符合相關報道。鈣鐘和膜鐘對主導起搏位置和除極速率的作用以及房性早搏對竇房結自律性的影響等定量研究也符合相關實驗研究。本模型為深入探討鈣、膜鐘在竇房結自律性中的相對作用以及與心房電活動的關系提供了幫助,同時可為構建三維竇房結和心房器官模型等奠定基礎。
引用本文: 張虹, 李蕊娟, 黃欣, 姚翠萍. 基于鈣鐘的竇房結二維組織建模及定量分析. 生物醫學工程學雜志, 2016, 33(6): 1152-1157. doi: 10.7507/1001-5515.20160183 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
竇房結是心臟正常竇性節律的起搏點。竇房結細胞可以自動、有節律地產生電流并帶動心房組織興奮,繼而按照電傳導系統的順序最終引起心室肌的電興奮和心臟的收縮[1]。近年的研究發現,竇房結細胞內肌漿網(sarcoplasmic reticulum,SR)中的Ca2+在動作電位舒張后期局部、自動地釋放啟動了竇房結再次的除極[2, 3]。這種Ca2+的自動釋放控制著電興奮的節律,因而被稱為“鈣鐘”。鈣鐘的作用促進了Na+-Ca2+交換電流(INCX)的激活,進而加速了除極速率并激活了L-型Ca2+電流(ICaL),從而導致了動作電位的最終產生。由細胞膜離子電流參與構成的自發起搏則被稱為“膜鐘”。竇房結細胞是一個“鈣鐘”和“膜鐘”相互耦合、相互作用的系統[4]。
竇房結鈣、膜鐘的起搏新機制為從分子細胞水平正確認識竇房結的自律性、病竇綜合癥以及竇性心律失常提供了幫助。但是竇房結結構和功能復雜,細胞體積小且具有異質性,使得開展動物實驗具有一定難度[5]。近年來,基于細胞動作電位動力學數學模型的計算機定量研究已成為心臟基礎電生理研究的一種重要手段。其中,Zhang等[6]因其分別建立了中心和周邊竇房結細胞模型以及非勻質竇房結和心房一維組織模型而具代表性,但該模型并未涉及鈣鐘的活動。2009年出現了第一個詳細描述鈣鐘動力學活動的竇房結細胞數學模型,但該模型由于未考慮竇房結細胞間的電生理差異,使迄今的定量研究主要處于單細胞水平[7]。本文基于上述鈣鐘動力學模型分別建立中心和邊緣竇房結細胞模型并在此基礎上建立了二維不規則竇房結和心房組織模型并進行了定量分析。通過該模型的建立,期望可為今后研究鈣、膜鐘在竇房結自律性中的相對作用以及心律失常的機制奠定相關基礎。
1 方法
1.1 中心和邊緣單細胞模型
據報道,竇房結中心和邊緣單細胞的差異主要表現在細胞大小、膜電容以及電導率。本文參照Zhang等[6]建立的模型確定中心和邊緣的細胞尺寸和膜電容值。由于任何種類的離子電流密度都可用以下通式描述,
| ${{i}_{ion}}={{g}_{ion}}\times (V-{{E}_{ion}})\times {{d}_{1}}\times {{d}_{2}}\cdots \times {{d}_{i}}$ |
其中,V代表膜電位,gion代表某個離子電流的最大電導,Eion為其反轉電位,di為門控變量。因此本文采用根據動物實驗獲得的一定膜電位下的電流密度值和門控參數,并結合Zhang等[6]模型由式(1)反推算出各離子電導(gion),主要包括L-型Ca2+電流電導(gCaL),瞬時外向K+電流電導(gto),快和慢激活的內向整流K+電流電導(gKr和gKs),超極化激活的“funny”電流電導(gf)以及持續性4-AP敏感電流(Isus)的電導(gsus) [8]。
竇房結中心細胞沒有Na+電流(INa)的參與,但報道發現INa存在于邊緣細胞,因此本文在竇房結邊緣細胞中引入INa,
| ${{I}_{Na}}={{g}_{Na}}{{m}^{3}}h{{[N{{a}^{+}}]}_{o}}\frac{{{F}^{2}}RT{{e}^{(V-{{E}_{Na}})F/RT}}-1}{{{e}^{VF}}/RT-1}V~$ |
其中,gNa為電導,m和h為激活和失活門控變量,[Na+]o 為細胞外Na+ 濃度,F為法拉第常數,R和T 分別為氣體常數和絕對溫度,ENa為反轉電位[9]。
1.2 竇房結和心房非勻質組織模型
本文根據目前普遍認可的梯度模型假說建立了包含竇房結在內的心房組織模型[10]。從中心到周邊竇房結細胞大小、膜電容、電導率及細胞間縫隙連接電導參照文獻[11]給出的指數函數確定。
根據解剖和組織學結構建立的二維非勻質組織模型為包含竇房結的一個心房肌跨壁橫斷面[12],其結構和形態如圖 1所示。根據組織中細胞分布和排列的離散特性,將竇房結和心房細胞理想化為彼此電偶聯的網絡。右側竇房結呈不規則長條狀,左側為心房肌。竇房結邊緣細胞位于與心房的交界處。定量分析實驗中,沿記錄線記錄細胞動作電位的傳導情況。
由于模型邊界不規則,本文采用五點差分和有限元方法分別對組織內細胞網格和邊界進行處理[13]。首先對整個組織模型進行幾何離散,即將竇房結劃為元素I(竇房結記錄線以上部分)、元素II和元素III三個部分,心房為元素IV。之后按逆時針方向將各元素的邊界依次劃分為① ~⑥ 段,其中④ 為竇房結與心房的交界線。最后利用MATLAB中的cftool函數自動擬合,分別構造出上述六段邊界的試函數。如圖 1所示,如果模型的參考原點位于右下角竇房結中心細胞所在列與心房底部細胞所在行的交點(0,0)處,l和n分別表示細胞所在行、列的位置,則6段邊界的試函數如下:
| $\begin{align} & Q\left( 1,l \right)=7.069\times {{e}^{-{{\left( \frac{l-38.54}{16.16} \right)}^{2}}}}+16.08\times {{e}^{-{{\left( \frac{l-10.77}{28.65} \right)}^{2}}}}+14.09\times {{e}^{-{{\left( l\frac{-66.92}{24} \right)}^{2}}}}-1 \\ & Q(2,l)=0.010\text{ }99\times {{l}^{2}}-0.065\text{ }93\times l+11 \\ & Q(3,l)=12.03\times {{e}^{-{{\left( \frac{l-28.58}{19.56} \right)}^{2}}}}+6.712\times {{e}^{-{{\left( \frac{l-51.13}{9.449} \right)}^{2}}}}+1.734\times {{e}^{-{{\left( \frac{l-58.01}{3.688} \right)}^{2}}}} \\ & Q(4,l)=1.202\times {{10}^{15}}\times {{e}^{-{{\left( \frac{l-3.666}{11.09} \right)}^{2}}}}+4.099\times {{e}^{-{{\left( \frac{l-60.31}{10.98} \right)}^{2}}}} \\ & Q(5,l)=21.35\times {{e}^{-{{\left( \frac{l-84.08}{16.49} \right)}^{2}}}}~+6.869\times {{e}^{-{{\left( \frac{l-61.77}{3.166} \right)}^{2}}}}+12.14\times {{e}^{-{{\left( \frac{l-67.07}{7.002} \right)}^{2}}}}+2.598\times {{e}^{-{{\left( \frac{l-61.18}{0.8257} \right)}^{2}}}} \\ & Q(6,l)=l-83 \\ \end{align}$ |
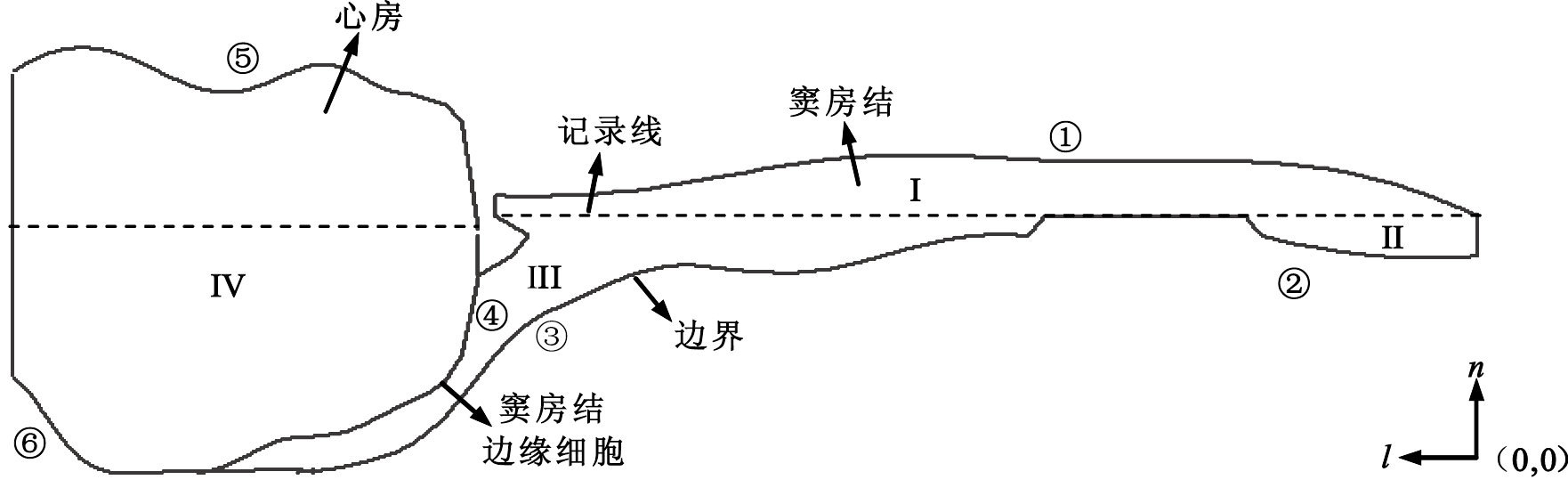 圖1
竇房結心房組織結構示意圖
Figure1.
Schematic diagram of the sinoatrial node and atrium
圖1
竇房結心房組織結構示意圖
Figure1.
Schematic diagram of the sinoatrial node and atrium
將以上6段按順序依次拼接起來得到全域邊界的試函數。
文中利用C語言編程,算子分裂方法對組織模型進行數值解算[4]。時間步長為5 μs,竇房結空間步長為0.1 mm,心房肌空間步長為0.32 mm。竇房結細胞間以及與心房偶聯處電導為25 nS,心房細胞間偶聯電導為175 nS。
2 結果
2.1 單細胞動作電位
如表 1所示,本文給出了竇房結中心和邊緣細胞推算得到的離子電導。所建的中心和邊緣細胞的動作電位如圖 2所示。如表 2所示,本文從動作電位幅度(action potential amplitude,APA)、最大舒張期電位(maximum diastolic potential,MDP)、周期(cycle length,CL)以及除極速率(dV/dtmax)四個方面比較了Maltsev-Lakatta模型[7],Zhang模型[6]和本文所建的模型以及動物實驗參數[8]。
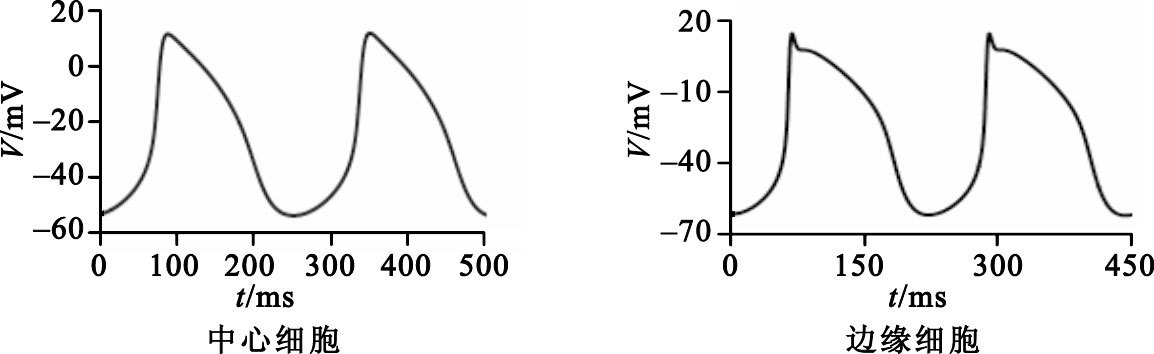 圖2
中心和邊緣竇房結細胞的動作電位
Figure2.
Action potentials for the central and peripheral sinoatrial node cells
圖2
中心和邊緣竇房結細胞的動作電位
Figure2.
Action potentials for the central and peripheral sinoatrial node cells
如圖 2、表 2所示,相對于中心細胞,邊緣細胞具有動作電位幅度高、周期短、舒張期最大電位絕對值大以及除極速率快的特點,這與文獻[9]的報道以及 Zhang模型的特點相一致。
2.2 組織模型及定量分析
如圖 3所示,文中給出了建立的竇房結和心房組織模型中膜電位斑圖隨電興奮的變化圖。以最左側中心竇房結細胞開始自發起搏作為起始時刻,當進展到20 ms時電興奮已擴布至邊緣細胞,27 ms時心房與竇房結交界處的細胞被除極,電興奮形成的波前以弧形向心房推進并在30 ms時使整個心房組織激動。之后心房先于竇房結開始復極化,60 ms時已基本恢復至靜息電位,而竇房結在160 ms時才復極至靜息態,可見心房的動作電位時程遠小于竇房結細胞。
 圖3
組織模型中膜電位斑圖隨電擴布的變化
Figure3.
Change of membrane potential pattern with electrical diffusion in the developed tissue model
圖3
組織模型中膜電位斑圖隨電擴布的變化
Figure3.
Change of membrane potential pattern with electrical diffusion in the developed tissue model
為了分析竇房結鈣鐘的作用,定量實驗中局部提高鈣泵的速率Pup。如圖 4所示,文中給出了沿記錄線上細胞的動作電位。星號所示的位置處Pup被增大了近2倍。與圖 3中正常狀態時電興奮由竇房結中心向邊緣傳導的順序相比,在圖 4中Pup被提高區域的細胞先于中心處而起搏,其形成的激動沿箭頭所示方向朝竇房結中心和心房同時傳播,最終帶動心房細胞除極化。可見鈣鐘動力學活動的增強將提高竇房結細胞的自律性,這與文獻[14]的實驗報道中發現的主導起搏點總與鈣鐘最活躍位置正相關的結果相吻合。
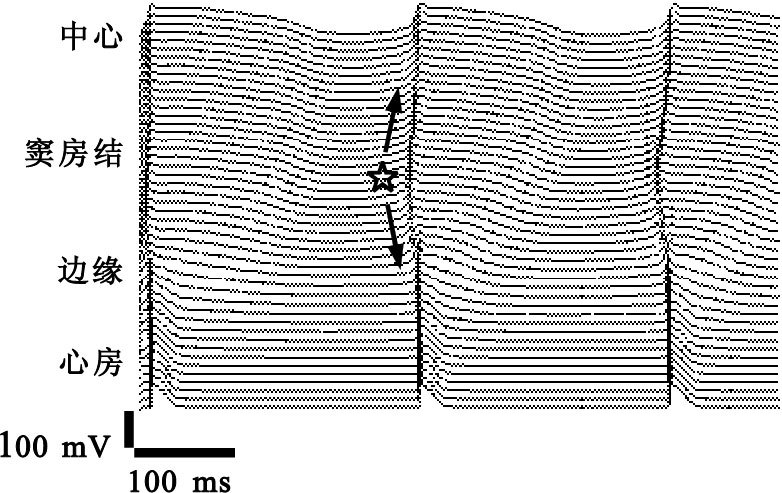 圖4
竇房結鈣鐘對自律性的影響
Figure4.
Effects of the calcium clock on automaticity
圖4
竇房結鈣鐘對自律性的影響
Figure4.
Effects of the calcium clock on automaticity
為分析膜鐘對自律性的作用,分別將參與舒張期除極的超極化激活的“funny”電流(If)和L-型Ca2+電流(ICaL)阻斷,分析其對動作電位除極速率dV/dtmax的影響。如圖 5所示,文中給出了沿記錄線的細胞在正常、阻斷If和ICaL的情況下除極速率的變化。與正常情況相比,阻斷If和ICaL后除極速率均有明顯下降。接近中心處的細胞在If和ICaL阻斷后,除極速率分別下降50%和30%,且在靠近邊緣細胞的位置,If阻斷所造成的除極速率的降低更為明顯。這可能是因為越接近邊緣細胞,If電流密度越大,阻斷后對自發起搏的影響也就越大。但是,越接近邊緣,ICaL阻斷對除極速率下降的影響卻越小,這可能是因為中心細胞的除極沒有Na+電流(INa)的參與,而越靠近邊緣,INa越大。由于細胞的除極化是INa與ICaL共同作用的結果,因此單純阻斷ICaL對邊緣細胞的影響反而會降低。
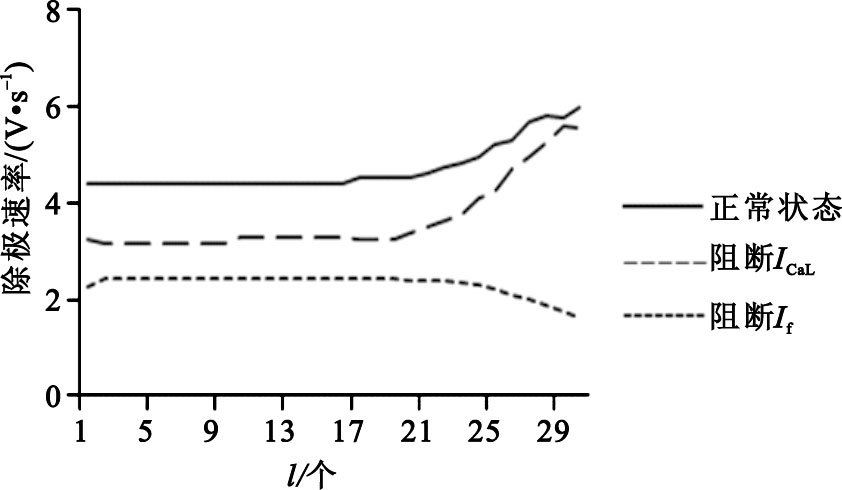 圖5
沿記錄線阻斷部分膜電流對除極速率的影響
Figure5.
Effects of blocking membrane currents on upstroke velocity along the recording line
圖5
沿記錄線阻斷部分膜電流對除極速率的影響
Figure5.
Effects of blocking membrane currents on upstroke velocity along the recording line
文獻報道顯示,房性心律失常對竇房結自律性有一定影響[15]。房性早搏是較為常見的一種心律失常,本文通過在心房施加早搏電刺激觀察其對竇房結電擴布的影響。如圖 6所示,為一次自發起搏后在星號所標示的位置處施加房性早搏時,記錄線上細胞動作電位的傳導和膜電位斑圖的變化。如果以自發起搏作為起始時刻,250 ms時在心房施加早搏刺激,由膜電位斑圖可見,早搏誘發的激動在房內傳播并向竇房結與心房的交界區擴布,272 ms時竇房結邊緣細胞受早搏刺激先于竇房結中心細胞而除極化,造成激動由邊緣向中心傳播。303 ms時中心細胞開始自發起搏并向邊緣傳播,造成308 ms時兩個相向而行的波在箭頭所示的位置處發生碰撞。
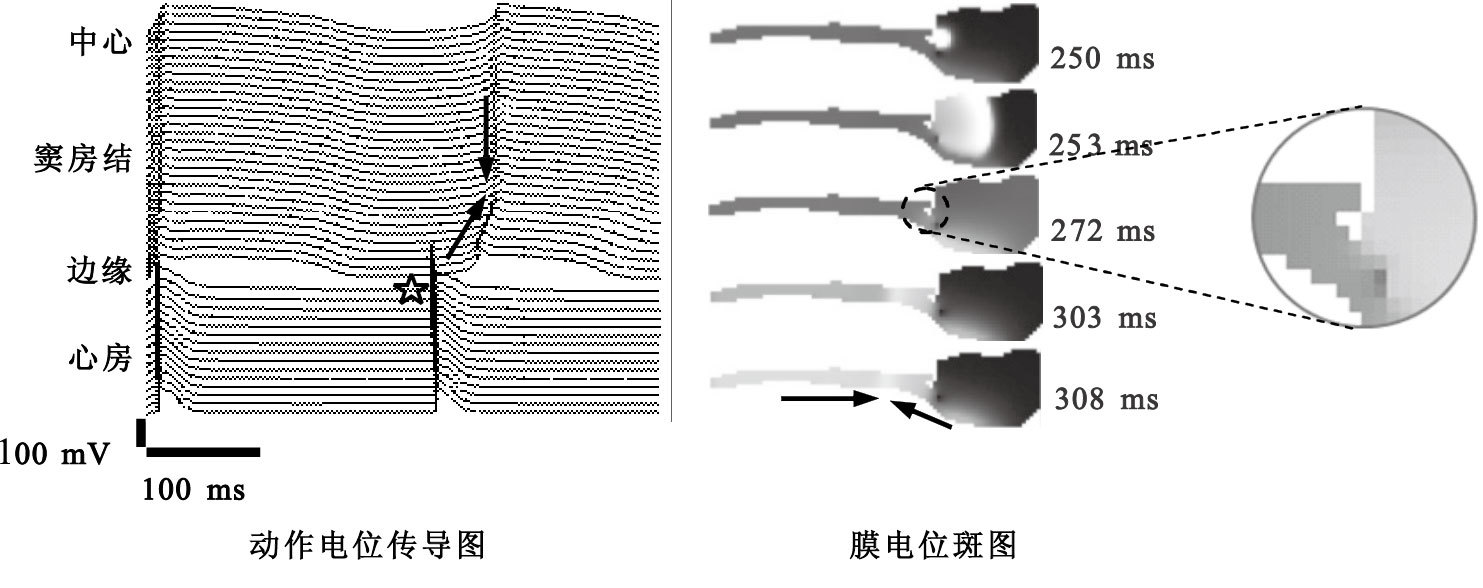 圖6
房性早搏對竇房結自律性的作用
Figure6.
Impact of the premature beat in atrium on automaticity of the sinoatrial node
圖6
房性早搏對竇房結自律性的作用
Figure6.
Impact of the premature beat in atrium on automaticity of the sinoatrial node
如圖 7所示將竇房結與心房間的連接部位加寬,房性早搏引起的激動會在272 ms時從加寬(圓圈標記)和下部的偶聯位置處同時向竇房結擴布,305 ms時與竇房結中心自發起搏引起的電興奮發生碰撞(箭頭所示)。與圖 6相比,傳導速度加快,且碰撞的位置更加遠離竇房結邊緣區域,說明竇房結和心房間的解剖結構和偶聯狀態對電擴布具有一定影響。
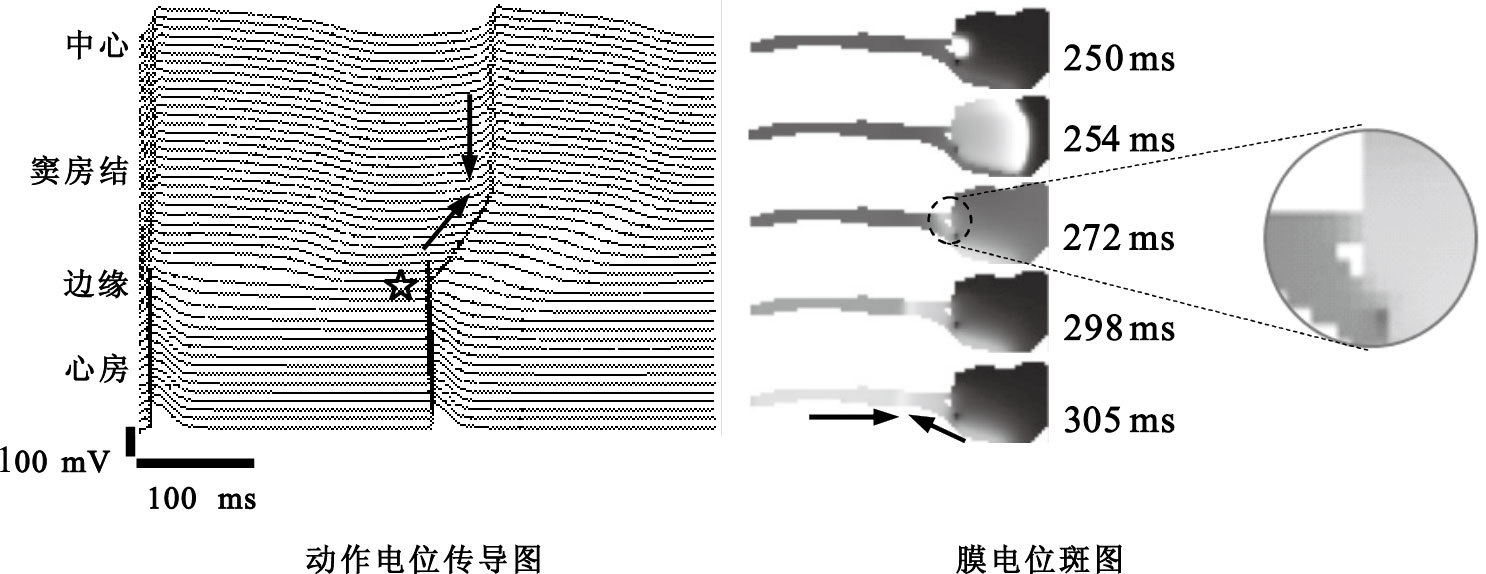 圖7
偶聯狀態對電興奮擴布的作用
Figure7.
Impact of the coupling state on the excitation propagation
圖7
偶聯狀態對電興奮擴布的作用
Figure7.
Impact of the coupling state on the excitation propagation
以上定量實驗進一步揭示了鈣鐘和膜鐘對主導起搏位置和起搏速率的作用。另外,研究表明房性早搏誘發的電興奮可通過竇房結和心房的偶聯擴布至竇房結內,從而抑制竇房結邊緣區域細胞的自律性,導致中心竇房結自發的激動與早搏誘發的激動發生碰撞和湮滅,且兩類細胞間的偶聯越密切,其影響越顯著;該現象符合竇房結功能下調與房性心律失常相關的報道[15]。
3 討論
本文在近年描述竇房結鈣鐘動力學活動的單細胞數學模型基礎上分別建立了中心和邊緣細胞電生理模型,并在此基礎上根據竇房結和心房解剖及組織學結構建立了二維非勻質組織模型。采用五點差分和有限元方法分別對組織內細胞網格和邊界進行處理。通過分段構造試函數,拼接得到全域邊界試函數的方法對不規則的組織邊界加以描述,便于求解和編程。
本文構建的中心和邊緣單細胞模型的動作電位在幅度、自律性周期、舒張期電位等方面表現出的差異性與Zhang模型一致,但中心和邊緣處細胞的這些差異性在Zhang模型中體現的更加顯著,比如,Zhang模型的中心和邊緣處細胞動作電位幅度相差31%,最大舒張期電位相差34%,周期相差50%,而本模型中心和邊緣細胞的上述指標分別相差21%,14%和22%。但是,根據實驗數據和本模型構成的組織模型的電生理實驗結果說明了所建模型的有效性。另外,基于本模型的房性早搏實驗說明心房內的異位搏動可向竇房結傳導,從而使竇房結的邊緣細胞早于中心細胞而興奮,但隨后中心細胞的自發起搏將阻斷心房早搏引起的電沖動的進一步傳播。Steinbeck等[16]利用電極標測兔心房內施加的早搏刺激對竇房結電活動的影響,其研究發現,早搏引起的沖動只能引起部分竇房結細胞除極,中心區域仍可保持其原有的自律性,這與本文定量研究的結果相吻合。
由于缺乏鈣鐘在竇房結中心和邊緣處異質性的相關實驗數據,因此本文所建模型未能體現出鈣鐘的異質性,模型存在一定局限性。但是,本模型相對于以往報道的模型,比如Zhang模型而言可更為準確地反映肌漿網鈣鐘的動力學活動,從而為深入研究竇房結的自律性機制以及鈣、膜鐘的相對作用和與心房電活動的關系提供幫助,同時也可為構建三維竇房結和心房器官模型奠定一定的基礎。
引言
竇房結是心臟正常竇性節律的起搏點。竇房結細胞可以自動、有節律地產生電流并帶動心房組織興奮,繼而按照電傳導系統的順序最終引起心室肌的電興奮和心臟的收縮[1]。近年的研究發現,竇房結細胞內肌漿網(sarcoplasmic reticulum,SR)中的Ca2+在動作電位舒張后期局部、自動地釋放啟動了竇房結再次的除極[2, 3]。這種Ca2+的自動釋放控制著電興奮的節律,因而被稱為“鈣鐘”。鈣鐘的作用促進了Na+-Ca2+交換電流(INCX)的激活,進而加速了除極速率并激活了L-型Ca2+電流(ICaL),從而導致了動作電位的最終產生。由細胞膜離子電流參與構成的自發起搏則被稱為“膜鐘”。竇房結細胞是一個“鈣鐘”和“膜鐘”相互耦合、相互作用的系統[4]。
竇房結鈣、膜鐘的起搏新機制為從分子細胞水平正確認識竇房結的自律性、病竇綜合癥以及竇性心律失常提供了幫助。但是竇房結結構和功能復雜,細胞體積小且具有異質性,使得開展動物實驗具有一定難度[5]。近年來,基于細胞動作電位動力學數學模型的計算機定量研究已成為心臟基礎電生理研究的一種重要手段。其中,Zhang等[6]因其分別建立了中心和周邊竇房結細胞模型以及非勻質竇房結和心房一維組織模型而具代表性,但該模型并未涉及鈣鐘的活動。2009年出現了第一個詳細描述鈣鐘動力學活動的竇房結細胞數學模型,但該模型由于未考慮竇房結細胞間的電生理差異,使迄今的定量研究主要處于單細胞水平[7]。本文基于上述鈣鐘動力學模型分別建立中心和邊緣竇房結細胞模型并在此基礎上建立了二維不規則竇房結和心房組織模型并進行了定量分析。通過該模型的建立,期望可為今后研究鈣、膜鐘在竇房結自律性中的相對作用以及心律失常的機制奠定相關基礎。
1 方法
1.1 中心和邊緣單細胞模型
據報道,竇房結中心和邊緣單細胞的差異主要表現在細胞大小、膜電容以及電導率。本文參照Zhang等[6]建立的模型確定中心和邊緣的細胞尺寸和膜電容值。由于任何種類的離子電流密度都可用以下通式描述,
| ${{i}_{ion}}={{g}_{ion}}\times (V-{{E}_{ion}})\times {{d}_{1}}\times {{d}_{2}}\cdots \times {{d}_{i}}$ |
其中,V代表膜電位,gion代表某個離子電流的最大電導,Eion為其反轉電位,di為門控變量。因此本文采用根據動物實驗獲得的一定膜電位下的電流密度值和門控參數,并結合Zhang等[6]模型由式(1)反推算出各離子電導(gion),主要包括L-型Ca2+電流電導(gCaL),瞬時外向K+電流電導(gto),快和慢激活的內向整流K+電流電導(gKr和gKs),超極化激活的“funny”電流電導(gf)以及持續性4-AP敏感電流(Isus)的電導(gsus) [8]。
竇房結中心細胞沒有Na+電流(INa)的參與,但報道發現INa存在于邊緣細胞,因此本文在竇房結邊緣細胞中引入INa,
| ${{I}_{Na}}={{g}_{Na}}{{m}^{3}}h{{[N{{a}^{+}}]}_{o}}\frac{{{F}^{2}}RT{{e}^{(V-{{E}_{Na}})F/RT}}-1}{{{e}^{VF}}/RT-1}V~$ |
其中,gNa為電導,m和h為激活和失活門控變量,[Na+]o 為細胞外Na+ 濃度,F為法拉第常數,R和T 分別為氣體常數和絕對溫度,ENa為反轉電位[9]。
1.2 竇房結和心房非勻質組織模型
本文根據目前普遍認可的梯度模型假說建立了包含竇房結在內的心房組織模型[10]。從中心到周邊竇房結細胞大小、膜電容、電導率及細胞間縫隙連接電導參照文獻[11]給出的指數函數確定。
根據解剖和組織學結構建立的二維非勻質組織模型為包含竇房結的一個心房肌跨壁橫斷面[12],其結構和形態如圖 1所示。根據組織中細胞分布和排列的離散特性,將竇房結和心房細胞理想化為彼此電偶聯的網絡。右側竇房結呈不規則長條狀,左側為心房肌。竇房結邊緣細胞位于與心房的交界處。定量分析實驗中,沿記錄線記錄細胞動作電位的傳導情況。
由于模型邊界不規則,本文采用五點差分和有限元方法分別對組織內細胞網格和邊界進行處理[13]。首先對整個組織模型進行幾何離散,即將竇房結劃為元素I(竇房結記錄線以上部分)、元素II和元素III三個部分,心房為元素IV。之后按逆時針方向將各元素的邊界依次劃分為① ~⑥ 段,其中④ 為竇房結與心房的交界線。最后利用MATLAB中的cftool函數自動擬合,分別構造出上述六段邊界的試函數。如圖 1所示,如果模型的參考原點位于右下角竇房結中心細胞所在列與心房底部細胞所在行的交點(0,0)處,l和n分別表示細胞所在行、列的位置,則6段邊界的試函數如下:
| $\begin{align} & Q\left( 1,l \right)=7.069\times {{e}^{-{{\left( \frac{l-38.54}{16.16} \right)}^{2}}}}+16.08\times {{e}^{-{{\left( \frac{l-10.77}{28.65} \right)}^{2}}}}+14.09\times {{e}^{-{{\left( l\frac{-66.92}{24} \right)}^{2}}}}-1 \\ & Q(2,l)=0.010\text{ }99\times {{l}^{2}}-0.065\text{ }93\times l+11 \\ & Q(3,l)=12.03\times {{e}^{-{{\left( \frac{l-28.58}{19.56} \right)}^{2}}}}+6.712\times {{e}^{-{{\left( \frac{l-51.13}{9.449} \right)}^{2}}}}+1.734\times {{e}^{-{{\left( \frac{l-58.01}{3.688} \right)}^{2}}}} \\ & Q(4,l)=1.202\times {{10}^{15}}\times {{e}^{-{{\left( \frac{l-3.666}{11.09} \right)}^{2}}}}+4.099\times {{e}^{-{{\left( \frac{l-60.31}{10.98} \right)}^{2}}}} \\ & Q(5,l)=21.35\times {{e}^{-{{\left( \frac{l-84.08}{16.49} \right)}^{2}}}}~+6.869\times {{e}^{-{{\left( \frac{l-61.77}{3.166} \right)}^{2}}}}+12.14\times {{e}^{-{{\left( \frac{l-67.07}{7.002} \right)}^{2}}}}+2.598\times {{e}^{-{{\left( \frac{l-61.18}{0.8257} \right)}^{2}}}} \\ & Q(6,l)=l-83 \\ \end{align}$ |
 圖1
竇房結心房組織結構示意圖
Figure1.
Schematic diagram of the sinoatrial node and atrium
圖1
竇房結心房組織結構示意圖
Figure1.
Schematic diagram of the sinoatrial node and atrium
將以上6段按順序依次拼接起來得到全域邊界的試函數。
文中利用C語言編程,算子分裂方法對組織模型進行數值解算[4]。時間步長為5 μs,竇房結空間步長為0.1 mm,心房肌空間步長為0.32 mm。竇房結細胞間以及與心房偶聯處電導為25 nS,心房細胞間偶聯電導為175 nS。
2 結果
2.1 單細胞動作電位
如表 1所示,本文給出了竇房結中心和邊緣細胞推算得到的離子電導。所建的中心和邊緣細胞的動作電位如圖 2所示。如表 2所示,本文從動作電位幅度(action potential amplitude,APA)、最大舒張期電位(maximum diastolic potential,MDP)、周期(cycle length,CL)以及除極速率(dV/dtmax)四個方面比較了Maltsev-Lakatta模型[7],Zhang模型[6]和本文所建的模型以及動物實驗參數[8]。
 圖2
中心和邊緣竇房結細胞的動作電位
Figure2.
Action potentials for the central and peripheral sinoatrial node cells
圖2
中心和邊緣竇房結細胞的動作電位
Figure2.
Action potentials for the central and peripheral sinoatrial node cells
如圖 2、表 2所示,相對于中心細胞,邊緣細胞具有動作電位幅度高、周期短、舒張期最大電位絕對值大以及除極速率快的特點,這與文獻[9]的報道以及 Zhang模型的特點相一致。
2.2 組織模型及定量分析
如圖 3所示,文中給出了建立的竇房結和心房組織模型中膜電位斑圖隨電興奮的變化圖。以最左側中心竇房結細胞開始自發起搏作為起始時刻,當進展到20 ms時電興奮已擴布至邊緣細胞,27 ms時心房與竇房結交界處的細胞被除極,電興奮形成的波前以弧形向心房推進并在30 ms時使整個心房組織激動。之后心房先于竇房結開始復極化,60 ms時已基本恢復至靜息電位,而竇房結在160 ms時才復極至靜息態,可見心房的動作電位時程遠小于竇房結細胞。
 圖3
組織模型中膜電位斑圖隨電擴布的變化
Figure3.
Change of membrane potential pattern with electrical diffusion in the developed tissue model
圖3
組織模型中膜電位斑圖隨電擴布的變化
Figure3.
Change of membrane potential pattern with electrical diffusion in the developed tissue model
為了分析竇房結鈣鐘的作用,定量實驗中局部提高鈣泵的速率Pup。如圖 4所示,文中給出了沿記錄線上細胞的動作電位。星號所示的位置處Pup被增大了近2倍。與圖 3中正常狀態時電興奮由竇房結中心向邊緣傳導的順序相比,在圖 4中Pup被提高區域的細胞先于中心處而起搏,其形成的激動沿箭頭所示方向朝竇房結中心和心房同時傳播,最終帶動心房細胞除極化。可見鈣鐘動力學活動的增強將提高竇房結細胞的自律性,這與文獻[14]的實驗報道中發現的主導起搏點總與鈣鐘最活躍位置正相關的結果相吻合。
 圖4
竇房結鈣鐘對自律性的影響
Figure4.
Effects of the calcium clock on automaticity
圖4
竇房結鈣鐘對自律性的影響
Figure4.
Effects of the calcium clock on automaticity
為分析膜鐘對自律性的作用,分別將參與舒張期除極的超極化激活的“funny”電流(If)和L-型Ca2+電流(ICaL)阻斷,分析其對動作電位除極速率dV/dtmax的影響。如圖 5所示,文中給出了沿記錄線的細胞在正常、阻斷If和ICaL的情況下除極速率的變化。與正常情況相比,阻斷If和ICaL后除極速率均有明顯下降。接近中心處的細胞在If和ICaL阻斷后,除極速率分別下降50%和30%,且在靠近邊緣細胞的位置,If阻斷所造成的除極速率的降低更為明顯。這可能是因為越接近邊緣細胞,If電流密度越大,阻斷后對自發起搏的影響也就越大。但是,越接近邊緣,ICaL阻斷對除極速率下降的影響卻越小,這可能是因為中心細胞的除極沒有Na+電流(INa)的參與,而越靠近邊緣,INa越大。由于細胞的除極化是INa與ICaL共同作用的結果,因此單純阻斷ICaL對邊緣細胞的影響反而會降低。
 圖5
沿記錄線阻斷部分膜電流對除極速率的影響
Figure5.
Effects of blocking membrane currents on upstroke velocity along the recording line
圖5
沿記錄線阻斷部分膜電流對除極速率的影響
Figure5.
Effects of blocking membrane currents on upstroke velocity along the recording line
文獻報道顯示,房性心律失常對竇房結自律性有一定影響[15]。房性早搏是較為常見的一種心律失常,本文通過在心房施加早搏電刺激觀察其對竇房結電擴布的影響。如圖 6所示,為一次自發起搏后在星號所標示的位置處施加房性早搏時,記錄線上細胞動作電位的傳導和膜電位斑圖的變化。如果以自發起搏作為起始時刻,250 ms時在心房施加早搏刺激,由膜電位斑圖可見,早搏誘發的激動在房內傳播并向竇房結與心房的交界區擴布,272 ms時竇房結邊緣細胞受早搏刺激先于竇房結中心細胞而除極化,造成激動由邊緣向中心傳播。303 ms時中心細胞開始自發起搏并向邊緣傳播,造成308 ms時兩個相向而行的波在箭頭所示的位置處發生碰撞。
 圖6
房性早搏對竇房結自律性的作用
Figure6.
Impact of the premature beat in atrium on automaticity of the sinoatrial node
圖6
房性早搏對竇房結自律性的作用
Figure6.
Impact of the premature beat in atrium on automaticity of the sinoatrial node
如圖 7所示將竇房結與心房間的連接部位加寬,房性早搏引起的激動會在272 ms時從加寬(圓圈標記)和下部的偶聯位置處同時向竇房結擴布,305 ms時與竇房結中心自發起搏引起的電興奮發生碰撞(箭頭所示)。與圖 6相比,傳導速度加快,且碰撞的位置更加遠離竇房結邊緣區域,說明竇房結和心房間的解剖結構和偶聯狀態對電擴布具有一定影響。
 圖7
偶聯狀態對電興奮擴布的作用
Figure7.
Impact of the coupling state on the excitation propagation
圖7
偶聯狀態對電興奮擴布的作用
Figure7.
Impact of the coupling state on the excitation propagation
以上定量實驗進一步揭示了鈣鐘和膜鐘對主導起搏位置和起搏速率的作用。另外,研究表明房性早搏誘發的電興奮可通過竇房結和心房的偶聯擴布至竇房結內,從而抑制竇房結邊緣區域細胞的自律性,導致中心竇房結自發的激動與早搏誘發的激動發生碰撞和湮滅,且兩類細胞間的偶聯越密切,其影響越顯著;該現象符合竇房結功能下調與房性心律失常相關的報道[15]。
3 討論
本文在近年描述竇房結鈣鐘動力學活動的單細胞數學模型基礎上分別建立了中心和邊緣細胞電生理模型,并在此基礎上根據竇房結和心房解剖及組織學結構建立了二維非勻質組織模型。采用五點差分和有限元方法分別對組織內細胞網格和邊界進行處理。通過分段構造試函數,拼接得到全域邊界試函數的方法對不規則的組織邊界加以描述,便于求解和編程。
本文構建的中心和邊緣單細胞模型的動作電位在幅度、自律性周期、舒張期電位等方面表現出的差異性與Zhang模型一致,但中心和邊緣處細胞的這些差異性在Zhang模型中體現的更加顯著,比如,Zhang模型的中心和邊緣處細胞動作電位幅度相差31%,最大舒張期電位相差34%,周期相差50%,而本模型中心和邊緣細胞的上述指標分別相差21%,14%和22%。但是,根據實驗數據和本模型構成的組織模型的電生理實驗結果說明了所建模型的有效性。另外,基于本模型的房性早搏實驗說明心房內的異位搏動可向竇房結傳導,從而使竇房結的邊緣細胞早于中心細胞而興奮,但隨后中心細胞的自發起搏將阻斷心房早搏引起的電沖動的進一步傳播。Steinbeck等[16]利用電極標測兔心房內施加的早搏刺激對竇房結電活動的影響,其研究發現,早搏引起的沖動只能引起部分竇房結細胞除極,中心區域仍可保持其原有的自律性,這與本文定量研究的結果相吻合。
由于缺乏鈣鐘在竇房結中心和邊緣處異質性的相關實驗數據,因此本文所建模型未能體現出鈣鐘的異質性,模型存在一定局限性。但是,本模型相對于以往報道的模型,比如Zhang模型而言可更為準確地反映肌漿網鈣鐘的動力學活動,從而為深入研究竇房結的自律性機制以及鈣、膜鐘的相對作用和與心房電活動的關系提供幫助,同時也可為構建三維竇房結和心房器官模型奠定一定的基礎。




