利用過氧化氫(H2O2)建立大鼠心肌細胞氧化損傷模型;觀察心肌細胞氧化損傷過程中 myocardin 和核因子 E2 相關因子 2(Nrf2) 的表達變化并初步探討 myocardin 對 Nrf2 的影響。通過轉染質粒過表達目的基因,轉染 shRNA 質粒下調目的基因表達;通過磺酰羅丹明 B(SRB)比色法檢測細胞增殖,通過 Real-time PCR 檢測 mRNA 的表達,通過 Western blot 檢測蛋白的表達。結果顯示 200 μmol/L H2O2 孵育 24 h 為最佳 H2O2 氧化損傷條件;H2O2 抑制 myocardin mRNA 及蛋白的表達,同時增加 Nrf2 mRNA 及蛋白的表達;過表達 myocardin 基因或者下調 Nrf2 基因后相對活細胞數較對照組明顯減少,而下調 myocardin 基因或者上調 Nrf2 基因后相對活細胞數較對照組明顯增多;過表達 myocardin 基因后檢測到 Nrf2 mRNA 和蛋白表達出現明顯下調,而下調 myocardin 基因后檢測到 Nrf2 mRNA 和蛋白表達明顯上調。因此推斷 myocardin 基因可能抑制細胞增殖,而 Nrf2 基因可能促進細胞增殖;H2O2 造成大鼠心肌細胞氧化損傷過程中激活 Nrf2 相關抗氧化損傷信號途徑,其機制可能是通過下調 myocardin 的表達而實現的。
引用本文: 聶琦, 陶立軒, 余承熙, 代玉環, 夏瑩, 劉玉婷, 夏志丹, 李佳蓬, 董堅. 心肌細胞氧化損傷對 myocardin 和 核因子 E2 相關因子 2 的影響. 生物醫學工程學雜志, 2017, 34(4): 585-590. doi: 10.7507/1001-5515.201603009 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
氧化應激時產生大量活性氧(reactive oxygen species,ROS)造成細胞損傷,而過氧化氫(H2O2)是體內氧化代謝的中間產物,同時又是一種活性氧,因此實驗研究中常用 H2O2 建立氧化損傷模型[1]。ROS 能激活轉錄因子核因子 E2 相關因子 2(nuclear factor erythroid 2-related factor 2,Nrf2)-抗氧化反應元件(antioxidant response element,ARE)通路[2],轉錄調控下游抗氧化蛋白等產生生物學效應,從而發揮抗氧化損傷作用。myocardin 是最新發現的血清反應因子(serum response factor,SRF)協同轉錄因子,它與 SRF 結合成復合物,促進 SRF-CArG box(SRF-[CC(A/T)6GG])依賴的靶基因的表達,影響和控制心臟及平滑肌細胞的發育和分化。在氧化損傷過程中,二者對心肌細胞是否存在相互作用尚不清楚。本實驗主要是為了明確 H2O2 造成細胞氧化損傷過程中 myocardin 和 Nrf2 基因的表達變化以及它們對細胞增殖的影響,并初探 myocardin 對 Nrf2 的影響。
1 資料與方法
1.1 實驗細胞
大鼠心肌 H9C2 細胞購自武漢博士德生物工程有限公司。
1.2 主要試劑
DMEM 培養基(GIBCO 公司),胎牛血清(GIBCO 公司),Trizol 裂解液(Ambion 公司),RIPA 裂解液(碧云天生物技術公司),反轉錄試劑盒(TaKaRa 公司),SYBGR Green(TaKaRa 公司),30% H2O2(國藥集團化學試劑有限公司),myocar-din、Nrf2 單克隆抗體、辣根過氧化物酶鼠抗及兔抗(上海起發實驗試劑有限公司),1 μg/μL 聚乙烯亞胺(polyethyleneimine,PEI)(GE 公司),DAPI(武漢博士德生物工程有限公司)。
1.3 主要質粒
pcDNA3.1 質粒、myocardin 質粒(即 pcDNA3.1-myocardin 質粒)、myocardin shRNA 質粒、Nrf2 shRNA 質粒、PTK642 質粒、PTK642-Nrf2 質粒,均由天津科技大學惠贈。
1.4 主要儀器
日本 Astec 氣套式二氧化碳恒溫培養箱,Spec-traMax? i3x 多功能酶標儀,美國 SIM 凝膠成像系統,OLYMPUS 激光共聚焦顯微鏡,BioRad CFX96 定量 PCR 儀,BioRad ChemiDocTMXRS+化學發光成像系統。
1.5 方法
1.5.1 細胞培養 大鼠心肌 H9C2 細胞加入 DMEM 完全培養基(含 10% 胎牛血清、100 U/mL 青霉素、100 mg/mL 鏈霉素)中,37℃、5% CO2 培養箱中培養。
1.5.2 細胞種板密度及用途 96 孔板種板細胞數約 1×104/孔,主要用于磺酰羅丹明 B(sulforhoda-mine B,SRB)檢測;24 孔板種板細胞數約 5×104/孔,主要用于細胞爬片;6 孔板種板細胞數為 1×105/孔~2×105/孔,主要用于提取 RNA 及蛋白。
1.5.3 相關檢測指標及實驗方法 (1)PEI 轉染法:細胞貼壁后所占總面積達到培養皿面積的 70%~90% 開始轉染。用無血清 DMEM 培養基稀釋目的 DNA,然后將 1 μg/μL PEI 轉染液(PEI∶Total DNA=3∶1)加入稀釋質粒中,立即旋渦振蕩;室溫靜置 15 min 后將 DNA-PEI 混合液直接加入細胞培養基中,24~48 h 收獲細胞提取 RNA 或者蛋白。
(2)SRB 比色法:細胞接種于 96 孔板進行分組處理后,棄上清,10% 三氯乙酸固定、0.4%(質量—體積百分濃度)SRB 染色、10 mmol/L Tris base(pH 10.5)振蕩搖勻后在酶標儀測定 540 nm 波長處光吸收值,計算細胞生長抑制率及細胞活力。
(3)Real-time PCR 檢測目的基因 mRNA 的表達:用 GeneTool 軟件設計 myocardin、Nrf2 和內參基因 GAPDH 的 PCR 引物(引物序列及產物長度見表 1)。細胞接種于 6 孔板進行分組處理后,利用 Trizol 試劑提取細胞總 RNA,按 Takara 反轉錄試劑盒操作步驟合成 cDNA,然后于 CFX96 Real-timeSystem 檢測目的基因 mRNA 的表達。
(4)Western blot 檢測目的基因蛋白的表達:細胞接種于 6 孔板進行分組處理后,每孔加入 100 μL RIPA 裂解液及 1 μL Cocktail 蛋白酶抑制劑,冰上裂解 30 min,4℃、14 000 r/min 離心 20 min,收集上清液;加入蛋白上樣 Buffer,100℃ 煮沸 5~10 min;聚丙烯酰胺凝膠電泳(polyacrlamide gel electrophoresis, PAGE),然后將 PAGE 分離的蛋白質樣品轉移到硝酸纖維素薄膜,5% 脫脂奶粉 37℃ 封閉 90 min,孵育一抗(37℃ 孵育 1.5 h 或者 4℃ 孵育過夜);1×TBST 洗滌三次,每次 5 min;孵育二抗(37℃ 1 h);再用 1×TBST 洗滌三次,每次 5 min;顯影。
(5)DAPI 染色法:在 24 孔板中放入滅菌細胞爬片,細胞培養并分組處理完畢后棄去培養基;加入適量 DAPI 工作液(約 80 μL/孔)覆蓋細胞即可,室溫避光染色 15~30 min;棄去染色液,1×PBS 洗滌細胞,水平搖床上室溫慢搖 5 min×3 次;取出細胞爬片倒置于載玻片上;于 OLYMPUS 激光共聚焦顯微鏡下(100×)觀察對比每個視野下各組細胞數及細胞核形態變化,并拍照分析。
1.5.4 實驗步驟 (1)細胞貼壁后分組處理:① 對照組(H9C2 組):棄原培養基,更換完全培養基培養 24 h;② H2O2 組:棄原培養基,加入不同濃度 H2O2 的完全培養基孵育 24 h。分組進行 SRB 檢測,計算細胞生長抑制率,確定 H2O2 最佳孵育濃度。進行 DAPI 染色,顯微鏡下觀察細胞數及細胞核形態變化,進一步了解細胞損傷情況。
(2)按轉染不同目的基因質粒分兩大組:① 上調目的基因組:對照組轉染空載體(pcDNA3.1 或 PTK642)質粒,實驗組轉染目的基因(pcDNA3.1-myocardin 或 PTK642-Nrf2)質粒;② 下調目的基因組:對照組轉染 shRNA 空載體質粒,實驗組轉染目的基因-shRNA 質粒(myocardin shRNA 質粒或 Nrf2 shRNA 質粒)。
(3)通過 SRB 檢測相對活細胞數,了解myo-cardin 及 Nrf2 基因對細胞增殖的影響。
(4)通過 Real-time PCR 檢測各組細胞 myo-cardin 及 Nrf2 mRNA 的表達差異。
(5)通過 Western blot 檢測各組細胞 myo-cardin 及 Nrf2 蛋白的表達差異。
1.6 統計學處理
用 SPSS20.0 軟件進行數據處理,計量資料以均數±標準差表示,組間比較均采用 t 檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 確定 H2O2 氧化損傷最佳孵育濃度
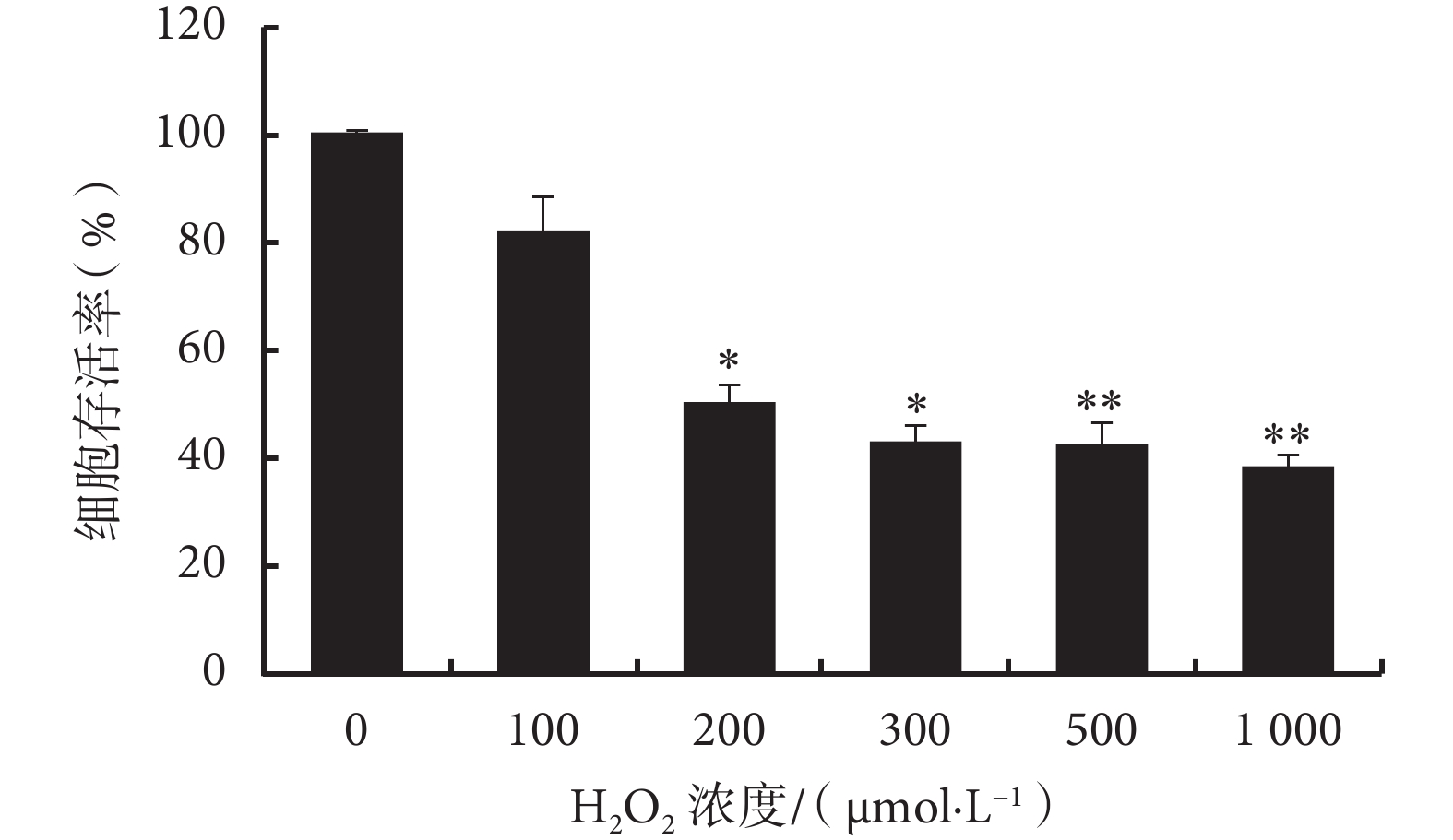
2.1.1 不同濃度 H2O2 氧化損傷 大鼠心肌 H9C2 細胞分別加入不同濃度 H2O2 孵育 24 h,SRB 檢測后計算細胞活力,結果提示 200 μmol/L H2O2 孵育時細胞存活率與對照組比較差異有統計學意義(P<0.05)(見圖 1),故選擇 200 μmol/L 為 H2O2 氧化損傷最佳孵育濃度。
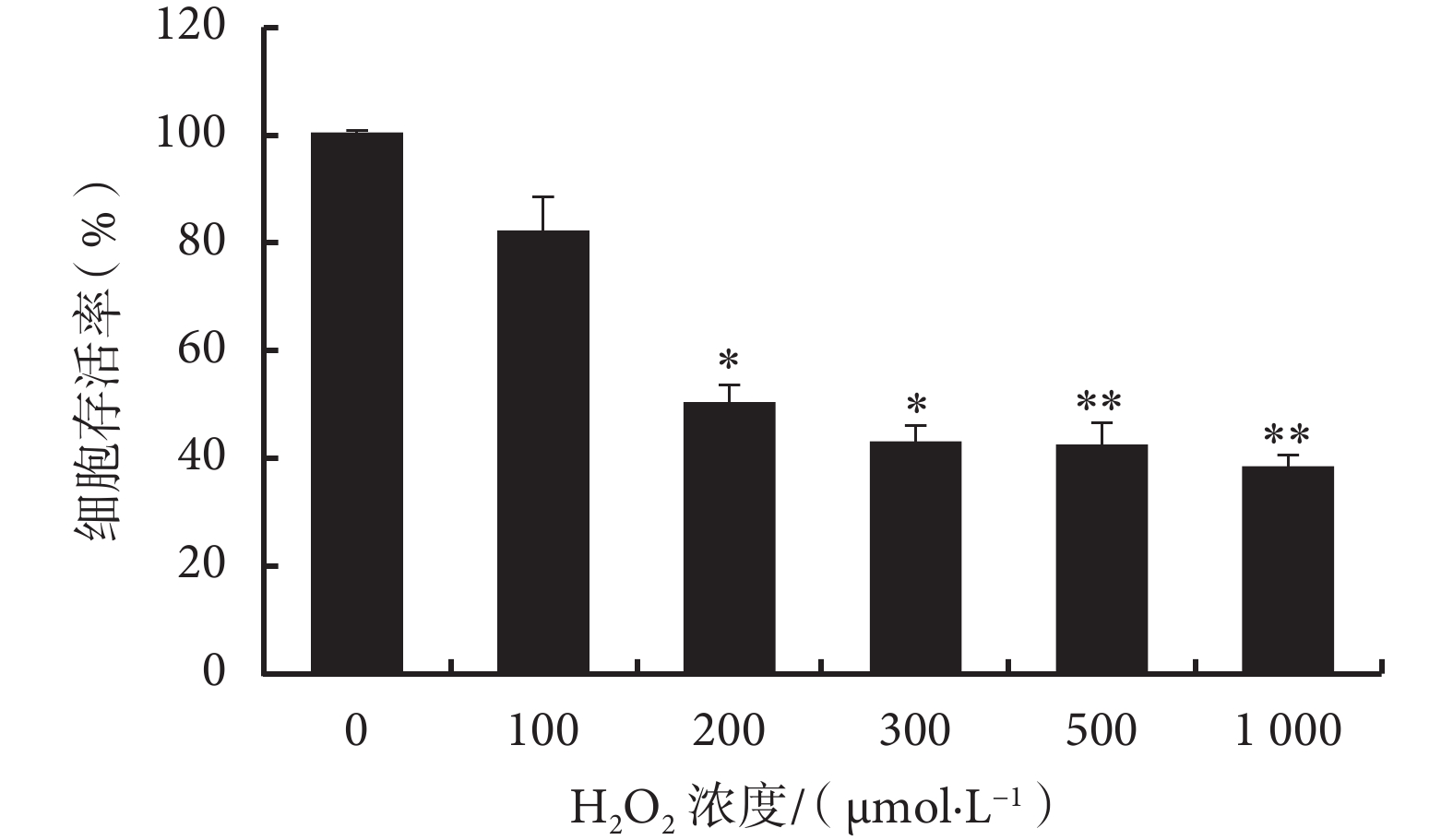 圖1
H2O2 濃度梯度氧化損傷
圖1
H2O2 濃度梯度氧化損傷
以 0 μmol/L 組作為對照組,*
*
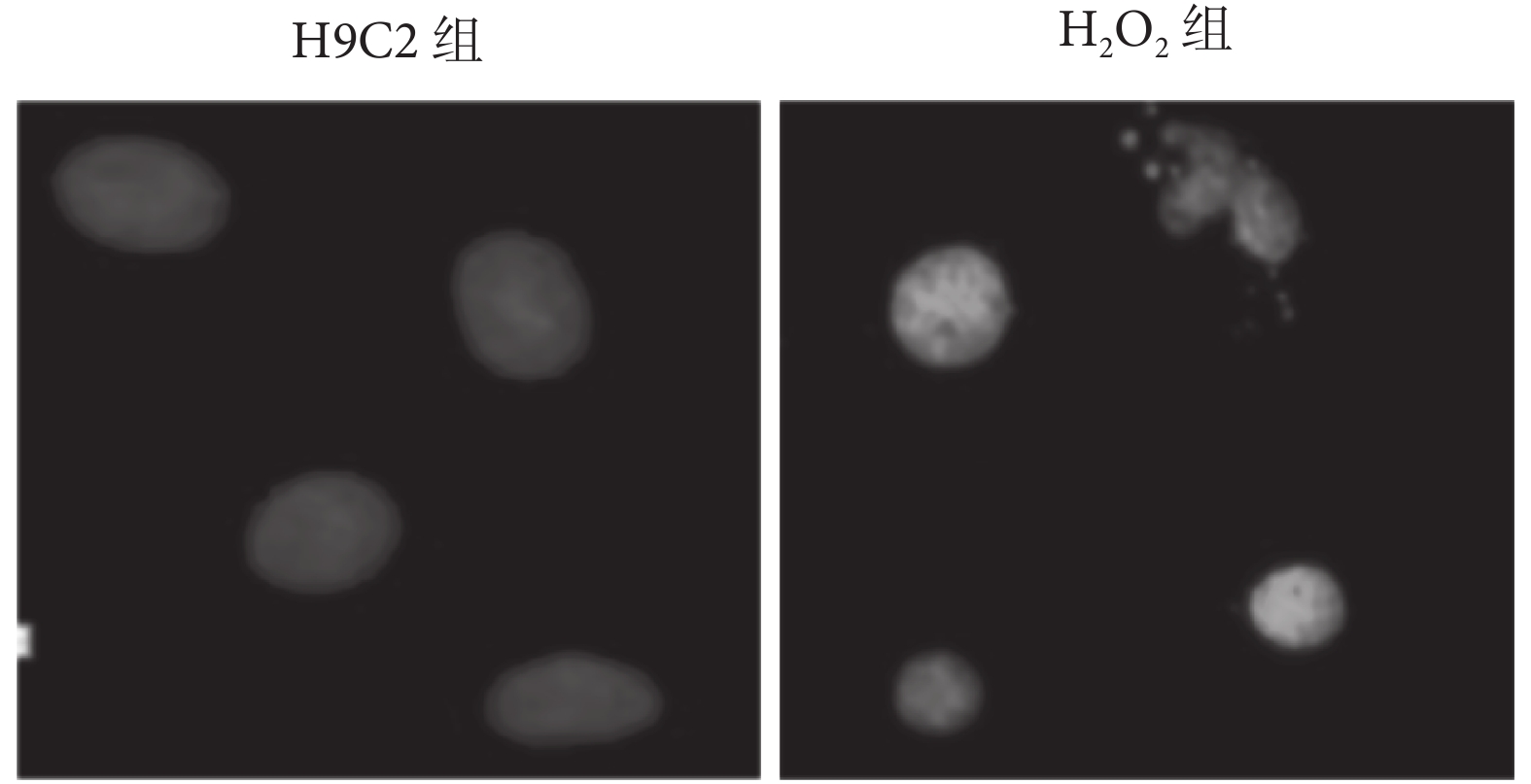
2.1.2 鏡下觀察 H2O2 對細胞造成的損傷及生長抑制 大鼠心肌 H9C2 細胞分組處理完畢后進行 DAPI 染色,結果提示每個視野下 H2O2 組細胞數較 H9C2 組明顯減少;H2O2 對細胞造成明顯損傷及生長抑制(見圖 2、表 2)。
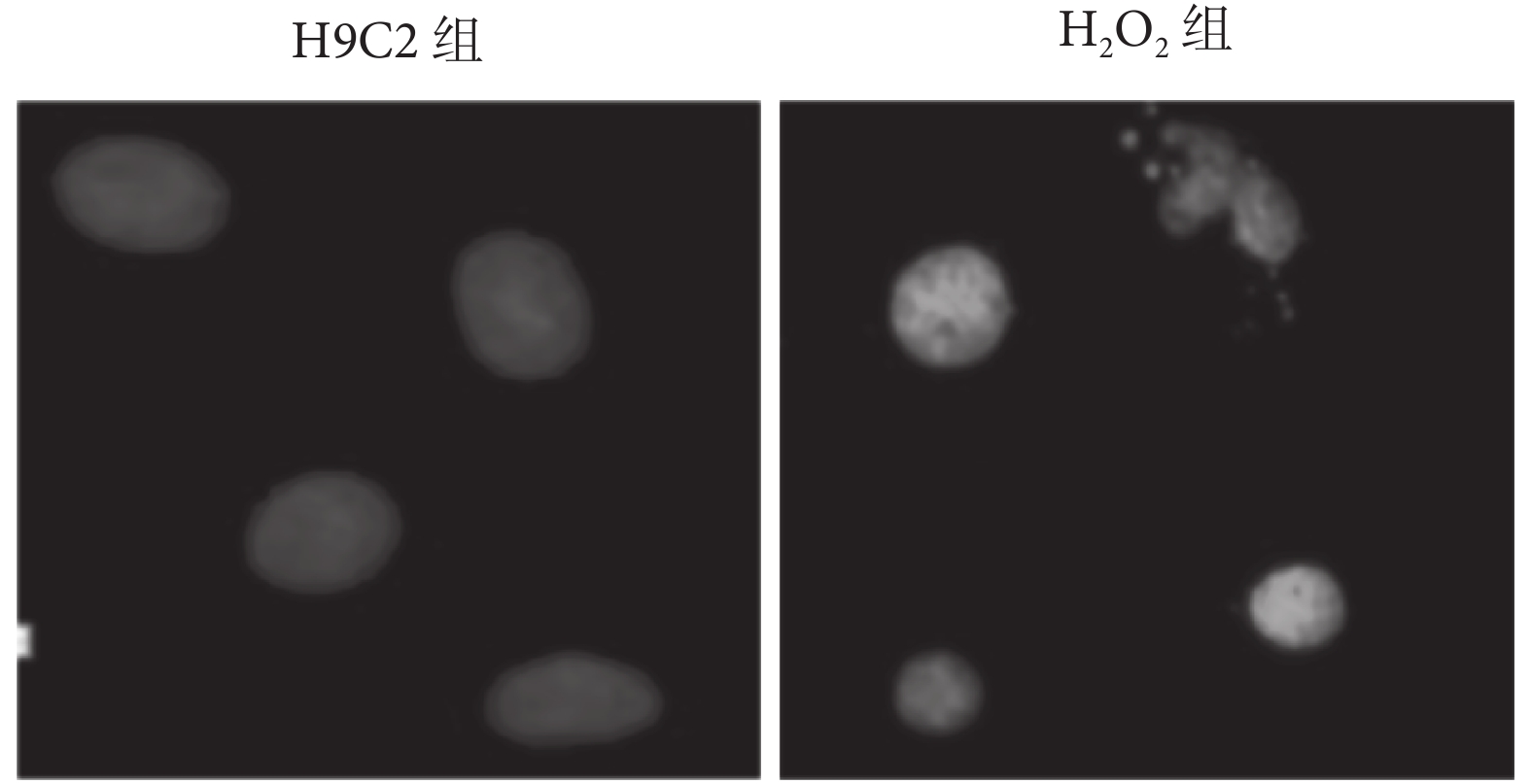 圖2
兩組細胞形態(OLYMPUS 激光共聚焦顯微鏡下,100×)
Figure2.
Morphology of cells (by OLYMPUS laser confocal microscopy, 100×)
圖2
兩組細胞形態(OLYMPUS 激光共聚焦顯微鏡下,100×)
Figure2.
Morphology of cells (by OLYMPUS laser confocal microscopy, 100×)
2.2 H2O2 對 H9C2 細胞中 myocardin 和 Nrf2 基因的影響
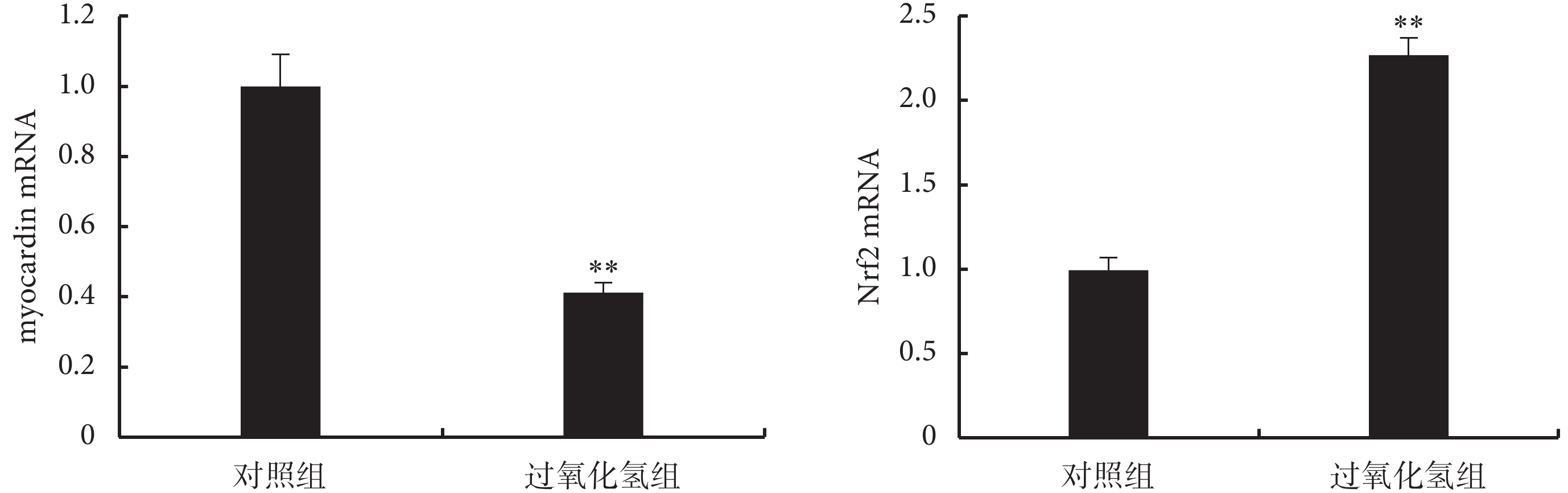
2.2.1 H2O2 對 myocardin mRNA 和 Nrf2 mRNA 的影響 H2O2 組 myocardin mRNA 表達較對照組下調 58.86%,而 Nrf2 mRNA 上調到對照組的 2.27 倍(見圖 3)。
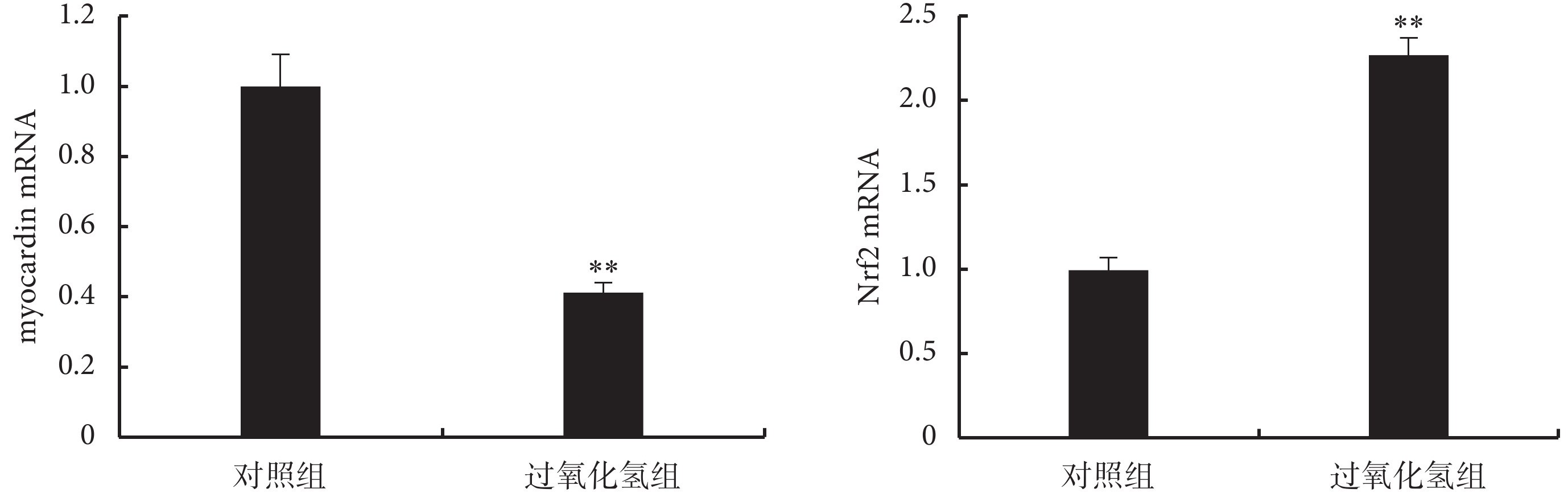 圖3
H2O2 對 myocardin mRNA 和 Nrf2 mRNA 表達的影響
圖3
H2O2 對 myocardin mRNA 和 Nrf2 mRNA 表達的影響
**
**
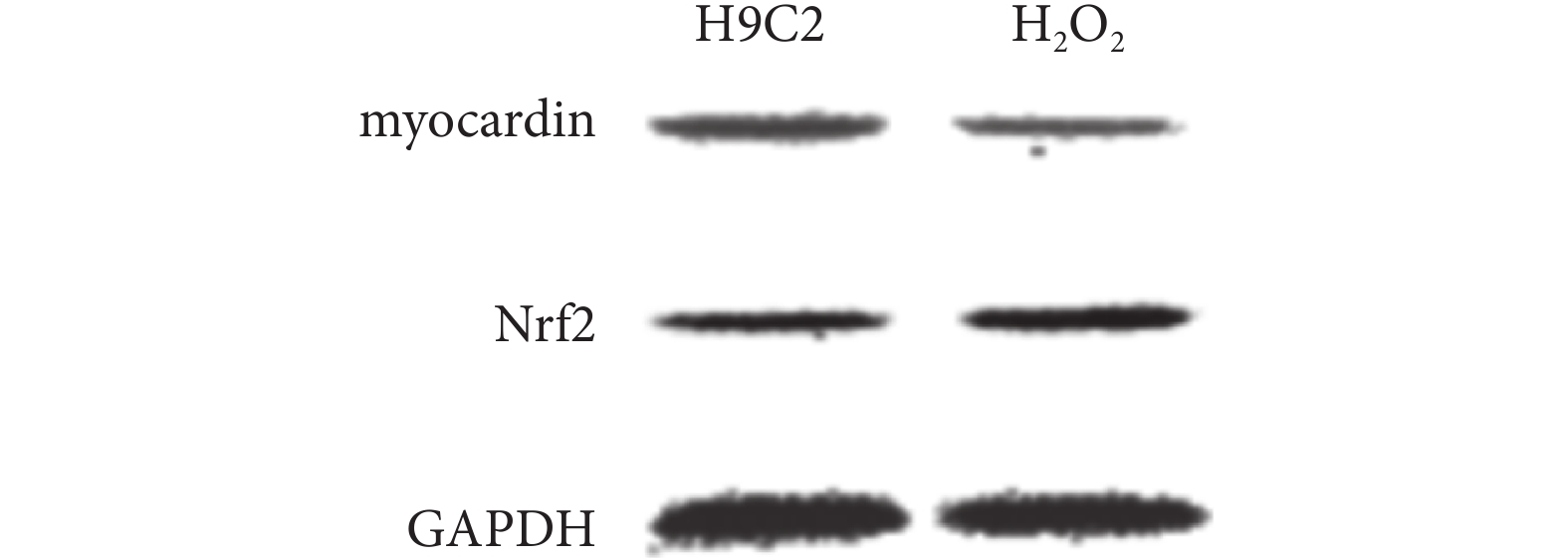
2.2.2 H2O2 對 myocardin 蛋白和 Nrf2 蛋白的影響 H2O2 可下調 H9C2 細胞中 myocardin 蛋白表達,以及上調 Nrf2 蛋白表達(見圖 4)。
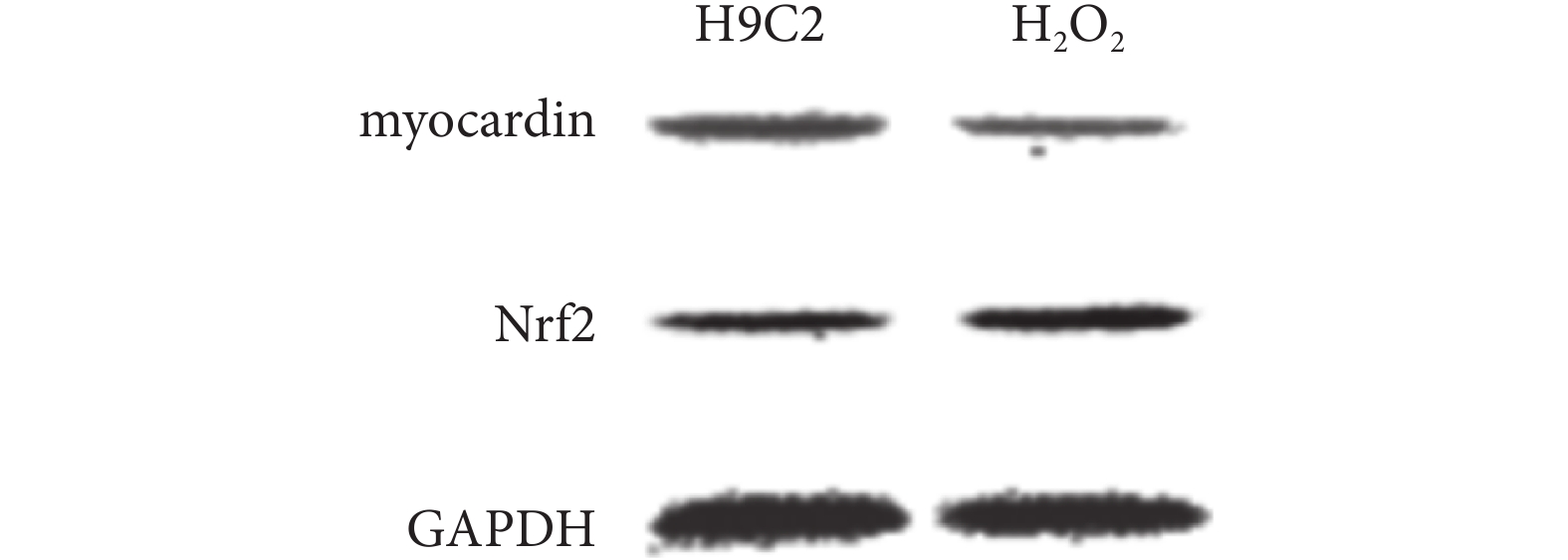 圖4
兩組細胞 myocardin 蛋白和 Nrf2 蛋白的表達差異
Figure4.
Differential expression of myocardin and Nrf2 between two groups
圖4
兩組細胞 myocardin 蛋白和 Nrf2 蛋白的表達差異
Figure4.
Differential expression of myocardin and Nrf2 between two groups
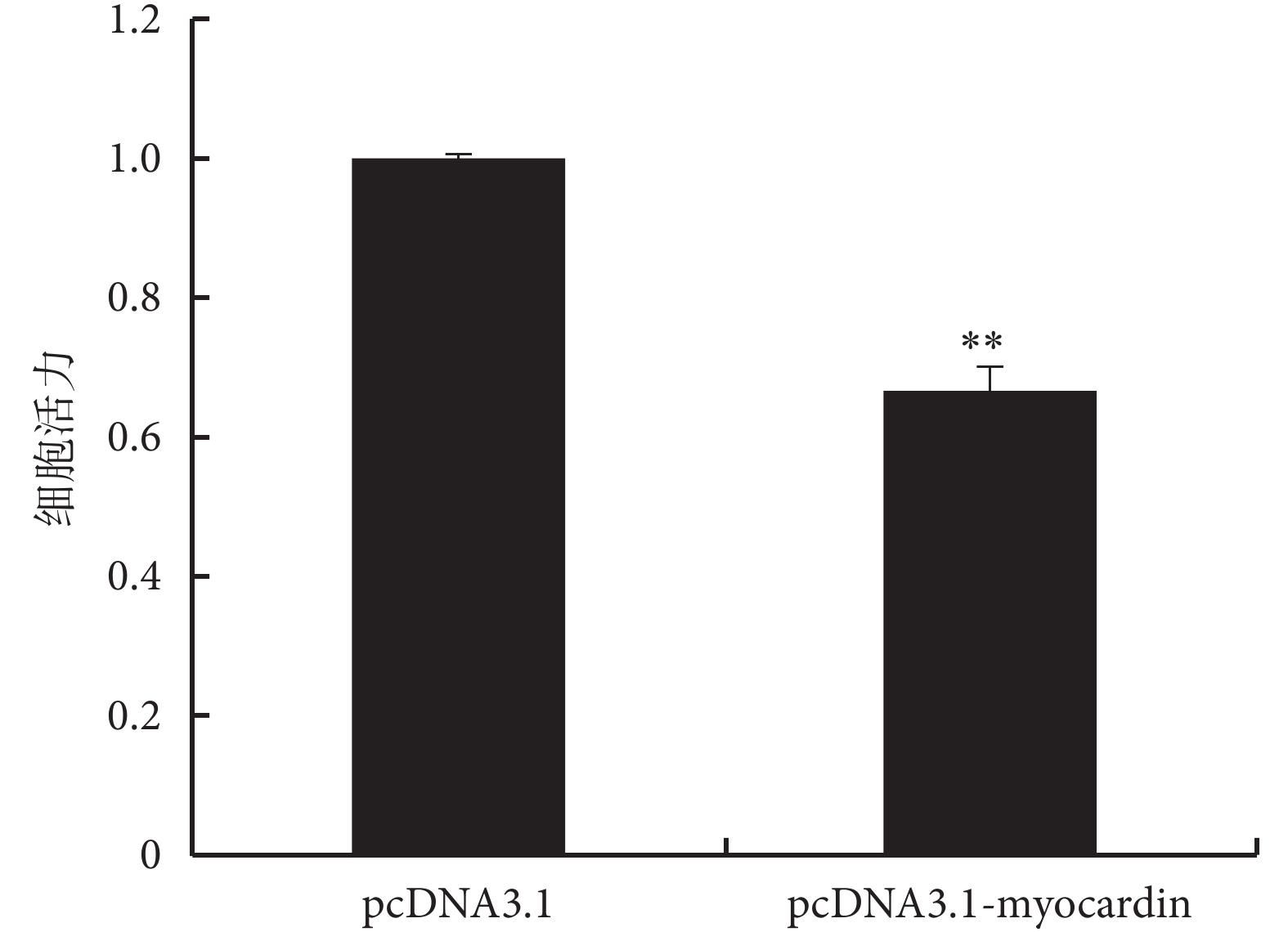
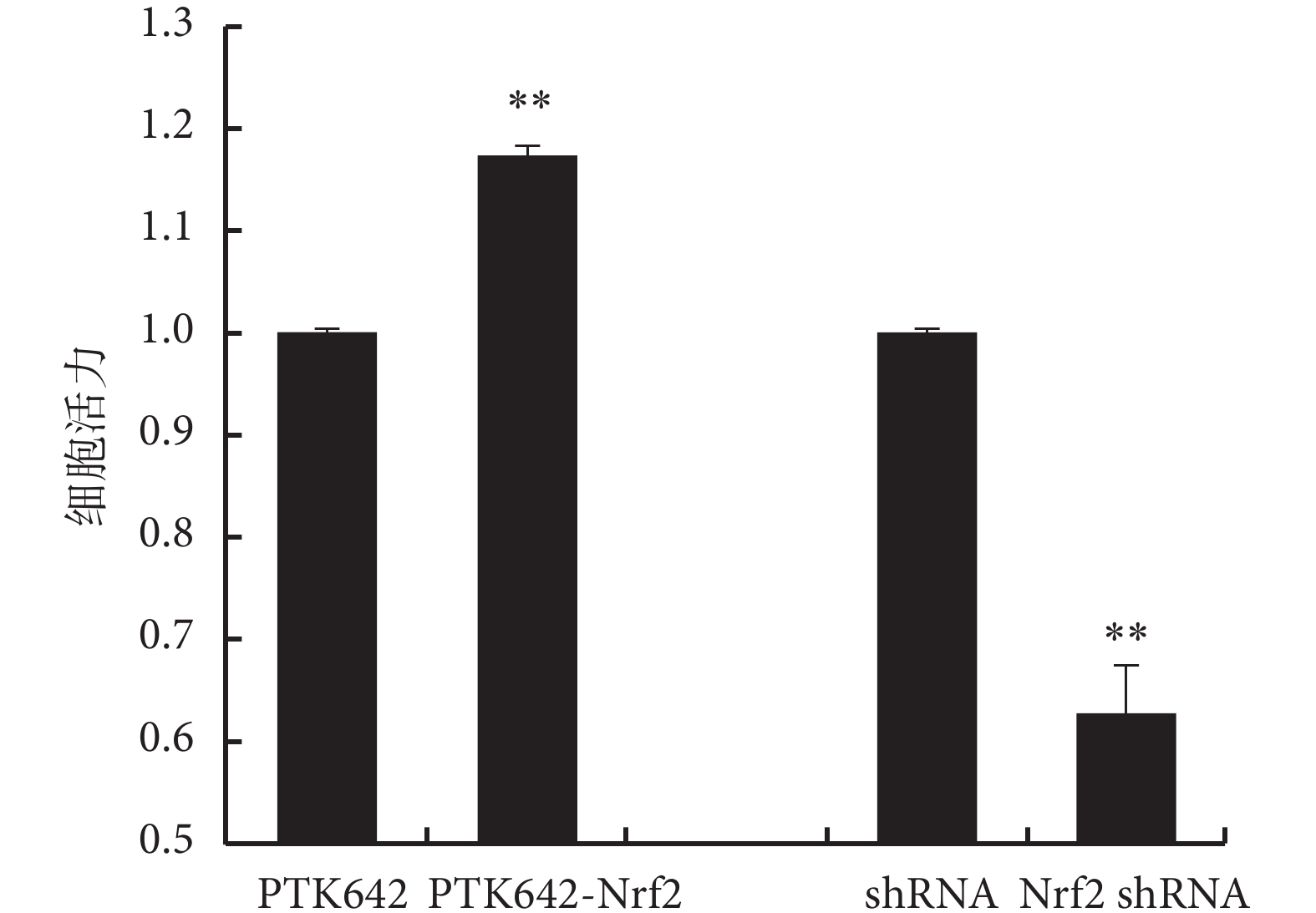
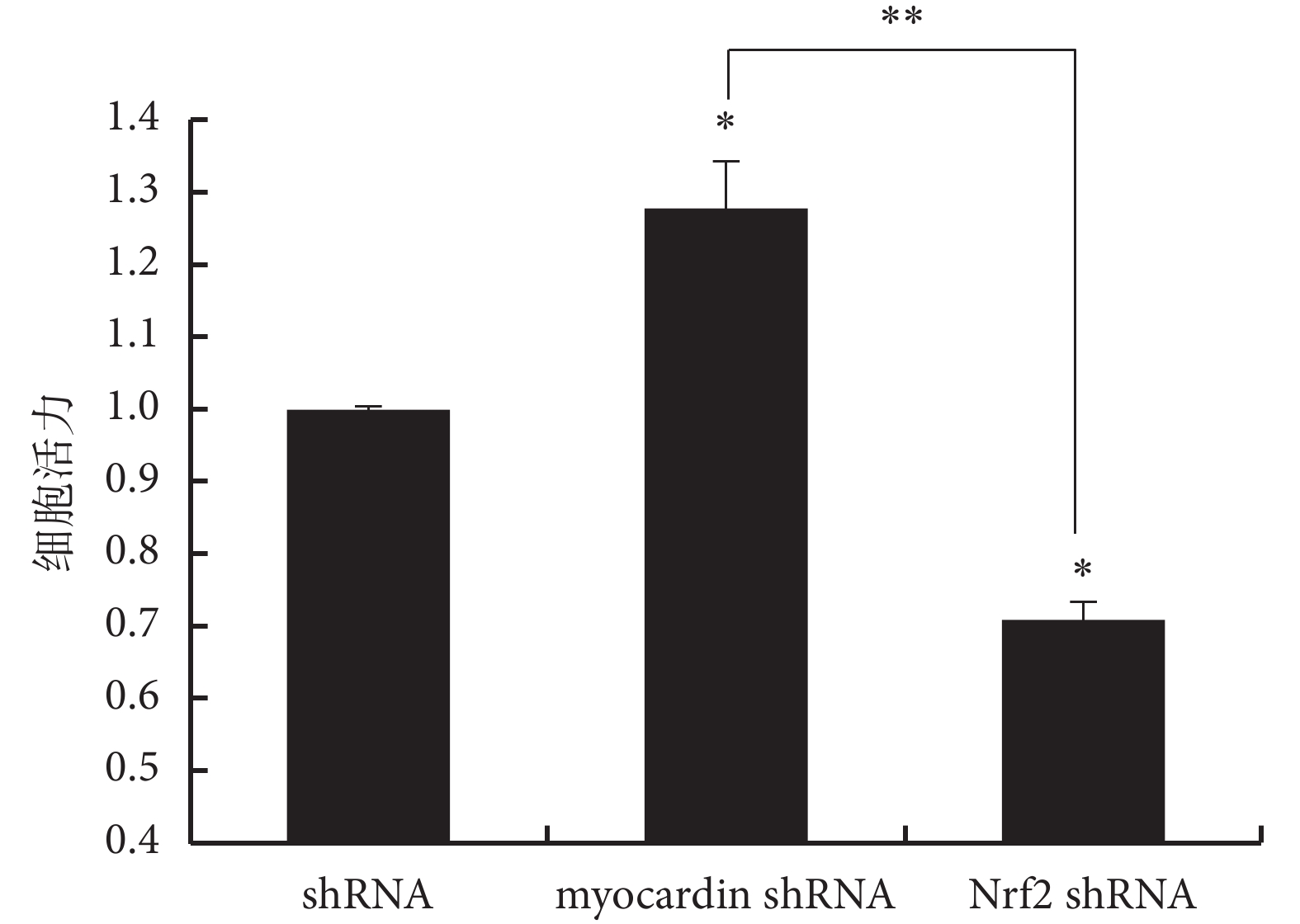
2.3 myocardin 及 Nrf2 對細胞增殖的影響
過表達 myocardin 基因和下調 Nrf2 基因表達可抑制細胞增殖,而下調 myocardin 基因表達和上調 Nrf2 基因表達可促進細胞增殖(見圖 5、6、7),實驗證明 myocardin 基因和 Nrf2 基因對細胞增殖的影響呈現相反的作用。
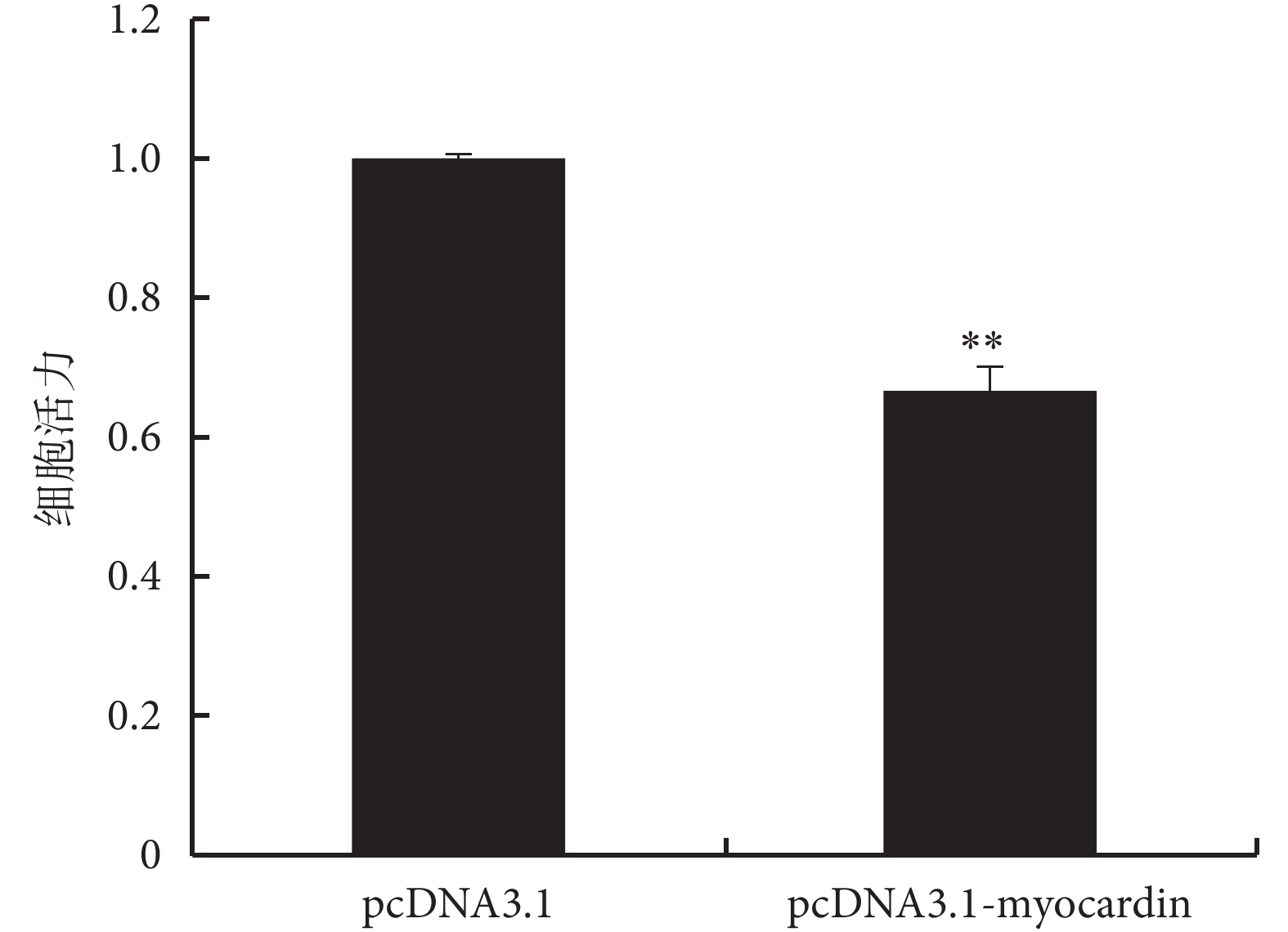 圖5
過表達 myocardin 基因對細胞活力的影響
圖5
過表達 myocardin 基因對細胞活力的影響
**
**
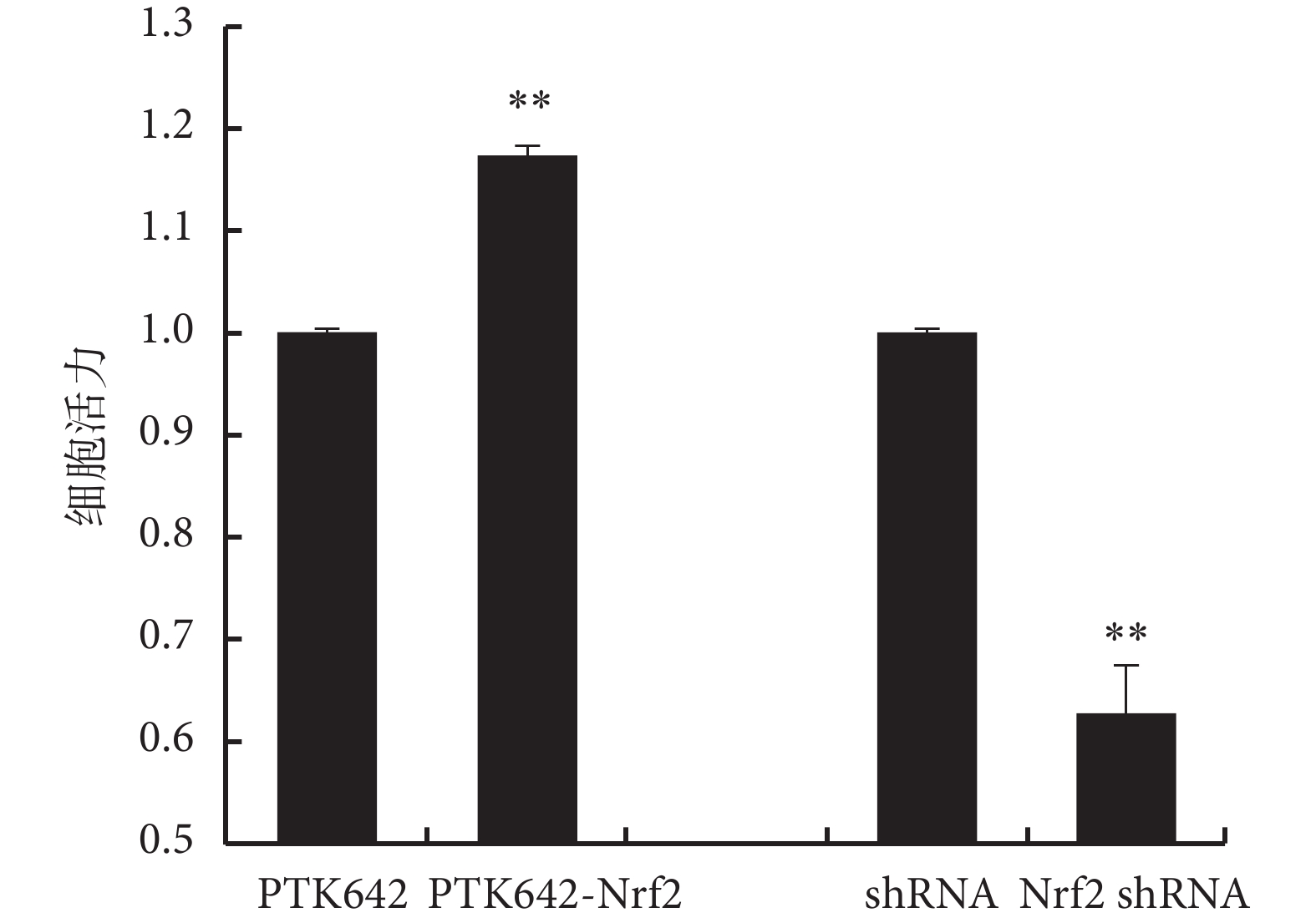 圖6
Nrf2 對細胞活力的影響
圖6
Nrf2 對細胞活力的影響
**
**
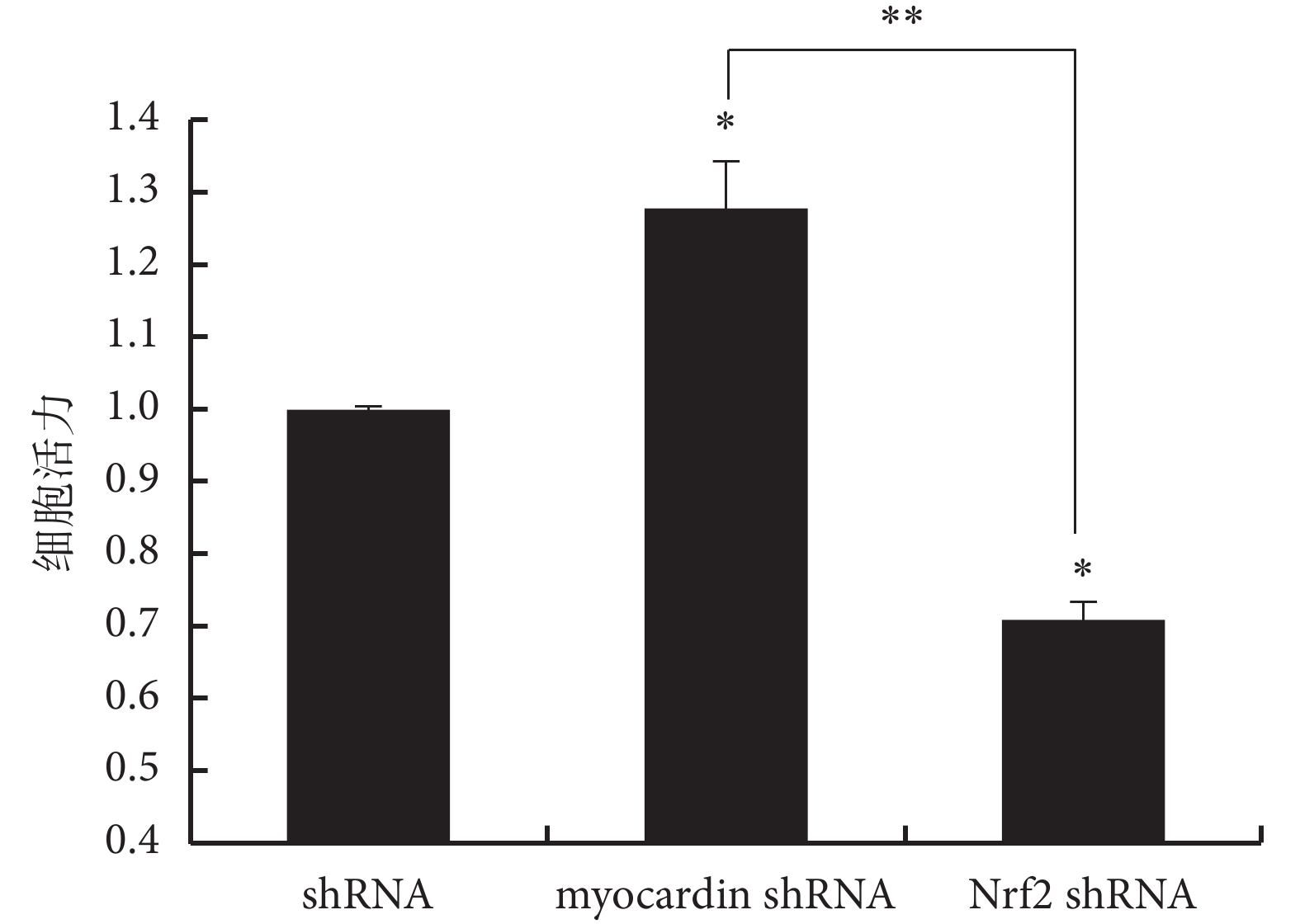 圖7
下調 myocardin 及 Nrf2 基因表達對細胞活力的影響
圖7
下調 myocardin 及 Nrf2 基因表達對細胞活力的影響
與 shRNA 對照組比較,*
*
2.4 調控 myocardin 基因表達對 Nrf2 基因的影響
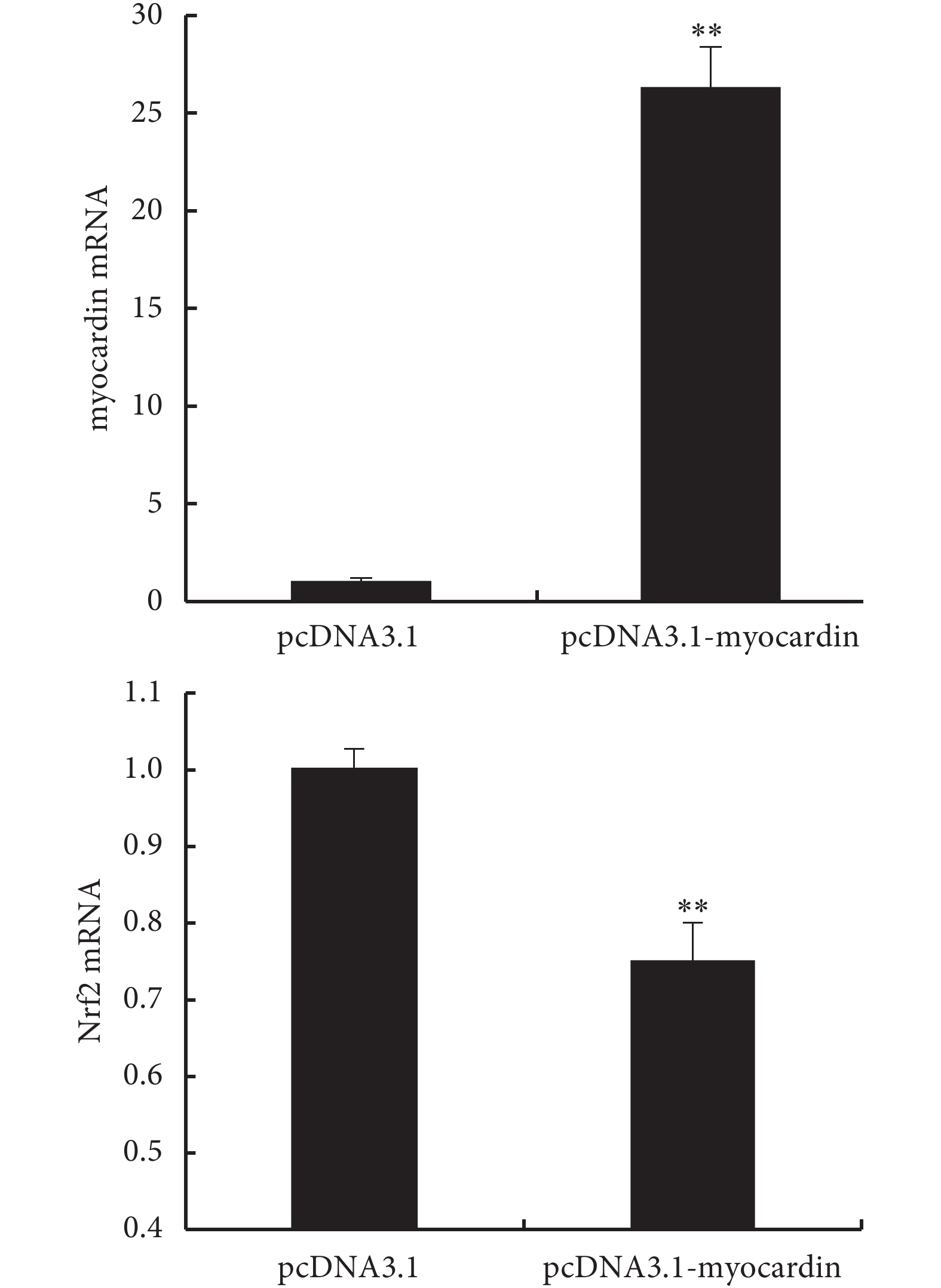
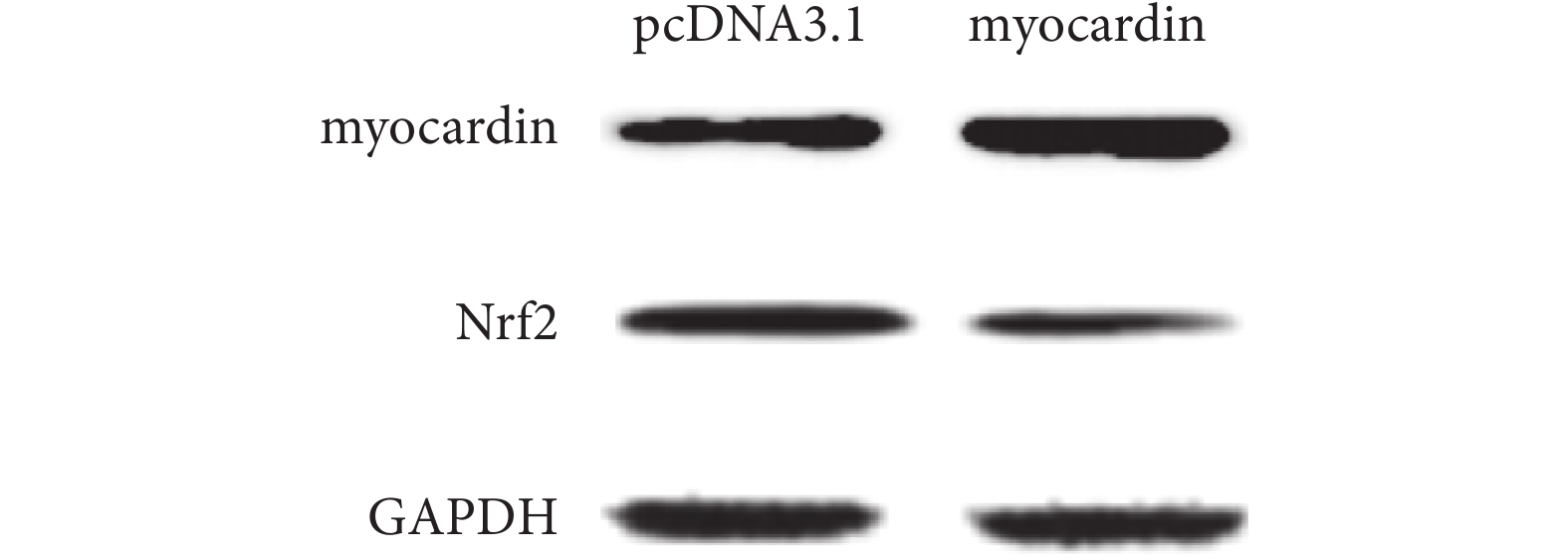
2.4.1 上調 myocardin 基因表達對 Nrf2 基因的影響(見圖 8、9) 實驗組轉染 myocardin 質粒后檢測到 myocardin mRNA 上調到對照組的 26.27 倍,提示成功轉染 myocardin 基因;而過表達 myo-cardin 后檢測到 Nrf2 表達(mRNA 及蛋白)下調。
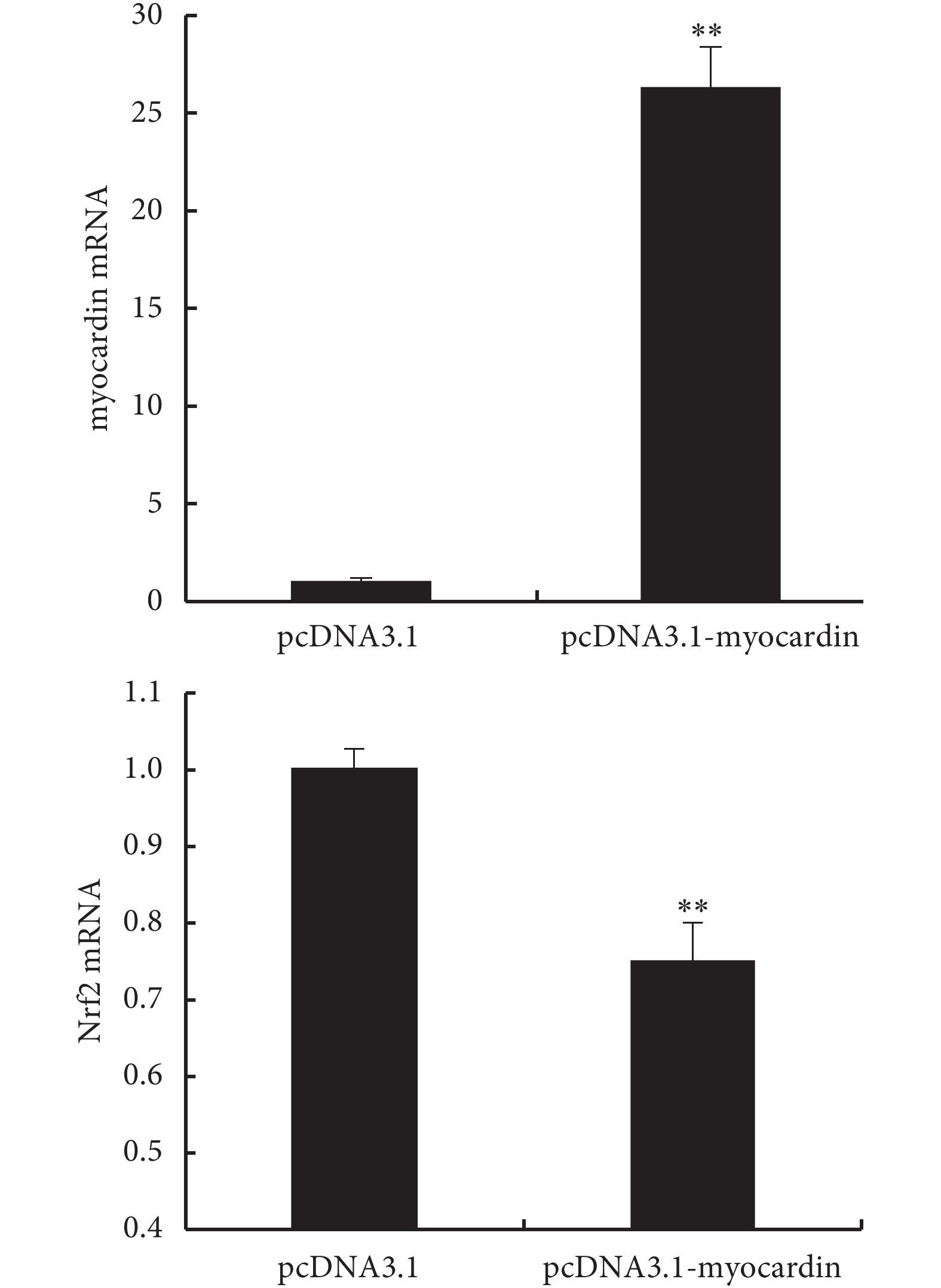 圖8
轉染 myocardin 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
圖8
轉染 myocardin 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
**
**
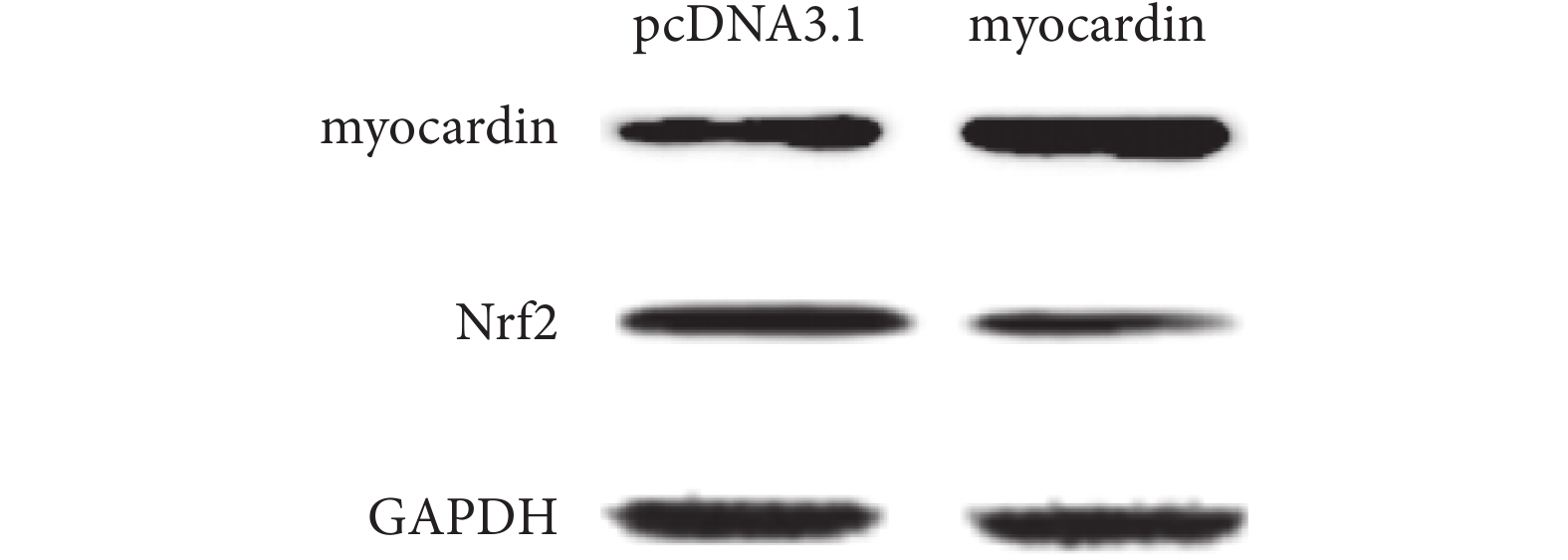 圖9
轉染 pcDNA3.1-myocardin 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure9.
Expression of myocardin and Nrf2 in cells that transfected with pcDNA3.1-myocardin expression plasmid
圖9
轉染 pcDNA3.1-myocardin 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure9.
Expression of myocardin and Nrf2 in cells that transfected with pcDNA3.1-myocardin expression plasmid
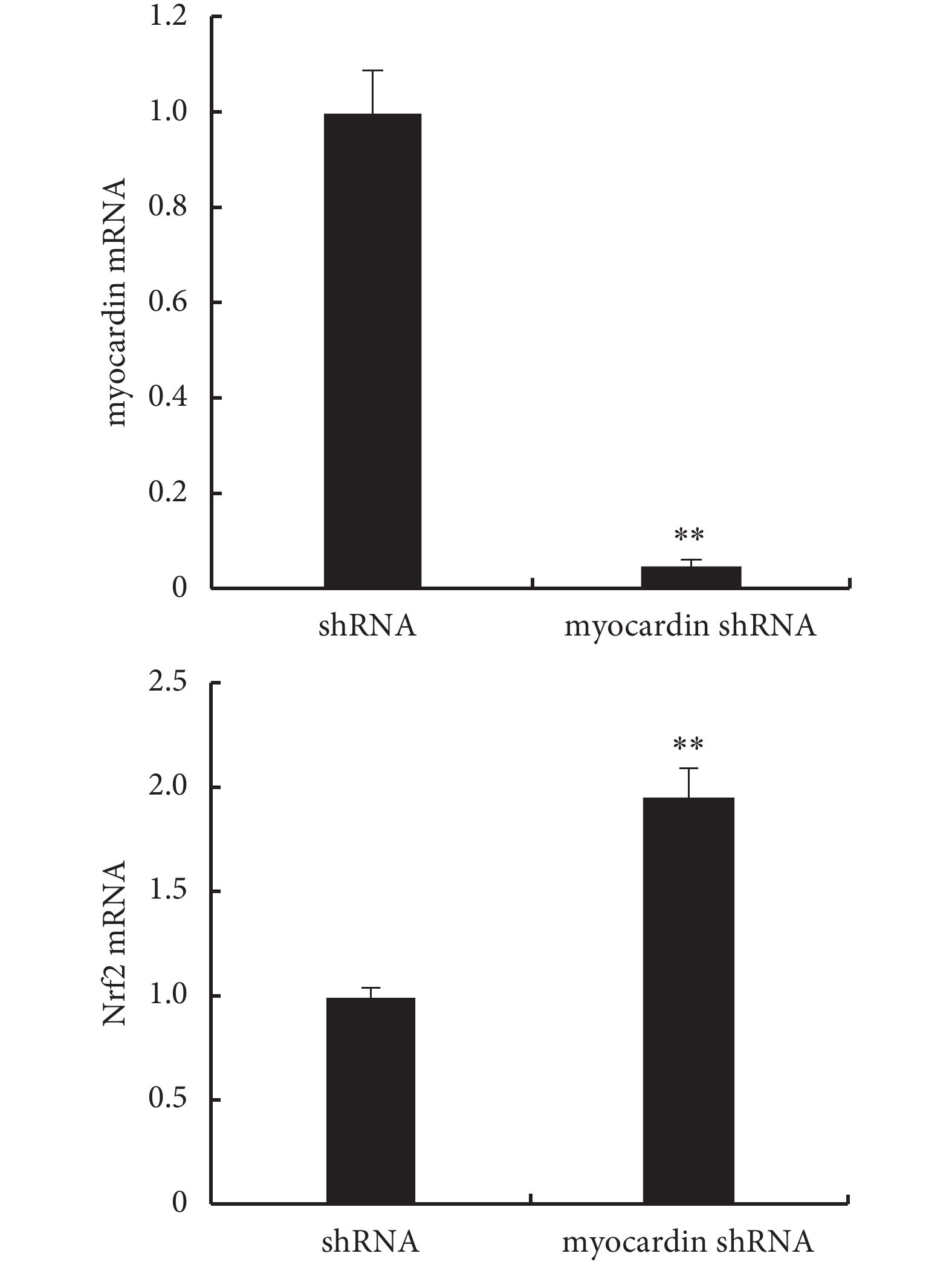
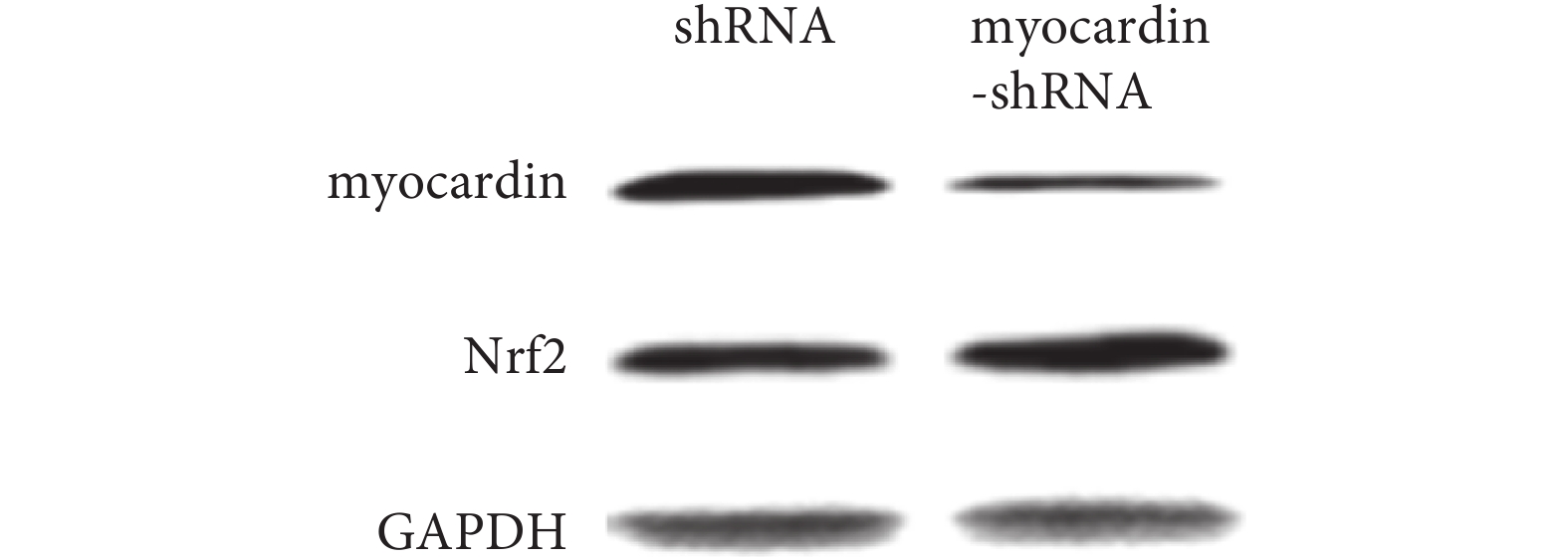
2.4.2 下調 myocardin 基因表達對 Nrf2 基因的影響(見圖 10、11) 實驗組轉染 myocardin shRNA 質粒后 myocardin 基因表達明顯下調,檢測到 Nrf2 基因表達(mRNA 及蛋白)較對照組明顯上調,即下調 myocardin 基因表達可導致 Nrf2 mRNA 及蛋白表達上調。
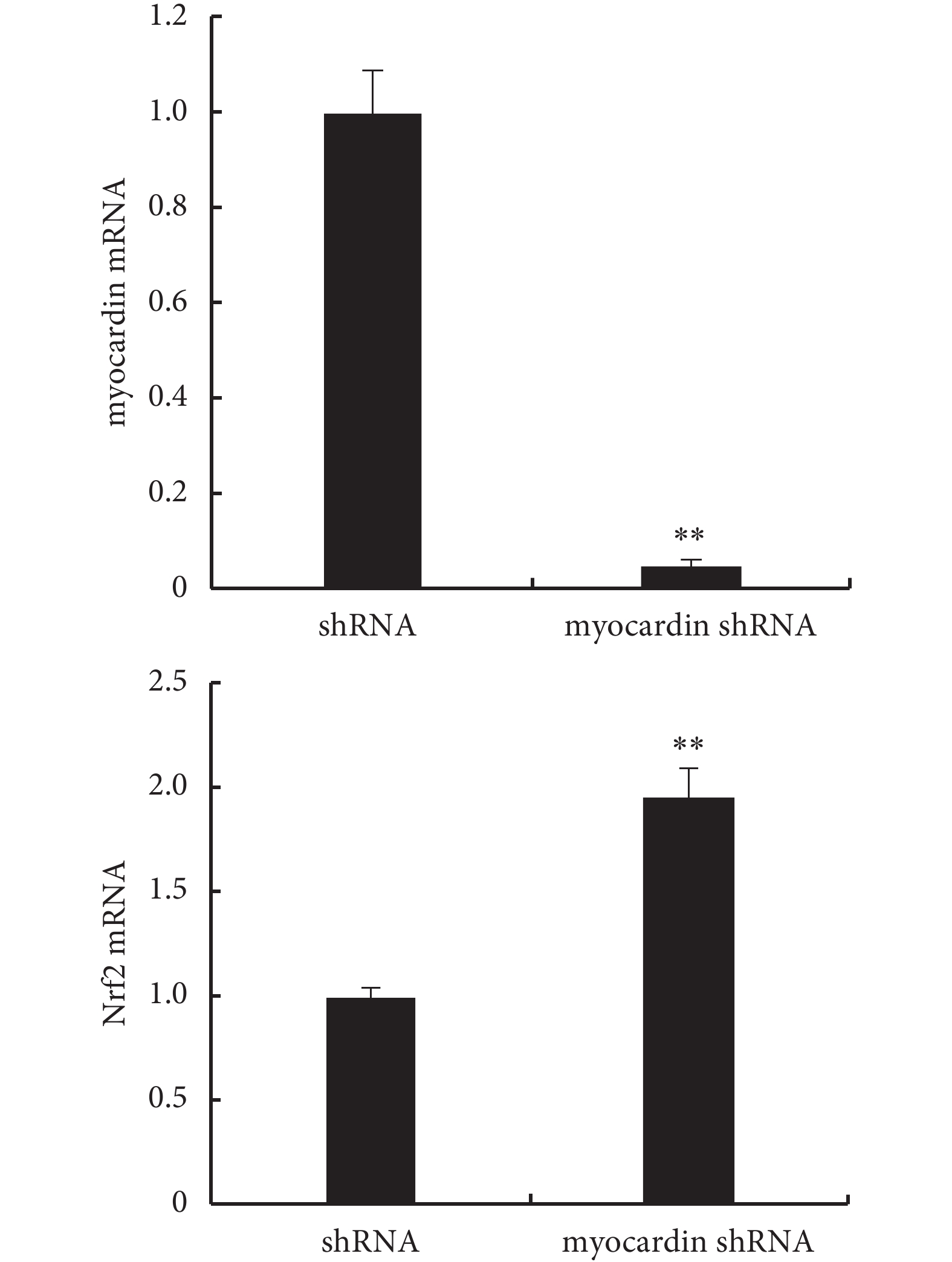 圖10
轉染 myocardin shRNA 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
圖10
轉染 myocardin shRNA 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
**
**
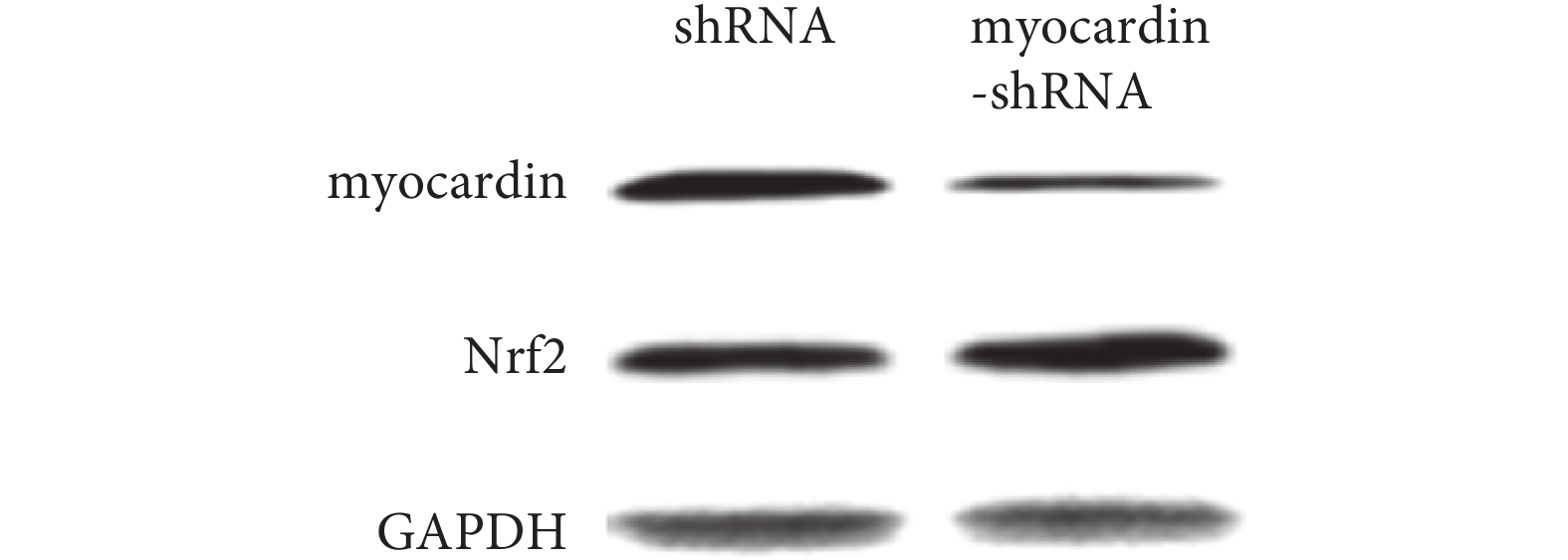 圖11
轉染 myocardin shRNA 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure11.
Expression of myocardin and Nrf2 in cells that transfected with myocardin shRNA plasmid
圖11
轉染 myocardin shRNA 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure11.
Expression of myocardin and Nrf2 in cells that transfected with myocardin shRNA plasmid
3 討論
正常生物體內的氧化代謝會產生少量的 ROS,ROS 低濃度時在正常的細胞代謝和信號轉導中具有重要作用,體內抗氧化系統能及時清除多余的氧自由基以維持機體代謝平衡,而高濃度的 ROS 會引起細胞損傷。文獻報道,過量的 ROS 介導產生的氧化應激是導致心肌缺血再灌注損傷發生的主要機制[3]。因此,本研究應用 H2O2 和大鼠心肌細胞建立氧化損傷模型。
myocardin 特異地在心臟和平滑肌細胞內廣泛表達[4],影響心臟及平滑肌細胞的發育和分化[5]。在最近的研究工作中,我們首次發現 myocardin 可以保護心肌細胞使其避免由十字胞堿引起的凋亡,這一發現提示 myocardin 在成年心肌細胞中可能具有保護功能。氧化損傷過程中亦伴隨著細胞凋亡的發生,而 myocardin 是否能在心肌細胞氧化-抗氧化損傷過程中發揮保護作用尚不清楚。
生物進化過程中,機體形成了一套復雜的對抗氧化應激反應的反饋應答系統[6]。當反復暴露于活性氧自由基時,機體自身能通過 Kelch 樣環氧氯丙烷相關蛋白-1(kelch-like ech-associated protein-1, Keap1)-Nrf2-ARE 通路誘導產生一系列保護性蛋白,以緩解活性氧自由基對細胞造成的損害[7]。
本實驗研究表明:200 μmol/L H2O2 孵育 24 h 能導致大鼠心肌 H9C2 細胞出現氧化損傷,細胞增殖受到抑制,氧化損傷過程中反饋激活了內源性 Nrf2 主導的抗氧化損傷信號系統,同時發現 myo-cardin 的表達明顯下調。進一步實驗結果提示上調 myocardin 基因和下調 Nrf2 基因表達可抑制細胞增殖,下調 myocardin 基因表達和上調 Nrf2 基因表達可促進細胞增殖;且上調 myocardin 基因表達時檢測到 Nrf2 表達下調,而下調 myocardin 基因表達時檢測到 Nrf2 表達上調。由此推測心肌細胞遭受氧化損傷時可能通過上調 Nrf2 基因表達發揮抗氧化損傷作用;同時通過上調 Nrf2 基因表達及下調 myocardin 基因表達促進細胞增殖;而 Nrf2 基因表達上調可能是通過下調 myocardin 基因表達實現的。
myocardin 基因在影響細胞增殖和氧化-抗氧化損傷過程中的表現與抗氧化基因 Nrf2 的表現完全相反,其作用機制尚不明確。二者之間是否存在直接或者間接的轉錄調控作用?H2O2 導致心肌氧化損傷時反饋激活了 Nrf2 主導的抗氧化損傷信號系統是否是通過下調 myocardin 基因而實現的?這些作用機制都需要進一步研究明確,以便更好地尋求抗氧化損傷的生物學治療靶點。
引言
氧化應激時產生大量活性氧(reactive oxygen species,ROS)造成細胞損傷,而過氧化氫(H2O2)是體內氧化代謝的中間產物,同時又是一種活性氧,因此實驗研究中常用 H2O2 建立氧化損傷模型[1]。ROS 能激活轉錄因子核因子 E2 相關因子 2(nuclear factor erythroid 2-related factor 2,Nrf2)-抗氧化反應元件(antioxidant response element,ARE)通路[2],轉錄調控下游抗氧化蛋白等產生生物學效應,從而發揮抗氧化損傷作用。myocardin 是最新發現的血清反應因子(serum response factor,SRF)協同轉錄因子,它與 SRF 結合成復合物,促進 SRF-CArG box(SRF-[CC(A/T)6GG])依賴的靶基因的表達,影響和控制心臟及平滑肌細胞的發育和分化。在氧化損傷過程中,二者對心肌細胞是否存在相互作用尚不清楚。本實驗主要是為了明確 H2O2 造成細胞氧化損傷過程中 myocardin 和 Nrf2 基因的表達變化以及它們對細胞增殖的影響,并初探 myocardin 對 Nrf2 的影響。
1 資料與方法
1.1 實驗細胞
大鼠心肌 H9C2 細胞購自武漢博士德生物工程有限公司。
1.2 主要試劑
DMEM 培養基(GIBCO 公司),胎牛血清(GIBCO 公司),Trizol 裂解液(Ambion 公司),RIPA 裂解液(碧云天生物技術公司),反轉錄試劑盒(TaKaRa 公司),SYBGR Green(TaKaRa 公司),30% H2O2(國藥集團化學試劑有限公司),myocar-din、Nrf2 單克隆抗體、辣根過氧化物酶鼠抗及兔抗(上海起發實驗試劑有限公司),1 μg/μL 聚乙烯亞胺(polyethyleneimine,PEI)(GE 公司),DAPI(武漢博士德生物工程有限公司)。
1.3 主要質粒
pcDNA3.1 質粒、myocardin 質粒(即 pcDNA3.1-myocardin 質粒)、myocardin shRNA 質粒、Nrf2 shRNA 質粒、PTK642 質粒、PTK642-Nrf2 質粒,均由天津科技大學惠贈。
1.4 主要儀器
日本 Astec 氣套式二氧化碳恒溫培養箱,Spec-traMax? i3x 多功能酶標儀,美國 SIM 凝膠成像系統,OLYMPUS 激光共聚焦顯微鏡,BioRad CFX96 定量 PCR 儀,BioRad ChemiDocTMXRS+化學發光成像系統。
1.5 方法
1.5.1 細胞培養 大鼠心肌 H9C2 細胞加入 DMEM 完全培養基(含 10% 胎牛血清、100 U/mL 青霉素、100 mg/mL 鏈霉素)中,37℃、5% CO2 培養箱中培養。
1.5.2 細胞種板密度及用途 96 孔板種板細胞數約 1×104/孔,主要用于磺酰羅丹明 B(sulforhoda-mine B,SRB)檢測;24 孔板種板細胞數約 5×104/孔,主要用于細胞爬片;6 孔板種板細胞數為 1×105/孔~2×105/孔,主要用于提取 RNA 及蛋白。
1.5.3 相關檢測指標及實驗方法 (1)PEI 轉染法:細胞貼壁后所占總面積達到培養皿面積的 70%~90% 開始轉染。用無血清 DMEM 培養基稀釋目的 DNA,然后將 1 μg/μL PEI 轉染液(PEI∶Total DNA=3∶1)加入稀釋質粒中,立即旋渦振蕩;室溫靜置 15 min 后將 DNA-PEI 混合液直接加入細胞培養基中,24~48 h 收獲細胞提取 RNA 或者蛋白。
(2)SRB 比色法:細胞接種于 96 孔板進行分組處理后,棄上清,10% 三氯乙酸固定、0.4%(質量—體積百分濃度)SRB 染色、10 mmol/L Tris base(pH 10.5)振蕩搖勻后在酶標儀測定 540 nm 波長處光吸收值,計算細胞生長抑制率及細胞活力。
(3)Real-time PCR 檢測目的基因 mRNA 的表達:用 GeneTool 軟件設計 myocardin、Nrf2 和內參基因 GAPDH 的 PCR 引物(引物序列及產物長度見表 1)。細胞接種于 6 孔板進行分組處理后,利用 Trizol 試劑提取細胞總 RNA,按 Takara 反轉錄試劑盒操作步驟合成 cDNA,然后于 CFX96 Real-timeSystem 檢測目的基因 mRNA 的表達。
(4)Western blot 檢測目的基因蛋白的表達:細胞接種于 6 孔板進行分組處理后,每孔加入 100 μL RIPA 裂解液及 1 μL Cocktail 蛋白酶抑制劑,冰上裂解 30 min,4℃、14 000 r/min 離心 20 min,收集上清液;加入蛋白上樣 Buffer,100℃ 煮沸 5~10 min;聚丙烯酰胺凝膠電泳(polyacrlamide gel electrophoresis, PAGE),然后將 PAGE 分離的蛋白質樣品轉移到硝酸纖維素薄膜,5% 脫脂奶粉 37℃ 封閉 90 min,孵育一抗(37℃ 孵育 1.5 h 或者 4℃ 孵育過夜);1×TBST 洗滌三次,每次 5 min;孵育二抗(37℃ 1 h);再用 1×TBST 洗滌三次,每次 5 min;顯影。
(5)DAPI 染色法:在 24 孔板中放入滅菌細胞爬片,細胞培養并分組處理完畢后棄去培養基;加入適量 DAPI 工作液(約 80 μL/孔)覆蓋細胞即可,室溫避光染色 15~30 min;棄去染色液,1×PBS 洗滌細胞,水平搖床上室溫慢搖 5 min×3 次;取出細胞爬片倒置于載玻片上;于 OLYMPUS 激光共聚焦顯微鏡下(100×)觀察對比每個視野下各組細胞數及細胞核形態變化,并拍照分析。
1.5.4 實驗步驟 (1)細胞貼壁后分組處理:① 對照組(H9C2 組):棄原培養基,更換完全培養基培養 24 h;② H2O2 組:棄原培養基,加入不同濃度 H2O2 的完全培養基孵育 24 h。分組進行 SRB 檢測,計算細胞生長抑制率,確定 H2O2 最佳孵育濃度。進行 DAPI 染色,顯微鏡下觀察細胞數及細胞核形態變化,進一步了解細胞損傷情況。
(2)按轉染不同目的基因質粒分兩大組:① 上調目的基因組:對照組轉染空載體(pcDNA3.1 或 PTK642)質粒,實驗組轉染目的基因(pcDNA3.1-myocardin 或 PTK642-Nrf2)質粒;② 下調目的基因組:對照組轉染 shRNA 空載體質粒,實驗組轉染目的基因-shRNA 質粒(myocardin shRNA 質粒或 Nrf2 shRNA 質粒)。
(3)通過 SRB 檢測相對活細胞數,了解myo-cardin 及 Nrf2 基因對細胞增殖的影響。
(4)通過 Real-time PCR 檢測各組細胞 myo-cardin 及 Nrf2 mRNA 的表達差異。
(5)通過 Western blot 檢測各組細胞 myo-cardin 及 Nrf2 蛋白的表達差異。
1.6 統計學處理
用 SPSS20.0 軟件進行數據處理,計量資料以均數±標準差表示,組間比較均采用 t 檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 確定 H2O2 氧化損傷最佳孵育濃度
2.1.1 不同濃度 H2O2 氧化損傷 大鼠心肌 H9C2 細胞分別加入不同濃度 H2O2 孵育 24 h,SRB 檢測后計算細胞活力,結果提示 200 μmol/L H2O2 孵育時細胞存活率與對照組比較差異有統計學意義(P<0.05)(見圖 1),故選擇 200 μmol/L 為 H2O2 氧化損傷最佳孵育濃度。
 圖1
H2O2 濃度梯度氧化損傷
圖1
H2O2 濃度梯度氧化損傷
以 0 μmol/L 組作為對照組,*
*
2.1.2 鏡下觀察 H2O2 對細胞造成的損傷及生長抑制 大鼠心肌 H9C2 細胞分組處理完畢后進行 DAPI 染色,結果提示每個視野下 H2O2 組細胞數較 H9C2 組明顯減少;H2O2 對細胞造成明顯損傷及生長抑制(見圖 2、表 2)。
 圖2
兩組細胞形態(OLYMPUS 激光共聚焦顯微鏡下,100×)
Figure2.
Morphology of cells (by OLYMPUS laser confocal microscopy, 100×)
圖2
兩組細胞形態(OLYMPUS 激光共聚焦顯微鏡下,100×)
Figure2.
Morphology of cells (by OLYMPUS laser confocal microscopy, 100×)
2.2 H2O2 對 H9C2 細胞中 myocardin 和 Nrf2 基因的影響
2.2.1 H2O2 對 myocardin mRNA 和 Nrf2 mRNA 的影響 H2O2 組 myocardin mRNA 表達較對照組下調 58.86%,而 Nrf2 mRNA 上調到對照組的 2.27 倍(見圖 3)。
 圖3
H2O2 對 myocardin mRNA 和 Nrf2 mRNA 表達的影響
圖3
H2O2 對 myocardin mRNA 和 Nrf2 mRNA 表達的影響
**
**
2.2.2 H2O2 對 myocardin 蛋白和 Nrf2 蛋白的影響 H2O2 可下調 H9C2 細胞中 myocardin 蛋白表達,以及上調 Nrf2 蛋白表達(見圖 4)。
 圖4
兩組細胞 myocardin 蛋白和 Nrf2 蛋白的表達差異
Figure4.
Differential expression of myocardin and Nrf2 between two groups
圖4
兩組細胞 myocardin 蛋白和 Nrf2 蛋白的表達差異
Figure4.
Differential expression of myocardin and Nrf2 between two groups
2.3 myocardin 及 Nrf2 對細胞增殖的影響
過表達 myocardin 基因和下調 Nrf2 基因表達可抑制細胞增殖,而下調 myocardin 基因表達和上調 Nrf2 基因表達可促進細胞增殖(見圖 5、6、7),實驗證明 myocardin 基因和 Nrf2 基因對細胞增殖的影響呈現相反的作用。
 圖5
過表達 myocardin 基因對細胞活力的影響
圖5
過表達 myocardin 基因對細胞活力的影響
**
**
 圖6
Nrf2 對細胞活力的影響
圖6
Nrf2 對細胞活力的影響
**
**
 圖7
下調 myocardin 及 Nrf2 基因表達對細胞活力的影響
圖7
下調 myocardin 及 Nrf2 基因表達對細胞活力的影響
與 shRNA 對照組比較,*
*
2.4 調控 myocardin 基因表達對 Nrf2 基因的影響
2.4.1 上調 myocardin 基因表達對 Nrf2 基因的影響(見圖 8、9) 實驗組轉染 myocardin 質粒后檢測到 myocardin mRNA 上調到對照組的 26.27 倍,提示成功轉染 myocardin 基因;而過表達 myo-cardin 后檢測到 Nrf2 表達(mRNA 及蛋白)下調。
 圖8
轉染 myocardin 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
圖8
轉染 myocardin 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
**
**
 圖9
轉染 pcDNA3.1-myocardin 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure9.
Expression of myocardin and Nrf2 in cells that transfected with pcDNA3.1-myocardin expression plasmid
圖9
轉染 pcDNA3.1-myocardin 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure9.
Expression of myocardin and Nrf2 in cells that transfected with pcDNA3.1-myocardin expression plasmid
2.4.2 下調 myocardin 基因表達對 Nrf2 基因的影響(見圖 10、11) 實驗組轉染 myocardin shRNA 質粒后 myocardin 基因表達明顯下調,檢測到 Nrf2 基因表達(mRNA 及蛋白)較對照組明顯上調,即下調 myocardin 基因表達可導致 Nrf2 mRNA 及蛋白表達上調。
 圖10
轉染 myocardin shRNA 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
圖10
轉染 myocardin shRNA 質粒后檢測 myocardin mRNA 和 Nrf2 mRNA 的表達
**
**
 圖11
轉染 myocardin shRNA 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure11.
Expression of myocardin and Nrf2 in cells that transfected with myocardin shRNA plasmid
圖11
轉染 myocardin shRNA 質粒后檢測 myocardin 和 Nrf2 蛋白的表達
Figure11.
Expression of myocardin and Nrf2 in cells that transfected with myocardin shRNA plasmid
3 討論
正常生物體內的氧化代謝會產生少量的 ROS,ROS 低濃度時在正常的細胞代謝和信號轉導中具有重要作用,體內抗氧化系統能及時清除多余的氧自由基以維持機體代謝平衡,而高濃度的 ROS 會引起細胞損傷。文獻報道,過量的 ROS 介導產生的氧化應激是導致心肌缺血再灌注損傷發生的主要機制[3]。因此,本研究應用 H2O2 和大鼠心肌細胞建立氧化損傷模型。
myocardin 特異地在心臟和平滑肌細胞內廣泛表達[4],影響心臟及平滑肌細胞的發育和分化[5]。在最近的研究工作中,我們首次發現 myocardin 可以保護心肌細胞使其避免由十字胞堿引起的凋亡,這一發現提示 myocardin 在成年心肌細胞中可能具有保護功能。氧化損傷過程中亦伴隨著細胞凋亡的發生,而 myocardin 是否能在心肌細胞氧化-抗氧化損傷過程中發揮保護作用尚不清楚。
生物進化過程中,機體形成了一套復雜的對抗氧化應激反應的反饋應答系統[6]。當反復暴露于活性氧自由基時,機體自身能通過 Kelch 樣環氧氯丙烷相關蛋白-1(kelch-like ech-associated protein-1, Keap1)-Nrf2-ARE 通路誘導產生一系列保護性蛋白,以緩解活性氧自由基對細胞造成的損害[7]。
本實驗研究表明:200 μmol/L H2O2 孵育 24 h 能導致大鼠心肌 H9C2 細胞出現氧化損傷,細胞增殖受到抑制,氧化損傷過程中反饋激活了內源性 Nrf2 主導的抗氧化損傷信號系統,同時發現 myo-cardin 的表達明顯下調。進一步實驗結果提示上調 myocardin 基因和下調 Nrf2 基因表達可抑制細胞增殖,下調 myocardin 基因表達和上調 Nrf2 基因表達可促進細胞增殖;且上調 myocardin 基因表達時檢測到 Nrf2 表達下調,而下調 myocardin 基因表達時檢測到 Nrf2 表達上調。由此推測心肌細胞遭受氧化損傷時可能通過上調 Nrf2 基因表達發揮抗氧化損傷作用;同時通過上調 Nrf2 基因表達及下調 myocardin 基因表達促進細胞增殖;而 Nrf2 基因表達上調可能是通過下調 myocardin 基因表達實現的。
myocardin 基因在影響細胞增殖和氧化-抗氧化損傷過程中的表現與抗氧化基因 Nrf2 的表現完全相反,其作用機制尚不明確。二者之間是否存在直接或者間接的轉錄調控作用?H2O2 導致心肌氧化損傷時反饋激活了 Nrf2 主導的抗氧化損傷信號系統是否是通過下調 myocardin 基因而實現的?這些作用機制都需要進一步研究明確,以便更好地尋求抗氧化損傷的生物學治療靶點。