為構建穩定表達人乳頭瘤病毒(HPV)58 型 E6E7 融合基因的人宮頸癌 C33A 細胞系,將實驗前期構建好并實現真核表達的重組慢病毒顆粒 LV-HPV58E6E7 轉染入 HPV(–)的人宮頸癌 C33A 細胞,經流式細胞儀分選出穩定轉染的陽性克隆,利用四唑鹽比色(MTT)法檢測轉染后細胞的生長情況以及流式細胞術檢測細胞周期,并將穩定表達 HPV58E6E7 融合基因的 C33A 細胞 LV-HPV58E6E7/C33A 接種于裸鼠左腋下成瘤,用熒光定量 PCR(qRT-PCR)、Western blot 檢測瘤組織中 HPV58 型 E6E7 融合基因的轉錄和表達。結果顯示 HPV58E6E7 融合基因可促進 C33A 細胞的增殖;LV-HPV58E6E7/C33A 細胞株能在裸鼠體內穩定轉錄及表達 HPV58 型 E6E7 融合基因。這表明我們成功建立了能穩定表達 HPV58E6E7 融合基因的人宮頸癌 C33A 細胞系 LV-HPV58E6E7/C33A,為 HPV58 型治療性疫苗的免疫效果檢測提供了抗原細胞來源。
引用本文: 賈超穎, 馬偉紅, 王鶴. 穩定表達人乳頭瘤病毒 58 型(HPV58)E6E7 融合基因的人宮頸癌細胞株 C33A 的構建及驗證. 生物醫學工程學雜志, 2017, 34(4): 578-584. doi: 10.7507/1001-5515.201605040 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
人乳頭瘤病毒(human papillomavirus,HPV)已被證實是子宮頸癌及癌前病變發生的首要因素且為始動因素。既往研究證明,HPV E6 和 E7 蛋白從病毒開始感染到癌癥的進展期,在腫瘤發展的所有階段均有表達,同時,作為維持其惡性表型所必需持續存在的病毒抗原[1],E6 和 E7 蛋白能誘發機體產生并維持較強的以病毒抗原為靶分子的特異性細胞毒性 T 細胞(cytotoxic T cell,Tc 或 CTL)反應。因此,HPV E6 和 E7 蛋白成為宮頸癌治療性疫苗研究和開發的主要特異靶抗原[2]。
流行病學研究證明,HPV16 和 18 型的感染在世界范圍內很普遍,沒有明顯的地區差異,而 HPV58 型的感染分布則具有明顯的區域性,僅在東亞和南亞各國有很高的感染率,尤其是我國南方的一些地區,如廣西、香港等區域,已超過 18 型而位居第二[3]。由于 HPV 世界流行病學的分布,目前國內外 HPV 治療性疫苗的研制主要集中在 HPV16 型、HPV18 型,缺少對 HPV58 型治療性疫苗的研究[4],市面上更不存在 HPV58 型陽性的人宮頸癌細胞系,因此無法構建相關的動物模型,而穩定表達 HPV58 型 E6E7 融合基因的細胞系是后期 HPV58 型治療性疫苗開發及評價其免疫效果研究所必須的。本研究在前期成功構建的表達 HPV58 型 E6E7 融合基因的慢病毒載體的基礎上[5],通過構建穩定表達 HPV58 型 E6E7 融合基因的人宮頸癌細胞系,并建立荷瘤小鼠模型,為 HPV58 型陽性相關腫瘤及其癌前病變免疫相關疫苗的研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 質粒、引物、菌株、細胞、動物 HPV58E6E7 融合基因上下游引物、GAPDH 上下游引物、重組慢病毒 LV-HPV58E6E7 和空載體病毒 LV-CON 均由本實驗室構建并保存;HPV(–)的 C33A 細胞株購自中國科學院;雌性 BALA/C 裸鼠,4~6 周,16~18 g,購自廣西醫科大學動物實驗中心并飼養于廣西醫科大學動物實驗中心 SPF 級層流室內。
1.1.2 主要試劑、酶及抗體 培養基 RPMI-1640、胎牛血清、胰酶購自美國 Corning 公司;青鏈霉素雙抗、RIPA(radio immunoprecipitation assay)裂解液、二哇琳甲酸(Bicinchoninicacid,BCA)蛋白定量提取試劑盒、MTT 購自碧云天公司;總 RNA 逆轉錄試劑盒購自美國 Thermo 公司;SYBR? Premix Ex Taq II 購自寶生生物公司;鼠抗 β-actin 抗體、鼠抗人 His 標簽單克隆抗體、HRP 標記的羊抗小鼠 IgG 購自北京博奧森生物技術有限公司;細胞周期測試盒購于凱基生物公司;ECL 化學發光試劑盒購自索萊寶公司。
1.2 方法
1.2.1 重組慢病毒 LV-HPV58E6E7 感染 C33A 細胞將 HPV(–)的人宮頸癌細胞株 C33A 細胞置于含有 10% 胎牛血清、100 U/mL 的青霉素、100 μg/mL 鏈霉素的 RPMI-1640 完全培養液中,于 37℃、5% CO2 的恒溫培養箱中培養。將對數生長期的 C33A 細胞接種到 6 孔板中,分三組:C33A 組:C33A 細胞,無處理,為空白對照組;LV-NC/C33A 組:轉染空載體的病毒顆粒的 C33A 細胞,為陰性對照組;LV-HPV58E6E7/C33A 組:轉染帶 HPV58E6E7 融合基因的病毒顆粒的 C33A 細胞,為實驗組。24 h 后待其匯合度達到 20%~30% 時,將包含 HPV58 型 E6E7 融合基因的病毒顆粒 LV-HPV58E6E7 及空載體病毒顆粒 LV-CON 分別轉染 C33A 細胞,轉染后將細胞置于 37℃、5% CO2 培養箱中培養。由于該慢病毒系統帶有綠色熒光,因此 48~72 h 后可直接在倒置熒光顯微鏡下觀察兩組細胞的轉染情況。
1.2.2 流式細胞儀分選細胞及轉染效率的檢測 收集對數生長期的上述三組細胞,用含有 2% 血清的 PBS 重懸細胞,配成濃度為 1×107 個/mL 的細胞懸液;300 目篩網過濾重懸的細胞,移入流式專用管上流式機分選。將分選后的細胞進行擴大培養,傳代至第 20 代時再次用流式細胞儀檢測熒光表達率。
1.2.3 重組慢病毒 LV-HPV58E6E7 對 C33A 細胞生長及其周期的影響 (1)MTT 法檢測三組細胞生長曲線的測定:分別收集細胞匯合度達 80%~90% 的 LV-HPV58E6E7/C33A、LV-NC/C33A 及 C33A 組細胞,制成單細胞懸液,按每孔 5×103 個細胞接種于 96 孔板,每孔總體積均為 200 μL,于 5% CO2、37℃ 培養。細胞培養 24、48、72、96、120 h,每種細胞任選 5 個孔進行實驗:每孔加入 MTT 溶液 20 μL(5 mg/mL),37℃ 孵育 4 h 后棄去上清加入 DMSO(二甲基亞砜)150 μL,充分混勻使甲臜充分溶解;用酶標儀測定各孔的 A490 吸光度值,記錄結果。以時間為橫軸,取 5 個相同生長天數及攜帶相同載體的光吸收值均值作為該類細胞的某天吸光值,并作為縱軸繪制細胞生長曲線。計算各組細胞的倍增時間:倍增時間=兩倍原始細胞計數點(與吸光度相關)對應時間—初始細胞計數點對應時間。
(2)流式細胞儀檢測三組細胞生長周期變化:分別收集細胞匯合度達 80%~90% 的 LV-HPV58-E6E7/C33A、LV-NC/C33A 及 C33A 組細胞,制成細胞密度為 1×106 個/mL 的細胞懸液,將 1 mL 細胞懸液緩慢加入至預冷的 4 mL 無水乙醇中,輕柔吹打后混勻后放于 4℃ 過夜。第二天將細胞混合液 2 000 r/min 離心 5 min 去除上清,用 PBS 洗滌細胞 2 次后加入 RNAse 100 μL 重懸細胞,于 37℃ 水浴 30 min。每管加入 400 μL 新配的碘化丙啶(propidium iodide,PI)液,于 4℃ 避光孵育 30 min 后篩網過濾,上流式細胞儀檢測細胞周期。
1.2.4 穩定表達 HPV58E6E7 融合基因的荷瘤裸鼠模型的建立及鑒定 (1)建立裸鼠皮下成瘤模型:將 4~6 周、體重為 16~18 g 的 12 只雌性 BALB/C 裸鼠隨機分成三組,每組 4 只。接種 C33A 細胞者為空白對照組,接種 LV-NC/C33A 細胞者為陰性對照組,接種 LV-HPV58E6E7/C33A 細胞者為實驗組。分別取對數生長期的 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組及 C33A 組細胞,制備單細胞懸液,調整細胞濃度為 1×107 個細胞/mL,于小鼠左腋下皮下接種 0.1 mL 細胞懸液,即 1×106 個細胞/只。
(2)觀察裸鼠皮下成瘤情況:接種細胞后,定期觀察裸鼠皮下成瘤情況并記錄。待腫瘤生長一定天數時,腹腔注射 0.1 mL 3.5% 水合氯醛溶液麻醉裸鼠,將裸鼠固定后置于暗箱平臺,利用動物活體成像系統拍攝裸鼠皮下腫瘤及熒光表達情況。
(3)檢測裸鼠皮下腫瘤組織中 HPV58 型 E6E7 融合基因表達情況。
A. qRT-PCR 檢測三組裸鼠皮下瘤組織中 HPV58E6E7 融合基因負載量:種瘤三周后,處死小鼠,手術分離出瘤組織,用 Trizol 法提取每組裸鼠皮下瘤組織的總 RNA,逆轉錄合成 cDNA,以各組細胞 cDNA 為模板,運用 HPV58 E6E7 融合基因、GAPDH 上下游引物進行熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR),檢測各瘤組織中 HPV58E6E7 融合基因的含量。反應體系 20.0 μL:SYBR Premix Ex Taq II 10.0 μL;PCR Forward Primer(10 μmol/L)0.75 μL;PCR Forward Primer(10 μmol/L)0.75 μL;模板 1.0 μL;ddH2O 7.5 μL。反應條件:94℃ 預變性 5 min;94℃ 變性 30 s、56℃ 退火 30 s、72℃ 延伸 30 s,共 30 個循環;72℃ 延伸 10 min。產物 4℃ 保存。
由 MX-3000P PCR 儀程序軟件,直接得出兩個標準品中三個樣本 DNA 中 HPV58E6E7、GAPDH 的 Ct 值、擴增效率,然后根據倍比稀釋的標準品的 Ct 值繪制出標準曲線,最后根據樣本 DNA 的 Ct 值及標準曲線,計算出相對應的基因拷貝數。
B. Western blot 檢測三組裸鼠皮下瘤組織中 HPV58E6E7+HIS 標簽蛋白的表達:用 RIPA 法提取三組裸鼠皮下瘤組織總蛋白,并用 BCA 法測定三組蛋白濃度。將各組蛋白調整至同一濃度后,進行 SDS-PAGE 電泳(80 V 電壓跑濃縮膠,整個過程 30~40 min,后轉至 120 V 跑分離膠,總時間約 2 h),電轉移至 PVDF 膜上(100 mA 轉膜 1.5 h),5% 脫脂蛋白 TBST 封閉液室溫振蕩 2 h,與 1∶1 000 稀釋的 6×鼠抗 His 抗體、1∶1 000 稀釋的鼠抗β-actin 抗體,4℃ 孵育過夜;TBST 洗膜 3 次,然后與 1∶2 000 稀釋的 HRP 標記的山羊抗小鼠 IgG 室溫孵育 2 h,TBST 洗膜 3 次,ECL 顯色檢測目的蛋白。
1.2.5 統計學分析 實驗數據采用 SPSS16.0 統計軟件進行分析,計量數據以均數±標準差表示,不同處理組組間比較采用方差分析或 t 檢驗,組間多重比較采用 SNK 檢驗方法進行分析,P<0.05 為差異有統計學意義。
2 結果
2.1 流式細胞儀分選出的細胞及轉染效率的檢測
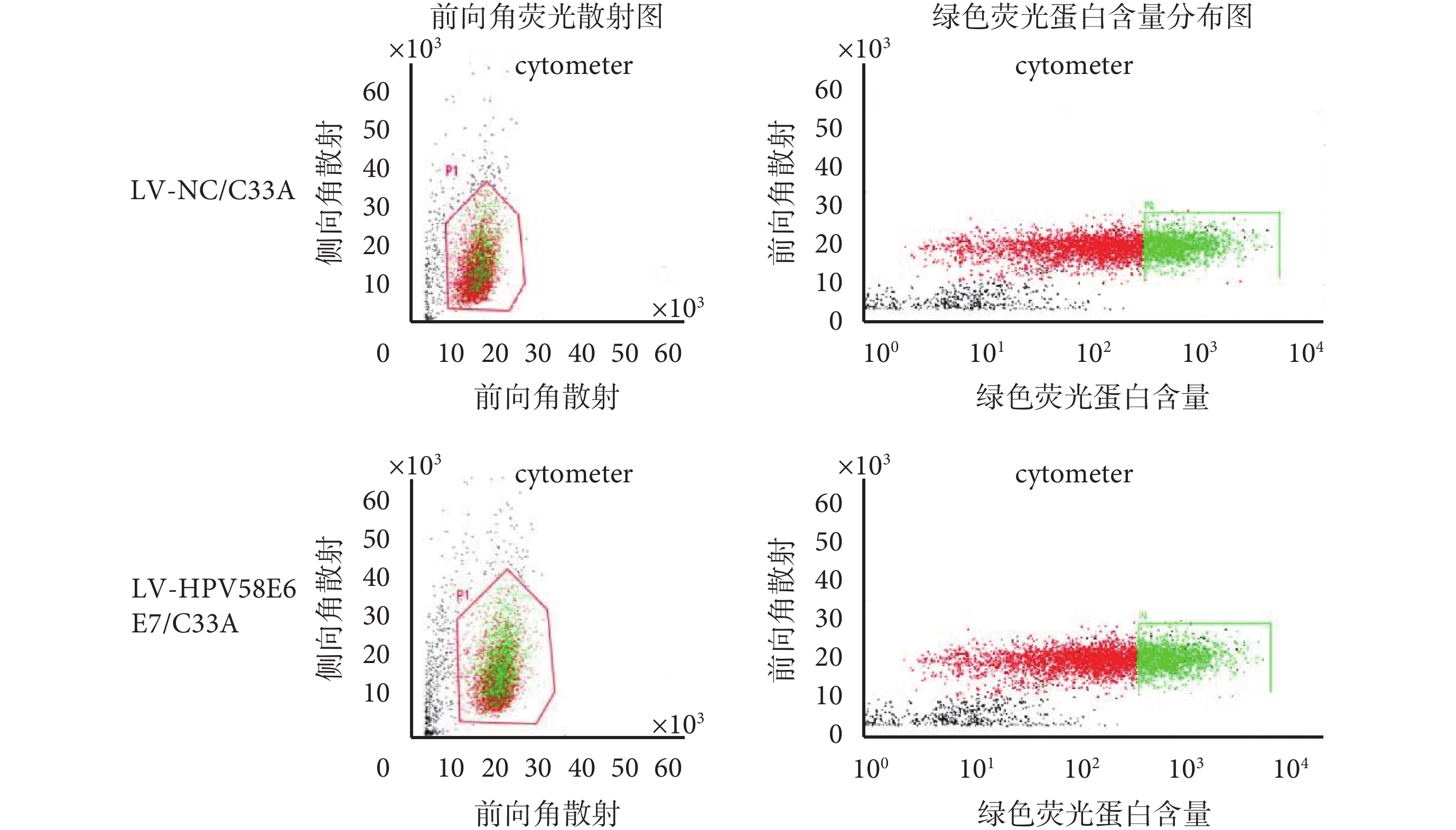
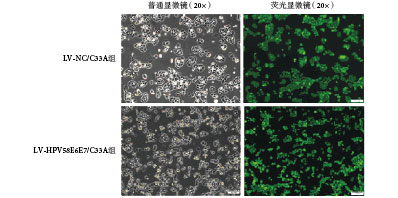
將病毒感染后的細胞擴大培養,并用流式細胞儀進行分選,如圖 1 所示,右側綠色區域為分選出的帶強綠熒光的 C33A 細胞,分別命名為 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組。經流式細胞儀分選出強綠色熒光信號的細胞,形態上與正常未經處理的 C33A 細胞沒有明顯差異:分選出的細胞均發出綠色熒光,熒光均勻分布于整個胞漿(如圖 2 所示),擴大培養 20 代后細胞內熒光蛋白仍能穩定表達,表明 LV-HPV58E6E7 和 LV-CON 病毒能穩定且持久地整合在人宮頸癌 C33A 細胞基因組中。
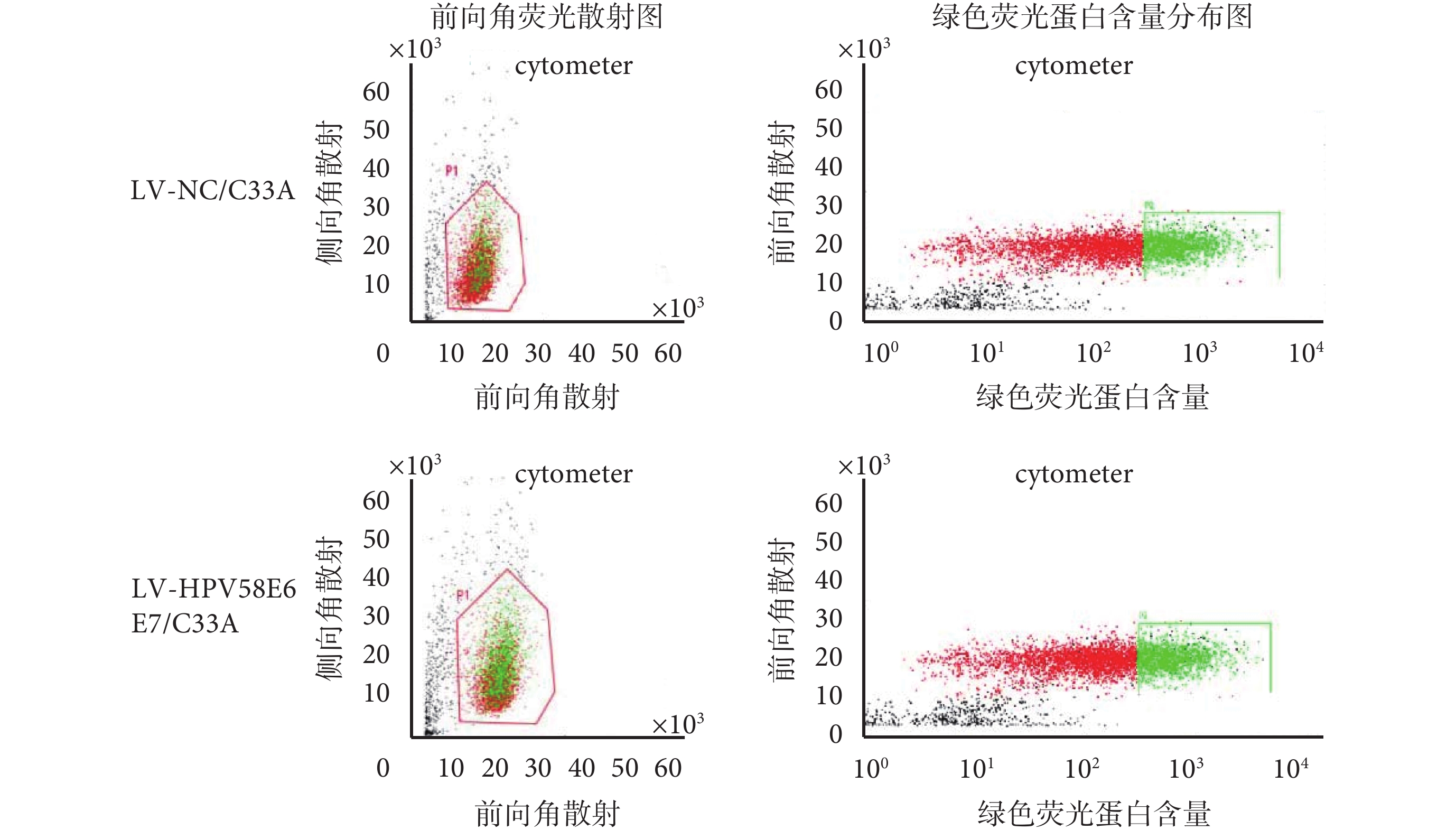 圖1
流式細胞術分選綠色熒光細胞效率圖
Figure1.
Efficiency of green fluorescent protein-based cell sorting by flow cytometry
圖1
流式細胞術分選綠色熒光細胞效率圖
Figure1.
Efficiency of green fluorescent protein-based cell sorting by flow cytometry
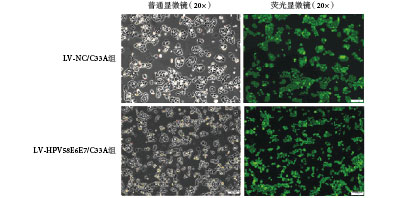 圖2
分選后培養第 20 代細胞顯微鏡下形態圖
Figure2.
Cell morphology of the 20th generation of cells after sorting observed by microscope
圖2
分選后培養第 20 代細胞顯微鏡下形態圖
Figure2.
Cell morphology of the 20th generation of cells after sorting observed by microscope
2.2 MTT 法測定三組細胞生長曲線
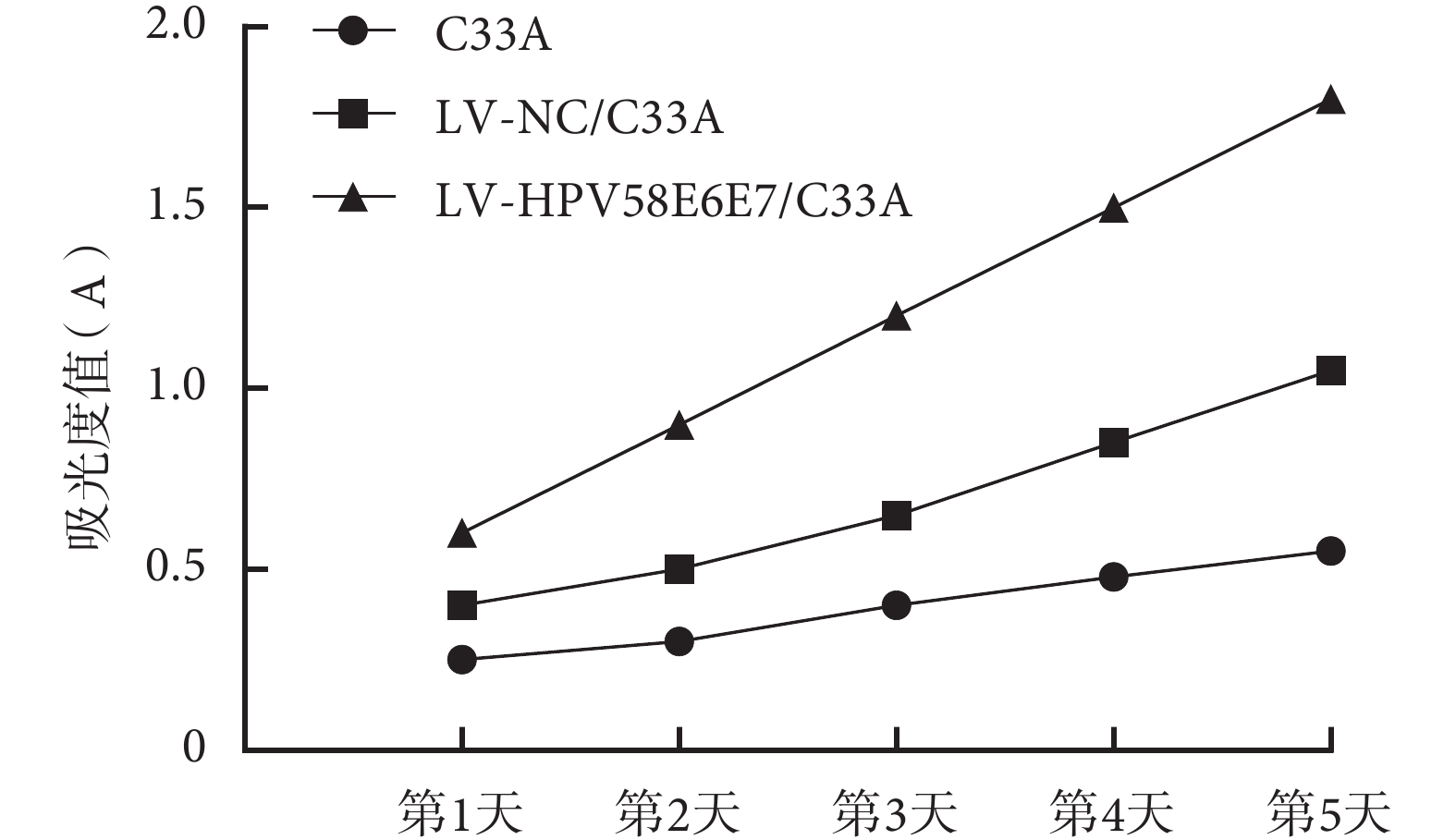
每組細胞每天任選 5 個孔測其吸光度值(A490)的平均值,共檢測 5 d,以吸光度值為縱坐標,培養間隔時間為橫坐標,繪制生長曲線,計算對數期生長細胞的倍增時間(如圖 3 所示)。LV-HPV58E6E7/C33A 組、LV-NC/C33A 組及 C33A 組細胞的倍增時間分別為 48、72、96 h,結果表明:轉染了 HPV58 E6E7 融合基因的宮頸癌 C33A 細胞倍增時間明顯短于 LV-NC/C33A 組(P<0.05)及 C33A 組細胞(P<0.05),細胞增殖加快。
 圖3
MTT 法檢測三組細胞生長曲線圖
Figure3.
Cell growth curves in the three groups detected by MTT
圖3
MTT 法檢測三組細胞生長曲線圖
Figure3.
Cell growth curves in the three groups detected by MTT
2.3 流式細胞術檢測各組細胞周期的變化
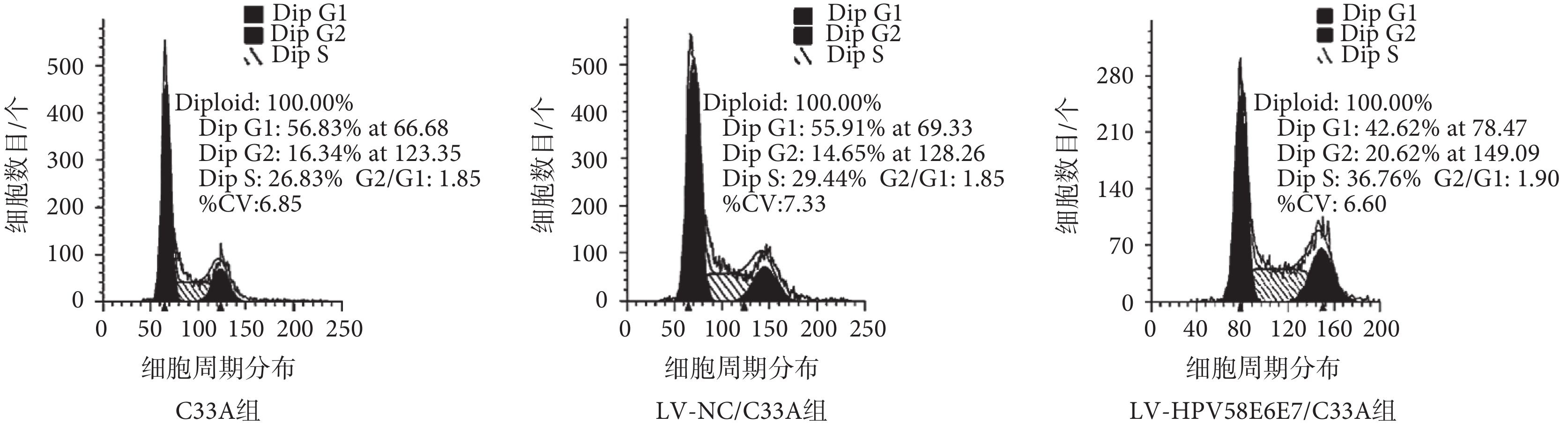
將三組細胞按前述方案處理后上流式細胞儀檢測,如圖 4 結果顯示:LV-NC/C33A 組及 C33A 組細胞周期的各期分布無明顯差異(P>0.05);而轉染了 HPV58 型 E6E7 融合基因的 LV-HPV58E6E7/C33A 組細胞,如表 1 所示,其 DNA 合成前期 G1 期的細胞百分率均低于 LV-NC/C33A 組(P<0.05)及 C33A 組細胞(P<0.05),處于 DNA 合成后期 G2 期及 S 期細胞的百分率均高于 LV-NC/C33A 組(P<0.05)及 C33A 組細胞(P<0.05),提示 HPV58 型 E6E7 融合基因可能通過某種途徑參與了細胞周期的調控,促進細胞分裂,從而促進 C33A 細胞的增殖。
 圖4
流式細胞術檢測三組細胞周期
Figure4.
Cell cycle in the three groups detected by flow cytometry
圖4
流式細胞術檢測三組細胞周期
Figure4.
Cell cycle in the three groups detected by flow cytometry
2.4 成功建立裸鼠皮下成瘤模型
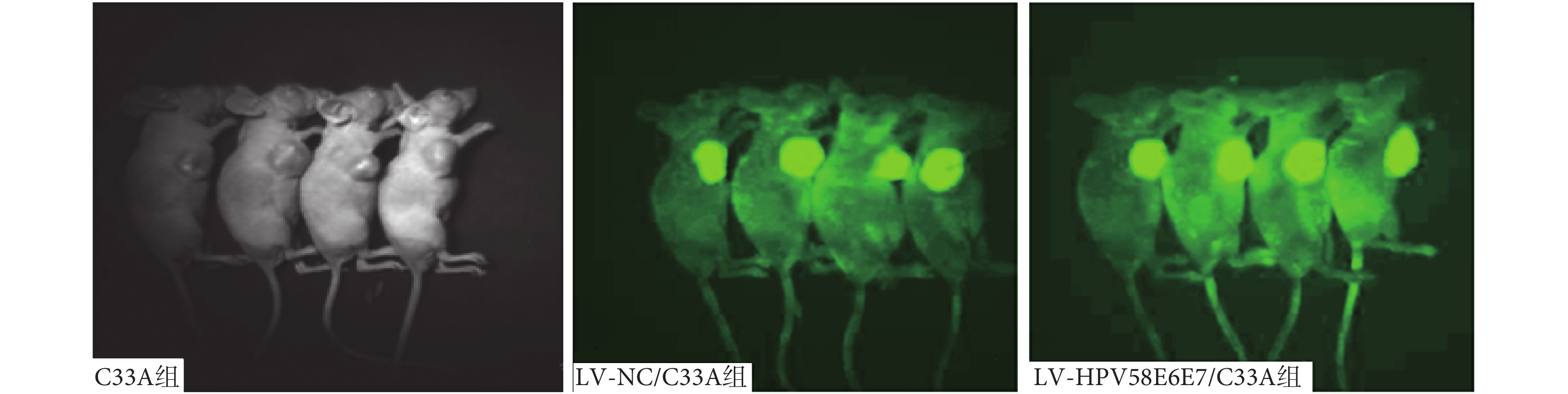
12 只 BALA/C 裸鼠在左腋下皮下接種各組細胞懸液(1×106 個細胞/只),3 周后可見所有裸鼠皮下瘤長徑超過 1 cm。經活體成像儀成像顯示:LV-NC/C33A 組、LV-HPV58E6E7/C33A 組活體裸鼠的皮下移植瘤中有綠色熒光表達,表明裸鼠體內瘤組織可持續、穩定表達綠色熒光蛋白(green fluore-scent protein,GFP),如圖 5 所示。
 圖5
三組細胞構建裸鼠皮下成瘤模型
Figure5.
Subcutaneous tumor models of nude mice inoculated with C33A, LV-NC/C33A, and LV-HPV58E6E7/C33A cells
圖5
三組細胞構建裸鼠皮下成瘤模型
Figure5.
Subcutaneous tumor models of nude mice inoculated with C33A, LV-NC/C33A, and LV-HPV58E6E7/C33A cells
2.5 qRT-PCR 檢測三組瘤組織中 HPV58 型 E6E7 融合基因的負載量
提取三組瘤組織總 RNA,逆轉錄成 cDNA 后,以 HPV58 型 E6E7 融合基因上下游引物、管家基因 GAPDH 上下游引物特異性擴增各組細胞中 HPV58E6E7 融合基因及 GAPDH 基因。qRT-PCR 檢測結果顯示:LV-NC/C33A 組及 C33A 組裸鼠瘤組織的病毒負載量均為 0;LV-HPV58E6E7/C33A 組裸鼠瘤組織病毒負載量均值為 0.65,證明帶有 HPV58 型 E6E7 融合基因的 C33A 細胞能夠在裸鼠體內穩定轉錄 HPV58E6E7 融合基因。
2.6 Western blot 驗證三組瘤組織中 HIS 標簽蛋白的負載量
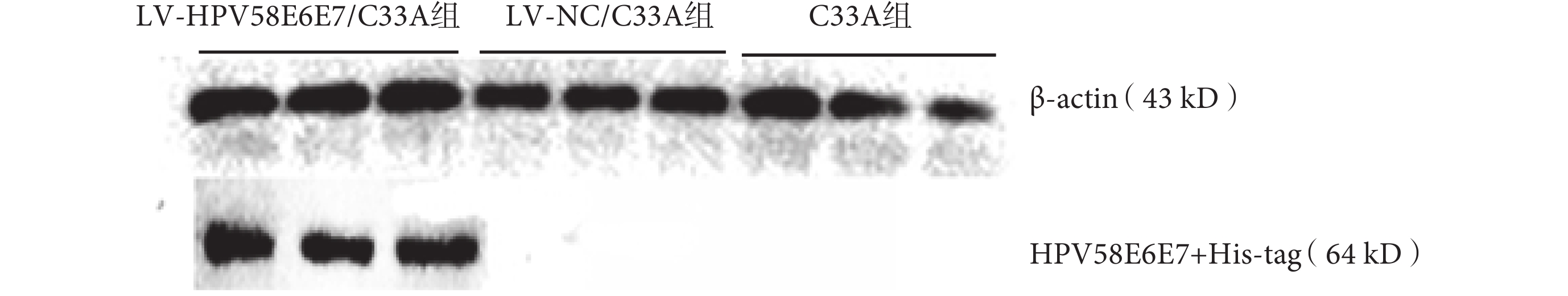
提取三組瘤組織總蛋白,用鼠抗 His-tag 抗體及內參抗體鼠抗 β-actin 抗體作為一抗進行 Western blot 檢測。結果如圖 6 所示,在 LV-HPV58E6E7/C33A 組瘤組織的總蛋白中,在分子量約 64 kD 處的蛋白能與兔抗 His-tag 抗體特異性反應,免疫條帶位置與 HPV58E6E7+His-tag 的融合蛋白(約為 64 kD,其中 HPV58E6E7 融合蛋白為 27 kD,His-tag 蛋白為 37 kD)理論分子量相符,而在對照組 LV-NC/C33A 及 C33A 組瘤組織的總蛋白中,未見上述條帶。由此證明:LV-HPV58E6E7/C33A 組能夠表達包含示蹤標簽的 HPV58E6E7+His-tag 融合蛋白,證明帶有 HPV58 型 E6E7 融合基因的 C33A 細胞能夠在裸鼠體內穩定翻譯 HPV58E6E7+His-tag 融合蛋白。
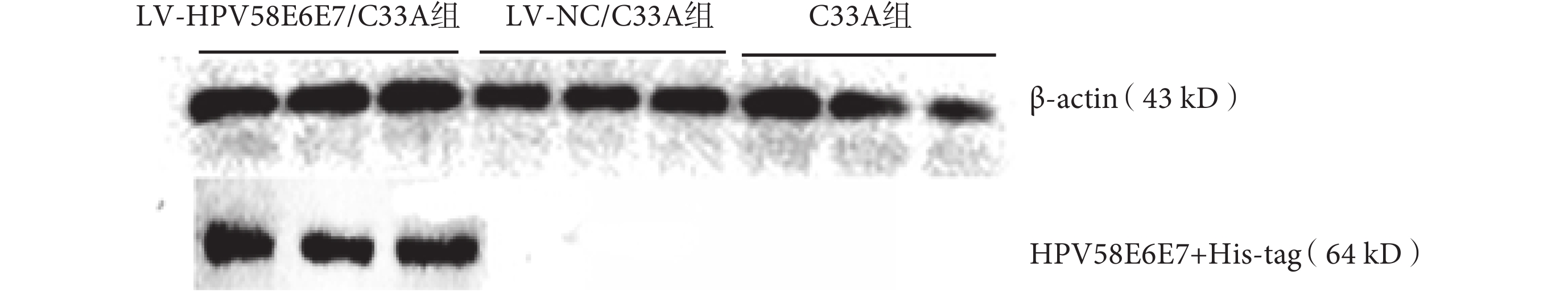 圖6
三組瘤組織中 His-tag 標簽蛋白表達的 Western blot 鑒定
Figure6.
Detection of the expression of His-tag protein in tumor tissues in the three groups by Western blot
圖6
三組瘤組織中 His-tag 標簽蛋白表達的 Western blot 鑒定
Figure6.
Detection of the expression of His-tag protein in tumor tissues in the three groups by Western blot
3 討論
雖然 HPV58 型是我國特別高發的高危型 HPV,特別是廣西等南方地區,但由于全球 HPV58 型感染地理分布的差異極大,國內外對于 HPV58 型的研究不多。目前市場上仍無能穩定表達 HPV58 E6 或 E7 基因的人宮頸癌細胞系,難以評價 HPV58 型疫苗的免疫效果。課題組前期已成功構建了表達 HPV58E6E7 融合基因的慢病毒系統并通過 qRT-PCR 及 Western blot 檢測實現其真核表達[1],本研究試圖構建能穩定表達 HPV58 型 E6E7 融合基因的人宮頸癌細胞株,為后續 HPV58 型宮頸癌疫苗的研究提供靶抗原細胞。
C33A 細胞系是 HPV 檢出陰性的人宮頸癌細胞株[6],其能夠表達我國最為常見的限制型主要組織相容性復合體(major histocompatibility complex,MHC)Ⅰ類分子[7]。我們將前期構建的表達 HPV58 型 E6E7 融合基因的慢病毒 LV-HPV58E6E7 及空載病毒 LV-CON 轉染到 C33A 細胞,熒光顯微鏡下 LV-HPV58E6E7/C33A 融合基因組及 LV-NC/C33A 組均能觀察到 GFP 的表達。通過流式細胞儀將轉染有目的基因及空載基因的強綠色熒光細胞分選出來并擴大培養,擴大培養 20 代后 GFP 仍能穩定表達,表明 LV-HPV58E6E7 融合基因和 LV-CON 病毒載體穩定且持久地整合在人宮頸癌 C33A 細胞基因組中。
體外實驗表明,細胞周期與細胞的增殖關系密切。而細胞周期的長短則取決于 G0/G1 期,G0/G1 期阻滯可使細胞增殖周期延長,增殖速度減慢[8-9]。通過流式細胞儀檢測分選好的 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組、C33A 組細胞的周期變化,細胞生長曲線實驗結果顯示:LV-HPV58E6E7/C33A 組倍增時間明顯快于 LV-NC/C33A 組(P<0.05)和C33A 組細胞(P<0.05);流式細胞儀檢測細胞周期顯示轉染 HPV58E6E7 融合基因組后,LV-HPV58E6E7/C33A 細胞處于 G1 期的細胞比例為 42.16%±1.63%,處于 S 期的細胞比例為 34.51%±2.01%,處于 G2 期的細胞比例為 23.33%±1.63%,G2 期和 S 期數據均高于 LV-NC/C33A 組(P<0.05)和 C33A 組細胞(P<0.05)。結果顯示 HPV58 型 E6E7 融合基因能夠促進細胞的增殖,同時能使 G1 期細胞減少以及 G2 期及 S 期細胞增加,表明 E6、E7 具有轉化活性,能夠促進腫瘤的發生、發展,可作為 HPV58 型疫苗研究的靶抗原。
為了建立能夠穩定表達 HPV58E6E7 融合基因的動物模型,我們選擇目前常用的、穩定的腫瘤實驗動物 BALB/C 裸鼠,它的 8 號染色體上隱性基因突變,無胸腺,且其先天性 T 細胞免疫缺損,缺乏免疫應答性及無免疫排斥反應,另外,它能夠短時間內成瘤,腫瘤能夠良好地生長、持續增殖和長期傳代,且腫瘤的形態與功能可與原人腫瘤保持一致性,是近年來研究惡性腫瘤基礎資料的良好模型[10]。慢病毒載體自身攜帶有抗生素抗性基因及 GFP 基因,課題組構建的 LV-HPV58E6E7/C33A 融合基因經流式分選后細胞均能表達綠色熒光并能夠反復傳代,在子代中穩定表達,因此可借助活體成像儀檢測裸鼠皮下移植瘤中的基因表達及細胞活動情況。將 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組、C33A 組細胞接種到裸鼠皮下,通過活體成像儀、qRT-PCR 和 Western blot 可檢測各組瘤組織中 HPV58E6E7+His-tag 標簽蛋白的表達情況。實驗結果表明,LV-HPV58E6E7/C33A 組、LV-NC/C33A 組、C33A 組的成瘤率均為 100%,并且瘤體體積隨時間的增加而逐漸增大。21 天后,所有裸鼠左腋窩區皮下結節大小約 1 cm,經活體成像儀成像,LV-HPV58E6E7/C33A 組、LV-NC/C33A 組裸鼠瘤組織可見熒光蛋白表達,而 C33A 組裸鼠則未見熒光蛋白。表明慢病毒自帶 GFP 可在裸鼠體內穩定表達。采用 qRT-PCR 及 Western blot 檢測各組瘤組織中 HPV58E6E7 基因及 HPV58E6E7+His-tag 標簽蛋白的表達,結果顯示 LV-NC/C33A、C33A 組裸鼠移植瘤組織均未檢測到 HPV58E6E7 基因及 HPV58E6E7+His-tag 標簽蛋白的表達,而 LV-HPV58E6E7/C33A 組裸鼠移植瘤組織中有 HPV58E6E7 基因及 HPV58E6E7+His-tag 標簽蛋白的表達,且根據 qRT-PCR 數值比較發現其在裸鼠移植瘤中高度表達,表明該新建細胞模型已經穩定整合了 HPV58E6E7 融合基因,可在轉錄水平及蛋白水平上穩定表達。
總之,通過以上方法,我們成功建立了能內源性表達 HPV58 型 E6E7 融合基因的人宮頸癌 C33A 模型細胞,為 HPV58 型相關疫苗的免疫效果檢測奠定了基礎。
引言
人乳頭瘤病毒(human papillomavirus,HPV)已被證實是子宮頸癌及癌前病變發生的首要因素且為始動因素。既往研究證明,HPV E6 和 E7 蛋白從病毒開始感染到癌癥的進展期,在腫瘤發展的所有階段均有表達,同時,作為維持其惡性表型所必需持續存在的病毒抗原[1],E6 和 E7 蛋白能誘發機體產生并維持較強的以病毒抗原為靶分子的特異性細胞毒性 T 細胞(cytotoxic T cell,Tc 或 CTL)反應。因此,HPV E6 和 E7 蛋白成為宮頸癌治療性疫苗研究和開發的主要特異靶抗原[2]。
流行病學研究證明,HPV16 和 18 型的感染在世界范圍內很普遍,沒有明顯的地區差異,而 HPV58 型的感染分布則具有明顯的區域性,僅在東亞和南亞各國有很高的感染率,尤其是我國南方的一些地區,如廣西、香港等區域,已超過 18 型而位居第二[3]。由于 HPV 世界流行病學的分布,目前國內外 HPV 治療性疫苗的研制主要集中在 HPV16 型、HPV18 型,缺少對 HPV58 型治療性疫苗的研究[4],市面上更不存在 HPV58 型陽性的人宮頸癌細胞系,因此無法構建相關的動物模型,而穩定表達 HPV58 型 E6E7 融合基因的細胞系是后期 HPV58 型治療性疫苗開發及評價其免疫效果研究所必須的。本研究在前期成功構建的表達 HPV58 型 E6E7 融合基因的慢病毒載體的基礎上[5],通過構建穩定表達 HPV58 型 E6E7 融合基因的人宮頸癌細胞系,并建立荷瘤小鼠模型,為 HPV58 型陽性相關腫瘤及其癌前病變免疫相關疫苗的研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 質粒、引物、菌株、細胞、動物 HPV58E6E7 融合基因上下游引物、GAPDH 上下游引物、重組慢病毒 LV-HPV58E6E7 和空載體病毒 LV-CON 均由本實驗室構建并保存;HPV(–)的 C33A 細胞株購自中國科學院;雌性 BALA/C 裸鼠,4~6 周,16~18 g,購自廣西醫科大學動物實驗中心并飼養于廣西醫科大學動物實驗中心 SPF 級層流室內。
1.1.2 主要試劑、酶及抗體 培養基 RPMI-1640、胎牛血清、胰酶購自美國 Corning 公司;青鏈霉素雙抗、RIPA(radio immunoprecipitation assay)裂解液、二哇琳甲酸(Bicinchoninicacid,BCA)蛋白定量提取試劑盒、MTT 購自碧云天公司;總 RNA 逆轉錄試劑盒購自美國 Thermo 公司;SYBR? Premix Ex Taq II 購自寶生生物公司;鼠抗 β-actin 抗體、鼠抗人 His 標簽單克隆抗體、HRP 標記的羊抗小鼠 IgG 購自北京博奧森生物技術有限公司;細胞周期測試盒購于凱基生物公司;ECL 化學發光試劑盒購自索萊寶公司。
1.2 方法
1.2.1 重組慢病毒 LV-HPV58E6E7 感染 C33A 細胞將 HPV(–)的人宮頸癌細胞株 C33A 細胞置于含有 10% 胎牛血清、100 U/mL 的青霉素、100 μg/mL 鏈霉素的 RPMI-1640 完全培養液中,于 37℃、5% CO2 的恒溫培養箱中培養。將對數生長期的 C33A 細胞接種到 6 孔板中,分三組:C33A 組:C33A 細胞,無處理,為空白對照組;LV-NC/C33A 組:轉染空載體的病毒顆粒的 C33A 細胞,為陰性對照組;LV-HPV58E6E7/C33A 組:轉染帶 HPV58E6E7 融合基因的病毒顆粒的 C33A 細胞,為實驗組。24 h 后待其匯合度達到 20%~30% 時,將包含 HPV58 型 E6E7 融合基因的病毒顆粒 LV-HPV58E6E7 及空載體病毒顆粒 LV-CON 分別轉染 C33A 細胞,轉染后將細胞置于 37℃、5% CO2 培養箱中培養。由于該慢病毒系統帶有綠色熒光,因此 48~72 h 后可直接在倒置熒光顯微鏡下觀察兩組細胞的轉染情況。
1.2.2 流式細胞儀分選細胞及轉染效率的檢測 收集對數生長期的上述三組細胞,用含有 2% 血清的 PBS 重懸細胞,配成濃度為 1×107 個/mL 的細胞懸液;300 目篩網過濾重懸的細胞,移入流式專用管上流式機分選。將分選后的細胞進行擴大培養,傳代至第 20 代時再次用流式細胞儀檢測熒光表達率。
1.2.3 重組慢病毒 LV-HPV58E6E7 對 C33A 細胞生長及其周期的影響 (1)MTT 法檢測三組細胞生長曲線的測定:分別收集細胞匯合度達 80%~90% 的 LV-HPV58E6E7/C33A、LV-NC/C33A 及 C33A 組細胞,制成單細胞懸液,按每孔 5×103 個細胞接種于 96 孔板,每孔總體積均為 200 μL,于 5% CO2、37℃ 培養。細胞培養 24、48、72、96、120 h,每種細胞任選 5 個孔進行實驗:每孔加入 MTT 溶液 20 μL(5 mg/mL),37℃ 孵育 4 h 后棄去上清加入 DMSO(二甲基亞砜)150 μL,充分混勻使甲臜充分溶解;用酶標儀測定各孔的 A490 吸光度值,記錄結果。以時間為橫軸,取 5 個相同生長天數及攜帶相同載體的光吸收值均值作為該類細胞的某天吸光值,并作為縱軸繪制細胞生長曲線。計算各組細胞的倍增時間:倍增時間=兩倍原始細胞計數點(與吸光度相關)對應時間—初始細胞計數點對應時間。
(2)流式細胞儀檢測三組細胞生長周期變化:分別收集細胞匯合度達 80%~90% 的 LV-HPV58-E6E7/C33A、LV-NC/C33A 及 C33A 組細胞,制成細胞密度為 1×106 個/mL 的細胞懸液,將 1 mL 細胞懸液緩慢加入至預冷的 4 mL 無水乙醇中,輕柔吹打后混勻后放于 4℃ 過夜。第二天將細胞混合液 2 000 r/min 離心 5 min 去除上清,用 PBS 洗滌細胞 2 次后加入 RNAse 100 μL 重懸細胞,于 37℃ 水浴 30 min。每管加入 400 μL 新配的碘化丙啶(propidium iodide,PI)液,于 4℃ 避光孵育 30 min 后篩網過濾,上流式細胞儀檢測細胞周期。
1.2.4 穩定表達 HPV58E6E7 融合基因的荷瘤裸鼠模型的建立及鑒定 (1)建立裸鼠皮下成瘤模型:將 4~6 周、體重為 16~18 g 的 12 只雌性 BALB/C 裸鼠隨機分成三組,每組 4 只。接種 C33A 細胞者為空白對照組,接種 LV-NC/C33A 細胞者為陰性對照組,接種 LV-HPV58E6E7/C33A 細胞者為實驗組。分別取對數生長期的 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組及 C33A 組細胞,制備單細胞懸液,調整細胞濃度為 1×107 個細胞/mL,于小鼠左腋下皮下接種 0.1 mL 細胞懸液,即 1×106 個細胞/只。
(2)觀察裸鼠皮下成瘤情況:接種細胞后,定期觀察裸鼠皮下成瘤情況并記錄。待腫瘤生長一定天數時,腹腔注射 0.1 mL 3.5% 水合氯醛溶液麻醉裸鼠,將裸鼠固定后置于暗箱平臺,利用動物活體成像系統拍攝裸鼠皮下腫瘤及熒光表達情況。
(3)檢測裸鼠皮下腫瘤組織中 HPV58 型 E6E7 融合基因表達情況。
A. qRT-PCR 檢測三組裸鼠皮下瘤組織中 HPV58E6E7 融合基因負載量:種瘤三周后,處死小鼠,手術分離出瘤組織,用 Trizol 法提取每組裸鼠皮下瘤組織的總 RNA,逆轉錄合成 cDNA,以各組細胞 cDNA 為模板,運用 HPV58 E6E7 融合基因、GAPDH 上下游引物進行熒光定量 PCR(real-time fluorescence quantitative PCR,qRT-PCR),檢測各瘤組織中 HPV58E6E7 融合基因的含量。反應體系 20.0 μL:SYBR Premix Ex Taq II 10.0 μL;PCR Forward Primer(10 μmol/L)0.75 μL;PCR Forward Primer(10 μmol/L)0.75 μL;模板 1.0 μL;ddH2O 7.5 μL。反應條件:94℃ 預變性 5 min;94℃ 變性 30 s、56℃ 退火 30 s、72℃ 延伸 30 s,共 30 個循環;72℃ 延伸 10 min。產物 4℃ 保存。
由 MX-3000P PCR 儀程序軟件,直接得出兩個標準品中三個樣本 DNA 中 HPV58E6E7、GAPDH 的 Ct 值、擴增效率,然后根據倍比稀釋的標準品的 Ct 值繪制出標準曲線,最后根據樣本 DNA 的 Ct 值及標準曲線,計算出相對應的基因拷貝數。
B. Western blot 檢測三組裸鼠皮下瘤組織中 HPV58E6E7+HIS 標簽蛋白的表達:用 RIPA 法提取三組裸鼠皮下瘤組織總蛋白,并用 BCA 法測定三組蛋白濃度。將各組蛋白調整至同一濃度后,進行 SDS-PAGE 電泳(80 V 電壓跑濃縮膠,整個過程 30~40 min,后轉至 120 V 跑分離膠,總時間約 2 h),電轉移至 PVDF 膜上(100 mA 轉膜 1.5 h),5% 脫脂蛋白 TBST 封閉液室溫振蕩 2 h,與 1∶1 000 稀釋的 6×鼠抗 His 抗體、1∶1 000 稀釋的鼠抗β-actin 抗體,4℃ 孵育過夜;TBST 洗膜 3 次,然后與 1∶2 000 稀釋的 HRP 標記的山羊抗小鼠 IgG 室溫孵育 2 h,TBST 洗膜 3 次,ECL 顯色檢測目的蛋白。
1.2.5 統計學分析 實驗數據采用 SPSS16.0 統計軟件進行分析,計量數據以均數±標準差表示,不同處理組組間比較采用方差分析或 t 檢驗,組間多重比較采用 SNK 檢驗方法進行分析,P<0.05 為差異有統計學意義。
2 結果
2.1 流式細胞儀分選出的細胞及轉染效率的檢測
將病毒感染后的細胞擴大培養,并用流式細胞儀進行分選,如圖 1 所示,右側綠色區域為分選出的帶強綠熒光的 C33A 細胞,分別命名為 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組。經流式細胞儀分選出強綠色熒光信號的細胞,形態上與正常未經處理的 C33A 細胞沒有明顯差異:分選出的細胞均發出綠色熒光,熒光均勻分布于整個胞漿(如圖 2 所示),擴大培養 20 代后細胞內熒光蛋白仍能穩定表達,表明 LV-HPV58E6E7 和 LV-CON 病毒能穩定且持久地整合在人宮頸癌 C33A 細胞基因組中。
 圖1
流式細胞術分選綠色熒光細胞效率圖
Figure1.
Efficiency of green fluorescent protein-based cell sorting by flow cytometry
圖1
流式細胞術分選綠色熒光細胞效率圖
Figure1.
Efficiency of green fluorescent protein-based cell sorting by flow cytometry
 圖2
分選后培養第 20 代細胞顯微鏡下形態圖
Figure2.
Cell morphology of the 20th generation of cells after sorting observed by microscope
圖2
分選后培養第 20 代細胞顯微鏡下形態圖
Figure2.
Cell morphology of the 20th generation of cells after sorting observed by microscope
2.2 MTT 法測定三組細胞生長曲線
每組細胞每天任選 5 個孔測其吸光度值(A490)的平均值,共檢測 5 d,以吸光度值為縱坐標,培養間隔時間為橫坐標,繪制生長曲線,計算對數期生長細胞的倍增時間(如圖 3 所示)。LV-HPV58E6E7/C33A 組、LV-NC/C33A 組及 C33A 組細胞的倍增時間分別為 48、72、96 h,結果表明:轉染了 HPV58 E6E7 融合基因的宮頸癌 C33A 細胞倍增時間明顯短于 LV-NC/C33A 組(P<0.05)及 C33A 組細胞(P<0.05),細胞增殖加快。
 圖3
MTT 法檢測三組細胞生長曲線圖
Figure3.
Cell growth curves in the three groups detected by MTT
圖3
MTT 法檢測三組細胞生長曲線圖
Figure3.
Cell growth curves in the three groups detected by MTT
2.3 流式細胞術檢測各組細胞周期的變化
將三組細胞按前述方案處理后上流式細胞儀檢測,如圖 4 結果顯示:LV-NC/C33A 組及 C33A 組細胞周期的各期分布無明顯差異(P>0.05);而轉染了 HPV58 型 E6E7 融合基因的 LV-HPV58E6E7/C33A 組細胞,如表 1 所示,其 DNA 合成前期 G1 期的細胞百分率均低于 LV-NC/C33A 組(P<0.05)及 C33A 組細胞(P<0.05),處于 DNA 合成后期 G2 期及 S 期細胞的百分率均高于 LV-NC/C33A 組(P<0.05)及 C33A 組細胞(P<0.05),提示 HPV58 型 E6E7 融合基因可能通過某種途徑參與了細胞周期的調控,促進細胞分裂,從而促進 C33A 細胞的增殖。
 圖4
流式細胞術檢測三組細胞周期
Figure4.
Cell cycle in the three groups detected by flow cytometry
圖4
流式細胞術檢測三組細胞周期
Figure4.
Cell cycle in the three groups detected by flow cytometry
2.4 成功建立裸鼠皮下成瘤模型
12 只 BALA/C 裸鼠在左腋下皮下接種各組細胞懸液(1×106 個細胞/只),3 周后可見所有裸鼠皮下瘤長徑超過 1 cm。經活體成像儀成像顯示:LV-NC/C33A 組、LV-HPV58E6E7/C33A 組活體裸鼠的皮下移植瘤中有綠色熒光表達,表明裸鼠體內瘤組織可持續、穩定表達綠色熒光蛋白(green fluore-scent protein,GFP),如圖 5 所示。
 圖5
三組細胞構建裸鼠皮下成瘤模型
Figure5.
Subcutaneous tumor models of nude mice inoculated with C33A, LV-NC/C33A, and LV-HPV58E6E7/C33A cells
圖5
三組細胞構建裸鼠皮下成瘤模型
Figure5.
Subcutaneous tumor models of nude mice inoculated with C33A, LV-NC/C33A, and LV-HPV58E6E7/C33A cells
2.5 qRT-PCR 檢測三組瘤組織中 HPV58 型 E6E7 融合基因的負載量
提取三組瘤組織總 RNA,逆轉錄成 cDNA 后,以 HPV58 型 E6E7 融合基因上下游引物、管家基因 GAPDH 上下游引物特異性擴增各組細胞中 HPV58E6E7 融合基因及 GAPDH 基因。qRT-PCR 檢測結果顯示:LV-NC/C33A 組及 C33A 組裸鼠瘤組織的病毒負載量均為 0;LV-HPV58E6E7/C33A 組裸鼠瘤組織病毒負載量均值為 0.65,證明帶有 HPV58 型 E6E7 融合基因的 C33A 細胞能夠在裸鼠體內穩定轉錄 HPV58E6E7 融合基因。
2.6 Western blot 驗證三組瘤組織中 HIS 標簽蛋白的負載量
提取三組瘤組織總蛋白,用鼠抗 His-tag 抗體及內參抗體鼠抗 β-actin 抗體作為一抗進行 Western blot 檢測。結果如圖 6 所示,在 LV-HPV58E6E7/C33A 組瘤組織的總蛋白中,在分子量約 64 kD 處的蛋白能與兔抗 His-tag 抗體特異性反應,免疫條帶位置與 HPV58E6E7+His-tag 的融合蛋白(約為 64 kD,其中 HPV58E6E7 融合蛋白為 27 kD,His-tag 蛋白為 37 kD)理論分子量相符,而在對照組 LV-NC/C33A 及 C33A 組瘤組織的總蛋白中,未見上述條帶。由此證明:LV-HPV58E6E7/C33A 組能夠表達包含示蹤標簽的 HPV58E6E7+His-tag 融合蛋白,證明帶有 HPV58 型 E6E7 融合基因的 C33A 細胞能夠在裸鼠體內穩定翻譯 HPV58E6E7+His-tag 融合蛋白。
 圖6
三組瘤組織中 His-tag 標簽蛋白表達的 Western blot 鑒定
Figure6.
Detection of the expression of His-tag protein in tumor tissues in the three groups by Western blot
圖6
三組瘤組織中 His-tag 標簽蛋白表達的 Western blot 鑒定
Figure6.
Detection of the expression of His-tag protein in tumor tissues in the three groups by Western blot
3 討論
雖然 HPV58 型是我國特別高發的高危型 HPV,特別是廣西等南方地區,但由于全球 HPV58 型感染地理分布的差異極大,國內外對于 HPV58 型的研究不多。目前市場上仍無能穩定表達 HPV58 E6 或 E7 基因的人宮頸癌細胞系,難以評價 HPV58 型疫苗的免疫效果。課題組前期已成功構建了表達 HPV58E6E7 融合基因的慢病毒系統并通過 qRT-PCR 及 Western blot 檢測實現其真核表達[1],本研究試圖構建能穩定表達 HPV58 型 E6E7 融合基因的人宮頸癌細胞株,為后續 HPV58 型宮頸癌疫苗的研究提供靶抗原細胞。
C33A 細胞系是 HPV 檢出陰性的人宮頸癌細胞株[6],其能夠表達我國最為常見的限制型主要組織相容性復合體(major histocompatibility complex,MHC)Ⅰ類分子[7]。我們將前期構建的表達 HPV58 型 E6E7 融合基因的慢病毒 LV-HPV58E6E7 及空載病毒 LV-CON 轉染到 C33A 細胞,熒光顯微鏡下 LV-HPV58E6E7/C33A 融合基因組及 LV-NC/C33A 組均能觀察到 GFP 的表達。通過流式細胞儀將轉染有目的基因及空載基因的強綠色熒光細胞分選出來并擴大培養,擴大培養 20 代后 GFP 仍能穩定表達,表明 LV-HPV58E6E7 融合基因和 LV-CON 病毒載體穩定且持久地整合在人宮頸癌 C33A 細胞基因組中。
體外實驗表明,細胞周期與細胞的增殖關系密切。而細胞周期的長短則取決于 G0/G1 期,G0/G1 期阻滯可使細胞增殖周期延長,增殖速度減慢[8-9]。通過流式細胞儀檢測分選好的 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組、C33A 組細胞的周期變化,細胞生長曲線實驗結果顯示:LV-HPV58E6E7/C33A 組倍增時間明顯快于 LV-NC/C33A 組(P<0.05)和C33A 組細胞(P<0.05);流式細胞儀檢測細胞周期顯示轉染 HPV58E6E7 融合基因組后,LV-HPV58E6E7/C33A 細胞處于 G1 期的細胞比例為 42.16%±1.63%,處于 S 期的細胞比例為 34.51%±2.01%,處于 G2 期的細胞比例為 23.33%±1.63%,G2 期和 S 期數據均高于 LV-NC/C33A 組(P<0.05)和 C33A 組細胞(P<0.05)。結果顯示 HPV58 型 E6E7 融合基因能夠促進細胞的增殖,同時能使 G1 期細胞減少以及 G2 期及 S 期細胞增加,表明 E6、E7 具有轉化活性,能夠促進腫瘤的發生、發展,可作為 HPV58 型疫苗研究的靶抗原。
為了建立能夠穩定表達 HPV58E6E7 融合基因的動物模型,我們選擇目前常用的、穩定的腫瘤實驗動物 BALB/C 裸鼠,它的 8 號染色體上隱性基因突變,無胸腺,且其先天性 T 細胞免疫缺損,缺乏免疫應答性及無免疫排斥反應,另外,它能夠短時間內成瘤,腫瘤能夠良好地生長、持續增殖和長期傳代,且腫瘤的形態與功能可與原人腫瘤保持一致性,是近年來研究惡性腫瘤基礎資料的良好模型[10]。慢病毒載體自身攜帶有抗生素抗性基因及 GFP 基因,課題組構建的 LV-HPV58E6E7/C33A 融合基因經流式分選后細胞均能表達綠色熒光并能夠反復傳代,在子代中穩定表達,因此可借助活體成像儀檢測裸鼠皮下移植瘤中的基因表達及細胞活動情況。將 LV-HPV58E6E7/C33A 組、LV-NC/C33A 組、C33A 組細胞接種到裸鼠皮下,通過活體成像儀、qRT-PCR 和 Western blot 可檢測各組瘤組織中 HPV58E6E7+His-tag 標簽蛋白的表達情況。實驗結果表明,LV-HPV58E6E7/C33A 組、LV-NC/C33A 組、C33A 組的成瘤率均為 100%,并且瘤體體積隨時間的增加而逐漸增大。21 天后,所有裸鼠左腋窩區皮下結節大小約 1 cm,經活體成像儀成像,LV-HPV58E6E7/C33A 組、LV-NC/C33A 組裸鼠瘤組織可見熒光蛋白表達,而 C33A 組裸鼠則未見熒光蛋白。表明慢病毒自帶 GFP 可在裸鼠體內穩定表達。采用 qRT-PCR 及 Western blot 檢測各組瘤組織中 HPV58E6E7 基因及 HPV58E6E7+His-tag 標簽蛋白的表達,結果顯示 LV-NC/C33A、C33A 組裸鼠移植瘤組織均未檢測到 HPV58E6E7 基因及 HPV58E6E7+His-tag 標簽蛋白的表達,而 LV-HPV58E6E7/C33A 組裸鼠移植瘤組織中有 HPV58E6E7 基因及 HPV58E6E7+His-tag 標簽蛋白的表達,且根據 qRT-PCR 數值比較發現其在裸鼠移植瘤中高度表達,表明該新建細胞模型已經穩定整合了 HPV58E6E7 融合基因,可在轉錄水平及蛋白水平上穩定表達。
總之,通過以上方法,我們成功建立了能內源性表達 HPV58 型 E6E7 融合基因的人宮頸癌 C33A 模型細胞,為 HPV58 型相關疫苗的免疫效果檢測奠定了基礎。