本研究以牛中性粒細胞牛溶菌肽的線性衍生物 Bac2a 為研究對象,以蜂毒素為對照肽,探討 Bac2a 的生物特性及其穩定性。采用圓二色譜法、微量稀釋法、噻唑藍(MTT)法等方法測定了 Bac2a 的二級結構、抑菌活性、溶血活性、細胞毒性及其穩定性。研究結果表明:Bac2a 在水溶液中呈無規則卷曲狀,在疏水環境中則呈 α-螺旋結構;Bac2a 的抑菌作用較強,最小抑菌濃度(MIC)為 2~32 μmol/L;當肽濃度為 64 μmol/L 時,其溶血率較低,僅為 14.81%;細胞毒性小,治療指數為 3.26,細胞選擇性較強;100℃ 處理 1 h 后,Bac2a 依然保持較強的抑菌活性,熱穩定性好。因此,Bac2a 在食品、醫藥和其它領域都具有良好的應用前景,有望成為抗生素替代品。
引用本文: 李盈盈, 韓宛君, 曹宋宋, 侯俊財, 姜瞻梅, 姜成剛, 王海梅, 逄詩玥. 牛溶菌肽線性衍生物 Bac2a 的生物特性及其穩定性研究. 生物醫學工程學雜志, 2017, 34(4): 572-577. doi: 10.7507/1001-5515.201609002 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
近年來,由于抗生素的大量使用導致耐藥菌株不斷出現以及藥物殘留問題日益凸顯,嚴重威脅著人類的健康,尤其是“超級細菌”的出現,給人們的生命安全和經濟帶來巨大損失,因此迫切需要尋找一種新型安全的抗菌藥物。抗菌肽(antimicrobial peptides,AMPs)的出現有可能使這一局面得到改觀[1]。抗菌肽又稱抗微生物肽,廣泛存在于包括原核生物到人類的各個有機體中,是生物體天然免疫防御系統的重要組成部分。抗菌肽的氨基酸殘基數目一般為 12~50 個,C-末端一般富含非極性氨基酸,如丙氨酸、纈氨酸和色氨酸,N-末端常富含陽離子氨基酸,如賴氨酸、精氨酸和組氨酸等[2];抗菌肽一般帶有正電荷,等電點大于 7,相對分子量一般小于 10 kD。抗菌肽作用范圍廣,對細菌、真菌、病毒、腫瘤細胞、原生動物均有很好的抑制或殺滅作用。抗菌肽還具有抗生素無法比擬的優點,不僅對正常細胞無毒性,而且不會使細菌產生抗藥性,這使得抗菌肽具有廣闊的發展空間。
牛溶菌肽是從牛中性粒細胞的大顆粒中提取的,是自然界存在的分子量最小的天然陽離子抗菌肽,其對大腸桿菌和金黃色葡萄球菌均具有較好的抗菌活性,已成為近年來研究較多的抗菌肽之一[3]。牛溶菌肽由 12 個氨基酸組成,包括 4 個精氨酸殘基、2 個半胱氨酸殘基和 6 個疏水殘基,序列為 RLCRIVVIRVCR。2 個半胱氨酸殘基形成的二硫鍵使牛溶菌肽成為一個環狀結構。通過改建,可以使牛溶菌肽線性化,形成各種衍生物[4]。Bac2a 是通過用疏水性氨基酸丙氨酸替代半胱氨酸得到的一種線性衍生物,序列為 RLARIVVIRVAR。這種改變破壞了原肽的環形結構,但是增加了疏水性氨基酸含量[5]。近年來研究表明,Bac2a 具有比牛溶菌肽更高的抗菌活性,但是 Bac2a 對細胞的毒性及其穩定性尚不清楚。蜂毒素是意大利蜜蜂蜂毒素的主要成分之一,占蜂毒干重的 50%,具有較強的抑菌活性,但蜂毒素具有較高溶血性和細胞毒性的副作用限制了其使用,其多用作抗氧化肽的對照肽[6]。本研究以化學合成的 Bac2a 為研究對象,以蜂毒素為對照肽,對 Bac2a 的抑菌性、安全性和穩定性進行了較全面的研究,為 Bac2a 成為抗生素替代品提供理論依據。
1 材料與方法
1.1 材料
抗菌肽 Bac2a 和蜂毒素均由上海吉爾(GL)生化有限公司采用固相化學合成法合成,純度達 95% 以上。用無菌蒸餾水溶解,使濃度為 2.56 mmol/L,—20℃ 下保存備用。實驗所用菌株包括大腸桿菌(Escherichia coli ATCC 25922)、大腸桿菌(Esche-richia coli UB1005)、金黃色葡萄球菌(Staphy-lococcus aureus ATCC 29213)、金黃色葡萄球菌(Staphylococcus aureus ATCC 25923)、表皮葡萄球菌(Staphylococcus epidermidis ATCC 12228)、單增李斯特菌(Listeriamonocytogenes CMCC 54004)、鼠傷寒沙門菌(Salmonella Typhimurium C77-31)、鼠傷寒沙門菌(Salmonella Typhimurium ATCC-14028)、雞白痢沙門菌(Salmonella Typhimurium C79-13)和沙門菌(Salmonella entericasubspenterica CMCC 50071),均為中國農業科學院哈爾濱獸醫研究所保存。實驗所用人腎上皮 293 細胞由中國農業科學院哈爾濱獸醫研究所保存。瓊脂培養基(Mueller-Hinton Agar,MHA)、肉湯培養基(Mueller-Hinton Broth,MHB)購于北京奧博星生物技術有限責任公司,Triton X-100、胃蛋白酶、木瓜蛋白酶、胰蛋白酶、蛋白酶 K 購于 Sigma 公司,噻唑藍(thiazolyl blue,MTT)、磷酸鹽緩沖(pho-sphate buffer saline,PBS)、三氟乙醇(trifluoroe-thanol,TFE)、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、二甲基亞砜(dimethyl sulfoxide,DMSO)等購于 Biosharp 公司。
1.2 設備
HVE-50 高壓蒸汽滅菌鍋(日本),VD-1320 型超凈工作臺(北京東聯哈爾儀器制造有限公司),RS-232C 酶標儀(日本),721 型可見分光光度計(上海元析儀器有限公司),搖床震蕩培養箱 ZHWY-211D(上海智城分析儀器制造有限公司),電熱恒溫水浴鍋 XMTD-4000(北京市永元明醫療儀器廠)。
1.3 方法
1.3.1 抗菌肽的分子特性 在http://web.expasy. org/compute_pi/網站預測 Bac2a 和蜂毒素的理論分子量、凈電荷、等電點;在http://heliquest.ipmc. cnrs.fr/網站預測 Bac2a 和蜂毒素的疏水性和疏水力矩。
1.3.2 Bac2a 和蜂毒素的二級結構的測定 Bac2a 和蜂毒素的二級結構采用圓二色譜法進行測定[7]。具體測定方法是將 Bac2a 分別溶解在 10 mmol/L 磷酸鹽緩沖溶液、50% 的 TFE、30 mmol/L SDS 溶液中,模擬水環境、生物膜的疏水環境、帶負電荷的原核細胞膜環境,使其終濃度為 60 μmol/L。25℃ 時,用圓二色譜儀對樣品溶液進行測定,圓二色譜儀石英樣品池的光程為 0.10 cm,掃描測定范圍為 190~250 nm,分辨率 0.50 nm,帶寬 1.00 nm,掃描速度為 10 nm/min。對照肽蜂毒素的二級結構的測定方法同 Bac2a。
1.3.3 菌種的培養 將凍存于—20℃ 的待測菌活化兩代后,劃線接種于瓊脂培養基中,37℃ 培養 18~20 h,挑取單菌落,接種于 20 mL 無菌肉湯培養基中,過夜培養后,按 2% 接種量接種于 10 mL 新鮮肉湯培養基中,培養 2~4 h,至菌體處于對數生長期。調整菌體濃度為 1×105 CFU/mL,備用。
1.3.4 抑菌活性的測定 抗菌肽抑菌活性的測定采用微量稀釋法[8]。在 96 孔板的前 10 個孔中,用多肽稀釋液將 Bac2a 分別稀釋為 256、128、64、32、16、8、4、2、1、0.50 μmol/L 的溶液,每孔再加入 50 μL 菌液。第 11 孔加入 50 μL 多肽稀釋液和 50 μL 菌液,作為陽性對照組。第 12 孔加入 50 μL 多肽稀釋液和 50 μL MHB 肉湯培養基,作為陰性對照組。加樣后放于 37℃ 培養箱中培養 18~24 h,觀察各孔細菌生長情況。無肉眼可見細菌生長的最低濃度即為該肽的最小抑菌濃度(minimal inhibitory concentration,MIC)。Bac2a 對 10 種菌的 MIC 的平均數,為幾何平均數(geometric mean,GM)。每個濃度重復三次。對照肽蜂毒素的抑菌活性的測定方法同 Bac2a。
1.3.5 溶血活性的測定 抗菌肽的溶血活性測定,參考 Li 等[9]方法。采集 1 mL 的人新鮮血液,1 000×g 離心 10 min 后,收集紅細胞,然后用磷酸鹽緩沖溶液洗滌三次,再用 10 mL 磷酸鹽緩沖溶液重懸細胞。在 96 孔板的前 10 個孔中,用磷酸鹽緩沖溶液將 Bac2a 分別稀釋為 1.3.4 節所述 10 個濃度,每孔再加入 50 μL 紅細胞懸液。11 號孔為陽性對照,加入 50 μL 紅細胞懸液和 50 μL 0.01% Triton X-100;12 號孔為陰性對照,加入 50 μL 紅細胞懸液和 50 μL 磷酸鹽緩沖溶液。37℃ 培養 1 h 取出,4℃,1 000×g 條件下離心 10 min,再將上清液轉移到干凈的 96 孔板對應的孔中,用酶標儀于 570 nm 處測定吸光值。每個濃度重復三次。計算公式如下:
 |
其中,A 為抗菌肽樣品處理組的吸光值;At 為陽性對照組的吸光值;A0 為陰性對照組的吸光值。
溶血率達到 5.00% 時的濃度為最小溶血濃度(minimum hemolysis concentration,MHC),MHC 對 MIC 的比值為治療指數(therapeutic index,TI)。對照肽蜂毒素的溶血活性的測定方法同 Bac2a。
1.3.6 細胞毒性的測定 抗菌肽的細胞毒性的測定采用 MTT 法[10]。將保存于液氮中的人腎上皮 293 細胞復蘇,在 DMEM 培養液中培養傳代。將生長到對數期的細胞制備成單細胞懸液,備用。按照上述 1.3.4 節方法稀釋肽。在 96 孔板的 1~10 號孔內加入 50 μL 制備好的單細胞懸液和稀釋好的 Bac2a,細胞濃度大約是 1×104個/孔。11 號孔為陽性對照,只加單細胞懸液不加 Bac2a;12 號孔為陰性對照,既不加單細胞懸液也不加 Bac2a。培養 24 h 后,每孔中加入 40 μL MTT 溶液,繼續培養 4 h。然后加入 150 μL DMSO 溶液,低速振蕩 10 min,用酶標儀在 492 nm 處測定吸光度值。每個濃度重復三次。計算公式如下:
 |
對照肽蜂毒素細胞毒性的測定方同 Bac2a。
1.3.7 穩定性的測定 本試驗主要研究了鹽離子、溫度、蛋白酶對抗菌肽抑菌作用的影響。以大腸桿菌(ATCC 25922)為實驗菌株,具體步驟如下:① 配制含不同濃度的 Na+ 和 Mg2+ 的 MHB 培養基,使 Na+、Mg2+ 的終濃度分別為 50、100、150 mmol/L 和 0.5、1.0、2.0 mmol/L,待完全溶解后,測定抗菌肽的 MIC,未經鹽離子處理的 Bac2a 對大腸桿菌(ATCC 25922)的 MIC 為對照組;② 將抗菌肽配制成 2.56 mmol/L,100℃ 加熱 1 h 后,按照上述 1.3.4 節方法將抗菌肽稀釋成不同濃度,測定抗菌肽的 MIC,未經熱處理的 Bac2a 對大腸桿菌(ATCC 25922)的 MIC 為對照組;③ 在 37℃ 水浴條件下,用反應終濃度為 1 mg/mL 的胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶 K 溶液分別處理抗菌肽 1 h,測定抗菌肽的 MIC,未經四種蛋白酶處理的 Bac2a 對大腸桿菌(ATCC 25922)的 MIC 為對照組。對照肽蜂毒素穩定性的測定方法同 Bac2a。
2 結果
2.1 抗菌肽的分子特性
Bac2a 和蜂毒素的分子特性如表 1 所示,合成肽的實際分子量與理論分子量很接近,表明合成肽是所需要的目標肽。
2.2 Bac2a 和蜂毒素的二級結構
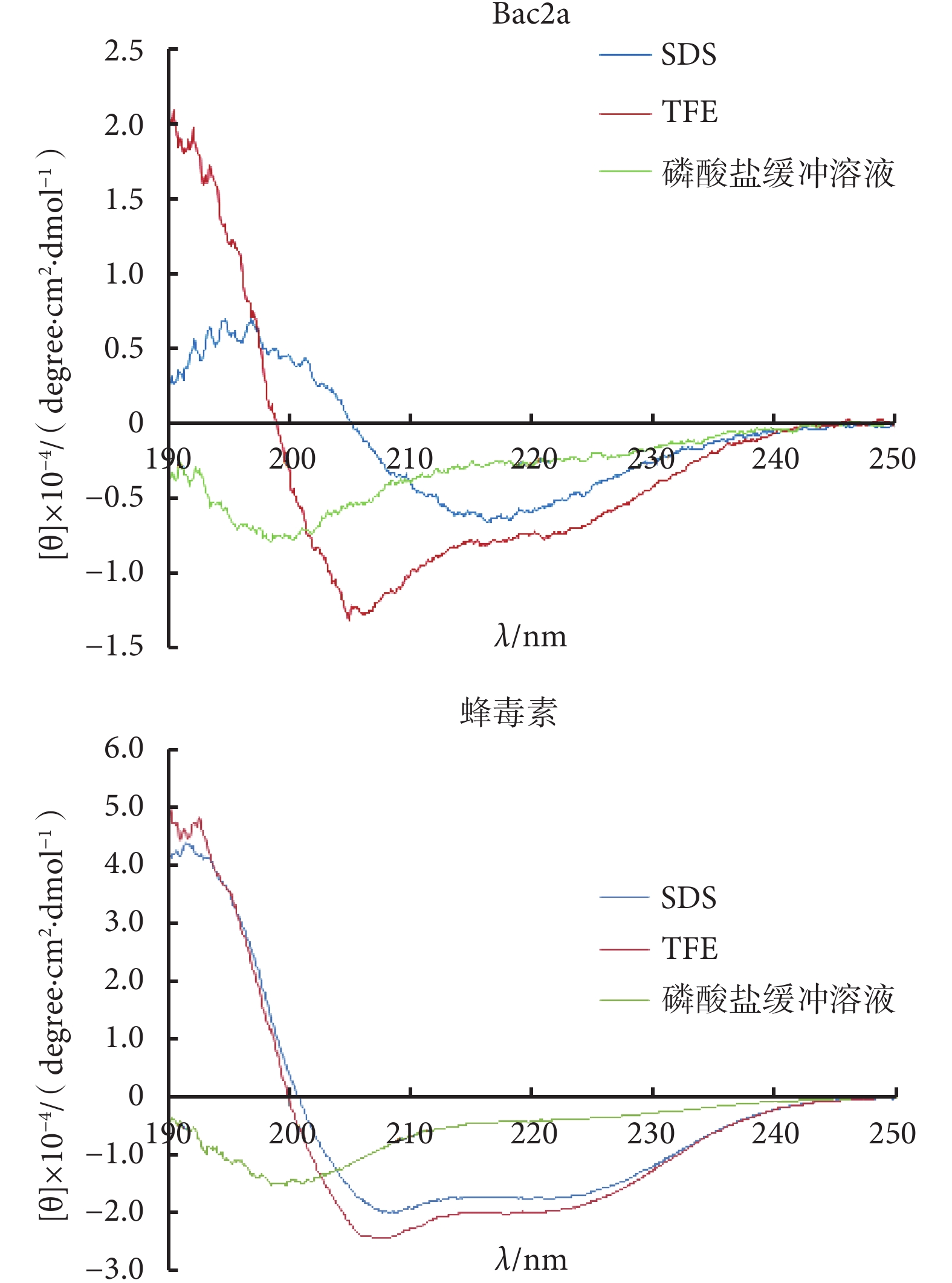
Bac2a 和蜂毒素在 10 mmol/L 磷酸鹽緩沖溶液、50% TFE、30 mmol/L SDS 溶液中的二級結構見圖 1。由圖 1 可見,在磷酸鹽緩沖溶液中,在波長為 200 nm 處附近,Bac2a 和蜂毒素出現負的特征性峰;在 TFE 溶液中,在波長為 192 nm 處,兩條肽出現一個正的特征峰,而在 208 nm 和 220 nm 波長附近,兩條肽都有明顯的負峰;在 SDS 溶液中,Bac2a 在波長為 195~198 nm 處有一強的正峰,而在波長為 217~218 nm 處有一負峰,蜂毒素在 SDS 溶液中出現負峰。
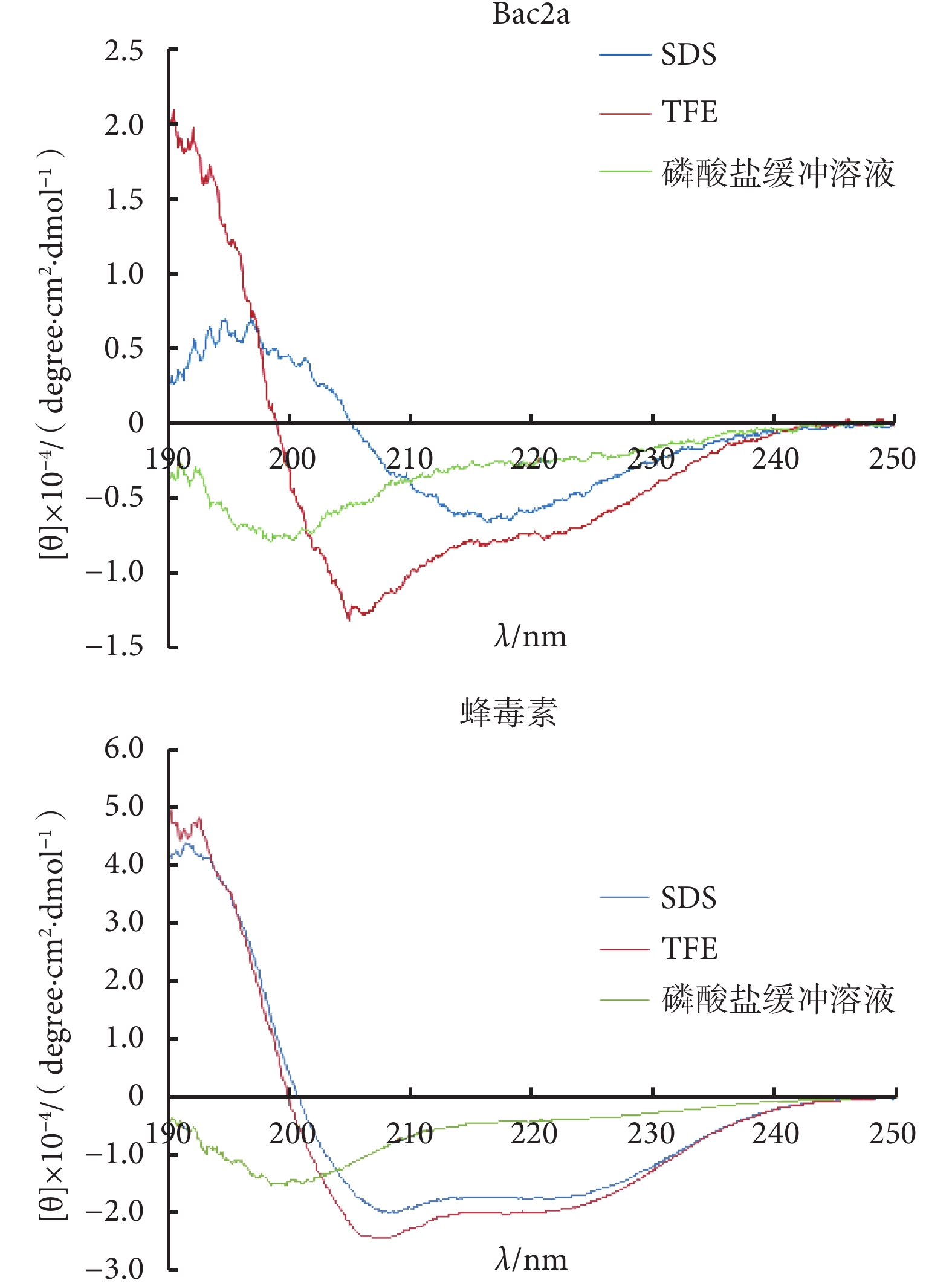 圖1
Bac2a 和蜂毒素在 10 mmol·L–1磷酸鹽緩沖液、50% TFE 和 30 mmol·L–1 SDS 溶液中的圓二色譜圖
Figure1.
CD spectra of Bac2a and melittin in 10 mmol·L–1 sodium phosphate buffer, 50% TFE, and 30 mmol·L–1 SDS
圖1
Bac2a 和蜂毒素在 10 mmol·L–1磷酸鹽緩沖液、50% TFE 和 30 mmol·L–1 SDS 溶液中的圓二色譜圖
Figure1.
CD spectra of Bac2a and melittin in 10 mmol·L–1 sodium phosphate buffer, 50% TFE, and 30 mmol·L–1 SDS
2.3 抑菌活性
Bac2a 和蜂毒素對革蘭陰性菌和革蘭陽性菌的 MIC 見表 2。由表 2 可見,Bac2a 的 MIC 范圍為 2~32 μmol/L ,其對大腸桿菌(ATCC 25922)的抑菌性最強,MIC 為 2 μmol/L,而對鼠傷寒沙門菌(C77-31)的抑菌性最弱,MIC 為 32 μmol/L;GM 為 9.80 μmol/L。蜂毒素的 MIC 范圍為 1~8 μmol/L,其對大腸桿菌(ATCC 25922)的抑菌性最強,MIC 為 1 μmol/L,對鼠傷寒沙門菌(C77-31)和雞白痢沙門菌(C79-13)的抑菌性最弱,MIC 為 8 μmol/L;GM 為 3.20 μmol/L。
2.4 溶血活性
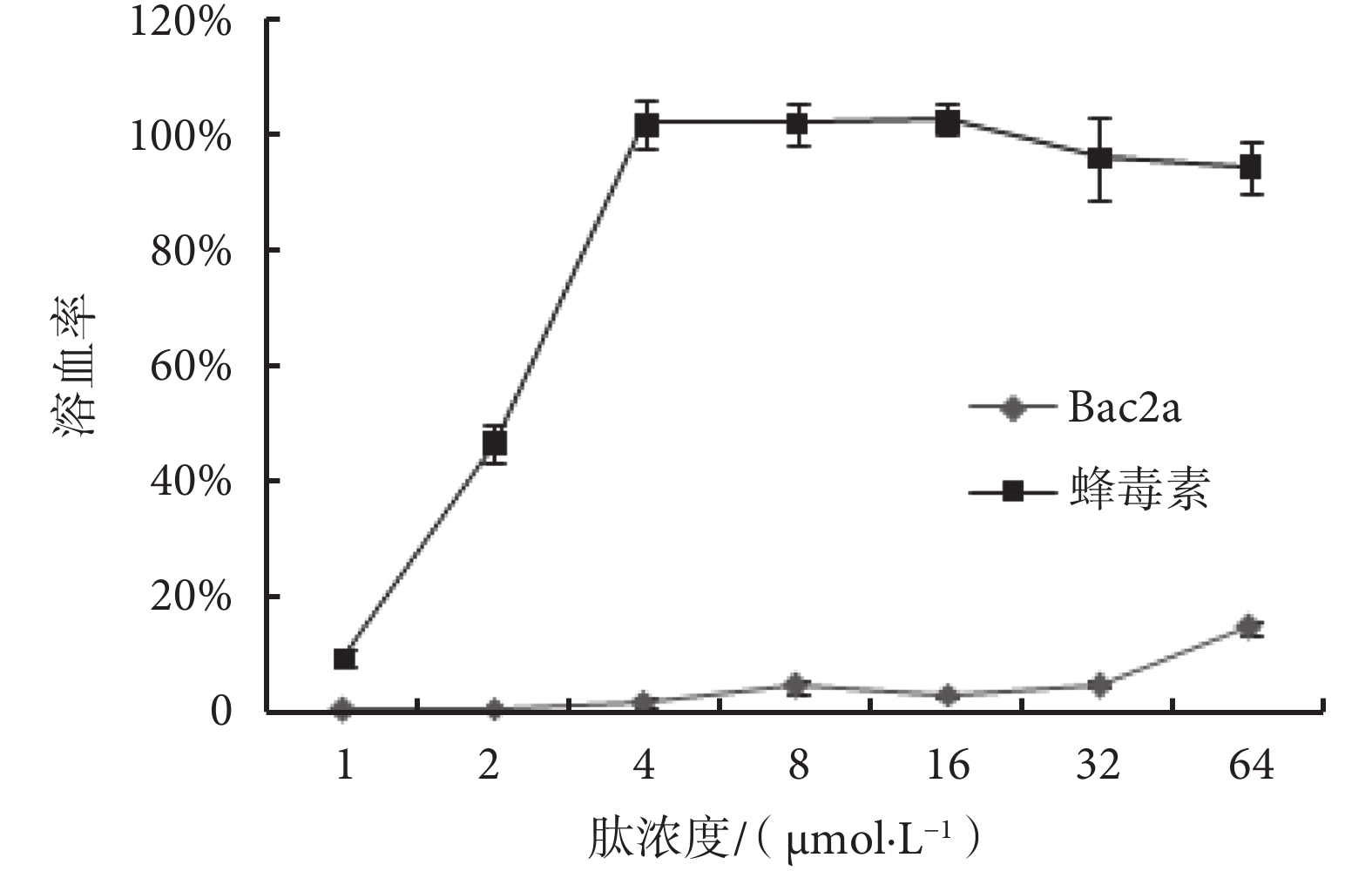
Bac2a 和蜂毒素對人正常紅細胞的損傷作用見圖 2。由圖 2 可見,Bac2a 的濃度在 1~32 μmol/L 內,溶血率非常低(<5%),當其濃度達到 64 μmol/L 時,其溶血率也僅為 14.81%,MHC 和 TI 值分別為 32.00 μmol/L 和 3.26(見表 2)。但蜂毒素的最低溶血率為 9.49%,隨著濃度的增加,溶血率急劇上升,當濃度為 4 μmol/L 時就達到了 100%,MHC 和 TI 值分別為 0.25 μmol/L 和 0.08(見表 2)。
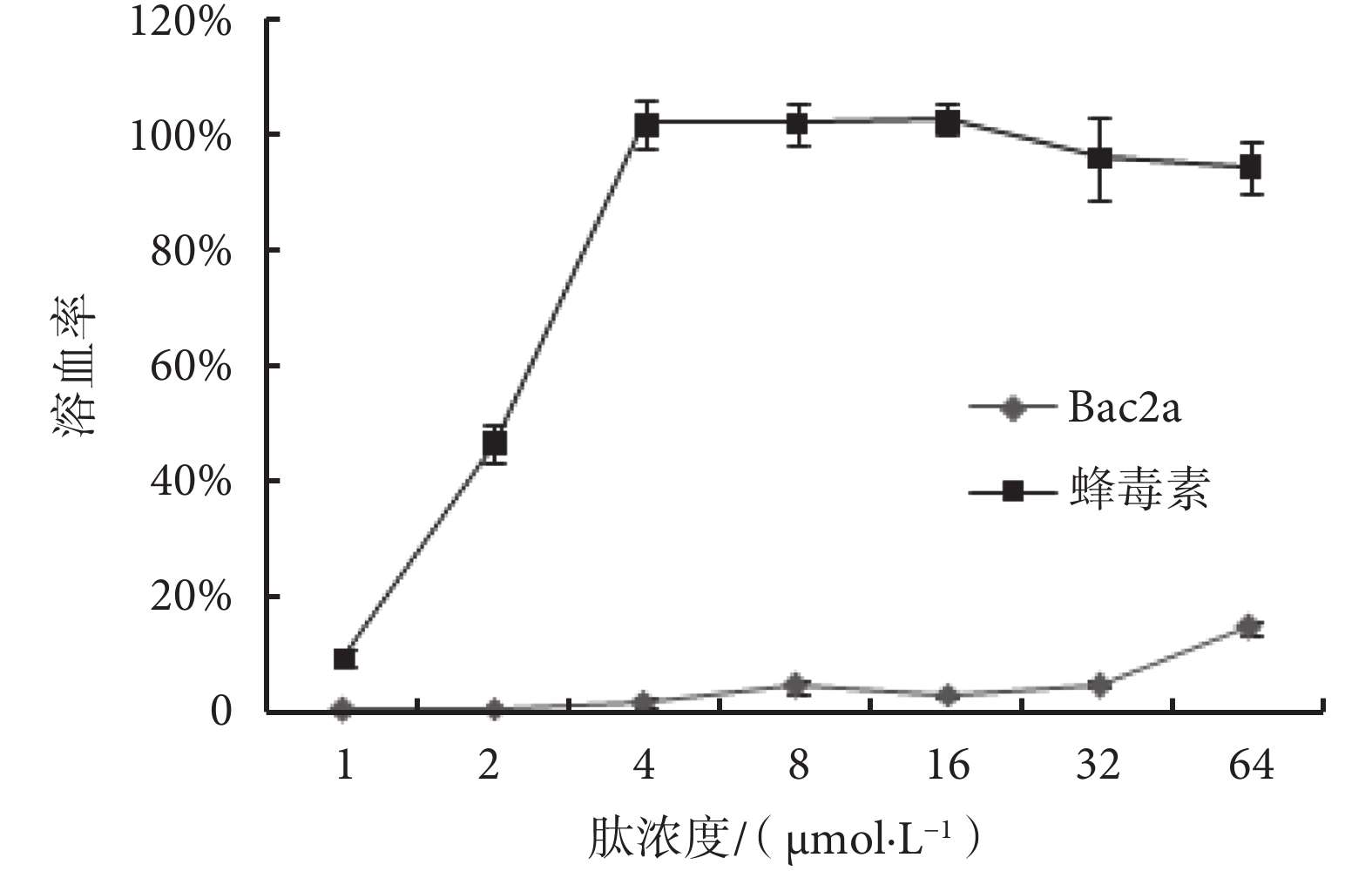 圖2
Bac2a 和蜂毒素的溶血活性
Figure2.
Hemolytic activities of Bac2a and melittin
圖2
Bac2a 和蜂毒素的溶血活性
Figure2.
Hemolytic activities of Bac2a and melittin
2.5 細胞毒性
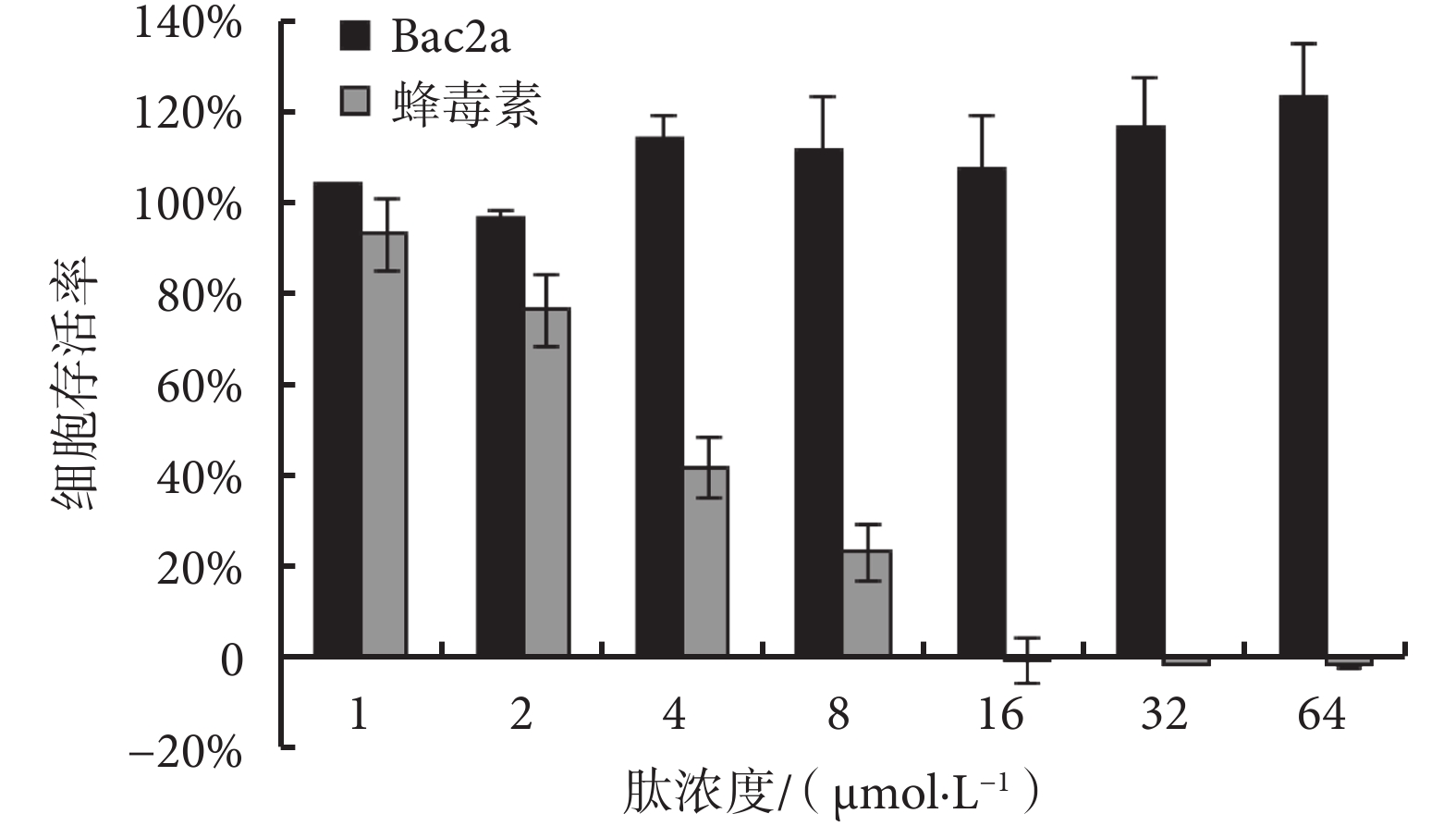
Bac2a 和蜂毒素對人腎上皮 293 細胞存活率的影響見圖 3。由圖 3 可見,Bac2a 的濃度在 1~ 64 μmol/L 之間時,細胞的存活率在 97.00% 以上,其細胞毒性小。而蜂毒素表現出很強的細胞毒性,在濃度達到 4 μmol/L 時,細胞存活率只有 41.95%,當蜂毒素濃度達到 16 μmol/L 時,細胞的存活率接近零。
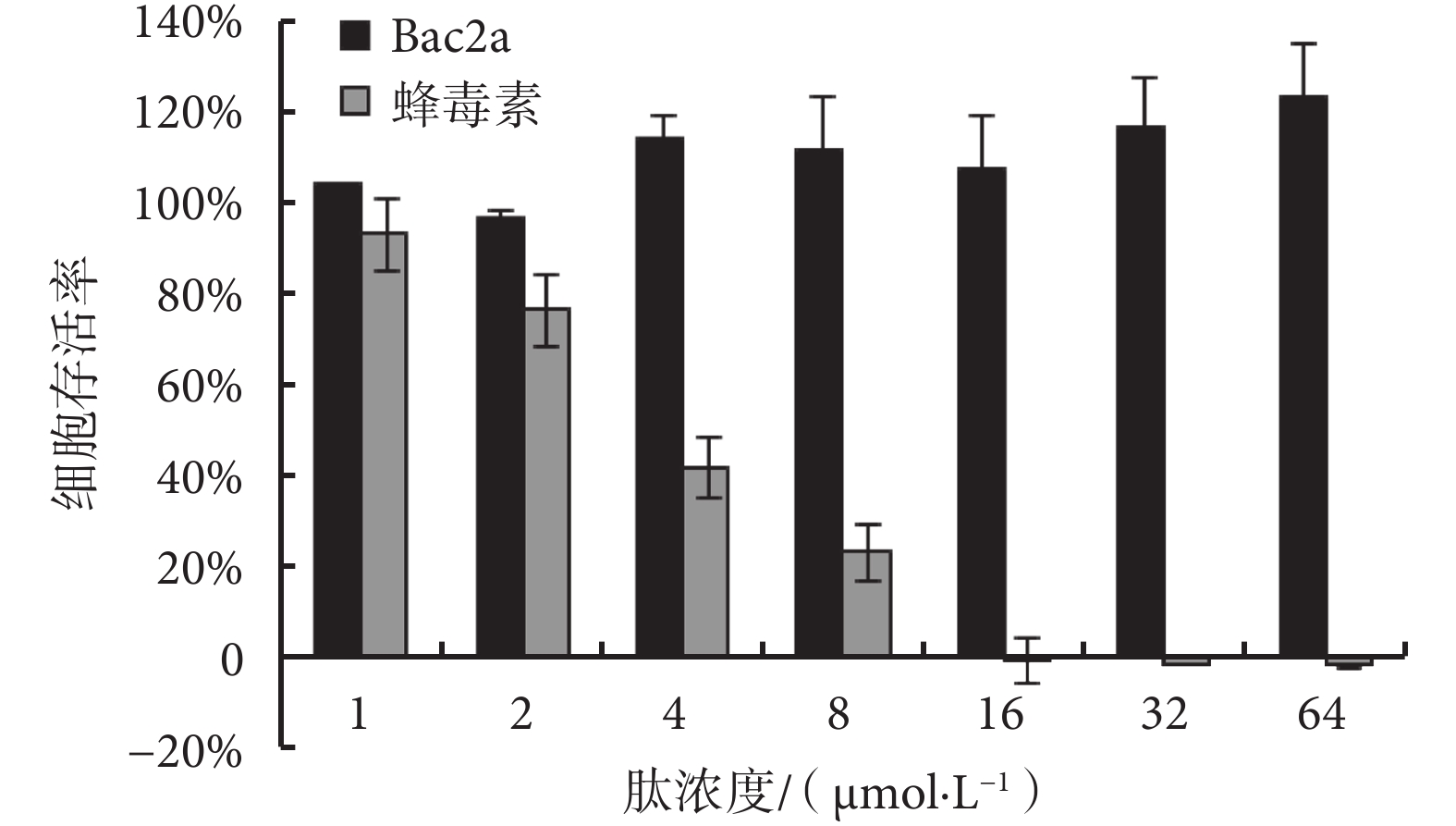 圖3
Bac2a 和蜂毒素的細胞毒性
Figure3.
Cytotoxicities of Bac2a and melittin
圖3
Bac2a 和蜂毒素的細胞毒性
Figure3.
Cytotoxicities of Bac2a and melittin
2.6 穩定性
2.6.1 鹽離子穩定性 Na+ 離子和 Mg2+ 離子對 Bac2a 和蜂毒素穩定性的影響見表 3,當 NaCl 溶液的濃度為 50、100、150 mmol/L 時,Bac2a 的 MIC 分別為 8、16、32 μmol/L,均大于未處理的 2 μmol/L;當 MgCl2 溶液的濃度為 0.50、1、2 mmol/L 時,Bac2a 的 MIC 分別為 2、4、8 μmol/L。但蜂毒素的 MIC 不受陽離子影響,鹽溶液穩定性高。
2.6.2 熱穩定性 溫度對 Bac2a 和蜂毒素穩定性的影響見表 4,由表 4 可知,100℃ 處理 1 h 時,抗菌肽 Bac2a 對菌株的 MIC 仍為 2 μmol/L,不受溫度影響。蜂毒素的熱穩定性也很高。
2.6.3 酶穩定性 不同蛋白酶對 Bac2a 和蜂毒素穩定性的影響見表 5。由表 5 可見,Bac2a 經 4 種蛋白酶處理之后,MIC 發生了改變。經木瓜蛋白酶處理后,MIC 為 16 μmol/L,與對照組 2 μmol/L 相比,抑菌性大大降低。Bac2a 經胃蛋白酶、胰蛋白酶、蛋白酶 K 處理后,MIC 均>64 μmol/L,幾乎喪失抑菌能力。蜂毒素抗蛋白酶 K 和胃蛋白酶酶解的能力較弱,經處理后,與對照組相比,抑菌活性幾乎喪失,抗胰蛋白酶和木瓜蛋白酶酶解的能力較強,抑菌活性沒有發生改變。
3 討論
研究表明,抗菌肽的二級結構,以 α-螺旋結構為最多,β-折疊結構次之,無序結構及環狀結構最少[11-12]。本試驗中,Bac2a 和蜂毒素在磷酸鹽緩沖溶液中,在波長 200 nm 附近出現一個負的特征性峰,這是蛋白質和多肽無規則卷曲結構的典型圖譜特征[13],說明這兩條肽在水溶液中呈無規則卷曲的二級結構;當在 50% 的 TFE 溶液中,Bac2a 和蜂毒素在 192 nm 附近出現一個正的特征峰,而在 208 nm 和 220 nm 波長附近都出現明顯的負峰,說明這兩條肽在疏水溶液中呈 α-螺旋型結構[14]。當在 30 mmol/L SDS 溶液中,Bac2a 在 195~198 nm 處有一強的正峰,而在 217~218 nm 處有一負峰,這是 β-折疊構象的典型圖譜特征[15],說明 SDS 溶液誘導 Bac2a 顯現 β-折疊的二級結構,這一結構的改變能讓疏水的 C-末端更容易插入細胞膜的脂質雙分子層[16]。而蜂毒素在 SDS 溶液中與在 50% 的 TFE 溶液中峰型特征相似,是典型的 α-螺旋結構。
丁永林[3]和 Wu 等[5]的研究表明,牛溶菌肽對革蘭陽性菌和革蘭陰性菌的 MIC 較高(MIC 在 6~128 μmol/L 之間),抑菌效果不好。本試驗結果表明,牛溶菌肽的線性衍生物 Bac2a 的抑菌活性較高(MIC 在 2~32 μmol/L 之間),這說明將半胱氨酸替代成丙氨酸,雖然破壞了環形結構但是增加了其疏水性氨基酸含量,這對增強抑菌性有一定效果。隨著肽濃度的增加,Bac2a 的溶血率呈上升趨勢,其對紅細胞的溶血率呈濃度依賴性,但是上升的幅度很小,說明 Bac2a 對細胞的溶血能力相對較弱。肽濃度在 1~64 μmol/L 范圍內,細胞存活率很高,說明 Bac2a 的細胞毒性也很低。蜂毒素是公認的抑菌性較強的抗菌肽,但溶血性和細胞毒性很高,細胞選擇性較低[5],因此 Bac2a 在實際應用中比蜂毒素更有優勢。
治療指數是指示抗菌劑抗菌特異性的參數,是 MHC 對 MIC 的比值。治療指數越大,表明抗菌特異性越強[14]。由表 2 可知,Bac2a 的治療指數為 3.26,蜂毒素為 0.08,Bac2a 的治療指數遠強于蜂毒素,表示 Bac2a 的細胞選擇性較高,作為添加劑比蜂毒素更有優勢。Bac2a 在擁有較強抗菌性的同時能夠保持較低的溶血性和毒性,證明 Bac2a 具有成為抗生素替代品的潛力。
本實驗研究發現,增加溶液中鈉離子和鎂離子濃度會使 Bac2a 的抑菌性降低,說明 Bac2a 對上述兩種鹽離子不穩定,這可能是因為二價陽離子的結合位點是革蘭陰性菌細胞膜上帶負電荷的脂多糖,而陽離子抗菌肽主要是通過靜電作用與細菌細胞膜結合,兩者是競爭關系[17-18]。因此增強溶液中二價陽離子的濃度會抑制抗菌肽與細胞膜作用,從而使抑菌性降低。研究發現,Bac2a 熱穩定性較高,與 Ma 等[18]報道結果一致。
大量的研究結果已經證明,胃蛋白酶的酶切位點是疏水性氨基酸或芳香族氨基酸;胰蛋白酶的酶切位點是賴氨酸和精氨酸的羧基端形成的肽鍵;木瓜蛋白酶屬于巰基蛋白酶,作用位點是精氨酸、賴氨酸、甘氨酸結合的肽鍵;蛋白酶 K 的酶切位點具有廣泛特異性。本實驗中 Bac2a 對四種蛋白酶的穩定性都不太好。說明 Bac2a 具有 4 種蛋白酶的酶解位點,容易酶解而失活。
本實驗通過微量稀釋法測量抗菌肽的抑菌活性,結果表明,牛溶菌肽線性衍生物 Bac2a 抑菌性較強,與蜂毒素相比,其細胞選擇性較好,并且對真核細胞的毒性小;同時抗菌肽 Bac2a 具有較好的熱穩定性,但鹽離子穩定性和蛋白酶水解穩定性較差。總之,抗菌肽 Bac2a 具有成為抗生素替代品的潛力,可以考慮適當應用于食品、醫藥及其它領域。
引言
近年來,由于抗生素的大量使用導致耐藥菌株不斷出現以及藥物殘留問題日益凸顯,嚴重威脅著人類的健康,尤其是“超級細菌”的出現,給人們的生命安全和經濟帶來巨大損失,因此迫切需要尋找一種新型安全的抗菌藥物。抗菌肽(antimicrobial peptides,AMPs)的出現有可能使這一局面得到改觀[1]。抗菌肽又稱抗微生物肽,廣泛存在于包括原核生物到人類的各個有機體中,是生物體天然免疫防御系統的重要組成部分。抗菌肽的氨基酸殘基數目一般為 12~50 個,C-末端一般富含非極性氨基酸,如丙氨酸、纈氨酸和色氨酸,N-末端常富含陽離子氨基酸,如賴氨酸、精氨酸和組氨酸等[2];抗菌肽一般帶有正電荷,等電點大于 7,相對分子量一般小于 10 kD。抗菌肽作用范圍廣,對細菌、真菌、病毒、腫瘤細胞、原生動物均有很好的抑制或殺滅作用。抗菌肽還具有抗生素無法比擬的優點,不僅對正常細胞無毒性,而且不會使細菌產生抗藥性,這使得抗菌肽具有廣闊的發展空間。
牛溶菌肽是從牛中性粒細胞的大顆粒中提取的,是自然界存在的分子量最小的天然陽離子抗菌肽,其對大腸桿菌和金黃色葡萄球菌均具有較好的抗菌活性,已成為近年來研究較多的抗菌肽之一[3]。牛溶菌肽由 12 個氨基酸組成,包括 4 個精氨酸殘基、2 個半胱氨酸殘基和 6 個疏水殘基,序列為 RLCRIVVIRVCR。2 個半胱氨酸殘基形成的二硫鍵使牛溶菌肽成為一個環狀結構。通過改建,可以使牛溶菌肽線性化,形成各種衍生物[4]。Bac2a 是通過用疏水性氨基酸丙氨酸替代半胱氨酸得到的一種線性衍生物,序列為 RLARIVVIRVAR。這種改變破壞了原肽的環形結構,但是增加了疏水性氨基酸含量[5]。近年來研究表明,Bac2a 具有比牛溶菌肽更高的抗菌活性,但是 Bac2a 對細胞的毒性及其穩定性尚不清楚。蜂毒素是意大利蜜蜂蜂毒素的主要成分之一,占蜂毒干重的 50%,具有較強的抑菌活性,但蜂毒素具有較高溶血性和細胞毒性的副作用限制了其使用,其多用作抗氧化肽的對照肽[6]。本研究以化學合成的 Bac2a 為研究對象,以蜂毒素為對照肽,對 Bac2a 的抑菌性、安全性和穩定性進行了較全面的研究,為 Bac2a 成為抗生素替代品提供理論依據。
1 材料與方法
1.1 材料
抗菌肽 Bac2a 和蜂毒素均由上海吉爾(GL)生化有限公司采用固相化學合成法合成,純度達 95% 以上。用無菌蒸餾水溶解,使濃度為 2.56 mmol/L,—20℃ 下保存備用。實驗所用菌株包括大腸桿菌(Escherichia coli ATCC 25922)、大腸桿菌(Esche-richia coli UB1005)、金黃色葡萄球菌(Staphy-lococcus aureus ATCC 29213)、金黃色葡萄球菌(Staphylococcus aureus ATCC 25923)、表皮葡萄球菌(Staphylococcus epidermidis ATCC 12228)、單增李斯特菌(Listeriamonocytogenes CMCC 54004)、鼠傷寒沙門菌(Salmonella Typhimurium C77-31)、鼠傷寒沙門菌(Salmonella Typhimurium ATCC-14028)、雞白痢沙門菌(Salmonella Typhimurium C79-13)和沙門菌(Salmonella entericasubspenterica CMCC 50071),均為中國農業科學院哈爾濱獸醫研究所保存。實驗所用人腎上皮 293 細胞由中國農業科學院哈爾濱獸醫研究所保存。瓊脂培養基(Mueller-Hinton Agar,MHA)、肉湯培養基(Mueller-Hinton Broth,MHB)購于北京奧博星生物技術有限責任公司,Triton X-100、胃蛋白酶、木瓜蛋白酶、胰蛋白酶、蛋白酶 K 購于 Sigma 公司,噻唑藍(thiazolyl blue,MTT)、磷酸鹽緩沖(pho-sphate buffer saline,PBS)、三氟乙醇(trifluoroe-thanol,TFE)、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、二甲基亞砜(dimethyl sulfoxide,DMSO)等購于 Biosharp 公司。
1.2 設備
HVE-50 高壓蒸汽滅菌鍋(日本),VD-1320 型超凈工作臺(北京東聯哈爾儀器制造有限公司),RS-232C 酶標儀(日本),721 型可見分光光度計(上海元析儀器有限公司),搖床震蕩培養箱 ZHWY-211D(上海智城分析儀器制造有限公司),電熱恒溫水浴鍋 XMTD-4000(北京市永元明醫療儀器廠)。
1.3 方法
1.3.1 抗菌肽的分子特性 在http://web.expasy. org/compute_pi/網站預測 Bac2a 和蜂毒素的理論分子量、凈電荷、等電點;在http://heliquest.ipmc. cnrs.fr/網站預測 Bac2a 和蜂毒素的疏水性和疏水力矩。
1.3.2 Bac2a 和蜂毒素的二級結構的測定 Bac2a 和蜂毒素的二級結構采用圓二色譜法進行測定[7]。具體測定方法是將 Bac2a 分別溶解在 10 mmol/L 磷酸鹽緩沖溶液、50% 的 TFE、30 mmol/L SDS 溶液中,模擬水環境、生物膜的疏水環境、帶負電荷的原核細胞膜環境,使其終濃度為 60 μmol/L。25℃ 時,用圓二色譜儀對樣品溶液進行測定,圓二色譜儀石英樣品池的光程為 0.10 cm,掃描測定范圍為 190~250 nm,分辨率 0.50 nm,帶寬 1.00 nm,掃描速度為 10 nm/min。對照肽蜂毒素的二級結構的測定方法同 Bac2a。
1.3.3 菌種的培養 將凍存于—20℃ 的待測菌活化兩代后,劃線接種于瓊脂培養基中,37℃ 培養 18~20 h,挑取單菌落,接種于 20 mL 無菌肉湯培養基中,過夜培養后,按 2% 接種量接種于 10 mL 新鮮肉湯培養基中,培養 2~4 h,至菌體處于對數生長期。調整菌體濃度為 1×105 CFU/mL,備用。
1.3.4 抑菌活性的測定 抗菌肽抑菌活性的測定采用微量稀釋法[8]。在 96 孔板的前 10 個孔中,用多肽稀釋液將 Bac2a 分別稀釋為 256、128、64、32、16、8、4、2、1、0.50 μmol/L 的溶液,每孔再加入 50 μL 菌液。第 11 孔加入 50 μL 多肽稀釋液和 50 μL 菌液,作為陽性對照組。第 12 孔加入 50 μL 多肽稀釋液和 50 μL MHB 肉湯培養基,作為陰性對照組。加樣后放于 37℃ 培養箱中培養 18~24 h,觀察各孔細菌生長情況。無肉眼可見細菌生長的最低濃度即為該肽的最小抑菌濃度(minimal inhibitory concentration,MIC)。Bac2a 對 10 種菌的 MIC 的平均數,為幾何平均數(geometric mean,GM)。每個濃度重復三次。對照肽蜂毒素的抑菌活性的測定方法同 Bac2a。
1.3.5 溶血活性的測定 抗菌肽的溶血活性測定,參考 Li 等[9]方法。采集 1 mL 的人新鮮血液,1 000×g 離心 10 min 后,收集紅細胞,然后用磷酸鹽緩沖溶液洗滌三次,再用 10 mL 磷酸鹽緩沖溶液重懸細胞。在 96 孔板的前 10 個孔中,用磷酸鹽緩沖溶液將 Bac2a 分別稀釋為 1.3.4 節所述 10 個濃度,每孔再加入 50 μL 紅細胞懸液。11 號孔為陽性對照,加入 50 μL 紅細胞懸液和 50 μL 0.01% Triton X-100;12 號孔為陰性對照,加入 50 μL 紅細胞懸液和 50 μL 磷酸鹽緩沖溶液。37℃ 培養 1 h 取出,4℃,1 000×g 條件下離心 10 min,再將上清液轉移到干凈的 96 孔板對應的孔中,用酶標儀于 570 nm 處測定吸光值。每個濃度重復三次。計算公式如下:
 |
其中,A 為抗菌肽樣品處理組的吸光值;At 為陽性對照組的吸光值;A0 為陰性對照組的吸光值。
溶血率達到 5.00% 時的濃度為最小溶血濃度(minimum hemolysis concentration,MHC),MHC 對 MIC 的比值為治療指數(therapeutic index,TI)。對照肽蜂毒素的溶血活性的測定方法同 Bac2a。
1.3.6 細胞毒性的測定 抗菌肽的細胞毒性的測定采用 MTT 法[10]。將保存于液氮中的人腎上皮 293 細胞復蘇,在 DMEM 培養液中培養傳代。將生長到對數期的細胞制備成單細胞懸液,備用。按照上述 1.3.4 節方法稀釋肽。在 96 孔板的 1~10 號孔內加入 50 μL 制備好的單細胞懸液和稀釋好的 Bac2a,細胞濃度大約是 1×104個/孔。11 號孔為陽性對照,只加單細胞懸液不加 Bac2a;12 號孔為陰性對照,既不加單細胞懸液也不加 Bac2a。培養 24 h 后,每孔中加入 40 μL MTT 溶液,繼續培養 4 h。然后加入 150 μL DMSO 溶液,低速振蕩 10 min,用酶標儀在 492 nm 處測定吸光度值。每個濃度重復三次。計算公式如下:
 |
對照肽蜂毒素細胞毒性的測定方同 Bac2a。
1.3.7 穩定性的測定 本試驗主要研究了鹽離子、溫度、蛋白酶對抗菌肽抑菌作用的影響。以大腸桿菌(ATCC 25922)為實驗菌株,具體步驟如下:① 配制含不同濃度的 Na+ 和 Mg2+ 的 MHB 培養基,使 Na+、Mg2+ 的終濃度分別為 50、100、150 mmol/L 和 0.5、1.0、2.0 mmol/L,待完全溶解后,測定抗菌肽的 MIC,未經鹽離子處理的 Bac2a 對大腸桿菌(ATCC 25922)的 MIC 為對照組;② 將抗菌肽配制成 2.56 mmol/L,100℃ 加熱 1 h 后,按照上述 1.3.4 節方法將抗菌肽稀釋成不同濃度,測定抗菌肽的 MIC,未經熱處理的 Bac2a 對大腸桿菌(ATCC 25922)的 MIC 為對照組;③ 在 37℃ 水浴條件下,用反應終濃度為 1 mg/mL 的胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶 K 溶液分別處理抗菌肽 1 h,測定抗菌肽的 MIC,未經四種蛋白酶處理的 Bac2a 對大腸桿菌(ATCC 25922)的 MIC 為對照組。對照肽蜂毒素穩定性的測定方法同 Bac2a。
2 結果
2.1 抗菌肽的分子特性
Bac2a 和蜂毒素的分子特性如表 1 所示,合成肽的實際分子量與理論分子量很接近,表明合成肽是所需要的目標肽。
2.2 Bac2a 和蜂毒素的二級結構
Bac2a 和蜂毒素在 10 mmol/L 磷酸鹽緩沖溶液、50% TFE、30 mmol/L SDS 溶液中的二級結構見圖 1。由圖 1 可見,在磷酸鹽緩沖溶液中,在波長為 200 nm 處附近,Bac2a 和蜂毒素出現負的特征性峰;在 TFE 溶液中,在波長為 192 nm 處,兩條肽出現一個正的特征峰,而在 208 nm 和 220 nm 波長附近,兩條肽都有明顯的負峰;在 SDS 溶液中,Bac2a 在波長為 195~198 nm 處有一強的正峰,而在波長為 217~218 nm 處有一負峰,蜂毒素在 SDS 溶液中出現負峰。
 圖1
Bac2a 和蜂毒素在 10 mmol·L–1磷酸鹽緩沖液、50% TFE 和 30 mmol·L–1 SDS 溶液中的圓二色譜圖
Figure1.
CD spectra of Bac2a and melittin in 10 mmol·L–1 sodium phosphate buffer, 50% TFE, and 30 mmol·L–1 SDS
圖1
Bac2a 和蜂毒素在 10 mmol·L–1磷酸鹽緩沖液、50% TFE 和 30 mmol·L–1 SDS 溶液中的圓二色譜圖
Figure1.
CD spectra of Bac2a and melittin in 10 mmol·L–1 sodium phosphate buffer, 50% TFE, and 30 mmol·L–1 SDS
2.3 抑菌活性
Bac2a 和蜂毒素對革蘭陰性菌和革蘭陽性菌的 MIC 見表 2。由表 2 可見,Bac2a 的 MIC 范圍為 2~32 μmol/L ,其對大腸桿菌(ATCC 25922)的抑菌性最強,MIC 為 2 μmol/L,而對鼠傷寒沙門菌(C77-31)的抑菌性最弱,MIC 為 32 μmol/L;GM 為 9.80 μmol/L。蜂毒素的 MIC 范圍為 1~8 μmol/L,其對大腸桿菌(ATCC 25922)的抑菌性最強,MIC 為 1 μmol/L,對鼠傷寒沙門菌(C77-31)和雞白痢沙門菌(C79-13)的抑菌性最弱,MIC 為 8 μmol/L;GM 為 3.20 μmol/L。
2.4 溶血活性
Bac2a 和蜂毒素對人正常紅細胞的損傷作用見圖 2。由圖 2 可見,Bac2a 的濃度在 1~32 μmol/L 內,溶血率非常低(<5%),當其濃度達到 64 μmol/L 時,其溶血率也僅為 14.81%,MHC 和 TI 值分別為 32.00 μmol/L 和 3.26(見表 2)。但蜂毒素的最低溶血率為 9.49%,隨著濃度的增加,溶血率急劇上升,當濃度為 4 μmol/L 時就達到了 100%,MHC 和 TI 值分別為 0.25 μmol/L 和 0.08(見表 2)。
 圖2
Bac2a 和蜂毒素的溶血活性
Figure2.
Hemolytic activities of Bac2a and melittin
圖2
Bac2a 和蜂毒素的溶血活性
Figure2.
Hemolytic activities of Bac2a and melittin
2.5 細胞毒性
Bac2a 和蜂毒素對人腎上皮 293 細胞存活率的影響見圖 3。由圖 3 可見,Bac2a 的濃度在 1~ 64 μmol/L 之間時,細胞的存活率在 97.00% 以上,其細胞毒性小。而蜂毒素表現出很強的細胞毒性,在濃度達到 4 μmol/L 時,細胞存活率只有 41.95%,當蜂毒素濃度達到 16 μmol/L 時,細胞的存活率接近零。
 圖3
Bac2a 和蜂毒素的細胞毒性
Figure3.
Cytotoxicities of Bac2a and melittin
圖3
Bac2a 和蜂毒素的細胞毒性
Figure3.
Cytotoxicities of Bac2a and melittin
2.6 穩定性
2.6.1 鹽離子穩定性 Na+ 離子和 Mg2+ 離子對 Bac2a 和蜂毒素穩定性的影響見表 3,當 NaCl 溶液的濃度為 50、100、150 mmol/L 時,Bac2a 的 MIC 分別為 8、16、32 μmol/L,均大于未處理的 2 μmol/L;當 MgCl2 溶液的濃度為 0.50、1、2 mmol/L 時,Bac2a 的 MIC 分別為 2、4、8 μmol/L。但蜂毒素的 MIC 不受陽離子影響,鹽溶液穩定性高。
2.6.2 熱穩定性 溫度對 Bac2a 和蜂毒素穩定性的影響見表 4,由表 4 可知,100℃ 處理 1 h 時,抗菌肽 Bac2a 對菌株的 MIC 仍為 2 μmol/L,不受溫度影響。蜂毒素的熱穩定性也很高。
2.6.3 酶穩定性 不同蛋白酶對 Bac2a 和蜂毒素穩定性的影響見表 5。由表 5 可見,Bac2a 經 4 種蛋白酶處理之后,MIC 發生了改變。經木瓜蛋白酶處理后,MIC 為 16 μmol/L,與對照組 2 μmol/L 相比,抑菌性大大降低。Bac2a 經胃蛋白酶、胰蛋白酶、蛋白酶 K 處理后,MIC 均>64 μmol/L,幾乎喪失抑菌能力。蜂毒素抗蛋白酶 K 和胃蛋白酶酶解的能力較弱,經處理后,與對照組相比,抑菌活性幾乎喪失,抗胰蛋白酶和木瓜蛋白酶酶解的能力較強,抑菌活性沒有發生改變。
3 討論
研究表明,抗菌肽的二級結構,以 α-螺旋結構為最多,β-折疊結構次之,無序結構及環狀結構最少[11-12]。本試驗中,Bac2a 和蜂毒素在磷酸鹽緩沖溶液中,在波長 200 nm 附近出現一個負的特征性峰,這是蛋白質和多肽無規則卷曲結構的典型圖譜特征[13],說明這兩條肽在水溶液中呈無規則卷曲的二級結構;當在 50% 的 TFE 溶液中,Bac2a 和蜂毒素在 192 nm 附近出現一個正的特征峰,而在 208 nm 和 220 nm 波長附近都出現明顯的負峰,說明這兩條肽在疏水溶液中呈 α-螺旋型結構[14]。當在 30 mmol/L SDS 溶液中,Bac2a 在 195~198 nm 處有一強的正峰,而在 217~218 nm 處有一負峰,這是 β-折疊構象的典型圖譜特征[15],說明 SDS 溶液誘導 Bac2a 顯現 β-折疊的二級結構,這一結構的改變能讓疏水的 C-末端更容易插入細胞膜的脂質雙分子層[16]。而蜂毒素在 SDS 溶液中與在 50% 的 TFE 溶液中峰型特征相似,是典型的 α-螺旋結構。
丁永林[3]和 Wu 等[5]的研究表明,牛溶菌肽對革蘭陽性菌和革蘭陰性菌的 MIC 較高(MIC 在 6~128 μmol/L 之間),抑菌效果不好。本試驗結果表明,牛溶菌肽的線性衍生物 Bac2a 的抑菌活性較高(MIC 在 2~32 μmol/L 之間),這說明將半胱氨酸替代成丙氨酸,雖然破壞了環形結構但是增加了其疏水性氨基酸含量,這對增強抑菌性有一定效果。隨著肽濃度的增加,Bac2a 的溶血率呈上升趨勢,其對紅細胞的溶血率呈濃度依賴性,但是上升的幅度很小,說明 Bac2a 對細胞的溶血能力相對較弱。肽濃度在 1~64 μmol/L 范圍內,細胞存活率很高,說明 Bac2a 的細胞毒性也很低。蜂毒素是公認的抑菌性較強的抗菌肽,但溶血性和細胞毒性很高,細胞選擇性較低[5],因此 Bac2a 在實際應用中比蜂毒素更有優勢。
治療指數是指示抗菌劑抗菌特異性的參數,是 MHC 對 MIC 的比值。治療指數越大,表明抗菌特異性越強[14]。由表 2 可知,Bac2a 的治療指數為 3.26,蜂毒素為 0.08,Bac2a 的治療指數遠強于蜂毒素,表示 Bac2a 的細胞選擇性較高,作為添加劑比蜂毒素更有優勢。Bac2a 在擁有較強抗菌性的同時能夠保持較低的溶血性和毒性,證明 Bac2a 具有成為抗生素替代品的潛力。
本實驗研究發現,增加溶液中鈉離子和鎂離子濃度會使 Bac2a 的抑菌性降低,說明 Bac2a 對上述兩種鹽離子不穩定,這可能是因為二價陽離子的結合位點是革蘭陰性菌細胞膜上帶負電荷的脂多糖,而陽離子抗菌肽主要是通過靜電作用與細菌細胞膜結合,兩者是競爭關系[17-18]。因此增強溶液中二價陽離子的濃度會抑制抗菌肽與細胞膜作用,從而使抑菌性降低。研究發現,Bac2a 熱穩定性較高,與 Ma 等[18]報道結果一致。
大量的研究結果已經證明,胃蛋白酶的酶切位點是疏水性氨基酸或芳香族氨基酸;胰蛋白酶的酶切位點是賴氨酸和精氨酸的羧基端形成的肽鍵;木瓜蛋白酶屬于巰基蛋白酶,作用位點是精氨酸、賴氨酸、甘氨酸結合的肽鍵;蛋白酶 K 的酶切位點具有廣泛特異性。本實驗中 Bac2a 對四種蛋白酶的穩定性都不太好。說明 Bac2a 具有 4 種蛋白酶的酶解位點,容易酶解而失活。
本實驗通過微量稀釋法測量抗菌肽的抑菌活性,結果表明,牛溶菌肽線性衍生物 Bac2a 抑菌性較強,與蜂毒素相比,其細胞選擇性較好,并且對真核細胞的毒性小;同時抗菌肽 Bac2a 具有較好的熱穩定性,但鹽離子穩定性和蛋白酶水解穩定性較差。總之,抗菌肽 Bac2a 具有成為抗生素替代品的潛力,可以考慮適當應用于食品、醫藥及其它領域。