浮游菌是衡量環境潔凈度的一項重要指標,然而潔凈作業環境與受控實驗環境的特殊性往往導致浮游菌的研究比較受限。本文設計并實現了一種微環境實驗箱系統,便于在常規實驗條件下進行浮游菌研究。Fluent 數值模擬表明,浮游菌在實驗箱內中上部具備較好的分布狀態,并呈現出自下而上的濃度增長分布現象。根據模擬結果,在實驗箱內選擇不同空間位置的 5 個測量點進行粒子計數濃度驗證實驗。實驗結果表明金黃色葡萄球菌發菌 5 min 后各測量點平均粒子濃度均達到了 107 個/m3 數量級,各測量點粒子分布較為一致,且上部濃度略高于中部濃度,中部濃度略高于底部濃度。驗證實驗結果與數值模擬結果相符,證明該系統能夠較好地用于浮游菌研究。
引用本文: 詹寧波, 陳鋒, 杜耀華, 程智, 李辰宇, 吳金龍, 吳太虎. 用于浮游菌研究的微環境實驗箱系統的研制. 生物醫學工程學雜志, 2017, 34(5): 778-783. doi: 10.7507/1001-5515.201609005 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
浮游菌(airborne microbe)是指懸浮在空氣中的,可通過培養基在適宜的生長條件下繁殖到可見菌落數的活性微生物粒子[1]。流行病學研究表明,醫院手術室、重癥監護病房(intensive care unit,ICU)等各類潔凈環境的浮游菌濃度與患者感染率呈正相關[2-3]。浮游菌的發生、存活、限制擴散、快速檢測和分布評價等研究已成為國內外研究的熱點[4]。
潔凈環境下直接對浮游菌進行研究存在兩方面的問題:一是容易對正常的作業活動造成干擾;二是存在攜帶污染。研究表明潔凈環境下人員活動會造成浮游菌濃度顯著升高[5]。因此,在對浮游菌進行研究時往往需要建立獨立的受控實驗環境。美國環保局(Environmental Protection Agency,EPA)在進行相關研究時建造了龐大的閉環風洞系統(20 m×14 m×1.5 m)[6],拜耳(Bayer HealthCare)則借助了美軍 Dugway 試驗場 150 m3 的微生物密閉艙完成測試[7]。鑒于在常規實驗室中達成這些實驗條件比較困難,本研究研制了一個浮游菌微環境密閉實驗箱系統,可用于對浮游菌的發生、存活自凈、采樣檢測和分布特性進行研究[8-9]。實驗箱內濕度可調,可模擬不同濕度條件下的浮游菌生存環境,同時箱內保持一定負壓,避免浮游菌外泄污染工作環境。
1 微環境實驗箱系統的設計
1.1 整體設計
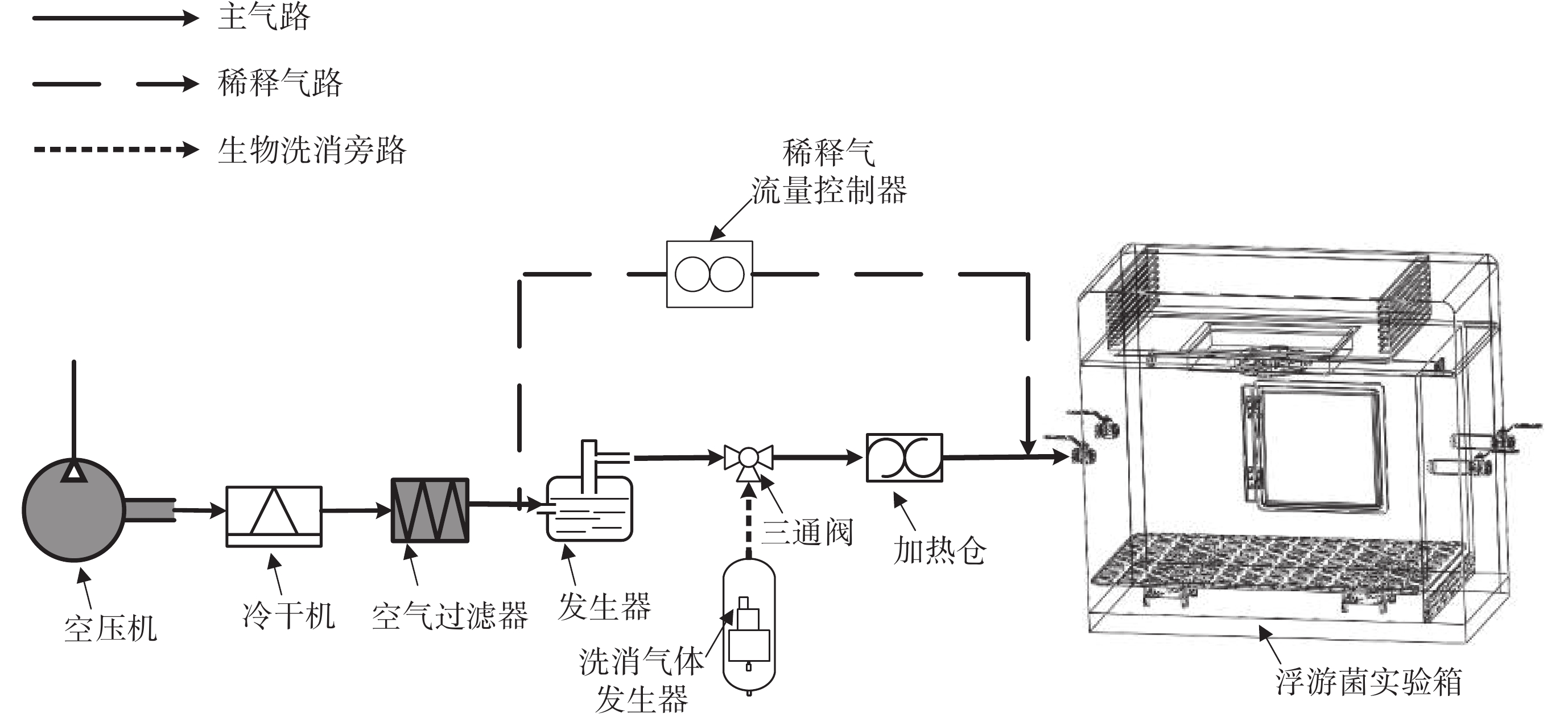
浮游菌微環境實驗箱系統包括空壓機、冷干機、空氣過濾器、發生器、二氧化氯消毒裝置、三通閥、加熱倉、稀釋氣流量控制器以及浮游菌實驗箱等功能單元。其裝置原理示意圖如圖 1 所示。
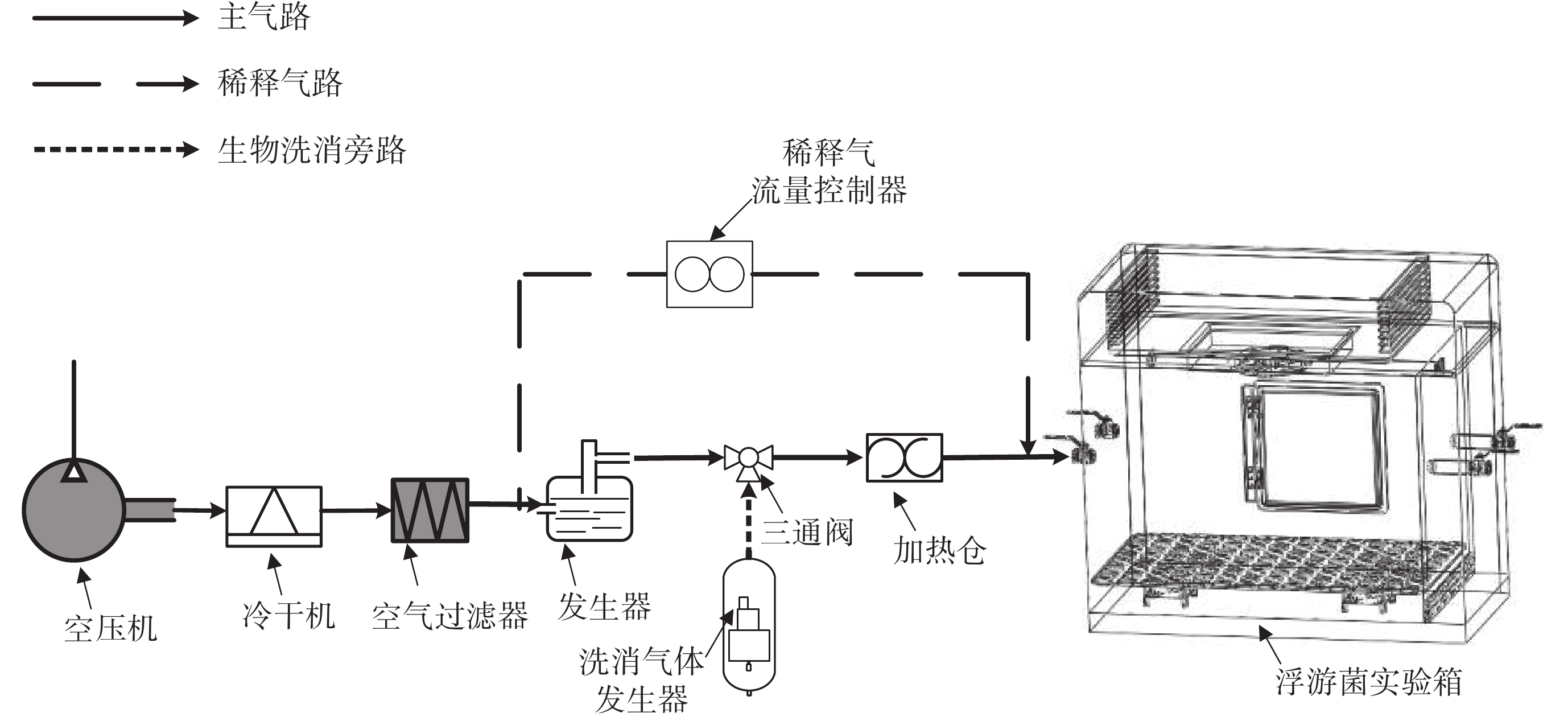 圖1
浮游菌微環境實驗箱系統原理示意圖
Figure1.
Schematic diagram of microenvironment test chamber for airborne microbe research
圖1
浮游菌微環境實驗箱系統原理示意圖
Figure1.
Schematic diagram of microenvironment test chamber for airborne microbe research
各功能模塊通過封閉的氣流管路進行物理連接,系統發生裝置以空壓機作為氣流動力輸出,首先經過冷干機去除氣源當中的液態水成分,然后經由空氣過濾器濾除氣流中包含的微小固態雜質,空壓機、冷干機以及空氣過濾器共同組成發生裝置的氣源外網,為發生過程提供潔凈穩定的氣流。
在此之后氣流分為兩部分。一部分氣流以恒定流速經過發生器,對發生器中裝盛的懸濁菌液進行分散發生,并在分散發生后通過干燥倉去除其表面包覆的大量水分;另一部分氣流則作為稀釋氣對發生后的浮游菌樣本進行稀釋,稀釋流量通過稀釋氣流量控制器進行控制,進而實現對進入實驗箱中浮游菌濃度的動態控制。兩路氣流在加熱倉的后級管路中匯聚混合,最終以樣本氣流中裹挾固相氣溶膠的形式進入浮游菌實驗箱。
1.2 實驗箱設計
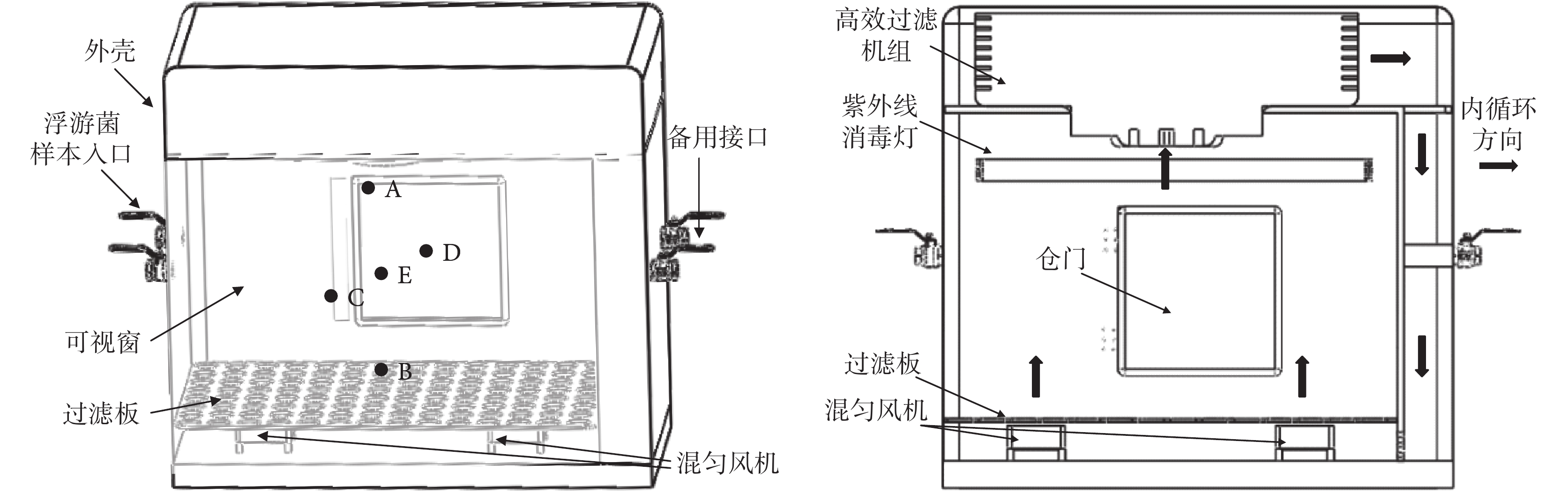
實驗箱作為浮游菌樣本制備的終端,是基于生物安全柜原理的有效改造,主要功用是實現對浮游菌的動態儲存和防護隔離,見圖 2。控制過程中通過壓力傳感器檢測實驗箱內的壓力,使箱內保持負壓狀態,以免浮游菌向外泄漏。實驗箱設計使用模式共有 4 種:樣本注入模式、樣本混勻模式、樣本采集模式和箱體自凈模式。
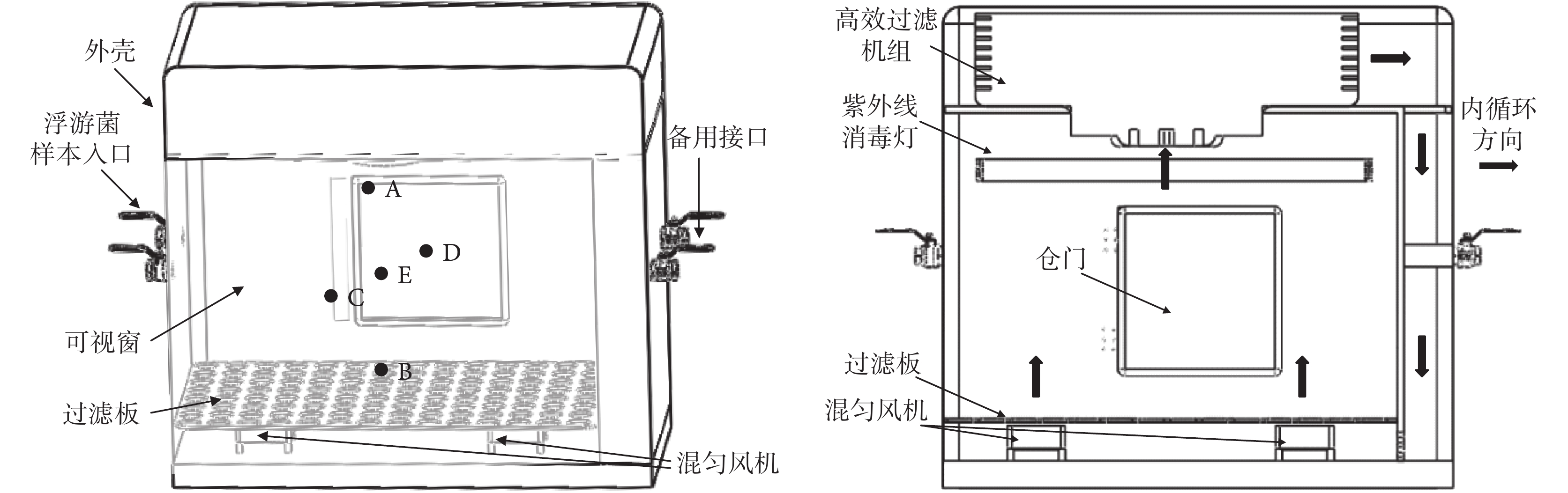 圖2
實驗箱設計原理圖
Figure2.
Schematic design of test chamber
圖2
實驗箱設計原理圖
Figure2.
Schematic design of test chamber
樣本注入模式下發生裝置處于產生浮游菌樣本狀態,實驗箱處于接收樣本狀態。在該模式下,樣本入口和呼吸口開啟,樣本通過入口進入箱體內部,并通過呼吸口在箱體內維持一定的負壓,呼吸口外接空氣過濾器防止浮游菌溢出。此時,混勻風扇處于工作狀態,防止浮游菌沉降積聚在箱體底部。
發生過程結束后,樣本混勻模式通過一定時間的氣流攪拌使浮游菌在箱體內部分布均勻。在該模式下,樣本入口和呼吸口同時關閉,依靠混勻風扇作為氣流動力源。箱內通過濕度傳感器實時檢測并控制加濕器調節濕度,20%~95%RH 范圍內可調。
樣本采集模式通常用來對浮游菌相關的采集或是監測裝置進行參數標定和性能評價。由于此類裝置的進樣原理不同,樣本采集模式存在兩種使用方法:一種是在發生浮游菌樣本前將待測試設備置于箱體內部多孔過濾板上,當進入采集模式后通過外部遙控或手套窗進行操作;另一種使用方法是將待測設備連備用接口并打開呼吸口,在箱體外完成采集操作。
箱體自凈模式指當測試結束后,箱體通過內部氣體自循環的方式完成凈化。在該模式下,樣本入口和呼吸口關閉,混勻風扇、紫外線消毒燈和高效過濾機組開啟。此時內部氣流按圖 2 中內循環方向所示以高效過濾機組和混勻風扇作為動力源,以過濾凈化和紫外線消毒完成倉體內部環境的自凈。
1.3 洗消和自凈過程設計
1.3.1 生物洗消旁路 實驗中浮游菌種類繁多,特性各異,為避免在多次測試過程中的交叉干擾,同時防止氣流管路被生物污染,系統中設計了生物洗消旁路實現封閉氣路的洗消。生物洗消旁路包括洗消氣體發生器和三通閥。當測試結束后,將三通閥選通到洗消旁路,洗消氣體發生器發生的洗消氣體流經樣本氣流管路,達到洗消管路的目的。在本系統中,洗消氣體發生器選用的是便攜式二氧化氯消毒裝置,其反應生成方式如式(1)所示。二氧化氯具有極強的殺菌能力(殺菌能力是氯氣的 5 倍、次氯酸鈉的 50 倍),能夠對浮游菌發生過程中所流經的氣流管路進行充分的洗消[10-11]。而且生成二氧化氯的反應生成物均對人體無害,洗消之后只需將三通閥切換到主氣路,將潔凈空氣通入管路中即可排出殘余在管路中的洗消氣體。
 |
1.3.2 箱內自凈過程 箱內自凈時間 t 是浮游菌實驗箱系統的一項重要參數。本研究在設計中提出以下假設:① 實驗箱工作在自凈模式時,任一時刻箱內的浮游菌濃度是空間均勻的;② 箱壁光滑,不考慮其對浮游菌的吸附影響。設箱內高效過濾機組的流量為 Q,過濾效率為 η,箱體內容積為 V,那么在 Δt 時間內箱體內氣溶膠減少個數 ΔS(t)可以表示為:
 |
將式(2)進行微分表達:
 |
對式(3)在時間區間(0,t)內進行定積分,得到:
 |
求解定積分,可得時刻 t 箱內濾除的浮游菌個數 S(t)與初始倉內濃度 S0 的比值(凈化率):
 |
根據實驗箱的實際使用需求,取箱內容積 V=1 m3,風機過濾機組 0.3 μm 以上氣溶膠過濾效率 η=100%,假定倉內初始 0.3 μm 以上粒徑的浮游菌濃度為 107個/m3 數量級(取值接近空氣中真實數量級),如果想要使自凈后的箱內 0.3 μm 以上粒徑的氣溶膠個數小于 10 個,那么自凈時間和風機過濾機組流量的乘積應該滿足:
 |
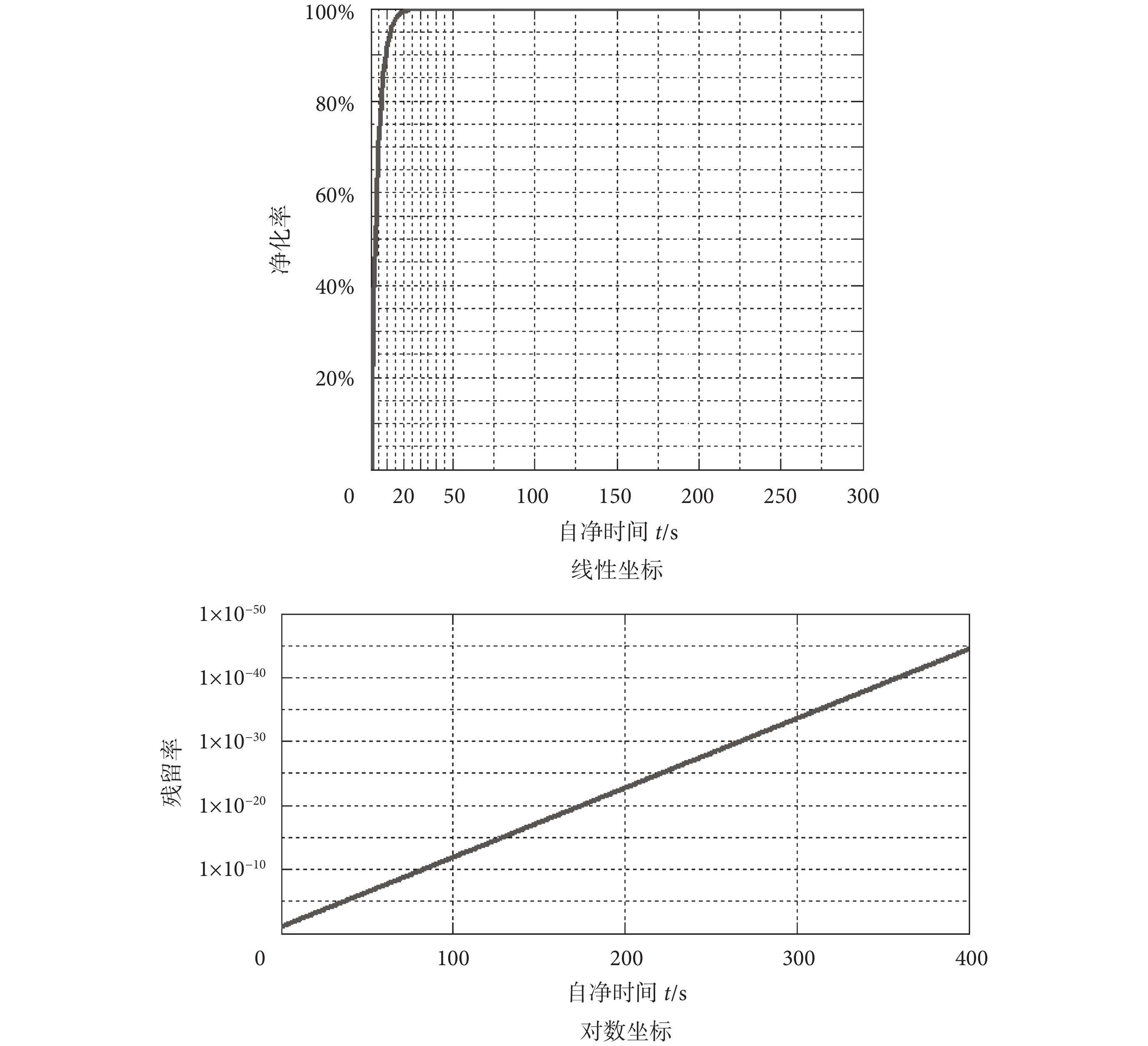
自凈時長是影響相關實驗效率的重要因素,假設理想的自凈時間小于 1 min,那么根據式(6)可計算得到風機過濾機組流量應大于 0.23 m3/s。根據以上實驗結論,設計選擇流量為 900 m3/h(0.25 m3/s)高效過濾機組,利用式(5)繪出自凈效率 S(t)/S 關于自凈時間 t 的變化曲線,見圖 3。
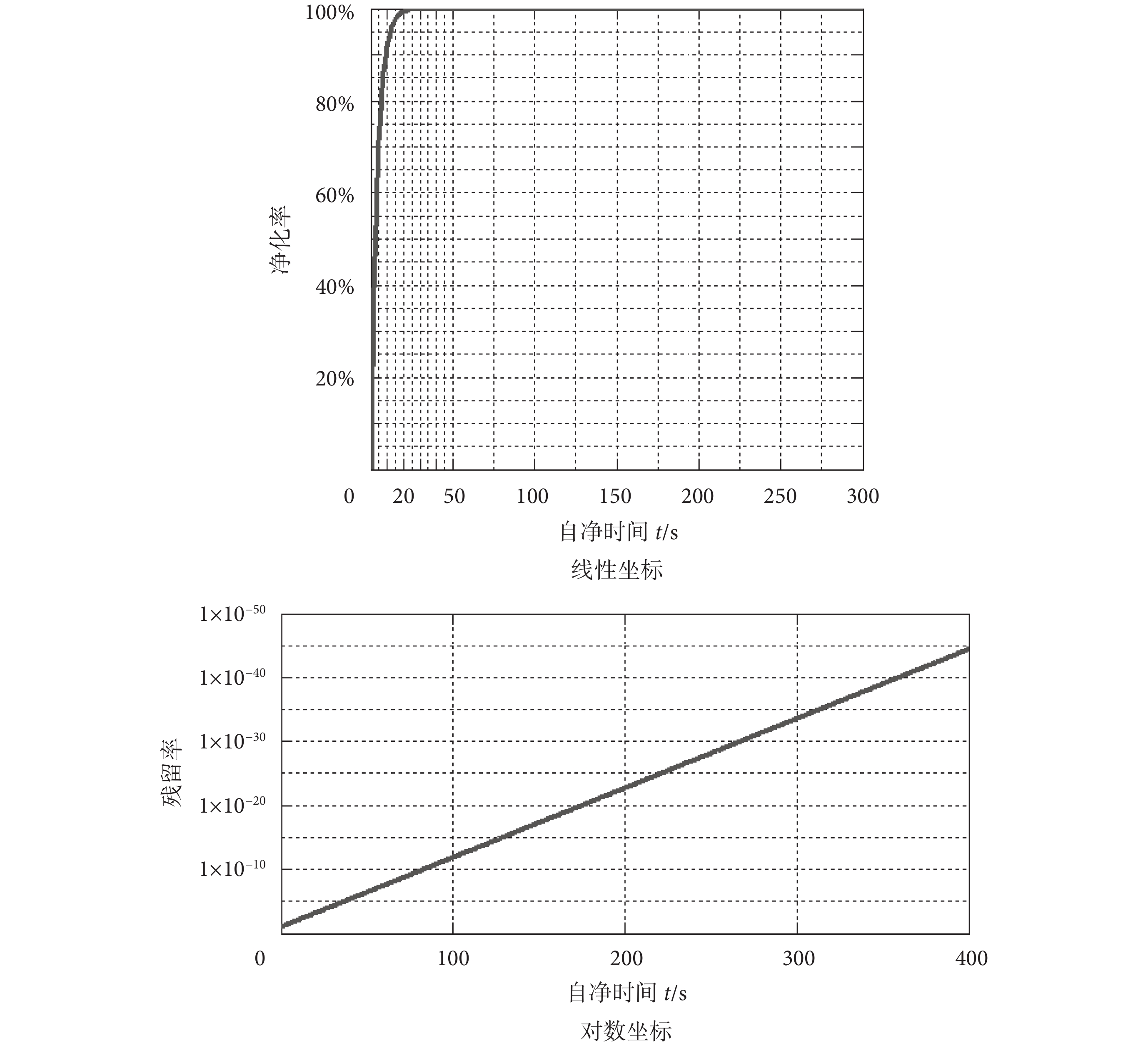 圖3
自凈效率曲線
Figure3.
Purification efficiency curve
圖3
自凈效率曲線
Figure3.
Purification efficiency curve
由圖 3 可以看出,10 s 的自凈時間就可以保證 90% 以上的凈化率,而當自凈時間延長到 100 s 時,粒子的殘留率甚至會小于百億分之一,即便是在最嚴苛的浮游菌背景下該效率值也可以滿足自凈需要。另外,由于風機過濾機組安裝在箱體頂部,而回風孔在底部位置,因此在自凈過程中箱內浮游菌濃度是沿垂直向上方向漸增的,也就是說微分方程(3)中的濃度表達式 S/V 比實際值略小,因此在實踐過程中實際的自凈效率會略高于上述計算得到的理論值。
2 數值模擬與實驗研究
2.1 實驗箱模型數值模擬
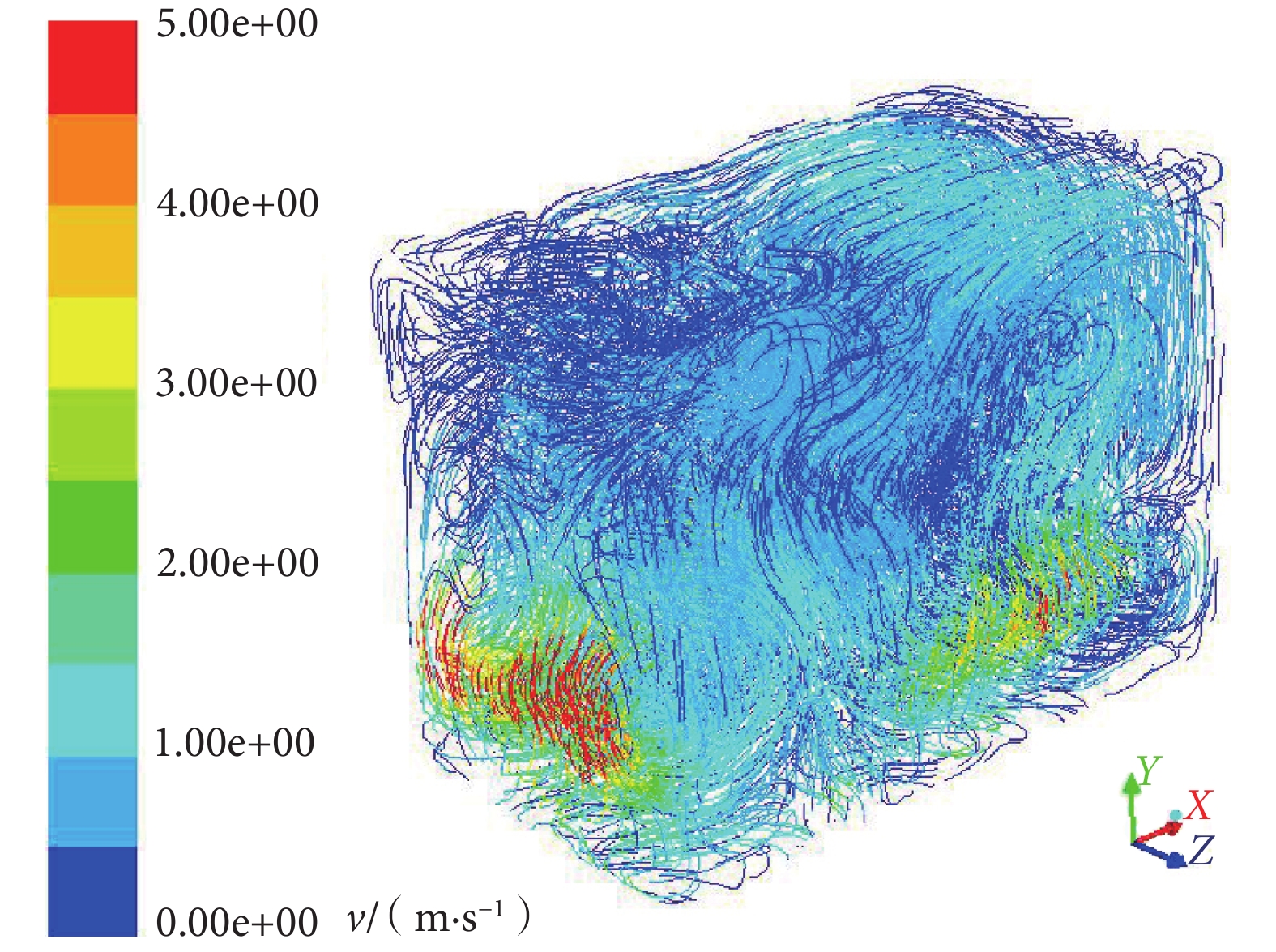
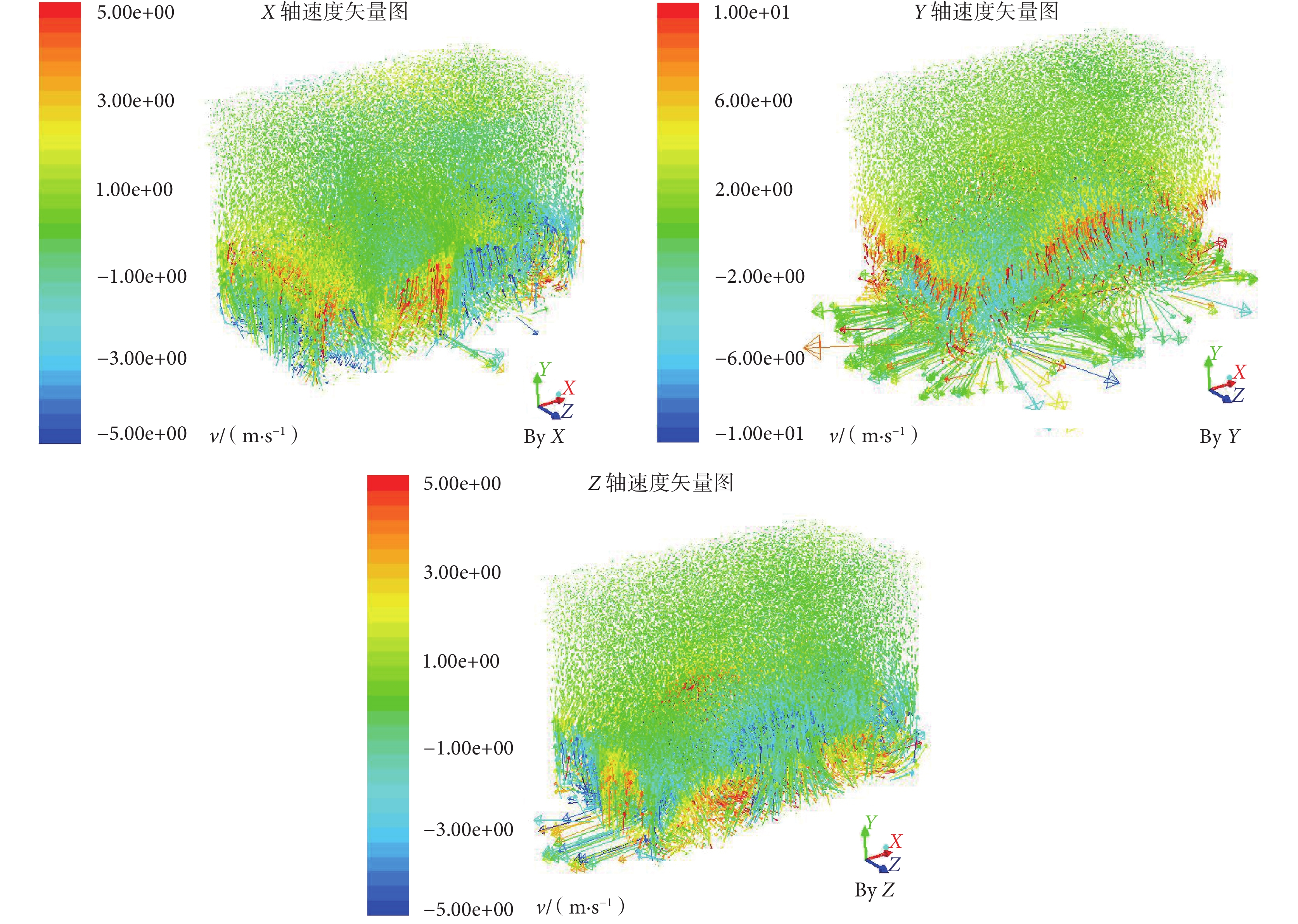
軸流風扇具有流量大、壓頭低等特點,被廣泛應用于多種需要進行氣體通風、攪拌的場合,能夠滿足實驗箱內浮游菌混勻分布的功能要求。本研究中在氣箱底部安裝 4 個軸流方向垂直向上的混勻風扇,使用 ANSYS 公司的計算流體力學軟件 Fluent 對浮游菌分布狀況進行數值模擬[12]。根據實驗箱的工程設計參數在 ICEM 中建立結構模型,采用四面體網格進行網格劃分,設置計算域和檢查網格質量。將實驗箱網格模型導入至 Fluent,基于壓力基模型對網格文件進行有限元分析。設置箱內流體介質為固定物性的常溫空氣 [1.29 kg/m3,1.789 4×10–5 kg/(m·s)],根據實驗箱底部 4 個軸流風機工作壓力編輯為 intake-fan 邊界條件(跳躍壓力 1 000 Pa),過濾板定義為Y 軸方向孔隙率 0.8 的多孔介質,箱壁設置為粗糙高度 0.03、粗糙常數 0.5 的壁面,設置迭代殘差為 10–5 對實驗模型進行迭代運算。仿真結果如圖 4、圖 5 所示。
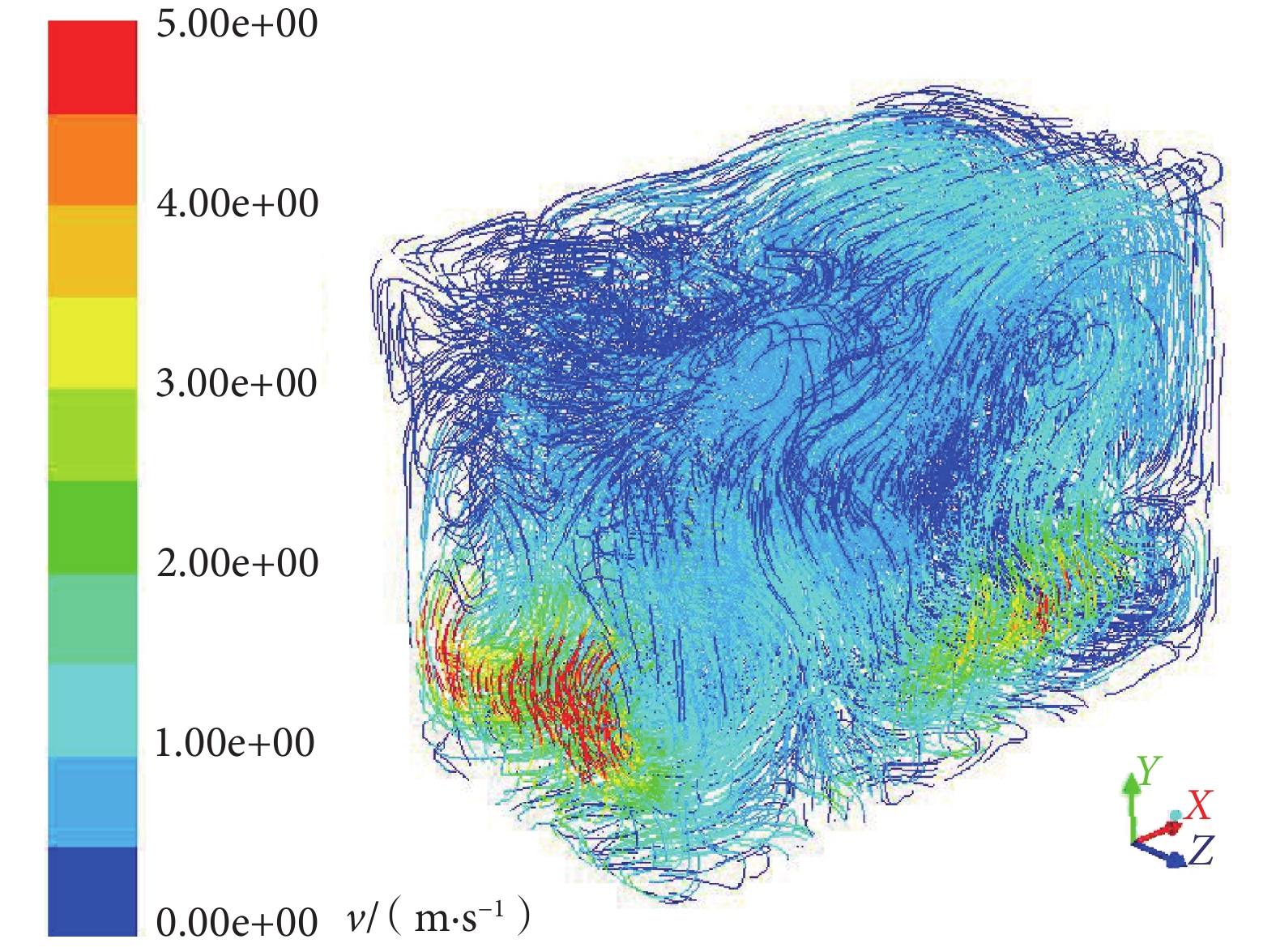 圖4
箱內氣流軌跡
Figure4.
Trajectory of air in the test chamber
圖4
箱內氣流軌跡
Figure4.
Trajectory of air in the test chamber
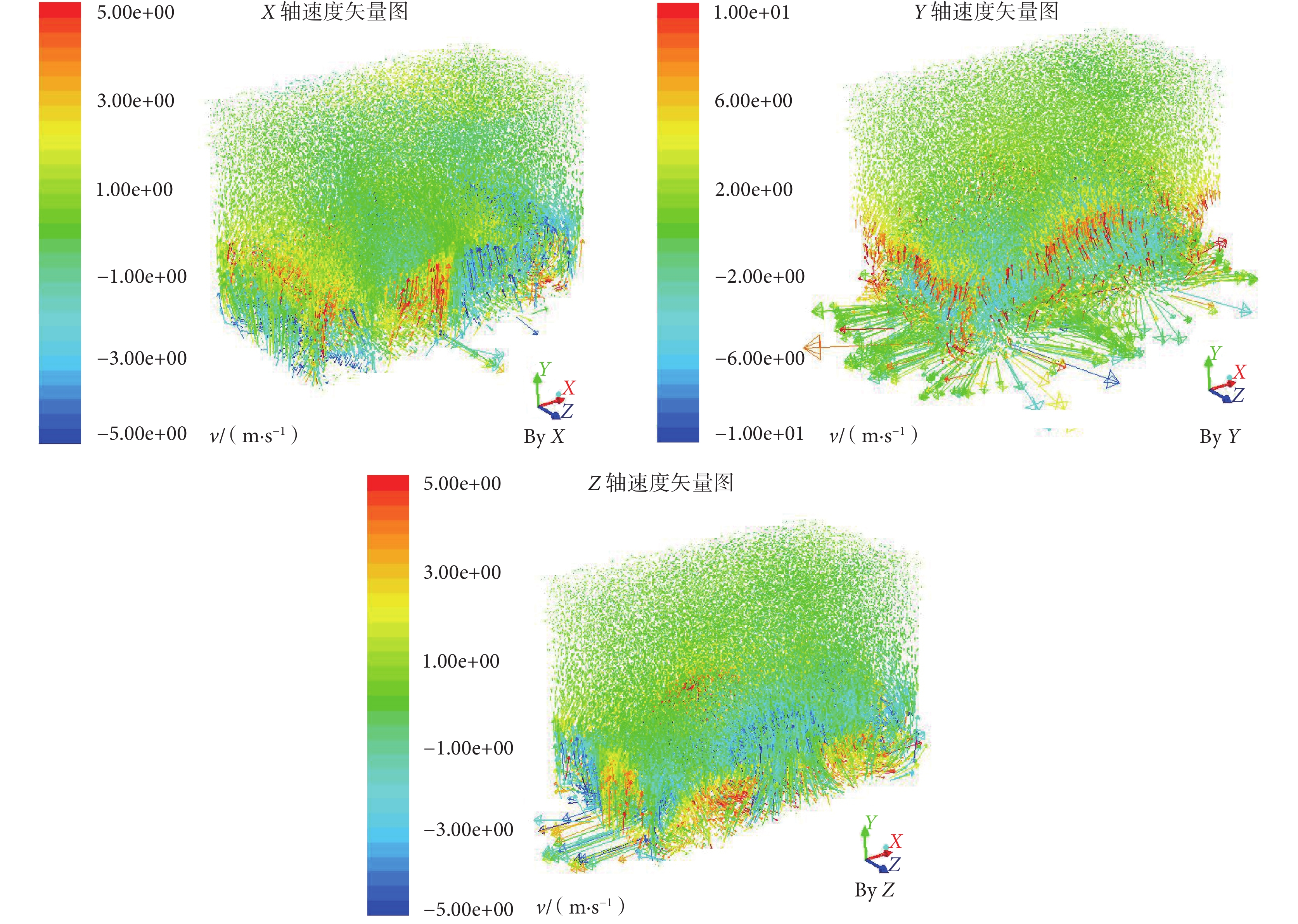 圖5
箱內氣流速度矢量
Figure5.
Airflow velocity vector in the chamber
圖5
箱內氣流速度矢量
Figure5.
Airflow velocity vector in the chamber
對箱內流動軌跡(見圖 4)加以分析,氣流從箱內底部逐步上升,隨著高度增加其速度逐步減小,最終為 0.20~0.70 m/s。對箱內流動速度矢量(見圖 5)進行分析,箱底部浮游菌會隨著風扇作用旋轉上升,在 X 軸和 Z 軸方向速度為 3.00~5.00 m/s,Y 軸方向速度為 8.00~9.00 m/s;在實驗箱中部,X 軸和 Z 軸方向速度下降至 1.30~2.00 m/s,Y 軸方向呈現出在 X-Z 平面上兩邊高中間低的趨勢,兩側速度為 3.00~4.00 m/s,中間大部分速度在 0.60~1.33 m/s;在實驗箱頂部 X 軸、Y 軸、Z 軸方向矢量均在 0.60~1.33 m/s。由此可知箱內中上部氣流速度較為一致,浮游菌能夠呈現出較好的懸浮狀態。同時由于底部風扇的新風效應,箱內浮游菌濃度分布會略有差異,具體表現為上部>中部>底部。因此,選擇實驗箱內 A(上)、B(下)、C(前)、D(后)和 E(中)共 5 個測量點(見圖 2),對浮游菌分布進行實驗驗證。
2.2 箱內浮游菌分布實驗驗證
2.2.1 實驗材料與設備 浮游菌微環境實驗箱系統,金黃色葡萄球菌(濃度數量級為 107 cfu/mL)懸濁液(Staphylococcus aureus,天津武警后勤學院),日本 Kanomax-3910 光散射式粒子計數器,可調節支架。
2.2.2 方法 ① 實驗箱內選擇 A、B、C、D、E 等 5 個點位;② 完成系統自凈 2 min;③ 啟動粒子計數器對各點位進行獨立計數,每次 1 min,測量 3 次取平均;④ 發菌工作 5 min;⑤ 重復步驟 ③;⑥ 完成統計分析。
2.2.3 實驗結果 各采樣點在系統自凈后和發菌后平均粒子計數見表 1。自凈 2 min 后,各采樣點平均粒子計數均在 10 以內,說明自凈后實驗箱內粒子數極少,是較為理想的浮游菌實驗微環境。發菌 5 min 后,各采樣點平均粒子濃度均達到了 107 個/m3 數量級,箱內濃度分布表現為上部略大于中部(A>E),中部略大于下部(E>B),且中部基本持平(C、D、E),基本上空間各點位粒子分布仍比較一致,細微分布差異或許由底部 4 個軸流混勻風扇導致。實驗結果與數值模擬結果較為一致,表明實驗箱系統能夠提供較為一致的浮游菌分布。
3 結論
浮游菌是衡量環境潔凈度的一項重要指標,作業環境與實驗環境的特殊性往往導致浮游菌的研究比較受限。在常規實驗條件下進行浮游菌研究時,往往需要一個微型、密閉的環境,一方面用于模擬有潔凈度要求的浮游菌存在環境,另一方面用于避免浮游菌外泄,確保工作環境生物安全。本研究設計并實現了一種用于浮游菌研究的微環境實驗箱系統,除具備生物防護功能外,數值模擬及實驗驗證均證明了該系統能夠提供浮游菌粒子分布較為一致的實驗環境。目前所研制的樣機已用于 50 余次實驗研究,包括常見浮游菌的發生、不同溫度下存活率、傳統采樣培養和生物粒子熒光計數等,與國內外其他同類研究得到了較為一致的實驗結果[7, 13],證明了該系統能夠較好地用于浮游菌研究。
引言
浮游菌(airborne microbe)是指懸浮在空氣中的,可通過培養基在適宜的生長條件下繁殖到可見菌落數的活性微生物粒子[1]。流行病學研究表明,醫院手術室、重癥監護病房(intensive care unit,ICU)等各類潔凈環境的浮游菌濃度與患者感染率呈正相關[2-3]。浮游菌的發生、存活、限制擴散、快速檢測和分布評價等研究已成為國內外研究的熱點[4]。
潔凈環境下直接對浮游菌進行研究存在兩方面的問題:一是容易對正常的作業活動造成干擾;二是存在攜帶污染。研究表明潔凈環境下人員活動會造成浮游菌濃度顯著升高[5]。因此,在對浮游菌進行研究時往往需要建立獨立的受控實驗環境。美國環保局(Environmental Protection Agency,EPA)在進行相關研究時建造了龐大的閉環風洞系統(20 m×14 m×1.5 m)[6],拜耳(Bayer HealthCare)則借助了美軍 Dugway 試驗場 150 m3 的微生物密閉艙完成測試[7]。鑒于在常規實驗室中達成這些實驗條件比較困難,本研究研制了一個浮游菌微環境密閉實驗箱系統,可用于對浮游菌的發生、存活自凈、采樣檢測和分布特性進行研究[8-9]。實驗箱內濕度可調,可模擬不同濕度條件下的浮游菌生存環境,同時箱內保持一定負壓,避免浮游菌外泄污染工作環境。
1 微環境實驗箱系統的設計
1.1 整體設計
浮游菌微環境實驗箱系統包括空壓機、冷干機、空氣過濾器、發生器、二氧化氯消毒裝置、三通閥、加熱倉、稀釋氣流量控制器以及浮游菌實驗箱等功能單元。其裝置原理示意圖如圖 1 所示。
 圖1
浮游菌微環境實驗箱系統原理示意圖
Figure1.
Schematic diagram of microenvironment test chamber for airborne microbe research
圖1
浮游菌微環境實驗箱系統原理示意圖
Figure1.
Schematic diagram of microenvironment test chamber for airborne microbe research
各功能模塊通過封閉的氣流管路進行物理連接,系統發生裝置以空壓機作為氣流動力輸出,首先經過冷干機去除氣源當中的液態水成分,然后經由空氣過濾器濾除氣流中包含的微小固態雜質,空壓機、冷干機以及空氣過濾器共同組成發生裝置的氣源外網,為發生過程提供潔凈穩定的氣流。
在此之后氣流分為兩部分。一部分氣流以恒定流速經過發生器,對發生器中裝盛的懸濁菌液進行分散發生,并在分散發生后通過干燥倉去除其表面包覆的大量水分;另一部分氣流則作為稀釋氣對發生后的浮游菌樣本進行稀釋,稀釋流量通過稀釋氣流量控制器進行控制,進而實現對進入實驗箱中浮游菌濃度的動態控制。兩路氣流在加熱倉的后級管路中匯聚混合,最終以樣本氣流中裹挾固相氣溶膠的形式進入浮游菌實驗箱。
1.2 實驗箱設計
實驗箱作為浮游菌樣本制備的終端,是基于生物安全柜原理的有效改造,主要功用是實現對浮游菌的動態儲存和防護隔離,見圖 2。控制過程中通過壓力傳感器檢測實驗箱內的壓力,使箱內保持負壓狀態,以免浮游菌向外泄漏。實驗箱設計使用模式共有 4 種:樣本注入模式、樣本混勻模式、樣本采集模式和箱體自凈模式。
 圖2
實驗箱設計原理圖
Figure2.
Schematic design of test chamber
圖2
實驗箱設計原理圖
Figure2.
Schematic design of test chamber
樣本注入模式下發生裝置處于產生浮游菌樣本狀態,實驗箱處于接收樣本狀態。在該模式下,樣本入口和呼吸口開啟,樣本通過入口進入箱體內部,并通過呼吸口在箱體內維持一定的負壓,呼吸口外接空氣過濾器防止浮游菌溢出。此時,混勻風扇處于工作狀態,防止浮游菌沉降積聚在箱體底部。
發生過程結束后,樣本混勻模式通過一定時間的氣流攪拌使浮游菌在箱體內部分布均勻。在該模式下,樣本入口和呼吸口同時關閉,依靠混勻風扇作為氣流動力源。箱內通過濕度傳感器實時檢測并控制加濕器調節濕度,20%~95%RH 范圍內可調。
樣本采集模式通常用來對浮游菌相關的采集或是監測裝置進行參數標定和性能評價。由于此類裝置的進樣原理不同,樣本采集模式存在兩種使用方法:一種是在發生浮游菌樣本前將待測試設備置于箱體內部多孔過濾板上,當進入采集模式后通過外部遙控或手套窗進行操作;另一種使用方法是將待測設備連備用接口并打開呼吸口,在箱體外完成采集操作。
箱體自凈模式指當測試結束后,箱體通過內部氣體自循環的方式完成凈化。在該模式下,樣本入口和呼吸口關閉,混勻風扇、紫外線消毒燈和高效過濾機組開啟。此時內部氣流按圖 2 中內循環方向所示以高效過濾機組和混勻風扇作為動力源,以過濾凈化和紫外線消毒完成倉體內部環境的自凈。
1.3 洗消和自凈過程設計
1.3.1 生物洗消旁路 實驗中浮游菌種類繁多,特性各異,為避免在多次測試過程中的交叉干擾,同時防止氣流管路被生物污染,系統中設計了生物洗消旁路實現封閉氣路的洗消。生物洗消旁路包括洗消氣體發生器和三通閥。當測試結束后,將三通閥選通到洗消旁路,洗消氣體發生器發生的洗消氣體流經樣本氣流管路,達到洗消管路的目的。在本系統中,洗消氣體發生器選用的是便攜式二氧化氯消毒裝置,其反應生成方式如式(1)所示。二氧化氯具有極強的殺菌能力(殺菌能力是氯氣的 5 倍、次氯酸鈉的 50 倍),能夠對浮游菌發生過程中所流經的氣流管路進行充分的洗消[10-11]。而且生成二氧化氯的反應生成物均對人體無害,洗消之后只需將三通閥切換到主氣路,將潔凈空氣通入管路中即可排出殘余在管路中的洗消氣體。
 |
1.3.2 箱內自凈過程 箱內自凈時間 t 是浮游菌實驗箱系統的一項重要參數。本研究在設計中提出以下假設:① 實驗箱工作在自凈模式時,任一時刻箱內的浮游菌濃度是空間均勻的;② 箱壁光滑,不考慮其對浮游菌的吸附影響。設箱內高效過濾機組的流量為 Q,過濾效率為 η,箱體內容積為 V,那么在 Δt 時間內箱體內氣溶膠減少個數 ΔS(t)可以表示為:
 |
將式(2)進行微分表達:
 |
對式(3)在時間區間(0,t)內進行定積分,得到:
 |
求解定積分,可得時刻 t 箱內濾除的浮游菌個數 S(t)與初始倉內濃度 S0 的比值(凈化率):
 |
根據實驗箱的實際使用需求,取箱內容積 V=1 m3,風機過濾機組 0.3 μm 以上氣溶膠過濾效率 η=100%,假定倉內初始 0.3 μm 以上粒徑的浮游菌濃度為 107個/m3 數量級(取值接近空氣中真實數量級),如果想要使自凈后的箱內 0.3 μm 以上粒徑的氣溶膠個數小于 10 個,那么自凈時間和風機過濾機組流量的乘積應該滿足:
 |
自凈時長是影響相關實驗效率的重要因素,假設理想的自凈時間小于 1 min,那么根據式(6)可計算得到風機過濾機組流量應大于 0.23 m3/s。根據以上實驗結論,設計選擇流量為 900 m3/h(0.25 m3/s)高效過濾機組,利用式(5)繪出自凈效率 S(t)/S 關于自凈時間 t 的變化曲線,見圖 3。
 圖3
自凈效率曲線
Figure3.
Purification efficiency curve
圖3
自凈效率曲線
Figure3.
Purification efficiency curve
由圖 3 可以看出,10 s 的自凈時間就可以保證 90% 以上的凈化率,而當自凈時間延長到 100 s 時,粒子的殘留率甚至會小于百億分之一,即便是在最嚴苛的浮游菌背景下該效率值也可以滿足自凈需要。另外,由于風機過濾機組安裝在箱體頂部,而回風孔在底部位置,因此在自凈過程中箱內浮游菌濃度是沿垂直向上方向漸增的,也就是說微分方程(3)中的濃度表達式 S/V 比實際值略小,因此在實踐過程中實際的自凈效率會略高于上述計算得到的理論值。
2 數值模擬與實驗研究
2.1 實驗箱模型數值模擬
軸流風扇具有流量大、壓頭低等特點,被廣泛應用于多種需要進行氣體通風、攪拌的場合,能夠滿足實驗箱內浮游菌混勻分布的功能要求。本研究中在氣箱底部安裝 4 個軸流方向垂直向上的混勻風扇,使用 ANSYS 公司的計算流體力學軟件 Fluent 對浮游菌分布狀況進行數值模擬[12]。根據實驗箱的工程設計參數在 ICEM 中建立結構模型,采用四面體網格進行網格劃分,設置計算域和檢查網格質量。將實驗箱網格模型導入至 Fluent,基于壓力基模型對網格文件進行有限元分析。設置箱內流體介質為固定物性的常溫空氣 [1.29 kg/m3,1.789 4×10–5 kg/(m·s)],根據實驗箱底部 4 個軸流風機工作壓力編輯為 intake-fan 邊界條件(跳躍壓力 1 000 Pa),過濾板定義為Y 軸方向孔隙率 0.8 的多孔介質,箱壁設置為粗糙高度 0.03、粗糙常數 0.5 的壁面,設置迭代殘差為 10–5 對實驗模型進行迭代運算。仿真結果如圖 4、圖 5 所示。
 圖4
箱內氣流軌跡
Figure4.
Trajectory of air in the test chamber
圖4
箱內氣流軌跡
Figure4.
Trajectory of air in the test chamber
 圖5
箱內氣流速度矢量
Figure5.
Airflow velocity vector in the chamber
圖5
箱內氣流速度矢量
Figure5.
Airflow velocity vector in the chamber
對箱內流動軌跡(見圖 4)加以分析,氣流從箱內底部逐步上升,隨著高度增加其速度逐步減小,最終為 0.20~0.70 m/s。對箱內流動速度矢量(見圖 5)進行分析,箱底部浮游菌會隨著風扇作用旋轉上升,在 X 軸和 Z 軸方向速度為 3.00~5.00 m/s,Y 軸方向速度為 8.00~9.00 m/s;在實驗箱中部,X 軸和 Z 軸方向速度下降至 1.30~2.00 m/s,Y 軸方向呈現出在 X-Z 平面上兩邊高中間低的趨勢,兩側速度為 3.00~4.00 m/s,中間大部分速度在 0.60~1.33 m/s;在實驗箱頂部 X 軸、Y 軸、Z 軸方向矢量均在 0.60~1.33 m/s。由此可知箱內中上部氣流速度較為一致,浮游菌能夠呈現出較好的懸浮狀態。同時由于底部風扇的新風效應,箱內浮游菌濃度分布會略有差異,具體表現為上部>中部>底部。因此,選擇實驗箱內 A(上)、B(下)、C(前)、D(后)和 E(中)共 5 個測量點(見圖 2),對浮游菌分布進行實驗驗證。
2.2 箱內浮游菌分布實驗驗證
2.2.1 實驗材料與設備 浮游菌微環境實驗箱系統,金黃色葡萄球菌(濃度數量級為 107 cfu/mL)懸濁液(Staphylococcus aureus,天津武警后勤學院),日本 Kanomax-3910 光散射式粒子計數器,可調節支架。
2.2.2 方法 ① 實驗箱內選擇 A、B、C、D、E 等 5 個點位;② 完成系統自凈 2 min;③ 啟動粒子計數器對各點位進行獨立計數,每次 1 min,測量 3 次取平均;④ 發菌工作 5 min;⑤ 重復步驟 ③;⑥ 完成統計分析。
2.2.3 實驗結果 各采樣點在系統自凈后和發菌后平均粒子計數見表 1。自凈 2 min 后,各采樣點平均粒子計數均在 10 以內,說明自凈后實驗箱內粒子數極少,是較為理想的浮游菌實驗微環境。發菌 5 min 后,各采樣點平均粒子濃度均達到了 107 個/m3 數量級,箱內濃度分布表現為上部略大于中部(A>E),中部略大于下部(E>B),且中部基本持平(C、D、E),基本上空間各點位粒子分布仍比較一致,細微分布差異或許由底部 4 個軸流混勻風扇導致。實驗結果與數值模擬結果較為一致,表明實驗箱系統能夠提供較為一致的浮游菌分布。
3 結論
浮游菌是衡量環境潔凈度的一項重要指標,作業環境與實驗環境的特殊性往往導致浮游菌的研究比較受限。在常規實驗條件下進行浮游菌研究時,往往需要一個微型、密閉的環境,一方面用于模擬有潔凈度要求的浮游菌存在環境,另一方面用于避免浮游菌外泄,確保工作環境生物安全。本研究設計并實現了一種用于浮游菌研究的微環境實驗箱系統,除具備生物防護功能外,數值模擬及實驗驗證均證明了該系統能夠提供浮游菌粒子分布較為一致的實驗環境。目前所研制的樣機已用于 50 余次實驗研究,包括常見浮游菌的發生、不同溫度下存活率、傳統采樣培養和生物粒子熒光計數等,與國內外其他同類研究得到了較為一致的實驗結果[7, 13],證明了該系統能夠較好地用于浮游菌研究。