運用表面引發原子轉移自由基聚合反應(SI-ATRP)在玻璃表面構建甲基丙烯酸聚乙二醇酯(PEGMA)-甲基丙烯酸縮水甘油酯(GMA)的二元嵌段共聚物(PEGMA-GMA),然后利用 GMA 中豐富的環氧基團將內皮細胞選擇性多肽精氨酸-谷氨酸-天冬氨酸-纈氨酸(REDV)通過開環反應固定在 PEGMA-GMA 聚合物刷的末端。采用靜態水接觸角、X 射線光電子能譜(XPS)以及原子力顯微鏡(AFM)等對聚合物刷的結構和親水性能進行了表征,結果證明在玻璃基材表面成功構建了 REDV 多肽修飾的二元嵌段共聚物刷;同時利用紫外-可見吸收光譜(UV-Vis)對表面固定的 REDV 進行了定量表征。最后采用復鈣化凝血時間和血小板黏附實驗對涂層的血液相容性進行表征,結果顯示聚合物涂層具有良好的血液相容性。這種修飾多肽的聚乙二醇生物活性涂層為后續表面內皮化研究奠定了良好的前期基礎。
引用本文: 魏雨, 張景迅, 張玉忠, 馮先濤, 楊炫煌. 玻璃表面可控聚乙二醇生物活性涂層構建及其血液相容性研究. 生物醫學工程學雜志, 2019, 36(2): 260-266. doi: 10.7507/1001-5515.201705032 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
藥物洗脫支架是目前介入治療心血管疾病最主要的手段,而由于藥物釋放帶來的血管內皮延遲愈合,以及繼而引發的晚期血栓等不良事件,是限制心血管支架臨床應用的主要問題[1-3]。因此,材料表面的內皮化程度是影響生物材料體內應用的重要因素。采用一定手段對材料表面進行修飾改性,特異性固定可以促進內皮細胞黏附的生物分子,以此增強惰性材料表面的內皮細胞選擇性以及促進表面內皮化程度,是解決支架現有晚期血栓、再狹窄等不良問題的有效手段之一[4-7]。
在功能性材料的制備中,材料表面的改性是一項重要的研究內容。前期研究中,我們采用表面涂覆方法構建了多肽修飾的內皮細胞選擇涂層[7],并比較了不同多肽接枝后表面的內皮化效果[8]。該方法涂覆方便,但存在接枝密度不可控以及結合力不牢固的問題。為了克服這些問題,在本研究中,我們擬采用表面引發的原子轉移自由基聚合方法(surface-initiated atom transfer radical polymerization,SI-ATRP)在玻璃基材表面構建多肽修飾的生物活性涂層。SI-ATRP 為近年來發展起來的一種新技術[9]。尤其在生物材料領域,該技術能夠在生物材料表面形成一層結構致密的聚合物分子刷(polymer brush),改善涂層黏附力,從而改變材料表面的固有性質,構建良好的生物抗污表面[10-11]。聚乙二醇類材料(poly(ethylene glycol),PEG)因其優異的抗蛋白質、血小板等非特異性阻抗性能,廣泛用于心血管植入材料的表面改性[12-15]。此外,甲基丙烯酸縮水甘油酯(glycidyl methacrylate,GMA)側鏈含有大量的環氧基團,能夠通過開環反應特異性固定生物活性分子[16-18]。惰性材料和活性分子的協同作用可以有效實現材料表面特定生物分子的特異性吸附。在現有表面固定生物活性分子的研究中,多肽精氨酸-谷氨酸-天冬氨酸-纈氨酸(Arg-Glu-Asp-Val,REDV)可被主要在內皮細胞膜中表達的整合素 α4β1 特異性識別,而不引起平滑肌細胞的增殖。Plouffe 等[19]在微流道表面固定 REDV 后發現,內皮細胞、平滑肌細胞和成纖維細胞混合液通過微流道表面時能夠實現混合體系中內皮細胞的選擇性黏附,再結合 PEG 對平滑肌細胞的非選擇性抑制,二者協同作用構建的涂層可以有效阻抗表面平滑肌細胞非特異性黏附,同時促進內皮細胞的選擇性生長和遷移,且不同的接枝密度可以調控內皮細胞和平滑肌細胞在表面的增殖量和增殖比例[20]。
基于此,本文在前期研究的基礎上,探索采用 SI-ATRP 技術取代原有的表面涂覆方法,在玻璃基材表面構建甲基丙烯酸聚乙二醇酯和甲基丙烯酸縮水甘油酯(poly(ethylene glycol) methacrylate-block-glycidyl methacrylate,PEGMA-GMA)的雙嵌段共聚物刷,并利用 GMA 側鏈的環氧基團開環固定具有內皮細胞選擇性的 REDV 活性多肽,從而在基材表面形成致密牢固的多肽修飾生物活性涂層。通過不同表征手段對表面結構、形貌和 REDV 接枝量進行了表征,并對涂層的血液相容性進行了研究。
1 實驗
1.1 材料與試劑
PEGMA(分子量 950)、GMA、3-氨基丙基三乙氧基硅烷(APTES)、2-溴異丁酰溴(BIBB)、2,2’-聯吡啶(Bpy)、溴化亞銅(CuBr)均購自 Aldrich 公司(美國),甲醇、二氯甲烷等有機試劑購自阿拉丁試劑(上海)有限公司。以上試劑均為分析純。REDV 購自吉爾生化(上海)有限公司。
1.2 玻璃表面 SI-ATRP 引發劑制備
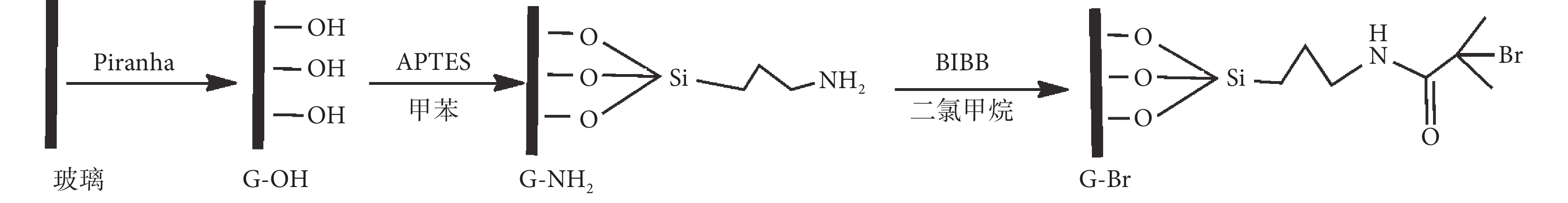
載玻片切割成 1 cm × 1 cm 大小,用“Piranha”溶液(96% H2SO4∶30% H2O2 = 7∶3,V/V)浸泡清洗 10 min 后,超聲洗滌真空干燥備用。將清洗后的玻璃片浸入含有 APTES 的無水甲苯溶液中,在氮氣保護下反應過夜,分別用甲苯、丙酮超聲洗滌真空干燥,得到富含氨基的表面。將偶聯劑改性后的玻璃放入已滴加 α-溴代異丁酰溴和三乙胺的二氯甲烷溶液中,避光室溫反應 12 h,依次用甲苯、丙酮-水混合液和丙酮超聲洗滌,真空干燥,獲得玻璃片 SI-ATRP 引發劑。如圖 1 所示。
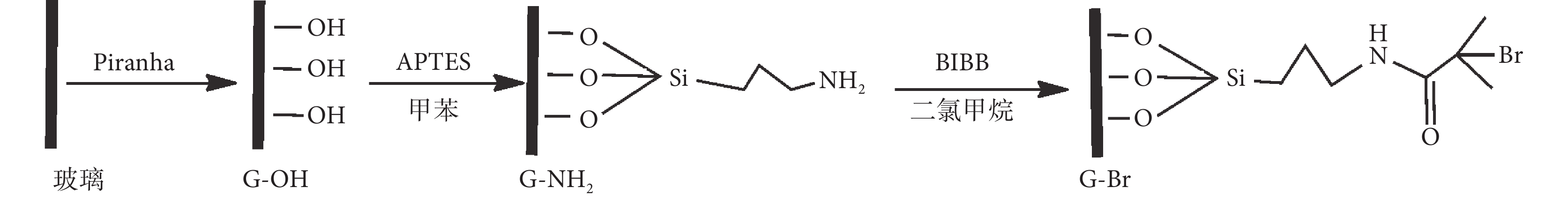 圖1
玻璃表面引發劑合成路線
Figure1.
Formation of the ATRP initiator layer on glass substrate
圖1
玻璃表面引發劑合成路線
Figure1.
Formation of the ATRP initiator layer on glass substrate
1.3 PEGMA-GMA 聚合物刷的制備
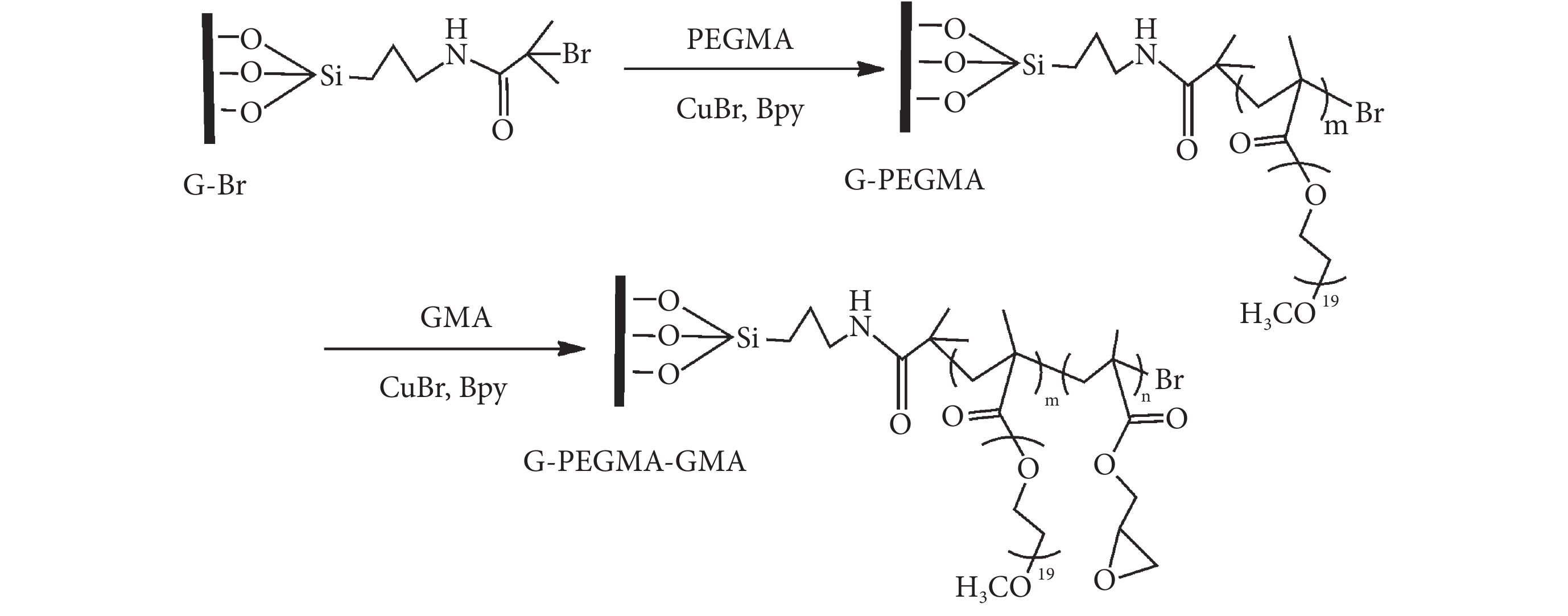
將固定引發劑的玻璃片和 PEGMA、超純水、甲醇、Bpy、CuBr 配制成的反應溶液一起加入到真空除氧的反應裝置內,室溫聚合 12 h,之后將玻璃片清洗并用氮氣吹干,得到 PEGMA 修飾的表面(G-PEGMA)。 將超純水、甲醇、GMA、CuBr 和 Bpy 配制成反應液,除去氧氣后加入到裝有 G-PEGMA 的反應裝置中,氮氣保護下反應過夜,清洗氮氣吹干后真空干燥保存。反應過程如圖 2 所示。
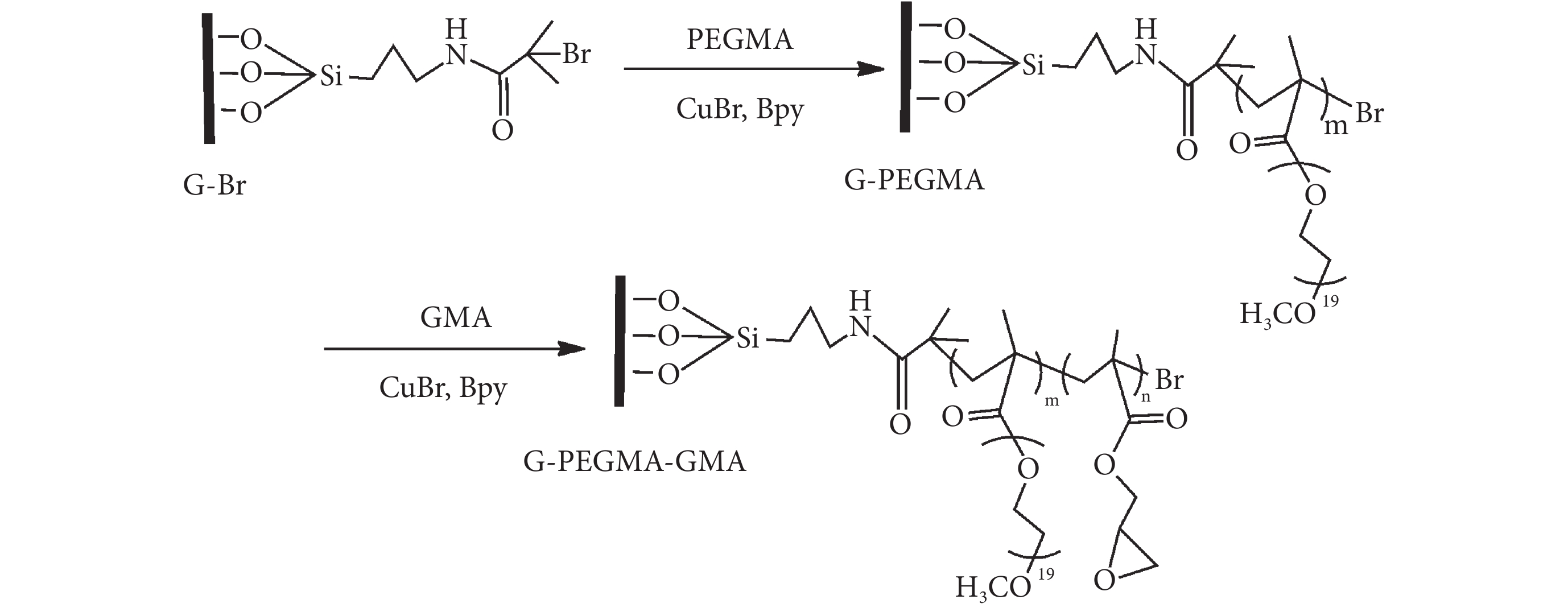 圖2
玻璃表面 PEGMA-GMA 聚合物刷合成過程
Figure2.
Synthesis procedure of PEGMA-GMA copolymer brushes on glass substrate
圖2
玻璃表面 PEGMA-GMA 聚合物刷合成過程
Figure2.
Synthesis procedure of PEGMA-GMA copolymer brushes on glass substrate
1.4 REDV 活性分子的表面固定
REDV 與 GMA 聚合物刷末端的環氧基團可以發生開環反應,具體反應過程如下:將 G-PEGMA-GMA 樣品浸入 20 μg/mL 的 REDV 多肽 PBS 溶液中(pH = 7.5),室溫反應 24 h,隨后放入賴氨酸溶液中 6 h,以消除沒有與多肽反應的環氧基團,蒸餾水清洗,氮氣吹干。
1.5 材料表面表征
表面化學結構組成采用 X 射線光電子能譜(X-ray photoelectron spectroscopy,XPS,AXIS-HSi,島津,日本)進行測試,表面形貌采用原子力顯微鏡(atomic force microscope,AFM,MultiMode8,布魯克,德國)測定,靜態水接觸角采用自動水接觸角儀(SL200C,科諾,美國)進行測量,REDV 的接枝量由紫外-可見分光光度儀(ultraviolet–visible spectroscopy,UV-VIS,UV-2450,島津,日本)表征。
1.6 血液相容性表征[21 ]
1.6.1 復鈣化凝血時間測試
將已預熱至 37℃ 的人體抗凝血漿(已除 Ca2+)100 μL 和生理鹽水 100 μL 依次加入到內表面已修飾聚合物刷的硅化玻璃管中,將試管靜置于 37℃ 恒溫水浴中 60 s 后,加入 100 μL 已預熱的 0.025 mol/L CaCl2 溶液,開始計時。將自制不銹鋼鉤針在玻璃管中緩慢攪動,直至不銹鋼鉤針開始出現絲狀纖維蛋白,停止計時,此時間即復鈣化凝血時間。并以空白玻璃管和 PEGMA 修飾的惰性玻璃管作為參照,每種樣品平行測定 6 次,取其平均值即樣品的最終復鈣化時間。采用 origin8.5 軟件對實驗數據進行統計學分析,采用平均值 ± 標準差表示實驗結果。組間比較采用 t 檢驗,當 P < 0.05 時視為差異有統計學意義。
1.6.2 血小板黏附
取現抽 10 mL 新鮮抗凝全血于離心管中,離心(1 000 r/min)10 min,得上層清液即為富血小板血漿(platelet rich plasma,PRP)。將玻璃裸材與經相應修飾后的材料分別置于潔凈濾紙上,用微量進樣器移取 20 μL PRP 于玻璃裸材和經相應修飾后的材料,并與修飾后的材料接觸 30 min,然后用 PBS 緩沖液(pH7.4)小心清洗表面以除去黏附不牢的血小板。將玻璃裸材與經相應修飾后的材料分別浸入 1% 戊二醛固定液中固定 30 min,然后用純水清洗表面 3 次,再依次用 10%、30%、50%、70%、90%、100%(V/V)乙醇/水梯度溶液浸洗,使黏附的血小板脫水。自然干燥后置于干燥器中保存。使用場發射掃描電子顯微鏡對玻璃裸材與經相應修飾后的材料表面黏附的血小板形貌進行表征。
2 結果與討論
2.1 表面化學組成分析
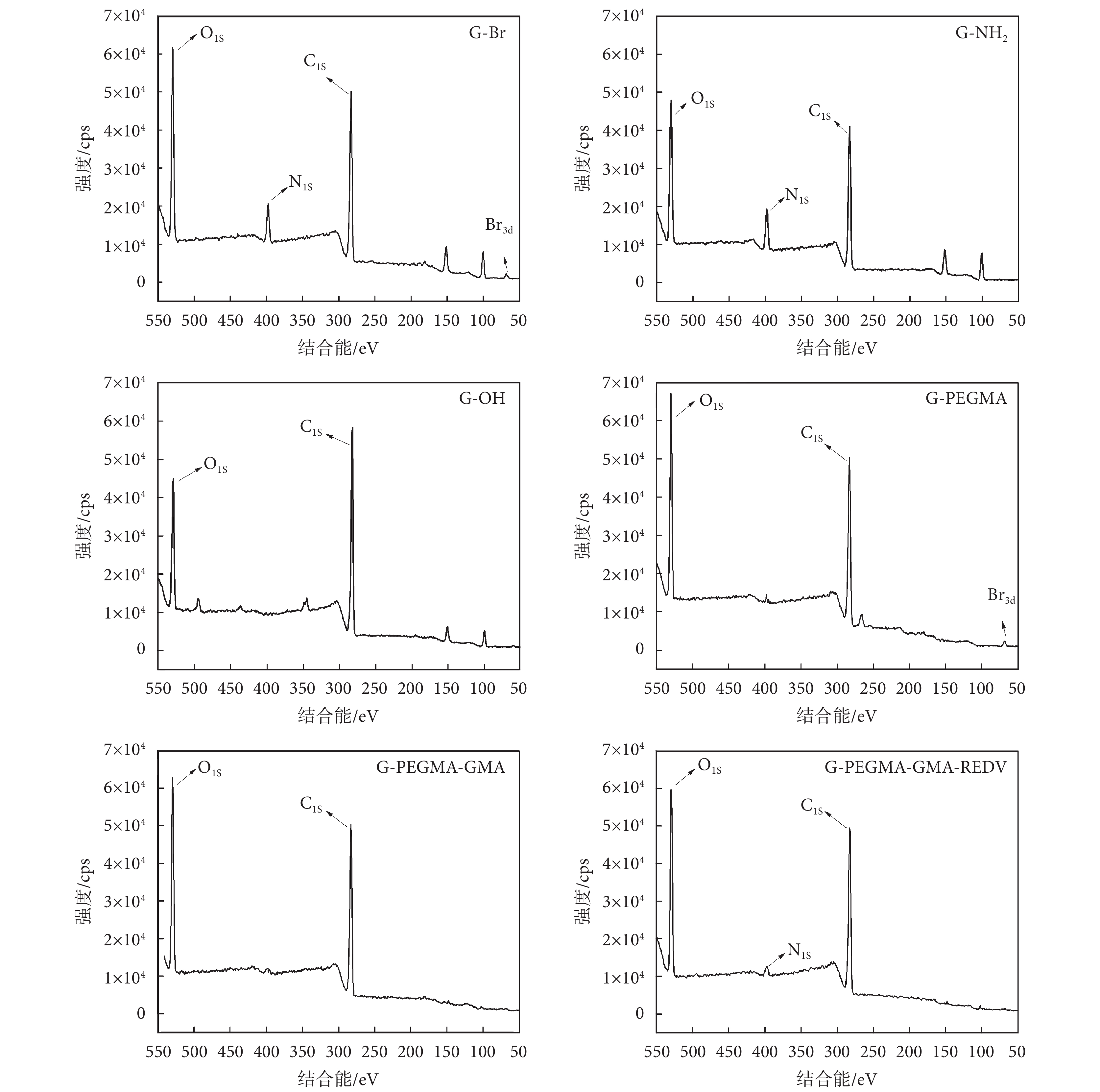
圖 3 給出了玻璃基材表面以及經過不同接枝反應后的表面結構組成的 XPS 表征結果。由于玻璃本身成分復雜,可以看出未改性的玻璃基材表面(G-OH)有較多雜峰,其中 103 eV 和 155 eV 分別屬于 Si2p 和 Si2s 元素。修飾 APTES 后,玻璃表面的譜圖中出現了氮元素的 N1s(400 eV)特征峰,證明玻璃基材表面成功修飾上了氨基基團(G-NH2)。當表面進一步固定 BIBB 引發劑后,譜圖中出現了溴元素(68 eV,Br3d)的特征峰,證明引發劑已成功接枝在玻璃表面(G-Br)。繼續修飾 PEGMA 聚合物(G-PEGMA)和 GMA 聚合物(G-PEGMA-GMA)后,表面基本被聚合物刷所覆蓋,氮元素和硅元素的特征峰大大減小;在聚合物刷末端開環固定 REDV 活性分子后(G-PEGMA-GMA-REDV),由于多肽中的氨基存在,使得表面又出現了 N1s(400 eV)的特征峰,表明 REDV 多肽已成功接枝到基材表面。
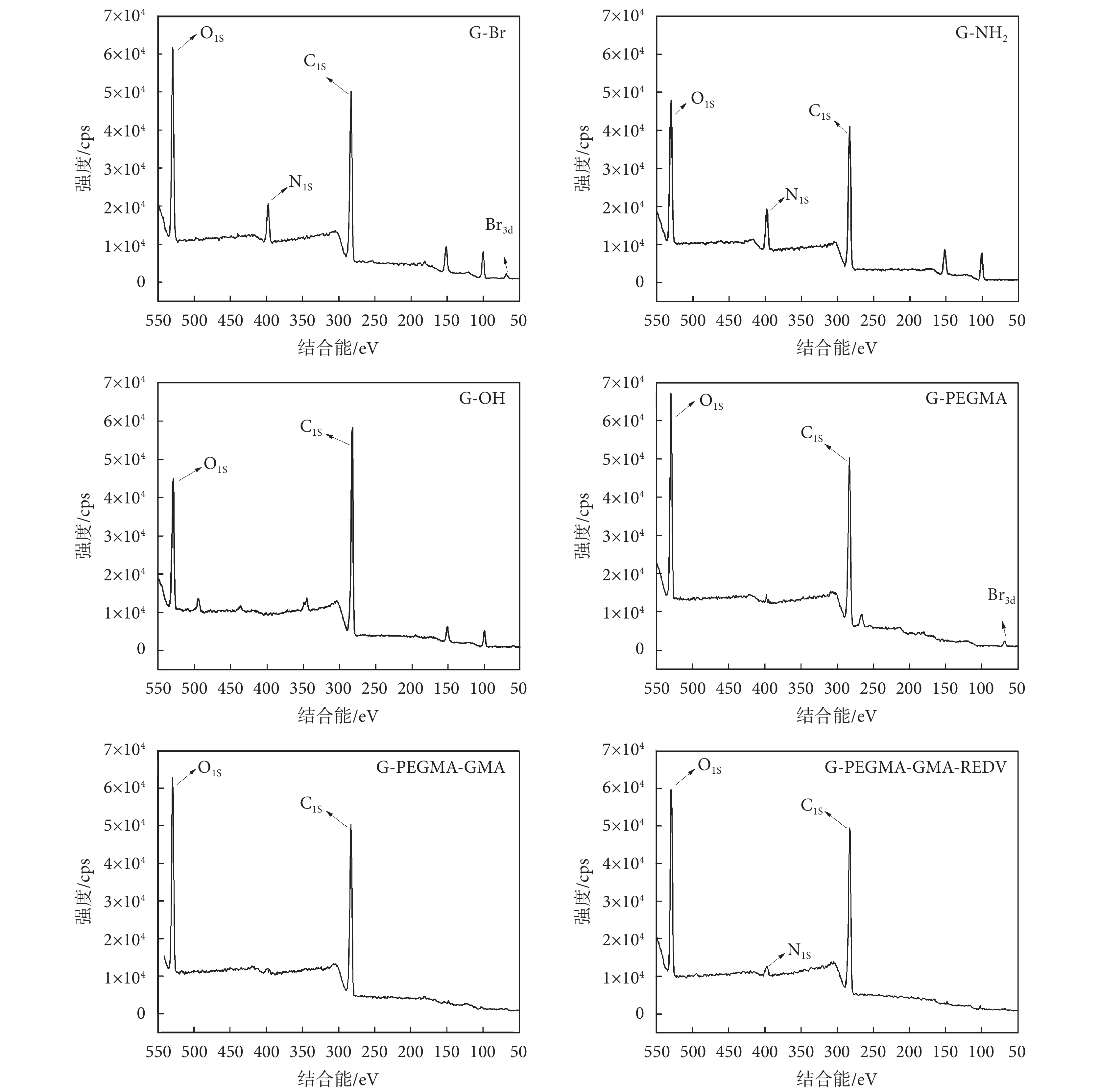 圖3
玻璃表面 XPS 結構表征
Figure3.
XPS spectra of different surfaces
圖3
玻璃表面 XPS 結構表征
Figure3.
XPS spectra of different surfaces
2.2 表面接觸角分析
表面引發接枝反應過程中,接觸角隨著表面組分的不同而發生變化。表 1 列出了玻璃表面各步反應后接觸角的變化過程。玻璃表面經“Piranha”溶液處理后,表面富含親水性的羥基,靜態接觸角為 42.8°,接枝 APTES 和 BIBB 后,表面疏水性增強[22],接觸角數據分別增加至 71.1°和 79.3°。接枝 PEGMA 聚合物刷后,由于 PEGMA 的親水性,接觸角降到 63.4°;二次引發 GMA 聚合后,水接觸角增至 74.6°;親水性多肽 REDV 修飾到表面以后親水性又明顯增強,并伴隨產生了羥基[23],因此表面接觸角降至 55.1°。以上各表面的親水程度反映了不同接枝過程后基材表面結構組成的變化,進一步證明了聚合物刷的成功構建。
2.3 表面形貌表征
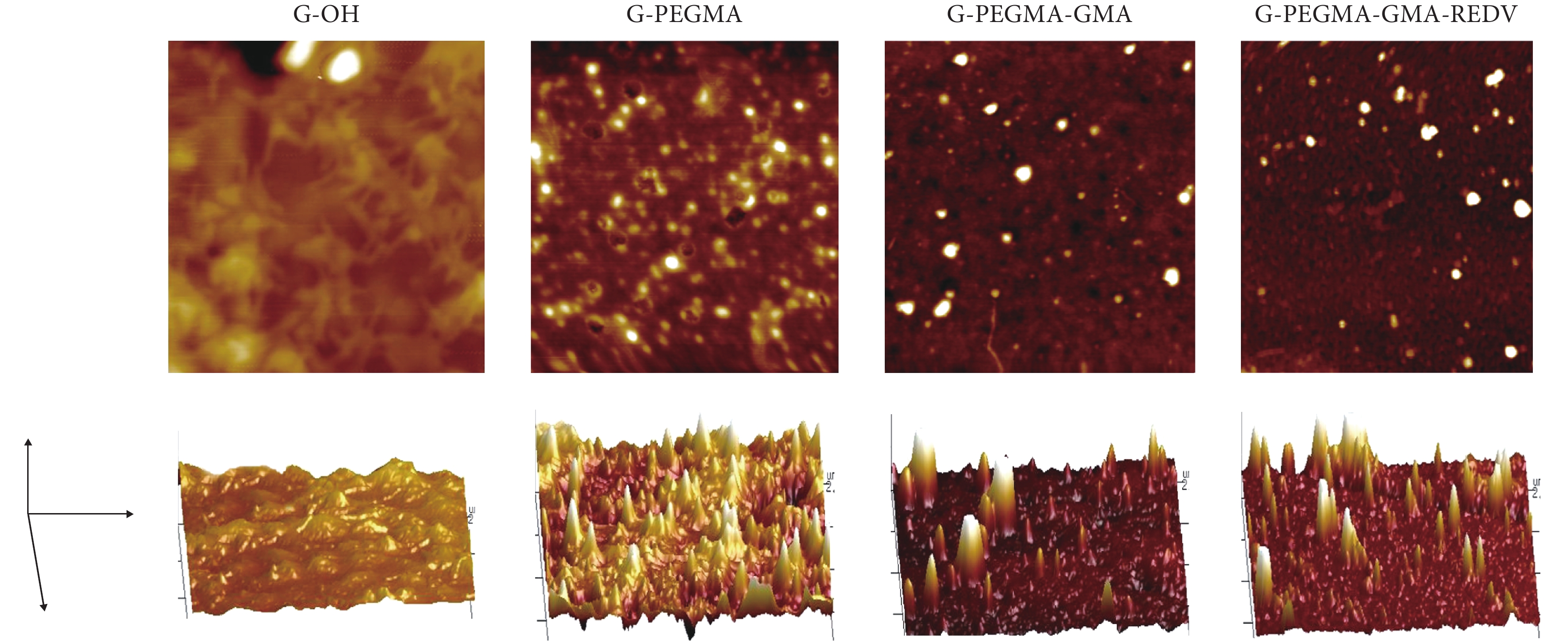
利用原子力顯微鏡對玻璃基材接枝前后的表面形貌進行了表征,結果如圖 4 所示。圖中分別為 G-OH、G-PEGMA、G-PEGMA-GMA 和 G-PEGMA-GMA-REDV 的二維相結構圖(上)和三維表面形貌圖(下)。其中玻璃基材表面比較光滑均勻,其三維圖也較為平整,表面粗糙度參數為 0.7 nm。表面接枝 PEGMA 聚合物刷以后,與未修飾的 G-OH 表面相比,粗糙度增大,相結構圖呈現明顯相分離,三維相結構也出現山峰狀凸起,表面粗糙度增至 1.4 nm;接枝 GMA 后,相結構圖和表面形貌起伏程度進一步增加,表面粗糙度也隨之增加到 1.8 nm;接枝 REDV 多肽后,三維結構山峰狀凸起變高且變得更多,粗糙度增大到 2.1 nm,側面證明 G-PEGMA-GMA-REDV 聚合物刷的成功構建。
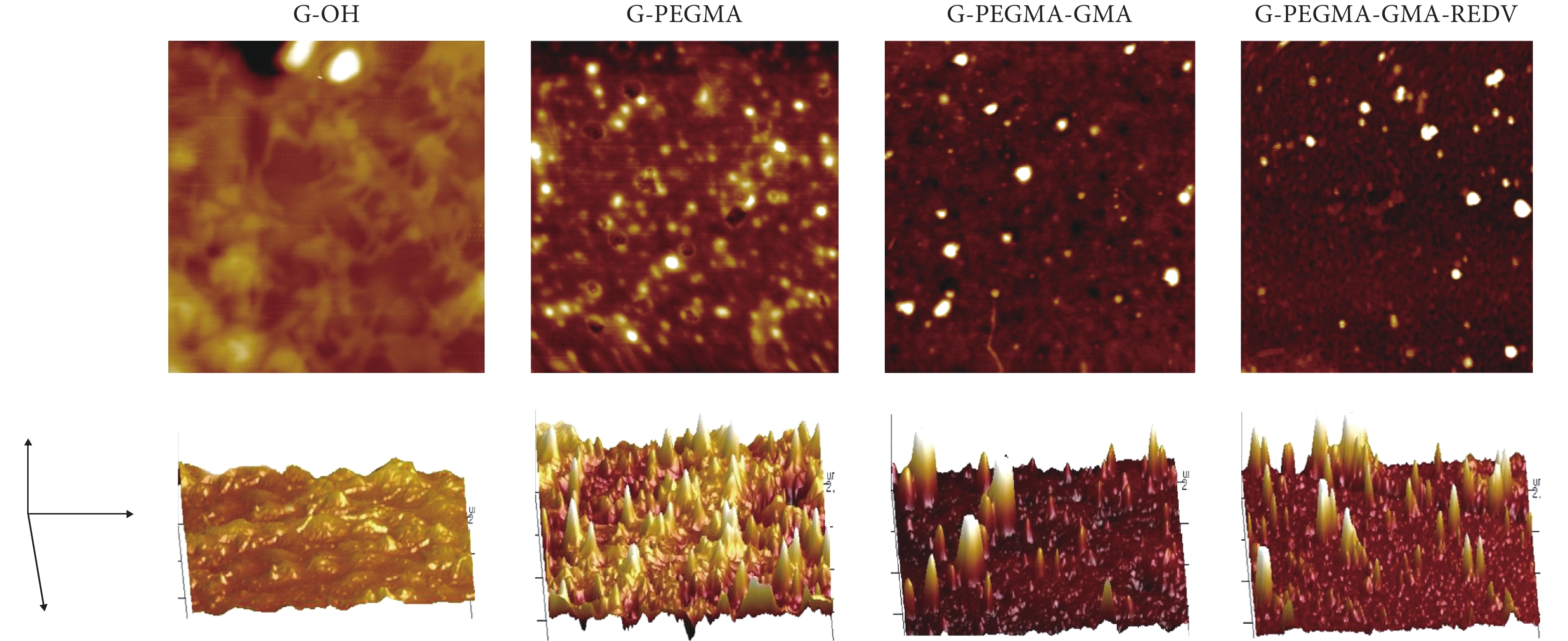 圖4
各步接枝表面相圖(上)與三維形貌圖(下)
Figure4.
AFM phase (top) and height (below) images of different surfaces
圖4
各步接枝表面相圖(上)與三維形貌圖(下)
Figure4.
AFM phase (top) and height (below) images of different surfaces
2.4 表面活性分子的定量表征
REDV 多肽中含有豐富的氨基,可與 GMA 聚合物刷末端的環氧基團發生開環反應,從而實現生物活性多肽分子的表面固定。由于多肽在紫外-可見分光光度計下有紫外吸收,因此,在紫外吸收 280 nm 左右計算 PBS 溶液在樣品進入前后的吸收曲線差值,即可得到玻璃基材表面 REDV 多肽的接枝量。根據玻璃基材面積可以得出最終表面接枝量為(16 ± 1.3)ng/cm2。
2.5 血液相容性表征
2.5.1 復鈣化凝血時間結果表征
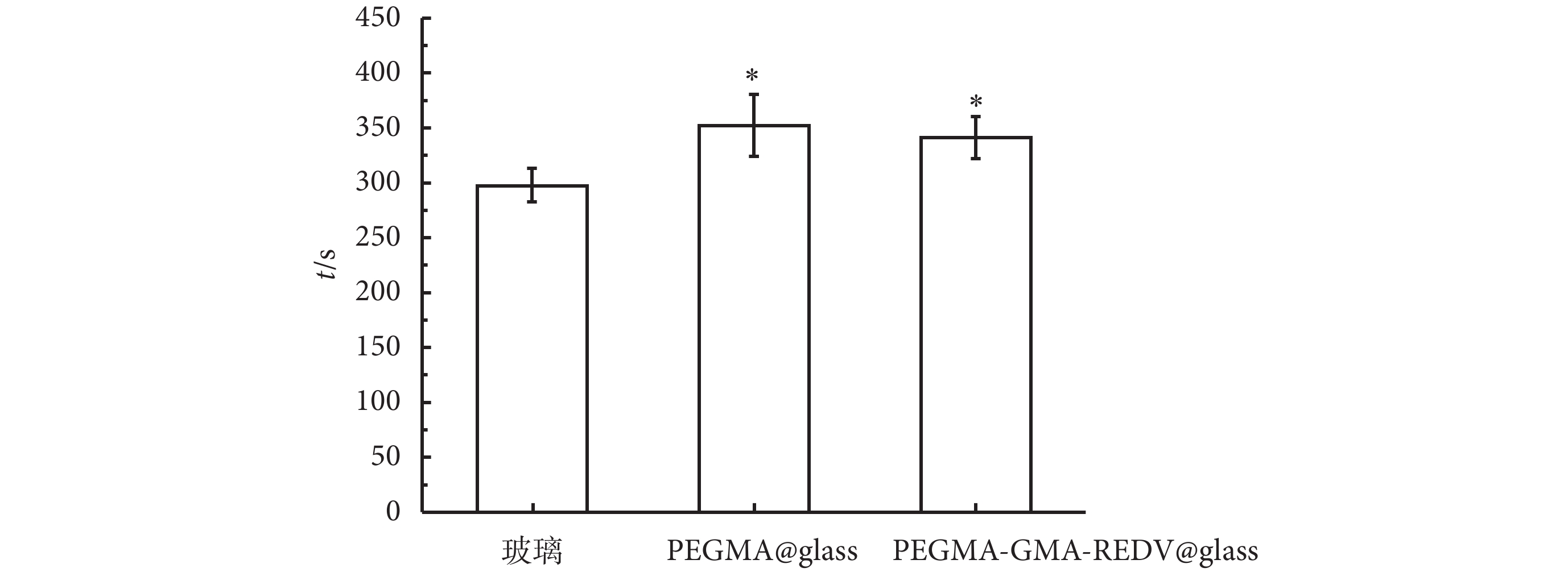
采用空白的硅化玻璃試管和惰性的 PEGMA 涂層修飾的玻璃試管作為參照,測定了固定 PEGMA-GMA-REDV 涂層的玻璃試管內表面的復鈣化凝血時間,其結果見圖 5。由圖中可見,空白玻璃試管的復鈣化時間為(297 ± 15)s,而 PEGMA 修飾的涂層復鈣化凝血時間為(352 ± 28)s,固定 REDV 多肽的仿生涂層表面的復鈣化凝血時間為(341 ± 19)s。PEGMA 基團的引入能夠使復鈣化凝血時間增加,提高聚合物刷的血液相容性。
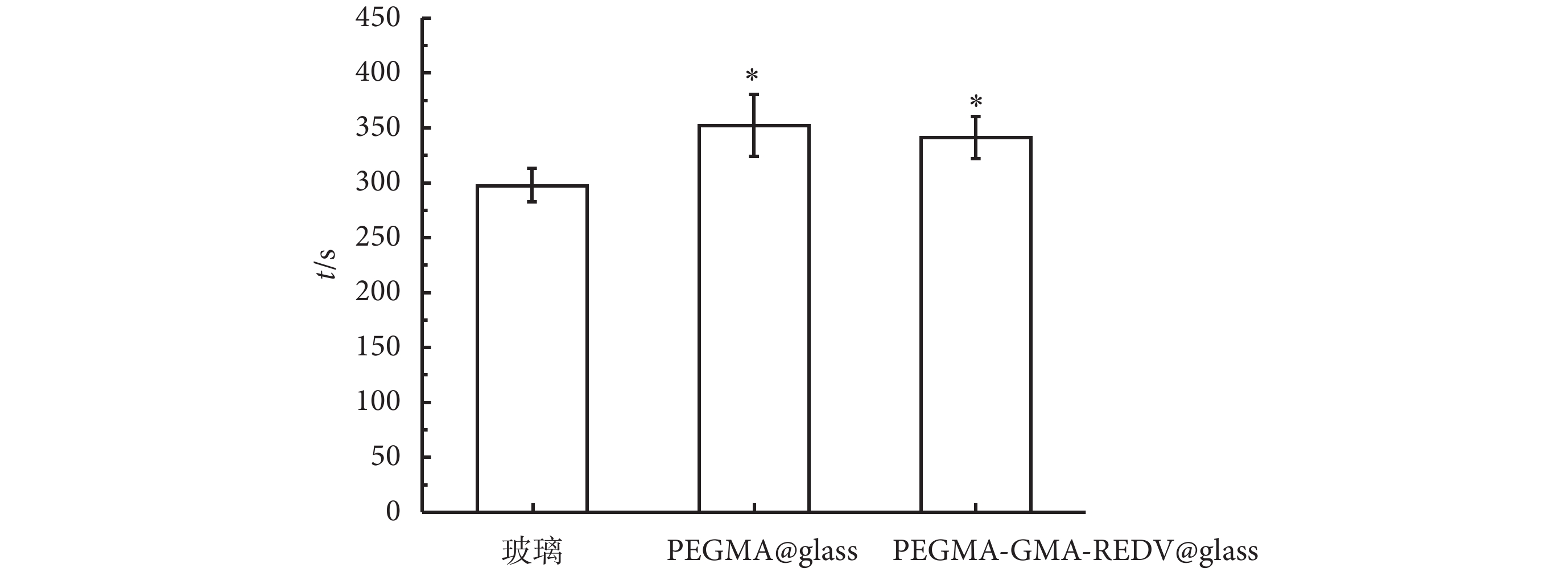 圖5
血液復鈣化時間測試結果(* 與玻璃對照組比較,P < 0.05)
Figure5.
Columnar scheme of plasma recalcification time (PRT) (* compared to glass control group,P < 0.05)
圖5
血液復鈣化時間測試結果(* 與玻璃對照組比較,P < 0.05)
Figure5.
Columnar scheme of plasma recalcification time (PRT) (* compared to glass control group,P < 0.05)
2.5.2 血小板黏附結果表征
為進一步表征嵌段共聚物涂層的親水性和血液相容性,采用掃描電鏡對 PEGMA-GMA-REDV 嵌段共聚物涂層的血小板黏附情況進行了表征,并以空白玻璃片和 PEGMA 聚合物修飾的玻璃片作為參照,結果如圖 6 所示。由圖可見,對照樣品空白玻璃片表面與血液接觸后,黏附了大量活化的血小板以及大塊的纖維狀物質;而在 PEGMA 聚合物涂層和 PEGMA-GMA-REDV 嵌段共聚物涂層表面,僅僅存在一些未被激活的血小板,且血小板的數量很少,遠遠低于空白樣品,表明 PEGMA 具有良好的親水抗污效果,該嵌段共聚物涂層具有良好的抗血小板黏附性質。PEGMA 的引入是改善材料表面血液相容性的關鍵因素。
 圖6
血小板黏附結果
Figure6.
Typical images of platelet adhesion
圖6
血小板黏附結果
Figure6.
Typical images of platelet adhesion
3 結論
本研究利用 SI-ATRP 技術在玻璃基材表面構建了 PEGMA-GMA 二元嵌段共聚物刷,并通過 GMA 末端環氧基與氨基的開環反應固定了 REDV 活性多肽。靜態水接觸角、XPS 和 AFM 從不同角度證明了玻璃基材表面各步接枝反應的成功。通過紫外-可見分光光度計對表面固定的 REDV 多肽進行了定量表征,血漿復鈣化實驗和血小板黏附結果表明該二元嵌段共聚物刷構建的涂層具有良好的血液相容性。PEG 可以阻抗非特異性吸附,包括血小板和細胞的黏附。在 PEG 阻抗的基礎上,REDV 作為一種活性多肽,可以特異性地促進內皮細胞的黏附和增殖,從而實現表面的內皮化。盡管由于 PEG 的存在,內皮細胞的黏附數量和速度會變慢,但是隨著時間的延長,內皮細胞和平滑肌細胞之間的數量比會越來越大,這也是形成表面內皮化的重要條件;而且 PEG 和 REDV 之間的競爭關系以及內皮細胞黏附的數量和快慢可以通過 REDV 的表面接枝量來進行調控。本研究提供了一種惰性聚合物 PEGMA 與生物活性分子 REDV 協同作用的表面構建新方法,為后續原位內皮化功能界面的研究提供了理論與實驗依據。
引言
藥物洗脫支架是目前介入治療心血管疾病最主要的手段,而由于藥物釋放帶來的血管內皮延遲愈合,以及繼而引發的晚期血栓等不良事件,是限制心血管支架臨床應用的主要問題[1-3]。因此,材料表面的內皮化程度是影響生物材料體內應用的重要因素。采用一定手段對材料表面進行修飾改性,特異性固定可以促進內皮細胞黏附的生物分子,以此增強惰性材料表面的內皮細胞選擇性以及促進表面內皮化程度,是解決支架現有晚期血栓、再狹窄等不良問題的有效手段之一[4-7]。
在功能性材料的制備中,材料表面的改性是一項重要的研究內容。前期研究中,我們采用表面涂覆方法構建了多肽修飾的內皮細胞選擇涂層[7],并比較了不同多肽接枝后表面的內皮化效果[8]。該方法涂覆方便,但存在接枝密度不可控以及結合力不牢固的問題。為了克服這些問題,在本研究中,我們擬采用表面引發的原子轉移自由基聚合方法(surface-initiated atom transfer radical polymerization,SI-ATRP)在玻璃基材表面構建多肽修飾的生物活性涂層。SI-ATRP 為近年來發展起來的一種新技術[9]。尤其在生物材料領域,該技術能夠在生物材料表面形成一層結構致密的聚合物分子刷(polymer brush),改善涂層黏附力,從而改變材料表面的固有性質,構建良好的生物抗污表面[10-11]。聚乙二醇類材料(poly(ethylene glycol),PEG)因其優異的抗蛋白質、血小板等非特異性阻抗性能,廣泛用于心血管植入材料的表面改性[12-15]。此外,甲基丙烯酸縮水甘油酯(glycidyl methacrylate,GMA)側鏈含有大量的環氧基團,能夠通過開環反應特異性固定生物活性分子[16-18]。惰性材料和活性分子的協同作用可以有效實現材料表面特定生物分子的特異性吸附。在現有表面固定生物活性分子的研究中,多肽精氨酸-谷氨酸-天冬氨酸-纈氨酸(Arg-Glu-Asp-Val,REDV)可被主要在內皮細胞膜中表達的整合素 α4β1 特異性識別,而不引起平滑肌細胞的增殖。Plouffe 等[19]在微流道表面固定 REDV 后發現,內皮細胞、平滑肌細胞和成纖維細胞混合液通過微流道表面時能夠實現混合體系中內皮細胞的選擇性黏附,再結合 PEG 對平滑肌細胞的非選擇性抑制,二者協同作用構建的涂層可以有效阻抗表面平滑肌細胞非特異性黏附,同時促進內皮細胞的選擇性生長和遷移,且不同的接枝密度可以調控內皮細胞和平滑肌細胞在表面的增殖量和增殖比例[20]。
基于此,本文在前期研究的基礎上,探索采用 SI-ATRP 技術取代原有的表面涂覆方法,在玻璃基材表面構建甲基丙烯酸聚乙二醇酯和甲基丙烯酸縮水甘油酯(poly(ethylene glycol) methacrylate-block-glycidyl methacrylate,PEGMA-GMA)的雙嵌段共聚物刷,并利用 GMA 側鏈的環氧基團開環固定具有內皮細胞選擇性的 REDV 活性多肽,從而在基材表面形成致密牢固的多肽修飾生物活性涂層。通過不同表征手段對表面結構、形貌和 REDV 接枝量進行了表征,并對涂層的血液相容性進行了研究。
1 實驗
1.1 材料與試劑
PEGMA(分子量 950)、GMA、3-氨基丙基三乙氧基硅烷(APTES)、2-溴異丁酰溴(BIBB)、2,2’-聯吡啶(Bpy)、溴化亞銅(CuBr)均購自 Aldrich 公司(美國),甲醇、二氯甲烷等有機試劑購自阿拉丁試劑(上海)有限公司。以上試劑均為分析純。REDV 購自吉爾生化(上海)有限公司。
1.2 玻璃表面 SI-ATRP 引發劑制備
載玻片切割成 1 cm × 1 cm 大小,用“Piranha”溶液(96% H2SO4∶30% H2O2 = 7∶3,V/V)浸泡清洗 10 min 后,超聲洗滌真空干燥備用。將清洗后的玻璃片浸入含有 APTES 的無水甲苯溶液中,在氮氣保護下反應過夜,分別用甲苯、丙酮超聲洗滌真空干燥,得到富含氨基的表面。將偶聯劑改性后的玻璃放入已滴加 α-溴代異丁酰溴和三乙胺的二氯甲烷溶液中,避光室溫反應 12 h,依次用甲苯、丙酮-水混合液和丙酮超聲洗滌,真空干燥,獲得玻璃片 SI-ATRP 引發劑。如圖 1 所示。
 圖1
玻璃表面引發劑合成路線
Figure1.
Formation of the ATRP initiator layer on glass substrate
圖1
玻璃表面引發劑合成路線
Figure1.
Formation of the ATRP initiator layer on glass substrate
1.3 PEGMA-GMA 聚合物刷的制備
將固定引發劑的玻璃片和 PEGMA、超純水、甲醇、Bpy、CuBr 配制成的反應溶液一起加入到真空除氧的反應裝置內,室溫聚合 12 h,之后將玻璃片清洗并用氮氣吹干,得到 PEGMA 修飾的表面(G-PEGMA)。 將超純水、甲醇、GMA、CuBr 和 Bpy 配制成反應液,除去氧氣后加入到裝有 G-PEGMA 的反應裝置中,氮氣保護下反應過夜,清洗氮氣吹干后真空干燥保存。反應過程如圖 2 所示。
 圖2
玻璃表面 PEGMA-GMA 聚合物刷合成過程
Figure2.
Synthesis procedure of PEGMA-GMA copolymer brushes on glass substrate
圖2
玻璃表面 PEGMA-GMA 聚合物刷合成過程
Figure2.
Synthesis procedure of PEGMA-GMA copolymer brushes on glass substrate
1.4 REDV 活性分子的表面固定
REDV 與 GMA 聚合物刷末端的環氧基團可以發生開環反應,具體反應過程如下:將 G-PEGMA-GMA 樣品浸入 20 μg/mL 的 REDV 多肽 PBS 溶液中(pH = 7.5),室溫反應 24 h,隨后放入賴氨酸溶液中 6 h,以消除沒有與多肽反應的環氧基團,蒸餾水清洗,氮氣吹干。
1.5 材料表面表征
表面化學結構組成采用 X 射線光電子能譜(X-ray photoelectron spectroscopy,XPS,AXIS-HSi,島津,日本)進行測試,表面形貌采用原子力顯微鏡(atomic force microscope,AFM,MultiMode8,布魯克,德國)測定,靜態水接觸角采用自動水接觸角儀(SL200C,科諾,美國)進行測量,REDV 的接枝量由紫外-可見分光光度儀(ultraviolet–visible spectroscopy,UV-VIS,UV-2450,島津,日本)表征。
1.6 血液相容性表征[21 ]
1.6.1 復鈣化凝血時間測試
將已預熱至 37℃ 的人體抗凝血漿(已除 Ca2+)100 μL 和生理鹽水 100 μL 依次加入到內表面已修飾聚合物刷的硅化玻璃管中,將試管靜置于 37℃ 恒溫水浴中 60 s 后,加入 100 μL 已預熱的 0.025 mol/L CaCl2 溶液,開始計時。將自制不銹鋼鉤針在玻璃管中緩慢攪動,直至不銹鋼鉤針開始出現絲狀纖維蛋白,停止計時,此時間即復鈣化凝血時間。并以空白玻璃管和 PEGMA 修飾的惰性玻璃管作為參照,每種樣品平行測定 6 次,取其平均值即樣品的最終復鈣化時間。采用 origin8.5 軟件對實驗數據進行統計學分析,采用平均值 ± 標準差表示實驗結果。組間比較采用 t 檢驗,當 P < 0.05 時視為差異有統計學意義。
1.6.2 血小板黏附
取現抽 10 mL 新鮮抗凝全血于離心管中,離心(1 000 r/min)10 min,得上層清液即為富血小板血漿(platelet rich plasma,PRP)。將玻璃裸材與經相應修飾后的材料分別置于潔凈濾紙上,用微量進樣器移取 20 μL PRP 于玻璃裸材和經相應修飾后的材料,并與修飾后的材料接觸 30 min,然后用 PBS 緩沖液(pH7.4)小心清洗表面以除去黏附不牢的血小板。將玻璃裸材與經相應修飾后的材料分別浸入 1% 戊二醛固定液中固定 30 min,然后用純水清洗表面 3 次,再依次用 10%、30%、50%、70%、90%、100%(V/V)乙醇/水梯度溶液浸洗,使黏附的血小板脫水。自然干燥后置于干燥器中保存。使用場發射掃描電子顯微鏡對玻璃裸材與經相應修飾后的材料表面黏附的血小板形貌進行表征。
2 結果與討論
2.1 表面化學組成分析
圖 3 給出了玻璃基材表面以及經過不同接枝反應后的表面結構組成的 XPS 表征結果。由于玻璃本身成分復雜,可以看出未改性的玻璃基材表面(G-OH)有較多雜峰,其中 103 eV 和 155 eV 分別屬于 Si2p 和 Si2s 元素。修飾 APTES 后,玻璃表面的譜圖中出現了氮元素的 N1s(400 eV)特征峰,證明玻璃基材表面成功修飾上了氨基基團(G-NH2)。當表面進一步固定 BIBB 引發劑后,譜圖中出現了溴元素(68 eV,Br3d)的特征峰,證明引發劑已成功接枝在玻璃表面(G-Br)。繼續修飾 PEGMA 聚合物(G-PEGMA)和 GMA 聚合物(G-PEGMA-GMA)后,表面基本被聚合物刷所覆蓋,氮元素和硅元素的特征峰大大減小;在聚合物刷末端開環固定 REDV 活性分子后(G-PEGMA-GMA-REDV),由于多肽中的氨基存在,使得表面又出現了 N1s(400 eV)的特征峰,表明 REDV 多肽已成功接枝到基材表面。
 圖3
玻璃表面 XPS 結構表征
Figure3.
XPS spectra of different surfaces
圖3
玻璃表面 XPS 結構表征
Figure3.
XPS spectra of different surfaces
2.2 表面接觸角分析
表面引發接枝反應過程中,接觸角隨著表面組分的不同而發生變化。表 1 列出了玻璃表面各步反應后接觸角的變化過程。玻璃表面經“Piranha”溶液處理后,表面富含親水性的羥基,靜態接觸角為 42.8°,接枝 APTES 和 BIBB 后,表面疏水性增強[22],接觸角數據分別增加至 71.1°和 79.3°。接枝 PEGMA 聚合物刷后,由于 PEGMA 的親水性,接觸角降到 63.4°;二次引發 GMA 聚合后,水接觸角增至 74.6°;親水性多肽 REDV 修飾到表面以后親水性又明顯增強,并伴隨產生了羥基[23],因此表面接觸角降至 55.1°。以上各表面的親水程度反映了不同接枝過程后基材表面結構組成的變化,進一步證明了聚合物刷的成功構建。
2.3 表面形貌表征
利用原子力顯微鏡對玻璃基材接枝前后的表面形貌進行了表征,結果如圖 4 所示。圖中分別為 G-OH、G-PEGMA、G-PEGMA-GMA 和 G-PEGMA-GMA-REDV 的二維相結構圖(上)和三維表面形貌圖(下)。其中玻璃基材表面比較光滑均勻,其三維圖也較為平整,表面粗糙度參數為 0.7 nm。表面接枝 PEGMA 聚合物刷以后,與未修飾的 G-OH 表面相比,粗糙度增大,相結構圖呈現明顯相分離,三維相結構也出現山峰狀凸起,表面粗糙度增至 1.4 nm;接枝 GMA 后,相結構圖和表面形貌起伏程度進一步增加,表面粗糙度也隨之增加到 1.8 nm;接枝 REDV 多肽后,三維結構山峰狀凸起變高且變得更多,粗糙度增大到 2.1 nm,側面證明 G-PEGMA-GMA-REDV 聚合物刷的成功構建。
 圖4
各步接枝表面相圖(上)與三維形貌圖(下)
Figure4.
AFM phase (top) and height (below) images of different surfaces
圖4
各步接枝表面相圖(上)與三維形貌圖(下)
Figure4.
AFM phase (top) and height (below) images of different surfaces
2.4 表面活性分子的定量表征
REDV 多肽中含有豐富的氨基,可與 GMA 聚合物刷末端的環氧基團發生開環反應,從而實現生物活性多肽分子的表面固定。由于多肽在紫外-可見分光光度計下有紫外吸收,因此,在紫外吸收 280 nm 左右計算 PBS 溶液在樣品進入前后的吸收曲線差值,即可得到玻璃基材表面 REDV 多肽的接枝量。根據玻璃基材面積可以得出最終表面接枝量為(16 ± 1.3)ng/cm2。
2.5 血液相容性表征
2.5.1 復鈣化凝血時間結果表征
采用空白的硅化玻璃試管和惰性的 PEGMA 涂層修飾的玻璃試管作為參照,測定了固定 PEGMA-GMA-REDV 涂層的玻璃試管內表面的復鈣化凝血時間,其結果見圖 5。由圖中可見,空白玻璃試管的復鈣化時間為(297 ± 15)s,而 PEGMA 修飾的涂層復鈣化凝血時間為(352 ± 28)s,固定 REDV 多肽的仿生涂層表面的復鈣化凝血時間為(341 ± 19)s。PEGMA 基團的引入能夠使復鈣化凝血時間增加,提高聚合物刷的血液相容性。
 圖5
血液復鈣化時間測試結果(* 與玻璃對照組比較,P < 0.05)
Figure5.
Columnar scheme of plasma recalcification time (PRT) (* compared to glass control group,P < 0.05)
圖5
血液復鈣化時間測試結果(* 與玻璃對照組比較,P < 0.05)
Figure5.
Columnar scheme of plasma recalcification time (PRT) (* compared to glass control group,P < 0.05)
2.5.2 血小板黏附結果表征
為進一步表征嵌段共聚物涂層的親水性和血液相容性,采用掃描電鏡對 PEGMA-GMA-REDV 嵌段共聚物涂層的血小板黏附情況進行了表征,并以空白玻璃片和 PEGMA 聚合物修飾的玻璃片作為參照,結果如圖 6 所示。由圖可見,對照樣品空白玻璃片表面與血液接觸后,黏附了大量活化的血小板以及大塊的纖維狀物質;而在 PEGMA 聚合物涂層和 PEGMA-GMA-REDV 嵌段共聚物涂層表面,僅僅存在一些未被激活的血小板,且血小板的數量很少,遠遠低于空白樣品,表明 PEGMA 具有良好的親水抗污效果,該嵌段共聚物涂層具有良好的抗血小板黏附性質。PEGMA 的引入是改善材料表面血液相容性的關鍵因素。
 圖6
血小板黏附結果
Figure6.
Typical images of platelet adhesion
圖6
血小板黏附結果
Figure6.
Typical images of platelet adhesion
3 結論
本研究利用 SI-ATRP 技術在玻璃基材表面構建了 PEGMA-GMA 二元嵌段共聚物刷,并通過 GMA 末端環氧基與氨基的開環反應固定了 REDV 活性多肽。靜態水接觸角、XPS 和 AFM 從不同角度證明了玻璃基材表面各步接枝反應的成功。通過紫外-可見分光光度計對表面固定的 REDV 多肽進行了定量表征,血漿復鈣化實驗和血小板黏附結果表明該二元嵌段共聚物刷構建的涂層具有良好的血液相容性。PEG 可以阻抗非特異性吸附,包括血小板和細胞的黏附。在 PEG 阻抗的基礎上,REDV 作為一種活性多肽,可以特異性地促進內皮細胞的黏附和增殖,從而實現表面的內皮化。盡管由于 PEG 的存在,內皮細胞的黏附數量和速度會變慢,但是隨著時間的延長,內皮細胞和平滑肌細胞之間的數量比會越來越大,這也是形成表面內皮化的重要條件;而且 PEG 和 REDV 之間的競爭關系以及內皮細胞黏附的數量和快慢可以通過 REDV 的表面接枝量來進行調控。本研究提供了一種惰性聚合物 PEGMA 與生物活性分子 REDV 協同作用的表面構建新方法,為后續原位內皮化功能界面的研究提供了理論與實驗依據。