采用溶膠-凝膠法制備氧化鋅量子點(ZnO QDs),表面用 3-氨丙基三乙氧基硅烷(APTES)改性,制備氨基化的 ZnO QDs。同時,利用 N,N′-羰基二咪唑(CDI)活化蘆薈苦素(Alo),與氨基化的 ZnO QDs 反應,將 Alo 共價連接在 ZnO QDs 表面,獲得蘆薈苦素納米粒(Alo NPs)。采用透射電子顯微鏡(TEM)、動態光散射儀(DLS)、傅里葉變換紅外光譜儀(FTIR)和熱重分析儀(TGA)對 Alo NPs 的形貌、粒徑、結構進行了表征。測試表明,ZnO QDs 呈類圓形,由于 Alo 的連接,原本粒徑分布在 4 nm 左右的粒子粒徑增加至 8 nm 左右。TG 結果顯示 Alo NPs 中,ZnO QDs 和 Alo 的質量分數分別為 39.27%、35.14%。透皮滲透實驗結果表明 Alo NPs 能顯著提高 Alo 的透皮效率。體外釋藥行為顯示,Alo-NPs 在酸性條件下(pH = 5.0)2 h 即能釋放 87.63% ± 0.46% 的 Alo,而在 pH = 7.4 的介質中,2 h 內的累積釋放率只有 1.45% ± 0.21%。Alo-NPs 對酪氨酸酶活性抑制率呈濃度依賴型,當 ZnO QDs 的當量溶度為 12.5 μg/mL 時,抑制率可高達 40.32% ± 1.57%。這些結果說明 Alo NPs 作為外用酪氨酸酶活性抑制劑具有潛在的應用價值。
引用本文: 黃嘯, 陳春, 龔星全, 肖祖麗, 石秀蘭, 鄭曦, 潘玉竹, 易彩霞. 透皮蘆薈苦素納米粒的制備及其對酪氨酸酶活性的抑制作用. 生物醫學工程學雜志, 2019, 36(2): 254-259. doi: 10.7507/1001-5515.201805018 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
黑色素的過度沉積會導致黃褐斑、黑斑等色素性皮膚病,更嚴重的會誘發黑色素瘤[1-2],嚴重影響著人類的美觀和健康。黑色素的生成需經酪氨酸酶兩步催化,將 L-酪氨酸催化生成多巴醌,多巴醌經兩個非酶促反應途徑生成黑色素,可見酪氨酸酶是黑色素形成的關鍵限速酶。當酪氨酸酶過量表達時會導致黑色素的大量沉積,引發色素紊亂相關疾病。所以,使用高效低毒的酪氨酸酶抑制劑可有效防止黑色素的過度沉積[3]。近年來,研究報道黃酮及其衍生物、有機酸類、苷類、萜類和酯類等酪氨酸酶抑制劑,均對酪氨酸酶表現出良好的抑制作用[4-6]。然而,透皮率低這一缺點嚴重限制了外用酪氨酸酶抑制劑對黑素細胞中酪氨酸酶的抑制作用[7],使其在化妝品和臨床應用上的功效并不明顯。目前,只有極少研究關注酪氨酸酶抑制劑的透皮輸送問題[8-9]。這些研究都是利用經典的穿膜肽聚精氨酸來提高酪氨酸酶抑制劑的透皮效率,雖然透皮性能有所提高,但是聚精氨酸及其衍生物高昂的制備成本和酪氨酸酶抑制劑的無控制性釋放,仍然限制著酪氨酸酶抑制劑透皮運輸的廣泛應用[10]。
氧化鋅(zinc oxide,ZnO)是被美國食品藥品監督管理局認證的可安全應用于食品藥品的五種金屬氧化物之一[11]。ZnO 來源廣泛,價格低廉,且易于合成與修飾,是制備藥物遞送系統的理想基體材料。此外,研究表明氧化鋅量子點(zinc oxide quantum dots,ZnO QDs)作為藥物載體可以顯著提高透皮率差的藥物的透皮性能[12],并且當 ZnO QDs 被胞吞入細胞內涵體后,進入 pH 值小于 5.5 介質中可以快速溶解為鋅離子,智能釋放負載于其上的藥物[13]。因此,本研究擬選用 Zn QDs 共價連接透皮性能差的高效酪氨酸酶抑制劑——蘆薈苦素(aloesin,Alo)[14],制備一種新型酪氨酸酶抑制劑遞送系統,以期實現高效透皮運輸酪氨酸酶抑制劑的同時,又能智能控釋酪氨酸酶抑制劑,提高藥物利用度,進而提高外用酪氨酸酶抑制劑的功效。
1 材料和方法
1.1 試劑與儀器
二水乙酸鋅、正庚烷、3-氨丙基三乙氧基硅烷(aminopropyltriethoxysilane,APTES(98% +))、N,N′-羰基二咪唑[N,N′-carbonyldiimidazole,CDI(98% +)],購自上海泰坦科技股份有限公司;氫氧化鈉、無水乙醇、N,N-二甲基甲酰胺購自天津永大化學試劑有限公司;左旋多巴(99%)、曲拉通 X-100(分子生物學級)購自上海阿拉丁生化科技股份有限公司;Alo 購自加拿大 Toronto Research Chemicals 公司;黑素細胞、黑素細胞專用培養基購自美國 ScienCell 研究實驗室。未特別標注試劑均為分析純。
S90 型動態光散射儀(dynamic light scattering,DLS)購自英國 Malven 公司;Spectrum GX 型傅里葉變換紅外光譜儀(Fourier transform infrared spectroscopy,FTIR)、Lambda 900 紫外-可見分光光度計購自美國 Perkin Elmer 公司;Tecnai G20 型透射電子顯微鏡(transmission electron microscope,TEM)購自美國 FEI 公司;Q600 型熱重分析儀(thermal gravimetric analyzer,TGA)購自美國 TA 儀器公司;TP-6 透皮測試儀購自天津新天光分析儀器技術有限公司。
1.2 表面氨基化的 ZnO QDs 的合成
將 0.41 g 二水乙酸鋅溶解于 10 mL 無水乙醇中,68℃ 下保溫攪拌 1.5 h,冰浴中冷卻。另將 0.16 g 氫氧化鈉投入 5 mL 無水乙醇中配制氫氧化鈉的乙醇溶液,逐滴加入到乙酸鋅溶液中,繼續攪拌混合溶液直至溶液在 365 nm 紫外燈下顯示綠色熒光。加入正庚烷沉淀后離心得到 ZnO QDs。將制備好的 ZnO QDs 加入 APTES 的無水乙醇溶液中(V∶V = 0.08 mL∶15 mL),保持反應溫度 50℃,攪拌 7 h。反應后,分別用無水乙醇和去離子水洗滌沉淀物三次,并在真空下干燥,得到表面氨基化的 ZnO QDs(NH2@ZnO)。
1.3 Alo NPs 的合成
0.13 g Alo 和 0.05 g CDI 溶于 2 mL N,N-二甲基甲酰胺中,室溫下攪拌 2 h 后,逐滴加入含有 0.38 g 充分分散的氨基化 ZnO QDs 的 N,N-二甲基甲酰胺懸濁液中。室溫下攪拌反應 7 h,將產物分別用乙醇和去離子水洗滌三次,真空干燥,得到 Alo NPs。
1.4 結構與性能表征
TEM:工作電壓 200 kV。DLS:將 Zn QDs 和 Alo NPs 分散于純水中利用 DLS 測量粒徑分布。FTIR:采用溴化鉀壓片法對 Zn QDs、氨基化的 Zn QDs 和 Alo NPs 樣品進行 FTIR 測試,波數范圍:4 000~400 cm–1。TG:溫度范圍 0~800℃。
1.5 Alo NPs 透皮性能測定
利用透皮測試儀測量 Alo NPs 的透皮性能,選擇豚鼠腹部皮膚為透皮模型。在 35℃ 條件下,樣品室中放置 10 mg/mL 的 Alo NPs,一定時間點(1、2、4、8、16、24 h)收集透過的 Alo NPs,并計算累積滲透量。設置 Alo 和 ZnO QDs 為實驗對照組。
1.6 Alo 的體外釋放行為考察
將 5.20 mg Alo NPs 分散于 2 mL 不同 pH(5.0,7.4)的 PBS 并密封在透析袋(MW = 3 000)中。將透析袋分別浸入 3 mL 的不同 pH 值的 PBS 中并在 37℃ 下攪拌 72 h。在預定時間點(0.5、1.0、1.5、2.0、4.0、8.0 h)用紫外分光光度計測量透析液中 Alo 的濃度,以計算其累積釋放率。
1.7 酪氨酸酶活性的抑制
采用多巴氧化法測定酪氨酸酶活性。將黑素細胞以每孔 8 000 個的密度接種到 96 孔板中。12 h 后,分別加入不同量的 Alo NPs 使得最終 ZnO QDs 的當量濃度為 3.75、6.25 和 12.50 μg/mL。繼續培養 72 h,用 PBS 洗滌黑素細胞兩次,并加入 50 μL 1% 曲拉通 X-100。將黑素細胞置于 –80℃ 冰箱中 30 min,然后在室溫下取出放置 0.5 h 直至細胞破裂。裂解的細胞升溫至 37℃,加入 50 μL 0.2% 左旋多巴。37℃ 保溫 2 h,利用紫外-可見分光光度計測定 475 nm 處的吸光度,計算對酪氨酸酶活性的抑制率。設置相應濃度的 Alo 和 ZnO QDs 為實驗對照組。使用未經外加添加物處理的黑素細胞作為空白對照,用式(1)計算酪氨酸酶活性:
 |
其中,Ta 是酪氨酸酶活性,At 是處理組的吸光度,Ab 是空白對照組的吸光度。所有實驗組做六個復孔。
2 結果與討論
2.1 Alo NPs 的合成與表征
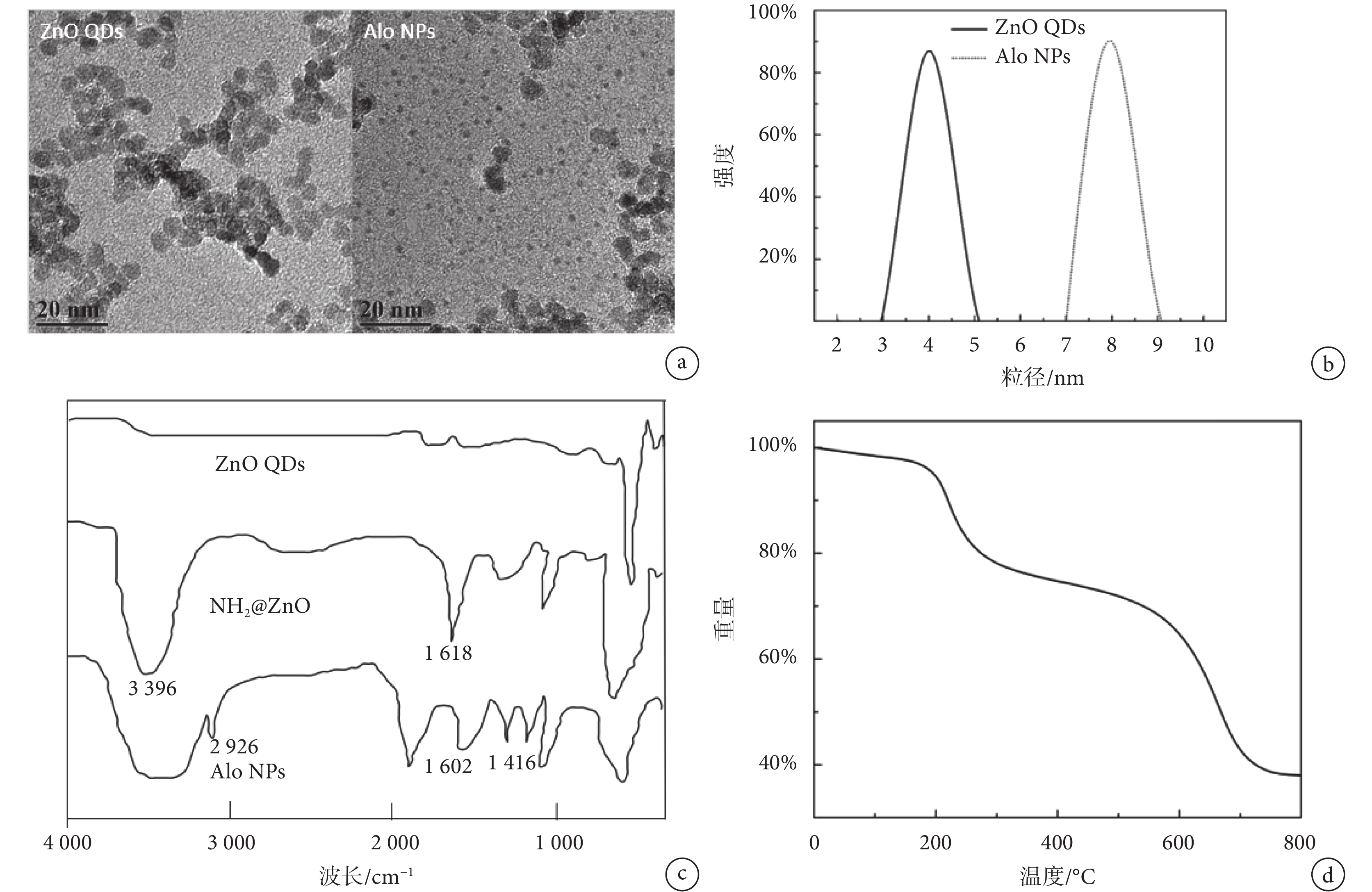
圖 1a 為 Zn QDs 和 Alo NPs 的 TEM 照片,圖中可觀察到 ZnO QDs 呈類圓形,具有很好的單分散性。但是當 Zn QDs 經過表面改性,共價接枝上 Alo 后,發生了一定程度的團聚,且粒徑有所增大。通過 DLS 測定兩種納米粒子的粒徑分布,結果顯示,原本粒徑分布在 4 nm 左右的 ZnO QDs 粒徑增加到 8 nm 左右(見圖 1b),與 TEM 照片結果吻合。圖 1c 是 ZnO QDs、NH2@ZnO 和 Alo NPs 的紅外光譜。相比 ZnO QDs 的光譜,NH2@ZnO 的光譜在 3 396 和 1 618 cm–1左右處出現兩個吸收峰,分別屬于 N-H 的伸縮和彎曲振動峰,說明氨基已經成功接枝在 ZnO QDs 表面。Alo NPs 光譜中出現 2 926 cm–1處的尖峰是-CH3 的振動峰,1 600~1 400 cm–1之間出現的數個吸收峰為苯環骨架的特征吸收峰,這些特征峰說明 Alo 已成功地與氨基化的 ZnO QDs 結合。以上分析說明 Alo NPs 已成功合成。
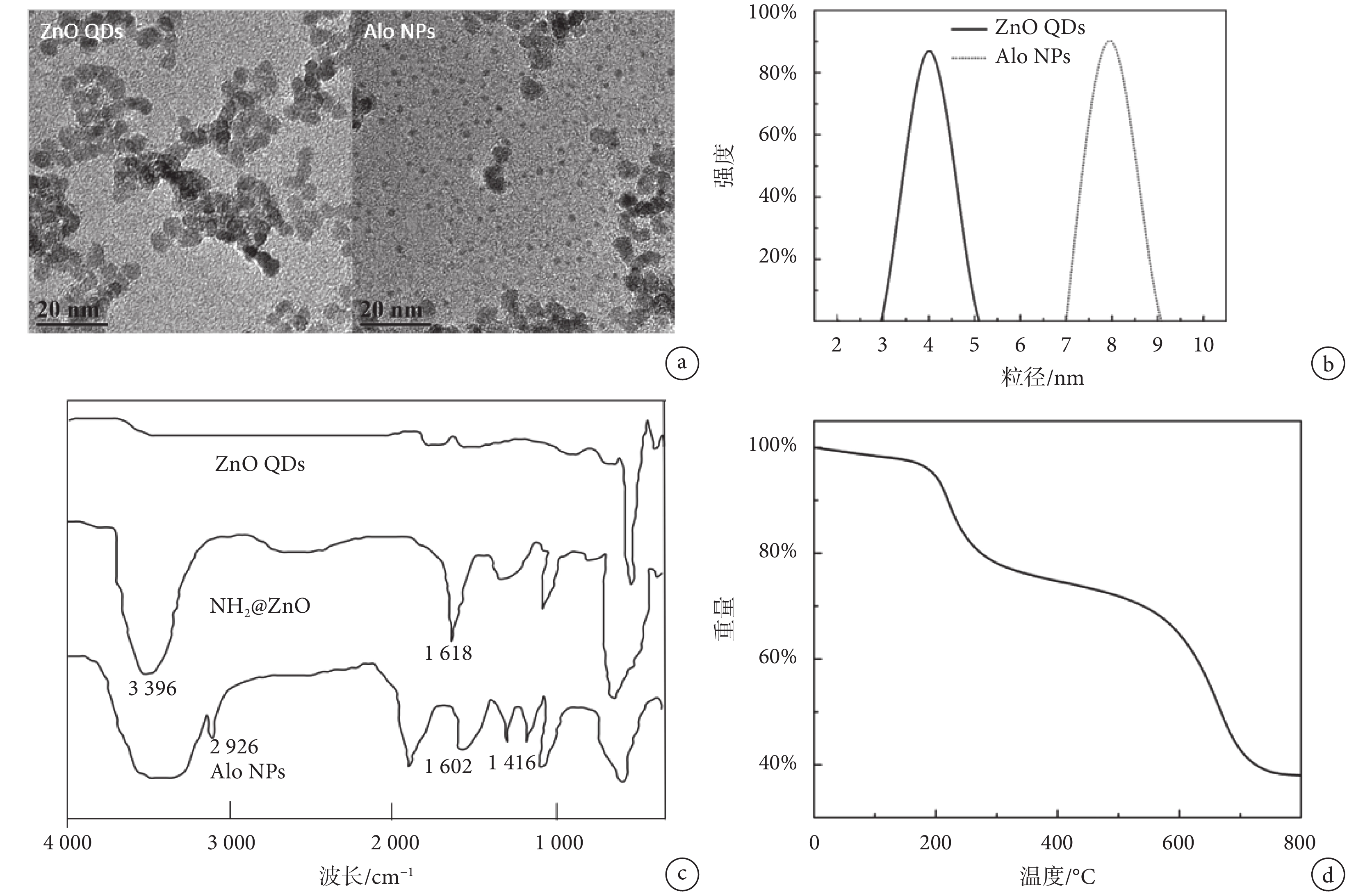 圖1
Alo NPs 的表征
圖1
Alo NPs 的表征
a. TEM 照片;b. 粒徑分布;c. 紅外圖譜;d. 熱重曲線
Figure1. Characterization of Alo NPsa. TEM images; b. size distribution; c. FTIR; d. TGA
利用 TGA 分析 Alo NPs 中各種成分所占的質量分數,結果如圖 1d 所示,在 220~240℃ 和 620~680℃ 兩個溫度段,Alo NPs 存在明顯的失重區間,分別由 APTES 和 Alo 蒸發所致,經過分析可得 ZnO QDs 和 Alo 的質量分數分別為 39.27% 和 35.14%。
2.2 Alo NPs 的透皮性能
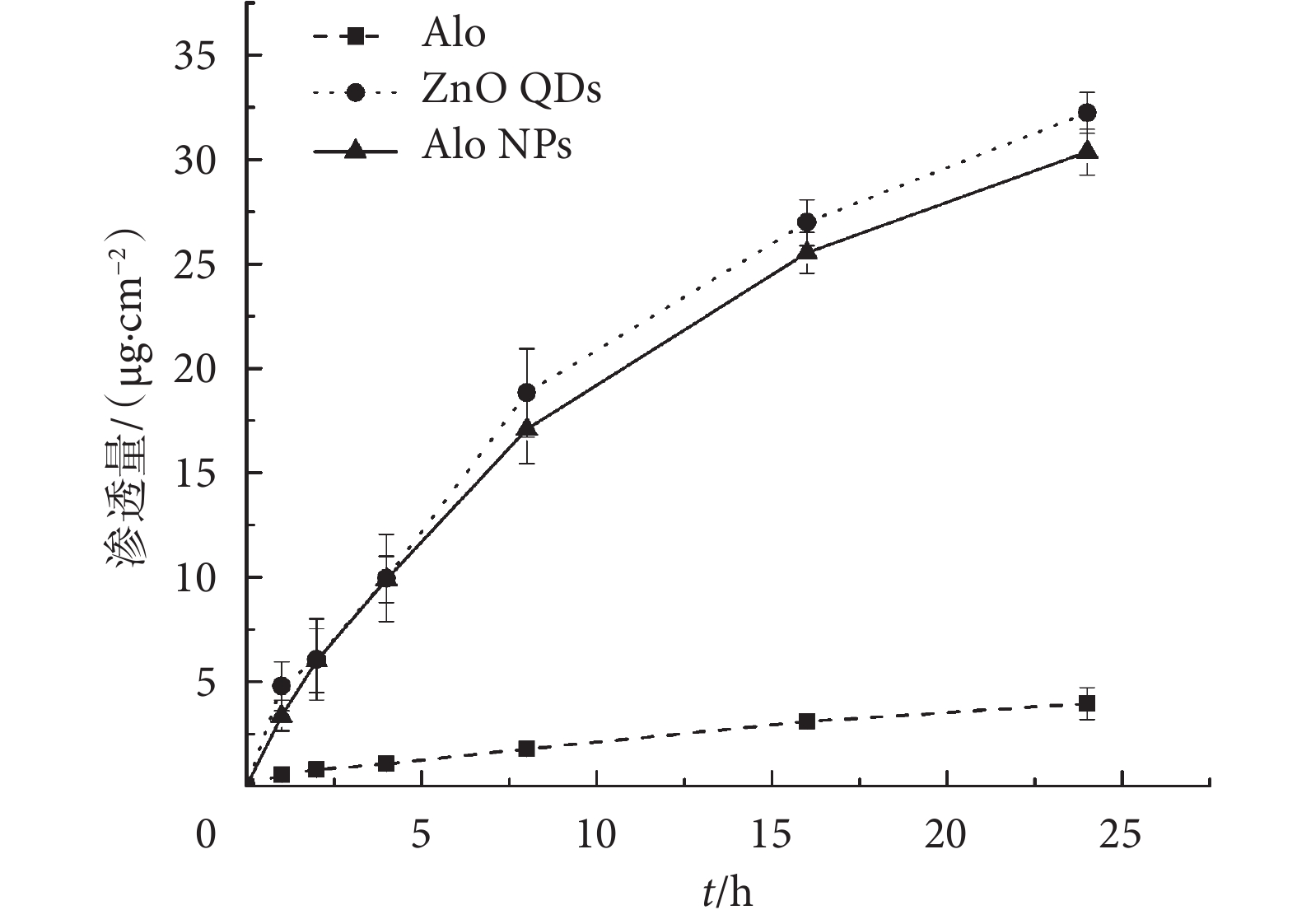
以豚鼠腹部皮膚作為透皮模型測試 Alo NPs 的透皮性能。結果如圖 2 所示,Alo NPs 在 24 h 后累積滲透量達到了(30.36 ± 1.09)μg/cm2,雖然略低于 ZnO QDs 的累積滲透量,但是同 Alo 僅有(3.97 ± 0.76)μg/cm2的累積滲透量相比,有明顯的增加。以上結果說明,將 Alo 連接在 Zn QDs 表面能夠顯著地提高 Alo 的透皮性能。
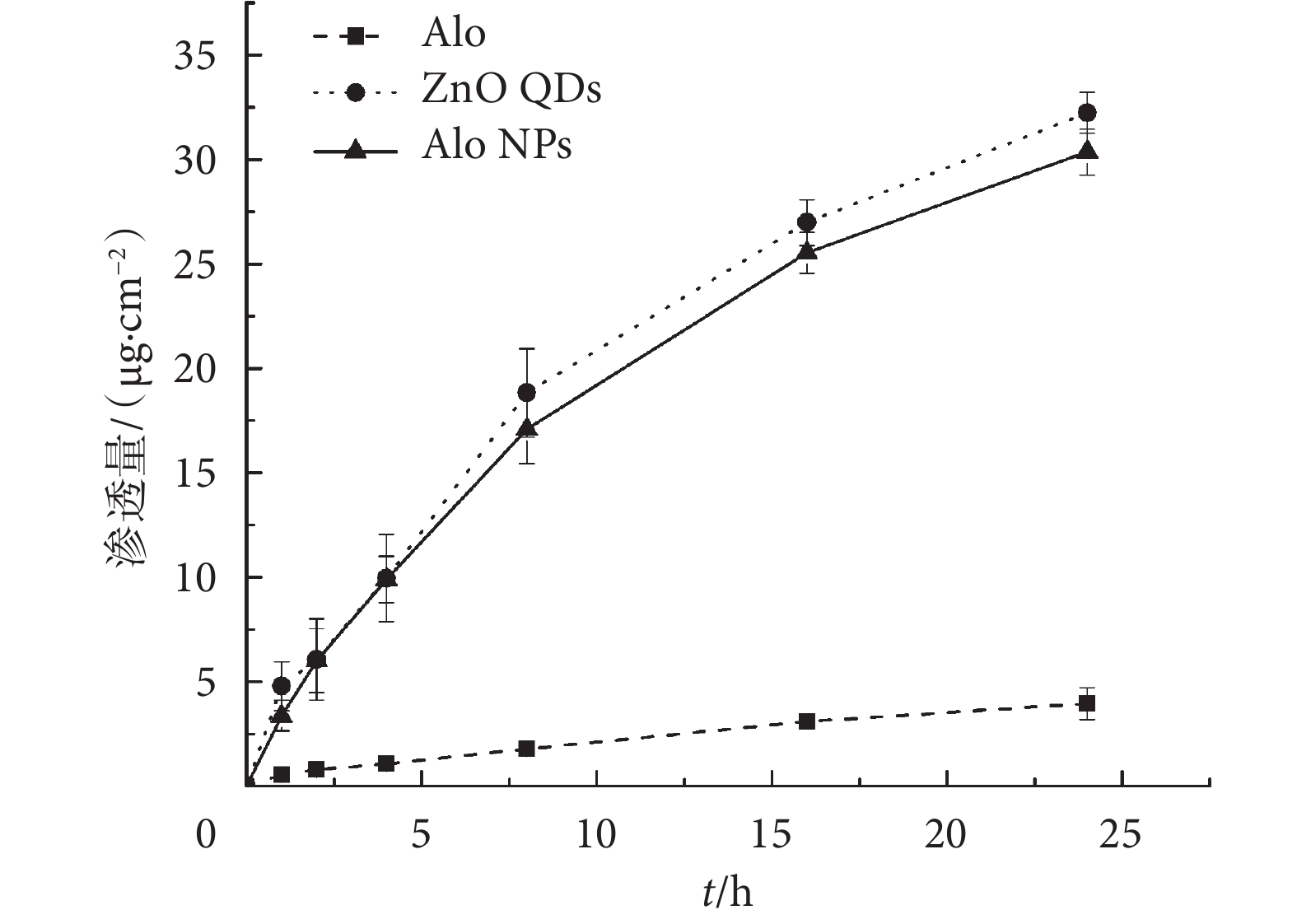 圖2
Alo NPs 的透皮性能
Figure2.
Skin penetration of Alo NPs
圖2
Alo NPs 的透皮性能
Figure2.
Skin penetration of Alo NPs
皮膚透過率差一直是限制外用酪氨酸酶抑制劑在化妝品或臨床應用效果的重要因素[15],而許多酪氨酸酶抑制劑的添加量也是有規定限量的,因此,提高酪氨酸酶抑制劑的透皮率成為解決這一矛盾的有效方法。目前,關于提高酪氨酸酶抑制劑透皮率的方法僅限于利用經典的穿膜肽聚精氨酸來幫助酪氨酸酶抑制劑透過皮膚[8-9],雖然透皮性能有所提高,但是聚精氨酸及其衍生物高昂的制備成本仍然限制著酪氨酸酶抑制劑透皮運輸的廣泛應用。此外,利用聚精氨酸及其衍生物透皮遞送目標藥物需要將兩者進行復雜的化學結合,直接降低了可操作性。近些年隨著納米技術的發展,納米藥物遞釋系統在透皮運輸的應用中呈現出極大的優勢,具有制備方法簡單、成本低、運輸遞送率高的特點[16-18]。研究報道 ZnO QDs 可以顯著提高藥物的透皮性能[12],由于其粒徑小,可以穿透角質層和毛囊,也可以從角質細胞間穿過[19-20]。本研究中的結果也顯示出 Zn QDs 良好的透皮性能。Alo 分子量較大、熔點高,又具有一定親水性,自身難以透過皮膚,但負載在 ZnO QDs 表面后,可隨之透過皮膚。由于 ZnO QDs 本身不溶于水,但分散性良好,且具有巨大的比表面積,比表面積與皮膚滲透性能成正相關性[21],所以當 Alo 負載在其表面后改變了 ZnO QDs 表面性質,使得 Alo NPs 的透皮性能稍低于 ZnO QDs,但是明顯高于 Alo。更重要的是,Alo 負載于 ZnO QDs 上,操作步驟簡便。因此,Alo NPs 展現出巨大的透皮遞送優勢。
2.3 Alo NPs 的體外智能釋藥行為
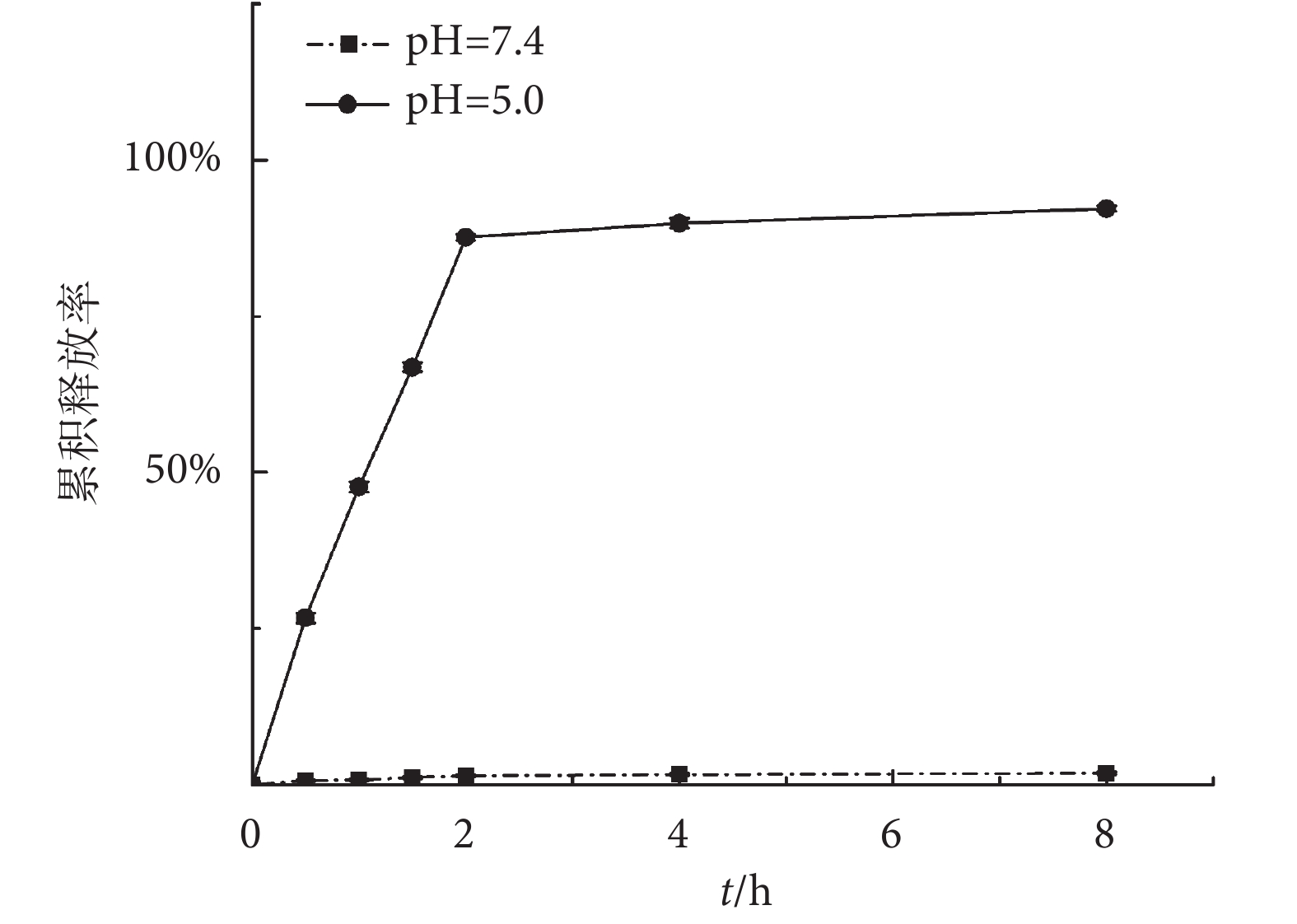
Alo NPs 在不同 pH 值緩沖液中的藥物釋放行為如圖 3 所示。Alo-NPs 在 pH 為 5.0 的緩沖液中,2 h 即能累積釋放 87.63% ± 0.46% 的 Alo,而在 pH 為 7.4 的緩沖液中,2 h 內 Alo 的累積釋放率只有 1.45% ± 0.21%。實驗結果說明,Alo NPs 的藥物釋放行為呈 pH 響應型,可以通過環境 pH 值來控制藥物的釋放行為。
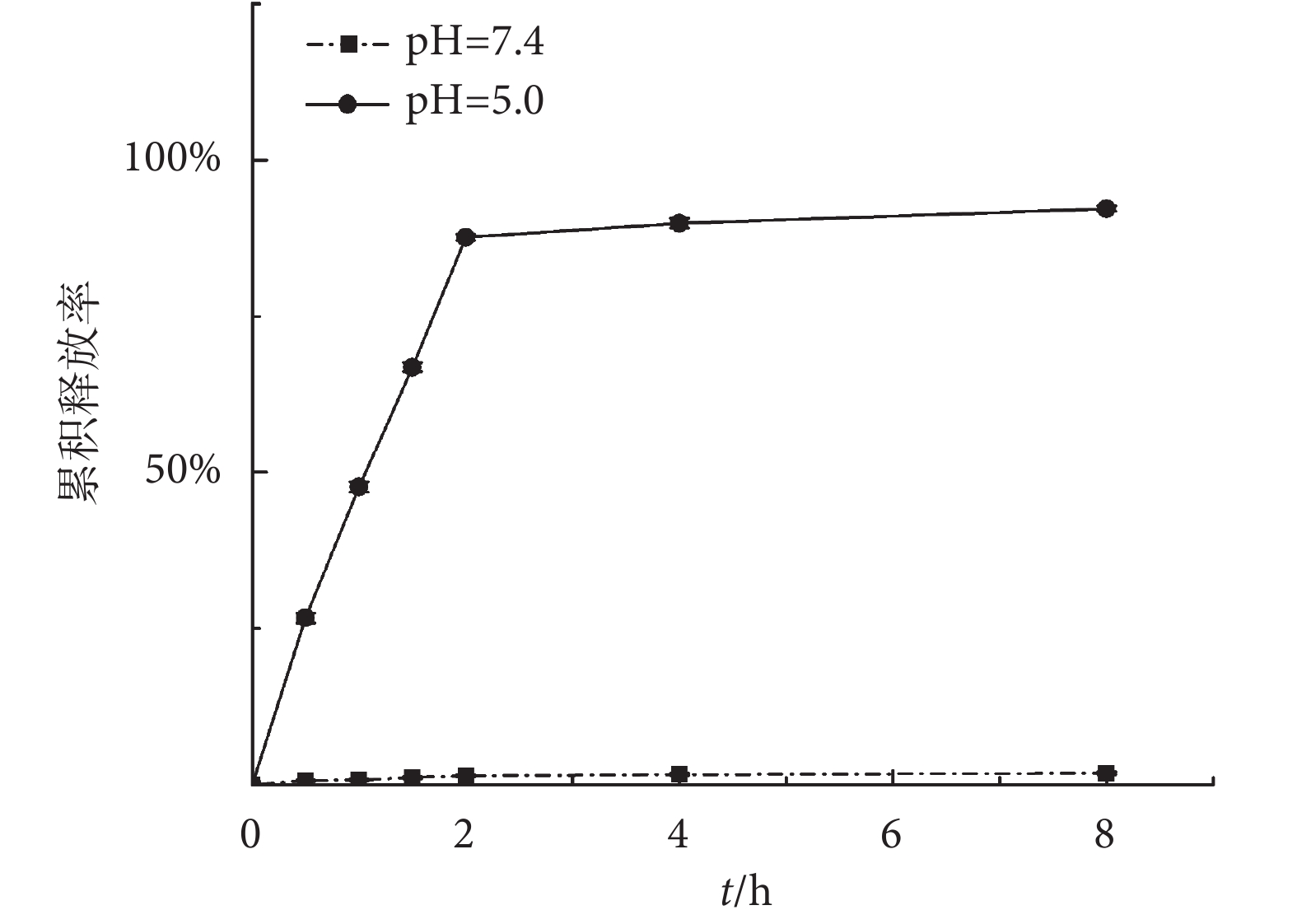 圖3
Alo NPs 在不同 pH 值緩沖液中的藥物釋放行為
Figure3.
Drug release behavior in different pH buffer solution
圖3
Alo NPs 在不同 pH 值緩沖液中的藥物釋放行為
Figure3.
Drug release behavior in different pH buffer solution
控制性地釋放藥物以提高藥物利用度,是藥物遞釋系統的另一優勢[22]。本研究利用 ZnO 的酸溶解性,控制釋放連接在 ZnO QDs 表面的 Alo,當 Alo NPs 置于酸性緩沖液中,ZnO 迅速溶解成 Zn2+,與 Alo 的結合被破壞,Alo 迅速釋放到環境介質中。而在中性緩沖液中,ZnO 穩定存在并與 Alo 共價結合,Alo 幾乎不會脫離 ZnO QDs,顯示出 Alo NPs 的穩定性。人體組織液的環境 pH 值為中性,而細胞內涵體內的環境 pH 值在 5.0 左右。因此,Alo NPs 在組織液中是不會釋放 Alo 的,只有被內吞入細胞內涵體內,Alo 才會得以釋放。Alo NPs 的 pH 控釋特性為藥物的定點釋放和利用度的提高提供了可能。
2.4 Alo NPs 對酪氨酸酶活性的抑制
表 1 是 Alo NPs 對酪氨酸酶活性抑制的實驗結果,酪氨酸酶活性隨著 Alo NPs 濃度的增加而降低,呈現出濃度依賴型。當 Alo NPs 中 ZnO QDs 的當量濃度為 12.5 μg/mL 時,酪氨酸酶活性抑制率高達 40.32% ± 1.57%。雖然 Alo NPs 與 Alo 相比對酪氨酸酶活性的抑制沒有表現出明顯的差異,但考慮到 Alo 較差的皮膚滲透性能,Alo NPs 作為外用酪氨酸酶活性抑制劑更具應用價值。
本研究選用的抑制濃度是基于課題組前期實驗結果中氧化鋅微粒對皮膚細胞的安全濃度[23],而通過共價連接后,酪氨酸酶抑制劑 Alo 的活性也未受到明顯影響。由此,ZnO QDs 可作為透皮運輸酪氨酸酶抑制劑的通用載體,來高效地遞送自身難以透過皮膚的酪氨酸酶抑制劑,這也將是課題組接下來需要研究的工作。
3 結論
本研究利用共價鍵將酪氨酸酶活性抑制劑蘆薈苦素連接在氧化鋅量子點表面,構建粒徑分布在 8 nm 左右的新型酪氨酸酶抑制劑。該抑制劑具有良好的皮膚透過性能,并具有在細胞內控制釋放蘆薈苦素的特性,對黑素細胞內酪氨酸酶活性表現出較好的抑制效果。因此,本研究制備的新型酪氨酸酶抑制劑作為外用酪氨酸酶活性抑制劑具有潛在的應用價值。
引言
黑色素的過度沉積會導致黃褐斑、黑斑等色素性皮膚病,更嚴重的會誘發黑色素瘤[1-2],嚴重影響著人類的美觀和健康。黑色素的生成需經酪氨酸酶兩步催化,將 L-酪氨酸催化生成多巴醌,多巴醌經兩個非酶促反應途徑生成黑色素,可見酪氨酸酶是黑色素形成的關鍵限速酶。當酪氨酸酶過量表達時會導致黑色素的大量沉積,引發色素紊亂相關疾病。所以,使用高效低毒的酪氨酸酶抑制劑可有效防止黑色素的過度沉積[3]。近年來,研究報道黃酮及其衍生物、有機酸類、苷類、萜類和酯類等酪氨酸酶抑制劑,均對酪氨酸酶表現出良好的抑制作用[4-6]。然而,透皮率低這一缺點嚴重限制了外用酪氨酸酶抑制劑對黑素細胞中酪氨酸酶的抑制作用[7],使其在化妝品和臨床應用上的功效并不明顯。目前,只有極少研究關注酪氨酸酶抑制劑的透皮輸送問題[8-9]。這些研究都是利用經典的穿膜肽聚精氨酸來提高酪氨酸酶抑制劑的透皮效率,雖然透皮性能有所提高,但是聚精氨酸及其衍生物高昂的制備成本和酪氨酸酶抑制劑的無控制性釋放,仍然限制著酪氨酸酶抑制劑透皮運輸的廣泛應用[10]。
氧化鋅(zinc oxide,ZnO)是被美國食品藥品監督管理局認證的可安全應用于食品藥品的五種金屬氧化物之一[11]。ZnO 來源廣泛,價格低廉,且易于合成與修飾,是制備藥物遞送系統的理想基體材料。此外,研究表明氧化鋅量子點(zinc oxide quantum dots,ZnO QDs)作為藥物載體可以顯著提高透皮率差的藥物的透皮性能[12],并且當 ZnO QDs 被胞吞入細胞內涵體后,進入 pH 值小于 5.5 介質中可以快速溶解為鋅離子,智能釋放負載于其上的藥物[13]。因此,本研究擬選用 Zn QDs 共價連接透皮性能差的高效酪氨酸酶抑制劑——蘆薈苦素(aloesin,Alo)[14],制備一種新型酪氨酸酶抑制劑遞送系統,以期實現高效透皮運輸酪氨酸酶抑制劑的同時,又能智能控釋酪氨酸酶抑制劑,提高藥物利用度,進而提高外用酪氨酸酶抑制劑的功效。
1 材料和方法
1.1 試劑與儀器
二水乙酸鋅、正庚烷、3-氨丙基三乙氧基硅烷(aminopropyltriethoxysilane,APTES(98% +))、N,N′-羰基二咪唑[N,N′-carbonyldiimidazole,CDI(98% +)],購自上海泰坦科技股份有限公司;氫氧化鈉、無水乙醇、N,N-二甲基甲酰胺購自天津永大化學試劑有限公司;左旋多巴(99%)、曲拉通 X-100(分子生物學級)購自上海阿拉丁生化科技股份有限公司;Alo 購自加拿大 Toronto Research Chemicals 公司;黑素細胞、黑素細胞專用培養基購自美國 ScienCell 研究實驗室。未特別標注試劑均為分析純。
S90 型動態光散射儀(dynamic light scattering,DLS)購自英國 Malven 公司;Spectrum GX 型傅里葉變換紅外光譜儀(Fourier transform infrared spectroscopy,FTIR)、Lambda 900 紫外-可見分光光度計購自美國 Perkin Elmer 公司;Tecnai G20 型透射電子顯微鏡(transmission electron microscope,TEM)購自美國 FEI 公司;Q600 型熱重分析儀(thermal gravimetric analyzer,TGA)購自美國 TA 儀器公司;TP-6 透皮測試儀購自天津新天光分析儀器技術有限公司。
1.2 表面氨基化的 ZnO QDs 的合成
將 0.41 g 二水乙酸鋅溶解于 10 mL 無水乙醇中,68℃ 下保溫攪拌 1.5 h,冰浴中冷卻。另將 0.16 g 氫氧化鈉投入 5 mL 無水乙醇中配制氫氧化鈉的乙醇溶液,逐滴加入到乙酸鋅溶液中,繼續攪拌混合溶液直至溶液在 365 nm 紫外燈下顯示綠色熒光。加入正庚烷沉淀后離心得到 ZnO QDs。將制備好的 ZnO QDs 加入 APTES 的無水乙醇溶液中(V∶V = 0.08 mL∶15 mL),保持反應溫度 50℃,攪拌 7 h。反應后,分別用無水乙醇和去離子水洗滌沉淀物三次,并在真空下干燥,得到表面氨基化的 ZnO QDs(NH2@ZnO)。
1.3 Alo NPs 的合成
0.13 g Alo 和 0.05 g CDI 溶于 2 mL N,N-二甲基甲酰胺中,室溫下攪拌 2 h 后,逐滴加入含有 0.38 g 充分分散的氨基化 ZnO QDs 的 N,N-二甲基甲酰胺懸濁液中。室溫下攪拌反應 7 h,將產物分別用乙醇和去離子水洗滌三次,真空干燥,得到 Alo NPs。
1.4 結構與性能表征
TEM:工作電壓 200 kV。DLS:將 Zn QDs 和 Alo NPs 分散于純水中利用 DLS 測量粒徑分布。FTIR:采用溴化鉀壓片法對 Zn QDs、氨基化的 Zn QDs 和 Alo NPs 樣品進行 FTIR 測試,波數范圍:4 000~400 cm–1。TG:溫度范圍 0~800℃。
1.5 Alo NPs 透皮性能測定
利用透皮測試儀測量 Alo NPs 的透皮性能,選擇豚鼠腹部皮膚為透皮模型。在 35℃ 條件下,樣品室中放置 10 mg/mL 的 Alo NPs,一定時間點(1、2、4、8、16、24 h)收集透過的 Alo NPs,并計算累積滲透量。設置 Alo 和 ZnO QDs 為實驗對照組。
1.6 Alo 的體外釋放行為考察
將 5.20 mg Alo NPs 分散于 2 mL 不同 pH(5.0,7.4)的 PBS 并密封在透析袋(MW = 3 000)中。將透析袋分別浸入 3 mL 的不同 pH 值的 PBS 中并在 37℃ 下攪拌 72 h。在預定時間點(0.5、1.0、1.5、2.0、4.0、8.0 h)用紫外分光光度計測量透析液中 Alo 的濃度,以計算其累積釋放率。
1.7 酪氨酸酶活性的抑制
采用多巴氧化法測定酪氨酸酶活性。將黑素細胞以每孔 8 000 個的密度接種到 96 孔板中。12 h 后,分別加入不同量的 Alo NPs 使得最終 ZnO QDs 的當量濃度為 3.75、6.25 和 12.50 μg/mL。繼續培養 72 h,用 PBS 洗滌黑素細胞兩次,并加入 50 μL 1% 曲拉通 X-100。將黑素細胞置于 –80℃ 冰箱中 30 min,然后在室溫下取出放置 0.5 h 直至細胞破裂。裂解的細胞升溫至 37℃,加入 50 μL 0.2% 左旋多巴。37℃ 保溫 2 h,利用紫外-可見分光光度計測定 475 nm 處的吸光度,計算對酪氨酸酶活性的抑制率。設置相應濃度的 Alo 和 ZnO QDs 為實驗對照組。使用未經外加添加物處理的黑素細胞作為空白對照,用式(1)計算酪氨酸酶活性:
 |
其中,Ta 是酪氨酸酶活性,At 是處理組的吸光度,Ab 是空白對照組的吸光度。所有實驗組做六個復孔。
2 結果與討論
2.1 Alo NPs 的合成與表征
圖 1a 為 Zn QDs 和 Alo NPs 的 TEM 照片,圖中可觀察到 ZnO QDs 呈類圓形,具有很好的單分散性。但是當 Zn QDs 經過表面改性,共價接枝上 Alo 后,發生了一定程度的團聚,且粒徑有所增大。通過 DLS 測定兩種納米粒子的粒徑分布,結果顯示,原本粒徑分布在 4 nm 左右的 ZnO QDs 粒徑增加到 8 nm 左右(見圖 1b),與 TEM 照片結果吻合。圖 1c 是 ZnO QDs、NH2@ZnO 和 Alo NPs 的紅外光譜。相比 ZnO QDs 的光譜,NH2@ZnO 的光譜在 3 396 和 1 618 cm–1左右處出現兩個吸收峰,分別屬于 N-H 的伸縮和彎曲振動峰,說明氨基已經成功接枝在 ZnO QDs 表面。Alo NPs 光譜中出現 2 926 cm–1處的尖峰是-CH3 的振動峰,1 600~1 400 cm–1之間出現的數個吸收峰為苯環骨架的特征吸收峰,這些特征峰說明 Alo 已成功地與氨基化的 ZnO QDs 結合。以上分析說明 Alo NPs 已成功合成。
 圖1
Alo NPs 的表征
圖1
Alo NPs 的表征
a. TEM 照片;b. 粒徑分布;c. 紅外圖譜;d. 熱重曲線
Figure1. Characterization of Alo NPsa. TEM images; b. size distribution; c. FTIR; d. TGA
利用 TGA 分析 Alo NPs 中各種成分所占的質量分數,結果如圖 1d 所示,在 220~240℃ 和 620~680℃ 兩個溫度段,Alo NPs 存在明顯的失重區間,分別由 APTES 和 Alo 蒸發所致,經過分析可得 ZnO QDs 和 Alo 的質量分數分別為 39.27% 和 35.14%。
2.2 Alo NPs 的透皮性能
以豚鼠腹部皮膚作為透皮模型測試 Alo NPs 的透皮性能。結果如圖 2 所示,Alo NPs 在 24 h 后累積滲透量達到了(30.36 ± 1.09)μg/cm2,雖然略低于 ZnO QDs 的累積滲透量,但是同 Alo 僅有(3.97 ± 0.76)μg/cm2的累積滲透量相比,有明顯的增加。以上結果說明,將 Alo 連接在 Zn QDs 表面能夠顯著地提高 Alo 的透皮性能。
 圖2
Alo NPs 的透皮性能
Figure2.
Skin penetration of Alo NPs
圖2
Alo NPs 的透皮性能
Figure2.
Skin penetration of Alo NPs
皮膚透過率差一直是限制外用酪氨酸酶抑制劑在化妝品或臨床應用效果的重要因素[15],而許多酪氨酸酶抑制劑的添加量也是有規定限量的,因此,提高酪氨酸酶抑制劑的透皮率成為解決這一矛盾的有效方法。目前,關于提高酪氨酸酶抑制劑透皮率的方法僅限于利用經典的穿膜肽聚精氨酸來幫助酪氨酸酶抑制劑透過皮膚[8-9],雖然透皮性能有所提高,但是聚精氨酸及其衍生物高昂的制備成本仍然限制著酪氨酸酶抑制劑透皮運輸的廣泛應用。此外,利用聚精氨酸及其衍生物透皮遞送目標藥物需要將兩者進行復雜的化學結合,直接降低了可操作性。近些年隨著納米技術的發展,納米藥物遞釋系統在透皮運輸的應用中呈現出極大的優勢,具有制備方法簡單、成本低、運輸遞送率高的特點[16-18]。研究報道 ZnO QDs 可以顯著提高藥物的透皮性能[12],由于其粒徑小,可以穿透角質層和毛囊,也可以從角質細胞間穿過[19-20]。本研究中的結果也顯示出 Zn QDs 良好的透皮性能。Alo 分子量較大、熔點高,又具有一定親水性,自身難以透過皮膚,但負載在 ZnO QDs 表面后,可隨之透過皮膚。由于 ZnO QDs 本身不溶于水,但分散性良好,且具有巨大的比表面積,比表面積與皮膚滲透性能成正相關性[21],所以當 Alo 負載在其表面后改變了 ZnO QDs 表面性質,使得 Alo NPs 的透皮性能稍低于 ZnO QDs,但是明顯高于 Alo。更重要的是,Alo 負載于 ZnO QDs 上,操作步驟簡便。因此,Alo NPs 展現出巨大的透皮遞送優勢。
2.3 Alo NPs 的體外智能釋藥行為
Alo NPs 在不同 pH 值緩沖液中的藥物釋放行為如圖 3 所示。Alo-NPs 在 pH 為 5.0 的緩沖液中,2 h 即能累積釋放 87.63% ± 0.46% 的 Alo,而在 pH 為 7.4 的緩沖液中,2 h 內 Alo 的累積釋放率只有 1.45% ± 0.21%。實驗結果說明,Alo NPs 的藥物釋放行為呈 pH 響應型,可以通過環境 pH 值來控制藥物的釋放行為。
 圖3
Alo NPs 在不同 pH 值緩沖液中的藥物釋放行為
Figure3.
Drug release behavior in different pH buffer solution
圖3
Alo NPs 在不同 pH 值緩沖液中的藥物釋放行為
Figure3.
Drug release behavior in different pH buffer solution
控制性地釋放藥物以提高藥物利用度,是藥物遞釋系統的另一優勢[22]。本研究利用 ZnO 的酸溶解性,控制釋放連接在 ZnO QDs 表面的 Alo,當 Alo NPs 置于酸性緩沖液中,ZnO 迅速溶解成 Zn2+,與 Alo 的結合被破壞,Alo 迅速釋放到環境介質中。而在中性緩沖液中,ZnO 穩定存在并與 Alo 共價結合,Alo 幾乎不會脫離 ZnO QDs,顯示出 Alo NPs 的穩定性。人體組織液的環境 pH 值為中性,而細胞內涵體內的環境 pH 值在 5.0 左右。因此,Alo NPs 在組織液中是不會釋放 Alo 的,只有被內吞入細胞內涵體內,Alo 才會得以釋放。Alo NPs 的 pH 控釋特性為藥物的定點釋放和利用度的提高提供了可能。
2.4 Alo NPs 對酪氨酸酶活性的抑制
表 1 是 Alo NPs 對酪氨酸酶活性抑制的實驗結果,酪氨酸酶活性隨著 Alo NPs 濃度的增加而降低,呈現出濃度依賴型。當 Alo NPs 中 ZnO QDs 的當量濃度為 12.5 μg/mL 時,酪氨酸酶活性抑制率高達 40.32% ± 1.57%。雖然 Alo NPs 與 Alo 相比對酪氨酸酶活性的抑制沒有表現出明顯的差異,但考慮到 Alo 較差的皮膚滲透性能,Alo NPs 作為外用酪氨酸酶活性抑制劑更具應用價值。
本研究選用的抑制濃度是基于課題組前期實驗結果中氧化鋅微粒對皮膚細胞的安全濃度[23],而通過共價連接后,酪氨酸酶抑制劑 Alo 的活性也未受到明顯影響。由此,ZnO QDs 可作為透皮運輸酪氨酸酶抑制劑的通用載體,來高效地遞送自身難以透過皮膚的酪氨酸酶抑制劑,這也將是課題組接下來需要研究的工作。
3 結論
本研究利用共價鍵將酪氨酸酶活性抑制劑蘆薈苦素連接在氧化鋅量子點表面,構建粒徑分布在 8 nm 左右的新型酪氨酸酶抑制劑。該抑制劑具有良好的皮膚透過性能,并具有在細胞內控制釋放蘆薈苦素的特性,對黑素細胞內酪氨酸酶活性表現出較好的抑制效果。因此,本研究制備的新型酪氨酸酶抑制劑作為外用酪氨酸酶活性抑制劑具有潛在的應用價值。