細胞冷凍干燥分為凍結和干燥兩個過程,其中凍結過程中冰晶對細胞造成的機械損傷和溶質損傷不容忽視,而使用凍干保護劑可以減少此過程中細胞受到的傷害。為了探究凍干保護劑凍結過程中對細胞的保護機制以及優化凍干保護劑配方,本實驗以肝癌細胞 Hep-G2 為對象,利用差示掃描量熱儀(DSC)探究不同凍干保護劑在凍結過程中的熱物性和未凍水份額;通過細胞凍存實驗,檢測使用不同保護劑的肝癌細胞 Hep-G2 的臺酚藍染色存活率和 24 h 貼壁率,結果表明配方為 40% (W/V)聚乙烯吡咯烷酮 K30(PVP) + 10%(V/V) 丙三醇 + 15%(V/V) 胎牛血清(FBS) + 20%(W/V)海藻糖的保護劑對細胞凍結過程的保護效果最佳,細胞 24 h 貼壁率可以達到 44.56% ± 2.73%。因此,研究表明該凍干保護劑配方在冷凍過程中可以有效保護細胞。
引用本文: 李維杰, 宋萍, 劉寶林. 肝癌細胞 Hep-G2 凍結過程中凍干保護劑熱物性和效果研究. 生物醫學工程學雜志, 2019, 36(5): 803-809. doi: 10.7507/1001-5515.201711004 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
細胞的冷凍干燥通常分為保護劑的添加、凍結、一次干燥、二次干燥和封裝儲存五個步驟[1]。然而凍結過程中,冰晶的形成可能會影響細胞質結構,甚至細胞骨架基因組的相關結構。研究表明添加保護劑可以減少細胞凍結或脫水帶來的傷害。保護劑的冷凍保護能力取決于滲透系數、不成對電子數量、溶解度和保護劑對細胞膜結構的影響[2-3]。Akhoondi 等[4]發現二甲基亞砜(Me2SO)雖然不能在凍結過程中阻止細胞膜相變,但可以降低水分運輸活化能,從而對細胞起到保護作用。丙三醇作為滲透性保護劑,可以在凍結期間調節細胞脫水的速率和程度[5]。而糖類和高聚物的組合能有效防止膜的泄漏[6],因此常用來作為凍干保護劑。
差示掃描量熱儀(differential scanning calorimeter,DSC)是在程序控溫下測量樣品熱學性質的儀器。通過熱焓值的變化,可以從側面反映出樣品的相變轉化。因此,本研究利用 DSC 測量了以上不同質量(體積)濃度的凍干保護劑[二甲基亞砜(Me2SO)、丙三醇、聚乙烯吡咯烷酮 K30(PVP)和海藻糖]在凍結過程的熱學特性的參數,包括共晶焓、熔融焓以及未凍水份額,從而對保護劑在凍結過程的篩選做出了理論分析并提供了一定的參考價值;再以肝癌細胞 Hep-G2 為凍存對象,通過對臺酚藍存活率和 24 h 貼壁率的檢測結果進行分析比較,加以實驗驗證。
1 材料與方法
1.1 材料與試劑
人肝癌細胞 Hep-G2(中國科學院,北京);Me2SO(APPLICHEM,德國);丙三醇、PVP、海藻糖(國藥集團化學試劑有限公司,上海);胎牛血清(fetal bovine serum,FBS)和胰蛋白酶(賽默飛世爾生物化學制品有限公司,北京);Dulbecco’s Modified Eagle Medium(DMEM)培養基(GIBCO,美國);臺盼藍染色液(2X)(國藥集團化學試劑有限公司,上海);D-hanks 液由 NaCl、KCl、Na2HPO4、KH2HPO4 配制(國藥集團化學試劑有限公司,上海)。
1.2 儀器與設備
200F3 DSC 差示掃描量熱儀(耐馳公司,德國);二氧化碳培養箱(上海博訊實業有限公司);低速臺式離心機(上海安亭科學儀器廠);DW-8GL388A 型超低溫冰箱(青島海爾特種電器有限公司);SW-CJ-1B 超凈工作臺(蘇州凈化有限公司)。
1.3 實驗方法
1.3.1 凍干保護劑的配制
實驗分組:共配制 12 組保護劑,根據保護劑不同種類又分為五大組,第一組序號為 0,是對照組,只有基礎液 DMEM;第二組序號為 1~3,是 Me2SO 組;第三組序號為 4~8,是 PVP 組;第四組序號為 9~10,是丙三醇組;第五組序號為 11,是根據第 1~4 大組實驗的結果選出的配方,為復方保護劑組。各組具體成分如表 1 所示。
1.3.2 DSC 實驗
以五組(12 種)保護劑作為研究對象,樣品質量為 10~20 mg,精確到 0.01 mg。DSC 程序設定為:20℃ 等溫 10 min,以 10℃/min 降到?80℃,平衡 10 min,再以 10℃/min 升溫到 30℃。參比側放置空白小坩堝,實驗時每個樣品做三個平行樣。采用 DSC 分析軟件 NETZSCH-Proteus,讀取共晶溫度和共晶焓,以及熔融起始溫度(Onset)和熔融焓。通過分析保護劑凍結過程的 DSC 熱流曲線,研究保護劑的低溫損傷機制以及對保護劑配方篩選進行理論指導。
1.3.3 細胞獲取及凍存實驗
以肝癌細胞 Hep-G2 為凍存研究對象,對前期 DSC 結果進行驗證。
取對數生長期的細胞(一個皿的 80%~90% 為最好),抽取培養皿中培養基,每個皿均加入 2 mL D-Hank’s,清洗 2 遍,用 0.5 mL 胰酶消化 1~2 min,當在顯微鏡下觀察細胞呈圓粒狀并較均勻地分布在培養皿中時,每個皿加入 2 mL DMEM 培養基終止消化,并將所有細胞吸入到同一離心管中,1 000 r/min,離心 5 min,倒去上清液。將上述配好的 12 種凍干保護劑分別取 3 mL 加入到細胞中,搖晃均勻,平衡 5 min 后,分別取 1 mL 到三支凍存管中,并標號以示區別。將凍存管放入-80℃ 深低溫冰箱,凍存 12 h 后進行細胞檢測。
1.3.4 細胞檢測
凍存 12 h 后將凍存管從深低溫冰箱中取出,于 37℃ 水浴鍋中快速搖晃復溫,1 000 r/min 離心 5 min,去上清液,加 1 mL 培養基吹打均勻,再取樣進行細胞形態觀察及臺酚藍存活率和 24 h 貼壁率的檢測。
(1)臺酚藍染色法檢測存活率[7]:
取 20 μL 0.4% 臺酚藍溶液和 20 μL 復水后細胞懸浮液,混勻,滴加在細胞計數板上,在 3 min 內插入細胞計數儀中,對其進行計數。按以下公式計算存活率:
 |
(2)24 h 貼壁率檢測:復溫后的細胞,加入 2 mL DMEM,于 1 200 r/min 離心 10 min,棄去上清液,加 4 mL DMEM,接種到培養皿中,放入 37℃、5% CO2 培養箱中培養,24 h 換液后,將培養皿中培養液吸入到離心管中,計數未貼壁細胞。接著用胰酶消化后,加 2 mL DMEM,計數貼壁細胞。計算公式如下:
 |
1.3.5 數據分析
用 origin 8.5 進行圖像處理,SPSS Statistics 軟件進行統計分析,組間數據比較采用 Duncan 檢驗,所有實驗數據均采用均值 ± 標準差的形式。
2 結果與分析
2.1 五組(12 種)凍干保護劑升降溫階段的相變觀察
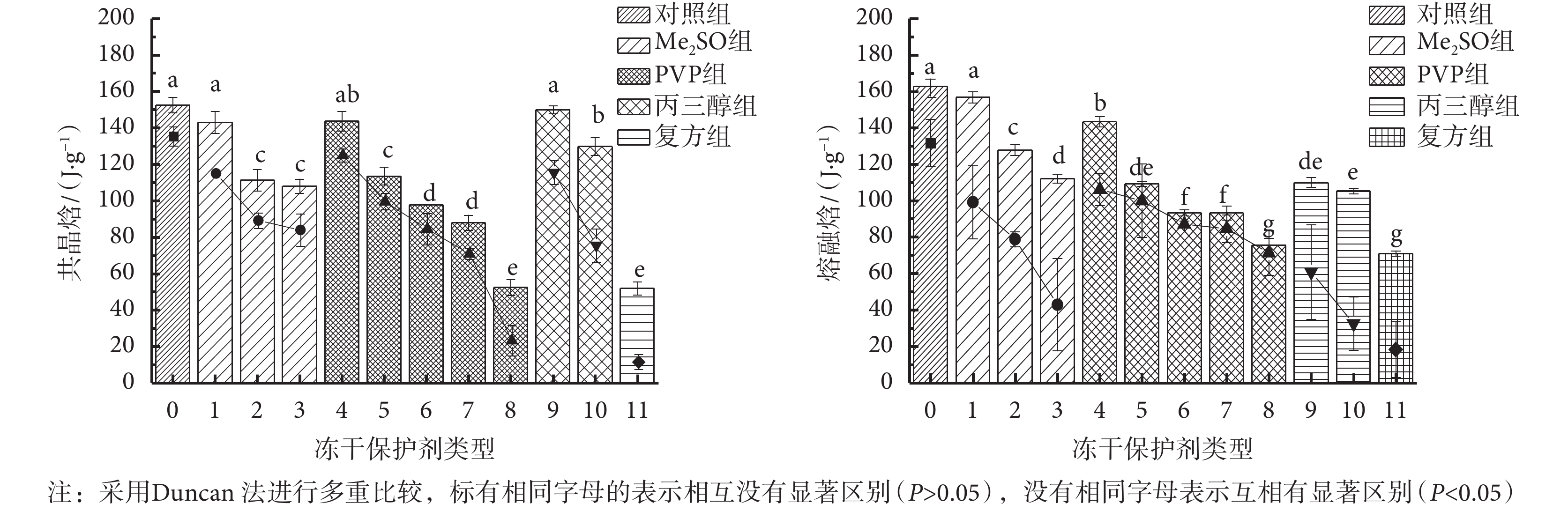
根據 DSC 的熱流曲線圖,可以獲得每種凍干保護劑的共晶焓值和熔融焓值。圖 1 表示的是五組(12 種)凍干保護劑降溫階段共晶焓的變化及升溫階段熔融焓的變化。
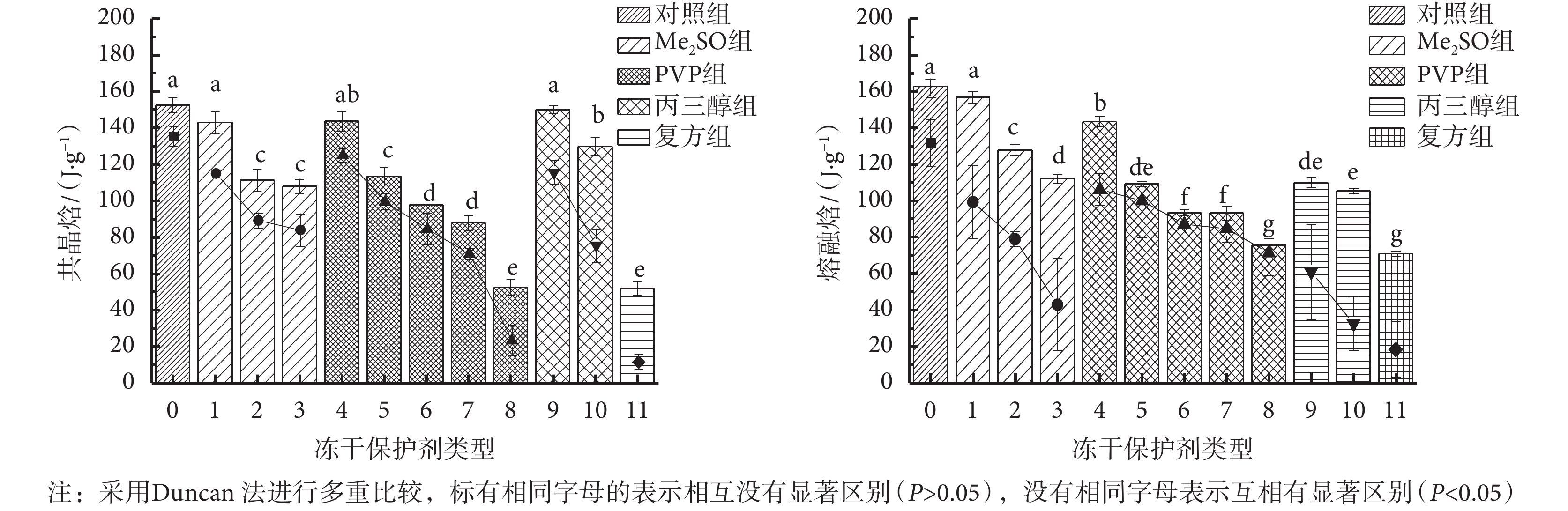 圖1
五組(12 種)保護劑的共晶焓及熔融焓
Figure1.
Eutectic enthalpy and melting enthalpy of five groups (12 species) of lyoprotectants
圖1
五組(12 種)保護劑的共晶焓及熔融焓
Figure1.
Eutectic enthalpy and melting enthalpy of five groups (12 species) of lyoprotectants
由圖 1 可以看出,五組(12 種)凍干保護劑的共晶焓和熔融焓有著相似的趨勢,即:與對照組相比,添加了 Me2SO、PVP、丙三醇的保護劑組以及復方組的共晶焓和熔融焓均有著不同程度的降低,且每組保護劑中,隨著保護劑濃度的增大,共晶焓和熔融焓會逐漸降低。共晶焓的變化表明,1~11 號的保護劑相變開始的溫度比對照組低,冰晶成核的溫度低,共晶焓值小;熔融焓的變化表明,在升溫段時,熔融焓值小,相變生成的冰晶少,因此受到的冰晶機械損傷減小。這可能與保護劑的玻璃化性質和官能團有關。
Me2SO 組中,10% Me2SO 組(序號 2)和 15% Me2SO 組(序號 3)的共晶焓和熔融焓明顯低于 5% Me2SO 組(序號 1)(P < 0.05),說明相較于 5% Me2SO 組,10% Me2SO 組和 15% Me2SO 組在凍結過程中釋放的熱量少,形成的冰晶少,有大量 Me2SO 分子會發生水合作用形成更多的結合水,從而減小了體系中的自由水濃度,弱化了水的結晶過程。
PVP 組中,隨著 PVP 質量濃度的增大,共晶焓和熔融焓逐漸減小,且 60% PVP 組(序號 8)的共晶焓和熔融焓顯著低于其他濃度的 PVP 組(P < 0.05),說明在凍結過程中,高濃度的 PVP 可以抑制冰晶的生長,減小冰晶造成的機械損傷。但是,過高濃度的 PVP 會給體系帶來較高的滲透壓,且一旦沒有冰晶生成或冰晶很少,后續的升華干燥過程則難以進行。
對于丙三醇組,10% 丙三醇組(序號 9)和 20% 丙三醇組(序號 10)的熔融焓均與對照組差異有統計學意義(P < 0.05)。這說明丙三醇的添加使保護劑熱焓值降低,即該過程中生成的冰晶量小。這是由于丙三醇與水分子結合形成了氫鍵,占據了自由水含量,從而降低了冰晶生成概率。
2.2 五組(12 種)保護劑 DSC 熱流曲線
利用 DSC 測得五組(12 種)凍干保護劑在升降溫過程中的熱物性參數,觀察相變過程,篩選最優保護劑配方。
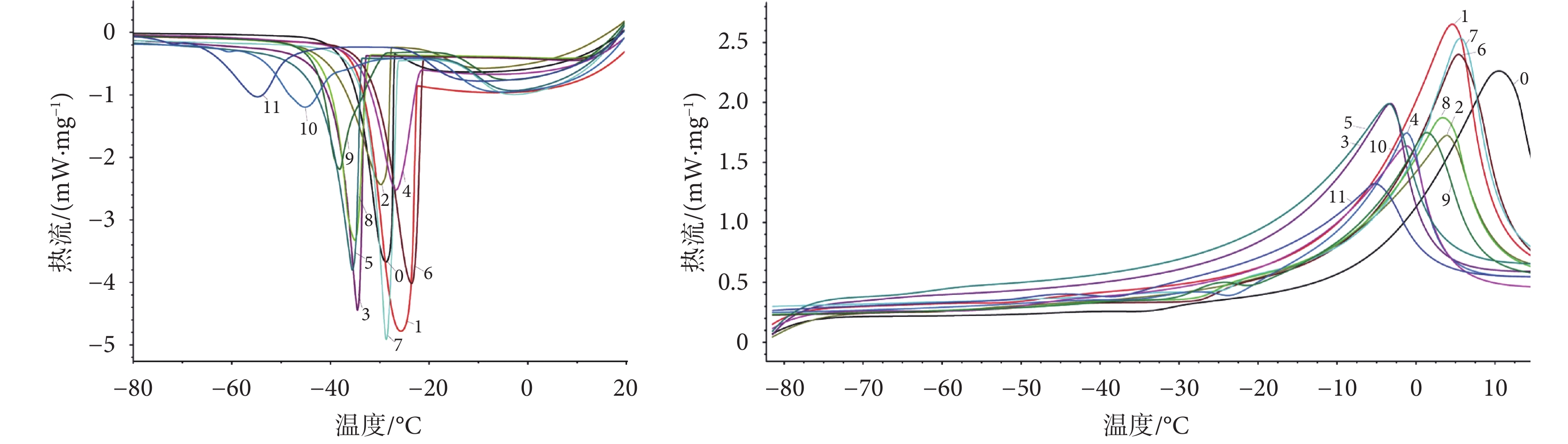
如圖 2 所示,比較五組(12 種)保護劑的降溫過程發現,復方組的共晶溫度和共晶焓與對照組的差異有統計學意義(P < 0.05),且與其他保護劑組相比也有顯著差異。這表明在降溫過程中,復方組相變發生的溫度最低,釋放的熱量最少,與水的結合能力最強,溶液粘度最大,由冰晶造成的物理損傷最小。
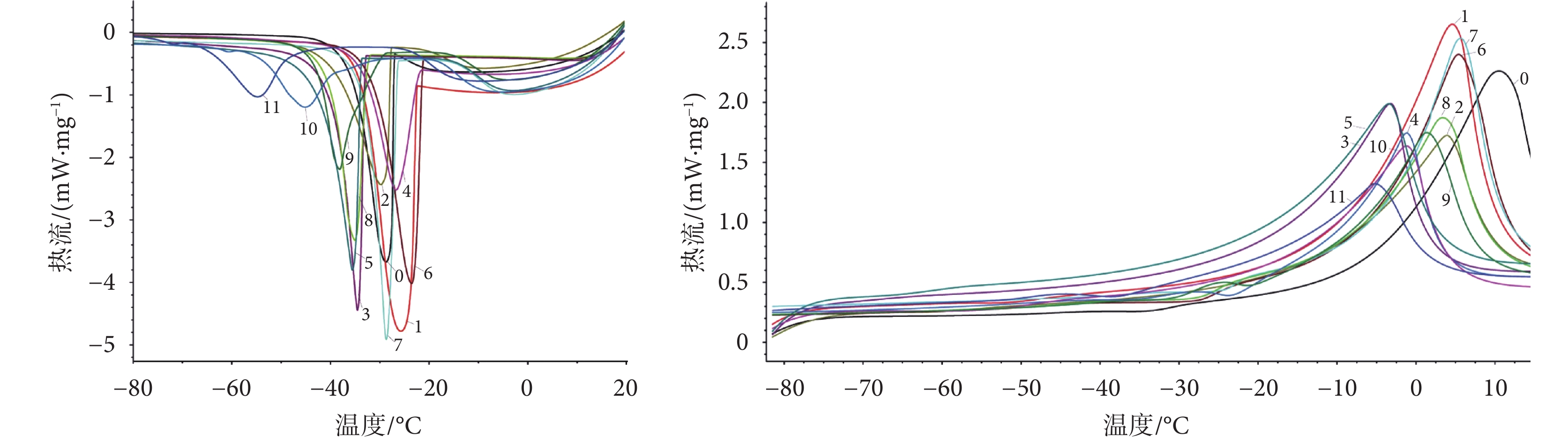 圖2
五組(12 種)保護劑降溫、升溫過程的 DSC 熱流曲線
Figure2.
DSC heating and cooling thermograms of five groups (12 species) of lyoprotectants
圖2
五組(12 種)保護劑降溫、升溫過程的 DSC 熱流曲線
Figure2.
DSC heating and cooling thermograms of five groups (12 species) of lyoprotectants
在保護劑的升溫過程,復方組的熔融起始溫度降低,熔融焓值減小,峰面積最小,且與對照組相比,熔融焓值減小了 56.38%,這表明復方組中 40% PVP 和 10% 丙三醇的組合強烈影響了保護劑的熔融相變過程,溫度跨度減小,意味著當保護劑加入到細胞中,在升溫過程中,細胞所經歷的危險溫區減小。因此,復方組要優于其他四組保護劑。
綜上所述,通過 DSC 研究了五組(12 種)保護劑在凍結和升溫過程中的熱學性質,發現與對照組相比,四組(11 種)保護劑仍會發生相變,但溫度范圍更廣、更平緩,這對在凍干的預凍步驟中保護劑的篩選提供了一個理論上的支持和參考。
2.3 五組(12 種)保護劑未凍水份額比較
由 DSC 熱流圖可以觀察出保護劑結晶焓值的變化,利用經驗公式[8],從而得到五組(12 種)保護劑的未凍水份額,見表 2。其公式如下:
 |
其中,α 為未凍水份額;ω 為樣品水分含量;Tf 為樣品在凍結過程中的結晶溫度,以℃為單位;ΔH(Tf)DSC 為利用 DSC 測得的樣品在 Tf 溫度下的結晶焓,以 J/g 為單位;ΔH(Tf)為純水的結晶焓,以 J/g 為單位;其與溫度的公式為:
 |
由表 2 可以看出,與對照組相比,四組(11 種)保護劑的未凍水份額均有不同程度升高,且同種保護劑中,隨著保護劑濃度增大,未凍水份額增大。其中,60% PVP 組(序號 8)和復方組(序號 11)的未凍水份額與對照組相比,差異有統計學意義(P < 0.05),這主要是與保護劑分子中的官能團有關[9]。但當 PVP 濃度過高時,體系滲透壓增大,不僅加大了干燥的難度,還會對細胞存活造成很大影響。
2.4 細胞實驗
利用 Duncan 法進行多重比較,對照組和添加四組(11 種)保護劑的細胞凍存復溫后的臺酚藍存活率和 24 h 貼壁率結果見表 3。
由表 3 可知,添加四組(11 種)保護劑的細胞凍存復溫后的臺酚藍存活率和 24 h 貼壁率與對照組(0 號)的差異均有統計學意義(P < 0.05),這表明添加體積分數為 5%~15% 的 Me2SO 和 10%~20% 的丙三醇,以及質量濃度為 20%~60% 的 PVP 保護劑對肝癌細胞冷凍干燥的凍結過程有一定的保護作用。其中,20%~40% PVP 組(序號 4~6)和復方組(序號 11)的存活率明顯高于其他組(P < 0.05),但 20%~40% PVP 組(序號 4~6)的 24 h 貼壁率較低,而復方組(序號 11)的 24 h 貼壁率顯著高于其他組(P < 0.05)。這表明復方組對細胞在凍結過程中的保護效果最佳,這與 DSC 實驗結果是一致的。
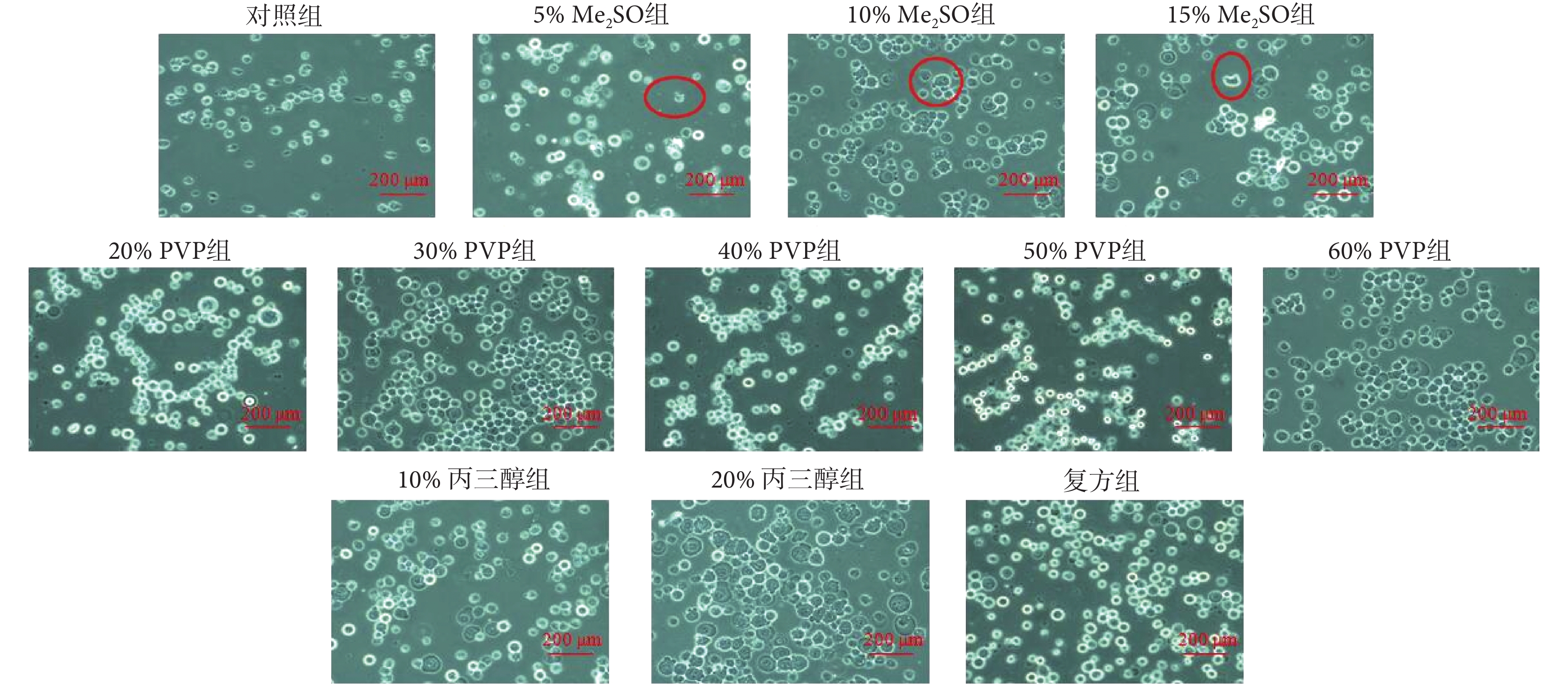
如圖 3 所示,在顯微鏡下觀察細胞形態發現,Me2SO 組中細胞幾乎都發生了不同程度的皺縮,而丙三醇組、20%~40% PVP 組和復方組(序號 11)中細胞形態完整,表現為細胞體積較大,呈圓球狀,在視野中明亮(均為被胰酶消化后的細胞),這可能與 Me2SO 的毒性有關。
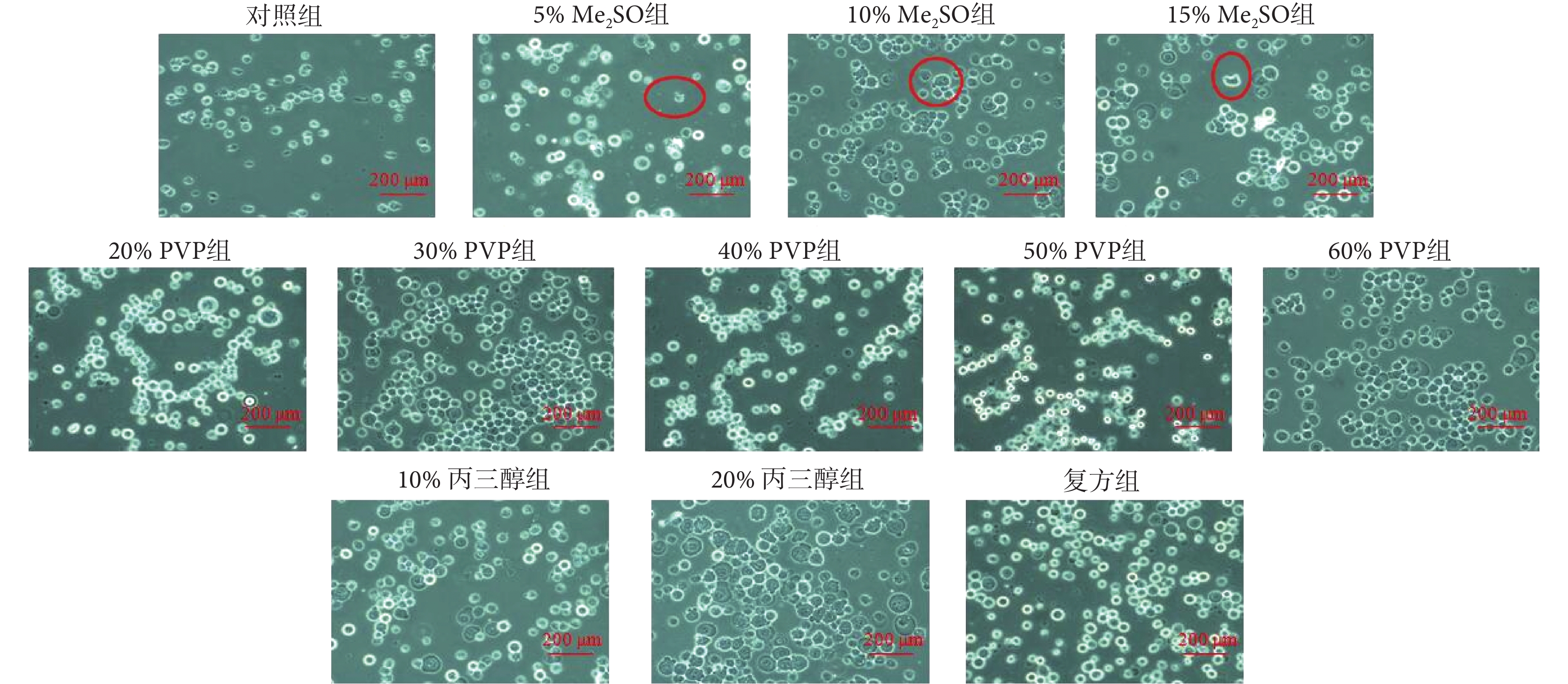 圖3
添加五組(12 種)保護劑細胞凍存 12 h 后復蘇的細胞形態圖
Figure3.
Cell morphology of Hep-G2 with five groups (12 species) of lyoprotectants after cryopreservation for 12 h
圖3
添加五組(12 種)保護劑細胞凍存 12 h 后復蘇的細胞形態圖
Figure3.
Cell morphology of Hep-G2 with five groups (12 species) of lyoprotectants after cryopreservation for 12 h
綜上所述,在細胞凍存實驗中,通過臺酚藍存活率和 24 h 貼壁率檢測五組(12 種)保護劑的保護效果。結果發現,與對照組相比,四組(11 種)保護劑對細胞凍存均有一定保護作用,其中復方保護劑組在肝癌細胞的凍結過程中保護效果最好,與 DSC 的實驗結論相一致。
3 討論
利用冷凍干燥技術保存細胞時,細胞會經歷凍結和干燥兩個頗為激烈的過程,給細胞膜及胞內物質均帶來巨大的損傷,往往造成細胞的死亡或者功能的喪失[10]。其中,細胞膜是凍結和熔融期間細胞凍存的主要損傷部位。在凍結過程中,細胞由冷凍引起的損傷主要有兩個方面:機械損傷和溶質損傷[11]。機械損傷即低溫所引起細胞內外冰晶的生長,產生的機械剪切導致細胞膜和胞內物質受到巨大損傷。而溶質損傷則為在凍結過程中,由于細胞外先結冰,胞外濃度增大,胞內外產生了一定的濃度差,胞內水分會向胞外滲透,同時在高濃度的胞外溶液中經歷的時間過長,從而導致蛋白質變性或細胞嚴重脫水、皺縮,甚至死亡。Oldenhof 等[12]發現凍結而引起的細胞膜脫水的程度取決于冰核溫度,并顯示出 Arrhenius 行為。Wolkers 等[13]利用低溫顯微鏡觀察 LNCaP 前列腺腫瘤細胞凍結過程中的細胞損傷,發現膜的相變開始與冰的成核溫度是高度一致的。這些研究表明,細胞存活和溫度歷程與細胞生物物理學脫水和胞內冰的形成高度相關。為此,本實驗利用 DSC 觀察不同保護劑的熱學性質,探究其保護機制和效果,最后通過細胞凍存實驗對其進行驗證。
為了實現細胞的冷凍干燥保存,通常會加入凍干保護劑。Me2SO 為滲透性保護劑,分子中含有 2 個甲基。由于甲基可以與水鍵合形成氫鍵,且自身不會發生鍵合[14],因此可以結合更多的水分子,使溶液黏度增大,玻璃化趨勢增強,阻礙冰晶的生長。在一定濃度范圍內,隨著 Me2SO 體積分數的增大,分子中甲基含量逐漸增多,結合的水分子會更多,冰晶生長就會更困難,釋放的熱量則更少。同樣的,在升溫時,融化的冰晶量隨之減少,熱焓值則相應減小。本實驗中,圖 1 和圖 2 表現出 Me2SO 保護劑組中,共晶焓和熔融焓都隨著保護劑體積分數的提高而下降;同時,在升溫段,熔融焓也隨之下降,與該說法結論一致。細胞實驗中,10% Me2SO 組(序號 2)和 15% Me2SO 組(序號 3)的存活率和貼壁率也顯著高于 5% Me2SO 組(序號 1),間接表明在一定體積分數范圍內,Me2SO 體積分數越大,Me2SO 結合水的能力更強。然而,與丙三醇組相比,Me2SO 組的 24 h 貼壁率明顯降低,而丙三醇的分子量要高于 Me2SO,因此 Me2SO 組 24 h 貼壁率低下很可能是 Me2SO 的毒性作用而不是因為滲透傷害。
同樣的,丙三醇也是滲透性保護劑,且對人體沒有毒性,可以提供胞內保護,因為它們優先排除在生物分子表面之外,從而穩定生物分子內部自然狀態。Wang 等[15]發現丙三醇可以增加蛋白質的穩定性,鹽水溶液洗滌后消失。何暉等[16]將紅細胞用丙三醇預處理后,發現紅細胞回收率可以達到 55.3%。根據 Wowk 等[17]的觀點,分子中的羥基可以與水分子鍵合形成氫鍵,而丙三醇分子中含有 3 個羥基,因此丙三醇作為保護劑,在凍結過程中可以將更多的自由水替換成結合水,減少冰晶的生成,與圖 1、圖 2 的結果一致。同時,細胞凍存實驗的結果表明,添加體積分數為 10%~20% 丙三醇的保護劑,對細胞凍存是有一定保護作用的。但圖 3 結果表明 10% 丙三醇組的細胞狀態優于 20% 丙三醇組。
PVP 是一種非滲透性保護劑,在凍干中往往因能和糖類鍵合形成氫鍵且提高玻璃化程度而一起發揮作用。Shamblin 等[18]研究發現,在相對濕度高于 20% 時,加入 20% PVP 到蔗糖中,可以提高玻璃化轉變溫度。Tomczak 等[19]發現酰基鏈填充的變化會減小膜滲透性泄漏。在本實驗中,圖 1、圖 2 和表 2 的數據表明,與對照組相比,當添加了 PVP 后,保護劑的共晶焓、熔融焓降低,未凍水份額顯著增高。這可能是因為 PVP 分子中含有羰基和酰胺基團,既可以和水分子水合,同時也可以與低分子量的糖類水合。由于 PVP 的存在,使保護劑溶液中海藻糖游離的羥基增多,從而使海藻糖結合水的量增大,溶液黏度大大提升,玻璃化程度增高[20]。且在細胞凍存實驗中,添加質量濃度為 20%~60% PVP 的保護劑與對照組差異具有統計學意義(P < 0.05),表明 PVP 的加入對細胞經歷凍結過程具有一定的保護作用。
在凍結過程中,未凍水份額的多少可以間接表明保護劑結合水能力的強弱。根據表 2,40% PVP 組(序號 8)的未凍水份額高于 5%~10% Me2SO 組的未凍水份額,說明 40% PVP 組(序號 8)結合水的能力強于 15% Me2SO 組(序號 3)。細胞凍存實驗中,10% 丙三醇組(序號 9)中觀察到細胞形態最佳,存活率和貼壁率也明顯高于對照組;而 Me2SO 組的細胞均有不同程度的形變,可能是由于 Me2SO 毒性太高。因此,本實驗中選擇了 40% PVP 和 10% 丙三醇為復方組。由圖 1、圖 2 和表 2、表 3 發現,復方組的共晶焓、熔融焓最低,未凍水份額與對照組差異有統計學意義(P < 0.05),保護效果最佳,隨后的細胞凍存實驗結果也與其一致。
4 結論
凍結過程中凍干保護劑的熱物性參數可以對不同配方保護劑的篩選和細胞凍存提供理論支持。實驗結論如下:①DSC 結果顯示,與對照組相比,添加了 Me2SO、PVP、丙三醇的保護劑組以及復方保護劑組仍會發生相變,且每組保護劑中,隨著保護劑濃度的增大,共晶溫度、共晶焓、熔融起始溫度和熔融焓逐漸減小。其中,復方保護劑組的共晶焓和熔融焓最小。② 細胞凍存實驗發現,復方保護劑組的存活率和 24 h 貼壁率與對照組的差異有統計學意義(P < 0.05),與 DSC 實驗結論一致。所以配方為 40% PVP + 10% 丙三醇 + 15% FBS + 20% 海藻糖保護劑的保護效果最佳,24 h 貼壁率可以達到 44.56% ± 2.73%。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
細胞的冷凍干燥通常分為保護劑的添加、凍結、一次干燥、二次干燥和封裝儲存五個步驟[1]。然而凍結過程中,冰晶的形成可能會影響細胞質結構,甚至細胞骨架基因組的相關結構。研究表明添加保護劑可以減少細胞凍結或脫水帶來的傷害。保護劑的冷凍保護能力取決于滲透系數、不成對電子數量、溶解度和保護劑對細胞膜結構的影響[2-3]。Akhoondi 等[4]發現二甲基亞砜(Me2SO)雖然不能在凍結過程中阻止細胞膜相變,但可以降低水分運輸活化能,從而對細胞起到保護作用。丙三醇作為滲透性保護劑,可以在凍結期間調節細胞脫水的速率和程度[5]。而糖類和高聚物的組合能有效防止膜的泄漏[6],因此常用來作為凍干保護劑。
差示掃描量熱儀(differential scanning calorimeter,DSC)是在程序控溫下測量樣品熱學性質的儀器。通過熱焓值的變化,可以從側面反映出樣品的相變轉化。因此,本研究利用 DSC 測量了以上不同質量(體積)濃度的凍干保護劑[二甲基亞砜(Me2SO)、丙三醇、聚乙烯吡咯烷酮 K30(PVP)和海藻糖]在凍結過程的熱學特性的參數,包括共晶焓、熔融焓以及未凍水份額,從而對保護劑在凍結過程的篩選做出了理論分析并提供了一定的參考價值;再以肝癌細胞 Hep-G2 為凍存對象,通過對臺酚藍存活率和 24 h 貼壁率的檢測結果進行分析比較,加以實驗驗證。
1 材料與方法
1.1 材料與試劑
人肝癌細胞 Hep-G2(中國科學院,北京);Me2SO(APPLICHEM,德國);丙三醇、PVP、海藻糖(國藥集團化學試劑有限公司,上海);胎牛血清(fetal bovine serum,FBS)和胰蛋白酶(賽默飛世爾生物化學制品有限公司,北京);Dulbecco’s Modified Eagle Medium(DMEM)培養基(GIBCO,美國);臺盼藍染色液(2X)(國藥集團化學試劑有限公司,上海);D-hanks 液由 NaCl、KCl、Na2HPO4、KH2HPO4 配制(國藥集團化學試劑有限公司,上海)。
1.2 儀器與設備
200F3 DSC 差示掃描量熱儀(耐馳公司,德國);二氧化碳培養箱(上海博訊實業有限公司);低速臺式離心機(上海安亭科學儀器廠);DW-8GL388A 型超低溫冰箱(青島海爾特種電器有限公司);SW-CJ-1B 超凈工作臺(蘇州凈化有限公司)。
1.3 實驗方法
1.3.1 凍干保護劑的配制
實驗分組:共配制 12 組保護劑,根據保護劑不同種類又分為五大組,第一組序號為 0,是對照組,只有基礎液 DMEM;第二組序號為 1~3,是 Me2SO 組;第三組序號為 4~8,是 PVP 組;第四組序號為 9~10,是丙三醇組;第五組序號為 11,是根據第 1~4 大組實驗的結果選出的配方,為復方保護劑組。各組具體成分如表 1 所示。
1.3.2 DSC 實驗
以五組(12 種)保護劑作為研究對象,樣品質量為 10~20 mg,精確到 0.01 mg。DSC 程序設定為:20℃ 等溫 10 min,以 10℃/min 降到?80℃,平衡 10 min,再以 10℃/min 升溫到 30℃。參比側放置空白小坩堝,實驗時每個樣品做三個平行樣。采用 DSC 分析軟件 NETZSCH-Proteus,讀取共晶溫度和共晶焓,以及熔融起始溫度(Onset)和熔融焓。通過分析保護劑凍結過程的 DSC 熱流曲線,研究保護劑的低溫損傷機制以及對保護劑配方篩選進行理論指導。
1.3.3 細胞獲取及凍存實驗
以肝癌細胞 Hep-G2 為凍存研究對象,對前期 DSC 結果進行驗證。
取對數生長期的細胞(一個皿的 80%~90% 為最好),抽取培養皿中培養基,每個皿均加入 2 mL D-Hank’s,清洗 2 遍,用 0.5 mL 胰酶消化 1~2 min,當在顯微鏡下觀察細胞呈圓粒狀并較均勻地分布在培養皿中時,每個皿加入 2 mL DMEM 培養基終止消化,并將所有細胞吸入到同一離心管中,1 000 r/min,離心 5 min,倒去上清液。將上述配好的 12 種凍干保護劑分別取 3 mL 加入到細胞中,搖晃均勻,平衡 5 min 后,分別取 1 mL 到三支凍存管中,并標號以示區別。將凍存管放入-80℃ 深低溫冰箱,凍存 12 h 后進行細胞檢測。
1.3.4 細胞檢測
凍存 12 h 后將凍存管從深低溫冰箱中取出,于 37℃ 水浴鍋中快速搖晃復溫,1 000 r/min 離心 5 min,去上清液,加 1 mL 培養基吹打均勻,再取樣進行細胞形態觀察及臺酚藍存活率和 24 h 貼壁率的檢測。
(1)臺酚藍染色法檢測存活率[7]:
取 20 μL 0.4% 臺酚藍溶液和 20 μL 復水后細胞懸浮液,混勻,滴加在細胞計數板上,在 3 min 內插入細胞計數儀中,對其進行計數。按以下公式計算存活率:
 |
(2)24 h 貼壁率檢測:復溫后的細胞,加入 2 mL DMEM,于 1 200 r/min 離心 10 min,棄去上清液,加 4 mL DMEM,接種到培養皿中,放入 37℃、5% CO2 培養箱中培養,24 h 換液后,將培養皿中培養液吸入到離心管中,計數未貼壁細胞。接著用胰酶消化后,加 2 mL DMEM,計數貼壁細胞。計算公式如下:
 |
1.3.5 數據分析
用 origin 8.5 進行圖像處理,SPSS Statistics 軟件進行統計分析,組間數據比較采用 Duncan 檢驗,所有實驗數據均采用均值 ± 標準差的形式。
2 結果與分析
2.1 五組(12 種)凍干保護劑升降溫階段的相變觀察
根據 DSC 的熱流曲線圖,可以獲得每種凍干保護劑的共晶焓值和熔融焓值。圖 1 表示的是五組(12 種)凍干保護劑降溫階段共晶焓的變化及升溫階段熔融焓的變化。
 圖1
五組(12 種)保護劑的共晶焓及熔融焓
Figure1.
Eutectic enthalpy and melting enthalpy of five groups (12 species) of lyoprotectants
圖1
五組(12 種)保護劑的共晶焓及熔融焓
Figure1.
Eutectic enthalpy and melting enthalpy of five groups (12 species) of lyoprotectants
由圖 1 可以看出,五組(12 種)凍干保護劑的共晶焓和熔融焓有著相似的趨勢,即:與對照組相比,添加了 Me2SO、PVP、丙三醇的保護劑組以及復方組的共晶焓和熔融焓均有著不同程度的降低,且每組保護劑中,隨著保護劑濃度的增大,共晶焓和熔融焓會逐漸降低。共晶焓的變化表明,1~11 號的保護劑相變開始的溫度比對照組低,冰晶成核的溫度低,共晶焓值小;熔融焓的變化表明,在升溫段時,熔融焓值小,相變生成的冰晶少,因此受到的冰晶機械損傷減小。這可能與保護劑的玻璃化性質和官能團有關。
Me2SO 組中,10% Me2SO 組(序號 2)和 15% Me2SO 組(序號 3)的共晶焓和熔融焓明顯低于 5% Me2SO 組(序號 1)(P < 0.05),說明相較于 5% Me2SO 組,10% Me2SO 組和 15% Me2SO 組在凍結過程中釋放的熱量少,形成的冰晶少,有大量 Me2SO 分子會發生水合作用形成更多的結合水,從而減小了體系中的自由水濃度,弱化了水的結晶過程。
PVP 組中,隨著 PVP 質量濃度的增大,共晶焓和熔融焓逐漸減小,且 60% PVP 組(序號 8)的共晶焓和熔融焓顯著低于其他濃度的 PVP 組(P < 0.05),說明在凍結過程中,高濃度的 PVP 可以抑制冰晶的生長,減小冰晶造成的機械損傷。但是,過高濃度的 PVP 會給體系帶來較高的滲透壓,且一旦沒有冰晶生成或冰晶很少,后續的升華干燥過程則難以進行。
對于丙三醇組,10% 丙三醇組(序號 9)和 20% 丙三醇組(序號 10)的熔融焓均與對照組差異有統計學意義(P < 0.05)。這說明丙三醇的添加使保護劑熱焓值降低,即該過程中生成的冰晶量小。這是由于丙三醇與水分子結合形成了氫鍵,占據了自由水含量,從而降低了冰晶生成概率。
2.2 五組(12 種)保護劑 DSC 熱流曲線
利用 DSC 測得五組(12 種)凍干保護劑在升降溫過程中的熱物性參數,觀察相變過程,篩選最優保護劑配方。
如圖 2 所示,比較五組(12 種)保護劑的降溫過程發現,復方組的共晶溫度和共晶焓與對照組的差異有統計學意義(P < 0.05),且與其他保護劑組相比也有顯著差異。這表明在降溫過程中,復方組相變發生的溫度最低,釋放的熱量最少,與水的結合能力最強,溶液粘度最大,由冰晶造成的物理損傷最小。
 圖2
五組(12 種)保護劑降溫、升溫過程的 DSC 熱流曲線
Figure2.
DSC heating and cooling thermograms of five groups (12 species) of lyoprotectants
圖2
五組(12 種)保護劑降溫、升溫過程的 DSC 熱流曲線
Figure2.
DSC heating and cooling thermograms of five groups (12 species) of lyoprotectants
在保護劑的升溫過程,復方組的熔融起始溫度降低,熔融焓值減小,峰面積最小,且與對照組相比,熔融焓值減小了 56.38%,這表明復方組中 40% PVP 和 10% 丙三醇的組合強烈影響了保護劑的熔融相變過程,溫度跨度減小,意味著當保護劑加入到細胞中,在升溫過程中,細胞所經歷的危險溫區減小。因此,復方組要優于其他四組保護劑。
綜上所述,通過 DSC 研究了五組(12 種)保護劑在凍結和升溫過程中的熱學性質,發現與對照組相比,四組(11 種)保護劑仍會發生相變,但溫度范圍更廣、更平緩,這對在凍干的預凍步驟中保護劑的篩選提供了一個理論上的支持和參考。
2.3 五組(12 種)保護劑未凍水份額比較
由 DSC 熱流圖可以觀察出保護劑結晶焓值的變化,利用經驗公式[8],從而得到五組(12 種)保護劑的未凍水份額,見表 2。其公式如下:
 |
其中,α 為未凍水份額;ω 為樣品水分含量;Tf 為樣品在凍結過程中的結晶溫度,以℃為單位;ΔH(Tf)DSC 為利用 DSC 測得的樣品在 Tf 溫度下的結晶焓,以 J/g 為單位;ΔH(Tf)為純水的結晶焓,以 J/g 為單位;其與溫度的公式為:
 |
由表 2 可以看出,與對照組相比,四組(11 種)保護劑的未凍水份額均有不同程度升高,且同種保護劑中,隨著保護劑濃度增大,未凍水份額增大。其中,60% PVP 組(序號 8)和復方組(序號 11)的未凍水份額與對照組相比,差異有統計學意義(P < 0.05),這主要是與保護劑分子中的官能團有關[9]。但當 PVP 濃度過高時,體系滲透壓增大,不僅加大了干燥的難度,還會對細胞存活造成很大影響。
2.4 細胞實驗
利用 Duncan 法進行多重比較,對照組和添加四組(11 種)保護劑的細胞凍存復溫后的臺酚藍存活率和 24 h 貼壁率結果見表 3。
由表 3 可知,添加四組(11 種)保護劑的細胞凍存復溫后的臺酚藍存活率和 24 h 貼壁率與對照組(0 號)的差異均有統計學意義(P < 0.05),這表明添加體積分數為 5%~15% 的 Me2SO 和 10%~20% 的丙三醇,以及質量濃度為 20%~60% 的 PVP 保護劑對肝癌細胞冷凍干燥的凍結過程有一定的保護作用。其中,20%~40% PVP 組(序號 4~6)和復方組(序號 11)的存活率明顯高于其他組(P < 0.05),但 20%~40% PVP 組(序號 4~6)的 24 h 貼壁率較低,而復方組(序號 11)的 24 h 貼壁率顯著高于其他組(P < 0.05)。這表明復方組對細胞在凍結過程中的保護效果最佳,這與 DSC 實驗結果是一致的。
如圖 3 所示,在顯微鏡下觀察細胞形態發現,Me2SO 組中細胞幾乎都發生了不同程度的皺縮,而丙三醇組、20%~40% PVP 組和復方組(序號 11)中細胞形態完整,表現為細胞體積較大,呈圓球狀,在視野中明亮(均為被胰酶消化后的細胞),這可能與 Me2SO 的毒性有關。
 圖3
添加五組(12 種)保護劑細胞凍存 12 h 后復蘇的細胞形態圖
Figure3.
Cell morphology of Hep-G2 with five groups (12 species) of lyoprotectants after cryopreservation for 12 h
圖3
添加五組(12 種)保護劑細胞凍存 12 h 后復蘇的細胞形態圖
Figure3.
Cell morphology of Hep-G2 with five groups (12 species) of lyoprotectants after cryopreservation for 12 h
綜上所述,在細胞凍存實驗中,通過臺酚藍存活率和 24 h 貼壁率檢測五組(12 種)保護劑的保護效果。結果發現,與對照組相比,四組(11 種)保護劑對細胞凍存均有一定保護作用,其中復方保護劑組在肝癌細胞的凍結過程中保護效果最好,與 DSC 的實驗結論相一致。
3 討論
利用冷凍干燥技術保存細胞時,細胞會經歷凍結和干燥兩個頗為激烈的過程,給細胞膜及胞內物質均帶來巨大的損傷,往往造成細胞的死亡或者功能的喪失[10]。其中,細胞膜是凍結和熔融期間細胞凍存的主要損傷部位。在凍結過程中,細胞由冷凍引起的損傷主要有兩個方面:機械損傷和溶質損傷[11]。機械損傷即低溫所引起細胞內外冰晶的生長,產生的機械剪切導致細胞膜和胞內物質受到巨大損傷。而溶質損傷則為在凍結過程中,由于細胞外先結冰,胞外濃度增大,胞內外產生了一定的濃度差,胞內水分會向胞外滲透,同時在高濃度的胞外溶液中經歷的時間過長,從而導致蛋白質變性或細胞嚴重脫水、皺縮,甚至死亡。Oldenhof 等[12]發現凍結而引起的細胞膜脫水的程度取決于冰核溫度,并顯示出 Arrhenius 行為。Wolkers 等[13]利用低溫顯微鏡觀察 LNCaP 前列腺腫瘤細胞凍結過程中的細胞損傷,發現膜的相變開始與冰的成核溫度是高度一致的。這些研究表明,細胞存活和溫度歷程與細胞生物物理學脫水和胞內冰的形成高度相關。為此,本實驗利用 DSC 觀察不同保護劑的熱學性質,探究其保護機制和效果,最后通過細胞凍存實驗對其進行驗證。
為了實現細胞的冷凍干燥保存,通常會加入凍干保護劑。Me2SO 為滲透性保護劑,分子中含有 2 個甲基。由于甲基可以與水鍵合形成氫鍵,且自身不會發生鍵合[14],因此可以結合更多的水分子,使溶液黏度增大,玻璃化趨勢增強,阻礙冰晶的生長。在一定濃度范圍內,隨著 Me2SO 體積分數的增大,分子中甲基含量逐漸增多,結合的水分子會更多,冰晶生長就會更困難,釋放的熱量則更少。同樣的,在升溫時,融化的冰晶量隨之減少,熱焓值則相應減小。本實驗中,圖 1 和圖 2 表現出 Me2SO 保護劑組中,共晶焓和熔融焓都隨著保護劑體積分數的提高而下降;同時,在升溫段,熔融焓也隨之下降,與該說法結論一致。細胞實驗中,10% Me2SO 組(序號 2)和 15% Me2SO 組(序號 3)的存活率和貼壁率也顯著高于 5% Me2SO 組(序號 1),間接表明在一定體積分數范圍內,Me2SO 體積分數越大,Me2SO 結合水的能力更強。然而,與丙三醇組相比,Me2SO 組的 24 h 貼壁率明顯降低,而丙三醇的分子量要高于 Me2SO,因此 Me2SO 組 24 h 貼壁率低下很可能是 Me2SO 的毒性作用而不是因為滲透傷害。
同樣的,丙三醇也是滲透性保護劑,且對人體沒有毒性,可以提供胞內保護,因為它們優先排除在生物分子表面之外,從而穩定生物分子內部自然狀態。Wang 等[15]發現丙三醇可以增加蛋白質的穩定性,鹽水溶液洗滌后消失。何暉等[16]將紅細胞用丙三醇預處理后,發現紅細胞回收率可以達到 55.3%。根據 Wowk 等[17]的觀點,分子中的羥基可以與水分子鍵合形成氫鍵,而丙三醇分子中含有 3 個羥基,因此丙三醇作為保護劑,在凍結過程中可以將更多的自由水替換成結合水,減少冰晶的生成,與圖 1、圖 2 的結果一致。同時,細胞凍存實驗的結果表明,添加體積分數為 10%~20% 丙三醇的保護劑,對細胞凍存是有一定保護作用的。但圖 3 結果表明 10% 丙三醇組的細胞狀態優于 20% 丙三醇組。
PVP 是一種非滲透性保護劑,在凍干中往往因能和糖類鍵合形成氫鍵且提高玻璃化程度而一起發揮作用。Shamblin 等[18]研究發現,在相對濕度高于 20% 時,加入 20% PVP 到蔗糖中,可以提高玻璃化轉變溫度。Tomczak 等[19]發現酰基鏈填充的變化會減小膜滲透性泄漏。在本實驗中,圖 1、圖 2 和表 2 的數據表明,與對照組相比,當添加了 PVP 后,保護劑的共晶焓、熔融焓降低,未凍水份額顯著增高。這可能是因為 PVP 分子中含有羰基和酰胺基團,既可以和水分子水合,同時也可以與低分子量的糖類水合。由于 PVP 的存在,使保護劑溶液中海藻糖游離的羥基增多,從而使海藻糖結合水的量增大,溶液黏度大大提升,玻璃化程度增高[20]。且在細胞凍存實驗中,添加質量濃度為 20%~60% PVP 的保護劑與對照組差異具有統計學意義(P < 0.05),表明 PVP 的加入對細胞經歷凍結過程具有一定的保護作用。
在凍結過程中,未凍水份額的多少可以間接表明保護劑結合水能力的強弱。根據表 2,40% PVP 組(序號 8)的未凍水份額高于 5%~10% Me2SO 組的未凍水份額,說明 40% PVP 組(序號 8)結合水的能力強于 15% Me2SO 組(序號 3)。細胞凍存實驗中,10% 丙三醇組(序號 9)中觀察到細胞形態最佳,存活率和貼壁率也明顯高于對照組;而 Me2SO 組的細胞均有不同程度的形變,可能是由于 Me2SO 毒性太高。因此,本實驗中選擇了 40% PVP 和 10% 丙三醇為復方組。由圖 1、圖 2 和表 2、表 3 發現,復方組的共晶焓、熔融焓最低,未凍水份額與對照組差異有統計學意義(P < 0.05),保護效果最佳,隨后的細胞凍存實驗結果也與其一致。
4 結論
凍結過程中凍干保護劑的熱物性參數可以對不同配方保護劑的篩選和細胞凍存提供理論支持。實驗結論如下:①DSC 結果顯示,與對照組相比,添加了 Me2SO、PVP、丙三醇的保護劑組以及復方保護劑組仍會發生相變,且每組保護劑中,隨著保護劑濃度的增大,共晶溫度、共晶焓、熔融起始溫度和熔融焓逐漸減小。其中,復方保護劑組的共晶焓和熔融焓最小。② 細胞凍存實驗發現,復方保護劑組的存活率和 24 h 貼壁率與對照組的差異有統計學意義(P < 0.05),與 DSC 實驗結論一致。所以配方為 40% PVP + 10% 丙三醇 + 15% FBS + 20% 海藻糖保護劑的保護效果最佳,24 h 貼壁率可以達到 44.56% ± 2.73%。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。