盡管圍手術期抗生素的使用和無菌技術在不斷改進,但骨科手術中假體感染仍不可避免,給手術帶來巨大挑戰。骨科假體表面的粗糙或多孔結構,為細菌黏附、增殖和生物膜形成提供了優良的場所,是導致感染的主要原因。傳統的抗生素治療和清創手術無法完全阻止感染復發。近年來,納米技術在生物材料、藥物輸送等方面展現出明顯的優勢,納米藥物載體能夠局部緩釋藥物或在特定刺激下智能控釋藥物,可有效實現局部抗菌治療、預防手術感染,且降低了藥物的毒副作用,其獨特優勢可為感染防治提供新的思路和選擇。目前納米載藥系統在防治骨科手術假體感染中的應用主要為骨科假體材料中添加納米載藥材料、假體表面構建載藥納米涂層、可灌注型納米抗菌藥物載體以及刺激響應型藥物控釋系統。本文綜述了目前骨科手術假體感染防治的方法,尤其是納米載藥系統在假體周圍感染防治中的研究現狀。
引用本文: 潘振堯, 王妍, 李嬌嬌, 陳佳龍. 納米載藥系統在骨科假體感染防治中的應用. 生物醫學工程學雜志, 2019, 36(5): 862-869, 878. doi: 10.7507/1001-5515.201807032 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
據統計,骨科手術初次感染率為 0.7%~2.4%[1],感染一旦發生,即使徹底清創、二次返修,也易復發,復發率高達 4.2%[2]。感染已經成為最可怕的骨科手術后并發癥,不但增加了患者身體和心理痛苦,也增加了患者負擔[3]。髖關節、膝關節置換術、長骨開放性骨折內固定術等常見的骨科手術都需要假體輔助,假體所攜帶細菌或體內細菌血源性傳播都會引發手術部位感染[4];且假體表面粗糙或多孔的結構,為細菌的黏附、增殖和生物膜形成提供了優良的場所。假體表面的生物膜是感染難以處理的主要原因,生物膜內細菌種類多[5]、活性低、增殖緩慢,難以通過血液或滑膜液提取,因此,感染細菌的種屬鑒定困難,無法對癥下藥。同時,生物膜能夠阻隔抗生素滲透[6],導致生物膜中的細菌對抗生素的敏感性降低,有研究證明抗生素可有效殺滅浮游菌,但生物膜內的細菌對抗生素的耐受力是浮游菌的 10~1 000 倍[7]。另外,一些細菌還會分泌抗生素水解酶(如 β-內酰胺酶、AmpC 酶)到生物膜的細胞外基質中,削弱了抗生素的殺菌能力[8],甚至部分細菌會侵入感染部位的細胞,通過降低感染細胞 α 毒素的表達水平來阻止細胞裂解、抵御宿主防御機制和抗生素攻擊,導致抗生素治療幾乎無效,這也是感染復發及難以根治的主要原因。因此,防止假體周圍感染和生物膜形成是保證手術長期效果的最重要手段,即在手術后初期,通過抑制細菌在假體表面的黏附或者通過清除假體周圍的細菌來阻止生物膜形成。
1 傳統防治感染的方案及其缺點
傳統的預防和治療骨科感染的方法包括抗生素治療和外科干預[9]。患者手術后需口服或靜脈注射抗生素控制感染,但大部分藥物無法抵達手術部位,且感染一旦發生,患者需長期、大劑量的抗生素治療,這會使細菌產生耐藥性并對患者造成全身毒性。另外,由于抗生素效用和生物膜的影響,幾乎 30% 的患者手術部位的組織液或體液樣本中難以分離出細菌,停藥后感染快速復發,不易控制[10]。當感染比較嚴重時需要手術清創,但由于醫生無法確定感染灶是否完全切除,導致療效的不確定性較高。
綜上所述,如何在假體周圍實現長效并精準地釋放抗菌藥物,是預防假體術后感染亟待解決的問題。
2 納米生物材料在骨科手術抗感染中的應用
納米技術涉及納米范圍內的科學和工程應用,提供具有潛力的新型納米尺度的材料,已用于藥物傳遞系統[11]。納米材料具有尺寸小、比表面積大、表面能高、藥物裝載量高、裝載藥物釋放易控等特性,使其在抗菌領域有巨大的應用潛力。
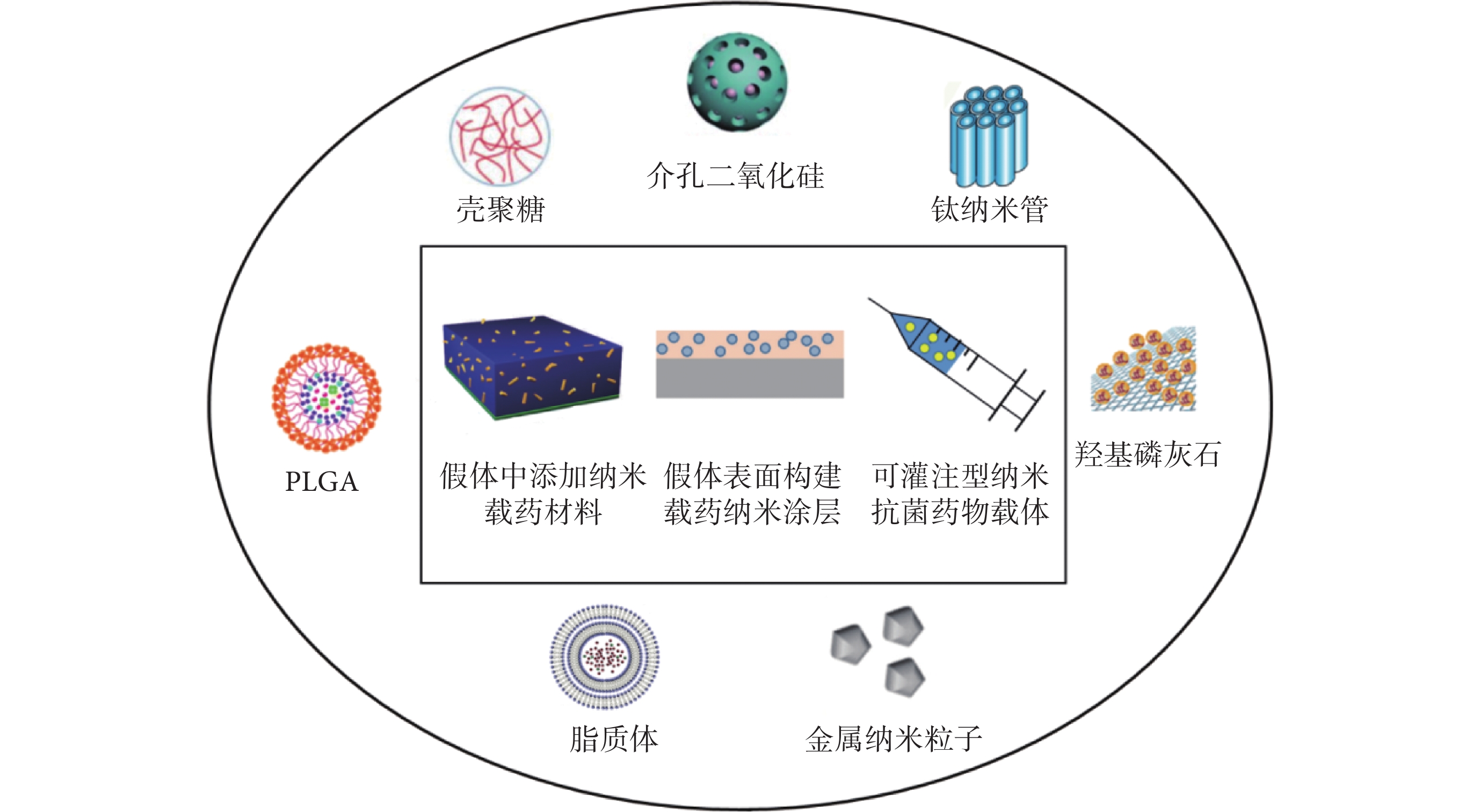
為了預防假體術后感染,直接修飾假體材料是最有效的方法,主要包括:① 裝載抗菌藥物的納米材料混合到假體材料中緩釋藥物;② 假體表面構建載藥納米涂層緩釋藥物。假體植入手術術后常規大劑量使用抗生素易導致耐藥菌產生并對機體有嚴重的毒副作用,而以納米材料作為載體,在體內不但可以隱藏和保護藥物分子防止其被降解,而且可以精準運輸藥物到特定部位并釋放,在保證療效的同時降低了全身毒性(如將裝載抗菌藥物的納米材料灌注到手術部位并緩釋藥物)(見圖 1)。另外,基于對手術感染部位的 pH 值、溫度、酶和抗原等的認知,研究者設計出納米智能給藥系統,通過因感染所致局部 pH 值、溫度、抗原、酶等的變化來觸發系統以釋放藥物,可以降低藥物的無效釋放,提高藥物的利用效率,降低藥物對機體的毒副作用。
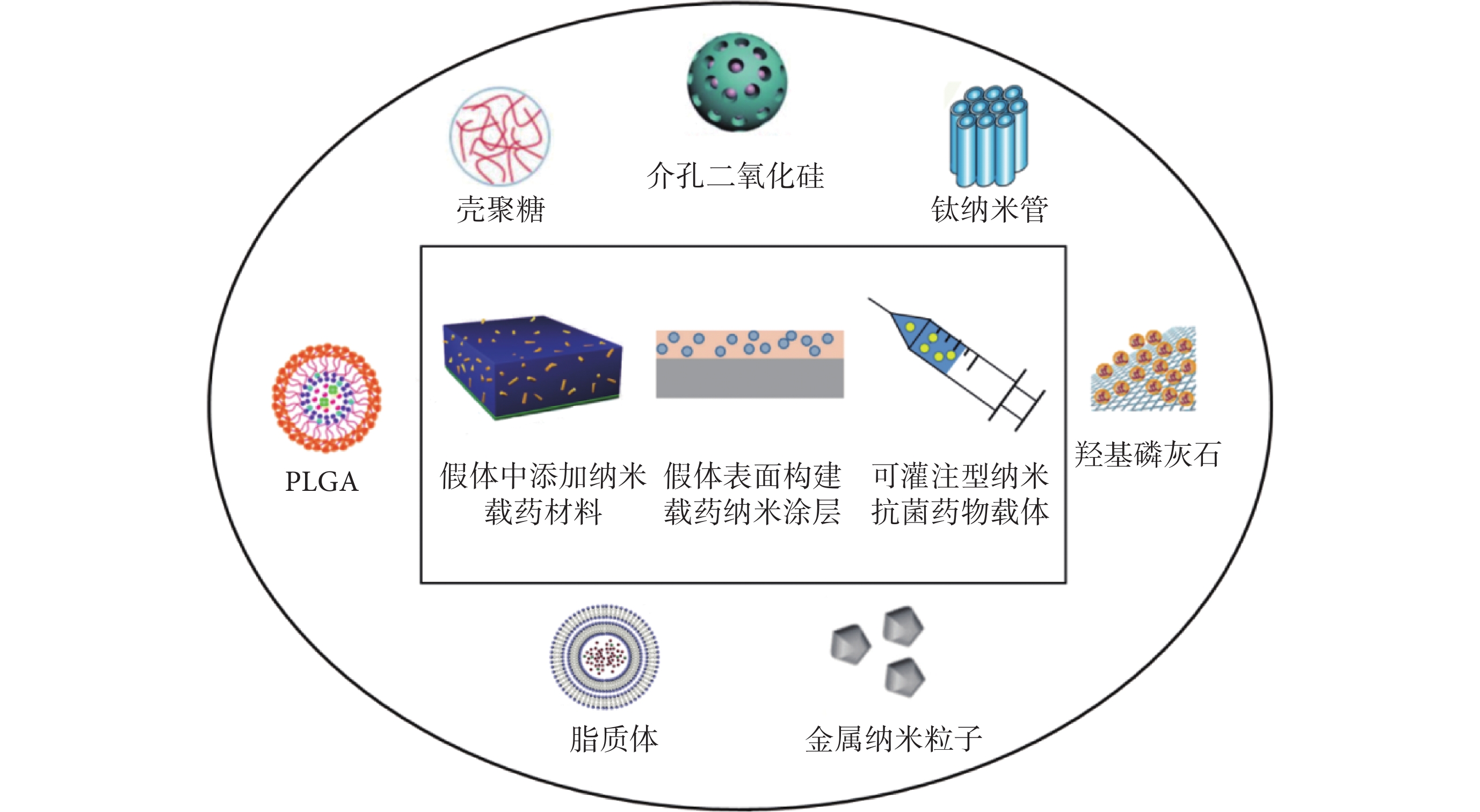 圖1
骨科假體周圍感染防治中常用的納米藥物運輸系統及使用方式
Figure1.
Various nanotechnology based strategies for prevention and treatment of orthopaedic implant related infection
圖1
骨科假體周圍感染防治中常用的納米藥物運輸系統及使用方式
Figure1.
Various nanotechnology based strategies for prevention and treatment of orthopaedic implant related infection
2.1 假體中添加納米載藥材料
大量研究報道了抗菌藥物(萬古霉素[12]、頭孢唑啉[13]、慶大霉素[14]等)與假體材料直接混合所制備的載藥假體,這種方式雖賦予了假體抗菌能力,但存在以下問題:① 添加過程中抗生素易聚集導致應力集中,且釋放后所留孔隙可能破壞材料結構的完整性;② 抗生素的釋放不可控,假體表面的抗生素快速釋放,使藥物峰值濃度過高,而內部的抗生素釋放困難,使峰值濃度維持時間短,總體抗菌效果差,這種不可控的釋放不但無法有效控制感染,還會導致耐藥菌的產生[15]。聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥是骨科假體手術中常用的材料,研究者在制備過程中直接添加慶大霉素后發現:當慶大霉素含量超過 6%,將對骨水泥的壓縮和彈性模量造成不同程度的影響,且藥物釋放只能維持 72 h[16]。為了解決上述問題,研究者制備了載抗菌藥物的納米粒子,再將其添入假體材料,實現了藥物與假體材料的均勻混合,改善了抗生素的不可控釋放,并減少了添加物對假體機械強度和/或疲勞特性的影響。
脂質體是具有疏水核心和親水外表面的雙層球形囊泡結構,可用于水性懸浮液中親水或疏水藥物的裝載。研究者將其包裹慶大霉素制成納米尺度的脂質體,并與 PMMA 骨水泥混合,結果顯示:相比于直接添加慶大霉素,脂質體的使用將慶大霉素在 PMMA 中的裝載量由 9% 提高到 22%,且慶大霉素在 30 天內幾乎呈現線性釋放;在機械性能方面,除壓縮強度略有降低外,韌性、彎曲強度和硬度均得到加強[17]。以脂質體為基礎的穩定、持久、有效的藥物運輸系統正在進一步研究中。
二氧化硅納米粒子因具有親水性表面、穩定性好、易于官能化等特點,已經成為優良的納米載體。介孔二氧化硅納米粒子(mesoporous silica nanoparticles,MSN)因其具有更大的表面積用于載藥而得到研究者關注。在一項研究中,MSN 被用來改善慶大霉素在 PMMA 骨水泥中的釋放動力學,研究者將裝載慶大霉素的 MSN 混入 PMMA 中(添加量為 10%),發現藥物可持續釋放 80 天以上且釋放量約為 60%;另外,雖然制得材料的彎曲模量下降了 10%,但其抗壓強度幾乎與市售骨水泥相同。此外,在安全性方面含 10% MSN 的骨水泥與小鼠成纖維細胞具有良好的相容性,細胞存活率為 96%[18]。有研究顯示,二氧化硅納米粒子和氨基糖苷類抗生素(慶大霉素、卡那霉素)結合后,能顯著改善此類抗生素的毒性[19]。另有學者將二氧化硅-慶大霉素納米復合物暴露于斑馬魚胚胎中,結果顯示胚胎死亡率并沒有明顯變化[20]。
納米羥基磷灰石(nano-hydroxyapatiten,nHAP)在化學組成和結構上接近天然骨礦物質,具有良好的生物降解性、骨傳導性和生物活性,廣泛用于骨替代材料。研究者制備了裝載萬古霉素的 nHAP/膠原/聚(乳酸)骨移植替代物用于修復大尺寸骨損傷,具有典型多孔結構,孔隙率約 80%,抗壓強度為 1.52 MPa;體外研究結果顯示其在 4 周內釋放了約 98% 的藥物,抑菌率超過了 99%,還表現出了良好的體內和體外生物相容性[21]。
納米金屬及氧化物(如銀、銅、鋅)具有良好的廣譜抗菌效果,且不誘發耐藥菌,有望成為抗生素替代型抗菌物質。有研究者在 PMMA 中分別添加納米銀和慶大霉素,抗菌結果顯示只有載納米銀的 PMMA 具有良好的廣譜抗菌性能[22]。另一研究顯示在波特蘭水泥中添加納米銀后,表現出了優異的抗菌效果,且假體的機械性能無明顯降低,也無細胞毒性[23]。甲基丙烯酸衍生物所合成的水凝膠具有良好的流變特性,是可用于骨修復的新型多功能生物材料,其裝載納米銀后,成骨細胞相容性和流變特性無明顯變化,但抗菌效果得到顯著提升[24]。
假體材料中添加納米載藥材料相較于傳統方法,不僅在抗菌藥物釋放和抗菌性能方面均展現出了明顯優勢,同時還保留了其應用所需的其他特性。在未來的研究中,納米材料及其降解產物對假體周圍組織的影響、藥物穩定釋放的持久性、感染控制后藥物釋放特性及對機體的影響等方面還需深入研究,尤其是相關動物實驗和臨床研究需要加強,以期制備出在機械性能、抗菌性能和生物相容性等方面均能更好地滿足臨床要求的優異的骨科假體材料。
2.2 假體表面構建載藥納米涂層
鑒于假體制備過程中添加載藥納米材料可能導致假體自身機械性能下降、內部藥物釋放緩慢等問題,不少研究者傾向于在假體表面構建載藥涂層,更好地調控藥物釋放速度。但是研究顯示將抗生素直接涂敷在假體表面,可能存在藥物快速釋放或因表面吸附血漿蛋白而阻礙藥物釋放等問題,使其難以長期保持良好的抗菌性能。最近研究者采用載藥涂層緩釋藥物,以實現對細菌黏附、增殖和生物膜形成的抑制。有研究顯示涂層厚度對植入材料體內表現的影響較大,相比微米級、毫米級厚度的涂層,納米尺度的涂層可以顯著降低異物反應的風險[25],所以納米尺度的功能涂層更多被用于改善假體表面性能。
殼聚糖(chitosan,CS)因具有良好的生物相容性、生物降解性和低免疫原性等特性受到了廣大研究者關注。研究者通過多步電泳沉積技術在鈦箔表面上制備 CS/生物活性玻璃/萬古霉素納米復合涂層,其可持續釋放萬古霉素長達 6 周,且藥物釋放與時間呈線性關系,抗菌結果顯示該涂層能夠顯著降低細菌感染的風險[26]。
銀納米粒子具有良好的抗菌能力,已經被用于假體表面涂層修飾,能夠降低植入手術失敗的風險[27]。鈦納米管具有排列整齊的三維孔洞結構、較高的機械強度和良好的生物相容性,廣泛用于藥物載體。研究者在人工關節上制備了載納米銀的鈦納米管抗菌涂層,將對照組(未修飾)人工關節和實驗組(載銀鈦納米管涂層)人工關節植入 80 只新西蘭兔體內,15 天后在植入部位注射金黃色葡萄球菌上清液構建感染模型,結果顯示實驗組動物在不同時間點的體溫、血清 C 反應蛋白濃度、紅細胞沉降率、降鈣素原和假體感染率方面均顯著低于對照組,證明抗菌涂層顯著抑制了感染的發生[28]。另一研究利用鼠感染模型評價了載銀鈦納米管涂層的生物安全性,結果顯示該涂層不僅可以穩定可控地釋放銀離子,在體外和體內均表現出良好的抗菌性能,而且無細胞毒性或成骨分化的障礙[29]。
nHAP 在納米涂層中也有廣泛應用,有研究者在鈦膝關節假體表面涂覆 nHAP/銀納米涂層,將修飾的關節和未修飾的關節植入兔子體內,然后注射金黃色葡萄球菌液。放射影像、微生物和組織學評估結果均顯示 nHAP/銀修飾關節的細菌定植率顯著低于未修飾組,且無炎癥或其他異物反應,證明了其體內安全性[30]。另一研究在種植體表面制備了 nHAP/銀納米涂層,動物實驗顯示,該涂層具有良好的抗菌效果,且肝臟、心臟、脾臟、腎臟和中樞神經組織樣本中均未檢測到銀的累積,種植體周圍也沒有炎癥反應和骨組織損傷[31]。
巨噬細胞在機體自身抗感染中起著重要作用,感染部位的巨噬細胞激活有利于防止感染發生;但當細胞介導的免疫反應不足(炎癥因子表達量低)時可能導致感染發生,因此,通過材料表面釋放炎癥因子可以降低體內感染發生率。研究者利用靜電層層自組裝技術,在假體表面制備了裝載炎癥因子(MCP-1 和 IL-12 p70)的納米涂層,體內結果顯示該涂層可以招募更多的巨噬細胞到達感染部位以達到防止感染的目的,該方法有效激活了機體免疫系統,避免了藥物毒副作用,是解決細菌耐藥性的有效手段[32]。
載藥脂質體以涂層形式附著于假體表面,可以實現藥物的長期釋放。研究者利用多巴胺將裝載地塞米松和米諾環素的脂質體固定在聚苯乙烯表面,結果顯示該表面抑制了促炎癥因子的表達,也阻止了細菌的黏附和增殖[33]。
通過在假體表面構建載藥納米涂層,可以使假體具有抗菌性能和生物相容性,并保持假體良好的理化、機械性能,但在臨床應用前仍有一些問題需要考慮:如何保證涂層長期釋放藥物并維持藥物濃度高于有效抑菌濃度;如何使抗菌藥物的釋放適時終止,以避免產生機體毒性和耐藥菌;另外,涂層與假體結合界面的穩定度、制備工藝的復雜度、大規模工業化生產的可實現性等問題也亟待解決。雖然目前在假體表面構建納米載藥涂層的研究取得了一定進展,但相關體內結果和臨床試驗的報道仍相對較少。
2.3 可灌注型納米抗菌藥物載體
抗菌藥物具有優異的抗菌效果,但手術部位藥物的低富集量限制了藥物效用,其他器官組織的藥物累積又容易導致局部損傷,還可能增加耐藥性菌株感染的風險[34],而且大劑量抗生素的長期施用也會對機體產生嚴重的毒副作用。實現抗菌藥物在手術部位的定點釋放,仍然是亟待解決的難題。納米抗菌藥物載體可以在人體內運輸藥物,且具有靶向運輸、藥物可控釋放等優勢,能夠降低藥物使用劑量、延長體內半衰期、提高患者依從性以及降低藥物對機體的毒副作用,為假體術后感染的治療帶來新的契機。
CS 的良好生物相容性、生物降解性和低免疫原性,使其也適用于藥物載體。鹽酸小檗堿(berberine,BBR)具有良好的抗菌功效,但由于水溶性差導致其生物利用度低以及體內半衰期短等缺點,限制了它的應用。研究者利用離子交聯技術合成了裝載 BBR 的 CS 球狀納米粒子,體外結果顯示其具有良好的 BBR 釋放能力,將其注射到大鼠關節感染部位,與使用自由形式的 BBR 溶液相比,大鼠血漿中 BBR 水平明顯降低,滑液中 BBR 含量更高且保留時間增加,半衰期更長,表現出了良好的感染治療能力[35]。
修飾的脂質體具有將藥物輸送到特定靶位點的能力,且裝載在脂質體中的藥物比自由形式的藥物更有效[36]。研究者通過脫水-再水合法制備了載萬古霉素的脂質體,體外結果顯示其具有優異的殺滅耐甲氧西林金黃色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)的能力。動物感染模型研究結果顯示,載萬古霉素脂質體在體內清除 MRSA 的能力比游離萬古霉素更高[37]。另一體內結果顯示脂質體包封的萬古霉素在腎臟的累積量少,有效降低了萬古霉素所致的腎毒性[38]。除了包封萬古霉素之外,還有大量關于脂質體包封其他抗菌藥物的研究,如氯霉素[39]、阿奇霉素[40]、肉桂油[41]等,結果顯示,這些脂質體納米復合物均表現出良好的抗菌能力,有效抑制了骨科手術相關的感染。
除了 CS 和脂類等的天然衍生聚合物之外,多種人工合成的高分子被用于納米顆粒的制備,目前最常用的是聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]。研究者通過雙重乳化法制備了包封慶大霉素硫酸鹽(gentamycin sulfate,GS)的 PLGA 納米顆粒,體外結果顯示經歷初期突釋后,隨后的 35 天 GS 穩定釋放,抗菌評價證明了其對骨髓炎的致病菌(金黃色葡萄球菌和表皮葡萄球菌)有高效的殺滅能力[42]。
納米載體賦予了抗菌藥物更好的抗菌活性、安全性和藥物緩釋等特性,但仍存在體內靶向性不足的問題。以二磷酸鹽為代表的含多磷酸酯基團的化合物對羥基磷灰石(hydroxylapatite,HA)具有強親和力,被稱為骨礦物質靶向分子(bone mineral seekers,BMS)。納米載體通過與 BMS 結合,可以提升其骨靶向運輸能力,實現骨科假體感染的定向防治。有研究者在裝載頭孢唑肟的脂質體表面連接阿侖膦酸鹽,并通過靜脈注射將其注入到動物體內,8 h 后檢測發現骨感染區域的藥物攝取量是非靶向區的 3 倍;另外,通過放射性標記頭孢唑肟來評價藥物分布,體內結果顯示具有骨靶向的載藥脂質體已成功將藥物富集至骨髓炎部位[43]。研究者用阿侖膦酸鹽-三(乙二醇)-膽固醇復合物包封苯唑西林,制備出了新型生物礦物骨靶向載藥結合脂質體(biomineral-binding liposomes,BBL),檢測結果顯示 BBL 與普通脂質體的理化性能相似,但穩定性更好,能靶向結合到骨組織的 HA,并顯著抑制金黃色葡萄球菌在其結合的骨組織表面的定植[44]。另一研究采用聚乳酸-羥基乙酸-聚乙二醇-阿侖膦酸共聚物裝載萬古霉素,以用于骨靶向位點的藥物運輸,體外結果表明其對骨質有高親和力,能有效抑制金黃色葡萄球菌在骨組織上的黏附和增殖,同時對大鼠骨髓基質細胞無毒性[45]。
納米藥物載體的研究使抗生素治療感染更加高效,但假體表面生物膜對抗生素的抗性和細菌的耐藥性仍是抗生素治療感染中亟需解決的問題[46]。金屬納米粒子不但可以產生活性氧,且能夠溶解出金屬離子與細菌體內活性蛋白結合,從而殺死細菌,為感染治療提供了新的方向。研究者制備了納米氧化鋅,抗菌結果顯示其可以有效抑制銅綠假單胞菌、大腸桿菌等生物膜的形成[47]。硒納米粒子的抗菌能力也被研究,結果顯示其對金黃色葡萄球菌、銅綠假單胞菌和奇異變形桿菌的生物膜形成抑制率分別達到了 42%、34.3%和 53.4%[48]。
磁性納米顆粒(magnetic nanoparticles,MNP)也已經被用于抗感染藥物傳遞系統,當外部磁場直接施加于假體感染部位,磁場可以控制 MNP 到達該部位釋放藥物,提高藥物輸送效率,另外,可以通過控制顆粒尺寸,實現磁性粒子穿透生物膜作用于細菌并擁有足夠長的體內半衰期。研究者體外評估了 MNP、環丙沙星和磁場共同作用下對銅綠假單胞菌生物膜的影響,結果顯示在 MNP 和磁場的作用下環丙沙星對生物膜中細菌的殺滅能力顯著增強,抗菌效果更加明顯[49]。磁性納米粒子復合 TiO2、ZnO[50]、銅[51]、銀[52]等,為細菌感染提供了另一種治療策略[53]。研究者制備了 Ag/Fe3O4 納米復合材料,與單純銀納米粒子相比,該材料釋放的 Ag+較少,但是卻表現出更好的抗菌功效。此外,可以通過施加磁場來增強其對生物膜的滲透效率,從內部瓦解生物膜[54]。
可灌注型納米藥物載體為假體感染的防治提供了新的思路,每一種載體都具有自己獨特的優勢。該類材料能夠實現藥物的靶向運輸和穩定釋放,同時延長藥物體內半衰期,減少毒副作用,但仍有問題需要解決,例如:CS 作為親水性的多糖僅能包裹親水性藥物,導致 CS 的載藥種類受到限制;脂質體存在藥物滲漏和突釋的問題;雙磷酸鹽修飾賦予納米材料更強的骨靶向能力,但長期給藥可能會引起包括頜骨壞死在內的幾種潛在并發癥[55];以納米銀為代表的納米金屬粒子具有一定的細胞毒性等。隨著表面改性技術的發展,這些問題正在被逐漸解決,未來研究者還需深入了解納米載體或藥物顆粒與機體生物分子或細胞之間的作用關系,納米粒子及其降解產物的細胞毒性以及長期積累可能產生的不良反應,為其臨床應用提供更全面的證據。
2.4 刺激響應型藥物控釋系統
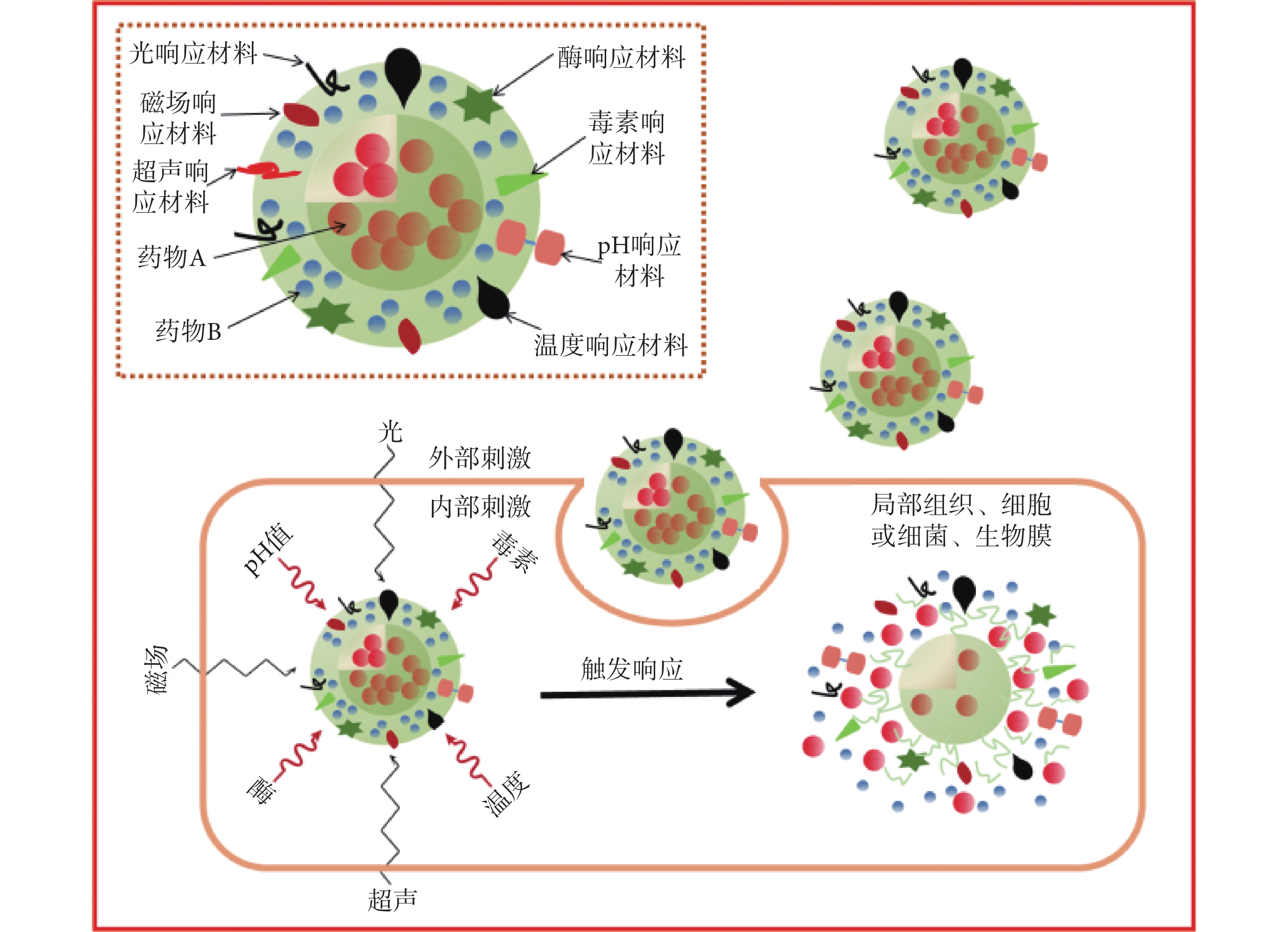
長期使用抗生素可能導致嚴重的并發癥,如出現耐藥菌和機體毒性等問題,雖然緩釋系統可以有效降低這些危害,但尋找更好的解決方法是納米載藥系統的研究熱點。在對感染病理認知的基礎上,設計特定的觸發系統釋放藥物,即只在感染發生時才釋放抗生素,這種方法理論上更有益。目前刺激響應可分為內部刺激和外部刺激,內部刺激包括機體生理的、病理的變化,如局部細菌毒素釋放、體溫升高、酶的過表達、pH 值下降、抗原抗體相互作用等;外部刺激包括熱、光、超聲、磁場和電場等物理因素[56](見圖 2)。
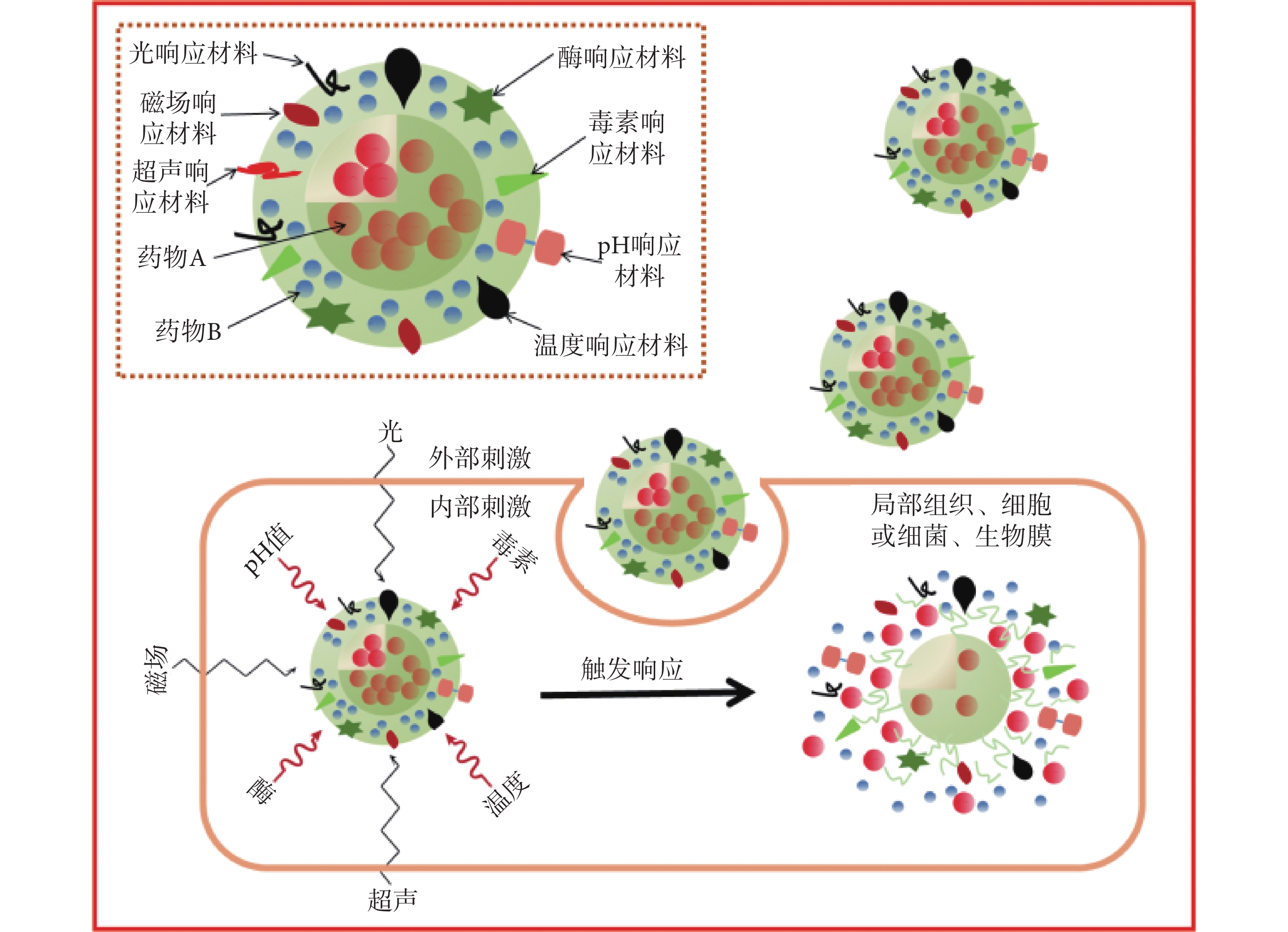 圖2
刺激響應型藥物控釋機制示意圖
Figure2.
Scheme of drug release from the triggered responsive drug delivery systems
圖2
刺激響應型藥物控釋機制示意圖
Figure2.
Scheme of drug release from the triggered responsive drug delivery systems
假體周圍感染發生時,細菌會釋放毒素,研究者據此開發了一種毒素響應的納米顆粒,其內部為裝載慶大霉素的 MSN,外部包被能對毒素做出響應的脂質層,即脂質雙層表面上固定細菌靶向多肽(UBI29-41)。脂質層在體內維持藥物穩定,當感染發生,細菌釋放的毒素會靶向連接 UBI29-41 導致脂質裂解,藥物從 MSN 中釋放,從而有效殺滅細菌[57]。
假體感染發生后常伴有局部溫度的升高。研究者在 MSN 上包被溫敏聚合物聚(N-異丙基丙烯酰胺)[poly(n-isopropylacrylamide),PNIPAM],體溫正常時,PNIPAM 膨脹并封閉 MSN 納米孔;當溫度升高后,PNIPAM 收縮,MSN 中裝載的藥物會從納米孔內釋放[58]。
酶具有生物識別能力。金黃色葡萄球菌作為假體周圍感染的主要病原體,會分泌透明質酸酶。研究者制備出裝載聚己縮胍的透明質酸基納米膠囊,結果顯示,金黃色葡萄球菌和耐甲氧西林金黃色葡萄球菌所釋放的透明質酸酶會裂解納米膠囊,從而釋放藥物、殺滅細菌,實現感染的有效治療[59]。假體感染后,蛋白酶會過度表達,研究者用特定的肽序列作接頭,使得裝載藥物的納米粒子能夠在酶過度表達的區域釋放藥物,實現了藥物的定向釋放[60]。
細菌代謝產物會導致假體周圍 pH 值下降,研究者將納米銀通過 pH 敏感鍵接枝到假體材料表面,當感染發生并導致 pH 值下降時,pH 敏感鍵會斷裂并釋放納米銀殺滅細菌[61]。另有研究者制備了具有 CS 核和 PLGA 殼結構的納米顆粒,其對萬古霉素的包封率達到 70.8%,且具有 pH 響應性和表面電荷可切換性,在 pH 值較低的環境下,藥物釋放速度明顯增加[62]。陽離子、兩親性的聚碳酸酯包裹藥物制備成載藥膠束,表面的正電荷使其很容易攻擊帶負電的菌壁并穿透細菌的細胞膜,從而引發細菌裂解和死亡[63]。
光刺激響應也受到了關注。研究者制備了摻有吲哚菁綠的新型二硒化物交聯的納米凝膠,通過光引發產生活性氧以裂解二硒鍵,這賦予了納米凝膠按需降解和可控釋放藥物的性能[64]。
隨著納米材料的發展,雙重甚至多重刺激響應藥物傳遞系統近年來也備受關注。pH/酶[65]、氧化還原/pH[66]、光/酶/氧化還原[67]等刺激響應系統研究都取得了一定的進展。
刺激響應藥物傳遞系統在沒有響應因素的情況下可以長期保持穩定,即使載藥量較高,也不會釋放。但在實際中,病灶部位與正常組織的響應因素差別相對較小,如 pH 值、溫度等,故要求該類納米粒子具備更靈敏的小范圍響應能力。目前響應性主要依賴于敏感響應型聚合物,而現有該類聚合物的敏感范圍相對不足,難以完全適用于臨床需求,需繼續改善性能。雙重及多重刺激響應納米粒子能更好地發揮對環境中各種響應的優勢并相互彌補不足,已成為靶向研究的重要方向。
3 結論
納米技術預防感染已取得一些進展,如 AcryMed 公司已將銀納米粒子修飾醫用假體的 SilvaGard 技術商業化,但大量的納米藥物載體距臨床應用仍很遙遠。以納米技術為基礎的載藥系統在預防假體周圍感染的可行性、有效性、可靠性和毒性等方面需要進一步的動物實驗和臨床試驗評估。納米技術未來在感染防治中會越來越重要,緩釋系統可有效增強局部抗菌效果、延長抗菌時間、降低機體毒性,而觸發響應藥物傳遞系統能夠適時控釋藥物,具有更大的優勢。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
據統計,骨科手術初次感染率為 0.7%~2.4%[1],感染一旦發生,即使徹底清創、二次返修,也易復發,復發率高達 4.2%[2]。感染已經成為最可怕的骨科手術后并發癥,不但增加了患者身體和心理痛苦,也增加了患者負擔[3]。髖關節、膝關節置換術、長骨開放性骨折內固定術等常見的骨科手術都需要假體輔助,假體所攜帶細菌或體內細菌血源性傳播都會引發手術部位感染[4];且假體表面粗糙或多孔的結構,為細菌的黏附、增殖和生物膜形成提供了優良的場所。假體表面的生物膜是感染難以處理的主要原因,生物膜內細菌種類多[5]、活性低、增殖緩慢,難以通過血液或滑膜液提取,因此,感染細菌的種屬鑒定困難,無法對癥下藥。同時,生物膜能夠阻隔抗生素滲透[6],導致生物膜中的細菌對抗生素的敏感性降低,有研究證明抗生素可有效殺滅浮游菌,但生物膜內的細菌對抗生素的耐受力是浮游菌的 10~1 000 倍[7]。另外,一些細菌還會分泌抗生素水解酶(如 β-內酰胺酶、AmpC 酶)到生物膜的細胞外基質中,削弱了抗生素的殺菌能力[8],甚至部分細菌會侵入感染部位的細胞,通過降低感染細胞 α 毒素的表達水平來阻止細胞裂解、抵御宿主防御機制和抗生素攻擊,導致抗生素治療幾乎無效,這也是感染復發及難以根治的主要原因。因此,防止假體周圍感染和生物膜形成是保證手術長期效果的最重要手段,即在手術后初期,通過抑制細菌在假體表面的黏附或者通過清除假體周圍的細菌來阻止生物膜形成。
1 傳統防治感染的方案及其缺點
傳統的預防和治療骨科感染的方法包括抗生素治療和外科干預[9]。患者手術后需口服或靜脈注射抗生素控制感染,但大部分藥物無法抵達手術部位,且感染一旦發生,患者需長期、大劑量的抗生素治療,這會使細菌產生耐藥性并對患者造成全身毒性。另外,由于抗生素效用和生物膜的影響,幾乎 30% 的患者手術部位的組織液或體液樣本中難以分離出細菌,停藥后感染快速復發,不易控制[10]。當感染比較嚴重時需要手術清創,但由于醫生無法確定感染灶是否完全切除,導致療效的不確定性較高。
綜上所述,如何在假體周圍實現長效并精準地釋放抗菌藥物,是預防假體術后感染亟待解決的問題。
2 納米生物材料在骨科手術抗感染中的應用
納米技術涉及納米范圍內的科學和工程應用,提供具有潛力的新型納米尺度的材料,已用于藥物傳遞系統[11]。納米材料具有尺寸小、比表面積大、表面能高、藥物裝載量高、裝載藥物釋放易控等特性,使其在抗菌領域有巨大的應用潛力。
為了預防假體術后感染,直接修飾假體材料是最有效的方法,主要包括:① 裝載抗菌藥物的納米材料混合到假體材料中緩釋藥物;② 假體表面構建載藥納米涂層緩釋藥物。假體植入手術術后常規大劑量使用抗生素易導致耐藥菌產生并對機體有嚴重的毒副作用,而以納米材料作為載體,在體內不但可以隱藏和保護藥物分子防止其被降解,而且可以精準運輸藥物到特定部位并釋放,在保證療效的同時降低了全身毒性(如將裝載抗菌藥物的納米材料灌注到手術部位并緩釋藥物)(見圖 1)。另外,基于對手術感染部位的 pH 值、溫度、酶和抗原等的認知,研究者設計出納米智能給藥系統,通過因感染所致局部 pH 值、溫度、抗原、酶等的變化來觸發系統以釋放藥物,可以降低藥物的無效釋放,提高藥物的利用效率,降低藥物對機體的毒副作用。
 圖1
骨科假體周圍感染防治中常用的納米藥物運輸系統及使用方式
Figure1.
Various nanotechnology based strategies for prevention and treatment of orthopaedic implant related infection
圖1
骨科假體周圍感染防治中常用的納米藥物運輸系統及使用方式
Figure1.
Various nanotechnology based strategies for prevention and treatment of orthopaedic implant related infection
2.1 假體中添加納米載藥材料
大量研究報道了抗菌藥物(萬古霉素[12]、頭孢唑啉[13]、慶大霉素[14]等)與假體材料直接混合所制備的載藥假體,這種方式雖賦予了假體抗菌能力,但存在以下問題:① 添加過程中抗生素易聚集導致應力集中,且釋放后所留孔隙可能破壞材料結構的完整性;② 抗生素的釋放不可控,假體表面的抗生素快速釋放,使藥物峰值濃度過高,而內部的抗生素釋放困難,使峰值濃度維持時間短,總體抗菌效果差,這種不可控的釋放不但無法有效控制感染,還會導致耐藥菌的產生[15]。聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥是骨科假體手術中常用的材料,研究者在制備過程中直接添加慶大霉素后發現:當慶大霉素含量超過 6%,將對骨水泥的壓縮和彈性模量造成不同程度的影響,且藥物釋放只能維持 72 h[16]。為了解決上述問題,研究者制備了載抗菌藥物的納米粒子,再將其添入假體材料,實現了藥物與假體材料的均勻混合,改善了抗生素的不可控釋放,并減少了添加物對假體機械強度和/或疲勞特性的影響。
脂質體是具有疏水核心和親水外表面的雙層球形囊泡結構,可用于水性懸浮液中親水或疏水藥物的裝載。研究者將其包裹慶大霉素制成納米尺度的脂質體,并與 PMMA 骨水泥混合,結果顯示:相比于直接添加慶大霉素,脂質體的使用將慶大霉素在 PMMA 中的裝載量由 9% 提高到 22%,且慶大霉素在 30 天內幾乎呈現線性釋放;在機械性能方面,除壓縮強度略有降低外,韌性、彎曲強度和硬度均得到加強[17]。以脂質體為基礎的穩定、持久、有效的藥物運輸系統正在進一步研究中。
二氧化硅納米粒子因具有親水性表面、穩定性好、易于官能化等特點,已經成為優良的納米載體。介孔二氧化硅納米粒子(mesoporous silica nanoparticles,MSN)因其具有更大的表面積用于載藥而得到研究者關注。在一項研究中,MSN 被用來改善慶大霉素在 PMMA 骨水泥中的釋放動力學,研究者將裝載慶大霉素的 MSN 混入 PMMA 中(添加量為 10%),發現藥物可持續釋放 80 天以上且釋放量約為 60%;另外,雖然制得材料的彎曲模量下降了 10%,但其抗壓強度幾乎與市售骨水泥相同。此外,在安全性方面含 10% MSN 的骨水泥與小鼠成纖維細胞具有良好的相容性,細胞存活率為 96%[18]。有研究顯示,二氧化硅納米粒子和氨基糖苷類抗生素(慶大霉素、卡那霉素)結合后,能顯著改善此類抗生素的毒性[19]。另有學者將二氧化硅-慶大霉素納米復合物暴露于斑馬魚胚胎中,結果顯示胚胎死亡率并沒有明顯變化[20]。
納米羥基磷灰石(nano-hydroxyapatiten,nHAP)在化學組成和結構上接近天然骨礦物質,具有良好的生物降解性、骨傳導性和生物活性,廣泛用于骨替代材料。研究者制備了裝載萬古霉素的 nHAP/膠原/聚(乳酸)骨移植替代物用于修復大尺寸骨損傷,具有典型多孔結構,孔隙率約 80%,抗壓強度為 1.52 MPa;體外研究結果顯示其在 4 周內釋放了約 98% 的藥物,抑菌率超過了 99%,還表現出了良好的體內和體外生物相容性[21]。
納米金屬及氧化物(如銀、銅、鋅)具有良好的廣譜抗菌效果,且不誘發耐藥菌,有望成為抗生素替代型抗菌物質。有研究者在 PMMA 中分別添加納米銀和慶大霉素,抗菌結果顯示只有載納米銀的 PMMA 具有良好的廣譜抗菌性能[22]。另一研究顯示在波特蘭水泥中添加納米銀后,表現出了優異的抗菌效果,且假體的機械性能無明顯降低,也無細胞毒性[23]。甲基丙烯酸衍生物所合成的水凝膠具有良好的流變特性,是可用于骨修復的新型多功能生物材料,其裝載納米銀后,成骨細胞相容性和流變特性無明顯變化,但抗菌效果得到顯著提升[24]。
假體材料中添加納米載藥材料相較于傳統方法,不僅在抗菌藥物釋放和抗菌性能方面均展現出了明顯優勢,同時還保留了其應用所需的其他特性。在未來的研究中,納米材料及其降解產物對假體周圍組織的影響、藥物穩定釋放的持久性、感染控制后藥物釋放特性及對機體的影響等方面還需深入研究,尤其是相關動物實驗和臨床研究需要加強,以期制備出在機械性能、抗菌性能和生物相容性等方面均能更好地滿足臨床要求的優異的骨科假體材料。
2.2 假體表面構建載藥納米涂層
鑒于假體制備過程中添加載藥納米材料可能導致假體自身機械性能下降、內部藥物釋放緩慢等問題,不少研究者傾向于在假體表面構建載藥涂層,更好地調控藥物釋放速度。但是研究顯示將抗生素直接涂敷在假體表面,可能存在藥物快速釋放或因表面吸附血漿蛋白而阻礙藥物釋放等問題,使其難以長期保持良好的抗菌性能。最近研究者采用載藥涂層緩釋藥物,以實現對細菌黏附、增殖和生物膜形成的抑制。有研究顯示涂層厚度對植入材料體內表現的影響較大,相比微米級、毫米級厚度的涂層,納米尺度的涂層可以顯著降低異物反應的風險[25],所以納米尺度的功能涂層更多被用于改善假體表面性能。
殼聚糖(chitosan,CS)因具有良好的生物相容性、生物降解性和低免疫原性等特性受到了廣大研究者關注。研究者通過多步電泳沉積技術在鈦箔表面上制備 CS/生物活性玻璃/萬古霉素納米復合涂層,其可持續釋放萬古霉素長達 6 周,且藥物釋放與時間呈線性關系,抗菌結果顯示該涂層能夠顯著降低細菌感染的風險[26]。
銀納米粒子具有良好的抗菌能力,已經被用于假體表面涂層修飾,能夠降低植入手術失敗的風險[27]。鈦納米管具有排列整齊的三維孔洞結構、較高的機械強度和良好的生物相容性,廣泛用于藥物載體。研究者在人工關節上制備了載納米銀的鈦納米管抗菌涂層,將對照組(未修飾)人工關節和實驗組(載銀鈦納米管涂層)人工關節植入 80 只新西蘭兔體內,15 天后在植入部位注射金黃色葡萄球菌上清液構建感染模型,結果顯示實驗組動物在不同時間點的體溫、血清 C 反應蛋白濃度、紅細胞沉降率、降鈣素原和假體感染率方面均顯著低于對照組,證明抗菌涂層顯著抑制了感染的發生[28]。另一研究利用鼠感染模型評價了載銀鈦納米管涂層的生物安全性,結果顯示該涂層不僅可以穩定可控地釋放銀離子,在體外和體內均表現出良好的抗菌性能,而且無細胞毒性或成骨分化的障礙[29]。
nHAP 在納米涂層中也有廣泛應用,有研究者在鈦膝關節假體表面涂覆 nHAP/銀納米涂層,將修飾的關節和未修飾的關節植入兔子體內,然后注射金黃色葡萄球菌液。放射影像、微生物和組織學評估結果均顯示 nHAP/銀修飾關節的細菌定植率顯著低于未修飾組,且無炎癥或其他異物反應,證明了其體內安全性[30]。另一研究在種植體表面制備了 nHAP/銀納米涂層,動物實驗顯示,該涂層具有良好的抗菌效果,且肝臟、心臟、脾臟、腎臟和中樞神經組織樣本中均未檢測到銀的累積,種植體周圍也沒有炎癥反應和骨組織損傷[31]。
巨噬細胞在機體自身抗感染中起著重要作用,感染部位的巨噬細胞激活有利于防止感染發生;但當細胞介導的免疫反應不足(炎癥因子表達量低)時可能導致感染發生,因此,通過材料表面釋放炎癥因子可以降低體內感染發生率。研究者利用靜電層層自組裝技術,在假體表面制備了裝載炎癥因子(MCP-1 和 IL-12 p70)的納米涂層,體內結果顯示該涂層可以招募更多的巨噬細胞到達感染部位以達到防止感染的目的,該方法有效激活了機體免疫系統,避免了藥物毒副作用,是解決細菌耐藥性的有效手段[32]。
載藥脂質體以涂層形式附著于假體表面,可以實現藥物的長期釋放。研究者利用多巴胺將裝載地塞米松和米諾環素的脂質體固定在聚苯乙烯表面,結果顯示該表面抑制了促炎癥因子的表達,也阻止了細菌的黏附和增殖[33]。
通過在假體表面構建載藥納米涂層,可以使假體具有抗菌性能和生物相容性,并保持假體良好的理化、機械性能,但在臨床應用前仍有一些問題需要考慮:如何保證涂層長期釋放藥物并維持藥物濃度高于有效抑菌濃度;如何使抗菌藥物的釋放適時終止,以避免產生機體毒性和耐藥菌;另外,涂層與假體結合界面的穩定度、制備工藝的復雜度、大規模工業化生產的可實現性等問題也亟待解決。雖然目前在假體表面構建納米載藥涂層的研究取得了一定進展,但相關體內結果和臨床試驗的報道仍相對較少。
2.3 可灌注型納米抗菌藥物載體
抗菌藥物具有優異的抗菌效果,但手術部位藥物的低富集量限制了藥物效用,其他器官組織的藥物累積又容易導致局部損傷,還可能增加耐藥性菌株感染的風險[34],而且大劑量抗生素的長期施用也會對機體產生嚴重的毒副作用。實現抗菌藥物在手術部位的定點釋放,仍然是亟待解決的難題。納米抗菌藥物載體可以在人體內運輸藥物,且具有靶向運輸、藥物可控釋放等優勢,能夠降低藥物使用劑量、延長體內半衰期、提高患者依從性以及降低藥物對機體的毒副作用,為假體術后感染的治療帶來新的契機。
CS 的良好生物相容性、生物降解性和低免疫原性,使其也適用于藥物載體。鹽酸小檗堿(berberine,BBR)具有良好的抗菌功效,但由于水溶性差導致其生物利用度低以及體內半衰期短等缺點,限制了它的應用。研究者利用離子交聯技術合成了裝載 BBR 的 CS 球狀納米粒子,體外結果顯示其具有良好的 BBR 釋放能力,將其注射到大鼠關節感染部位,與使用自由形式的 BBR 溶液相比,大鼠血漿中 BBR 水平明顯降低,滑液中 BBR 含量更高且保留時間增加,半衰期更長,表現出了良好的感染治療能力[35]。
修飾的脂質體具有將藥物輸送到特定靶位點的能力,且裝載在脂質體中的藥物比自由形式的藥物更有效[36]。研究者通過脫水-再水合法制備了載萬古霉素的脂質體,體外結果顯示其具有優異的殺滅耐甲氧西林金黃色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)的能力。動物感染模型研究結果顯示,載萬古霉素脂質體在體內清除 MRSA 的能力比游離萬古霉素更高[37]。另一體內結果顯示脂質體包封的萬古霉素在腎臟的累積量少,有效降低了萬古霉素所致的腎毒性[38]。除了包封萬古霉素之外,還有大量關于脂質體包封其他抗菌藥物的研究,如氯霉素[39]、阿奇霉素[40]、肉桂油[41]等,結果顯示,這些脂質體納米復合物均表現出良好的抗菌能力,有效抑制了骨科手術相關的感染。
除了 CS 和脂類等的天然衍生聚合物之外,多種人工合成的高分子被用于納米顆粒的制備,目前最常用的是聚乳酸-羥基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]。研究者通過雙重乳化法制備了包封慶大霉素硫酸鹽(gentamycin sulfate,GS)的 PLGA 納米顆粒,體外結果顯示經歷初期突釋后,隨后的 35 天 GS 穩定釋放,抗菌評價證明了其對骨髓炎的致病菌(金黃色葡萄球菌和表皮葡萄球菌)有高效的殺滅能力[42]。
納米載體賦予了抗菌藥物更好的抗菌活性、安全性和藥物緩釋等特性,但仍存在體內靶向性不足的問題。以二磷酸鹽為代表的含多磷酸酯基團的化合物對羥基磷灰石(hydroxylapatite,HA)具有強親和力,被稱為骨礦物質靶向分子(bone mineral seekers,BMS)。納米載體通過與 BMS 結合,可以提升其骨靶向運輸能力,實現骨科假體感染的定向防治。有研究者在裝載頭孢唑肟的脂質體表面連接阿侖膦酸鹽,并通過靜脈注射將其注入到動物體內,8 h 后檢測發現骨感染區域的藥物攝取量是非靶向區的 3 倍;另外,通過放射性標記頭孢唑肟來評價藥物分布,體內結果顯示具有骨靶向的載藥脂質體已成功將藥物富集至骨髓炎部位[43]。研究者用阿侖膦酸鹽-三(乙二醇)-膽固醇復合物包封苯唑西林,制備出了新型生物礦物骨靶向載藥結合脂質體(biomineral-binding liposomes,BBL),檢測結果顯示 BBL 與普通脂質體的理化性能相似,但穩定性更好,能靶向結合到骨組織的 HA,并顯著抑制金黃色葡萄球菌在其結合的骨組織表面的定植[44]。另一研究采用聚乳酸-羥基乙酸-聚乙二醇-阿侖膦酸共聚物裝載萬古霉素,以用于骨靶向位點的藥物運輸,體外結果表明其對骨質有高親和力,能有效抑制金黃色葡萄球菌在骨組織上的黏附和增殖,同時對大鼠骨髓基質細胞無毒性[45]。
納米藥物載體的研究使抗生素治療感染更加高效,但假體表面生物膜對抗生素的抗性和細菌的耐藥性仍是抗生素治療感染中亟需解決的問題[46]。金屬納米粒子不但可以產生活性氧,且能夠溶解出金屬離子與細菌體內活性蛋白結合,從而殺死細菌,為感染治療提供了新的方向。研究者制備了納米氧化鋅,抗菌結果顯示其可以有效抑制銅綠假單胞菌、大腸桿菌等生物膜的形成[47]。硒納米粒子的抗菌能力也被研究,結果顯示其對金黃色葡萄球菌、銅綠假單胞菌和奇異變形桿菌的生物膜形成抑制率分別達到了 42%、34.3%和 53.4%[48]。
磁性納米顆粒(magnetic nanoparticles,MNP)也已經被用于抗感染藥物傳遞系統,當外部磁場直接施加于假體感染部位,磁場可以控制 MNP 到達該部位釋放藥物,提高藥物輸送效率,另外,可以通過控制顆粒尺寸,實現磁性粒子穿透生物膜作用于細菌并擁有足夠長的體內半衰期。研究者體外評估了 MNP、環丙沙星和磁場共同作用下對銅綠假單胞菌生物膜的影響,結果顯示在 MNP 和磁場的作用下環丙沙星對生物膜中細菌的殺滅能力顯著增強,抗菌效果更加明顯[49]。磁性納米粒子復合 TiO2、ZnO[50]、銅[51]、銀[52]等,為細菌感染提供了另一種治療策略[53]。研究者制備了 Ag/Fe3O4 納米復合材料,與單純銀納米粒子相比,該材料釋放的 Ag+較少,但是卻表現出更好的抗菌功效。此外,可以通過施加磁場來增強其對生物膜的滲透效率,從內部瓦解生物膜[54]。
可灌注型納米藥物載體為假體感染的防治提供了新的思路,每一種載體都具有自己獨特的優勢。該類材料能夠實現藥物的靶向運輸和穩定釋放,同時延長藥物體內半衰期,減少毒副作用,但仍有問題需要解決,例如:CS 作為親水性的多糖僅能包裹親水性藥物,導致 CS 的載藥種類受到限制;脂質體存在藥物滲漏和突釋的問題;雙磷酸鹽修飾賦予納米材料更強的骨靶向能力,但長期給藥可能會引起包括頜骨壞死在內的幾種潛在并發癥[55];以納米銀為代表的納米金屬粒子具有一定的細胞毒性等。隨著表面改性技術的發展,這些問題正在被逐漸解決,未來研究者還需深入了解納米載體或藥物顆粒與機體生物分子或細胞之間的作用關系,納米粒子及其降解產物的細胞毒性以及長期積累可能產生的不良反應,為其臨床應用提供更全面的證據。
2.4 刺激響應型藥物控釋系統
長期使用抗生素可能導致嚴重的并發癥,如出現耐藥菌和機體毒性等問題,雖然緩釋系統可以有效降低這些危害,但尋找更好的解決方法是納米載藥系統的研究熱點。在對感染病理認知的基礎上,設計特定的觸發系統釋放藥物,即只在感染發生時才釋放抗生素,這種方法理論上更有益。目前刺激響應可分為內部刺激和外部刺激,內部刺激包括機體生理的、病理的變化,如局部細菌毒素釋放、體溫升高、酶的過表達、pH 值下降、抗原抗體相互作用等;外部刺激包括熱、光、超聲、磁場和電場等物理因素[56](見圖 2)。
 圖2
刺激響應型藥物控釋機制示意圖
Figure2.
Scheme of drug release from the triggered responsive drug delivery systems
圖2
刺激響應型藥物控釋機制示意圖
Figure2.
Scheme of drug release from the triggered responsive drug delivery systems
假體周圍感染發生時,細菌會釋放毒素,研究者據此開發了一種毒素響應的納米顆粒,其內部為裝載慶大霉素的 MSN,外部包被能對毒素做出響應的脂質層,即脂質雙層表面上固定細菌靶向多肽(UBI29-41)。脂質層在體內維持藥物穩定,當感染發生,細菌釋放的毒素會靶向連接 UBI29-41 導致脂質裂解,藥物從 MSN 中釋放,從而有效殺滅細菌[57]。
假體感染發生后常伴有局部溫度的升高。研究者在 MSN 上包被溫敏聚合物聚(N-異丙基丙烯酰胺)[poly(n-isopropylacrylamide),PNIPAM],體溫正常時,PNIPAM 膨脹并封閉 MSN 納米孔;當溫度升高后,PNIPAM 收縮,MSN 中裝載的藥物會從納米孔內釋放[58]。
酶具有生物識別能力。金黃色葡萄球菌作為假體周圍感染的主要病原體,會分泌透明質酸酶。研究者制備出裝載聚己縮胍的透明質酸基納米膠囊,結果顯示,金黃色葡萄球菌和耐甲氧西林金黃色葡萄球菌所釋放的透明質酸酶會裂解納米膠囊,從而釋放藥物、殺滅細菌,實現感染的有效治療[59]。假體感染后,蛋白酶會過度表達,研究者用特定的肽序列作接頭,使得裝載藥物的納米粒子能夠在酶過度表達的區域釋放藥物,實現了藥物的定向釋放[60]。
細菌代謝產物會導致假體周圍 pH 值下降,研究者將納米銀通過 pH 敏感鍵接枝到假體材料表面,當感染發生并導致 pH 值下降時,pH 敏感鍵會斷裂并釋放納米銀殺滅細菌[61]。另有研究者制備了具有 CS 核和 PLGA 殼結構的納米顆粒,其對萬古霉素的包封率達到 70.8%,且具有 pH 響應性和表面電荷可切換性,在 pH 值較低的環境下,藥物釋放速度明顯增加[62]。陽離子、兩親性的聚碳酸酯包裹藥物制備成載藥膠束,表面的正電荷使其很容易攻擊帶負電的菌壁并穿透細菌的細胞膜,從而引發細菌裂解和死亡[63]。
光刺激響應也受到了關注。研究者制備了摻有吲哚菁綠的新型二硒化物交聯的納米凝膠,通過光引發產生活性氧以裂解二硒鍵,這賦予了納米凝膠按需降解和可控釋放藥物的性能[64]。
隨著納米材料的發展,雙重甚至多重刺激響應藥物傳遞系統近年來也備受關注。pH/酶[65]、氧化還原/pH[66]、光/酶/氧化還原[67]等刺激響應系統研究都取得了一定的進展。
刺激響應藥物傳遞系統在沒有響應因素的情況下可以長期保持穩定,即使載藥量較高,也不會釋放。但在實際中,病灶部位與正常組織的響應因素差別相對較小,如 pH 值、溫度等,故要求該類納米粒子具備更靈敏的小范圍響應能力。目前響應性主要依賴于敏感響應型聚合物,而現有該類聚合物的敏感范圍相對不足,難以完全適用于臨床需求,需繼續改善性能。雙重及多重刺激響應納米粒子能更好地發揮對環境中各種響應的優勢并相互彌補不足,已成為靶向研究的重要方向。
3 結論
納米技術預防感染已取得一些進展,如 AcryMed 公司已將銀納米粒子修飾醫用假體的 SilvaGard 技術商業化,但大量的納米藥物載體距臨床應用仍很遙遠。以納米技術為基礎的載藥系統在預防假體周圍感染的可行性、有效性、可靠性和毒性等方面需要進一步的動物實驗和臨床試驗評估。納米技術未來在感染防治中會越來越重要,緩釋系統可有效增強局部抗菌效果、延長抗菌時間、降低機體毒性,而觸發響應藥物傳遞系統能夠適時控釋藥物,具有更大的優勢。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。