提出了一種結合光鑷技術與微流控芯片的人血紅細胞變形性高通量檢測方法,用于紅細胞變形性的統計學準確表征。首先,利用光阱力與流體粘滯阻力的共同作用實現紅細胞的有效拉伸變形;然后,利用圖像處理方法對單細胞變形前后的特征參量進行提取,得到面積和周長變形指數;最后,進行統計學分析,并利用平均變形指數參量( 、
、 )對紅細胞的變形性進行表征。搭建了高通量檢測系統,通過大量實驗得到了最優實驗條件;并利用具有不同變形性的 3 組樣本進行了統計學驗證實驗。結果表明,
)對紅細胞的變形性進行表征。搭建了高通量檢測系統,通過大量實驗得到了最優實驗條件;并利用具有不同變形性的 3 組樣本進行了統計學驗證實驗。結果表明, 最小區分量為 9.71%,8 通道結構的檢測通量約為 370 個/min。高通量檢測及表征方法可以實現不同變形性紅細胞的統計學有效區分,為其他類型樣本的高通量變形性分析提供了解決思路。
最小區分量為 9.71%,8 通道結構的檢測通量約為 370 個/min。高通量檢測及表征方法可以實現不同變形性紅細胞的統計學有效區分,為其他類型樣本的高通量變形性分析提供了解決思路。
引用本文: 張朦, 孟曉辰, 祝連慶. 結合光鑷與微流控技術的紅細胞變形性高通量檢測及表征方法. 生物醫學工程學雜志, 2020, 37(5): 848-854. doi: 10.7507/1001-5515.201911020 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
紅細胞(red blood cells,RBCs)變形性是指紅細胞在外力作用下改變自身形狀的能力,是血液表觀黏度和體內微循環有效灌注的必要條件,同時也是紅細胞壽命的重要決定因素[1]。在理論上,紅細胞變形性的研究可以闡明宏觀流變現象機制的理論基礎,幫助研究一些病變的發病病理,還可評估細胞的生理狀況;在病理學上,紅細胞變形性的測量可以在細胞層次上探索組織液等生理環境的病理現象,也有助于研究細胞在病變或受到藥物刺激后表現出來的力學特性變化[2-3],對疾病的診斷與治療具有重要的應用價值。
目前,紅細胞變形性的常用檢測方法有微管法、微孔濾膜法、粘性測量法以及光鑷法[1]。微管法采用內徑小于紅細胞直徑的微吸管,測量在一定負壓條件下紅細胞被吸入管內的長度。該方法可以實現對單細胞變形性的研究,但這種方法技術復雜、測量費時、設備昂貴,不宜用于臨床檢查,因此限制了它的應用范圍。微孔濾膜法是利用濾膜、金屬篩等具有過濾作用的器具來測定紅細胞的變形性。它的裝置較為簡單,其最大優點是能在一定程度上模擬紅細胞通過微循環中毛細血管的過程,但是不能觀察細胞過孔全過程,所以使得某些結果在各個研究者的報告中存在較大的差異。粘性測量法是利用紅細胞懸浮液的表觀粘度隨剪切率的增高而降低的原理,從粘度上的差異來估測紅細胞變形性,在較高剪切率情況下,表觀粘度降低越明顯,紅細胞的變形能力越好。該方法操作簡便,并能一次測量紅細胞群體的平均變形性,適用于臨床觀察,但不能分辨或實測單個細胞或細胞亞群群體的變形情況,無法獲得物理測量和實際變形之間的定量關系。光鑷技術應用高斯光束匯聚的激光勢阱捕獲細胞,結合聲光偏轉器可對細胞施加光阱作用使細胞發生形變,有效避免了機械損傷,并且光鑷系統對光阱力的控制和測量可精確到皮牛頓量級[4-5],是非常理想的單細胞細胞力學測量工具,但是無法實現高通量檢測。
以往光鑷捕獲紅細胞測量其變形性的方法均為靜態研究[6],無法實現連續流下的細胞操縱。近年來,人們開始探索動態研究紅細胞變形性的方法,有研究者利用光鑷捕捉和操縱活體小鼠真皮下毛細血管內的紅細胞[7],拖動細胞使其到達指定位置,這種方法可以清除堵塞的微血管,但是活體中光阱剛度難以校準,不同組織、不同捕獲位置的光學剛度也不同,另外,在較深的位置會失去激光功率,捕獲力度顯著下降。目前,有多種基于光鑷增強的微流控芯片進行細胞分析的方法,光鑷捕獲細胞并拖動目標細胞使其發生形變,從而利用合適的指標對其變形性進行判別。該方法具有準確度高、非侵入等優點,但光鑷對細胞產生的操縱力往往處于皮牛量級,因而連續流下的細胞操縱要求細胞進樣流速非常低,從而限制了光鑷在高通量細胞操縱方面的應用。
針對以上問題,本文提出一種光鑷技術與微流控芯片結合的方法實現紅細胞變形性的高通量分析。利用流體粘滯阻力與光鑷系統光阱力的共同作用實現單分散紅細胞的捕獲及變形拉伸[8-11],同時利用圖像處理方法對紅細胞變形前后的特征進行分析,獲取變形指數(deformation index,DI)對細胞變形性能進行表征。最后,分別利用 CaCl2 和 H2O2 溶液改變紅細胞的變形性,并進行了對比實驗,以期實現人血紅細胞變形性的高通量準確表征,并為其他種類細胞的變形性高通量研究提供可能。
1 方法研究
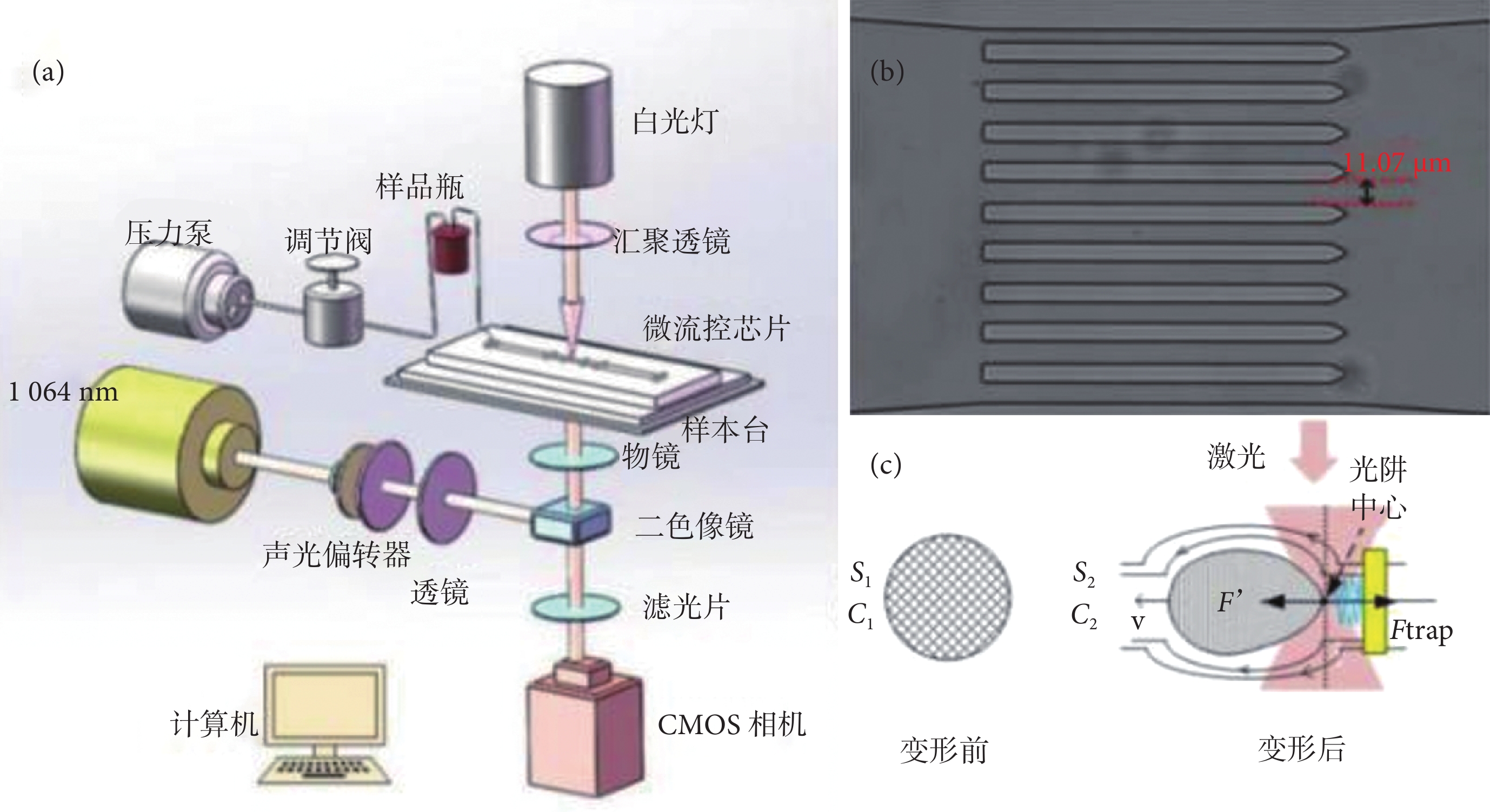
光鑷是指當一束激光經過高數值孔徑的顯微物鏡匯聚在樣品表面時,由于光和物質之間動量傳遞引起的力學效應,在匯聚點形成的三維梯度勢阱[12]。利用光鑷系統可以實現對微小粒子的捕獲及操縱。微流控裝置的流動控制由壓力泵的輸入電壓和微型壓力閥控制,其流速需保證光阱力能夠捕獲流動的紅細胞,當微流道內的單分散紅細胞被光阱捕獲時,紅細胞同時受到光阱力和沿流動方向的流體粘滯阻力的共同作用,從而實現紅細胞的有效拉伸[13-16]。基于微流控芯片的紅細胞變形性光鑷檢測方法原理圖如圖 1a 所示。圖 1b 為實驗系統的 8 通道線陣微流道實物圖,該通道寬 11 μm,高 12 μm,可以更好地控制流體流速,增加流通量,起到分流減速的作用。
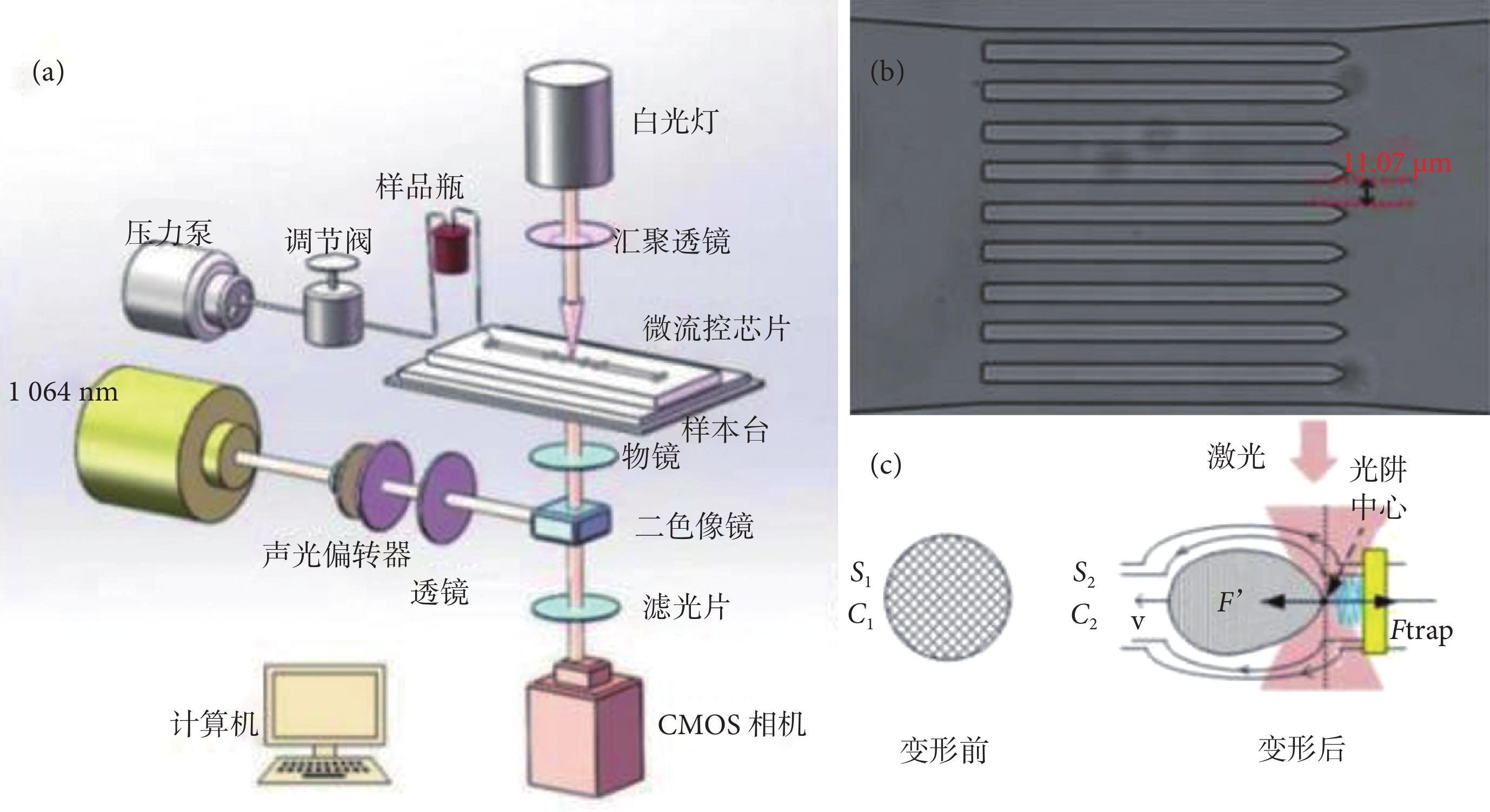 圖1
系統原理圖
圖1
系統原理圖
a. 光鑷檢測方法原理圖;b. 8 通道線陣微流道實物圖;c. 細胞變形評價參數
Figure1. System diagrama. schematic diagram of optical tweezers detection; b. eight channel line array microchannel; c. evaluation parameters of cell deformation
1.1 紅細胞變形受力分析
人血紅細胞的半徑遠大于激光波長,可將入射光當做光線的合集,利用射線光學理論近似模型對光阱力進行分析[12, 17]。假設人血紅細胞的折射率是 n,光阱力可分解為散射力 Fs 和梯度力 Fg[18],近似表示為:
 |
其中,θ 為光線入射角,γ 為折射角,P 為激光在通過聚焦物鏡后的功率,c 為光在真空中的傳播速度,R 為 Fresnel 反射系數,T 為 Fresnel 透射系數。
另一方面,微流控芯片的微流道與人血紅細胞具有良好的尺寸適配性[18-20],可以減小單分散紅細胞在微流道內流動的位置偏差,有效提高光鑷系統的捕獲效率。當匯聚光束作用在 8 通道之一中的紅細胞上時,不影響其余通道中細胞的流動狀態,但是長直流道內液體流速為拋物線分布,所以 8 個通道的流速有一定的差異性,單個紅細胞被光鑷系統捕獲時,紅細胞受到的流體粘滯阻力[17]可表示為:
 '/> '/> |
其中,r 為紅細胞半徑,η 為流體粘滯系數,v 為流體流速。粘滯阻力方向為流體的流動方向。
在光阱力與流體粘滯阻力的共同作用下,紅細胞在遠離光阱中心的末端發生形變[13-14],如圖 1c 所示。當光阱作用于紅細胞使其短暫停止時,會引起后續流速的變化,但這并不影響后續的測量,當下一個紅細胞進入光阱時與當前紅細胞發生碰撞,使其脫離光阱范圍,流體粘滯阻力和光阱力會重新達到平衡的懸停狀態,進而實現同一光阱的連續檢測。
1.2 紅細胞變形性表征方法
為了實現紅細胞變形性的高通量檢測,利用 CMOS 相機對單細胞的流動、捕獲及脫離過程進行視頻采集。利用 MATLAB 對血細胞圖像進行分析:首先利用 3 × 3 中值濾波器對紅細胞圖像進行銳化,使其邊緣變得清晰,再利用高斯頻域濾波減小圖像噪聲,然后采用 Canny 邊緣檢測算子的方法對紅細胞進行邊緣檢測[21]。隨后采用閾值分割的方法對圖像邊緣進行提取,得到需要的細胞輪廓,再對其采用數學形態中的腐蝕、膨脹和填充的算法對二值圖像進行優化,最終得到能夠真實反映紅細胞輪廓的填充圖像。
在此基礎上,利用面積變形指數(DIS)和周長變形指數(DIC)對紅細胞的變形量進行表征。變形指數 DI 定義為:
 |
其中,S1、S2 分別表示紅細胞被捕獲前、后的面積,C1、C2 分別表示紅細胞被捕獲前、后的周長。圖 1c 為細胞變形評價參數。
2 實驗與結果分析
2.1 微流控芯片制備
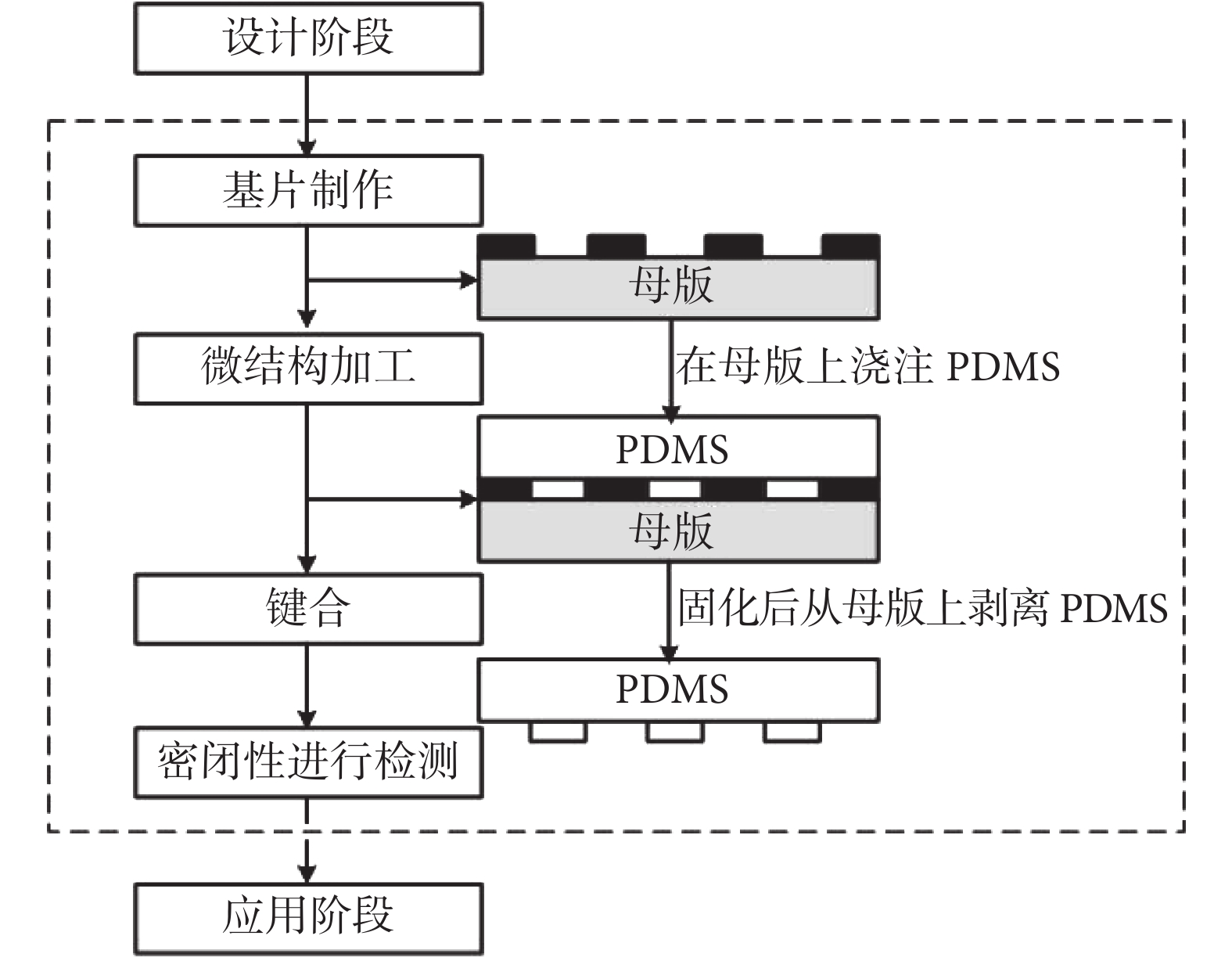
通常 PDMS 微流控芯片制造分為四個過程完成:芯片設計,基片制作,基片與蓋片的鍵合,以及對芯片的密閉性進行檢測[22-23]。微流控芯片制造流程如圖 2 所示。PDMS 微流控通道利用常規軟光刻制作,首先通過 L-EDIT 軟件設計通道結構,并將結構特征寫入透明掩模,在 4 英寸拋光的硅晶片上旋涂負性光刻膠 SU-8 以制造 SU-8 模具。將制作好的模具進行超聲清洗去除表面雜質,再放入真空干燥器中烘干,將質量比為 10∶1 的 PDMS 和固化劑的混合物倒在 SU-8 模具上,放入抽真空機進行排氣,按規定的時間(30 min)和溫度(90℃)在固化板上進行烘烤固化,然后將 PDMS 復制品從母模上剝離并進行打孔、鍵合。我們所用的蓋片為普通的蓋玻片,鍵合前先將蓋玻片放入干燥劑中進行烘干(200℃,2 h),利用氧等離子體鍵合原理,對 PDMS 和蓋玻片表面進行氧化處理并完成粘合。制造完成后通常需要對芯片密閉性進行檢測,以確保所制得的芯片能夠在相應的實驗中進行應用。
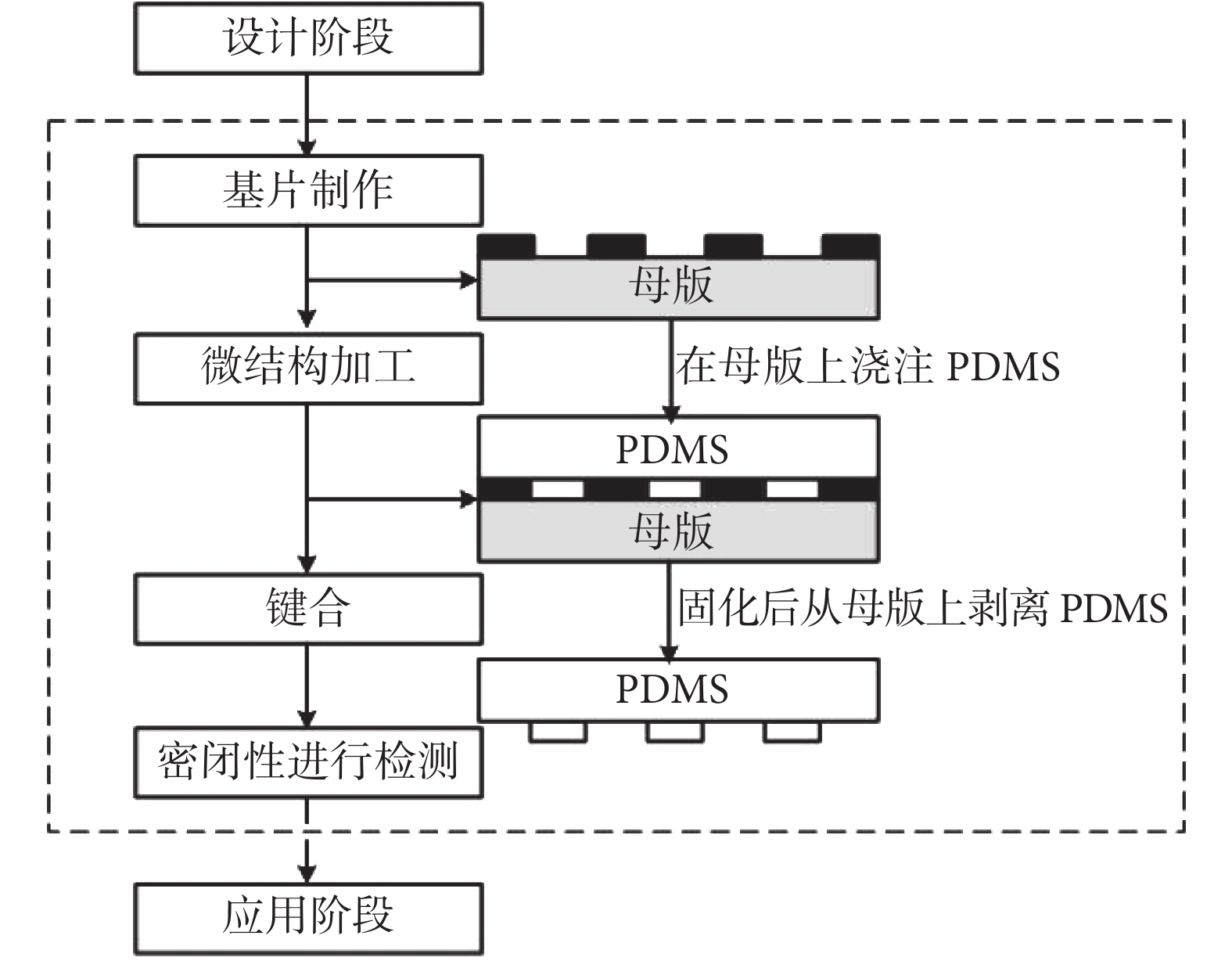 圖2
微流控芯片制造流程
Figure2.
Microfluidic chip manufacturing process
圖2
微流控芯片制造流程
Figure2.
Microfluidic chip manufacturing process
2.2 實驗系統搭建與樣品液制備
基于以上理論分析,搭建了人血紅細胞變形性高通量檢測方法驗證系統。光鑷系統為德國 Aresis 公司的 Tweez250si(5 W,1 064 nm 近紅外激光器,2 048 × 2 048 單色 CMOS,單像素尺寸 5.5 μm),配套軟件為 TWEEZ;微流控芯片內包含 8 個微流道,每個微流道高 12 μm、寬 11 μm;利用微型氣泵(SC3101PM,3.0 V,0.28 L/min)及精密調壓閥(IR1010-01-A,SMC)實現微流道內紅細胞流速的控制。實驗所用人血紅細胞(濃度 6%,阿氏液保存)購自華潤生物(中國上海)有限公司。
為了驗證本文高通量檢測方法對紅細胞變形差異的檢測有效性,分別利用 CaCl2(增大紅細胞變形量)和 H2O2(減小紅細胞變形量)溶液改變紅細胞的變形特性[24-25],對三種血紅細胞樣本進行制備:對照組(正常人血紅細胞)、H2O2 實驗組以及 CaCl2 實驗組。對照組:取 500 μL 紅細胞,利用離心法(1 200 r/min,5 min)重復清洗紅細胞三次后,加入 2 mL 磷酸鹽緩沖液(PBS,pH7.4);H2O2 實驗組:取 500 μL 紅細胞,三次離心清洗后加入 1 mL 濃度為 400 μmol/L 的 H2O2 溶液,反應完成后離心紅細胞加入 2 mL PBS;CaCl2 實驗組:取 500 μL 紅細胞,三次離心清洗后加入 1 mL 濃度為 500 μmol/L 的 CaCl2 溶液,反應 20 min 后離心紅細胞加入 2 mL PBS。三組樣本中分別加入 100 μL 濃度為 1% 的牛血清白蛋白溶液(BSA),防止細胞粘附。
2.3 最優實驗條件選取
由紅細胞的受力分析可知,紅細胞的變形量與光鑷功率以及流體流速直接相關。高功率條件下可以得到更大的光阱力[17],同時也會增大紅細胞的損傷概率;高驅動壓力可以產生大的粘滯阻力并且提高檢測通量,但是高流速會導致紅細胞捕獲效率降低的問題。所以,需要對不同光鑷功率和驅動壓力條件下的實驗效果進行分析,確定本系統的最優實驗條件。
大量實驗結果表明,當光鑷功率超過 200 mW 時微流控芯片會產生灼燒現象,所以本實驗的光鑷功率上限設置為 200 mW。通過調節微型氣泵的供電電壓可以實現流體驅動壓力的控制,為了實現紅細胞流速恒定,通常所記錄的視頻是在數值不變時記錄、測量。分別設置氣泵供電電壓為 1.5 V 和 3.0 V,光鑷功率 100 mW 和 200 mW,在 4 種組合實驗條件下對正常人血紅細胞的變形性進行檢測。實驗過程中發現當氣泵供電電壓設為 3.0 V、光鑷功率為 100 mW 時,無法實現紅細胞的有效捕獲。所以,只對其他 3 種實驗條件的結果進行了分析,圖 3 為不同實驗條件下紅細胞被捕獲后的變形圖像,細胞流動方向一致,即自上而下,如圖右側所示。每種實驗條件下隨機選取 10 組紅細胞圖像,計算其捕獲前后的面積及周長如表 1 所示。
 圖3
不同條件下的紅細胞被捕獲圖像
Figure3.
Red blood cells captured under different conditions
圖3
不同條件下的紅細胞被捕獲圖像
Figure3.
Red blood cells captured under different conditions
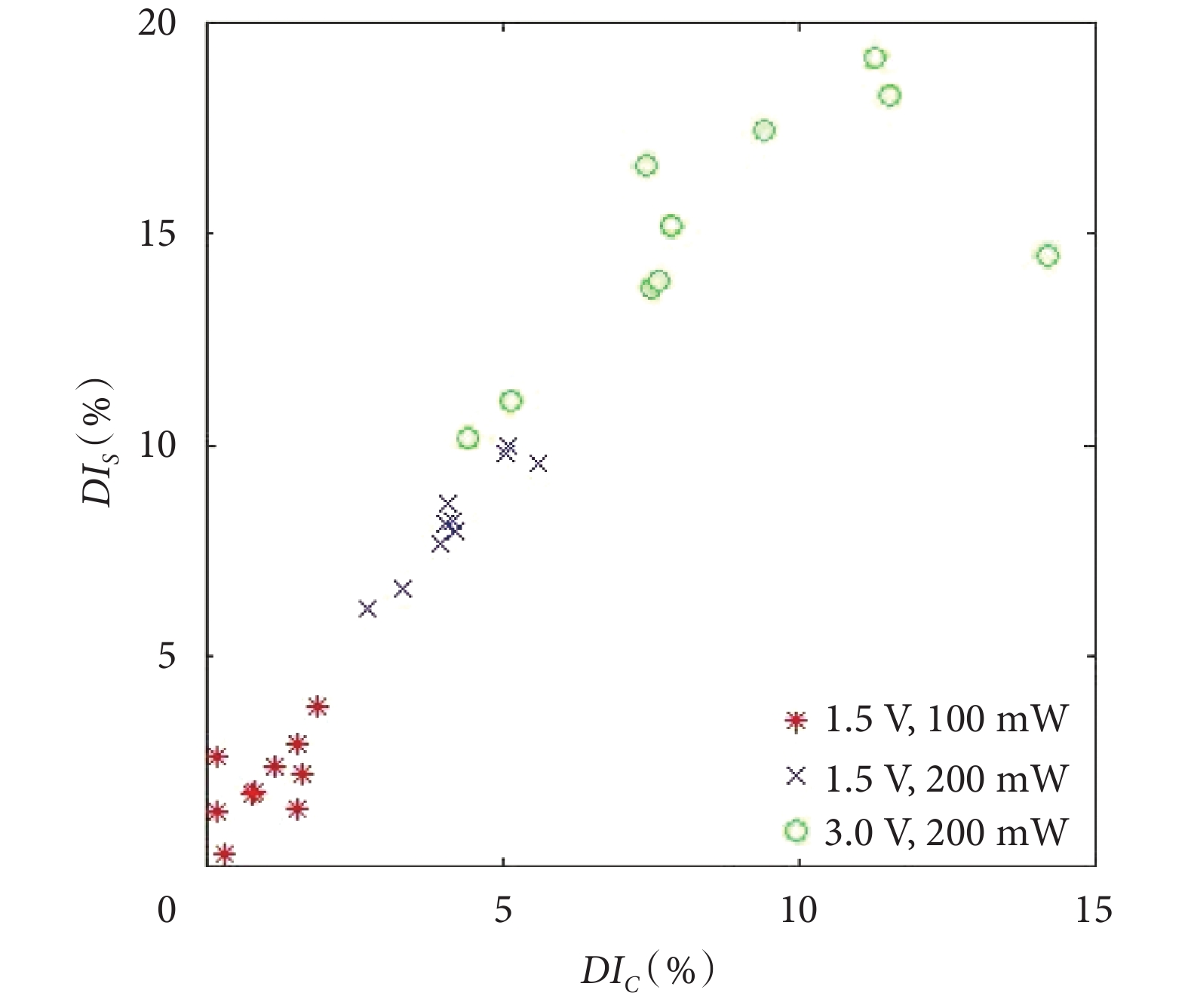
為了直觀對比不同實驗條件下紅細胞變形的差異性,分別對變形指數 DIC 和 DIS 進行了計算,如圖 4 所示。由圖 4 可知,3 種實驗條件下均可以實現單分散紅細胞的有效捕獲,當光鑷功率設定為上限值 200 mW 時,紅細胞的變形指數隨著流體粘滯阻力的增加而增大。微型氣泵供電電壓增加至 3.0 V 時,可以在保證紅細胞被有效捕獲的前提下,得到最大的形變量。
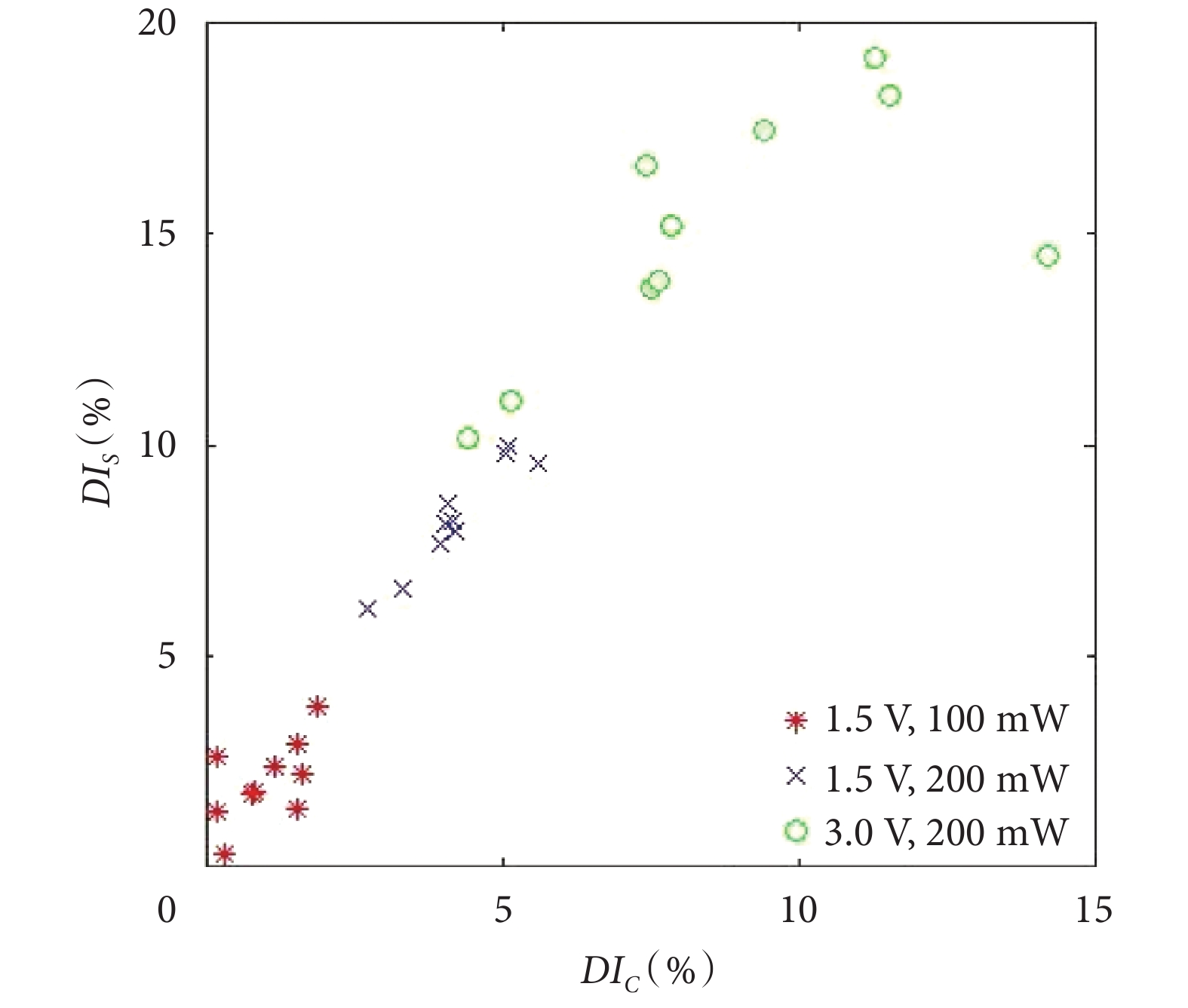 圖4
不同條件下的紅細胞變形指數
Figure4.
Erythrocyte deformation index under different conditions
圖4
不同條件下的紅細胞變形指數
Figure4.
Erythrocyte deformation index under different conditions
另外,由于紅細胞個體固有特性的差異,相同實驗條件下的變形量會存在一定的偏差。以圖 4 中的 10 組實驗結果為例,不同實驗條件下 DIS、DIC 最大值與最小值的差值分別為 3.50%、1.68%(電壓 1.5 V,功率 100 mW),3.85%、2.88%(電壓 1.5 V,功率 200 mW)和 8.97%、9.82%(電壓 3.0 V,功率 200 mW)。由以上分析可知,電壓為 3.0 V、功率為 200 mW 條件下可以實現紅細胞的有效變形分析以及細胞個體變形差異性的分析,可作為后續實驗條件。
2.4 對比實驗與統計分析
為了避免血紅細胞變形的個體差異性對實驗表征結果準確性的影響,需要對大量樣本的實驗結果進行分析,并利用變形指數的統計平均值對紅細胞的變形性進行表征。分別對 3 組樣本(對照組、H2O2 實驗組、CaCl2 實驗組)進行紅細胞變形性檢測。圖 5 為分別從三組實驗結果中隨機選取的 5 幅紅細胞被捕獲后的圖像,細胞流動方向自上而下,如圖 5 右側所示,從圖 5 可以明顯看出 H2O2 和 CaCl2 溶液對紅細胞變形性的改變。
 圖5
三組紅細胞變形性檢測圖像
Figure5.
Deformability detection of three groups of erythrocytes
圖5
三組紅細胞變形性檢測圖像
Figure5.
Deformability detection of three groups of erythrocytes
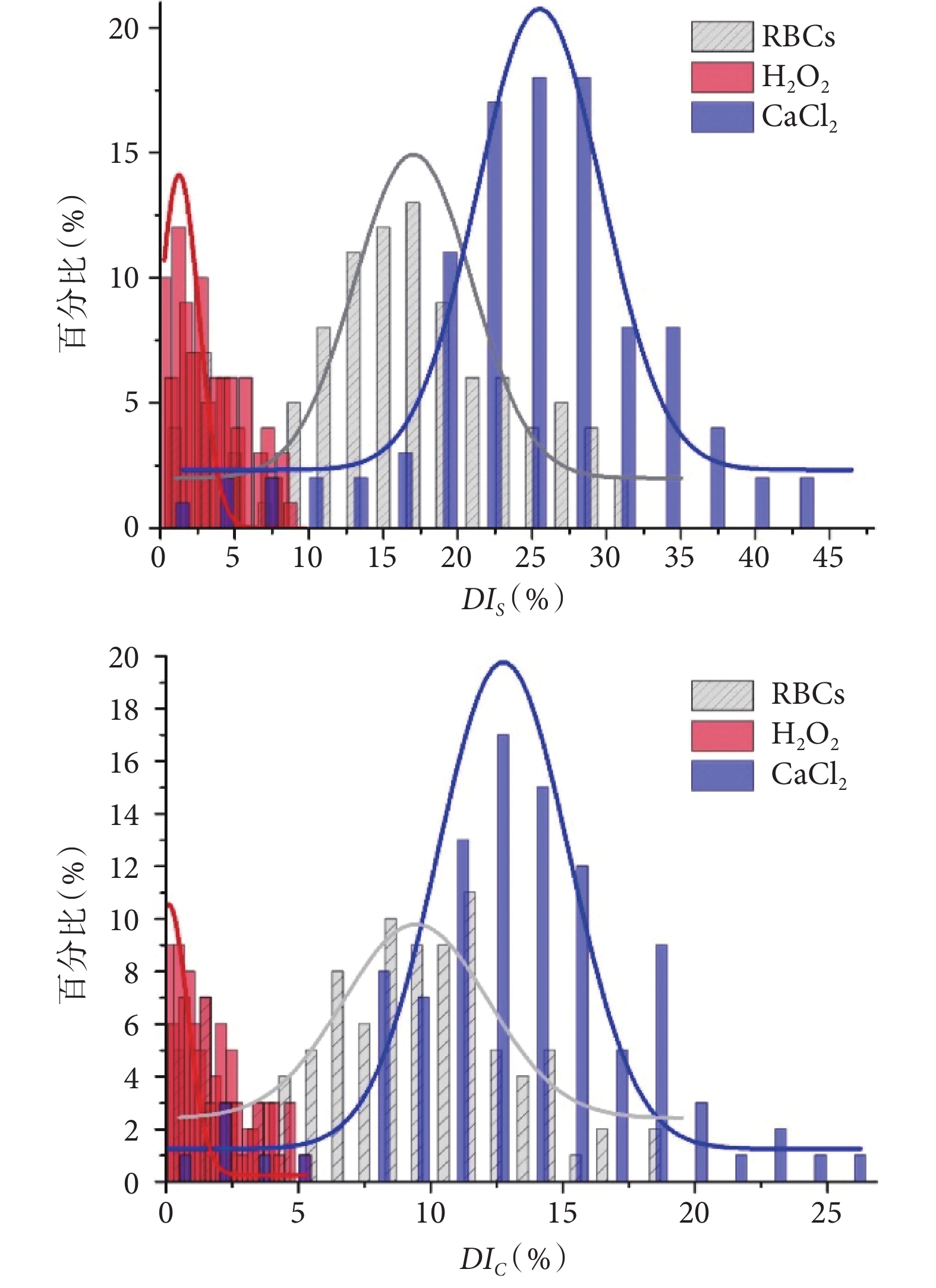
統計分析方面,分別從三組實驗結果中隨機挑選 100 個紅細胞,對其捕獲前后的面積、周長參數進行計算,得到變形指數。變形指數 DIS 和 DIC 的統計直方圖以及對應的輪廓擬合曲線如圖 6 所示。相較于正常對照組變形指數的分布區間,H2O2 溶液在減小紅細胞變形指數大小的同時,也減小了其分布范圍;相應的,CaCl2 溶液增大了紅細胞變形指數大小及其分布范圍。變形指數分布區間的改變進而導致了三組實驗結果的統計分布發生重疊的問題,這也體現出統計分析在紅細胞變形性分析中的必要性。考慮到統計直方圖的高斯分布特性,可近似利用 3σ 準則  (其中,
(其中, 為變形指數平均值,σ 為標準差)對三組實驗結果的統計分布進行表征,并利用
為變形指數平均值,σ 為標準差)對三組實驗結果的統計分布進行表征,并利用  對不同分布進行表征區分。
對不同分布進行表征區分。
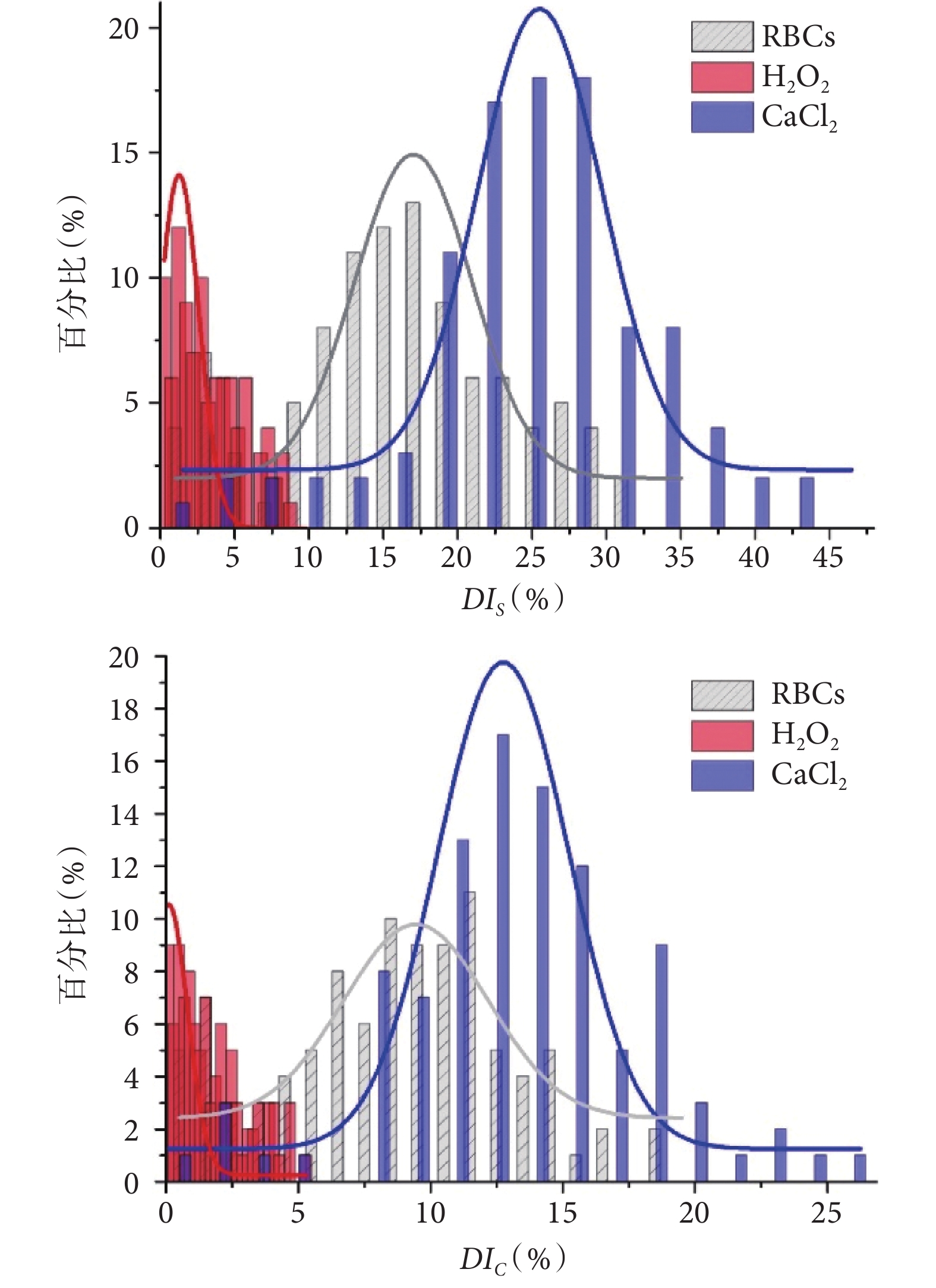 圖6
DIS、DIC 統計直方圖以及對應的輪廓擬合曲線圖
Figure6.
Statistical histogram of deformation index DIS and DIC respectively and the corresponding contour fitting curve
圖6
DIS、DIC 統計直方圖以及對應的輪廓擬合曲線圖
Figure6.
Statistical histogram of deformation index DIS and DIC respectively and the corresponding contour fitting curve
三組樣本實驗結果的  、
、 分別為:15.72%、8.84%(對照組),3.26%、1.68%(H2O2 實驗組)和 25.43%、13.49%(CaCl2 實驗組)。由此可知,
分別為:15.72%、8.84%(對照組),3.26%、1.68%(H2O2 實驗組)和 25.43%、13.49%(CaCl2 實驗組)。由此可知, 相比
相比  具有更好的差異性表征效果,僅限于本系統實驗條件以及樣品制備方法,可以實現
具有更好的差異性表征效果,僅限于本系統實驗條件以及樣品制備方法,可以實現  9.71% 的差異性有效識別,是此實驗中最小區分量的值。另一方面,系統檢測通量與紅細胞流速以及濃度相關,在既定實驗條件下(紅細胞流速恒定),本系統 8 通道結構的檢測通量約為 370 個細胞/min。
9.71% 的差異性有效識別,是此實驗中最小區分量的值。另一方面,系統檢測通量與紅細胞流速以及濃度相關,在既定實驗條件下(紅細胞流速恒定),本系統 8 通道結構的檢測通量約為 370 個細胞/min。
3 討論
雖然紅細胞的變形性測量方法有很多,但本文又提供了一個新的方法。該方法利用光鑷技術結合微流控芯片的方法進行研究,實現了在不損傷紅細胞本身結構的同時對紅細胞的變形性進行高通量的檢測。利用紅細胞捕獲前后的面積、周長變化,計算其變形指數來對紅細胞的變形性進行表征,并繪制統計直方圖,可以更直接地看出  相比
相比  表征結果的差異性,統計直方圖的分布區間產生重合,進一步驗證了采用統計量進行表征的重要性,用以提高測量的準確性。
表征結果的差異性,統計直方圖的分布區間產生重合,進一步驗證了采用統計量進行表征的重要性,用以提高測量的準確性。
在 CaCl2 和 H2O2 溶液改變紅細胞變形性的對比實驗中,紅細胞所產生的實驗結果與理論效果一致,表明該方法可以實現人血紅細胞變形性的高通量準確表征,也為其他種類細胞變形性的高通量研究提供了更大的可能。紅細胞變形性是體內微循環有效灌注的必要條件,在生物和醫學領域有著巨大的研究和應用前景,該方法也為進一步高通量地研究紅細胞變形性的微觀力學特征和全血流變學性質提供了新的思路。
4 結論
結合光鑷與微流控技術,利用流體粘滯阻力與光鑷系統光阱力的共同作用,實現了人血紅細胞的高通量拉伸變形,并利用圖像處理方法對變形前后的圖像特征進行分析,獲取變形指數,最后進行統計學分析以及變形性表征。搭建了實驗系統,以變形指數為指標對實驗效果進行評估,確定了系統的最優實驗條件;利用三組樣本對高通量檢測方法的可行性及有效性進行了驗證。實驗結果表明,變形指數平均值可以實現紅細胞變形性統計特征的表征,并且  比
比  具有更好的差異性表征效果,可以實現
具有更好的差異性表征效果,可以實現  9.71% 的差異性有效識別;以
9.71% 的差異性有效識別;以  為表征參量,可以實現不同變形特性樣本的準確區分(對照組 15.72%,H2O2 實驗組 3.26%,CaCl2 實驗組 25.43%)。僅限于本系統實驗條件以及樣品制備方法,檢測通量約為 370 個細胞/min。高通量檢測方法可以實現人血紅細胞變形性的高通量準確檢測及表征,在調整微流道結構及實驗條件后,也可為其他種類細胞變形性的高通量分析提供更大的可能。
為表征參量,可以實現不同變形特性樣本的準確區分(對照組 15.72%,H2O2 實驗組 3.26%,CaCl2 實驗組 25.43%)。僅限于本系統實驗條件以及樣品制備方法,檢測通量約為 370 個細胞/min。高通量檢測方法可以實現人血紅細胞變形性的高通量準確檢測及表征,在調整微流道結構及實驗條件后,也可為其他種類細胞變形性的高通量分析提供更大的可能。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
引言
紅細胞(red blood cells,RBCs)變形性是指紅細胞在外力作用下改變自身形狀的能力,是血液表觀黏度和體內微循環有效灌注的必要條件,同時也是紅細胞壽命的重要決定因素[1]。在理論上,紅細胞變形性的研究可以闡明宏觀流變現象機制的理論基礎,幫助研究一些病變的發病病理,還可評估細胞的生理狀況;在病理學上,紅細胞變形性的測量可以在細胞層次上探索組織液等生理環境的病理現象,也有助于研究細胞在病變或受到藥物刺激后表現出來的力學特性變化[2-3],對疾病的診斷與治療具有重要的應用價值。
目前,紅細胞變形性的常用檢測方法有微管法、微孔濾膜法、粘性測量法以及光鑷法[1]。微管法采用內徑小于紅細胞直徑的微吸管,測量在一定負壓條件下紅細胞被吸入管內的長度。該方法可以實現對單細胞變形性的研究,但這種方法技術復雜、測量費時、設備昂貴,不宜用于臨床檢查,因此限制了它的應用范圍。微孔濾膜法是利用濾膜、金屬篩等具有過濾作用的器具來測定紅細胞的變形性。它的裝置較為簡單,其最大優點是能在一定程度上模擬紅細胞通過微循環中毛細血管的過程,但是不能觀察細胞過孔全過程,所以使得某些結果在各個研究者的報告中存在較大的差異。粘性測量法是利用紅細胞懸浮液的表觀粘度隨剪切率的增高而降低的原理,從粘度上的差異來估測紅細胞變形性,在較高剪切率情況下,表觀粘度降低越明顯,紅細胞的變形能力越好。該方法操作簡便,并能一次測量紅細胞群體的平均變形性,適用于臨床觀察,但不能分辨或實測單個細胞或細胞亞群群體的變形情況,無法獲得物理測量和實際變形之間的定量關系。光鑷技術應用高斯光束匯聚的激光勢阱捕獲細胞,結合聲光偏轉器可對細胞施加光阱作用使細胞發生形變,有效避免了機械損傷,并且光鑷系統對光阱力的控制和測量可精確到皮牛頓量級[4-5],是非常理想的單細胞細胞力學測量工具,但是無法實現高通量檢測。
以往光鑷捕獲紅細胞測量其變形性的方法均為靜態研究[6],無法實現連續流下的細胞操縱。近年來,人們開始探索動態研究紅細胞變形性的方法,有研究者利用光鑷捕捉和操縱活體小鼠真皮下毛細血管內的紅細胞[7],拖動細胞使其到達指定位置,這種方法可以清除堵塞的微血管,但是活體中光阱剛度難以校準,不同組織、不同捕獲位置的光學剛度也不同,另外,在較深的位置會失去激光功率,捕獲力度顯著下降。目前,有多種基于光鑷增強的微流控芯片進行細胞分析的方法,光鑷捕獲細胞并拖動目標細胞使其發生形變,從而利用合適的指標對其變形性進行判別。該方法具有準確度高、非侵入等優點,但光鑷對細胞產生的操縱力往往處于皮牛量級,因而連續流下的細胞操縱要求細胞進樣流速非常低,從而限制了光鑷在高通量細胞操縱方面的應用。
針對以上問題,本文提出一種光鑷技術與微流控芯片結合的方法實現紅細胞變形性的高通量分析。利用流體粘滯阻力與光鑷系統光阱力的共同作用實現單分散紅細胞的捕獲及變形拉伸[8-11],同時利用圖像處理方法對紅細胞變形前后的特征進行分析,獲取變形指數(deformation index,DI)對細胞變形性能進行表征。最后,分別利用 CaCl2 和 H2O2 溶液改變紅細胞的變形性,并進行了對比實驗,以期實現人血紅細胞變形性的高通量準確表征,并為其他種類細胞的變形性高通量研究提供可能。
1 方法研究
光鑷是指當一束激光經過高數值孔徑的顯微物鏡匯聚在樣品表面時,由于光和物質之間動量傳遞引起的力學效應,在匯聚點形成的三維梯度勢阱[12]。利用光鑷系統可以實現對微小粒子的捕獲及操縱。微流控裝置的流動控制由壓力泵的輸入電壓和微型壓力閥控制,其流速需保證光阱力能夠捕獲流動的紅細胞,當微流道內的單分散紅細胞被光阱捕獲時,紅細胞同時受到光阱力和沿流動方向的流體粘滯阻力的共同作用,從而實現紅細胞的有效拉伸[13-16]。基于微流控芯片的紅細胞變形性光鑷檢測方法原理圖如圖 1a 所示。圖 1b 為實驗系統的 8 通道線陣微流道實物圖,該通道寬 11 μm,高 12 μm,可以更好地控制流體流速,增加流通量,起到分流減速的作用。
 圖1
系統原理圖
圖1
系統原理圖
a. 光鑷檢測方法原理圖;b. 8 通道線陣微流道實物圖;c. 細胞變形評價參數
Figure1. System diagrama. schematic diagram of optical tweezers detection; b. eight channel line array microchannel; c. evaluation parameters of cell deformation
1.1 紅細胞變形受力分析
人血紅細胞的半徑遠大于激光波長,可將入射光當做光線的合集,利用射線光學理論近似模型對光阱力進行分析[12, 17]。假設人血紅細胞的折射率是 n,光阱力可分解為散射力 Fs 和梯度力 Fg[18],近似表示為:
 |
其中,θ 為光線入射角,γ 為折射角,P 為激光在通過聚焦物鏡后的功率,c 為光在真空中的傳播速度,R 為 Fresnel 反射系數,T 為 Fresnel 透射系數。
另一方面,微流控芯片的微流道與人血紅細胞具有良好的尺寸適配性[18-20],可以減小單分散紅細胞在微流道內流動的位置偏差,有效提高光鑷系統的捕獲效率。當匯聚光束作用在 8 通道之一中的紅細胞上時,不影響其余通道中細胞的流動狀態,但是長直流道內液體流速為拋物線分布,所以 8 個通道的流速有一定的差異性,單個紅細胞被光鑷系統捕獲時,紅細胞受到的流體粘滯阻力[17]可表示為:
 '/> '/> |
其中,r 為紅細胞半徑,η 為流體粘滯系數,v 為流體流速。粘滯阻力方向為流體的流動方向。
在光阱力與流體粘滯阻力的共同作用下,紅細胞在遠離光阱中心的末端發生形變[13-14],如圖 1c 所示。當光阱作用于紅細胞使其短暫停止時,會引起后續流速的變化,但這并不影響后續的測量,當下一個紅細胞進入光阱時與當前紅細胞發生碰撞,使其脫離光阱范圍,流體粘滯阻力和光阱力會重新達到平衡的懸停狀態,進而實現同一光阱的連續檢測。
1.2 紅細胞變形性表征方法
為了實現紅細胞變形性的高通量檢測,利用 CMOS 相機對單細胞的流動、捕獲及脫離過程進行視頻采集。利用 MATLAB 對血細胞圖像進行分析:首先利用 3 × 3 中值濾波器對紅細胞圖像進行銳化,使其邊緣變得清晰,再利用高斯頻域濾波減小圖像噪聲,然后采用 Canny 邊緣檢測算子的方法對紅細胞進行邊緣檢測[21]。隨后采用閾值分割的方法對圖像邊緣進行提取,得到需要的細胞輪廓,再對其采用數學形態中的腐蝕、膨脹和填充的算法對二值圖像進行優化,最終得到能夠真實反映紅細胞輪廓的填充圖像。
在此基礎上,利用面積變形指數(DIS)和周長變形指數(DIC)對紅細胞的變形量進行表征。變形指數 DI 定義為:
 |
其中,S1、S2 分別表示紅細胞被捕獲前、后的面積,C1、C2 分別表示紅細胞被捕獲前、后的周長。圖 1c 為細胞變形評價參數。
2 實驗與結果分析
2.1 微流控芯片制備
通常 PDMS 微流控芯片制造分為四個過程完成:芯片設計,基片制作,基片與蓋片的鍵合,以及對芯片的密閉性進行檢測[22-23]。微流控芯片制造流程如圖 2 所示。PDMS 微流控通道利用常規軟光刻制作,首先通過 L-EDIT 軟件設計通道結構,并將結構特征寫入透明掩模,在 4 英寸拋光的硅晶片上旋涂負性光刻膠 SU-8 以制造 SU-8 模具。將制作好的模具進行超聲清洗去除表面雜質,再放入真空干燥器中烘干,將質量比為 10∶1 的 PDMS 和固化劑的混合物倒在 SU-8 模具上,放入抽真空機進行排氣,按規定的時間(30 min)和溫度(90℃)在固化板上進行烘烤固化,然后將 PDMS 復制品從母模上剝離并進行打孔、鍵合。我們所用的蓋片為普通的蓋玻片,鍵合前先將蓋玻片放入干燥劑中進行烘干(200℃,2 h),利用氧等離子體鍵合原理,對 PDMS 和蓋玻片表面進行氧化處理并完成粘合。制造完成后通常需要對芯片密閉性進行檢測,以確保所制得的芯片能夠在相應的實驗中進行應用。
 圖2
微流控芯片制造流程
Figure2.
Microfluidic chip manufacturing process
圖2
微流控芯片制造流程
Figure2.
Microfluidic chip manufacturing process
2.2 實驗系統搭建與樣品液制備
基于以上理論分析,搭建了人血紅細胞變形性高通量檢測方法驗證系統。光鑷系統為德國 Aresis 公司的 Tweez250si(5 W,1 064 nm 近紅外激光器,2 048 × 2 048 單色 CMOS,單像素尺寸 5.5 μm),配套軟件為 TWEEZ;微流控芯片內包含 8 個微流道,每個微流道高 12 μm、寬 11 μm;利用微型氣泵(SC3101PM,3.0 V,0.28 L/min)及精密調壓閥(IR1010-01-A,SMC)實現微流道內紅細胞流速的控制。實驗所用人血紅細胞(濃度 6%,阿氏液保存)購自華潤生物(中國上海)有限公司。
為了驗證本文高通量檢測方法對紅細胞變形差異的檢測有效性,分別利用 CaCl2(增大紅細胞變形量)和 H2O2(減小紅細胞變形量)溶液改變紅細胞的變形特性[24-25],對三種血紅細胞樣本進行制備:對照組(正常人血紅細胞)、H2O2 實驗組以及 CaCl2 實驗組。對照組:取 500 μL 紅細胞,利用離心法(1 200 r/min,5 min)重復清洗紅細胞三次后,加入 2 mL 磷酸鹽緩沖液(PBS,pH7.4);H2O2 實驗組:取 500 μL 紅細胞,三次離心清洗后加入 1 mL 濃度為 400 μmol/L 的 H2O2 溶液,反應完成后離心紅細胞加入 2 mL PBS;CaCl2 實驗組:取 500 μL 紅細胞,三次離心清洗后加入 1 mL 濃度為 500 μmol/L 的 CaCl2 溶液,反應 20 min 后離心紅細胞加入 2 mL PBS。三組樣本中分別加入 100 μL 濃度為 1% 的牛血清白蛋白溶液(BSA),防止細胞粘附。
2.3 最優實驗條件選取
由紅細胞的受力分析可知,紅細胞的變形量與光鑷功率以及流體流速直接相關。高功率條件下可以得到更大的光阱力[17],同時也會增大紅細胞的損傷概率;高驅動壓力可以產生大的粘滯阻力并且提高檢測通量,但是高流速會導致紅細胞捕獲效率降低的問題。所以,需要對不同光鑷功率和驅動壓力條件下的實驗效果進行分析,確定本系統的最優實驗條件。
大量實驗結果表明,當光鑷功率超過 200 mW 時微流控芯片會產生灼燒現象,所以本實驗的光鑷功率上限設置為 200 mW。通過調節微型氣泵的供電電壓可以實現流體驅動壓力的控制,為了實現紅細胞流速恒定,通常所記錄的視頻是在數值不變時記錄、測量。分別設置氣泵供電電壓為 1.5 V 和 3.0 V,光鑷功率 100 mW 和 200 mW,在 4 種組合實驗條件下對正常人血紅細胞的變形性進行檢測。實驗過程中發現當氣泵供電電壓設為 3.0 V、光鑷功率為 100 mW 時,無法實現紅細胞的有效捕獲。所以,只對其他 3 種實驗條件的結果進行了分析,圖 3 為不同實驗條件下紅細胞被捕獲后的變形圖像,細胞流動方向一致,即自上而下,如圖右側所示。每種實驗條件下隨機選取 10 組紅細胞圖像,計算其捕獲前后的面積及周長如表 1 所示。
 圖3
不同條件下的紅細胞被捕獲圖像
Figure3.
Red blood cells captured under different conditions
圖3
不同條件下的紅細胞被捕獲圖像
Figure3.
Red blood cells captured under different conditions
為了直觀對比不同實驗條件下紅細胞變形的差異性,分別對變形指數 DIC 和 DIS 進行了計算,如圖 4 所示。由圖 4 可知,3 種實驗條件下均可以實現單分散紅細胞的有效捕獲,當光鑷功率設定為上限值 200 mW 時,紅細胞的變形指數隨著流體粘滯阻力的增加而增大。微型氣泵供電電壓增加至 3.0 V 時,可以在保證紅細胞被有效捕獲的前提下,得到最大的形變量。
 圖4
不同條件下的紅細胞變形指數
Figure4.
Erythrocyte deformation index under different conditions
圖4
不同條件下的紅細胞變形指數
Figure4.
Erythrocyte deformation index under different conditions
另外,由于紅細胞個體固有特性的差異,相同實驗條件下的變形量會存在一定的偏差。以圖 4 中的 10 組實驗結果為例,不同實驗條件下 DIS、DIC 最大值與最小值的差值分別為 3.50%、1.68%(電壓 1.5 V,功率 100 mW),3.85%、2.88%(電壓 1.5 V,功率 200 mW)和 8.97%、9.82%(電壓 3.0 V,功率 200 mW)。由以上分析可知,電壓為 3.0 V、功率為 200 mW 條件下可以實現紅細胞的有效變形分析以及細胞個體變形差異性的分析,可作為后續實驗條件。
2.4 對比實驗與統計分析
為了避免血紅細胞變形的個體差異性對實驗表征結果準確性的影響,需要對大量樣本的實驗結果進行分析,并利用變形指數的統計平均值對紅細胞的變形性進行表征。分別對 3 組樣本(對照組、H2O2 實驗組、CaCl2 實驗組)進行紅細胞變形性檢測。圖 5 為分別從三組實驗結果中隨機選取的 5 幅紅細胞被捕獲后的圖像,細胞流動方向自上而下,如圖 5 右側所示,從圖 5 可以明顯看出 H2O2 和 CaCl2 溶液對紅細胞變形性的改變。
 圖5
三組紅細胞變形性檢測圖像
Figure5.
Deformability detection of three groups of erythrocytes
圖5
三組紅細胞變形性檢測圖像
Figure5.
Deformability detection of three groups of erythrocytes
統計分析方面,分別從三組實驗結果中隨機挑選 100 個紅細胞,對其捕獲前后的面積、周長參數進行計算,得到變形指數。變形指數 DIS 和 DIC 的統計直方圖以及對應的輪廓擬合曲線如圖 6 所示。相較于正常對照組變形指數的分布區間,H2O2 溶液在減小紅細胞變形指數大小的同時,也減小了其分布范圍;相應的,CaCl2 溶液增大了紅細胞變形指數大小及其分布范圍。變形指數分布區間的改變進而導致了三組實驗結果的統計分布發生重疊的問題,這也體現出統計分析在紅細胞變形性分析中的必要性。考慮到統計直方圖的高斯分布特性,可近似利用 3σ 準則  (其中,
(其中, 為變形指數平均值,σ 為標準差)對三組實驗結果的統計分布進行表征,并利用
為變形指數平均值,σ 為標準差)對三組實驗結果的統計分布進行表征,并利用  對不同分布進行表征區分。
對不同分布進行表征區分。
 圖6
DIS、DIC 統計直方圖以及對應的輪廓擬合曲線圖
Figure6.
Statistical histogram of deformation index DIS and DIC respectively and the corresponding contour fitting curve
圖6
DIS、DIC 統計直方圖以及對應的輪廓擬合曲線圖
Figure6.
Statistical histogram of deformation index DIS and DIC respectively and the corresponding contour fitting curve
三組樣本實驗結果的  、
、 分別為:15.72%、8.84%(對照組),3.26%、1.68%(H2O2 實驗組)和 25.43%、13.49%(CaCl2 實驗組)。由此可知,
分別為:15.72%、8.84%(對照組),3.26%、1.68%(H2O2 實驗組)和 25.43%、13.49%(CaCl2 實驗組)。由此可知, 相比
相比  具有更好的差異性表征效果,僅限于本系統實驗條件以及樣品制備方法,可以實現
具有更好的差異性表征效果,僅限于本系統實驗條件以及樣品制備方法,可以實現  9.71% 的差異性有效識別,是此實驗中最小區分量的值。另一方面,系統檢測通量與紅細胞流速以及濃度相關,在既定實驗條件下(紅細胞流速恒定),本系統 8 通道結構的檢測通量約為 370 個細胞/min。
9.71% 的差異性有效識別,是此實驗中最小區分量的值。另一方面,系統檢測通量與紅細胞流速以及濃度相關,在既定實驗條件下(紅細胞流速恒定),本系統 8 通道結構的檢測通量約為 370 個細胞/min。
3 討論
雖然紅細胞的變形性測量方法有很多,但本文又提供了一個新的方法。該方法利用光鑷技術結合微流控芯片的方法進行研究,實現了在不損傷紅細胞本身結構的同時對紅細胞的變形性進行高通量的檢測。利用紅細胞捕獲前后的面積、周長變化,計算其變形指數來對紅細胞的變形性進行表征,并繪制統計直方圖,可以更直接地看出  相比
相比  表征結果的差異性,統計直方圖的分布區間產生重合,進一步驗證了采用統計量進行表征的重要性,用以提高測量的準確性。
表征結果的差異性,統計直方圖的分布區間產生重合,進一步驗證了采用統計量進行表征的重要性,用以提高測量的準確性。
在 CaCl2 和 H2O2 溶液改變紅細胞變形性的對比實驗中,紅細胞所產生的實驗結果與理論效果一致,表明該方法可以實現人血紅細胞變形性的高通量準確表征,也為其他種類細胞變形性的高通量研究提供了更大的可能。紅細胞變形性是體內微循環有效灌注的必要條件,在生物和醫學領域有著巨大的研究和應用前景,該方法也為進一步高通量地研究紅細胞變形性的微觀力學特征和全血流變學性質提供了新的思路。
4 結論
結合光鑷與微流控技術,利用流體粘滯阻力與光鑷系統光阱力的共同作用,實現了人血紅細胞的高通量拉伸變形,并利用圖像處理方法對變形前后的圖像特征進行分析,獲取變形指數,最后進行統計學分析以及變形性表征。搭建了實驗系統,以變形指數為指標對實驗效果進行評估,確定了系統的最優實驗條件;利用三組樣本對高通量檢測方法的可行性及有效性進行了驗證。實驗結果表明,變形指數平均值可以實現紅細胞變形性統計特征的表征,并且  比
比  具有更好的差異性表征效果,可以實現
具有更好的差異性表征效果,可以實現  9.71% 的差異性有效識別;以
9.71% 的差異性有效識別;以  為表征參量,可以實現不同變形特性樣本的準確區分(對照組 15.72%,H2O2 實驗組 3.26%,CaCl2 實驗組 25.43%)。僅限于本系統實驗條件以及樣品制備方法,檢測通量約為 370 個細胞/min。高通量檢測方法可以實現人血紅細胞變形性的高通量準確檢測及表征,在調整微流道結構及實驗條件后,也可為其他種類細胞變形性的高通量分析提供更大的可能。
為表征參量,可以實現不同變形特性樣本的準確區分(對照組 15.72%,H2O2 實驗組 3.26%,CaCl2 實驗組 25.43%)。僅限于本系統實驗條件以及樣品制備方法,檢測通量約為 370 個細胞/min。高通量檢測方法可以實現人血紅細胞變形性的高通量準確檢測及表征,在調整微流道結構及實驗條件后,也可為其他種類細胞變形性的高通量分析提供更大的可能。
利益沖突聲明:本文全體作者均聲明不存在利益沖突。