外加直流電場刺激(EFS)可抑制脊髓損傷(SCI)后損傷組織局部Ca2+內流,有效抑制脊髓繼發性損傷的發生。但電場刺激結束后,損傷局部Ca2+會重新開始內流并激發后續病理生理學連鎖反應,影響了EFS治療SCI的效果。聚乙二醇(PEG)是一種親水性的高分子材料,具有促進細胞膜融合及受損細胞膜修復的作用。本文旨在研究EFS聯合PEG治療Sprague-Dawley(SD)大鼠SCI的效果。脊髓損傷后的SD大鼠被隨機分為對照組(無治療,n = 10)、電場組(EFS治療30 min,n = 10)、PEG組(浸潤50% PEG的明膠海綿覆蓋損傷處5 min,n = 10)和聯合組(電場刺激和PEG聯合治療,n = 10)。術后不同時間進行運動誘發電位(MEP)測量、運動行為學評分以及脊髓切片染色分析。研究結果表明,術后8周聯合組大鼠MEP潛伏期差和波幅差以及脊髓空洞面積比均顯著低于對照組、電場組和PEG組,而運動功能評分和脊髓神經組織殘余面積比均顯著高于對照組、電場組和PEG組。以上結果提示,聯合治療方法能減輕大鼠脊髓損傷后的病理損傷程度,促進大鼠電生理及運動功能的恢復,其療效優于EFS和PEG單獨使用時的效果。
引用本文: 張丞, 王靄華, 張廣浩, 吳昌哲, 容威, 霍小林. 電場刺激聯合聚乙二醇治療大鼠脊髓損傷的實驗研究. 生物醫學工程學雜志, 2022, 39(1): 10-18. doi: 10.7507/1001-5515.202011035 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
脊髓損傷(spinal cord injury,SCI)是脊髓遭受創傷后主要功能(感覺、運動、反射等)出現障礙的臨床常見病。SCI后的主要神經病變包括原發性損傷和繼發性損傷,原發性損傷是指創傷對脊髓本身產生的初次損傷,繼發性損傷是指原發性損傷后生物反應級聯反應所導致的一系列病理生理學變化,主要包括細胞凋亡、炎性反應等,其產生的危害遠超過原發性損傷[1]。研究表明脊髓損傷后損傷局部組織Ca2+ 的大量內流是繼發性損傷發生的主要誘因[2],也是各種細胞死亡方式的最后共同通路[3]。因此,治療SCI時應足夠重視Ca2+的調控,在脊髓損傷早期及時阻止損傷局部組織Ca2+的大量內流,抑制脊髓繼發性損傷的發生[4]。
研究表明Ca2+的流動可受到外加直流電場(electric field stimulation,EFS)的調節[5]。Strautman等[6]在正常組織處放置陰極,在損傷處放置陽極,在損傷局部形成反向電場,有效地抑制了細胞外Ca2+流入細胞內。細胞外Ca2+的大量內流在宏觀上表現為損傷電位(injury potential)的形成,即在損傷組織與正常組織之間形成的電位差[7]。我們[8-10]前期證實EFS早期調控的方法可以有效降低損傷電位,降低細胞凋亡程度,減輕脊髓繼發性損傷,促進脊髓功能的修復。但實驗中我們[9-10]發現,電場刺激停止后Ca2+恢復向細胞內流動,形成幅值較小的新的損傷電位,提示電場刺激的治療方法只能適時延長治療的時間窗口,無法從根本上抑制損傷局部Ca2+內流和繼發性損傷的發生。
聚乙二醇(polyethylene glycol,PEG)是一種無毒的乙二醇高聚物,能脫去細胞膜表面的結合水,使細胞膜上的蛋白質和磷脂分子發生疏散和重排,使損傷處兩側的磷脂雙分子層相互融合,從而消除細胞膜上的缺口達到修復受損細胞膜的目的[11-12]。近年來,PEG的膜修復特性被逐漸應用于SCI修復的研究中。Shi等[13-14]發現,用PEG處理脊髓損傷處可使部分斷裂的軸突在結構上重新建立連接,促進軸突傳導功能的恢復。Borgens等[15]在豚鼠脊髓擠壓損傷7 h后,通過局部給藥的方式用PEG處理損傷處,發現PEG能明顯改善豚鼠的表層軀干肌反射功能和神經傳導功能。然而研究者們發現,PEG的修復作用存在滯后性,施加后5 min才能發揮作用[16]。但在SCI后,細胞外的Ca2+ 濃度會在幾分鐘之內從正常水平(1.0~1.3 mmol/L)迅速下降至低濃度水平(< 0.1 mmol/L)[17-18],當細胞外Ca2+濃度低于0.5 mmol/L時,細胞膜的修復將受到抑制[19-20]。
因此,本文提出在SCI的早期治療中將EFS和PEG聯合使用,EFS發揮Ca2+調控功能并提供修復時間窗口,PEG發揮細胞膜修復功能并形成物理屏障,從而最大限度地抑制Ca2+內流,促進損傷脊髓功能的修復。本文擬通過損傷電位檢測、運動誘發電位分析、行為學評分和脊髓形態學觀察,評價聯合離子調控方法對大鼠脊髓損傷的治療效果。
1 實驗方法
1.1 實驗動物
本實驗所用動物為清潔級成年雌性Sprague-Dawley(SD)大鼠[SCXK(京)2020-0004],體重220~250 g,購自北京華阜康生物科技股份有限公司。動物的飼養及實驗過程依照《北京市實驗動物管理條例》相關規定進行,經北京清華長庚醫院動物倫理委員會批準通過。
1.2 大鼠脊髓損傷模型的制備
SD大鼠用2%戊巴比妥鈉腹腔注射麻醉,手術暴露T8至T12節段的脊柱,移除T8、T10及T12三個節段椎板,并暴露相應節段脊髓組織。將大鼠置于脊髓打擊器的底座上,將重10 g的砝碼從玻璃套管50 mm刻度處自由垂直落下,擊打T10節段的脊髓組織。受損脊髓局部出現充血和腫脹,大鼠尾巴痙攣性擺動,雙后肢出現回縮式撲動,說明大鼠SCI模型制作成功[21]。
1.3 動物分組及干預方法
脊髓損傷后的大鼠隨機分為4組:① 對照組(n = 10):損傷后無治療;② PEG組(n = 10):損傷后采用浸有50% PEG的明膠海綿覆蓋在損傷局部5 min;③ 電場組(n = 10):損傷后立即用EFS干預30 min;④ 聯合組(n = 10):電場干預期間同時將浸有50% PEG的明膠海綿覆蓋在損傷局部5 min,5 min后取走明膠海綿,電場刺激繼續至30 min結束。
PEG的施加方式:① 無菌明膠海綿裁剪:將吸收性明膠海綿(江西省祥恩醫療科技發展有限公司,60 mm × 20 mm × 5 mm)按長10 mm、寬5 mm、厚2.5 mm的大小進行裁剪。② PEG明膠海綿制作:稱取50 mg PEG-2000粉末(Sigma-Aldrich,美國)溶解于100 mL Krebs溶液中。將裁剪好的明膠海綿放置在配制好的PEG溶液中,4 ℃浸泡24 h后使用。③ 明膠海綿的覆蓋:用浸有50% PEG的明膠海綿覆蓋在損傷局部5 min,5 min后取走明膠海綿。
EFS的施加方式:電場刺激器的結構詳見本實驗室前期文章[10],每個刺激器由一個陽極和兩個陰極組成,每只大鼠使用兩個刺激器進行刺激。在脊髓損傷之前,將兩個刺激器的兩個陽極分別縫合在T10兩側的椎旁肌上,一個刺激器的兩個陰極被縫合在T8兩側的椎旁肌上,另一個刺激器的兩個陰極縫合在T12兩側的椎旁肌上(見圖1),電極縫合后進行脊髓損傷處理。脊髓損傷后即刻打開刺激器的開關,調節刺激電壓使頭側和尾側損傷電位均變為(0 ± 0.5)mV,外加直流電場共干預30 min。在電場刺激期間,刺激電壓根據損傷電位每10 min評估一次,根據需要進行調整。刺激完成后,手術取走刺激電極。
 圖1
電場刺激示意圖
Figure1.
Schematic diagram of electric field stimulation
圖1
電場刺激示意圖
Figure1.
Schematic diagram of electric field stimulation
1.4 脊髓損傷電位的測量
脊髓損傷電位是指脊髓無損傷部分與損傷部分之間所產生的電位差,主要是由脊髓損傷處Ca2+ 內流形成。大鼠損傷后立即用雙鹽橋電極測量損傷電位,雙鹽橋電極的結構以及測量方法在本實驗室前期的文章中有詳細介紹[10]。測量損傷電位時將與萬用表負輸入端相連的電極頭輕置于T10段脊髓上,另一個與萬用表正輸入端相接的電極頭輕置于T8或T12段脊髓上,萬用表上的讀數即為頭側損傷電位或尾側損傷電位。損傷電位測量完畢,傷口消毒后逐層縫合。術后所有動物每天注射青霉素鈉,定時換水添食,保持墊料干燥,定時人工排尿。
1.5 運動誘發電位的測量
分別于脊髓損傷前、損傷后30 min及損傷后8周測量大鼠運動誘發電位(motor evoked potential,MEP)。刺激電極陽極置于大鼠脊髓損傷區頭側的T8或尾側的T12脊髓上,陰極位于陽極的尾側,刺激信號脈寬200 μs,頻率1 Hz,刺激強度3 V。兩對記錄電極分別插入左右側后肢的腓腸肌肌腹,負極位于正極尾側,參考電極插入正負記錄電極之間。用電生理記錄儀檢測MEP信號,使用損傷區頭側、尾側的MEP波幅差和潛伏期差評價損傷脊髓的傳導功能恢復情況,差值越小說明恢復效果越好[22]。
1.6 運動功能評分
于術后1天、3天及之后的每周進行運動功能BBB評分(Basso, Beattie & Bresnahan locomotor rating scale),直至8周后實驗結束。評分過程中,將大鼠置于封閉的寬敞區域使其爬行,觀察者根據大鼠的臀、膝、踝關節行走,軀干運動及協調情況確定兩側后肢BBB評分,取平均值作為各組大鼠最終的運動功能評分[23]。實驗過程中,采用2名對實驗不知情的觀察者進行數據的采集與分析。
1.7 脊髓殘存的神經組織面積快藍染色
術后8周,取同齡正常大鼠2只,過量麻醉藥處死正常大鼠和各組大鼠,經心臟灌流后取出脊髓組織進行冰凍組織切片。每組10只大鼠,5只大鼠行連續脊髓橫切片,5只大鼠行連續脊髓縱切片。兩只正常大鼠取同節段脊髓,1只行連續脊髓橫切片,1只行連續脊髓縱切片。切片厚度均為20 μm,切片間隔均為500 μm。顯微鏡下觀察各組切片中殘存面積最少的設定為損傷中心,行神經組織面積快藍染色(Luxol fast blue staining,LFB)[24],顯微鏡下觀察并采集圖像,Image J定量分析縱切片脊髓空洞面積(LFB未著色部位)和橫切片脊髓殘存面積(LFB著色部位),并計算縱切片脊髓空洞面積比(脊髓空洞面積/脊髓平面面積)以及橫切片脊髓殘存面積比(脊髓殘存面積/脊髓平面面積)。
1.8 統計分析
所有數據均用SPSS 20.0軟件進行統計分析。所有數據表示為平均值±標準差。采用單因素方差分析比較各組大鼠脊髓組織縱切片組織空洞面積比及橫切片脊髓殘存組織面積比,組間兩兩比較采用Bonferroni事后檢驗。采用雙因素重復測量方差分析比較損傷電位的檢測結果、MEP潛伏期差和波幅差的差異以及BBB評分差異,組間兩兩比較采用Bonferroni事后檢驗。所有的統計分析中,檢驗水準均為0.05。
2 實驗結果
2.1 損傷電位的檢測結果
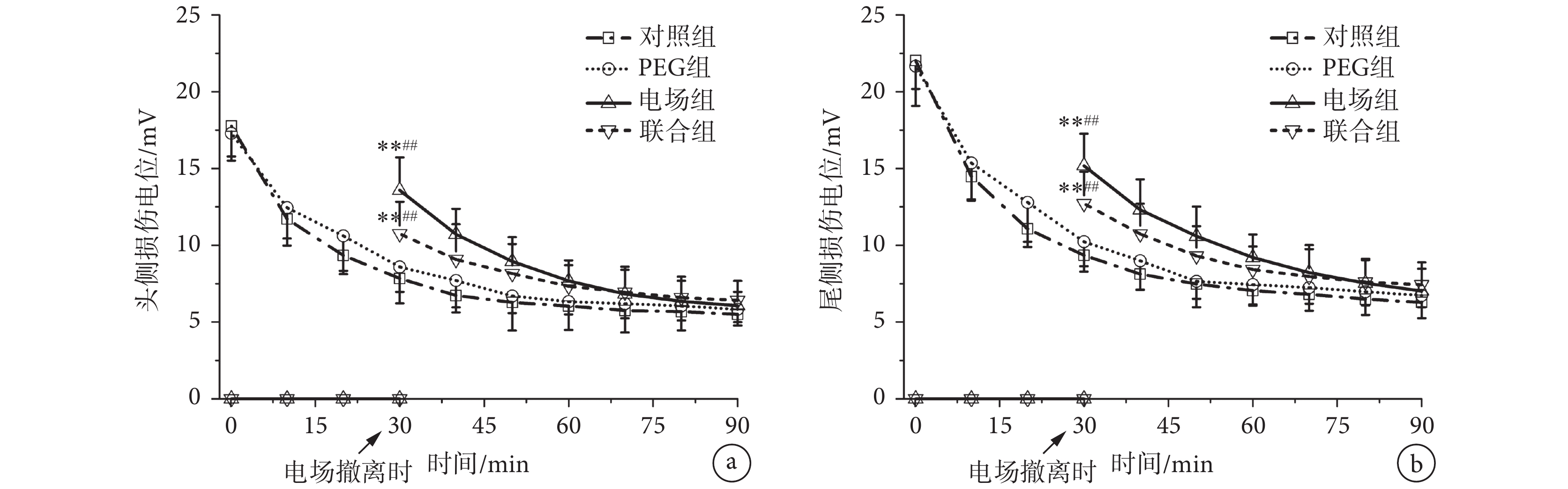
聯合組、電場組、PEG組和對照組的損傷電位測量結果如圖2所示。對照組和PEG組的頭、尾側損傷電位隨時間逐漸減小;電場組和聯合組在電場施加期間,頭、尾側損傷電位均為0 mV左右。電場撤離后,電場組和聯合組大鼠頭、尾側損傷電位重新形成,新生成的頭、尾側損傷電位低于對照組和PEG組頭、尾側損傷電位的初始值,之后隨時間逐漸減小。
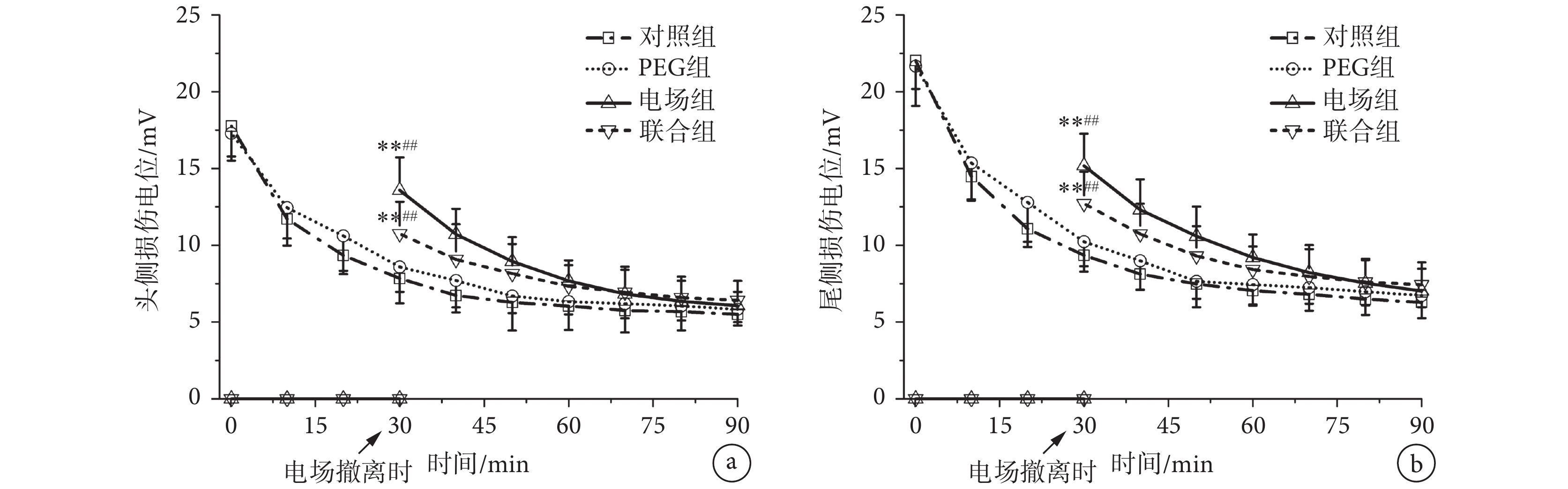 圖2
聯合組與其他組別損傷電位對比
圖2
聯合組與其他組別損傷電位對比
a. 各組大鼠頭側損傷電位;b. 各組大鼠尾側損傷電位。**
a. rostral injury potentials of four groups; b. caudal injury potentials of four groups. **
雙因素重復測量方差分析的結果表明,組別因素(F(3, 27) =104.57,n = 10,P < 0.01)和時間因素(F(3, 27) = 85.26,n = 10,P < 0.01)對損傷電位的變化均有顯著影響,說明各組損傷電位隨時間變化而發生顯著變化。
組間比較發現,在損傷后30 min,聯合組的頭側損傷電位顯著低于對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)頭側損傷電位的初始值,電場組的頭側損傷電位顯著低于對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)頭側損傷電位的初始值。尾側損傷電位的比較結果與頭側損傷電位的結果類似。
2.2 運動誘發電位的檢測結果
重復測量雙因素方差分析顯示,組別因素(F(3, 27) = 124.29,n = 10,P < 0.01)和時間因素(F(3, 27) = 105.48,n = 10,P < 0.01)對MEP的波幅差均有顯著影響,說明各組MEP波幅差隨時間變化而發生顯著變化。
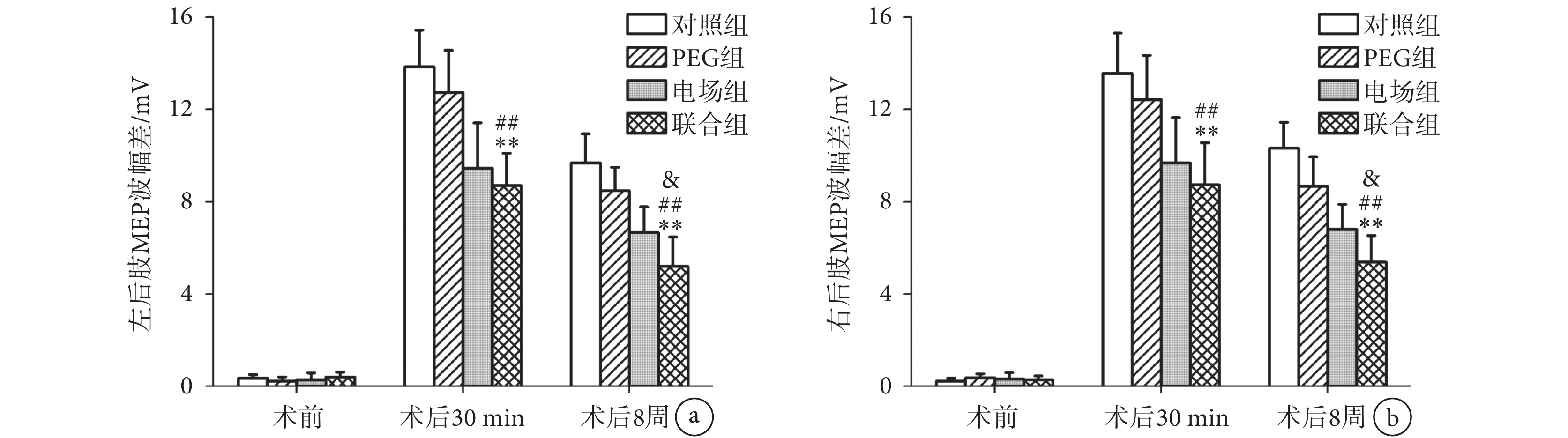
組間比較發現,如圖3所示,脊髓損傷前,所有大鼠的雙后肢MEP波幅差的差異無統計學意義(n = 10,P > 0.05)。術后30 min,聯合組的雙后肢波幅差與對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)相比顯著降低,但與電場組相比差異無統計學意義(n = 10,P > 0.05)。在術后8周時,聯合組的雙后肢MEP波幅差較對照組(n = 10,P < 0.01)、PEG組(n = 10,P < 0.01)和電場組(n = 10,P < 0.05)均顯著降低。
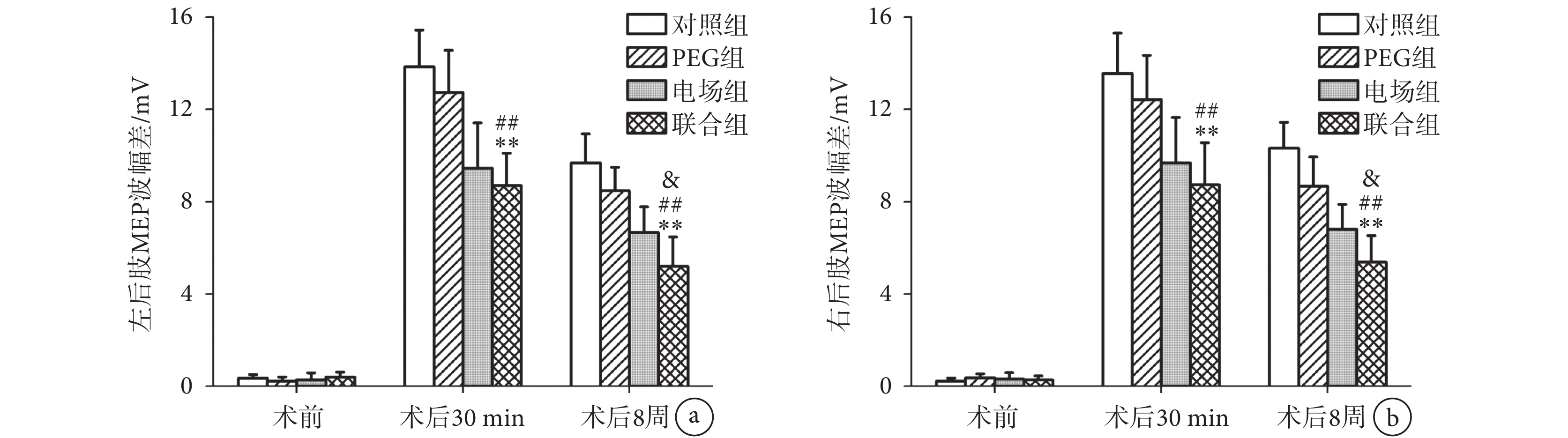 圖3
聯合組與其他組別MEP波幅差對比
圖3
聯合組與其他組別MEP波幅差對比
a. 各組大鼠左后肢MEP波幅差;b. 各組大鼠右后肢MEP波幅差。**
a. MEP amplitude differences of left hind limbs of four groups; b. MEP amplitude differences of right hind limbs of four groups. **
重復測量雙因素方差分析提示,組別(F(3, 27) = 131.32,n = 10,P < 0.01)和時間因素(F(3, 27) = 118.33,n = 10,P < 0.01)對MEP潛伏期差有顯著影響,說明各組MEP潛伏期差隨時間變化而發生顯著變化。
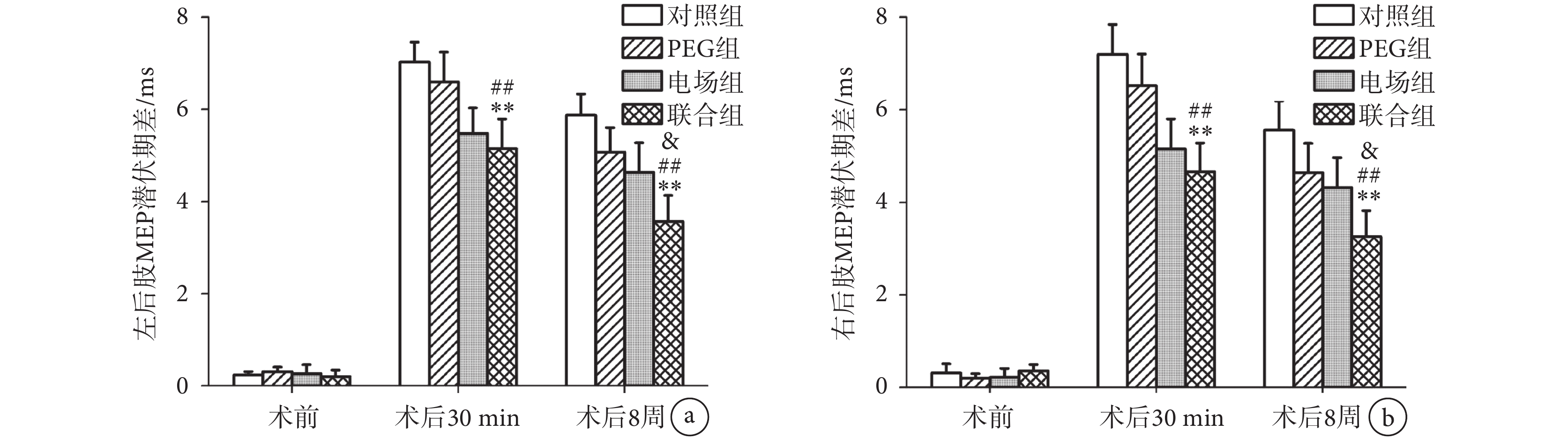
MEP潛伏期差的結果和MEP波幅差的結果相似,見圖4。脊髓損傷前,所有大鼠雙后肢MEP潛伏期差的差異無統計學意義(n = 10,P > 0.05)。術后30 min,聯合組的雙后肢潛伏期差較對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)顯著降低,但與電場組相比差異無統計學意義(n = 10,P > 0.05)。術后8周,聯合組雙后肢MEP潛伏期差顯著低于對照組(n = 10,P < 0.01)、PEG組(n = 10,P < 0.01)和電場組(n = 10,P < 0.05)。
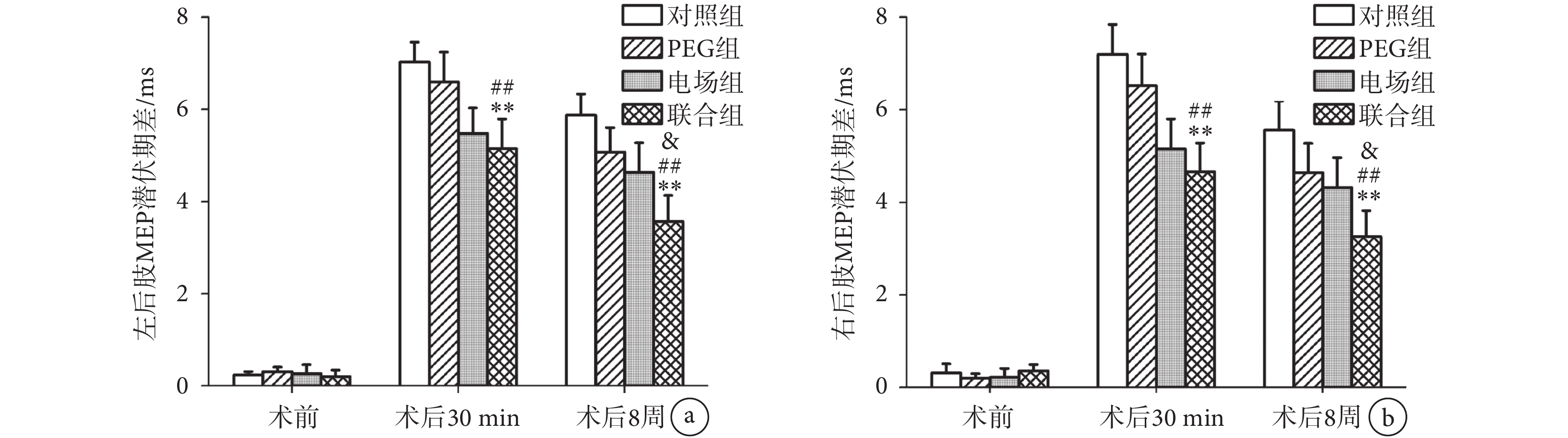 圖4
聯合組與其他組別MEP潛伏期差對比
圖4
聯合組與其他組別MEP潛伏期差對比
a. 各組大鼠左后肢MEP潛伏期差;b. 各組大鼠右后肢MEP潛伏期差。**
a. MEP latency differences of left hind limbs of four groups; b. MEP latency differences of right hind limbs of four groups. **
2.3 大鼠運動功能BBB評分
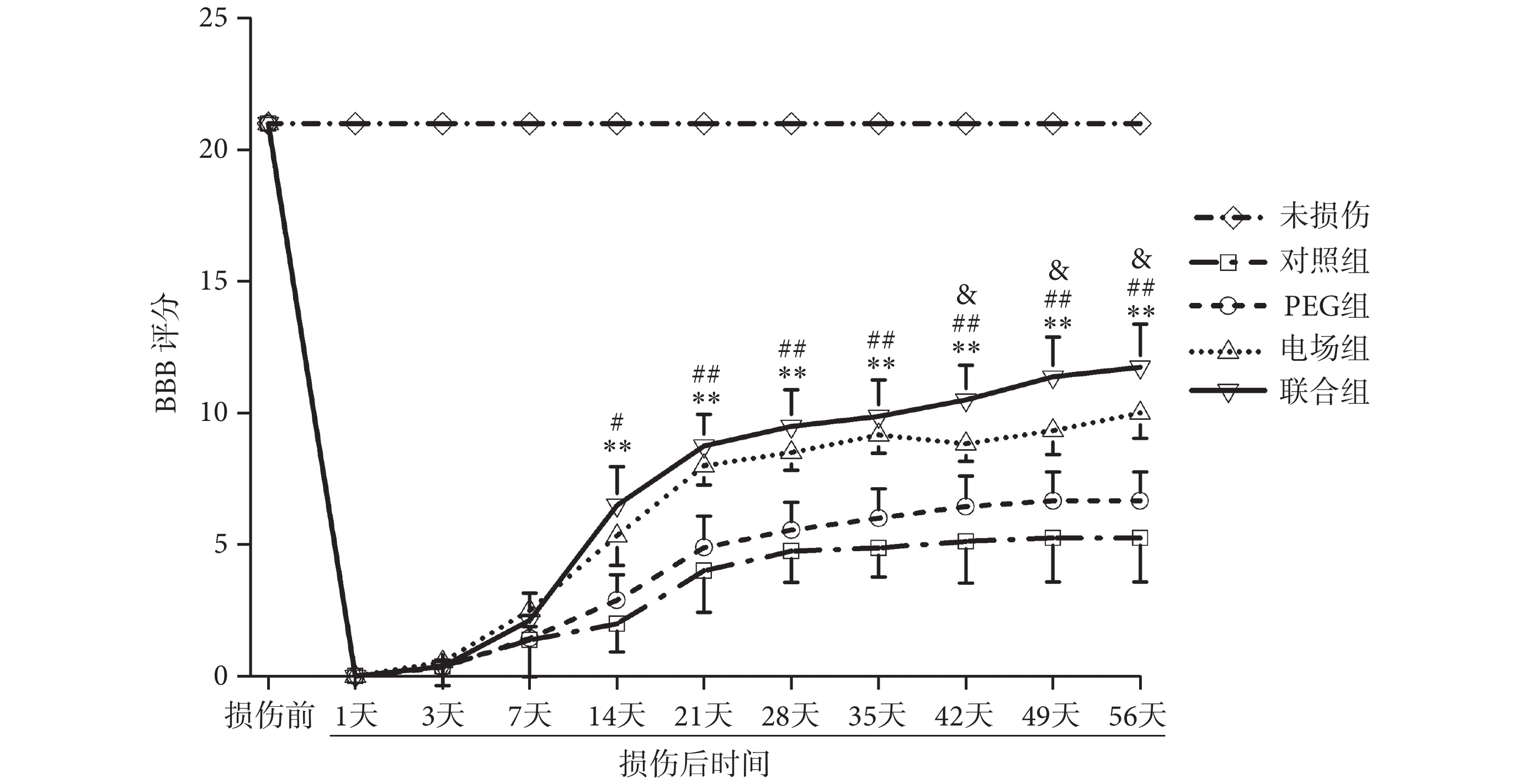
如圖5所示,脊髓損傷前所有大鼠的BBB評分均為21分,和正常大鼠評分無明顯差異。脊髓損傷后各組大鼠均出現明顯的功能障礙,之后各組大鼠運動功能均有不同程度的改善。雙因素重復測量方差分析顯示,組別(F(3, 27) = 84.56,n = 10,P < 0.01)和時間因素(F(3, 27) = 95.67,n = 10,P < 0.01)對大鼠BBB評分有顯著影響,各組大鼠間BBB評分的差異有統計學意義,且各組大鼠BBB評分隨時間變化而發生顯著變化。
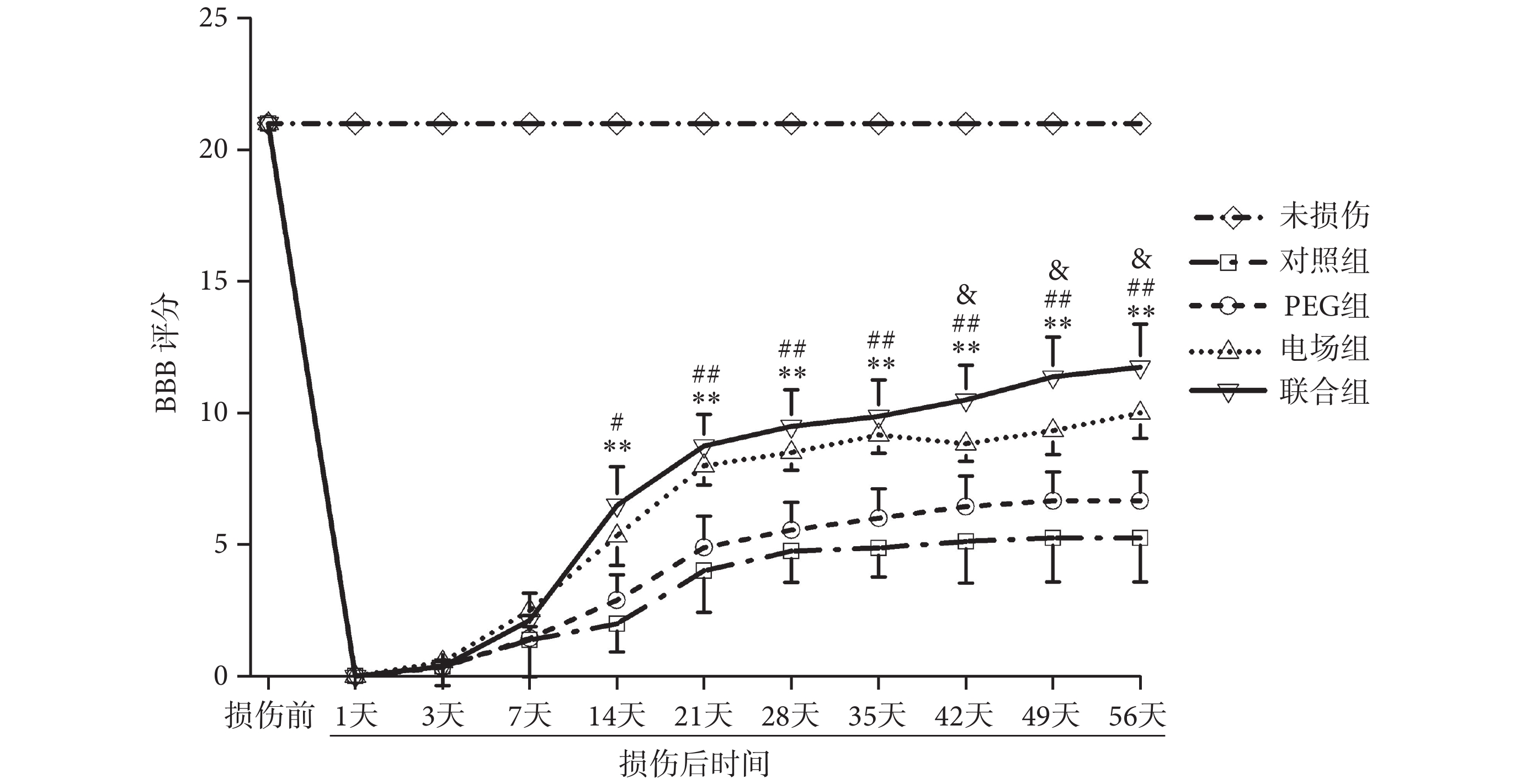 圖5
聯合組和其他組別的BBB評分比較
圖5
聯合組和其他組別的BBB評分比較
**
**
組間比較發現,術后14天,聯合組BBB評分開始顯著高于對照組和PEG組(P < 0.05),但與電場組間的差異無統計學意義(P > 0.05)。術后42天,聯合組BBB評分開始顯著高于電場組(P < 0.05)。聯合組大鼠在術后56天時的BBB評分為11.75 ± 1.65,提示大鼠有頻繁的負重運動,且偶見前后肢協調運動。
2.4 脊髓組織面積評價
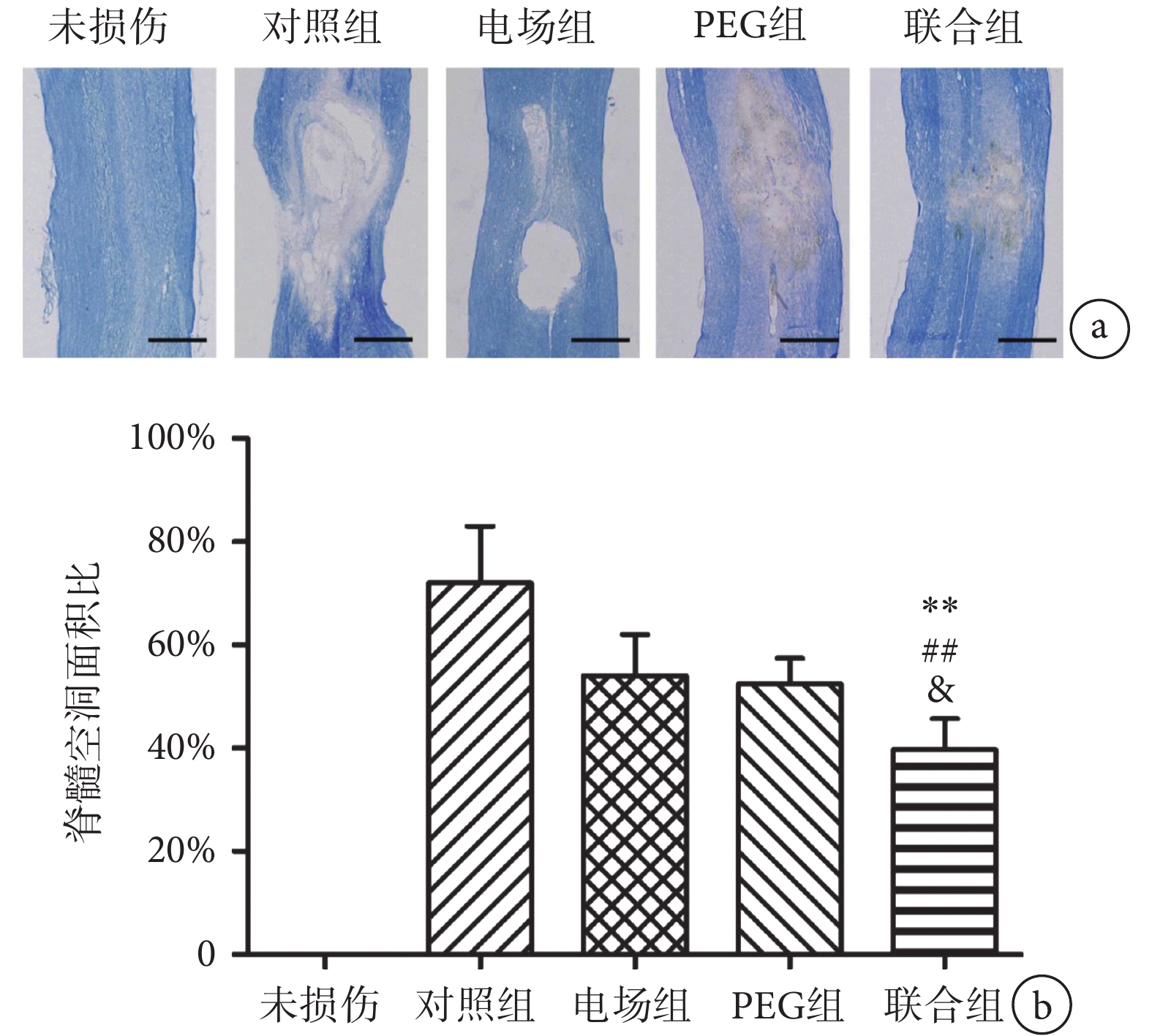
如圖6a所示,脊髓縱切片LFB染色結果顯示,未損傷脊髓的形態規整,輪廓清晰,無明顯纖維組織增生。術后8周脊髓縱切片中正常組織顯示為藍色,損傷后組織缺損形成的空洞顯示為中間白色。如圖6b所示,單因素方差分析顯示不同組間脊髓的空洞面積比的差異有統計學意義(F(3,16) = 28.54,n = 5,P < 0.01)。兩兩比較發現,對照組、電場組、PEG組和聯合組的脊髓空洞面積分別占脊髓縱切片面積的(72.71 ± 1.10)%、(54.25 ± 0.84)%、(52.52 ± 0.53)%和(39.71 ± 0.62)%。聯合組的脊髓空洞面積比顯著低于對照組(n = 5,P < 0.01)、電場組(n = 5,P < 0.01)和PEG組(n = 5,P < 0.05)。
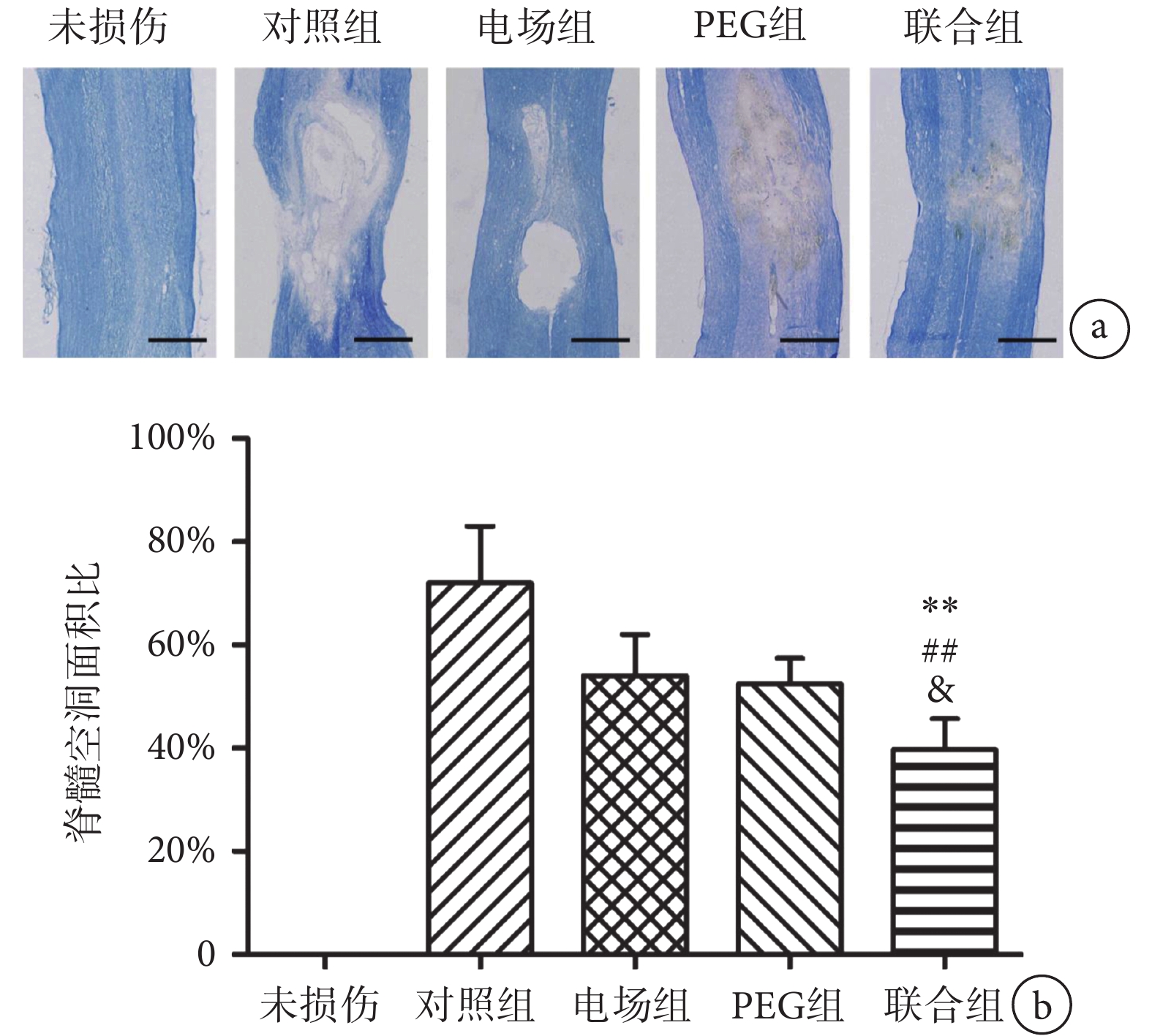 圖6
聯合組和其他組別脊髓縱切片的LFB染色結果比較a. 各組脊髓損傷中心縱切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的空洞面積比比較。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure6.
Comparison of LFB staining results of longitudinal sections of spinal cord between combined group and other groups
圖6
聯合組和其他組別脊髓縱切片的LFB染色結果比較a. 各組脊髓損傷中心縱切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的空洞面積比比較。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure6.
Comparison of LFB staining results of longitudinal sections of spinal cord between combined group and other groups
a. LFB staining of the longitudinal section of the injury center, the scale was 500 μm; b. comparison of the ratio of the spinal cord cavity area in the injury center. **
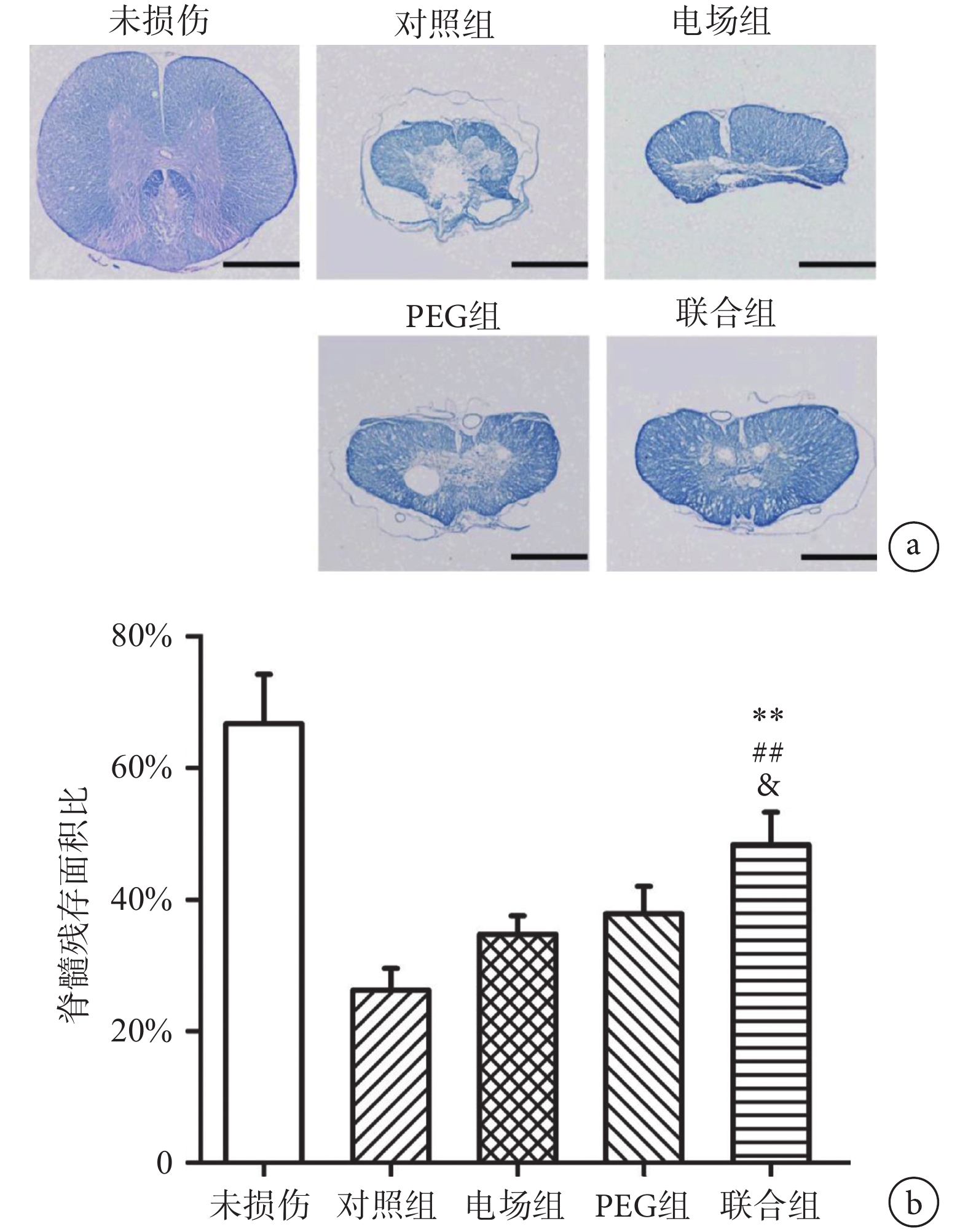
脊髓橫切片LFB染色結果如圖7a所示,正常組脊髓橫切片形狀飽滿,形狀規則,外周藍色為白質,主要由有髓神經纖維構成,中間蝴蝶狀淺色區域為灰質,主要由神經元組成。而損傷后8周脊髓(包括對照組、電場組、PEG組和聯合組)的形態發生明顯改變,切片中央出現不同程度的空洞區域,外周的藍色為殘存的正常脊髓組織。如圖7b所示,單因素方差分析顯示不同組間脊髓的殘存面積比的差異有統計學意義(F(3, 16) = 32.59,n = 5,P < 0.01)。兩兩比較發現,聯合組的髓鞘殘余面積比(51.71±8.22)%顯著高于對照組(25.35±6.47)% (n = 5,P < 0.01)、電場組(34.63±5.72)% (n = 5,P < 0.01)和PEG組(38.48±7.31)% (n = 5,P < 0.05)。
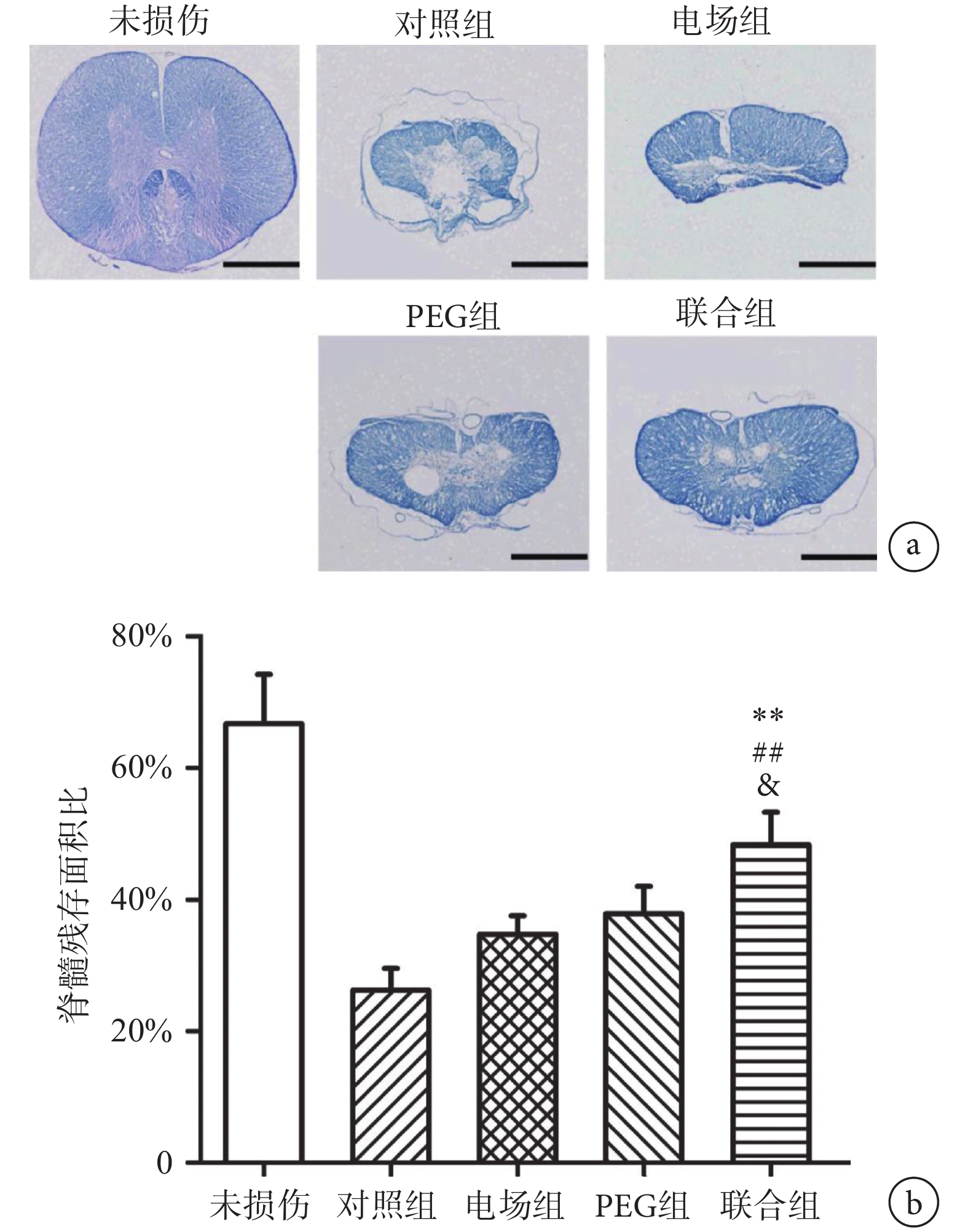 圖7
聯合組和其他組別脊髓橫切片的LFB染色結果比較a. 脊髓損傷中心橫切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的髓鞘殘余面積比。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure7.
Comparison of LFB staining results of cross sections of spinal cord between combined group and other groups
圖7
聯合組和其他組別脊髓橫切片的LFB染色結果比較a. 脊髓損傷中心橫切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的髓鞘殘余面積比。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure7.
Comparison of LFB staining results of cross sections of spinal cord between combined group and other groups
a. LFB staining of the cross section of the SCI center, the scale was 500 μm; b. the ratio of residual area of myelin sheath in the injury center of the spinal cord. **
3 討論
3.1 EFS結合PEG的聯合離子調控方法的設計
本實驗主要涉及的參數設計:① PEG的濃度:PEG對SCI的修復效果呈濃度依賴性,一方面當PEG濃度大于30%時脊髓損傷修復的效果較好,但另一方面隨著PEG濃度的增加,PEG在溶劑中的溶解難度也會增大[25-26]。我們在實驗中發現,當PEG濃度大于50%時,PEG無法完全溶解在Krebs溶液中。因此,本實驗選擇50%為PEG的實驗濃度。② PEG的作用時間:研究表明,脊髓損傷后幾分鐘內細胞外的Ca2+濃度會迅速下降[17],因此需在損傷后幾分鐘之內對Ca2+內流進行干預。我們前期采用50% PEG治療SD大鼠脊髓損傷,結果發現50% PEG作用大鼠脊髓損傷處5 min的效果顯著優于2 min,和8 min的效果無差異,所以本研究PEG的作用時間是5 min。本研究中雖然50% PEG只作用了5 min,但是其治療效果能持續較長時間,主要因為PEG可在脊髓損傷后發揮膜修復作用,保護細胞膜的結構完整性[14]。PEG可在細胞膜表面形成一道分子屏障,保護正常的離子通道的功能,減少Ca2+等離子的大量內流,減輕脊髓的繼發性損傷,利于脊髓后期再生和功能恢復。③ EFS的作用時間:損傷電位會隨著時間減小,在損傷后10 min內衰減迅速,損傷后30 min衰減到初始值的50%,隨后變化幅度變小,并大概在損傷后2 h恢復到0 mV左右。我們前期的研究顯示脊髓損傷后,電場刺激30 min和60 min的效果無顯著差異,并且由于EFS的作用時間過長會增加感染的風險,也可能導致受刺激組織過熱以及細胞毒性物質的產生,因此本研究中電場作用的時間是30 min。
3.2 EFS結合PEG對離子內流的影響
在電場刺激過程中,大鼠脊髓的T8和T12被設置為陰極,T10被設置為陽極,電場刺激器開機后,Ca2+暫時會聚集于陰極附近,減少了脊髓損傷局部的Ca2+內流,因此電場刺激期間電場組和聯合組的損傷電位約為0 mV,也即細胞膜內外的Ca2+濃度差無明顯變化。但電場刺激的作用缺乏持續性,電場撤離后,失去了電場的作用,損傷處的部分Ca2+會重新開始內流,電場組和聯合組將會重新形成損傷電位。因此,本研究采用聯合療法,將EFS和PEG聯合使用。結果顯示聯合組的損傷電位顯著低于對照組和PEG組大鼠損傷電位的初始值,上述結果可能是由于聯合作用期間,EFS發揮了離子調控功能并提供修復時間窗口,PEG形成物理屏障發揮了細胞膜修復功能,減少了EFS停止后的Ca2+內流。
3.3 EFS結合PEG對大鼠脊髓髓鞘的修復作用
脊髓有髓神經纖維由神經元軸突及髓鞘構成,髓鞘包裹在軸突外層,為神經元及軸突提供營養支持,髓鞘的完整性是保證軸突具備正常生理功能的前提。研究表明軸突脫髓鞘改變是脊髓損傷后的一個重要病理變化,在損傷早期脫髓鞘改變主要出現在損傷中心,之后沿纖維束逐漸擴展[27],引起比原發損傷范圍更廣的繼發性損傷。
目前,改善損傷后脊髓軸突髓鞘化、促進脊髓損傷修復主要有兩種方法:① 減輕脊髓損傷后的軸突脫髓鞘化;② 促進脊髓損傷后的軸突再髓鞘化[28]。我們前期研究證實,EFS可顯著抑制Ca2+內流,減少損傷后髓鞘細胞的凋亡,抑制SCI后殘存軸突的脫髓鞘改變。研究表明PEG作用一段時間后能使破裂的細胞膜閉合,提供適宜的微環境促進軸突髓鞘再生[29]。本研究的LFB染色結果也顯示,電場組及PEG組的殘存髓鞘面積較對照組顯著增大而空洞面積較對照組顯著縮小,也證實了這兩種方法對髓鞘的保護作用及再生的促進作用。進一步將兩種治療方法結合后發現,聯合組的髓鞘面積顯著高于電場組和PEG組,表明聯合療法的效果顯著優于EFS和PEG單獨使用時的效果。推測聯合治療方法在損傷后的不同時期發揮了不同的作用,為抑制損傷后脊髓髓鞘的丟失和脫髓鞘軸突的再髓鞘化創造了積極的條件[12-14]。
3.4 EFS結合PEG對脊髓傳導功能的修復作用
MEP可評估脊髓下行運動傳導通路的功能狀態,能直觀地反映大鼠后肢的運動功能恢復情況。MEP的結果顯示術后30 min,聯合組雙后肢MEP波幅差和潛伏期差均顯著低于對照組和PEG組,但與電場組相比無明顯差別。研究表明SCI后脊髓神經軸突會發生脫髓鞘的病理改變,軸突鉀離子通道的暴露使得軸突膜電位被鉗制在靜息電位水平,神經沖動傳導出現障礙[30-31],導致對照組的MEP波幅差和潛伏期均顯著上升。EFS可在損傷早期抑制Ca2+內流,抑制繼發性損傷和神經纖維脫髓鞘的發生,而PEG起效較晚,因此損傷30 min時聯合組的治療效果顯著優于對照組,但是與電場組相比無顯著差異。術后8周,聯合組MEP波幅差和潛伏期差顯著低于其他三組,表明PEG與EFS結合可以促進損傷脊髓傳導功能的修復。MEP波幅代表動作電位的強度,MEP潛伏期代表神經沖動的傳導速度,與神經纖維的數量及結構相關[4],該結果也與形態學的結果一致。
值得一提的是,MEP作為脊髓傳導功能的評價指標具有較高的敏感度,但也容易受多種因素的影響,麻醉劑就是其中一種。麻醉劑可影響脊髓的傳導通路及神經沖動的傳遞,最終可能改變MEP的結果。本文的雙后肢MEP均是在大鼠麻醉狀態下記錄的,這可能對本實驗的結果分析存在一定的影響。為更準確地分析聯合方法對SCI后大鼠運動功能的修復效果,本實驗進一步進行了大鼠后肢運動功能的BBB評分。
3.5 EFS結合PEG對大鼠運動功能的修復作用
BBB評分是一種評價SCI后大鼠后肢運動功能的方法,它涵蓋了SCI后大鼠恢復過程中后肢的行為學變化,能直觀地反映脊髓損傷后的恢復程度[32-33]。從BBB評分來看,PEG組BBB評分高于對照組,表明PEG可促進脊髓損傷的修復,這與既往的文獻報道結果相符[15,34]。損傷14天后,聯合組BBB評分開始顯著高于對照組和PEG組。損傷42天后,聯合組的BBB評分開始顯著高于電場組,表明經過大概6周的時間EFS結合PEG的治療方法顯著改善了大鼠的運動功能。
3.6 不足與展望
本研究并未測試50% PEG明膠海綿的相關理化參數,比如50% PEG明膠海綿在5 min內的局部釋放量及突釋效應。另外,本研究中雖然采用了運動誘發電位、運動功能評分以及脊髓殘存面積和脊髓空洞面積來聯合證明治療效果,但是由于動物數量的限制,我們這次的實驗沒有進行脊髓軸突、神經元等多個維度的免疫組化切片。后續的實驗我們會增加實驗動物的數量,并繼續優化實驗方案,測試明膠海綿的理化參數,增加多維度的免疫組化切片,更加全面地對治療效果進行評價。
本實驗通過形態學、電生理學以及行為學的研究結果,證實了EFS和PEG聯合治療大鼠SCI的長期效果優于EFS和PEG單獨使用時的效果,該研究為脊髓損傷的早期干預治療提供了一種新的思路。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:張丞、王藹華、張廣浩和容威和進行了動物實驗、數據分析和撰寫初稿,吳昌哲和霍小林提出研究思路和審閱及修訂初稿。
倫理聲明:本研究通過了北京清華長庚醫院動物倫理委員會的審批。
引言
脊髓損傷(spinal cord injury,SCI)是脊髓遭受創傷后主要功能(感覺、運動、反射等)出現障礙的臨床常見病。SCI后的主要神經病變包括原發性損傷和繼發性損傷,原發性損傷是指創傷對脊髓本身產生的初次損傷,繼發性損傷是指原發性損傷后生物反應級聯反應所導致的一系列病理生理學變化,主要包括細胞凋亡、炎性反應等,其產生的危害遠超過原發性損傷[1]。研究表明脊髓損傷后損傷局部組織Ca2+ 的大量內流是繼發性損傷發生的主要誘因[2],也是各種細胞死亡方式的最后共同通路[3]。因此,治療SCI時應足夠重視Ca2+的調控,在脊髓損傷早期及時阻止損傷局部組織Ca2+的大量內流,抑制脊髓繼發性損傷的發生[4]。
研究表明Ca2+的流動可受到外加直流電場(electric field stimulation,EFS)的調節[5]。Strautman等[6]在正常組織處放置陰極,在損傷處放置陽極,在損傷局部形成反向電場,有效地抑制了細胞外Ca2+流入細胞內。細胞外Ca2+的大量內流在宏觀上表現為損傷電位(injury potential)的形成,即在損傷組織與正常組織之間形成的電位差[7]。我們[8-10]前期證實EFS早期調控的方法可以有效降低損傷電位,降低細胞凋亡程度,減輕脊髓繼發性損傷,促進脊髓功能的修復。但實驗中我們[9-10]發現,電場刺激停止后Ca2+恢復向細胞內流動,形成幅值較小的新的損傷電位,提示電場刺激的治療方法只能適時延長治療的時間窗口,無法從根本上抑制損傷局部Ca2+內流和繼發性損傷的發生。
聚乙二醇(polyethylene glycol,PEG)是一種無毒的乙二醇高聚物,能脫去細胞膜表面的結合水,使細胞膜上的蛋白質和磷脂分子發生疏散和重排,使損傷處兩側的磷脂雙分子層相互融合,從而消除細胞膜上的缺口達到修復受損細胞膜的目的[11-12]。近年來,PEG的膜修復特性被逐漸應用于SCI修復的研究中。Shi等[13-14]發現,用PEG處理脊髓損傷處可使部分斷裂的軸突在結構上重新建立連接,促進軸突傳導功能的恢復。Borgens等[15]在豚鼠脊髓擠壓損傷7 h后,通過局部給藥的方式用PEG處理損傷處,發現PEG能明顯改善豚鼠的表層軀干肌反射功能和神經傳導功能。然而研究者們發現,PEG的修復作用存在滯后性,施加后5 min才能發揮作用[16]。但在SCI后,細胞外的Ca2+ 濃度會在幾分鐘之內從正常水平(1.0~1.3 mmol/L)迅速下降至低濃度水平(< 0.1 mmol/L)[17-18],當細胞外Ca2+濃度低于0.5 mmol/L時,細胞膜的修復將受到抑制[19-20]。
因此,本文提出在SCI的早期治療中將EFS和PEG聯合使用,EFS發揮Ca2+調控功能并提供修復時間窗口,PEG發揮細胞膜修復功能并形成物理屏障,從而最大限度地抑制Ca2+內流,促進損傷脊髓功能的修復。本文擬通過損傷電位檢測、運動誘發電位分析、行為學評分和脊髓形態學觀察,評價聯合離子調控方法對大鼠脊髓損傷的治療效果。
1 實驗方法
1.1 實驗動物
本實驗所用動物為清潔級成年雌性Sprague-Dawley(SD)大鼠[SCXK(京)2020-0004],體重220~250 g,購自北京華阜康生物科技股份有限公司。動物的飼養及實驗過程依照《北京市實驗動物管理條例》相關規定進行,經北京清華長庚醫院動物倫理委員會批準通過。
1.2 大鼠脊髓損傷模型的制備
SD大鼠用2%戊巴比妥鈉腹腔注射麻醉,手術暴露T8至T12節段的脊柱,移除T8、T10及T12三個節段椎板,并暴露相應節段脊髓組織。將大鼠置于脊髓打擊器的底座上,將重10 g的砝碼從玻璃套管50 mm刻度處自由垂直落下,擊打T10節段的脊髓組織。受損脊髓局部出現充血和腫脹,大鼠尾巴痙攣性擺動,雙后肢出現回縮式撲動,說明大鼠SCI模型制作成功[21]。
1.3 動物分組及干預方法
脊髓損傷后的大鼠隨機分為4組:① 對照組(n = 10):損傷后無治療;② PEG組(n = 10):損傷后采用浸有50% PEG的明膠海綿覆蓋在損傷局部5 min;③ 電場組(n = 10):損傷后立即用EFS干預30 min;④ 聯合組(n = 10):電場干預期間同時將浸有50% PEG的明膠海綿覆蓋在損傷局部5 min,5 min后取走明膠海綿,電場刺激繼續至30 min結束。
PEG的施加方式:① 無菌明膠海綿裁剪:將吸收性明膠海綿(江西省祥恩醫療科技發展有限公司,60 mm × 20 mm × 5 mm)按長10 mm、寬5 mm、厚2.5 mm的大小進行裁剪。② PEG明膠海綿制作:稱取50 mg PEG-2000粉末(Sigma-Aldrich,美國)溶解于100 mL Krebs溶液中。將裁剪好的明膠海綿放置在配制好的PEG溶液中,4 ℃浸泡24 h后使用。③ 明膠海綿的覆蓋:用浸有50% PEG的明膠海綿覆蓋在損傷局部5 min,5 min后取走明膠海綿。
EFS的施加方式:電場刺激器的結構詳見本實驗室前期文章[10],每個刺激器由一個陽極和兩個陰極組成,每只大鼠使用兩個刺激器進行刺激。在脊髓損傷之前,將兩個刺激器的兩個陽極分別縫合在T10兩側的椎旁肌上,一個刺激器的兩個陰極被縫合在T8兩側的椎旁肌上,另一個刺激器的兩個陰極縫合在T12兩側的椎旁肌上(見圖1),電極縫合后進行脊髓損傷處理。脊髓損傷后即刻打開刺激器的開關,調節刺激電壓使頭側和尾側損傷電位均變為(0 ± 0.5)mV,外加直流電場共干預30 min。在電場刺激期間,刺激電壓根據損傷電位每10 min評估一次,根據需要進行調整。刺激完成后,手術取走刺激電極。
 圖1
電場刺激示意圖
Figure1.
Schematic diagram of electric field stimulation
圖1
電場刺激示意圖
Figure1.
Schematic diagram of electric field stimulation
1.4 脊髓損傷電位的測量
脊髓損傷電位是指脊髓無損傷部分與損傷部分之間所產生的電位差,主要是由脊髓損傷處Ca2+ 內流形成。大鼠損傷后立即用雙鹽橋電極測量損傷電位,雙鹽橋電極的結構以及測量方法在本實驗室前期的文章中有詳細介紹[10]。測量損傷電位時將與萬用表負輸入端相連的電極頭輕置于T10段脊髓上,另一個與萬用表正輸入端相接的電極頭輕置于T8或T12段脊髓上,萬用表上的讀數即為頭側損傷電位或尾側損傷電位。損傷電位測量完畢,傷口消毒后逐層縫合。術后所有動物每天注射青霉素鈉,定時換水添食,保持墊料干燥,定時人工排尿。
1.5 運動誘發電位的測量
分別于脊髓損傷前、損傷后30 min及損傷后8周測量大鼠運動誘發電位(motor evoked potential,MEP)。刺激電極陽極置于大鼠脊髓損傷區頭側的T8或尾側的T12脊髓上,陰極位于陽極的尾側,刺激信號脈寬200 μs,頻率1 Hz,刺激強度3 V。兩對記錄電極分別插入左右側后肢的腓腸肌肌腹,負極位于正極尾側,參考電極插入正負記錄電極之間。用電生理記錄儀檢測MEP信號,使用損傷區頭側、尾側的MEP波幅差和潛伏期差評價損傷脊髓的傳導功能恢復情況,差值越小說明恢復效果越好[22]。
1.6 運動功能評分
于術后1天、3天及之后的每周進行運動功能BBB評分(Basso, Beattie & Bresnahan locomotor rating scale),直至8周后實驗結束。評分過程中,將大鼠置于封閉的寬敞區域使其爬行,觀察者根據大鼠的臀、膝、踝關節行走,軀干運動及協調情況確定兩側后肢BBB評分,取平均值作為各組大鼠最終的運動功能評分[23]。實驗過程中,采用2名對實驗不知情的觀察者進行數據的采集與分析。
1.7 脊髓殘存的神經組織面積快藍染色
術后8周,取同齡正常大鼠2只,過量麻醉藥處死正常大鼠和各組大鼠,經心臟灌流后取出脊髓組織進行冰凍組織切片。每組10只大鼠,5只大鼠行連續脊髓橫切片,5只大鼠行連續脊髓縱切片。兩只正常大鼠取同節段脊髓,1只行連續脊髓橫切片,1只行連續脊髓縱切片。切片厚度均為20 μm,切片間隔均為500 μm。顯微鏡下觀察各組切片中殘存面積最少的設定為損傷中心,行神經組織面積快藍染色(Luxol fast blue staining,LFB)[24],顯微鏡下觀察并采集圖像,Image J定量分析縱切片脊髓空洞面積(LFB未著色部位)和橫切片脊髓殘存面積(LFB著色部位),并計算縱切片脊髓空洞面積比(脊髓空洞面積/脊髓平面面積)以及橫切片脊髓殘存面積比(脊髓殘存面積/脊髓平面面積)。
1.8 統計分析
所有數據均用SPSS 20.0軟件進行統計分析。所有數據表示為平均值±標準差。采用單因素方差分析比較各組大鼠脊髓組織縱切片組織空洞面積比及橫切片脊髓殘存組織面積比,組間兩兩比較采用Bonferroni事后檢驗。采用雙因素重復測量方差分析比較損傷電位的檢測結果、MEP潛伏期差和波幅差的差異以及BBB評分差異,組間兩兩比較采用Bonferroni事后檢驗。所有的統計分析中,檢驗水準均為0.05。
2 實驗結果
2.1 損傷電位的檢測結果
聯合組、電場組、PEG組和對照組的損傷電位測量結果如圖2所示。對照組和PEG組的頭、尾側損傷電位隨時間逐漸減小;電場組和聯合組在電場施加期間,頭、尾側損傷電位均為0 mV左右。電場撤離后,電場組和聯合組大鼠頭、尾側損傷電位重新形成,新生成的頭、尾側損傷電位低于對照組和PEG組頭、尾側損傷電位的初始值,之后隨時間逐漸減小。
 圖2
聯合組與其他組別損傷電位對比
圖2
聯合組與其他組別損傷電位對比
a. 各組大鼠頭側損傷電位;b. 各組大鼠尾側損傷電位。**
a. rostral injury potentials of four groups; b. caudal injury potentials of four groups. **
雙因素重復測量方差分析的結果表明,組別因素(F(3, 27) =104.57,n = 10,P < 0.01)和時間因素(F(3, 27) = 85.26,n = 10,P < 0.01)對損傷電位的變化均有顯著影響,說明各組損傷電位隨時間變化而發生顯著變化。
組間比較發現,在損傷后30 min,聯合組的頭側損傷電位顯著低于對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)頭側損傷電位的初始值,電場組的頭側損傷電位顯著低于對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)頭側損傷電位的初始值。尾側損傷電位的比較結果與頭側損傷電位的結果類似。
2.2 運動誘發電位的檢測結果
重復測量雙因素方差分析顯示,組別因素(F(3, 27) = 124.29,n = 10,P < 0.01)和時間因素(F(3, 27) = 105.48,n = 10,P < 0.01)對MEP的波幅差均有顯著影響,說明各組MEP波幅差隨時間變化而發生顯著變化。
組間比較發現,如圖3所示,脊髓損傷前,所有大鼠的雙后肢MEP波幅差的差異無統計學意義(n = 10,P > 0.05)。術后30 min,聯合組的雙后肢波幅差與對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)相比顯著降低,但與電場組相比差異無統計學意義(n = 10,P > 0.05)。在術后8周時,聯合組的雙后肢MEP波幅差較對照組(n = 10,P < 0.01)、PEG組(n = 10,P < 0.01)和電場組(n = 10,P < 0.05)均顯著降低。
 圖3
聯合組與其他組別MEP波幅差對比
圖3
聯合組與其他組別MEP波幅差對比
a. 各組大鼠左后肢MEP波幅差;b. 各組大鼠右后肢MEP波幅差。**
a. MEP amplitude differences of left hind limbs of four groups; b. MEP amplitude differences of right hind limbs of four groups. **
重復測量雙因素方差分析提示,組別(F(3, 27) = 131.32,n = 10,P < 0.01)和時間因素(F(3, 27) = 118.33,n = 10,P < 0.01)對MEP潛伏期差有顯著影響,說明各組MEP潛伏期差隨時間變化而發生顯著變化。
MEP潛伏期差的結果和MEP波幅差的結果相似,見圖4。脊髓損傷前,所有大鼠雙后肢MEP潛伏期差的差異無統計學意義(n = 10,P > 0.05)。術后30 min,聯合組的雙后肢潛伏期差較對照組(n = 10,P < 0.01)和PEG組(n = 10,P < 0.01)顯著降低,但與電場組相比差異無統計學意義(n = 10,P > 0.05)。術后8周,聯合組雙后肢MEP潛伏期差顯著低于對照組(n = 10,P < 0.01)、PEG組(n = 10,P < 0.01)和電場組(n = 10,P < 0.05)。
 圖4
聯合組與其他組別MEP潛伏期差對比
圖4
聯合組與其他組別MEP潛伏期差對比
a. 各組大鼠左后肢MEP潛伏期差;b. 各組大鼠右后肢MEP潛伏期差。**
a. MEP latency differences of left hind limbs of four groups; b. MEP latency differences of right hind limbs of four groups. **
2.3 大鼠運動功能BBB評分
如圖5所示,脊髓損傷前所有大鼠的BBB評分均為21分,和正常大鼠評分無明顯差異。脊髓損傷后各組大鼠均出現明顯的功能障礙,之后各組大鼠運動功能均有不同程度的改善。雙因素重復測量方差分析顯示,組別(F(3, 27) = 84.56,n = 10,P < 0.01)和時間因素(F(3, 27) = 95.67,n = 10,P < 0.01)對大鼠BBB評分有顯著影響,各組大鼠間BBB評分的差異有統計學意義,且各組大鼠BBB評分隨時間變化而發生顯著變化。
 圖5
聯合組和其他組別的BBB評分比較
圖5
聯合組和其他組別的BBB評分比較
**
**
組間比較發現,術后14天,聯合組BBB評分開始顯著高于對照組和PEG組(P < 0.05),但與電場組間的差異無統計學意義(P > 0.05)。術后42天,聯合組BBB評分開始顯著高于電場組(P < 0.05)。聯合組大鼠在術后56天時的BBB評分為11.75 ± 1.65,提示大鼠有頻繁的負重運動,且偶見前后肢協調運動。
2.4 脊髓組織面積評價
如圖6a所示,脊髓縱切片LFB染色結果顯示,未損傷脊髓的形態規整,輪廓清晰,無明顯纖維組織增生。術后8周脊髓縱切片中正常組織顯示為藍色,損傷后組織缺損形成的空洞顯示為中間白色。如圖6b所示,單因素方差分析顯示不同組間脊髓的空洞面積比的差異有統計學意義(F(3,16) = 28.54,n = 5,P < 0.01)。兩兩比較發現,對照組、電場組、PEG組和聯合組的脊髓空洞面積分別占脊髓縱切片面積的(72.71 ± 1.10)%、(54.25 ± 0.84)%、(52.52 ± 0.53)%和(39.71 ± 0.62)%。聯合組的脊髓空洞面積比顯著低于對照組(n = 5,P < 0.01)、電場組(n = 5,P < 0.01)和PEG組(n = 5,P < 0.05)。
 圖6
聯合組和其他組別脊髓縱切片的LFB染色結果比較a. 各組脊髓損傷中心縱切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的空洞面積比比較。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure6.
Comparison of LFB staining results of longitudinal sections of spinal cord between combined group and other groups
圖6
聯合組和其他組別脊髓縱切片的LFB染色結果比較a. 各組脊髓損傷中心縱切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的空洞面積比比較。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure6.
Comparison of LFB staining results of longitudinal sections of spinal cord between combined group and other groups
a. LFB staining of the longitudinal section of the injury center, the scale was 500 μm; b. comparison of the ratio of the spinal cord cavity area in the injury center. **
脊髓橫切片LFB染色結果如圖7a所示,正常組脊髓橫切片形狀飽滿,形狀規則,外周藍色為白質,主要由有髓神經纖維構成,中間蝴蝶狀淺色區域為灰質,主要由神經元組成。而損傷后8周脊髓(包括對照組、電場組、PEG組和聯合組)的形態發生明顯改變,切片中央出現不同程度的空洞區域,外周的藍色為殘存的正常脊髓組織。如圖7b所示,單因素方差分析顯示不同組間脊髓的殘存面積比的差異有統計學意義(F(3, 16) = 32.59,n = 5,P < 0.01)。兩兩比較發現,聯合組的髓鞘殘余面積比(51.71±8.22)%顯著高于對照組(25.35±6.47)% (n = 5,P < 0.01)、電場組(34.63±5.72)% (n = 5,P < 0.01)和PEG組(38.48±7.31)% (n = 5,P < 0.05)。
 圖7
聯合組和其他組別脊髓橫切片的LFB染色結果比較a. 脊髓損傷中心橫切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的髓鞘殘余面積比。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure7.
Comparison of LFB staining results of cross sections of spinal cord between combined group and other groups
圖7
聯合組和其他組別脊髓橫切片的LFB染色結果比較a. 脊髓損傷中心橫切片LFB染色,標尺為500 μm;b. 損傷中心脊髓的髓鞘殘余面積比。** P < 0.01,與對照組相比;## P < 0.01,與電場組相比;& P < 0.05,與PEG組相比
Figure7.
Comparison of LFB staining results of cross sections of spinal cord between combined group and other groups
a. LFB staining of the cross section of the SCI center, the scale was 500 μm; b. the ratio of residual area of myelin sheath in the injury center of the spinal cord. **
3 討論
3.1 EFS結合PEG的聯合離子調控方法的設計
本實驗主要涉及的參數設計:① PEG的濃度:PEG對SCI的修復效果呈濃度依賴性,一方面當PEG濃度大于30%時脊髓損傷修復的效果較好,但另一方面隨著PEG濃度的增加,PEG在溶劑中的溶解難度也會增大[25-26]。我們在實驗中發現,當PEG濃度大于50%時,PEG無法完全溶解在Krebs溶液中。因此,本實驗選擇50%為PEG的實驗濃度。② PEG的作用時間:研究表明,脊髓損傷后幾分鐘內細胞外的Ca2+濃度會迅速下降[17],因此需在損傷后幾分鐘之內對Ca2+內流進行干預。我們前期采用50% PEG治療SD大鼠脊髓損傷,結果發現50% PEG作用大鼠脊髓損傷處5 min的效果顯著優于2 min,和8 min的效果無差異,所以本研究PEG的作用時間是5 min。本研究中雖然50% PEG只作用了5 min,但是其治療效果能持續較長時間,主要因為PEG可在脊髓損傷后發揮膜修復作用,保護細胞膜的結構完整性[14]。PEG可在細胞膜表面形成一道分子屏障,保護正常的離子通道的功能,減少Ca2+等離子的大量內流,減輕脊髓的繼發性損傷,利于脊髓后期再生和功能恢復。③ EFS的作用時間:損傷電位會隨著時間減小,在損傷后10 min內衰減迅速,損傷后30 min衰減到初始值的50%,隨后變化幅度變小,并大概在損傷后2 h恢復到0 mV左右。我們前期的研究顯示脊髓損傷后,電場刺激30 min和60 min的效果無顯著差異,并且由于EFS的作用時間過長會增加感染的風險,也可能導致受刺激組織過熱以及細胞毒性物質的產生,因此本研究中電場作用的時間是30 min。
3.2 EFS結合PEG對離子內流的影響
在電場刺激過程中,大鼠脊髓的T8和T12被設置為陰極,T10被設置為陽極,電場刺激器開機后,Ca2+暫時會聚集于陰極附近,減少了脊髓損傷局部的Ca2+內流,因此電場刺激期間電場組和聯合組的損傷電位約為0 mV,也即細胞膜內外的Ca2+濃度差無明顯變化。但電場刺激的作用缺乏持續性,電場撤離后,失去了電場的作用,損傷處的部分Ca2+會重新開始內流,電場組和聯合組將會重新形成損傷電位。因此,本研究采用聯合療法,將EFS和PEG聯合使用。結果顯示聯合組的損傷電位顯著低于對照組和PEG組大鼠損傷電位的初始值,上述結果可能是由于聯合作用期間,EFS發揮了離子調控功能并提供修復時間窗口,PEG形成物理屏障發揮了細胞膜修復功能,減少了EFS停止后的Ca2+內流。
3.3 EFS結合PEG對大鼠脊髓髓鞘的修復作用
脊髓有髓神經纖維由神經元軸突及髓鞘構成,髓鞘包裹在軸突外層,為神經元及軸突提供營養支持,髓鞘的完整性是保證軸突具備正常生理功能的前提。研究表明軸突脫髓鞘改變是脊髓損傷后的一個重要病理變化,在損傷早期脫髓鞘改變主要出現在損傷中心,之后沿纖維束逐漸擴展[27],引起比原發損傷范圍更廣的繼發性損傷。
目前,改善損傷后脊髓軸突髓鞘化、促進脊髓損傷修復主要有兩種方法:① 減輕脊髓損傷后的軸突脫髓鞘化;② 促進脊髓損傷后的軸突再髓鞘化[28]。我們前期研究證實,EFS可顯著抑制Ca2+內流,減少損傷后髓鞘細胞的凋亡,抑制SCI后殘存軸突的脫髓鞘改變。研究表明PEG作用一段時間后能使破裂的細胞膜閉合,提供適宜的微環境促進軸突髓鞘再生[29]。本研究的LFB染色結果也顯示,電場組及PEG組的殘存髓鞘面積較對照組顯著增大而空洞面積較對照組顯著縮小,也證實了這兩種方法對髓鞘的保護作用及再生的促進作用。進一步將兩種治療方法結合后發現,聯合組的髓鞘面積顯著高于電場組和PEG組,表明聯合療法的效果顯著優于EFS和PEG單獨使用時的效果。推測聯合治療方法在損傷后的不同時期發揮了不同的作用,為抑制損傷后脊髓髓鞘的丟失和脫髓鞘軸突的再髓鞘化創造了積極的條件[12-14]。
3.4 EFS結合PEG對脊髓傳導功能的修復作用
MEP可評估脊髓下行運動傳導通路的功能狀態,能直觀地反映大鼠后肢的運動功能恢復情況。MEP的結果顯示術后30 min,聯合組雙后肢MEP波幅差和潛伏期差均顯著低于對照組和PEG組,但與電場組相比無明顯差別。研究表明SCI后脊髓神經軸突會發生脫髓鞘的病理改變,軸突鉀離子通道的暴露使得軸突膜電位被鉗制在靜息電位水平,神經沖動傳導出現障礙[30-31],導致對照組的MEP波幅差和潛伏期均顯著上升。EFS可在損傷早期抑制Ca2+內流,抑制繼發性損傷和神經纖維脫髓鞘的發生,而PEG起效較晚,因此損傷30 min時聯合組的治療效果顯著優于對照組,但是與電場組相比無顯著差異。術后8周,聯合組MEP波幅差和潛伏期差顯著低于其他三組,表明PEG與EFS結合可以促進損傷脊髓傳導功能的修復。MEP波幅代表動作電位的強度,MEP潛伏期代表神經沖動的傳導速度,與神經纖維的數量及結構相關[4],該結果也與形態學的結果一致。
值得一提的是,MEP作為脊髓傳導功能的評價指標具有較高的敏感度,但也容易受多種因素的影響,麻醉劑就是其中一種。麻醉劑可影響脊髓的傳導通路及神經沖動的傳遞,最終可能改變MEP的結果。本文的雙后肢MEP均是在大鼠麻醉狀態下記錄的,這可能對本實驗的結果分析存在一定的影響。為更準確地分析聯合方法對SCI后大鼠運動功能的修復效果,本實驗進一步進行了大鼠后肢運動功能的BBB評分。
3.5 EFS結合PEG對大鼠運動功能的修復作用
BBB評分是一種評價SCI后大鼠后肢運動功能的方法,它涵蓋了SCI后大鼠恢復過程中后肢的行為學變化,能直觀地反映脊髓損傷后的恢復程度[32-33]。從BBB評分來看,PEG組BBB評分高于對照組,表明PEG可促進脊髓損傷的修復,這與既往的文獻報道結果相符[15,34]。損傷14天后,聯合組BBB評分開始顯著高于對照組和PEG組。損傷42天后,聯合組的BBB評分開始顯著高于電場組,表明經過大概6周的時間EFS結合PEG的治療方法顯著改善了大鼠的運動功能。
3.6 不足與展望
本研究并未測試50% PEG明膠海綿的相關理化參數,比如50% PEG明膠海綿在5 min內的局部釋放量及突釋效應。另外,本研究中雖然采用了運動誘發電位、運動功能評分以及脊髓殘存面積和脊髓空洞面積來聯合證明治療效果,但是由于動物數量的限制,我們這次的實驗沒有進行脊髓軸突、神經元等多個維度的免疫組化切片。后續的實驗我們會增加實驗動物的數量,并繼續優化實驗方案,測試明膠海綿的理化參數,增加多維度的免疫組化切片,更加全面地對治療效果進行評價。
本實驗通過形態學、電生理學以及行為學的研究結果,證實了EFS和PEG聯合治療大鼠SCI的長期效果優于EFS和PEG單獨使用時的效果,該研究為脊髓損傷的早期干預治療提供了一種新的思路。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:張丞、王藹華、張廣浩和容威和進行了動物實驗、數據分析和撰寫初稿,吳昌哲和霍小林提出研究思路和審閱及修訂初稿。
倫理聲明:本研究通過了北京清華長庚醫院動物倫理委員會的審批。