有源醫療器械是使用范圍比較廣泛的醫療器械產品,產品具備高可靠性水平是國產有源醫療器械產業實現高質量發展目標的必要要求。本文通過文獻研究、資料收集、實地調研、材料綜合梳理分析等方式,從產業政策、企業開展情況和審評方法等維度對我國有源醫療器械行業可靠性及其審評現狀和存在的問題進行了系統的分析研究,并結合可靠性工作的技術特點,從標準和指導原則兩個方向給出具體的問題解決建議,為后續行業制定科學、客觀、符合我國行業現狀和監管特點的有源醫療器械可靠性技術標準體系和指導原則提供參考。
引用本文: 朱嘉偉, 楊雪鶴, 鄭晨, 楊鵬飛, 李亞球, 李騫. 中國有源醫療器械行業可靠性及其審評現狀研究. 生物醫學工程學雜志, 2022, 39(5): 1050-1058. doi: 10.7507/1001-5515.202202032 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
引言
我國有源醫療器械產業要實現高質量發展的目標,高可靠性水平是產品必須具備的質量特性,監管部門十分重視有源醫療器械安全有效評估,可靠性是安全有效評估的核心要素。我國出臺了《醫療器械監督管理條例》[1]、《有源醫療器械使用期限注冊技術審查指導原則》 [2]等文件,把使用期限與可靠性作為醫療器械審評、產品注冊等環節中必須考核的項目之一,推動了有源醫療器械行業及審評部門對器械研發可靠性的嚴控把關,由此引起了廣泛的關注。但是由于我國有源醫療器械面臨著可靠性設計、分析、驗證及監管等方法缺失的問題,嚴重影響行業及監管部門可靠性工作的系統開展,導致國產產品質量不穩定,失效率高、性能指標衰減快等問題突出,對國產產品市場競爭力和品牌形象產生極大的負面影響。基于此,本文旨在調查研究我國有源醫療器械行業、企業以及審評部門可靠性工作現狀和存在的問題情況,并基于調研結果提出具體的解決方向,為我國有源醫療器械行業可靠性工作的優化與推進提供參考與指導。
1 我國有源醫療器械政策及其可靠性現狀分析
1.1 我國有源醫療器械產業及監管政策情況分析
有源醫療器械是我國醫療器械產業實現轉型升級和高質量發展目標的關鍵領域,政府在政策上對有源醫療器械產業給與了較大的關注和扶持力度。如中華人民共和國國務院、工業和信息化部、科學技術部、國家藥品監督管理局等均明確將高性能醫療器械,如影像設備、醫用機器人、可穿戴設備等作為戰略產業發展方向,提出大力發展高性能醫療器械,加快醫療器械轉型升級[3-6]。
除了在產業發展提出頂層規劃與政策支持外,近幾年來,針對醫療器械產品質量可靠性及其全壽命周期的監管,政府也提出了具體的展望和要求。在行業規劃方面,《增強制造業核心競爭力三年行動計劃(2018-2020年)》[7]、《醫療裝備產業發展規劃(2021-2025年)》(征求意見稿)[8]等文件均提出要推動醫療器械升級換代和質量性能提升,提高產品穩定性和可靠性,使產品性能和質量達到國際水平;在行業監管方面,《醫療器械監督管理條例》、《醫療器械安全和性能基本原則》[9]、《醫療器械注冊管理辦法(修訂草案征求意見稿)》[10]和《有源醫療器械使用期限注冊技術審查指導原則》[2]等文件從不同的維度對醫療器械全壽命周期質量可靠性提出了具體的監管和審評要求,將醫療器械的質量可控與安全、有效放到同等重要的位置。
1.2 我國有源醫療器械行業可靠性現狀分析
經過多年的發展,我國有源醫療器械國產化進程取得了長足進步,發達國家能夠生產的有源醫療器械,我國基本上都能夠生產,但由于國產有源醫療器械在產品創新性、工藝穩定性、質量可控性與可靠性等方面與發達國家相比差距明顯,嚴重影響著國產有源醫療器械的市場競爭力[11]。以醫用超聲設備為例,國產品牌的國內市場份額約為45%,且集中在中低端產品,進口設備分別約占據了65%和90%的中、高端產品市場份額,原因主要是國產設備的可靠性不足所致(國產設備年均故障率約為20%)。其他高端醫療器械如電子計算機斷層掃描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)和核醫學影像設備等也由于可靠性問題,國產品牌占有率亦較低。
雖然從國家政策和行業監管層面上均對醫療器械的質量可靠性提出了具體的愿景和要求,但國產有源醫療器械在可靠性上還是存在著比較突出的問題,且我國有源醫療器械可靠性研究尚處于起步階段,行業面臨著可靠性評價及監管方法、技術及標準體系缺失等問題[12],嚴重影響著國產有源醫療器械可靠性的提升以及政策、監管法規的落實與執行效果。
1.3 我國有源醫療器械行業可靠性研究工作開展情況
由于行業發展和監管都對可靠性提出了強烈的技術需求,近幾年國內有源醫療器械從業人員針對可靠性陸續開展了一些研究與應用工作。
在可靠性工程管理方面,宋國正等[13]分析了國產MRI可靠性不足的原因,給出了可靠性保障管理工作的建議。郁紅漪等[14]對醫用電氣設備在可靠性上存在的問題進行了梳理分析,提出了可靠性工作的要點。李天慶等[15]分析了影響呼吸機使用可靠性的關鍵因素,提出了提高呼吸機運行可靠性的應對措施。吳維民等[16]通過統計學分析,構建了一套醫療器械使用質量評價指標體系。
在可靠性設計分析方面,高治理[17]對醫療器械機械可靠性設計的概念、方法及數學模型作了初步的調研和討論。曾梓軒[18]對尿道閥進行了故障模式、影響及危害性分析(failure mode effects and criticality analysis,FMECA)和故障樹分析(fault tree analysis,FTA),找出了危害性大的故障模式。金海哲等[19]提出一種基于改進FMECA的醫療器械人因可靠性評估方法,解決了傳統風險系數數值重復與權重分配問題。劉瑞達[20]對微創手術機器人傳動系統可靠性問題進行了系統的故障模式及影響分析。李萍等[21]分析了認知可靠性與錯誤分析方法的概念、特點及使用流程。劉相花等[22]利用FMECA對呼吸機部件進行了失效危害度變化研究。吳家海[23]應用FMECA和FTA對下肢助行外骨骼機器人進行了可靠性分析,得到其高風險故障模式與薄弱部位。石佩茹[24]利用模糊理論和非線性組合賦權法,對血細胞分析儀進行了可靠性分配方法研究。馮忠強[25]利用文本挖掘與FMECA相結合的方法對直線加速器加速管開展了可靠性分析。
在可靠性測試評價方面,李楠等[26]針對正電子發射計算機斷層顯像提出以整機系統分解為子系統/部件的評價思路,研究了各子系統/部件的可靠性指標評價方法。牟鵬濤等[27-28]以全自動生化分析儀為例研究了一種加速疲勞測試方法。王宇帆等[29]從注冊審評法規的角度出發,討論了影響有源醫療器械產品壽命的因素。鄧振進等[30]運用加速測試方法對高流量濕化氧療裝備的有效期進行了評價。鄭晨等[31]探討了有源醫療器械使用期限的定義、適用原則和評價方法。李娟等[32]提出了驗證醫用制氧機使用期限的基本方法與思路,研究了影響制氧機使用期限的因素。官輝等[33]從產品有效期及壽命的影響因素入手,提出了有效期預計及加速壽命測試的方法。傅金德等[34]從監管與檢測角度出發,分析了有源醫療器械使用期限驗證方法。張文忠[35]探討了醫療器械硬件板卡可靠性故障激發測試方法。
可以看出,目前國內有源醫療器械行業針對可靠性技術開展了初步研究與應用,主要集中在可靠性設計分析和測試評價上,使用期限評價是行業可靠性工作的重點。總體來說,目前行業存在著方法不系統、不完善等問題,嚴重影響著相關可靠性工作的開展效果。
2 有源醫療器械企業可靠性工作現狀調研
2.1 有源醫療器械企業調研結果分析
為了了解我國有源醫療器械企業可靠性工作的實際開展情況,本文以可靠性工程管理、設計分析和測試評價為方向,通過實地拜訪、問卷調查、線上交流和文件材料查閱等方式對22個在我國注冊經營的國內外有源醫療器械企業(其中外企3個,國內企業19個)的可靠性工作現狀進行了系統的調研,具體的結果分析情況如下。
2.1.1 可靠性工程管理
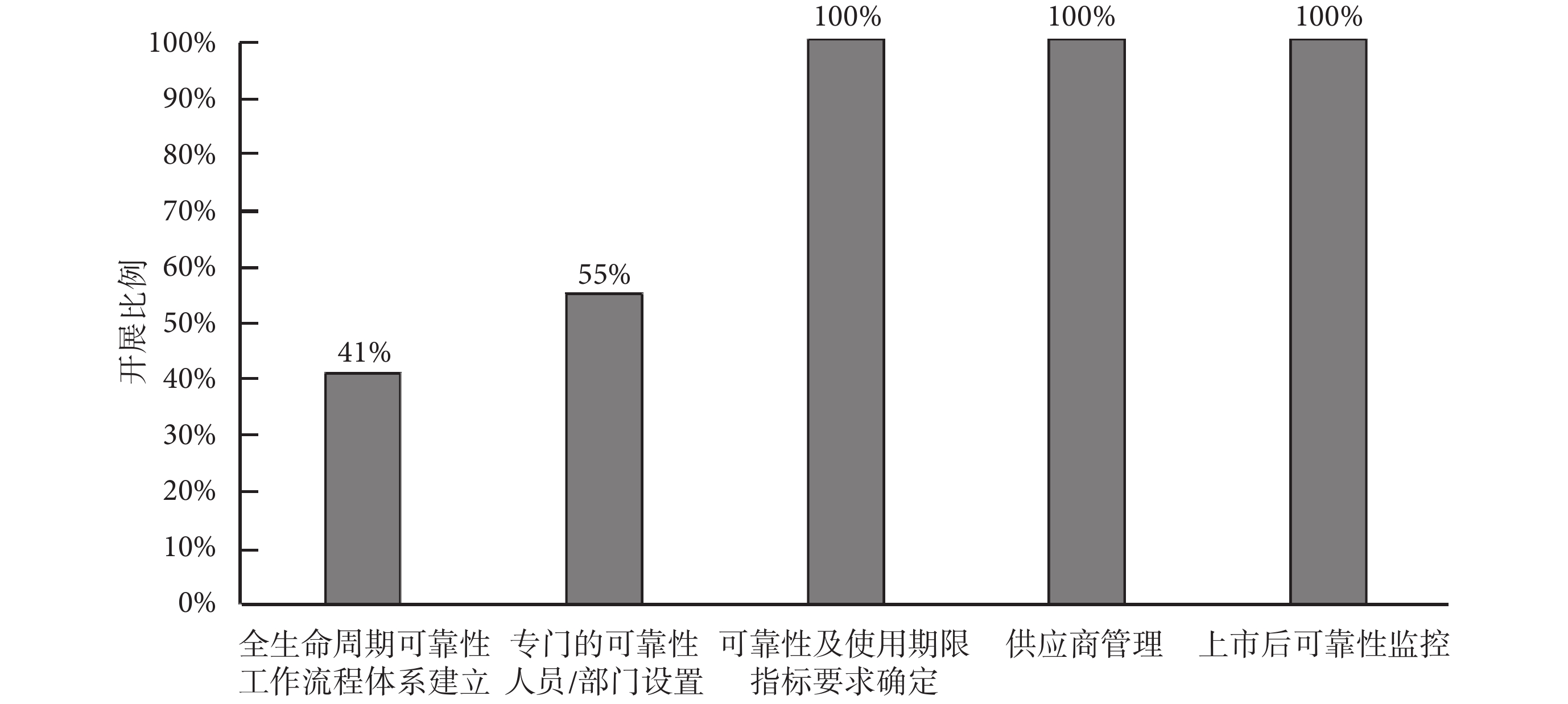
本部分從企業全壽命周期可靠性工作流程體系建立、專門的可靠性人員/部門設置、可靠性及使用期限指標要求確定、供應商管理和上市后可靠性監控等五個方面調研了解企業在可靠性工程管理的開展情況,各項工作的具體占比如圖1所示。
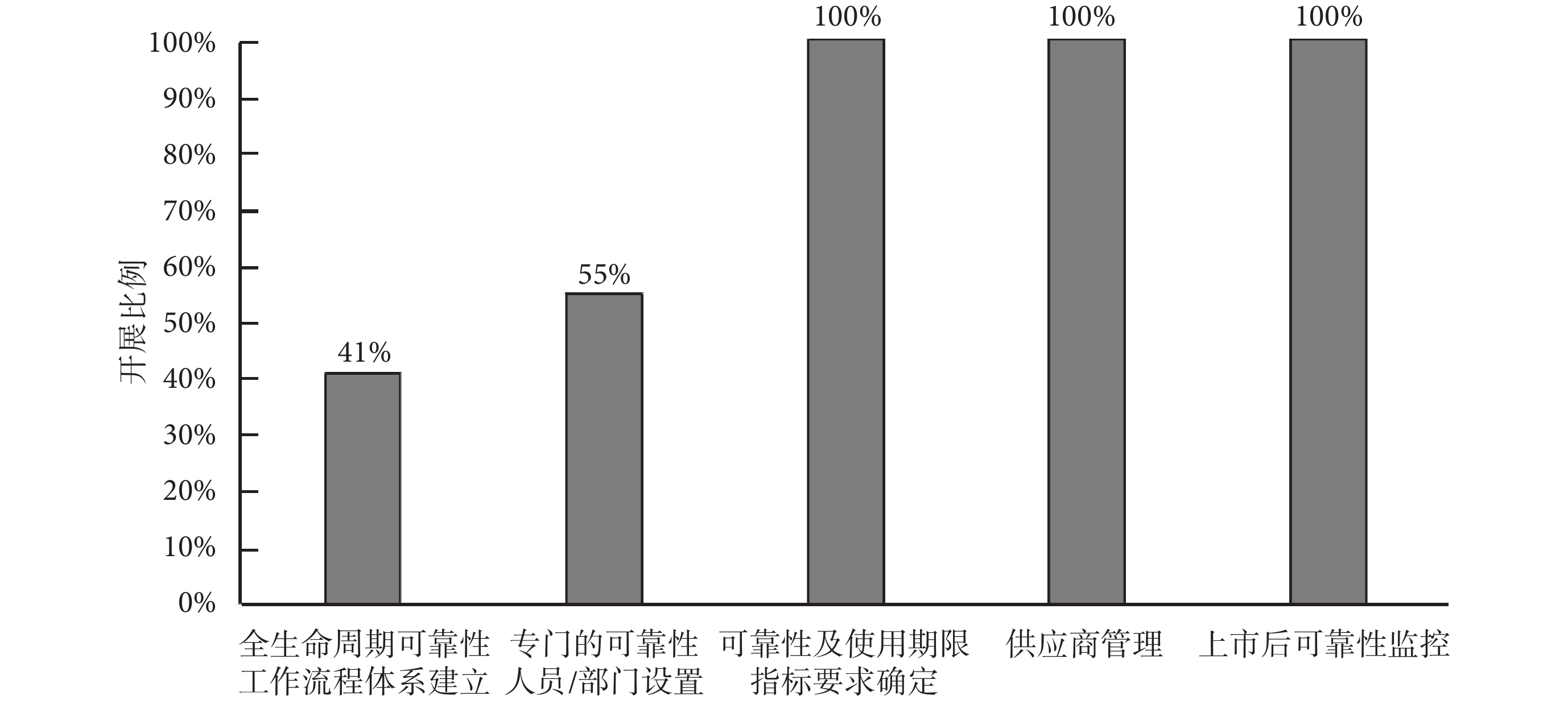 圖1
可靠性工程管理開展情況
Figure1.
Situation of reliability engineering management
圖1
可靠性工程管理開展情況
Figure1.
Situation of reliability engineering management
(1)全壽命周期可靠性工作流程體系建立
有41%的企業針對產品全壽命周期可靠性工作建立了完善的流程體系,主要集中在外企和規模較大的國內企業,大多都是對產品開展了多年可靠性研究并在產品可靠性上積累了豐富經驗的企業。其余大部分企業只開展了零散的可靠性工作,如可靠性測試、可靠性數據分析等,沒有針對可靠性建立一套成體系的工作流程。
(2)專門的可靠性人員/部門設置
55%的企業設置了專門的可靠性技術人員或部門從事產品的可靠性工作,其他受訪企業一般以兼職的形式讓產品工程師承擔開發過程中相關可靠性設計、分析與驗證等工作,也有部分企業僅在最后產品驗證階段讓質量檢測工程師兼任可靠性測試工作。
(3)可靠性及使用期限指標要求確定
由于《有源醫療器械使用期限注冊技術審查指導原則》[2]的頒布,受訪企業基本都針對可靠性及使用期限制定了明確的指標,超過70%的受訪企業直接以使用期限作為量化考核的可靠性指標,只有少部分企業(約30%,基本為外企和較大型的國內企業)會針對不同的應用需求,使用其他指標[如平均無故障工作時間(mean time between failure,MTBF)、失效率等]來作為產品的可靠性要求。
(4)供應商管理
受訪企業基本都對供應商建立了管理辦法,對關鍵部件或者易損件都提出了具體的可靠性要求。供應商一般會被要求提供測試或者統計數據分析報告來證明可靠性指標,要求高的企業還會對供應商進行質量體系稽核,對部件供應商是醫療器械企業的,還要求獲得《醫療器械質量管理體系用于法規的要求》(YY/T0287-2017)[36]的體系認證及產品注冊批準。部分規模較大的企業(基本為外企)還會對產品上市后暴露出可靠性問題的部件退回供應商,并要求供應商提供故障研究分析報告并加以改進。
(5)上市后可靠性監控
受訪企業基本都會通過收集故障信息來了解產品上市后的可靠性情況,一般收集維修/維護記錄、備件更換信息、不良事件、客戶反饋等信息來作為統計分析產品上市后可靠性水平的依據。與進口產品相比,國產產品在用數量不多和使用時間不長,導致大部分的受訪國內企業所獲得的故障數據并不特別充分,而且絕大部分的企業未能按照系統的數學統計方法對產品進行相關可靠性分析,對比來說外企在故障信息收集與統計分析上做得比較充分。
2.1.2 可靠性設計分析
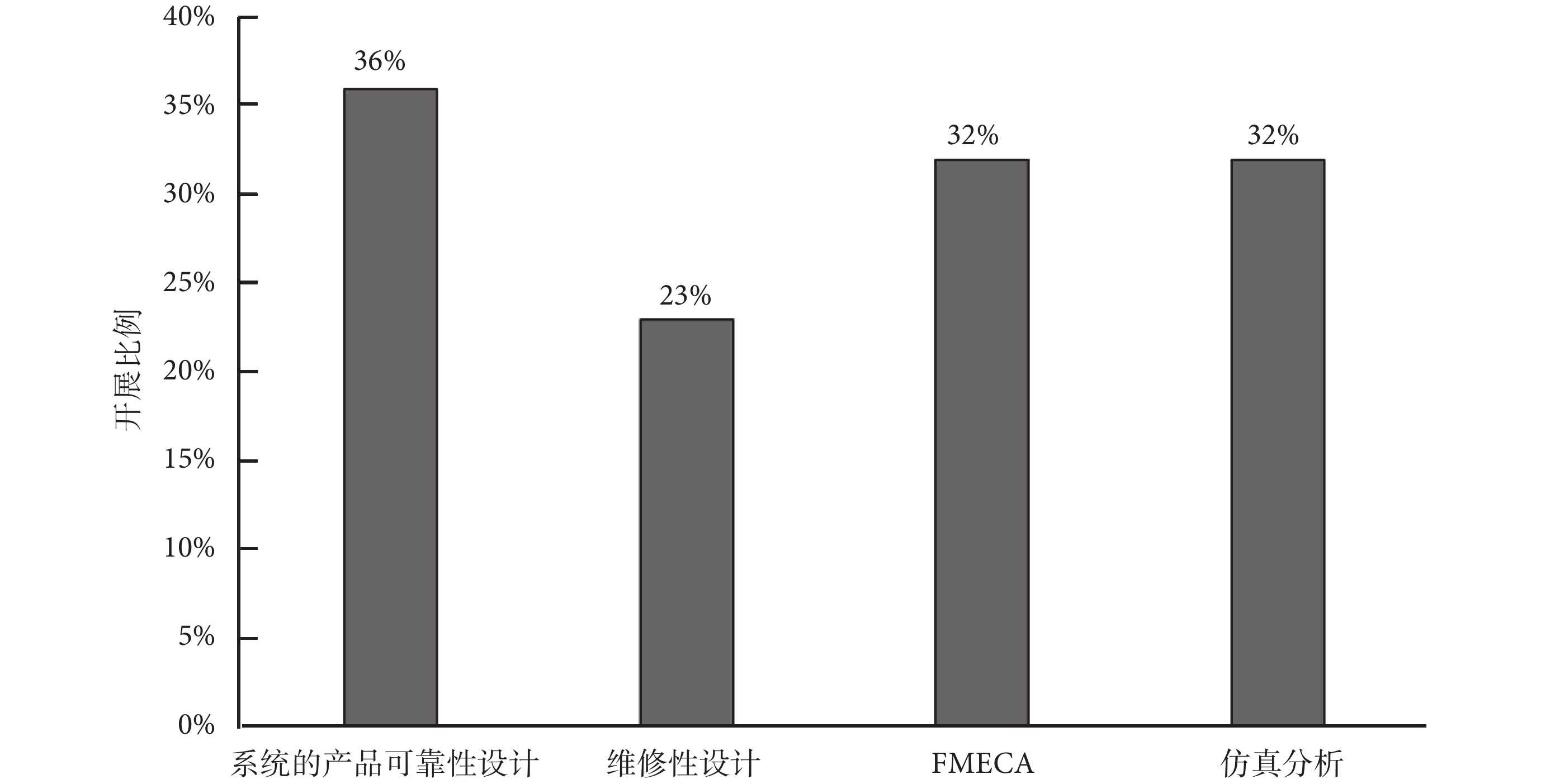
在可靠性設計分析方面,主要從系統的產品可靠性設計、維修性設計、FMECA和仿真分析等四個方面去調研企業的開展情況,各項工作的具體占比如圖2所示。
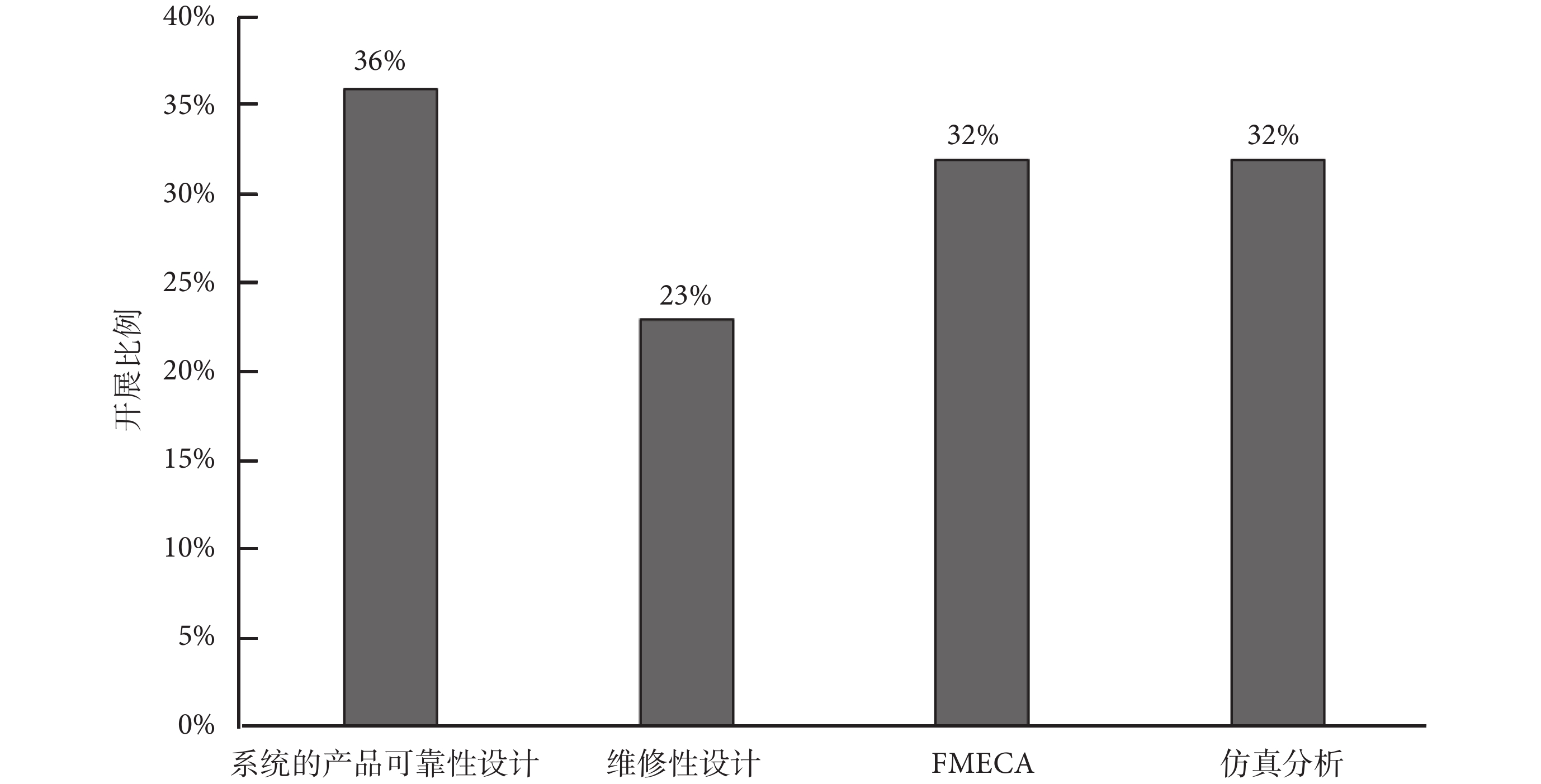 圖2
可靠性設計分析開展情況
Figure2.
Situation of reliability design and analysis
圖2
可靠性設計分析開展情況
Figure2.
Situation of reliability design and analysis
(1)系統的產品可靠性設計
可靠性設計工作一般包含可靠性預計、分配、熱設計、振動設計、降額設計等。有36%的受訪企業針對產品開展了系統的可靠性設計工作(基本為外企和規模較大的國內企業),大部分受訪企業只是蜻蜓點水地開展了部分可靠性設計工作,而且開展時也未對產品具體的設計和使用環境特點進行分析,在研發過程中所開展的可靠性設計工作非常有限。
(2)維修性設計
在受訪企業中,目前能夠針對有源醫療器械產品開展維修性設計的比例較低,只有23%,維修性設計開展比較全面的基本為外企,對于國產有源醫療器械來說維修性設計還處于起步階段,絕大部分的國內企業尚未開展產品維修性設計方面的工作,導致國產有源醫療器械維修性水平不高,由此降低了產品維修效率,直接影響產品的可用度水平。
(3)FMECA
32%的企業對產品開展了FMECA工作,基本為外企,受訪企業中開展FMECA工作的國內企業占比較少,FMECA工作在國內有源醫療器械企業中尚屬于起步階段。
(4)仿真分析
受訪企業中能夠利用仿真手段對產品開展可靠性分析的比例為32%,一般會在機械運動分析、熱分析、振動分析、疲勞強度、壽命或使用期限評價等方面開展仿真工作。利用仿真開展可靠性設計分析和指標驗證的受訪企業中大多數為國內企業,外企利用仿真手段對使用期限、壽命和可靠性指標進行驗證的情況較少,一般僅用于產品的設計分析工作。
2.1.3 可靠性指標驗證
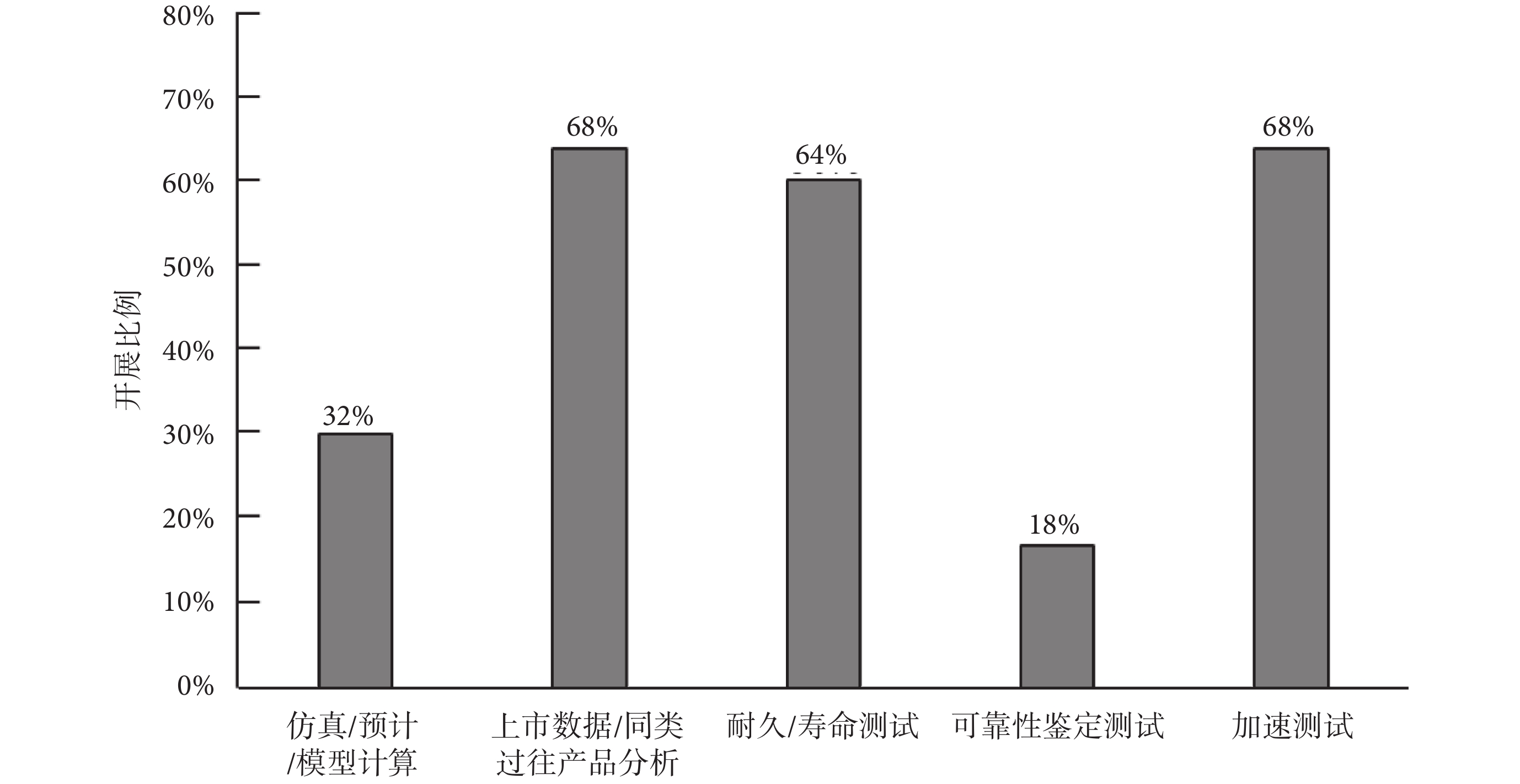
針對產品可靠性指標驗證,由于法規要求企業必須在有源醫療器械產品注冊時提供使用期限或有效期的分析驗證報告,并出臺了《有源醫療器械使用期限注冊技術審查指導原則》[2],因此全部受訪企業均以使用期限為對象針對產品開展了可靠性指標驗證工作,主要利用了仿真/預計/模型計算、上市數據/同類過往產品分析、耐久/壽命測試、可靠性鑒定測試、加速測試等五種方法對可靠性指標開展驗證,可靠性指標驗證方法的具體占比情況如圖3所示。
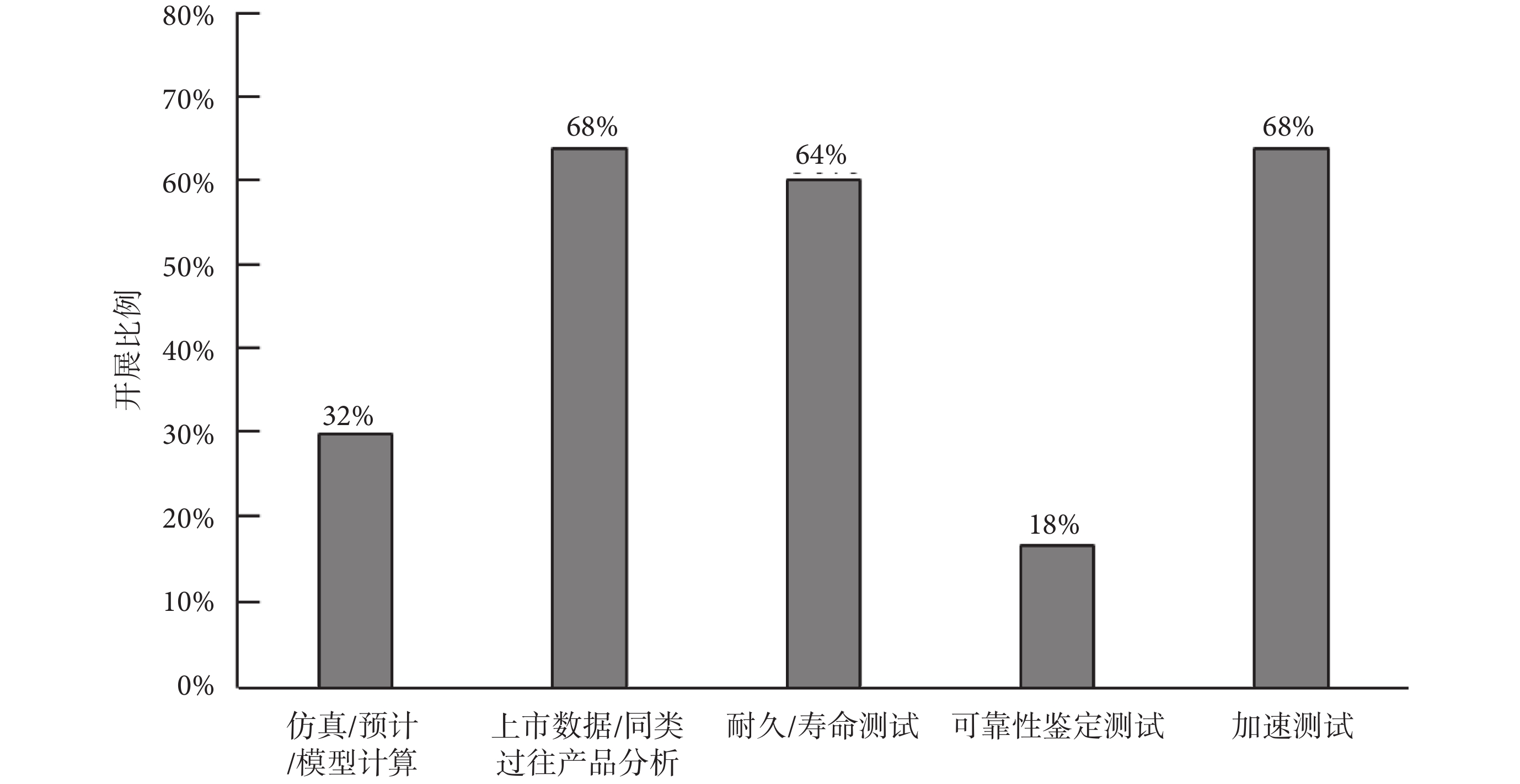 圖3
可靠性指標驗證方式情況
Figure3.
Situation of verification method for reliability index
圖3
可靠性指標驗證方式情況
Figure3.
Situation of verification method for reliability index
(1)仿真/預計/模型計算
有32%的受訪企業采用仿真/預計/模型計算的方式去驗證產品或產品關鍵部件的可靠性指標,通過調研了解到,一般企業會針對無法通過測試驗證或者缺乏過往使用數據的產品和部件使用仿真/預計/模型計算的方式去驗證可靠性指標,但是企業也只會在了解具體的仿真或計算模型的條件下才會使用此方式,而模型或者預計數據的準確性與真實產品的差距是比較難確認的,所以企業一般較少采用此種方式去開展可靠性指標驗證工作。
(2)上市數據/同類過往產品分析
有68%的受訪企業采用上市數據/同類過往產品分析的方式去驗證可靠性指標,但是不同企業之間也存在著可用于評估分析數據量的差異,例如上市產品數量少的企業,會面臨缺乏數據的情況,導致分析出來的可靠性指標結果統計意義不大,大公司由于上市產品數量多、評估數據豐富,分析出來的可靠性指標結果統計意義會比較高。因此,不同規模企業通過上市數據/同類過往產品分析的方式所獲得的可靠性指標在真實性上存在著較大的差異。
(3)耐久/壽命測試
64%的受訪企業利用耐久/壽命測試的方式開展產品可靠性指標驗證,一般會針對整機、運動部件(如滑環、掃描架、床等)、關鍵部件(如球管、探測器、連接器等)等開展耐久/壽命測試。對于植入類有源醫療器械、企業都會采取此方式開展可靠性指標驗證。耐久/壽命測試一般驗證結果的真實性和可信性都比較高,但需要耗費一定的測試和樣品成本。
(4)可靠性鑒定測試
只有18%的受訪企業利用可靠性鑒定測試開展指標驗證工作,開展比例低的主要原因是受訪企業較少使用如MTBF、失效率等傳統可靠性指標,且大多數受訪的國內企業對傳統可靠性指標理解不深入,相比之下一般外企理解得比較清楚,而且外企還會從壽命和MTBF兩個維度來確定產品可靠性指標。
(5)加速測試
由于有源醫療器械在注冊時宣稱的使用期限一般都是以年計算,因此加速測試是受訪企業中采用得相對較多且比較受歡迎的可靠性指標驗證手段,有68%的受訪企業采用此方式開展指標驗證工作。影響加速測試結果準確性的主要是加速測試模型,但是絕大部分的受訪企業基本都是直接套用別的產品的加速模型,對于所使用的模型及其參數的適用性大多都未經過研究驗證,導致加速測試結果的準確性存疑。
2.2 國內有源醫療器械企業調研總結
從以上調研統計結果可以看出,雖然在《有源醫療器械使用期限注冊技術審查指導原則》[2]和相關法規要求的推動下,國內有源醫療器械企業已經形成了產品可靠性意識,絕大部分的國內企業也都針對產品開展了部分可靠性工作,但基本都是不成體系、蜻蜓點水式的,目前國內有源醫療器械企業可靠性工作主要存在以下問題:
(1)缺乏系統的可靠性管理體系
從調研結果來說,雖然大部分的國內有源醫療器械企業都針對產品開展了可靠性工程管理工作,但是絕大多數國內企業尚未形成一套系統的管理體系來對可靠性工作進行統籌、規劃、執行和評審,勢必會導致可靠性工作效果大打折扣。
(2)可靠性設計分析工作沒有得到重視
設計分析工作在國內有源醫療器械行業尚未引起普遍且足夠的重視,從調研統計數據上看,各項可靠性設計分析工作開展比例都不高,如果這種情況得不到改變,勢必嚴重影響國產有源醫療器械產品的可靠性水平。
(3)可靠性測試不充分、方法不規范
由于缺乏專業的可靠性人才或專門的部門,大多數企業對可靠性測試理論和標準理解不全面、不到位,導致所采用的可靠性測試方法不規范,在加速測試的使用上問題尤為突出,基本都是直接套用其他產品的加速模型和參數,大多數企業未對加速模型的適用性開展過研究,導致加速測試結論的可信性大打折扣。除此之外,由于國內企業在產品前期開發階段的可靠性測試開展不充分,導致產品潛在薄弱環節得不到徹底暴露和整改,嚴重影響產品的固有可靠性水平。
3 有源醫療器械使用期限及可靠性審評工作現狀調研分析
為了了解審評中心在審查企業使用期限及可靠性材料的具體情況,本文從企業評價方法、審評中心審查方法和存在的困惑、困難等方面,通過實地拜訪、問卷調查和線上交流等方式,對10個審評中心的有源醫療器械使用期限及可靠性審評工作情況進行了調研。
3.1 企業使用期限及可靠性證明材料情況
通過審評中心調研得知,企業在開展使用期限評價時,基本會采用壽命或MTBF作為產品的使用期限指標,一般按照《有源醫療器械使用期限注冊技術審查指導原則》[2]所提出的方法通過整機或者拆分關鍵部件的方式來開展使用期限評價,具體情況如下:
3.1.1 使用期限及可靠性指標
100%的審評中心反饋企業基本都會采用壽命來表征產品的使用期限,有30%的審評中心反饋有企業還會采用MTBF來表征產品的使用期限。
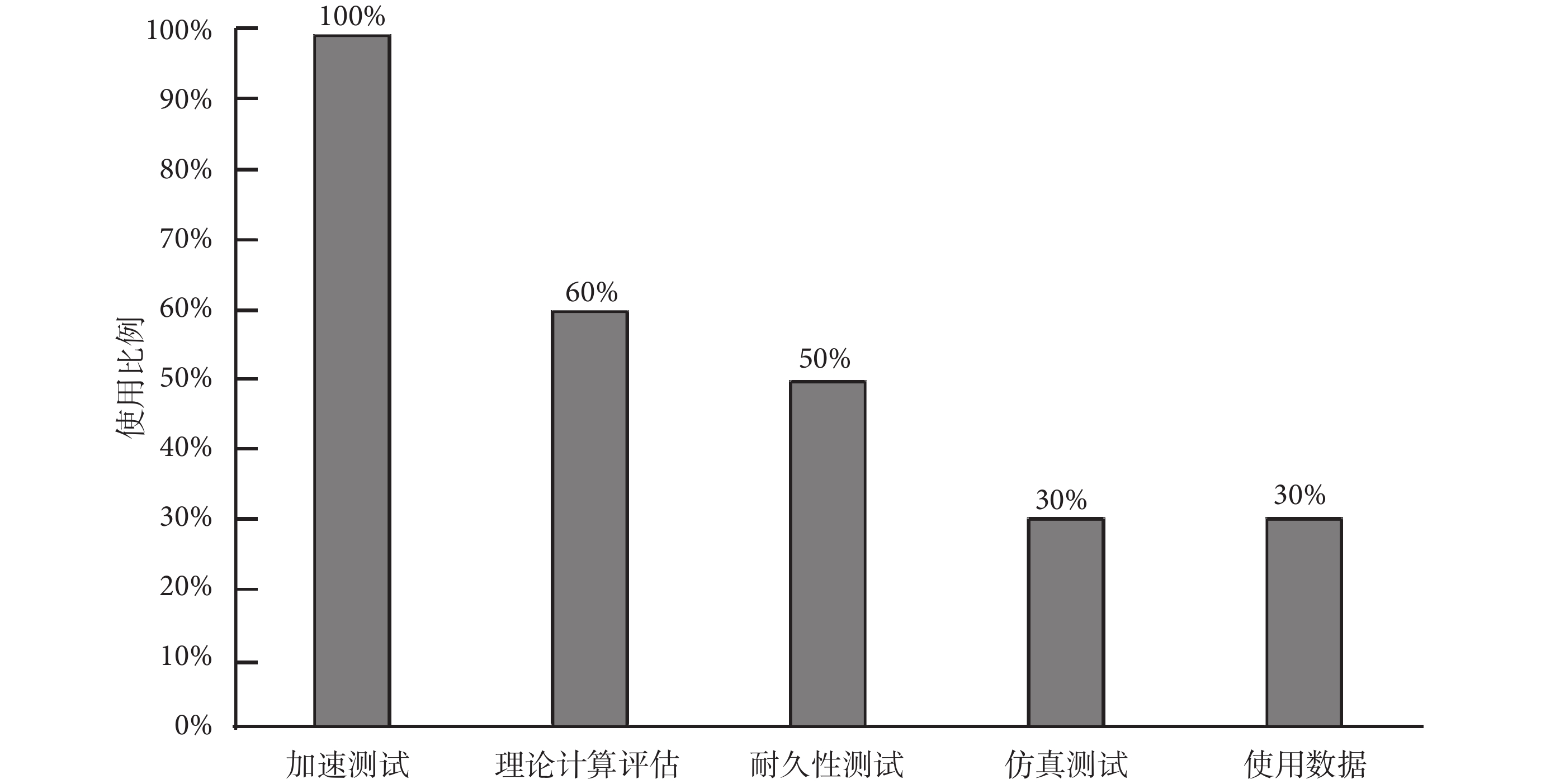
采用壽命作為使用期限指標時,企業常用的驗證方式在受訪審評中心中的占比情況如圖4所示,可以看出,采用最多的壽命驗證方式為加速測試(100%),占比排名2~排名5的驗證方式分別為理論計算評估(60%)、耐久性測試(50%)、仿真測試(30%)和使用數據(30%)。
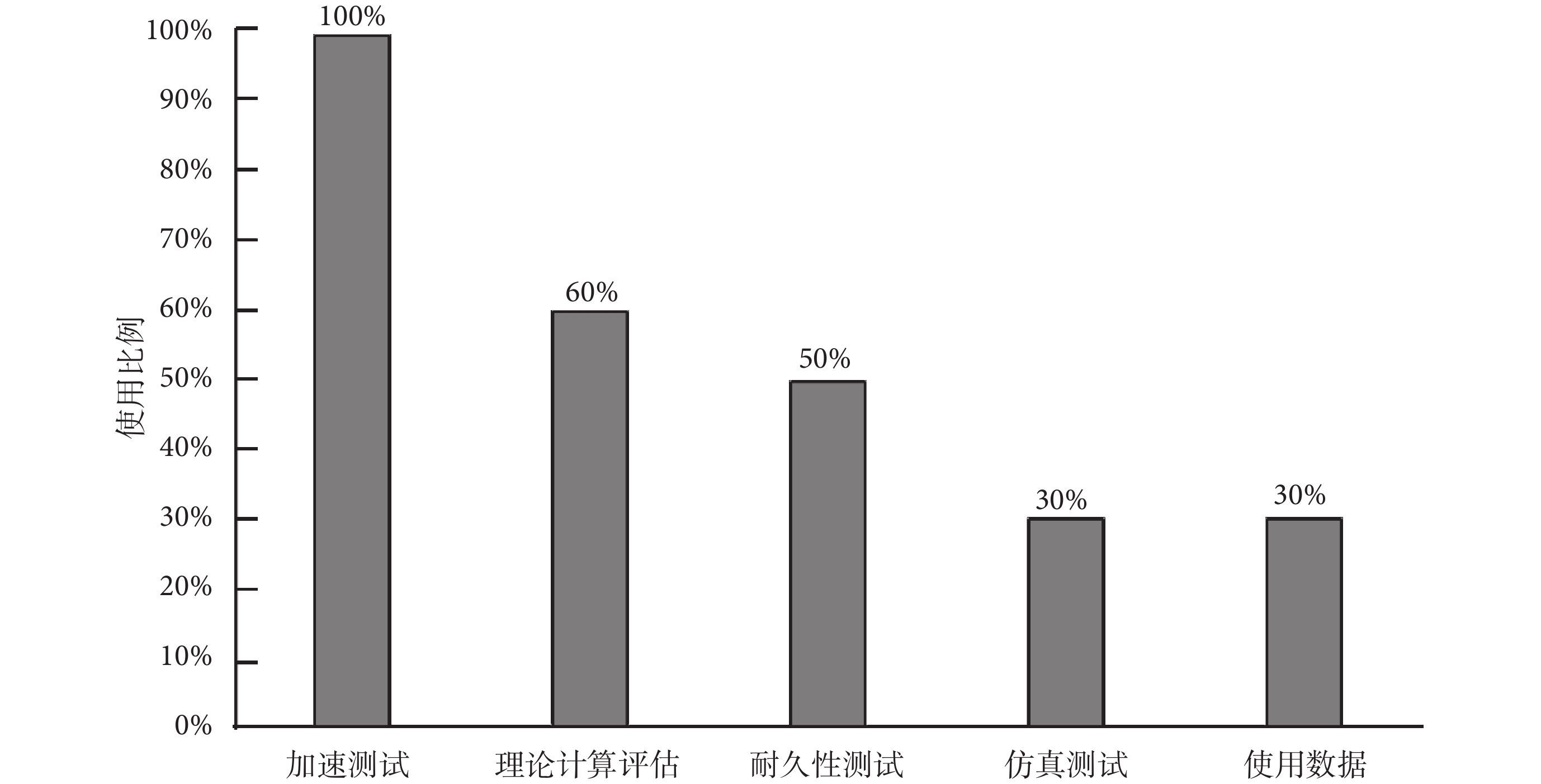 圖4
常用的壽命驗證方式情況
Figure4.
Situation of commonly used life verification methods
圖4
常用的壽命驗證方式情況
Figure4.
Situation of commonly used life verification methods
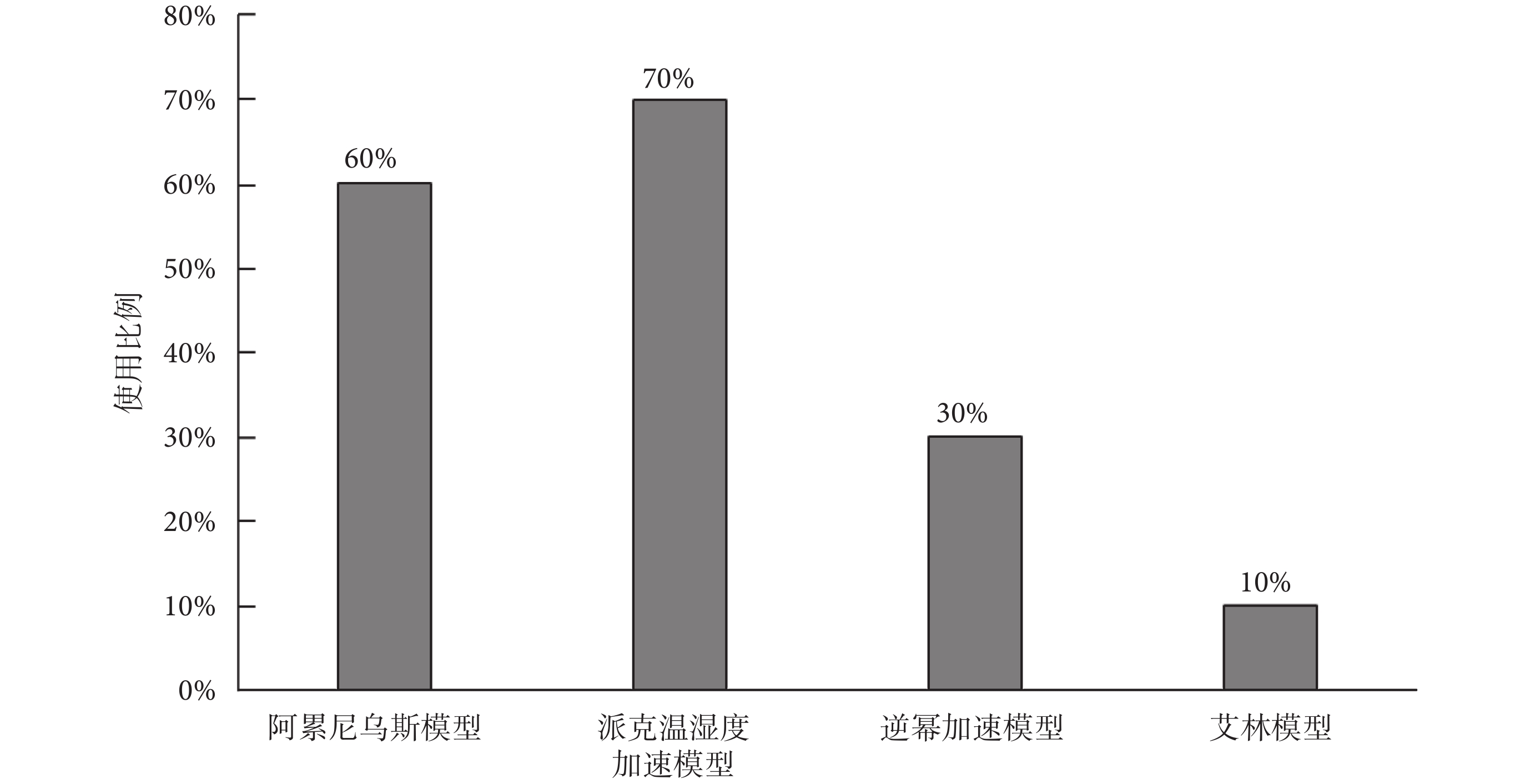
如圖5所示,受訪審評中心反饋,當企業利用加速測試開展壽命驗證時,一般常用的三類加速模型是阿累尼烏斯模型、派克溫濕度加速模型和逆冪加速模型,分別占比60%、70%和30%;還有一種較少使用的艾林模型,占比為10%。
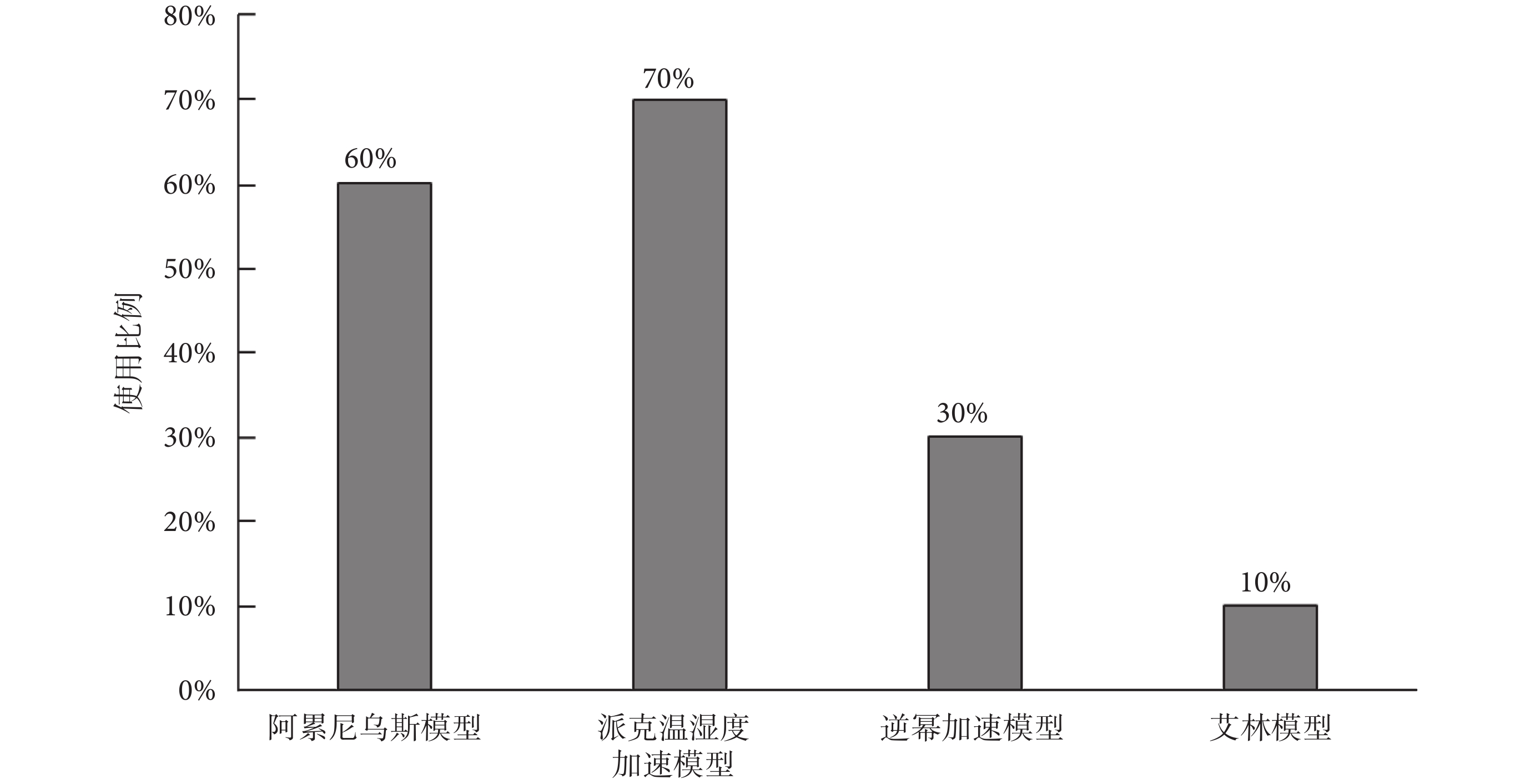 圖5
常用的加速模型情況
Figure5.
Situation of commonly used acceleration models
圖5
常用的加速模型情況
Figure5.
Situation of commonly used acceleration models
但是和審評員交流獲知,大多數企業針對加速模型及其參數并未提供任何適用性研究材料或說明。
采用MTBF作為使用期限指標的企業基本都是通過可靠性鑒定測試、可靠性評估測試或可靠性預計來開展相關指標驗證工作。
3.1.2 引用標準規范情況
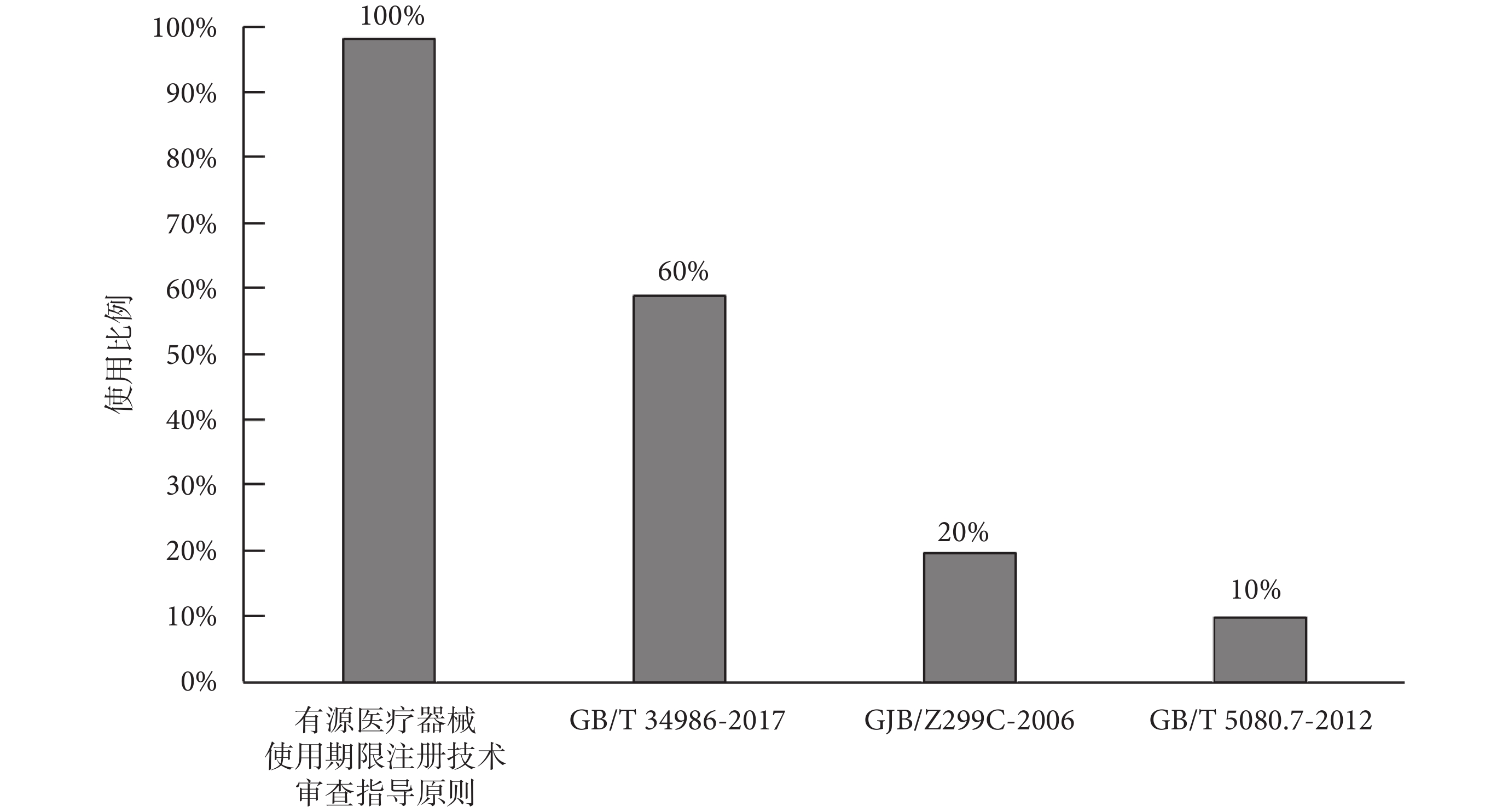
企業在開展產品使用期限研究時,經常會使用到的標準規范為《有源醫療器械使用期限注冊技術審查指導原則》[2]、《產品加速試驗方法》(GB/T 34986-2017)[37]、《電子設備可靠性預計手冊》(GJB/Z 299C-2006)[38]和《設備可靠性試驗恒定失效率假設下的失效率與平均無故障時間的驗證試驗方案》(GB/T 5080.7-2012)[39],分別占受訪審評中心的100%、60%、20%和10%,如圖6所示,《有源醫療器械使用期限注冊技術審查指導原則》和《產品加速試驗方法》(GB/T 34986-2017)是使用期限研究過程中,企業使用最多的兩個標準規范,除此之外,使用較多的標準規范基本為電工電子行業的標準。
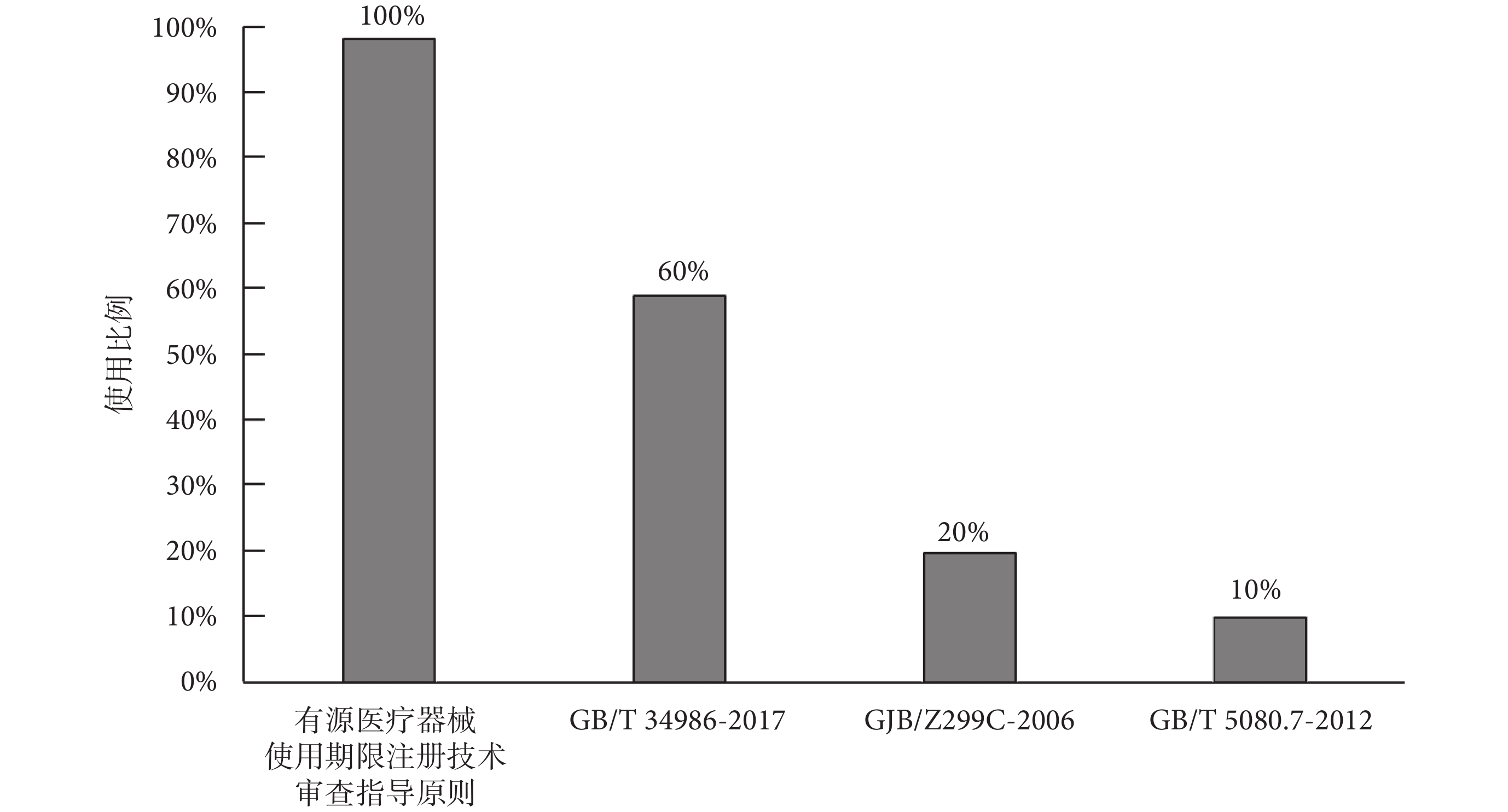 圖6
使用期限評價常用標準使用情況
Figure6.
Situation of commonly used standards for service life evaluation
圖6
使用期限評價常用標準使用情況
Figure6.
Situation of commonly used standards for service life evaluation
3.2 審評中心使用期限及可靠性材料審查情況
根據審評中心的調研情況得知,審評員基本依據《有源醫療器械使用期限注冊技術審查指導原則》[2]的要求對企業所提交的材料進行審評,一般主要審查企業申報材料是否有理有據、邏輯合理、結論明確,滿足以上條件的基本都可以通過,如果出現使用期限研究資料過于簡單、評價路徑或方法不清晰、數據前后矛盾或來源不明、原始記錄缺失等情況,審評中心一般會要求發補,但目前尚未出現因為使用期限評價而被退審的情況。
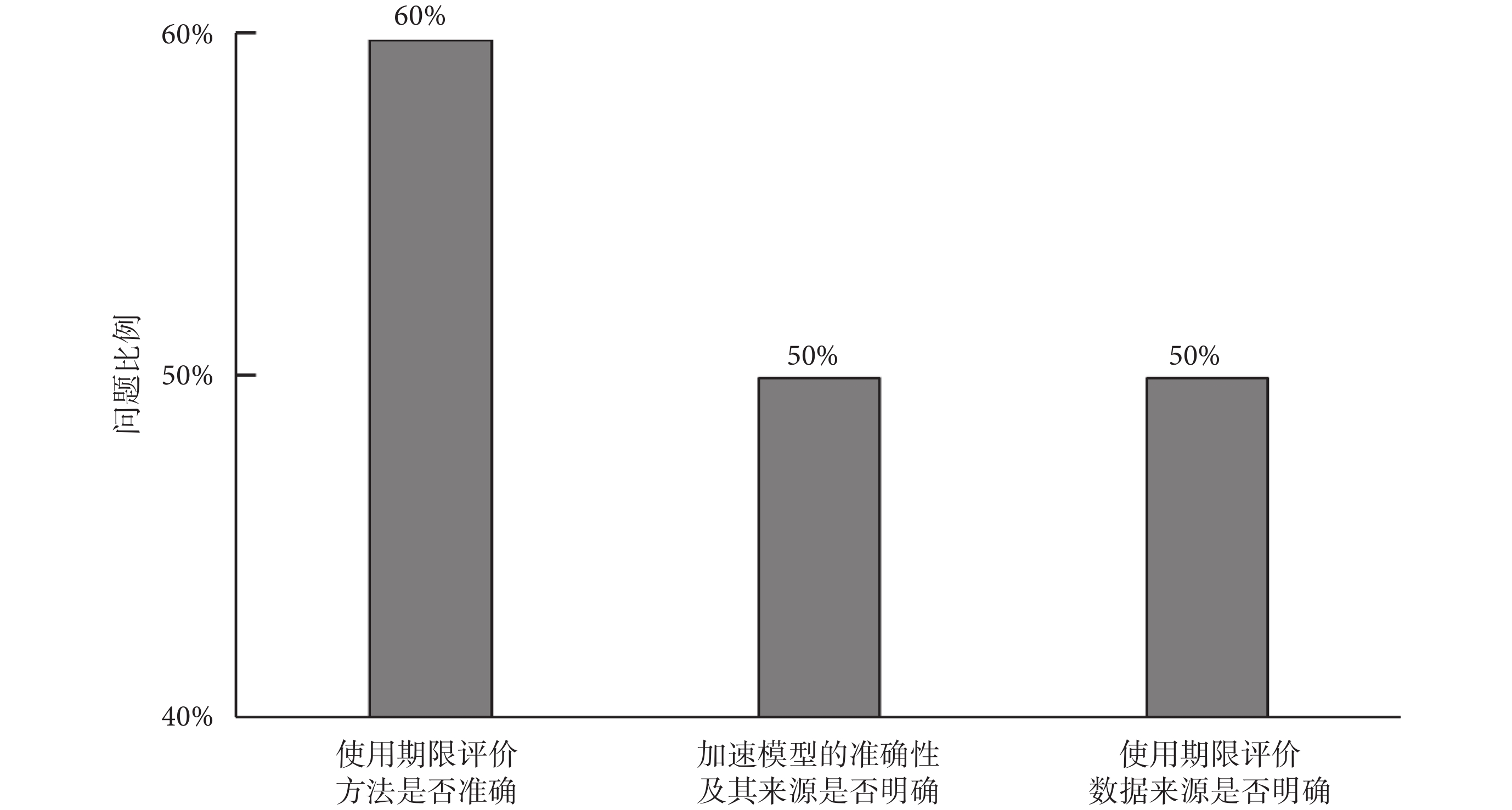
90%的受訪審評中心在審查使用期限材料的時候會存在困惑,困惑主要集中在使用期限評價方法是否準確、加速模型的準確性及其來源是否明確、使用期限評價數據來源是否明確這三個方面,分別占受訪審評中心60%、50%和50%,如圖7所示。
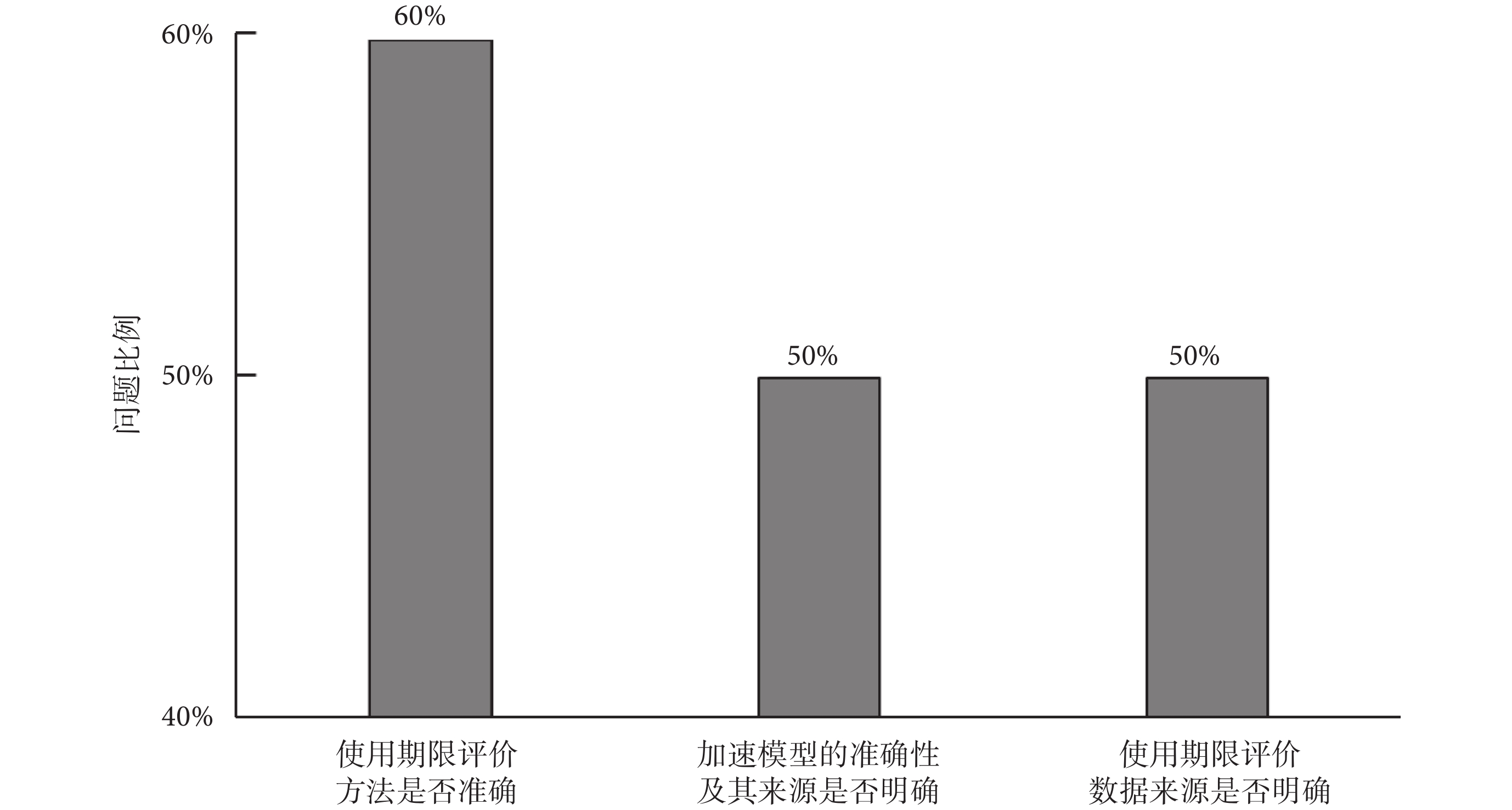 圖7
審評中心使用期限材料審評困惑情況
Figure7.
Confusion of service life evaluation material for the center for medical device evaluation
圖7
審評中心使用期限材料審評困惑情況
Figure7.
Confusion of service life evaluation material for the center for medical device evaluation
為了讓有源醫療器械使用期限及可靠性評價更加真實、嚴謹以及合理,受訪審評中心希望行業從以下幾個方面完善使用期限評價工作:① 按照《有源醫療器械使用期限注冊技術審查指導原則》[2]要求,分別建立不同評價方法的標準;② 針對有源醫療器械建立加速測試方法及其推薦模型庫;③ 根據不同種類產品的特點,建立對應的評價標準;④ 現場質量體系核查過程中關注申報產品使用期限研究和驗證過程;⑤ 研究制定不同類別產品的使用期限指導原則。
4 總結與展望
本文從行業情況和審評情況等維度對我國有源醫療器械可靠性工作及其監管現狀進行了調研分析,可以看出,我國有源醫療器械可靠性工作尚屬起步階段,行業針對可靠性技術在產品研發和監管上開展了初步的探索與應用,但是總體面臨著可靠性技術研究不足、標準體系缺乏、工作開展不充分和監管手段缺失等問題,導致國產有源醫療器械整體可靠性水平不高的問題尤為突出,嚴重影響產品的市場競爭力、產業的高質量發展以及相關政策、監管法規的執行效果。
為解決以上問題,我國有源醫療器械行業亟需圍繞可靠性工程管理、設計分析和測試評價等方向,形成可用于系統指導產品開發過程可靠性工作的指導原則,組建有源醫療器械可靠性標準化技術委員會(以下簡稱“標技委”)。從可靠性角度出發,以指導原則為導向,通過標技委統籌研究規劃,構建系統化的有源醫療器械可靠性標準體系,作為指導原則的詳細技術補充。從指導原則和標準體系兩個維度,構建有源醫療器械行業監管和技術兩個方向的工作規范,為監管部門以及相關企業系統開展可靠性監管審查和技術工作提供支撐,提高國產有源醫療器械的可靠性水平以及市場競爭力,推動實現我國醫療器械行業高質量發展的目標。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:朱嘉偉負責論文構思、撰寫及數據分析,楊雪鶴、鄭晨、楊鵬飛負責調研材料整理,李亞球、李騫負責論文修改及審校。
引言
我國有源醫療器械產業要實現高質量發展的目標,高可靠性水平是產品必須具備的質量特性,監管部門十分重視有源醫療器械安全有效評估,可靠性是安全有效評估的核心要素。我國出臺了《醫療器械監督管理條例》[1]、《有源醫療器械使用期限注冊技術審查指導原則》 [2]等文件,把使用期限與可靠性作為醫療器械審評、產品注冊等環節中必須考核的項目之一,推動了有源醫療器械行業及審評部門對器械研發可靠性的嚴控把關,由此引起了廣泛的關注。但是由于我國有源醫療器械面臨著可靠性設計、分析、驗證及監管等方法缺失的問題,嚴重影響行業及監管部門可靠性工作的系統開展,導致國產產品質量不穩定,失效率高、性能指標衰減快等問題突出,對國產產品市場競爭力和品牌形象產生極大的負面影響。基于此,本文旨在調查研究我國有源醫療器械行業、企業以及審評部門可靠性工作現狀和存在的問題情況,并基于調研結果提出具體的解決方向,為我國有源醫療器械行業可靠性工作的優化與推進提供參考與指導。
1 我國有源醫療器械政策及其可靠性現狀分析
1.1 我國有源醫療器械產業及監管政策情況分析
有源醫療器械是我國醫療器械產業實現轉型升級和高質量發展目標的關鍵領域,政府在政策上對有源醫療器械產業給與了較大的關注和扶持力度。如中華人民共和國國務院、工業和信息化部、科學技術部、國家藥品監督管理局等均明確將高性能醫療器械,如影像設備、醫用機器人、可穿戴設備等作為戰略產業發展方向,提出大力發展高性能醫療器械,加快醫療器械轉型升級[3-6]。
除了在產業發展提出頂層規劃與政策支持外,近幾年來,針對醫療器械產品質量可靠性及其全壽命周期的監管,政府也提出了具體的展望和要求。在行業規劃方面,《增強制造業核心競爭力三年行動計劃(2018-2020年)》[7]、《醫療裝備產業發展規劃(2021-2025年)》(征求意見稿)[8]等文件均提出要推動醫療器械升級換代和質量性能提升,提高產品穩定性和可靠性,使產品性能和質量達到國際水平;在行業監管方面,《醫療器械監督管理條例》、《醫療器械安全和性能基本原則》[9]、《醫療器械注冊管理辦法(修訂草案征求意見稿)》[10]和《有源醫療器械使用期限注冊技術審查指導原則》[2]等文件從不同的維度對醫療器械全壽命周期質量可靠性提出了具體的監管和審評要求,將醫療器械的質量可控與安全、有效放到同等重要的位置。
1.2 我國有源醫療器械行業可靠性現狀分析
經過多年的發展,我國有源醫療器械國產化進程取得了長足進步,發達國家能夠生產的有源醫療器械,我國基本上都能夠生產,但由于國產有源醫療器械在產品創新性、工藝穩定性、質量可控性與可靠性等方面與發達國家相比差距明顯,嚴重影響著國產有源醫療器械的市場競爭力[11]。以醫用超聲設備為例,國產品牌的國內市場份額約為45%,且集中在中低端產品,進口設備分別約占據了65%和90%的中、高端產品市場份額,原因主要是國產設備的可靠性不足所致(國產設備年均故障率約為20%)。其他高端醫療器械如電子計算機斷層掃描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)和核醫學影像設備等也由于可靠性問題,國產品牌占有率亦較低。
雖然從國家政策和行業監管層面上均對醫療器械的質量可靠性提出了具體的愿景和要求,但國產有源醫療器械在可靠性上還是存在著比較突出的問題,且我國有源醫療器械可靠性研究尚處于起步階段,行業面臨著可靠性評價及監管方法、技術及標準體系缺失等問題[12],嚴重影響著國產有源醫療器械可靠性的提升以及政策、監管法規的落實與執行效果。
1.3 我國有源醫療器械行業可靠性研究工作開展情況
由于行業發展和監管都對可靠性提出了強烈的技術需求,近幾年國內有源醫療器械從業人員針對可靠性陸續開展了一些研究與應用工作。
在可靠性工程管理方面,宋國正等[13]分析了國產MRI可靠性不足的原因,給出了可靠性保障管理工作的建議。郁紅漪等[14]對醫用電氣設備在可靠性上存在的問題進行了梳理分析,提出了可靠性工作的要點。李天慶等[15]分析了影響呼吸機使用可靠性的關鍵因素,提出了提高呼吸機運行可靠性的應對措施。吳維民等[16]通過統計學分析,構建了一套醫療器械使用質量評價指標體系。
在可靠性設計分析方面,高治理[17]對醫療器械機械可靠性設計的概念、方法及數學模型作了初步的調研和討論。曾梓軒[18]對尿道閥進行了故障模式、影響及危害性分析(failure mode effects and criticality analysis,FMECA)和故障樹分析(fault tree analysis,FTA),找出了危害性大的故障模式。金海哲等[19]提出一種基于改進FMECA的醫療器械人因可靠性評估方法,解決了傳統風險系數數值重復與權重分配問題。劉瑞達[20]對微創手術機器人傳動系統可靠性問題進行了系統的故障模式及影響分析。李萍等[21]分析了認知可靠性與錯誤分析方法的概念、特點及使用流程。劉相花等[22]利用FMECA對呼吸機部件進行了失效危害度變化研究。吳家海[23]應用FMECA和FTA對下肢助行外骨骼機器人進行了可靠性分析,得到其高風險故障模式與薄弱部位。石佩茹[24]利用模糊理論和非線性組合賦權法,對血細胞分析儀進行了可靠性分配方法研究。馮忠強[25]利用文本挖掘與FMECA相結合的方法對直線加速器加速管開展了可靠性分析。
在可靠性測試評價方面,李楠等[26]針對正電子發射計算機斷層顯像提出以整機系統分解為子系統/部件的評價思路,研究了各子系統/部件的可靠性指標評價方法。牟鵬濤等[27-28]以全自動生化分析儀為例研究了一種加速疲勞測試方法。王宇帆等[29]從注冊審評法規的角度出發,討論了影響有源醫療器械產品壽命的因素。鄧振進等[30]運用加速測試方法對高流量濕化氧療裝備的有效期進行了評價。鄭晨等[31]探討了有源醫療器械使用期限的定義、適用原則和評價方法。李娟等[32]提出了驗證醫用制氧機使用期限的基本方法與思路,研究了影響制氧機使用期限的因素。官輝等[33]從產品有效期及壽命的影響因素入手,提出了有效期預計及加速壽命測試的方法。傅金德等[34]從監管與檢測角度出發,分析了有源醫療器械使用期限驗證方法。張文忠[35]探討了醫療器械硬件板卡可靠性故障激發測試方法。
可以看出,目前國內有源醫療器械行業針對可靠性技術開展了初步研究與應用,主要集中在可靠性設計分析和測試評價上,使用期限評價是行業可靠性工作的重點。總體來說,目前行業存在著方法不系統、不完善等問題,嚴重影響著相關可靠性工作的開展效果。
2 有源醫療器械企業可靠性工作現狀調研
2.1 有源醫療器械企業調研結果分析
為了了解我國有源醫療器械企業可靠性工作的實際開展情況,本文以可靠性工程管理、設計分析和測試評價為方向,通過實地拜訪、問卷調查、線上交流和文件材料查閱等方式對22個在我國注冊經營的國內外有源醫療器械企業(其中外企3個,國內企業19個)的可靠性工作現狀進行了系統的調研,具體的結果分析情況如下。
2.1.1 可靠性工程管理
本部分從企業全壽命周期可靠性工作流程體系建立、專門的可靠性人員/部門設置、可靠性及使用期限指標要求確定、供應商管理和上市后可靠性監控等五個方面調研了解企業在可靠性工程管理的開展情況,各項工作的具體占比如圖1所示。
 圖1
可靠性工程管理開展情況
Figure1.
Situation of reliability engineering management
圖1
可靠性工程管理開展情況
Figure1.
Situation of reliability engineering management
(1)全壽命周期可靠性工作流程體系建立
有41%的企業針對產品全壽命周期可靠性工作建立了完善的流程體系,主要集中在外企和規模較大的國內企業,大多都是對產品開展了多年可靠性研究并在產品可靠性上積累了豐富經驗的企業。其余大部分企業只開展了零散的可靠性工作,如可靠性測試、可靠性數據分析等,沒有針對可靠性建立一套成體系的工作流程。
(2)專門的可靠性人員/部門設置
55%的企業設置了專門的可靠性技術人員或部門從事產品的可靠性工作,其他受訪企業一般以兼職的形式讓產品工程師承擔開發過程中相關可靠性設計、分析與驗證等工作,也有部分企業僅在最后產品驗證階段讓質量檢測工程師兼任可靠性測試工作。
(3)可靠性及使用期限指標要求確定
由于《有源醫療器械使用期限注冊技術審查指導原則》[2]的頒布,受訪企業基本都針對可靠性及使用期限制定了明確的指標,超過70%的受訪企業直接以使用期限作為量化考核的可靠性指標,只有少部分企業(約30%,基本為外企和較大型的國內企業)會針對不同的應用需求,使用其他指標[如平均無故障工作時間(mean time between failure,MTBF)、失效率等]來作為產品的可靠性要求。
(4)供應商管理
受訪企業基本都對供應商建立了管理辦法,對關鍵部件或者易損件都提出了具體的可靠性要求。供應商一般會被要求提供測試或者統計數據分析報告來證明可靠性指標,要求高的企業還會對供應商進行質量體系稽核,對部件供應商是醫療器械企業的,還要求獲得《醫療器械質量管理體系用于法規的要求》(YY/T0287-2017)[36]的體系認證及產品注冊批準。部分規模較大的企業(基本為外企)還會對產品上市后暴露出可靠性問題的部件退回供應商,并要求供應商提供故障研究分析報告并加以改進。
(5)上市后可靠性監控
受訪企業基本都會通過收集故障信息來了解產品上市后的可靠性情況,一般收集維修/維護記錄、備件更換信息、不良事件、客戶反饋等信息來作為統計分析產品上市后可靠性水平的依據。與進口產品相比,國產產品在用數量不多和使用時間不長,導致大部分的受訪國內企業所獲得的故障數據并不特別充分,而且絕大部分的企業未能按照系統的數學統計方法對產品進行相關可靠性分析,對比來說外企在故障信息收集與統計分析上做得比較充分。
2.1.2 可靠性設計分析
在可靠性設計分析方面,主要從系統的產品可靠性設計、維修性設計、FMECA和仿真分析等四個方面去調研企業的開展情況,各項工作的具體占比如圖2所示。
 圖2
可靠性設計分析開展情況
Figure2.
Situation of reliability design and analysis
圖2
可靠性設計分析開展情況
Figure2.
Situation of reliability design and analysis
(1)系統的產品可靠性設計
可靠性設計工作一般包含可靠性預計、分配、熱設計、振動設計、降額設計等。有36%的受訪企業針對產品開展了系統的可靠性設計工作(基本為外企和規模較大的國內企業),大部分受訪企業只是蜻蜓點水地開展了部分可靠性設計工作,而且開展時也未對產品具體的設計和使用環境特點進行分析,在研發過程中所開展的可靠性設計工作非常有限。
(2)維修性設計
在受訪企業中,目前能夠針對有源醫療器械產品開展維修性設計的比例較低,只有23%,維修性設計開展比較全面的基本為外企,對于國產有源醫療器械來說維修性設計還處于起步階段,絕大部分的國內企業尚未開展產品維修性設計方面的工作,導致國產有源醫療器械維修性水平不高,由此降低了產品維修效率,直接影響產品的可用度水平。
(3)FMECA
32%的企業對產品開展了FMECA工作,基本為外企,受訪企業中開展FMECA工作的國內企業占比較少,FMECA工作在國內有源醫療器械企業中尚屬于起步階段。
(4)仿真分析
受訪企業中能夠利用仿真手段對產品開展可靠性分析的比例為32%,一般會在機械運動分析、熱分析、振動分析、疲勞強度、壽命或使用期限評價等方面開展仿真工作。利用仿真開展可靠性設計分析和指標驗證的受訪企業中大多數為國內企業,外企利用仿真手段對使用期限、壽命和可靠性指標進行驗證的情況較少,一般僅用于產品的設計分析工作。
2.1.3 可靠性指標驗證
針對產品可靠性指標驗證,由于法規要求企業必須在有源醫療器械產品注冊時提供使用期限或有效期的分析驗證報告,并出臺了《有源醫療器械使用期限注冊技術審查指導原則》[2],因此全部受訪企業均以使用期限為對象針對產品開展了可靠性指標驗證工作,主要利用了仿真/預計/模型計算、上市數據/同類過往產品分析、耐久/壽命測試、可靠性鑒定測試、加速測試等五種方法對可靠性指標開展驗證,可靠性指標驗證方法的具體占比情況如圖3所示。
 圖3
可靠性指標驗證方式情況
Figure3.
Situation of verification method for reliability index
圖3
可靠性指標驗證方式情況
Figure3.
Situation of verification method for reliability index
(1)仿真/預計/模型計算
有32%的受訪企業采用仿真/預計/模型計算的方式去驗證產品或產品關鍵部件的可靠性指標,通過調研了解到,一般企業會針對無法通過測試驗證或者缺乏過往使用數據的產品和部件使用仿真/預計/模型計算的方式去驗證可靠性指標,但是企業也只會在了解具體的仿真或計算模型的條件下才會使用此方式,而模型或者預計數據的準確性與真實產品的差距是比較難確認的,所以企業一般較少采用此種方式去開展可靠性指標驗證工作。
(2)上市數據/同類過往產品分析
有68%的受訪企業采用上市數據/同類過往產品分析的方式去驗證可靠性指標,但是不同企業之間也存在著可用于評估分析數據量的差異,例如上市產品數量少的企業,會面臨缺乏數據的情況,導致分析出來的可靠性指標結果統計意義不大,大公司由于上市產品數量多、評估數據豐富,分析出來的可靠性指標結果統計意義會比較高。因此,不同規模企業通過上市數據/同類過往產品分析的方式所獲得的可靠性指標在真實性上存在著較大的差異。
(3)耐久/壽命測試
64%的受訪企業利用耐久/壽命測試的方式開展產品可靠性指標驗證,一般會針對整機、運動部件(如滑環、掃描架、床等)、關鍵部件(如球管、探測器、連接器等)等開展耐久/壽命測試。對于植入類有源醫療器械、企業都會采取此方式開展可靠性指標驗證。耐久/壽命測試一般驗證結果的真實性和可信性都比較高,但需要耗費一定的測試和樣品成本。
(4)可靠性鑒定測試
只有18%的受訪企業利用可靠性鑒定測試開展指標驗證工作,開展比例低的主要原因是受訪企業較少使用如MTBF、失效率等傳統可靠性指標,且大多數受訪的國內企業對傳統可靠性指標理解不深入,相比之下一般外企理解得比較清楚,而且外企還會從壽命和MTBF兩個維度來確定產品可靠性指標。
(5)加速測試
由于有源醫療器械在注冊時宣稱的使用期限一般都是以年計算,因此加速測試是受訪企業中采用得相對較多且比較受歡迎的可靠性指標驗證手段,有68%的受訪企業采用此方式開展指標驗證工作。影響加速測試結果準確性的主要是加速測試模型,但是絕大部分的受訪企業基本都是直接套用別的產品的加速模型,對于所使用的模型及其參數的適用性大多都未經過研究驗證,導致加速測試結果的準確性存疑。
2.2 國內有源醫療器械企業調研總結
從以上調研統計結果可以看出,雖然在《有源醫療器械使用期限注冊技術審查指導原則》[2]和相關法規要求的推動下,國內有源醫療器械企業已經形成了產品可靠性意識,絕大部分的國內企業也都針對產品開展了部分可靠性工作,但基本都是不成體系、蜻蜓點水式的,目前國內有源醫療器械企業可靠性工作主要存在以下問題:
(1)缺乏系統的可靠性管理體系
從調研結果來說,雖然大部分的國內有源醫療器械企業都針對產品開展了可靠性工程管理工作,但是絕大多數國內企業尚未形成一套系統的管理體系來對可靠性工作進行統籌、規劃、執行和評審,勢必會導致可靠性工作效果大打折扣。
(2)可靠性設計分析工作沒有得到重視
設計分析工作在國內有源醫療器械行業尚未引起普遍且足夠的重視,從調研統計數據上看,各項可靠性設計分析工作開展比例都不高,如果這種情況得不到改變,勢必嚴重影響國產有源醫療器械產品的可靠性水平。
(3)可靠性測試不充分、方法不規范
由于缺乏專業的可靠性人才或專門的部門,大多數企業對可靠性測試理論和標準理解不全面、不到位,導致所采用的可靠性測試方法不規范,在加速測試的使用上問題尤為突出,基本都是直接套用其他產品的加速模型和參數,大多數企業未對加速模型的適用性開展過研究,導致加速測試結論的可信性大打折扣。除此之外,由于國內企業在產品前期開發階段的可靠性測試開展不充分,導致產品潛在薄弱環節得不到徹底暴露和整改,嚴重影響產品的固有可靠性水平。
3 有源醫療器械使用期限及可靠性審評工作現狀調研分析
為了了解審評中心在審查企業使用期限及可靠性材料的具體情況,本文從企業評價方法、審評中心審查方法和存在的困惑、困難等方面,通過實地拜訪、問卷調查和線上交流等方式,對10個審評中心的有源醫療器械使用期限及可靠性審評工作情況進行了調研。
3.1 企業使用期限及可靠性證明材料情況
通過審評中心調研得知,企業在開展使用期限評價時,基本會采用壽命或MTBF作為產品的使用期限指標,一般按照《有源醫療器械使用期限注冊技術審查指導原則》[2]所提出的方法通過整機或者拆分關鍵部件的方式來開展使用期限評價,具體情況如下:
3.1.1 使用期限及可靠性指標
100%的審評中心反饋企業基本都會采用壽命來表征產品的使用期限,有30%的審評中心反饋有企業還會采用MTBF來表征產品的使用期限。
采用壽命作為使用期限指標時,企業常用的驗證方式在受訪審評中心中的占比情況如圖4所示,可以看出,采用最多的壽命驗證方式為加速測試(100%),占比排名2~排名5的驗證方式分別為理論計算評估(60%)、耐久性測試(50%)、仿真測試(30%)和使用數據(30%)。
 圖4
常用的壽命驗證方式情況
Figure4.
Situation of commonly used life verification methods
圖4
常用的壽命驗證方式情況
Figure4.
Situation of commonly used life verification methods
如圖5所示,受訪審評中心反饋,當企業利用加速測試開展壽命驗證時,一般常用的三類加速模型是阿累尼烏斯模型、派克溫濕度加速模型和逆冪加速模型,分別占比60%、70%和30%;還有一種較少使用的艾林模型,占比為10%。
 圖5
常用的加速模型情況
Figure5.
Situation of commonly used acceleration models
圖5
常用的加速模型情況
Figure5.
Situation of commonly used acceleration models
但是和審評員交流獲知,大多數企業針對加速模型及其參數并未提供任何適用性研究材料或說明。
采用MTBF作為使用期限指標的企業基本都是通過可靠性鑒定測試、可靠性評估測試或可靠性預計來開展相關指標驗證工作。
3.1.2 引用標準規范情況
企業在開展產品使用期限研究時,經常會使用到的標準規范為《有源醫療器械使用期限注冊技術審查指導原則》[2]、《產品加速試驗方法》(GB/T 34986-2017)[37]、《電子設備可靠性預計手冊》(GJB/Z 299C-2006)[38]和《設備可靠性試驗恒定失效率假設下的失效率與平均無故障時間的驗證試驗方案》(GB/T 5080.7-2012)[39],分別占受訪審評中心的100%、60%、20%和10%,如圖6所示,《有源醫療器械使用期限注冊技術審查指導原則》和《產品加速試驗方法》(GB/T 34986-2017)是使用期限研究過程中,企業使用最多的兩個標準規范,除此之外,使用較多的標準規范基本為電工電子行業的標準。
 圖6
使用期限評價常用標準使用情況
Figure6.
Situation of commonly used standards for service life evaluation
圖6
使用期限評價常用標準使用情況
Figure6.
Situation of commonly used standards for service life evaluation
3.2 審評中心使用期限及可靠性材料審查情況
根據審評中心的調研情況得知,審評員基本依據《有源醫療器械使用期限注冊技術審查指導原則》[2]的要求對企業所提交的材料進行審評,一般主要審查企業申報材料是否有理有據、邏輯合理、結論明確,滿足以上條件的基本都可以通過,如果出現使用期限研究資料過于簡單、評價路徑或方法不清晰、數據前后矛盾或來源不明、原始記錄缺失等情況,審評中心一般會要求發補,但目前尚未出現因為使用期限評價而被退審的情況。
90%的受訪審評中心在審查使用期限材料的時候會存在困惑,困惑主要集中在使用期限評價方法是否準確、加速模型的準確性及其來源是否明確、使用期限評價數據來源是否明確這三個方面,分別占受訪審評中心60%、50%和50%,如圖7所示。
 圖7
審評中心使用期限材料審評困惑情況
Figure7.
Confusion of service life evaluation material for the center for medical device evaluation
圖7
審評中心使用期限材料審評困惑情況
Figure7.
Confusion of service life evaluation material for the center for medical device evaluation
為了讓有源醫療器械使用期限及可靠性評價更加真實、嚴謹以及合理,受訪審評中心希望行業從以下幾個方面完善使用期限評價工作:① 按照《有源醫療器械使用期限注冊技術審查指導原則》[2]要求,分別建立不同評價方法的標準;② 針對有源醫療器械建立加速測試方法及其推薦模型庫;③ 根據不同種類產品的特點,建立對應的評價標準;④ 現場質量體系核查過程中關注申報產品使用期限研究和驗證過程;⑤ 研究制定不同類別產品的使用期限指導原則。
4 總結與展望
本文從行業情況和審評情況等維度對我國有源醫療器械可靠性工作及其監管現狀進行了調研分析,可以看出,我國有源醫療器械可靠性工作尚屬起步階段,行業針對可靠性技術在產品研發和監管上開展了初步的探索與應用,但是總體面臨著可靠性技術研究不足、標準體系缺乏、工作開展不充分和監管手段缺失等問題,導致國產有源醫療器械整體可靠性水平不高的問題尤為突出,嚴重影響產品的市場競爭力、產業的高質量發展以及相關政策、監管法規的執行效果。
為解決以上問題,我國有源醫療器械行業亟需圍繞可靠性工程管理、設計分析和測試評價等方向,形成可用于系統指導產品開發過程可靠性工作的指導原則,組建有源醫療器械可靠性標準化技術委員會(以下簡稱“標技委”)。從可靠性角度出發,以指導原則為導向,通過標技委統籌研究規劃,構建系統化的有源醫療器械可靠性標準體系,作為指導原則的詳細技術補充。從指導原則和標準體系兩個維度,構建有源醫療器械行業監管和技術兩個方向的工作規范,為監管部門以及相關企業系統開展可靠性監管審查和技術工作提供支撐,提高國產有源醫療器械的可靠性水平以及市場競爭力,推動實現我國醫療器械行業高質量發展的目標。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:朱嘉偉負責論文構思、撰寫及數據分析,楊雪鶴、鄭晨、楊鵬飛負責調研材料整理,李亞球、李騫負責論文修改及審校。