近年來,可穿戴設備迎來了蓬勃發展,將可穿戴設備與臨床結合是其重要的發展方向。本研究的目的是通過可穿戴設備連續監測心臟瓣膜手術患者在術前六分鐘步行試驗(6MWT)過程中的呼吸生理參數,建立術后肺部并發癥(PPCs)預測模型。納入四川大學華西醫院心臟大血管外科53名心臟瓣膜疾病患者,以術后是否出現PPCs作為分組依據,分析SensEcho可穿戴設備采集的6MWT連續呼吸生理參數,計算呼吸參數和血氧飽和度參數的組間差異,并構建預測模型。結果顯示使用可穿戴設備連續性監測6MWT中呼吸生理參數對心臟瓣膜手術患者PPCs具有較好的預測趨勢。本研究為可穿戴設備與臨床結合提供了一種新型參考模式。
引用本文: 王渝強, 王佳晨, 張健, 羅澤汝心, 郭應強, 張政波, 喻鵬銘. 基于可穿戴六分鐘步行系統預測心臟瓣膜手術術后肺部并發癥的探索性研究. 生物醫學工程學雜志, 2023, 40(6): 1117-1125. doi: 10.7507/1001-5515.202305007 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
心臟手術后10%~25%的患者會出現術后肺部并發癥(postoperative pulmonary complications,PPCs)[1-2],會顯著降低患者的功能能力,增加短期和長期死亡率[3],還會使患者住院費用顯著增加,停留重癥監護病房和住院的時間延長[4]。因此,術前對接受心臟瓣膜手術患者進行PPCs相關風險評估,對臨床治療方案的制定、預后的判斷、并發癥的預測、治療效果的評價以及醫療資源需求的估計等方面具有重要作用。目前臨床通常采用六分鐘步行測試(6-Minute Walk Test,6MWT)判斷患者心肺功能和預后,在一定程度上有助于預測PPCs[5]。然而,在實際臨床應用中,大多數只關注六分鐘步行距離(6-Minute Walk Test Distance,6MWD)這一靜息指標,尚未關注步行過程中連續呼吸生理數據中隱含的生理和病理信息,這可能會忽視早期的惡化跡象而發生不良事件[6]。造成這種現狀的一個重要因素就是目前缺少成熟的6MWT過程監測與記錄手段以及相關的臨床研究,無法明確6MWT過程中的連續動態生理信號與PPCs的關系。然而,生理參數的變化與患者的身體狀態緊密相關。AL-Khalidi等[7]的研究表明呼吸參數的頻繁改變反映了受損的心肺和神經功能。即使是輕度呼吸異常的患者都存在發生呼吸衰竭的風險。因此,對心臟手術患者在6MWT過程中實施呼吸參數的實時動態監測對臨床醫生和護理人員來說都勢在必行。
近年來,可穿戴設備已逐步應用于臨床領域,尤其是新冠疫情的暴發進一步推動了可穿戴設備在疾病管理中的發展與應用。目前大多數商用可穿戴設備已經可以提供心率、血氧以及耗能等相對準確的信息以反映身體活動情況[8]。Cheong等[9]的綜述發現使用基于生理特征的偏差,利用可穿戴設備結合人工智能統計分析技術建立了可以及早發現COVID-19感染的異常檢測模型,其受試者操作特征(receiver operating characteristic,ROC)曲線的陽性檢出率可達75%~94.4%。此外,國際領先的Apple Watch也正聚焦于基于生理信號的房顫檢測研究[10]。Escobar-Linero等[11]檢索近十年文獻發現可穿戴設備已大量應用于心血管系統事件和呼吸系統事件等。這些都表明目前可穿戴設備正在加速向與臨床應用結合的方向邁進。
綜上所述,本研究設想能夠通過可穿戴六分鐘步行試驗系統收集6MWT過程中的連續呼吸生理數據和血氧數據并對心臟瓣膜手術患者PPCs進行預測,發展PPCs預測模型,檢驗特征參數和模型的有效性并分析探索其臨床應用價值。
1 資料與方法
1.1 研究對象
納入2021年8月至2022年1月在四川大學華西醫院心臟大血管外科單一醫療團隊進行胸骨正中切開心臟瓣膜手術患者。所有參與者均取得了書面知情同意書。排除標準為:① 急診手術;② 滿足6MWT禁忌癥[5];③ 因不良事件或其他不可預見的情況而被迫終止;④ 可穿戴設備發出的信號不可讀或質量差。最終符合上述標準的患者共53例。根據是否出現PPCs將患者分為非術后肺部并發癥組(No-PPCs)和術后肺部并發癥組(PPCs)。
1.2 監測設備
本研究中使用的六分鐘步行系統是基于醫療級可穿戴設備SensEcho(見圖1)(海思瑞格科技有限公司,北京,已獲得中國食品藥品監督管理局認證)研制的數字化六分鐘步行系統[12-13],可以采集六分鐘步行試驗前-中-后的連續生理數據,包括胸呼吸、腹呼吸、單導聯心電、血氧飽和度、體位和體動等信號。
 圖1
SensEcho可穿戴設備
Figure1.
The SensEcho wearable device
圖1
SensEcho可穿戴設備
Figure1.
The SensEcho wearable device
1.3 監測流程以及數據預處理與特征提取
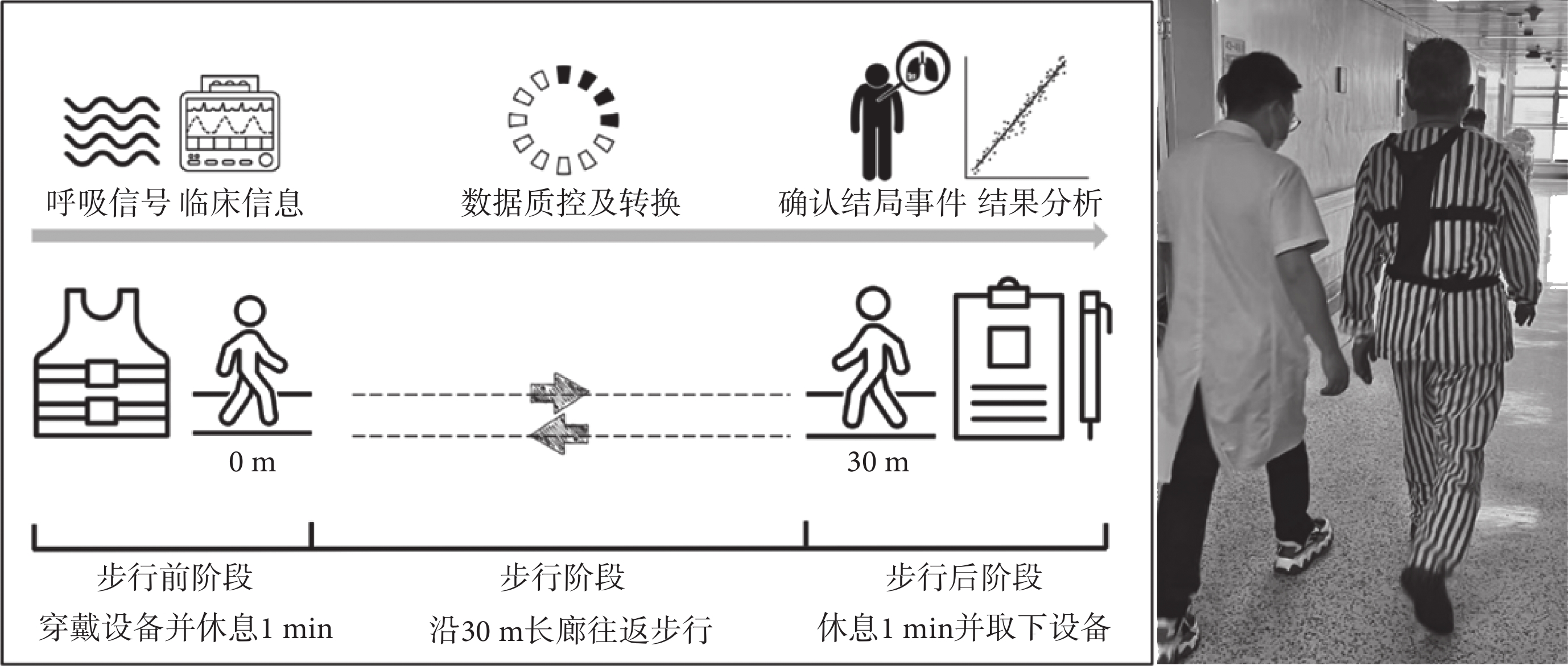
根據時間對6MWT進行階段劃分:步行開始前1 min為靜息階段;步行過程中為步行階段;步行結束后1 min為恢復階段。本研究統一設定為術前一天進行6MWT。進行測試前,將SensEcho穿戴在每位患者身上。隨后,在6MWT開始前1 min保持坐立靜息狀態,采集靜息階段生理數據,之后患者在物理治療師指導下,根據美國胸科學會指南[5]標準方案完成6MWT(見圖2)。如果出現以下任何癥狀:胸痛、意識喪失、無法忍受的呼吸困難、跌倒、大汗淋漓和面色蒼白,則終止步行測試,將之解釋為無法全程獨立完成步行測試并排除。步行結束后要求患者繼續穿戴SensEcho設備并保持坐立靜息狀態1 min,采集恢復階段連續生理數據。
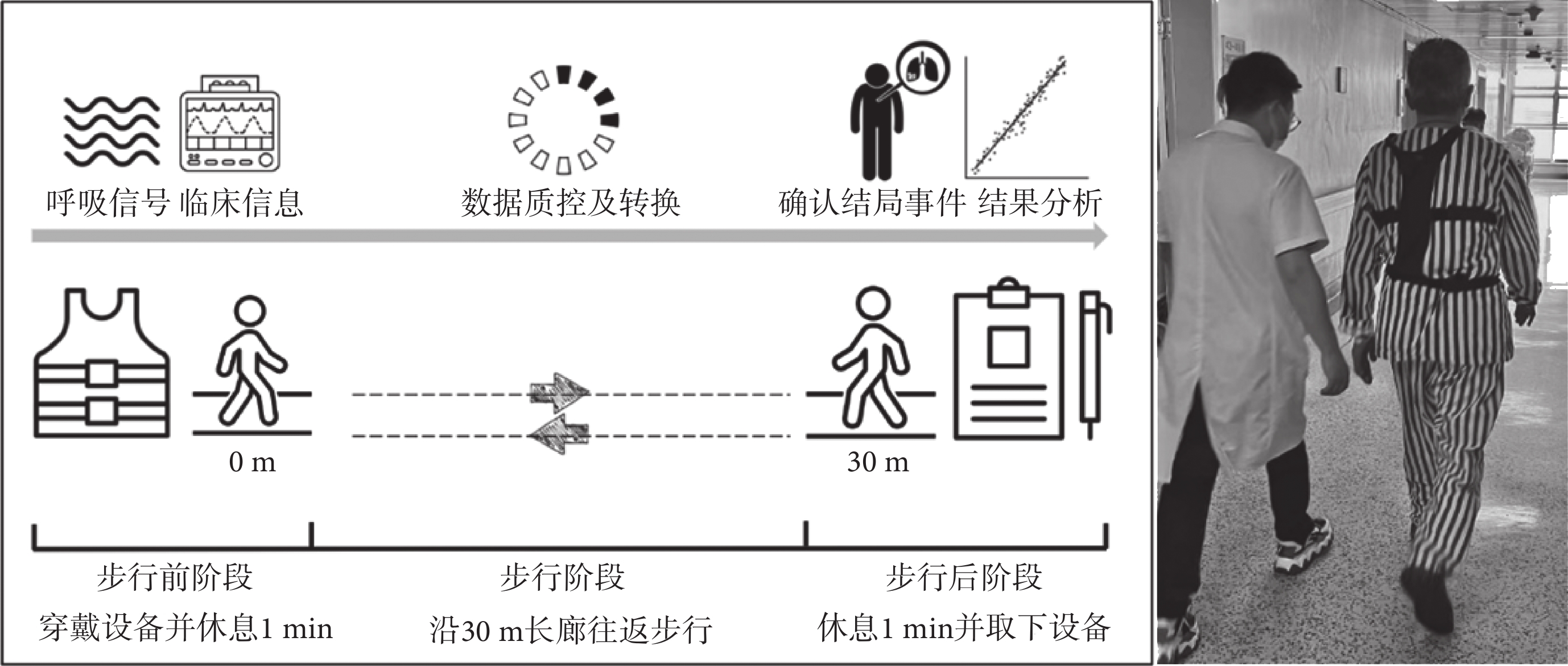 圖2
6MWT及連續性呼吸生理監測流程
Figure2.
6MWT and continuous respiratory physiology monitoring process
圖2
6MWT及連續性呼吸生理監測流程
Figure2.
6MWT and continuous respiratory physiology monitoring process
數據采集完畢后,進行處理分析。SensEcho設備可同步記錄患者心電信號,但一方面考慮到現有樣本量無法同時滿足納入呼吸信號以及心電信號進行數據建模分析;另一方面,本研究主要目的為監測呼吸生理信號以識別異常呼吸生理狀態對PPCs的預測作用,納入心電信號偏離本研究主題。因此,本研究僅針對呼吸生理信號進行分析和處理,主要納入數據包括呼吸頻率(breath rate,BR)、潮氣量(tidal volume,TV)、分鐘通氣量(minute ventilation volume,MVV)、腹呼吸貢獻度(abdominal-contribute,Abo-contribute)和脈搏氧飽和度(pulse oxygen saturation,SpO2)。
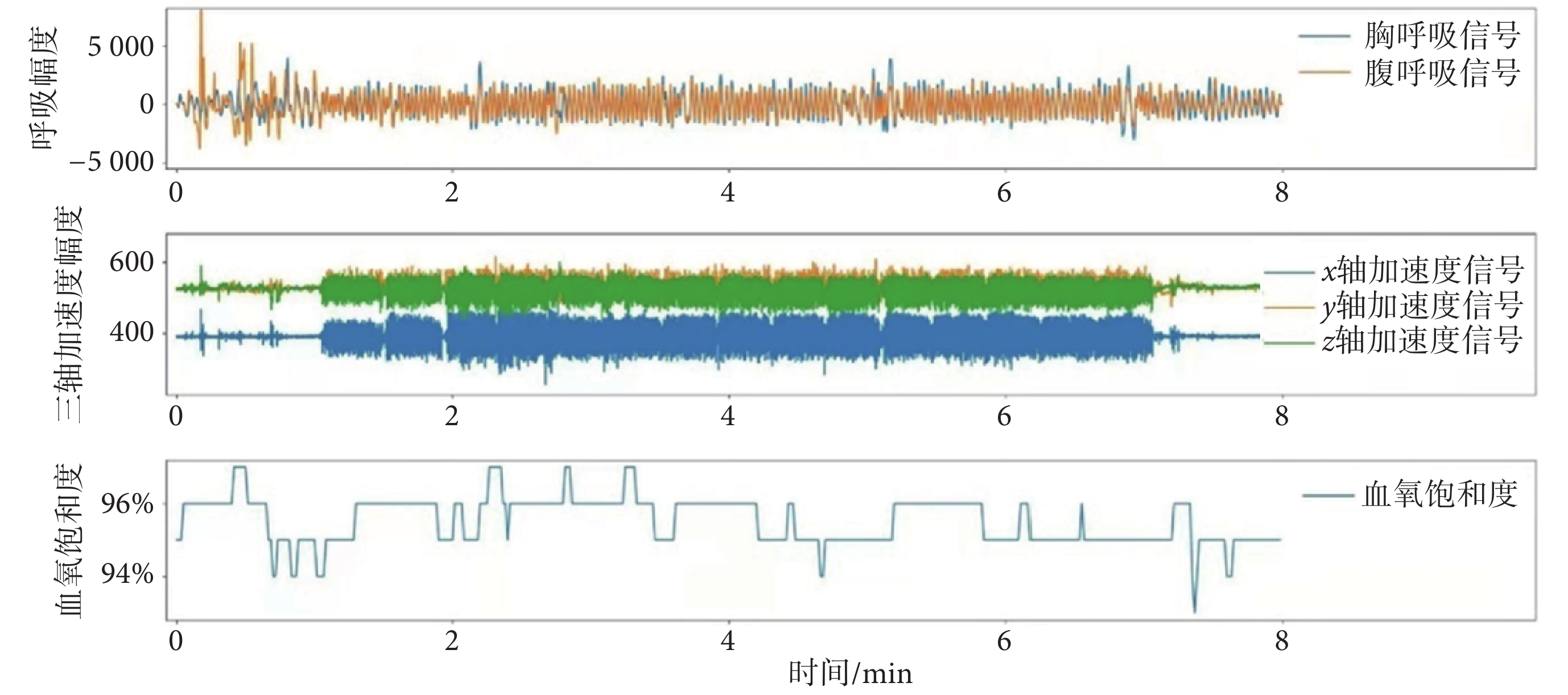
首先使用帶寬為0.1~1 Hz的帶通濾波器對呼吸信號進行濾波,去除運動偽跡、高頻干擾以及工頻干擾,然后使用Khodadad法檢測呼吸波形的波峰與波谷[14]。然后,根據采集的連續呼吸信號波形,逐呼吸地計算BR、TV、MVV、Abo-contribute,得到各呼吸參數的時間序列[15-16],參數定義如下:① BR:即每分鐘的呼吸次數,通過逐呼吸計算呼吸波形波峰與波峰之間的時間間距得到;② TV:即每次呼吸吸入或呼出的氣量,通過逐呼吸計算呼吸波形的幅度得到;③ MVV:即每分鐘進或出肺部的氣體總量,為呼吸頻率與潮氣量的乘積;④ Abo-contribute:即腹部的容積變化量占潮氣量的比值。以10 s的滑動時間窗口進行滑動平均,然后計算各呼吸參數的衍生參數(特征定義見表1)。血氧飽和度參數根據測量的連續血氧飽和度的時間序列(見圖3)計算得到,具體特征定義見表1。
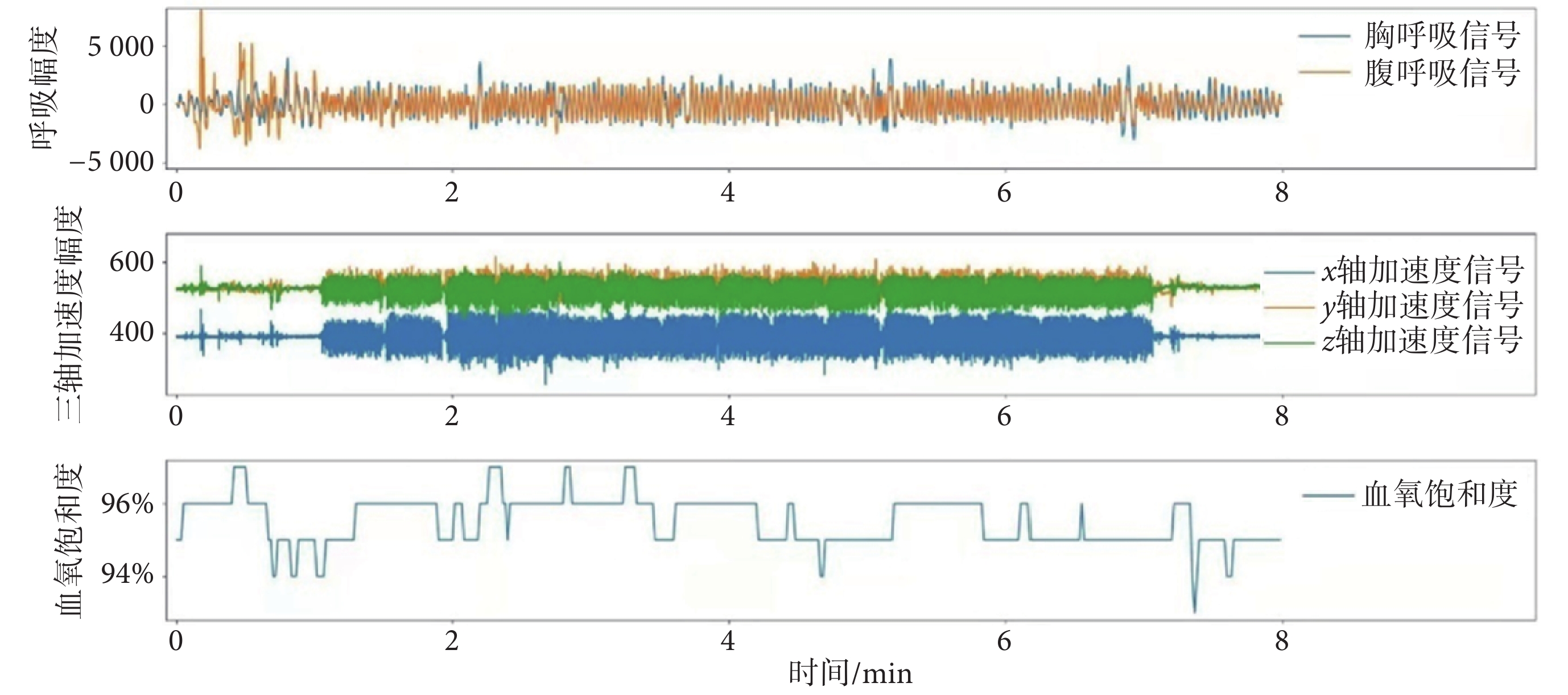 圖3
呼吸信號圖
Figure3.
Respiratory physiological signal acquisition process
圖3
呼吸信號圖
Figure3.
Respiratory physiological signal acquisition process
1.4 臨床數據及結局定義
所有臨床數據均由研究人員使用數據收集表從心臟外科手術患者數據庫中收集。數據類型如下:a)人口基線數據:包括年齡、性別、體質指數、吸煙史。b)術前風險評估:包括術前紐約心臟協會分類、左室射血分數、歐洲心臟手術風險評估。c)術前功能能力:第一秒用力呼出容積(forced expiratory volume in the first second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1/FVC、最大通氣量(maximum ventilatory volume,MVV)和最大吸氣壓(maximum inspiration pressure,MIP)。d)合并癥:慢性腎功能不全、高血壓、貧血、冠心病、神經系統障礙、糖尿病、充血性心力衰竭、低氧血癥、既往心臟手術、通氣功能障礙以及吸氣肌無力。e)手術類型:根據手術的復雜程度進行分類,定義為三大類:① 非冠脈搭橋的孤立性手術;② 兩項主要的手術方式;③ 三項或更多主要的手術方式[17]。f)術中數據:包括手術時間、體外循環時間和主動脈阻斷時間。對所有患者采用墨爾本評分進行評估,直至術后第14天[18]。滿足四項及以上判斷為PPCs。
1.5 統計分析
本研究使用Python3.7對連續生理信號進行處理,然后導入SPSS 20.0統計軟件進行數據統計學分析處理。對于上述變量以均值±標準差或中位數(四分位間距)進行表示,正態性數據組間比較使用兩樣本t檢驗,偏態性數據組間比較使用非參數秩和檢驗。分類變量以n(%)表示,組間比較使用χ2檢驗和Fisher確切概率法。
本研究使用邏輯回歸分析來調查呼吸生理參數對PPCs的影響。根據采集的連續呼吸波形信號,逐呼吸地計算出上述定義的各階段呼吸生理參數值。我們定義結局事件為二分類變量,使用單變量分析確定顯著預測因素。通過對兩組患者在步行試驗過程中連續呼吸生理參數特征差異進行排序,納入兩組連續呼吸生理參數中P<0.05的參數進行多因素邏輯回歸分析。Box-Tidwell測試用于評估連續性變量對數的線性假設。多重共線性假設通過皮爾遜相關系數統計和檢驗方差膨脹系數以及具有相同相關變量和獨立變量的多元回歸模型的公差進行評估。使用對數似然比檢驗模型的總體顯著性。Hosmer-Lemeshow擬合優度χ2檢驗用于評估模型的適當性。所有假設的統計檢驗均為雙側檢驗,檢測水準為0.05。
2 結果
2.1 兩組患者臨床特征分析
本研究所納入的53例患者中共有19例患者出現PPCs。與No-PPCs組相比,兩組人群在性別、年齡、吸煙史、左室射血分數、合并癥、手術類型與手術時間等指標的差異均無統計學意義(P>0.05),基線具有可比性(見表2)。
2.2 兩組患者6MWT過程呼吸生理參數對比分析
對表1中所列的呼吸和血氧生理參數進行組間對比分析,結果見表3。可以看出,兩組患者在BR-max、MVV-in-base、Abo-contribute的差異具有統計學意義。PPCs組BR-max[(30.04±3.85)次/分 vs.(32.60±4.69)次/分,P=0.04]、MVV-in-base[32 818.09±19 995.29 vs. 47 605.13±21 783.77,P=0.02]、Abo-contribute占比[base,(0.34±0.14)% vs.(0.43±0.15)%,P=0.04;mean,(0.35±0.19)% vs.(0.46±0.20)%,P=0.04;recovery,(0.35±0.19)% vs.(0.46±0.20)%,P=0.04]均較低。兩組人群TV、SpO2等呼吸生理參數差異未見統計學意義(P>0.05)。
2.3 PPCs預測分析
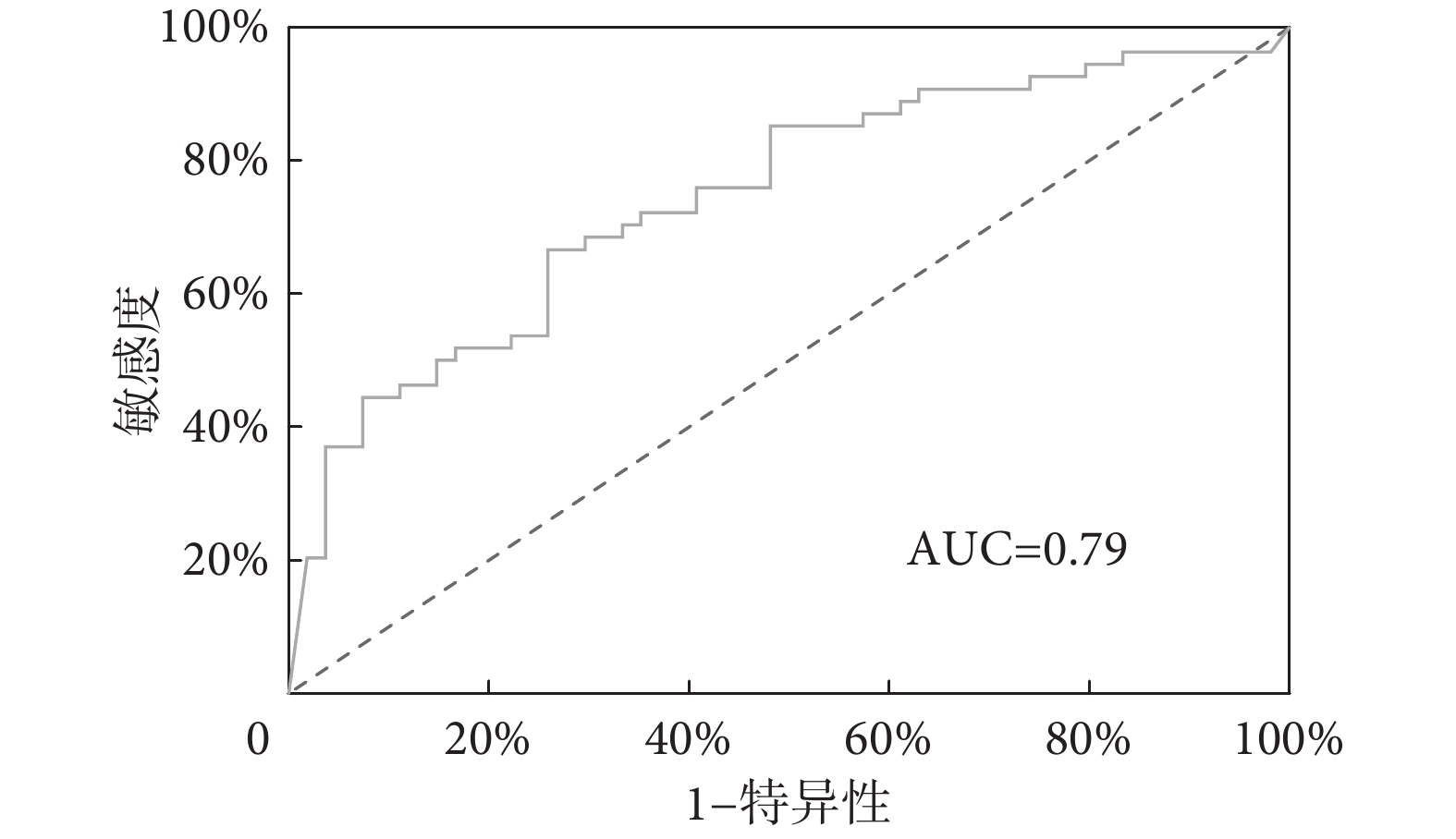
本研究采用多因素邏輯回歸分析對PPCs進行預測。根據組間差異分析,初步納入協變量為BR-max、MVV-in-base、Abo-contribute-base、Abo-contribute-mean以及Abo-contribute-recovery(P<0.05)。上述變量均在建模過程中設置為連續性變量。通過多因素邏輯回歸分析,最終確定BR-max(P=0.02)、Abo-contribute-base(P=0.04)、Abo-contribute-recovery(P=0.04)在多變量模型中被視為重要因素。模型具有統計學意義(χ2=13.53,P<0.01)。結果顯示該模型具有良好預測性能,敏感性89.5%,特異性61.8%,曲線下面積(area under curve,AUC)=0.79,95%CI 0.66~0.91(見圖4)。
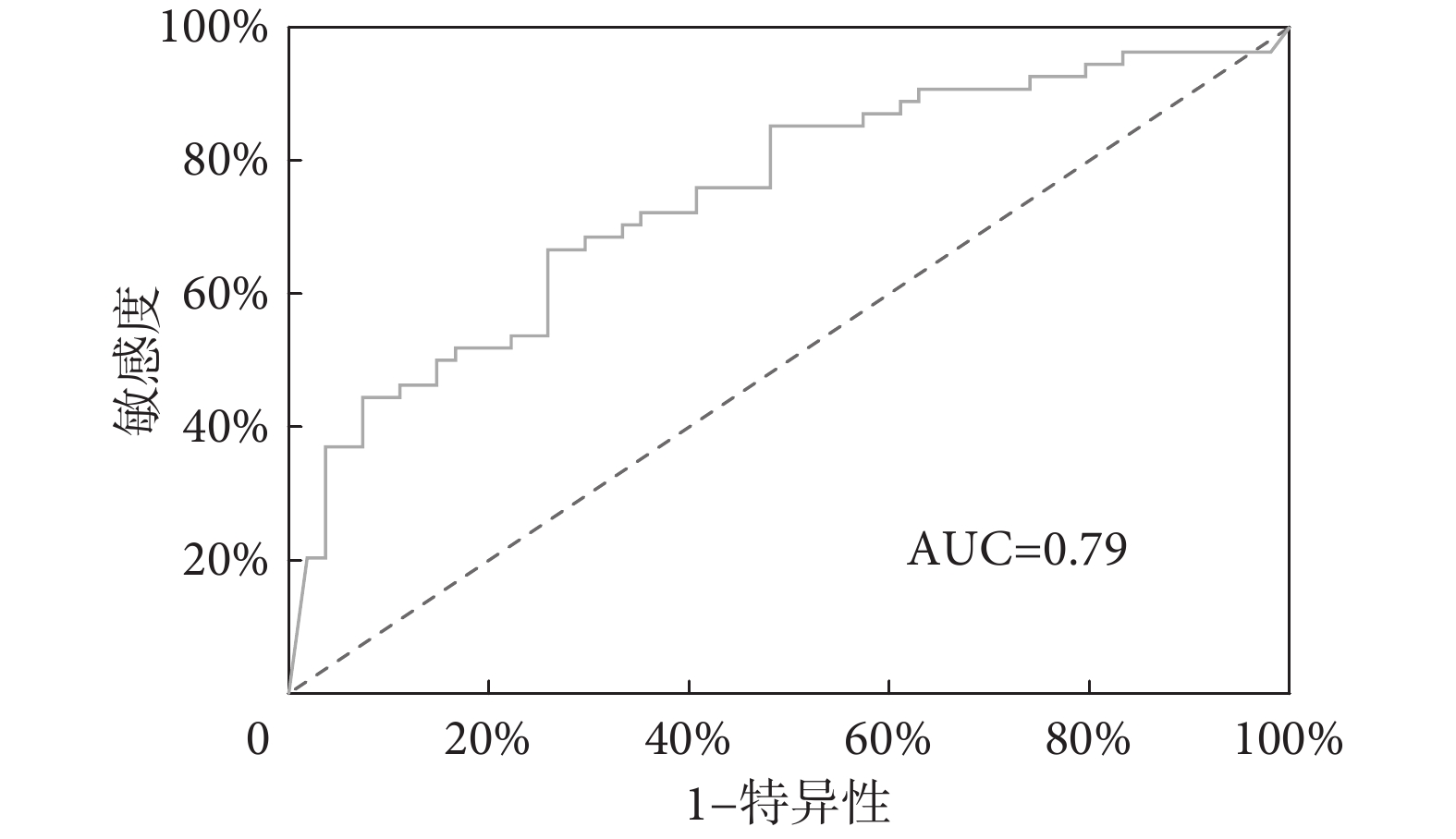 圖4
連續呼吸生理參數預測PPCs的ROC曲線
Figure4.
ROC curves of continuous respiratory physiological parameters for predicting PPCs
圖4
連續呼吸生理參數預測PPCs的ROC曲線
Figure4.
ROC curves of continuous respiratory physiological parameters for predicting PPCs
3 討論
本研究基于可穿戴設備對心臟瓣膜手術患者進行連續性呼吸生理監測,并對PPCs的發生進行了預測。結果顯示心臟瓣膜手術PPCs發生率為35.8%,這與全球范圍內心臟外科手術PPCs發生率的研究數據保持一致[19]。邏輯回歸模型最終確定BR-max、Abo-contribute-base、Abo-contribute-recovery為PPCs的重要預測因子,模型具有良好的預測性能(AUC=0.79)。
在過去的幾十年中,可穿戴設備已廣泛應用于日常醫療保健監測。最近,可穿戴設備在疾病惡化預警和康復評估等方面顯示出巨大潛力[20]。例如,連續監測氧飽和度以判斷是否發生運動性誘導低氧飽和度事件,有助于預測慢性阻塞性肺疾病患者預后情況[21]。眾所周知,PPCs是導致手術患者出現短期和長期預后不良、生活質量低下的一個重要因素[3]。因此,術前進行PPCs風險評估已成為圍手術期患者管理的標準內容和實現加速外科康復的常規臨床路徑。
既往在臨床環境中使用6MWD以評估患者運動能力[5],但由于單獨的6MWD測量可能不足以進行準確的臨床分析,因此隨著算法、傳感器技術的快速發展,一些研究人員開始專注于利用可穿戴設備在6MWT期間獲取連續性生理數據以揭示隱藏的信息[22]。我們的研究首次使用可穿戴設備連續性監測患者6MWT中的呼吸生理數據,然后進一步使用多維呼吸生理參數發展心臟瓣膜手術患者PPCs預測模型,從而識別患者異常呼吸生理狀態,為物理治療師制定個性化物理治療處方提供結構化報告以及理論依據。
研究發現BR-max可以預測PPCs發生,這可能是因為BR反映了機體執行運動的難易程度[23-24]。Aliverti[25]認為在劇烈運動中保持高頻率呼吸肌工作,可導致呼吸肌疲勞并啟動代謝反射,引起肢體骨骼肌血管收縮,加劇疲勞程度并反饋加強疲勞感知,表現為持續高強度運動的受限。PPCs組患者在運動過程中出現更低的BR-max,可能代表著患者的步行能力受到呼吸的限制。另一方面,我們發現胸腔和腹腔活動幅度對潮氣量的相對貢獻度是預測PPCs發生的重要因素。通常在靜息情況下,胸腔和腹腔對潮氣量的相對貢獻度分別為60%~70%和30%~40%[26],而腹腔對潮氣量的相對貢獻度可以從自主呼吸期間的40%增加到腹式呼吸期間的67%[27]。腹式呼吸運動可以改善腹部對潮氣量的貢獻度,有助于空氣分布至肺基底部,改善肺不張患者肺部特定區域的通氣。患者在運動過程中會采取不同呼吸模式,涉及不同分區的呼吸肌激活。腹式呼吸有利于減少呼氣末容積[28]。在相同運動負荷下,呼吸肌耗氧量更低,有助于骨骼肌競爭更多耗氧量以促進活動和減少疲勞感知[29]。因此,在運動過程中出現腹腔呼吸貢獻度低下的患者可能采取了異常呼吸模式而增加身體耗氧,導致發生PPCs的風險增加。
19世紀60年代,可穿戴技術的概念首先由Edward O Thorp提出[30],從那時起,可穿戴技術就受到了全世界研究人員的廣泛關注。可穿戴設備在商業領域已經取得了巨大進步,可以幫助進行身體運動檢測以及心率檢測等,已成為日常生活和健身市場的重要組成部分。可穿戴設備可以通過便攜式醫療或健康電子設備的形式直接穿戴于患者身體上,用于感知、記錄、分析、調節和干預,對疾病的診斷和治療具有重要意義。前期已有研究初步探索了可穿戴設備的臨床適用范圍,包括健康和安全監測、慢性病管理、疾病診治以及康復。例如Ryvlin等[31]利用可穿戴設備檢測全身強直陣攣發作,幫助臨床醫生優化抗癲癇治療并降低癲癇猝死的風險。Hsu等[32]使用多位置可穿戴傳感器對神經系統疾病患者的步態特征進行分析和分類,以指導康復運動方案的選擇。我們的研究首次利用可穿戴設備連續性監測心臟瓣膜手術患者呼吸生理參數,建立了預測PPCs的預測模型(AUC=0.79),并發現了容易導致患者出現PPCs的異常呼吸模式。通過連續性監測6MWT過程中呼吸生理參數的方式可以早期評估患者運動狀態下的呼吸模式并結合康復干預,有助于減少患者出現肺部不良事件的可能性。這預示著連續性生理監測與人工智能的結合有著更為廣闊的臨床使用場景,還可以用于探索合并呼吸系統疾病患者的通氣監測[33]以及居家的長程睡眠監測[34]等眾多領域。
本研究作為一項回顧性的單中心研究,存在樣本量相對較小的局限性。我們以研究對象出現肺部并發癥作為觀測的結局指標。根據實驗結果,PPCs組患者步行過程中Abo-contribute-mean為(0.35±0.19)%,No-PPCs組患者為(0.46±0.20)%,設雙側α=0.05,把握度為90%。利用PASS 15軟件計算得到的PPCs組患者樣本量N=19例,No-PPCs組患者樣本量N=19例,本研究納入人群數量初步達到統計學最低樣本量。另一方面,由于樣本量較小,對于SpO2等其他呼吸生理參數的檢驗效能可能不足,從而未顯示出統計學意義。因此,應謹慎解讀結果。后續研究將進一步擴大樣本量,探究多種呼吸生理參數的預測意義。
綜上所述,本研究基于六分鐘步行試驗系統連續性監測心臟瓣膜手術患者呼吸生理數據預測PPCs,通過提取多維呼吸生理參數發現,在步行過程中最大呼吸頻率較低、腹呼吸貢獻度占比低的心臟瓣膜手術患者更容易出現PPCs。隨著傳感器以及數據分析技術的發展和臨床實際需求的增加,可穿戴設備將在醫療領域發揮更大的作用。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:王渝強、羅澤汝心、王佳晨負責招募受試者、數據分析和論文撰寫;王佳晨、張健指導方法理論和試驗設計;郭應強、張政波、喻鵬銘指導論文撰寫。
倫理聲明:本研究通過了四川大學華西醫院倫理委員的審批(倫理編號:20211023)。
0 引言
心臟手術后10%~25%的患者會出現術后肺部并發癥(postoperative pulmonary complications,PPCs)[1-2],會顯著降低患者的功能能力,增加短期和長期死亡率[3],還會使患者住院費用顯著增加,停留重癥監護病房和住院的時間延長[4]。因此,術前對接受心臟瓣膜手術患者進行PPCs相關風險評估,對臨床治療方案的制定、預后的判斷、并發癥的預測、治療效果的評價以及醫療資源需求的估計等方面具有重要作用。目前臨床通常采用六分鐘步行測試(6-Minute Walk Test,6MWT)判斷患者心肺功能和預后,在一定程度上有助于預測PPCs[5]。然而,在實際臨床應用中,大多數只關注六分鐘步行距離(6-Minute Walk Test Distance,6MWD)這一靜息指標,尚未關注步行過程中連續呼吸生理數據中隱含的生理和病理信息,這可能會忽視早期的惡化跡象而發生不良事件[6]。造成這種現狀的一個重要因素就是目前缺少成熟的6MWT過程監測與記錄手段以及相關的臨床研究,無法明確6MWT過程中的連續動態生理信號與PPCs的關系。然而,生理參數的變化與患者的身體狀態緊密相關。AL-Khalidi等[7]的研究表明呼吸參數的頻繁改變反映了受損的心肺和神經功能。即使是輕度呼吸異常的患者都存在發生呼吸衰竭的風險。因此,對心臟手術患者在6MWT過程中實施呼吸參數的實時動態監測對臨床醫生和護理人員來說都勢在必行。
近年來,可穿戴設備已逐步應用于臨床領域,尤其是新冠疫情的暴發進一步推動了可穿戴設備在疾病管理中的發展與應用。目前大多數商用可穿戴設備已經可以提供心率、血氧以及耗能等相對準確的信息以反映身體活動情況[8]。Cheong等[9]的綜述發現使用基于生理特征的偏差,利用可穿戴設備結合人工智能統計分析技術建立了可以及早發現COVID-19感染的異常檢測模型,其受試者操作特征(receiver operating characteristic,ROC)曲線的陽性檢出率可達75%~94.4%。此外,國際領先的Apple Watch也正聚焦于基于生理信號的房顫檢測研究[10]。Escobar-Linero等[11]檢索近十年文獻發現可穿戴設備已大量應用于心血管系統事件和呼吸系統事件等。這些都表明目前可穿戴設備正在加速向與臨床應用結合的方向邁進。
綜上所述,本研究設想能夠通過可穿戴六分鐘步行試驗系統收集6MWT過程中的連續呼吸生理數據和血氧數據并對心臟瓣膜手術患者PPCs進行預測,發展PPCs預測模型,檢驗特征參數和模型的有效性并分析探索其臨床應用價值。
1 資料與方法
1.1 研究對象
納入2021年8月至2022年1月在四川大學華西醫院心臟大血管外科單一醫療團隊進行胸骨正中切開心臟瓣膜手術患者。所有參與者均取得了書面知情同意書。排除標準為:① 急診手術;② 滿足6MWT禁忌癥[5];③ 因不良事件或其他不可預見的情況而被迫終止;④ 可穿戴設備發出的信號不可讀或質量差。最終符合上述標準的患者共53例。根據是否出現PPCs將患者分為非術后肺部并發癥組(No-PPCs)和術后肺部并發癥組(PPCs)。
1.2 監測設備
本研究中使用的六分鐘步行系統是基于醫療級可穿戴設備SensEcho(見圖1)(海思瑞格科技有限公司,北京,已獲得中國食品藥品監督管理局認證)研制的數字化六分鐘步行系統[12-13],可以采集六分鐘步行試驗前-中-后的連續生理數據,包括胸呼吸、腹呼吸、單導聯心電、血氧飽和度、體位和體動等信號。
 圖1
SensEcho可穿戴設備
Figure1.
The SensEcho wearable device
圖1
SensEcho可穿戴設備
Figure1.
The SensEcho wearable device
1.3 監測流程以及數據預處理與特征提取
根據時間對6MWT進行階段劃分:步行開始前1 min為靜息階段;步行過程中為步行階段;步行結束后1 min為恢復階段。本研究統一設定為術前一天進行6MWT。進行測試前,將SensEcho穿戴在每位患者身上。隨后,在6MWT開始前1 min保持坐立靜息狀態,采集靜息階段生理數據,之后患者在物理治療師指導下,根據美國胸科學會指南[5]標準方案完成6MWT(見圖2)。如果出現以下任何癥狀:胸痛、意識喪失、無法忍受的呼吸困難、跌倒、大汗淋漓和面色蒼白,則終止步行測試,將之解釋為無法全程獨立完成步行測試并排除。步行結束后要求患者繼續穿戴SensEcho設備并保持坐立靜息狀態1 min,采集恢復階段連續生理數據。
 圖2
6MWT及連續性呼吸生理監測流程
Figure2.
6MWT and continuous respiratory physiology monitoring process
圖2
6MWT及連續性呼吸生理監測流程
Figure2.
6MWT and continuous respiratory physiology monitoring process
數據采集完畢后,進行處理分析。SensEcho設備可同步記錄患者心電信號,但一方面考慮到現有樣本量無法同時滿足納入呼吸信號以及心電信號進行數據建模分析;另一方面,本研究主要目的為監測呼吸生理信號以識別異常呼吸生理狀態對PPCs的預測作用,納入心電信號偏離本研究主題。因此,本研究僅針對呼吸生理信號進行分析和處理,主要納入數據包括呼吸頻率(breath rate,BR)、潮氣量(tidal volume,TV)、分鐘通氣量(minute ventilation volume,MVV)、腹呼吸貢獻度(abdominal-contribute,Abo-contribute)和脈搏氧飽和度(pulse oxygen saturation,SpO2)。
首先使用帶寬為0.1~1 Hz的帶通濾波器對呼吸信號進行濾波,去除運動偽跡、高頻干擾以及工頻干擾,然后使用Khodadad法檢測呼吸波形的波峰與波谷[14]。然后,根據采集的連續呼吸信號波形,逐呼吸地計算BR、TV、MVV、Abo-contribute,得到各呼吸參數的時間序列[15-16],參數定義如下:① BR:即每分鐘的呼吸次數,通過逐呼吸計算呼吸波形波峰與波峰之間的時間間距得到;② TV:即每次呼吸吸入或呼出的氣量,通過逐呼吸計算呼吸波形的幅度得到;③ MVV:即每分鐘進或出肺部的氣體總量,為呼吸頻率與潮氣量的乘積;④ Abo-contribute:即腹部的容積變化量占潮氣量的比值。以10 s的滑動時間窗口進行滑動平均,然后計算各呼吸參數的衍生參數(特征定義見表1)。血氧飽和度參數根據測量的連續血氧飽和度的時間序列(見圖3)計算得到,具體特征定義見表1。
 圖3
呼吸信號圖
Figure3.
Respiratory physiological signal acquisition process
圖3
呼吸信號圖
Figure3.
Respiratory physiological signal acquisition process
1.4 臨床數據及結局定義
所有臨床數據均由研究人員使用數據收集表從心臟外科手術患者數據庫中收集。數據類型如下:a)人口基線數據:包括年齡、性別、體質指數、吸煙史。b)術前風險評估:包括術前紐約心臟協會分類、左室射血分數、歐洲心臟手術風險評估。c)術前功能能力:第一秒用力呼出容積(forced expiratory volume in the first second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1/FVC、最大通氣量(maximum ventilatory volume,MVV)和最大吸氣壓(maximum inspiration pressure,MIP)。d)合并癥:慢性腎功能不全、高血壓、貧血、冠心病、神經系統障礙、糖尿病、充血性心力衰竭、低氧血癥、既往心臟手術、通氣功能障礙以及吸氣肌無力。e)手術類型:根據手術的復雜程度進行分類,定義為三大類:① 非冠脈搭橋的孤立性手術;② 兩項主要的手術方式;③ 三項或更多主要的手術方式[17]。f)術中數據:包括手術時間、體外循環時間和主動脈阻斷時間。對所有患者采用墨爾本評分進行評估,直至術后第14天[18]。滿足四項及以上判斷為PPCs。
1.5 統計分析
本研究使用Python3.7對連續生理信號進行處理,然后導入SPSS 20.0統計軟件進行數據統計學分析處理。對于上述變量以均值±標準差或中位數(四分位間距)進行表示,正態性數據組間比較使用兩樣本t檢驗,偏態性數據組間比較使用非參數秩和檢驗。分類變量以n(%)表示,組間比較使用χ2檢驗和Fisher確切概率法。
本研究使用邏輯回歸分析來調查呼吸生理參數對PPCs的影響。根據采集的連續呼吸波形信號,逐呼吸地計算出上述定義的各階段呼吸生理參數值。我們定義結局事件為二分類變量,使用單變量分析確定顯著預測因素。通過對兩組患者在步行試驗過程中連續呼吸生理參數特征差異進行排序,納入兩組連續呼吸生理參數中P<0.05的參數進行多因素邏輯回歸分析。Box-Tidwell測試用于評估連續性變量對數的線性假設。多重共線性假設通過皮爾遜相關系數統計和檢驗方差膨脹系數以及具有相同相關變量和獨立變量的多元回歸模型的公差進行評估。使用對數似然比檢驗模型的總體顯著性。Hosmer-Lemeshow擬合優度χ2檢驗用于評估模型的適當性。所有假設的統計檢驗均為雙側檢驗,檢測水準為0.05。
2 結果
2.1 兩組患者臨床特征分析
本研究所納入的53例患者中共有19例患者出現PPCs。與No-PPCs組相比,兩組人群在性別、年齡、吸煙史、左室射血分數、合并癥、手術類型與手術時間等指標的差異均無統計學意義(P>0.05),基線具有可比性(見表2)。
2.2 兩組患者6MWT過程呼吸生理參數對比分析
對表1中所列的呼吸和血氧生理參數進行組間對比分析,結果見表3。可以看出,兩組患者在BR-max、MVV-in-base、Abo-contribute的差異具有統計學意義。PPCs組BR-max[(30.04±3.85)次/分 vs.(32.60±4.69)次/分,P=0.04]、MVV-in-base[32 818.09±19 995.29 vs. 47 605.13±21 783.77,P=0.02]、Abo-contribute占比[base,(0.34±0.14)% vs.(0.43±0.15)%,P=0.04;mean,(0.35±0.19)% vs.(0.46±0.20)%,P=0.04;recovery,(0.35±0.19)% vs.(0.46±0.20)%,P=0.04]均較低。兩組人群TV、SpO2等呼吸生理參數差異未見統計學意義(P>0.05)。
2.3 PPCs預測分析
本研究采用多因素邏輯回歸分析對PPCs進行預測。根據組間差異分析,初步納入協變量為BR-max、MVV-in-base、Abo-contribute-base、Abo-contribute-mean以及Abo-contribute-recovery(P<0.05)。上述變量均在建模過程中設置為連續性變量。通過多因素邏輯回歸分析,最終確定BR-max(P=0.02)、Abo-contribute-base(P=0.04)、Abo-contribute-recovery(P=0.04)在多變量模型中被視為重要因素。模型具有統計學意義(χ2=13.53,P<0.01)。結果顯示該模型具有良好預測性能,敏感性89.5%,特異性61.8%,曲線下面積(area under curve,AUC)=0.79,95%CI 0.66~0.91(見圖4)。
 圖4
連續呼吸生理參數預測PPCs的ROC曲線
Figure4.
ROC curves of continuous respiratory physiological parameters for predicting PPCs
圖4
連續呼吸生理參數預測PPCs的ROC曲線
Figure4.
ROC curves of continuous respiratory physiological parameters for predicting PPCs
3 討論
本研究基于可穿戴設備對心臟瓣膜手術患者進行連續性呼吸生理監測,并對PPCs的發生進行了預測。結果顯示心臟瓣膜手術PPCs發生率為35.8%,這與全球范圍內心臟外科手術PPCs發生率的研究數據保持一致[19]。邏輯回歸模型最終確定BR-max、Abo-contribute-base、Abo-contribute-recovery為PPCs的重要預測因子,模型具有良好的預測性能(AUC=0.79)。
在過去的幾十年中,可穿戴設備已廣泛應用于日常醫療保健監測。最近,可穿戴設備在疾病惡化預警和康復評估等方面顯示出巨大潛力[20]。例如,連續監測氧飽和度以判斷是否發生運動性誘導低氧飽和度事件,有助于預測慢性阻塞性肺疾病患者預后情況[21]。眾所周知,PPCs是導致手術患者出現短期和長期預后不良、生活質量低下的一個重要因素[3]。因此,術前進行PPCs風險評估已成為圍手術期患者管理的標準內容和實現加速外科康復的常規臨床路徑。
既往在臨床環境中使用6MWD以評估患者運動能力[5],但由于單獨的6MWD測量可能不足以進行準確的臨床分析,因此隨著算法、傳感器技術的快速發展,一些研究人員開始專注于利用可穿戴設備在6MWT期間獲取連續性生理數據以揭示隱藏的信息[22]。我們的研究首次使用可穿戴設備連續性監測患者6MWT中的呼吸生理數據,然后進一步使用多維呼吸生理參數發展心臟瓣膜手術患者PPCs預測模型,從而識別患者異常呼吸生理狀態,為物理治療師制定個性化物理治療處方提供結構化報告以及理論依據。
研究發現BR-max可以預測PPCs發生,這可能是因為BR反映了機體執行運動的難易程度[23-24]。Aliverti[25]認為在劇烈運動中保持高頻率呼吸肌工作,可導致呼吸肌疲勞并啟動代謝反射,引起肢體骨骼肌血管收縮,加劇疲勞程度并反饋加強疲勞感知,表現為持續高強度運動的受限。PPCs組患者在運動過程中出現更低的BR-max,可能代表著患者的步行能力受到呼吸的限制。另一方面,我們發現胸腔和腹腔活動幅度對潮氣量的相對貢獻度是預測PPCs發生的重要因素。通常在靜息情況下,胸腔和腹腔對潮氣量的相對貢獻度分別為60%~70%和30%~40%[26],而腹腔對潮氣量的相對貢獻度可以從自主呼吸期間的40%增加到腹式呼吸期間的67%[27]。腹式呼吸運動可以改善腹部對潮氣量的貢獻度,有助于空氣分布至肺基底部,改善肺不張患者肺部特定區域的通氣。患者在運動過程中會采取不同呼吸模式,涉及不同分區的呼吸肌激活。腹式呼吸有利于減少呼氣末容積[28]。在相同運動負荷下,呼吸肌耗氧量更低,有助于骨骼肌競爭更多耗氧量以促進活動和減少疲勞感知[29]。因此,在運動過程中出現腹腔呼吸貢獻度低下的患者可能采取了異常呼吸模式而增加身體耗氧,導致發生PPCs的風險增加。
19世紀60年代,可穿戴技術的概念首先由Edward O Thorp提出[30],從那時起,可穿戴技術就受到了全世界研究人員的廣泛關注。可穿戴設備在商業領域已經取得了巨大進步,可以幫助進行身體運動檢測以及心率檢測等,已成為日常生活和健身市場的重要組成部分。可穿戴設備可以通過便攜式醫療或健康電子設備的形式直接穿戴于患者身體上,用于感知、記錄、分析、調節和干預,對疾病的診斷和治療具有重要意義。前期已有研究初步探索了可穿戴設備的臨床適用范圍,包括健康和安全監測、慢性病管理、疾病診治以及康復。例如Ryvlin等[31]利用可穿戴設備檢測全身強直陣攣發作,幫助臨床醫生優化抗癲癇治療并降低癲癇猝死的風險。Hsu等[32]使用多位置可穿戴傳感器對神經系統疾病患者的步態特征進行分析和分類,以指導康復運動方案的選擇。我們的研究首次利用可穿戴設備連續性監測心臟瓣膜手術患者呼吸生理參數,建立了預測PPCs的預測模型(AUC=0.79),并發現了容易導致患者出現PPCs的異常呼吸模式。通過連續性監測6MWT過程中呼吸生理參數的方式可以早期評估患者運動狀態下的呼吸模式并結合康復干預,有助于減少患者出現肺部不良事件的可能性。這預示著連續性生理監測與人工智能的結合有著更為廣闊的臨床使用場景,還可以用于探索合并呼吸系統疾病患者的通氣監測[33]以及居家的長程睡眠監測[34]等眾多領域。
本研究作為一項回顧性的單中心研究,存在樣本量相對較小的局限性。我們以研究對象出現肺部并發癥作為觀測的結局指標。根據實驗結果,PPCs組患者步行過程中Abo-contribute-mean為(0.35±0.19)%,No-PPCs組患者為(0.46±0.20)%,設雙側α=0.05,把握度為90%。利用PASS 15軟件計算得到的PPCs組患者樣本量N=19例,No-PPCs組患者樣本量N=19例,本研究納入人群數量初步達到統計學最低樣本量。另一方面,由于樣本量較小,對于SpO2等其他呼吸生理參數的檢驗效能可能不足,從而未顯示出統計學意義。因此,應謹慎解讀結果。后續研究將進一步擴大樣本量,探究多種呼吸生理參數的預測意義。
綜上所述,本研究基于六分鐘步行試驗系統連續性監測心臟瓣膜手術患者呼吸生理數據預測PPCs,通過提取多維呼吸生理參數發現,在步行過程中最大呼吸頻率較低、腹呼吸貢獻度占比低的心臟瓣膜手術患者更容易出現PPCs。隨著傳感器以及數據分析技術的發展和臨床實際需求的增加,可穿戴設備將在醫療領域發揮更大的作用。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:王渝強、羅澤汝心、王佳晨負責招募受試者、數據分析和論文撰寫;王佳晨、張健指導方法理論和試驗設計;郭應強、張政波、喻鵬銘指導論文撰寫。
倫理聲明:本研究通過了四川大學華西醫院倫理委員的審批(倫理編號:20211023)。