鈦金屬的表面形貌是影響其親水性及生物相容性的重要因素,探究鈦金屬表面處理策略是提高其生物相容性的重要途徑。本文先采用大顆粒噴砂酸蝕技術(SLA)處理鈦金屬A4(TA4),對得到的SLA-TA4進行堿熱、紫外光照及等離子體轟擊等單一方式表面處理。根據實驗結果得出,堿熱處理是提高并保持鈦金屬SLA-TA4親水性的最佳單一處理方法。隨后,在堿熱處理的基礎上,繼續研究多種表面處理方式形成的鈦金屬表面納米線網絡結構及其生物性能。通過小鼠胚胎成骨前體細胞MC3T3-E1黏附實驗,比較了不同方式表面處理后,鈦金屬材料支持細胞黏附、細胞鋪展的能力,并根據不同表面處理方式形成的材料表面接觸角、微坑深度及粗糙度等參數,分析探討多種表面處理方式造成的生物活性差異的機制。結果表明,經堿熱處理10 h及紫外照射1 h處理后的SLA-TA4 表現出最佳的生物活性及穩定性。從提高醫療器械表面生物活性的角度考慮,本文研究結果或對鈦金屬植入性器械的表面處理相關研究提供有價值的參考。
引用本文: 楊開通, 宋成龍, 馬智豪, 汪杰. 鈦種植體表面改性策略對生物活性的影響. 生物醫學工程學雜志, 2024, 41(3): 604-611. doi: 10.7507/1001-5515.202308049 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
鈦金屬(Ti)及其合金因出色的物理機械性能和優異的生物相容性,被廣泛選用作為口腔種植體的材料[1-2]。然而,純鈦的生物惰性以及與骨組織在結構和性質上的巨大差異,使得純鈦種植體在植入人體后,其生物學活性并不理想,難以與骨組織穩固結合。為了提升種植體與骨組織的結合強度,對鈦金屬及其合金進行表面改性是一種行之有效的方法。眾多研究顯示,經過適當的表面改性,鈦金屬及其合金能夠展現出骨誘導性,有效促進骨細胞在其表面黏附、增殖、分化和礦化[3-5]。即,改性處理能夠改變鈦金屬及其合金的表面特征、化學組成、粗糙度和親水性,這些變化有利于促進鈦金屬與骨結合,改善其生物學活性。
針對鈦及其合金的表面改性,現已廣泛采用的一系列方法技術包括:機械加工表面處理、可吸收噴砂介質處理、鈦漿涂層表面處理、羥基磷灰石涂層及改良、大顆粒噴砂酸蝕(sand-blasted large grift acid-etched,SLA)處理、親水大顆粒噴砂酸蝕處理等[6-9]。此外,表面納米化技術正成為鈦及其合金改性的一種趨勢。該技術通過特定的工藝,在材料表面形成納米級別的結構,例如納米顆粒、納米纖維、納米孔或納米晶體膜[10-13]。研究顯示,這種納米化結構具有與生物骨組織相似的性質,能有效提升骨結合效率[14]。
外部光輻照,特別是紫外光(ultraviolet,UV)照射,能夠顯著影響鈦金屬及其合金的性質[15-16]。例如,UV照射可以改變二氧化鈦(TiO2)的生物活性,這一過程被稱為光功能化[17]。鈦種植體的TiO2氧化層經UV照射后,不僅具有獨特的物理和化學性質,還增強了其生物相容性[18]。首先,TiO2表面的電荷屬性會發生顯著變化,從原本的負電位轉變為正電位[19]。這種電荷的轉變有助于帶負電荷的分子更容易吸附在鈦金屬表面,從而促進細胞的黏附反應,并最終促進細胞外基質(extracellular,ECM)在鈦金屬醫療器械表面的形成[20]。此外,光功能化還能使長期存放的鈦金屬表面的親水性得以恢復,這有利于血液在鈦金屬表面的延展和潤濕。研究表明,UV處理后的鈦金屬表面疏水性降低,骨整合過程加速[21-22],為鈦金屬及其合金在醫療器械領域的應用奠定了基礎。
基于上述研究,本文將對鈦金屬表面進行多種表面改性處理,表征鈦金屬片表面生成的納米線網絡結構,分析表面處理對于材料的元素組成、親水性能及表面粗糙度的影響,以及不同表面處理方式對細胞黏附的影響,并探究鈦金屬經表面處理后其生物活性增強的機制。本研究通過系統梳理不同表面處理方式對于鈦金屬表面理化性質和生物活性的影響,以期為鈦金屬種植體和其他類型鈦金屬醫療器械的研究提供思路和借鑒。
1 材料與方法
1.1 主要試劑和儀器
胎牛血清(fetal bovine serum,FBS)和最低必須培養基(alpha-minimum essential medium,α-MEM)購自大連美侖生物技術有限公司(中國);異硫氰酸熒光素(fluorescein isothiocyanate isomer,FITC)購自北京欣華綠源科技有限公司(中國);鬼筆環肽和4%多聚甲醛固定液購自碧云天生物技術有限公司(中國);生理鹽水RHAWN?購自北農雨禾科技有限公司(中國);氫氧化鈉(NaOH)購自阿拉丁試劑有限公司(中國);無水乙醇購自國藥集團化學試劑有限公司(中國)。
1.2 預處理制備SLA-TA4
首先,把鈦金屬A4(Ti-A4,TA4)加工成直徑為5.0 mm、厚度為1.5 mm的鈦金屬片(以下簡稱:鈦片)。隨后,對鈦片進行表面除油處理:先使用Micro 90清潔劑進行初步清洗,再通過純化水超聲波清洗以去除殘留油污。接著,采用100目的白剛玉對清洗后的鈦片進行噴砂處理,操作條件設定為壓縮空氣壓力6 kPa、噴射距離150 mm、噴砂時間20 s。完成噴砂處理后,將鈦片置于酸蝕液中進行酸蝕處理。該酸蝕液由體積比為1:1:2的硫酸(質量百分比98%)、鹽酸(質量百分比37%)和去離子水混合而成。酸蝕處理在60 ℃的溫度下進行,持續時間為60 min,最終得到的SLA-TA4鈦片。
1.2.1 堿熱處理
將SLA-TA4鈦片置于提前配置好的NaOH(5 mol/L)溶液中,進行初步的堿化處理,隨后將其轉移至65 ℃真空干燥箱中,保溫處理0.5、4.0、10.0 h后,待其自然冷卻至室溫,用無水乙醇和去離子水分別清洗3次,水浴超聲處理20 min后取出,干燥備用。
1.2.2 等離子體轟擊處理
將SLA-TA4鈦片放入真空等離子表面處理系統(PTL-VM500,普特勒電器科技有限公司,中國),在真空環境、功率500 W條件下,放電處理5 min。
1.2.3 UV照射處理
將SLA-TA4鈦片置于45 W的UV光源下,照射1 h。
1.2.4 高溫煅燒
將SLA-TA4鈦片置于管式爐中,在氮氣(N2)保護下升溫至450或700 ℃,熱處理1 h,自然冷卻至室溫備用。
1.3 接觸角測量
采用接觸角測量儀(JC2000C1,上海中晨數字技術設備有限公司,中國)分析樣品(n=6)表面的水接觸角。將純水滴在直徑(φ)為5.0 mm、厚度為1.5 mm的SLA-TA4鈦片樣品表面,通過成相系統分析接觸角的大小,衡量材料表面的親水性。
1.4 不同處理樣品的表面形貌分析
將制備的各組SLA-TA4樣品進行噴金處理后,采用掃描電子顯微鏡(scanning electron microscope,SEM)(JSM-7800F,日本電子株式會社,日本)在20 kV加速電壓下觀察樣品的表面形貌(放大倍數:10 000 ×和30 000 ×)。
1.5 不同處理樣品的表面元素分析
采用X射線光電子能譜儀(x-ray photoelectron spectroscopy,XPS)[Nexsa,賽默飛世爾(蘇州)儀器有限公司,中國]在高真空、150 W 射線輻射、15 kV電壓條件下對各組SLA-TA4樣品的表面元素組成進行檢測。
1.6 不同處理組樣品的粗糙度分析
采用激光共聚焦掃描顯微鏡(laser scanning confocal microscope,LSCM)(IX83,北京瑞科中儀科技有限公司,中國)分別對每個樣品表面選取120 × 120 μm2和20 × 20 μm2 兩處進行三維形貌掃描,并進行粗糙度分析。
1.7 成骨細胞培養
使用α-MEM培養基(含10%滅活胎牛血清、1% 鏈霉素和青霉素)將小鼠胚胎成骨前體細胞MC3T3-E1培養于37 ℃、5% CO2飽和濕度條件的恒溫培養箱中,每2~3 d換1次培養基,細胞鋪滿度為90%時進行傳代操作。將無菌鈦片材料放入24孔板中,接種MC3T3-E1細胞,密度為2×104 個/孔。
1.8 FITC染色評估細胞黏附
首先,配制濃度為0.1 mmol/L的FITC 標記的鬼筆環肽染液,將上述接種細胞的鈦片置于37 ℃磷酸緩沖液中浸泡1 min,然后置于4%多聚甲醛固定液中固定15 min,再使用磷酸緩沖液清洗鈦片2 次,每次清洗10 min,取一定量配制好的鬼筆環肽染液將鈦片覆蓋,于37 ℃條件下避光染色30 min;最后再次使用磷酸緩沖液清洗鈦片2 次,每次10 min,隨后將鈦片置于熒光顯微鏡下觀察細胞黏附情況。
2 結果與分析
2.1 單一表面處理方式對鈦金屬表面親水性的影響
研究發現,鈦金屬表面親水性對于植入人體后的鈦金屬醫療器械生物活性影響較大[23]。而且據以往研究發現,SLA-TA4雖然具有良好親水性,但其親水性不能長期保持[24]。因此,在本研究的初始階段,首先將TA4進行噴砂酸蝕處理成為SLA-TA4,以提高鈦金屬親水性。隨后,本研究對SLA-TA4進行UV光照、等離子體轟擊、高溫煅燒(450 ℃煅燒1 h)、堿熱處理(0.5 h)等多種不同表面處理,并評價這些單一表面處理對SLA鈦金屬的表面親水性的影響。如表1所示,未經處理的SLA-TA4鈦片作為對照組,表面表現出明顯的疏水狀態,空氣中靜置0、24、168 h后,接觸角分別為:115.18°、116.22°、118.73°。然而,經過鹽酸酸蝕、UV光照、高溫煅燒、等離子體轟擊和堿熱處理后,SLA鈦片表面的親水性得到了顯著提升。盡管如此,隨著材料在大氣環境中保存時間的延長,除了堿熱處理之外,其他四種方法處理的鈦片在空氣中的親水性難以維持長期穩定,無法滿足鈦金屬醫療器械長期保存的需求。因此,在后續的研究中,本文重點研究了以堿熱處理為基礎的多種表面處理組合,以尋求更穩定的親水性改善方案。
2.2 堿熱處理在鈦金材料表面形成的納米線網絡結構
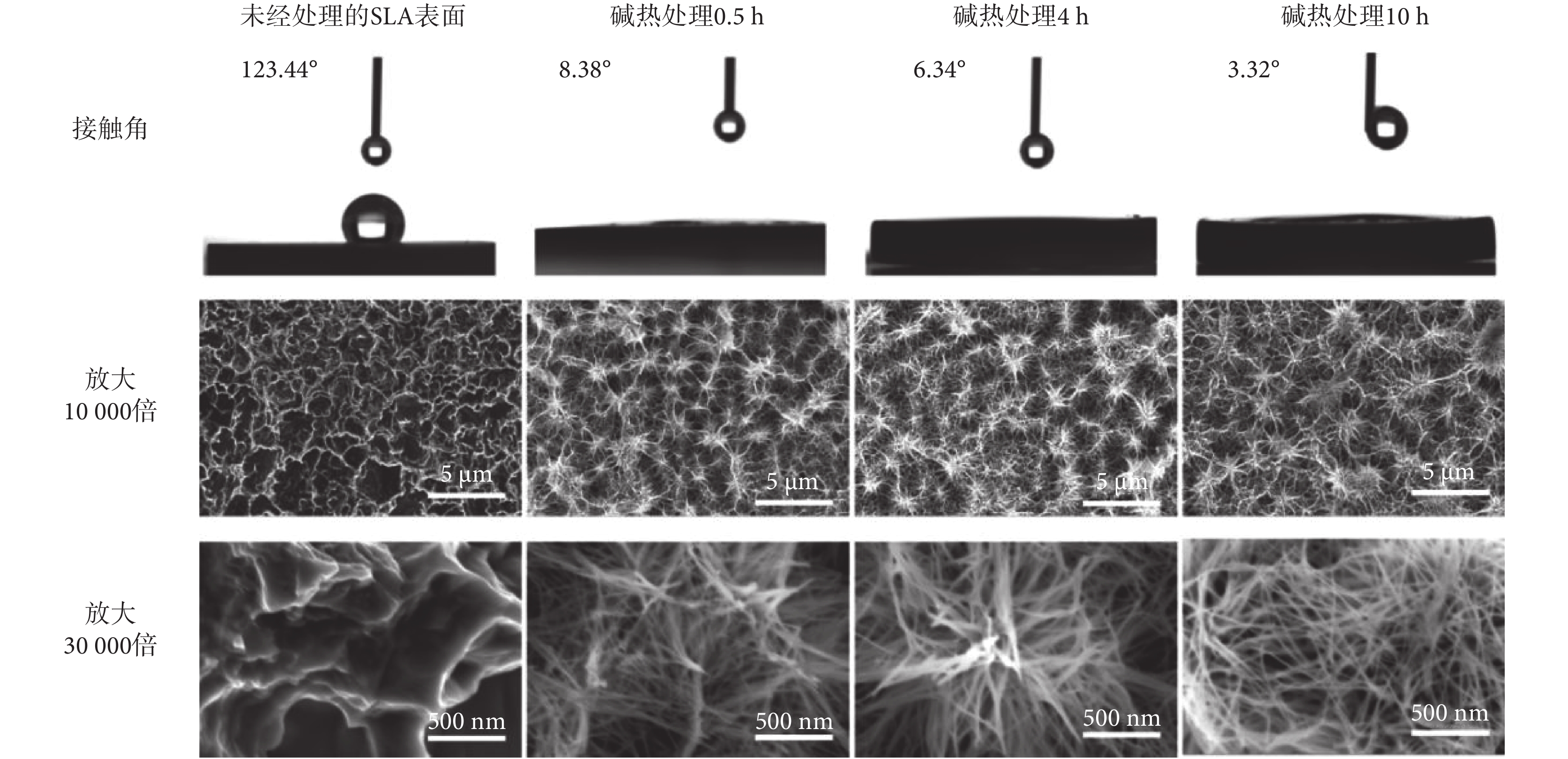
基于上述研究發現,SLA-TA4表面經過單一堿熱處理后表現出極佳親水性能,本文進一步探究了堿熱處理時長對材料親水性能及表面形貌的影響。通過對樣品表面的水接觸角測試發現,不同時長的堿熱處理使得樣品表面親水性發生變化。如圖1所示,經0.5、4.0、10.0 h堿熱處理后,SLA-TA4樣品的接觸角分別為8.38°、6.34°、3.32°,遠低于未經處理的SLA表面接觸角123.44°,且接觸角度數隨著堿熱處理時長的增加而逐漸降低。
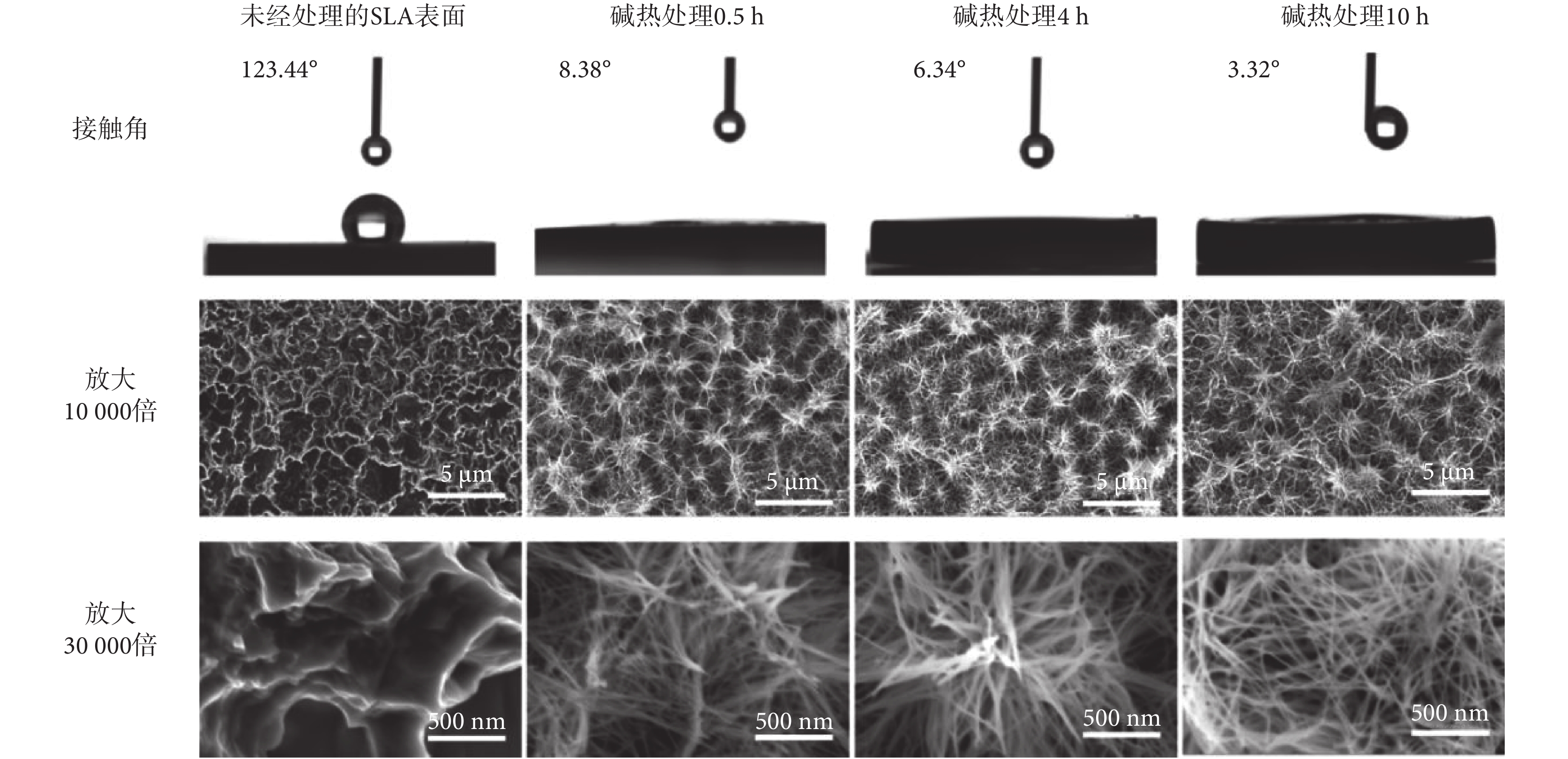 圖1
不同時長堿熱處理后SLA-TA4的接觸角和SEM圖像
Figure1.
Contact angle and SEM images of SLA-TA4 after alkali heat treatment of different duration
圖1
不同時長堿熱處理后SLA-TA4的接觸角和SEM圖像
Figure1.
Contact angle and SEM images of SLA-TA4 after alkali heat treatment of different duration
如圖1所示,未經處理的SLA表面呈現出光滑的微坑。堿熱處理0.5 h后,微坑邊緣銳化,形成隨機堆積狀態的納米線結構,樣品表面的粗糙度明顯提高;堿熱處理4.0 h后,SLA-TA4表面的納米結構更加密集,納米線長度增加。堿熱處理10.0 h后形成了典型納米線網絡結構,該結構中的納米級孔洞密集,存在大量的間隙,更易引發虹吸效應。由此可見,長時間的堿熱處理會豐富其表面納米結構,而納米線結構具有更穩定的暴露晶面,具備該結構的樣品表面與各種溶劑分子之間存在著更強的相互作用。除此之外,納米線網絡結構中電荷的轉移以及物質的擴散會更快,這些都將有利于鈦金屬材料表面親水性能的提升。
2.3 堿熱處理SLA-TA4樣品的粗糙度及元素分析
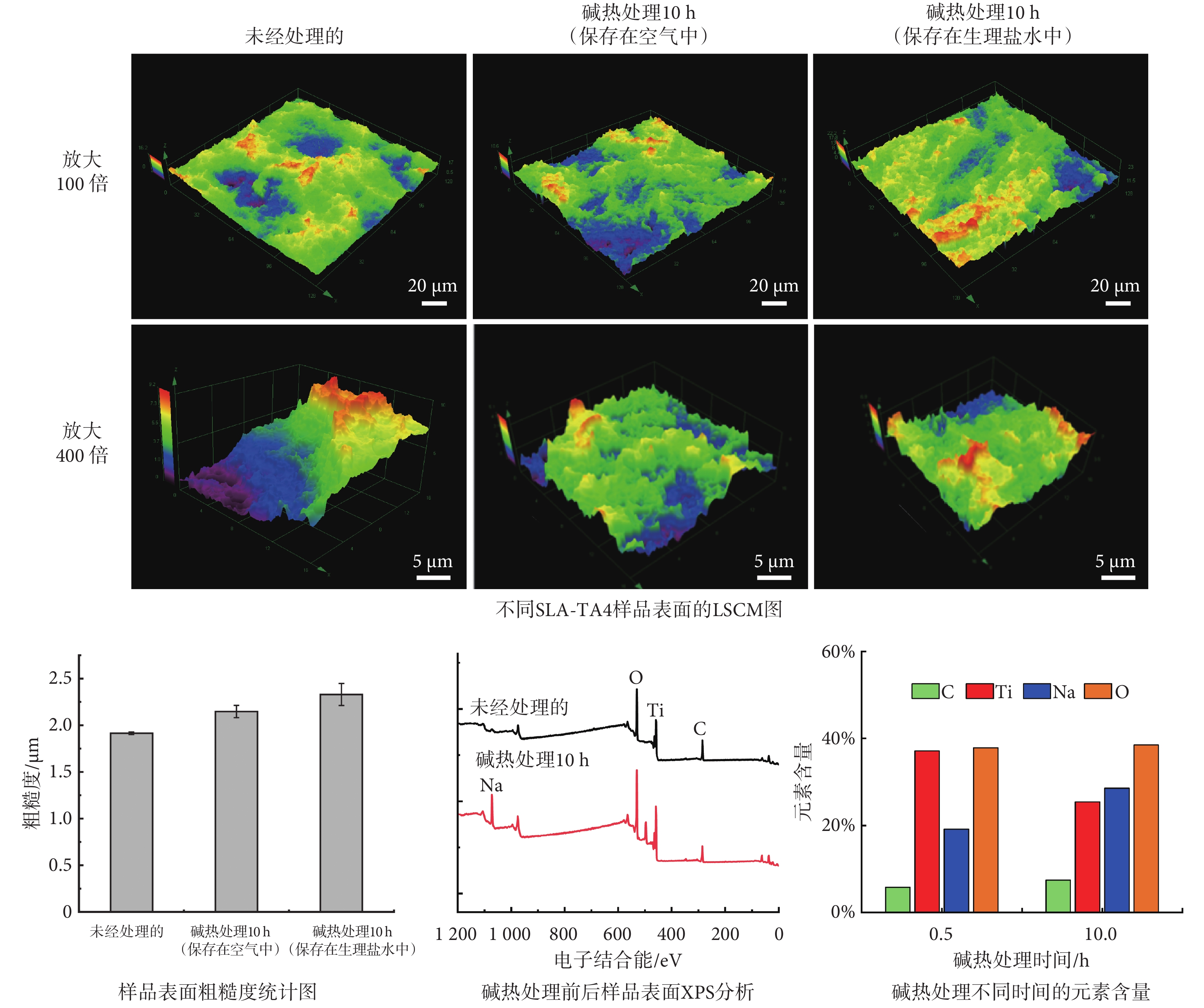
首先,通過LSCM對三種樣品,分別是:未經處理的SLA-TA4、保存在空氣中堿熱處理10 h的SLA-TA4、保存在生理鹽水中堿熱處理10 h的SLA-TA4,進行微坑深度測量和三維形貌的表征。此外,對堿熱處理的SLA-TA4樣品進行表面粗糙度和XPS元素分析,以闡明堿熱處理對SLA-TA4表面親水性能的影響機制。如圖2所示,三種樣品表面微坑最大深度分別為16.2、18.6、 22.2 μm,微坑平均深度為11.683 ± 0.073、12.149 ± 0.131、14.277 ± 0.218 μm,在生理鹽水中保存的樣品微坑最深,波動也相對最大。隨后,又測量了這三種樣品的表面粗糙度,其粗糙度平均值分別為1.914±0.0143、2.148 ± 0.066、2.335 ± 0.098 μm。其中,SLA-TA4經堿熱處理后并保存在生理鹽水中的樣品表面粗糙度更大,其親水性能也更好。
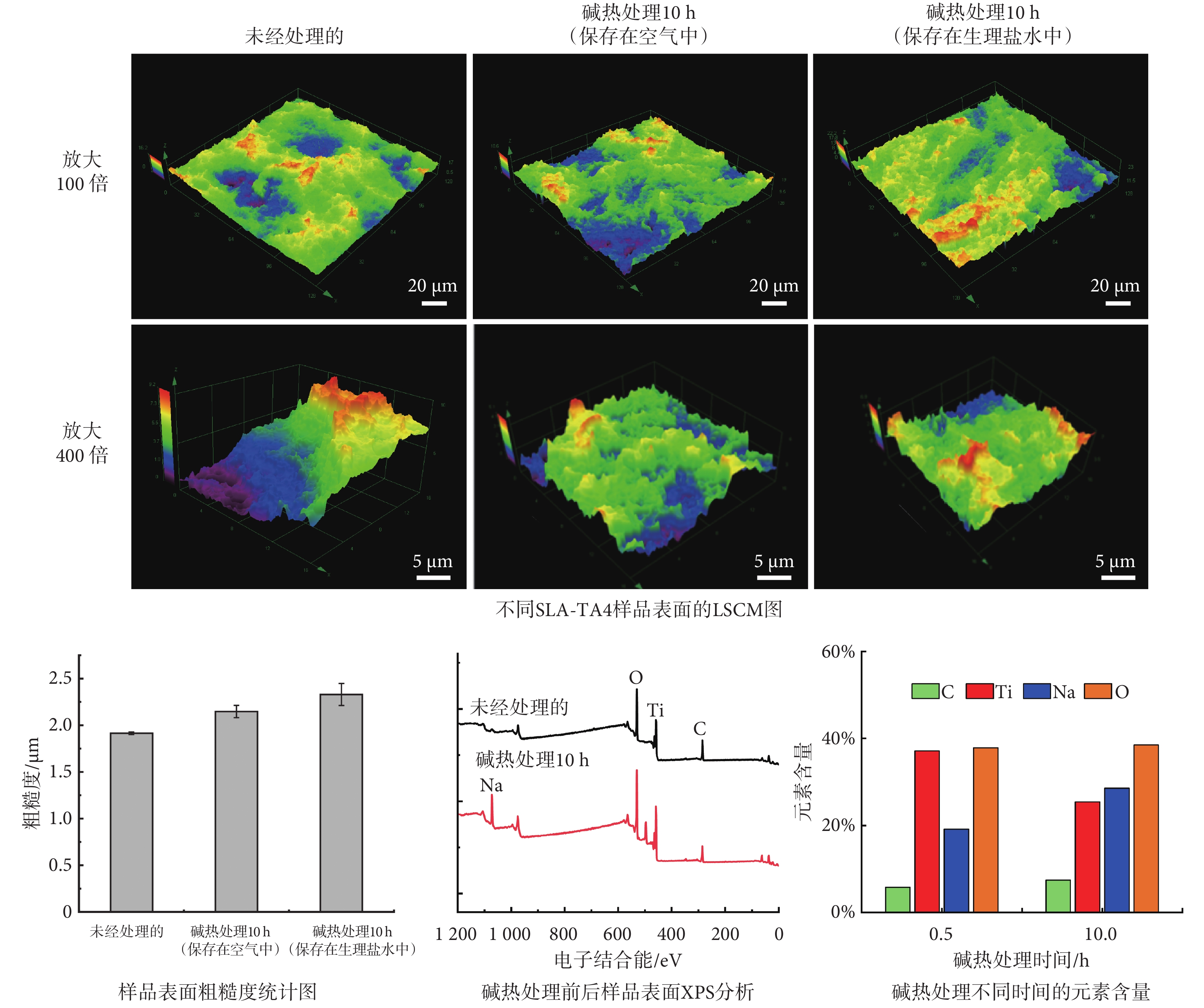 圖2
堿熱處理對SLA-TA4樣品表面的影響
Figure2.
Effect of alkali heat treatment on SLA-TA4 sample surface
圖2
堿熱處理對SLA-TA4樣品表面的影響
Figure2.
Effect of alkali heat treatment on SLA-TA4 sample surface
通過XPS元素分析可以發現,經過堿熱處理后的SLA-TA4樣品表面開始出現鈉(Na)元素的沉積。這是因為暴露在空氣中的鈦金屬表面一般會存在TiO2層,強堿NaOH會與TiO2發生反應,生成鈦酸鈉凝膠層[25]。在隨后的高溫熱處理中,鈦酸鈉凝膠層會逐漸轉變為無規則形貌的碳酸鈉涂層,其結構會更加穩定并且能夠顯著增強金屬基體之間的結合力[26-27]。此外,SLA-TA4鈦片表面沉積的鈉離子(Na+)會與水中的水合氫離子(H3O+)發生離子交換,可以形成表面富含鈦羥基(TiOH)的活化層,從而賦予了材料更好的親水性能和生物活性[28],也有利于誘導鈣離子(Ca2+)及磷酸根離子的沉積。對經過不同時長堿熱處理后的樣品表面進行元素含量分析,其中氧(O)元素含量基本保持不變,但碳(C)和Na的元素含量逐漸升高,長時間的堿熱處理使得樣品表面的碳酸鈉涂層更加穩固,這也使得材料具備了更優良的親水性。
2.4 基于堿熱處理的多種表面處理方式
為了提升材料表面的親水性能并增強其支持細胞增殖與分化的能力,本研究探討了以SLA處理后的堿熱處理為基本步驟,輔以其他表面處理技術作為二次處理的復合改性策略,旨在進一步優化材料的表面特性。
由表2所示,4種不同復合處理方式處理后的SLA-TA4樣品均展現出卓越的親水性能,彼此之間并無明顯差異。然而,隨著樣品在空氣中的保存時間延長至24 h和168 h,堿熱處理 + 高溫煅燒(450、700 ℃)、堿熱處理 + 等離子體轟擊等幾組樣品的接觸角會隨著時間變化而逐漸變大,表明親水性能有所下降。只有堿熱處理+UV光照處理的樣品保持穩定的親水性。另外,經過復合表面處理的樣品其接觸角均低于任何單一的表面處理方式形成的接觸角,且在長期穩定性方面表現更佳。這表明,通過復合表面處理方法可以顯著提升鈦金屬表面的親水性能。
由于700 ℃條件下的高溫煅燒容易使材料發生脆裂,導致材料表面的微納結構和組織成分發生破壞[29],在后續研究中重點分析另外3種復合處理手段,即:以堿熱處理為基礎步驟的處理時間均為10 h;450 ℃煅燒時間為1 h;等離子體轟擊時間為1.2.1小節描述的5 min;UV照射為1 h。利用SEM對上述3種復合處理方式的SLA-TA4樣品進行表面形貌表征。如圖3所示,經過不同表面處理后的樣品,表面形貌發生明顯變化。由未經處理的SLA-TA4表面的淺坑衍生為尖銳的毛細纖維形貌,并且有明顯的蜂窩孔洞結構出現,表面粗糙度明顯增加。對比發現,堿熱處理+UV光照得到的樣品表面毛細纖維更尖銳,表面孔洞數量也明顯更多。除此之外,研究發現堿熱處理SLA-TA4后繼續進行1 h的UV光照,可以有效地減小樣品表面所存在的碳氫化合物含量,從而進一步提升樣品的表面親水性能,這也將有利于成骨細胞的黏附[30]。
 圖3
不同表面處理方式協同堿熱處理的SLA-TA4的SEM圖像
Figure3.
SEM images of SLA-TA4 after different surface treatments in conjunction with alkali heat treatment
圖3
不同表面處理方式協同堿熱處理的SLA-TA4的SEM圖像
Figure3.
SEM images of SLA-TA4 after different surface treatments in conjunction with alkali heat treatment
2.5 SLA-TA4的細胞活性實驗
前文實驗結果表明,通過堿熱處理10 h與UV照射1 h的復合表面處理方法能夠顯著提升SLA-TA4表面的親水性。接下來,本文將以MC3T3-E1細胞實驗進一步驗證該方法對細胞黏附和活性的影響。為了探究不同保存介質對結果的影響,將經過堿熱處理10 h+UV照射1 h的SLA-TA4樣品分別置于空氣和生理鹽水中保存,并以未經處理的SLA-TA4作為對照,在這些樣品上進行細胞接種實驗。
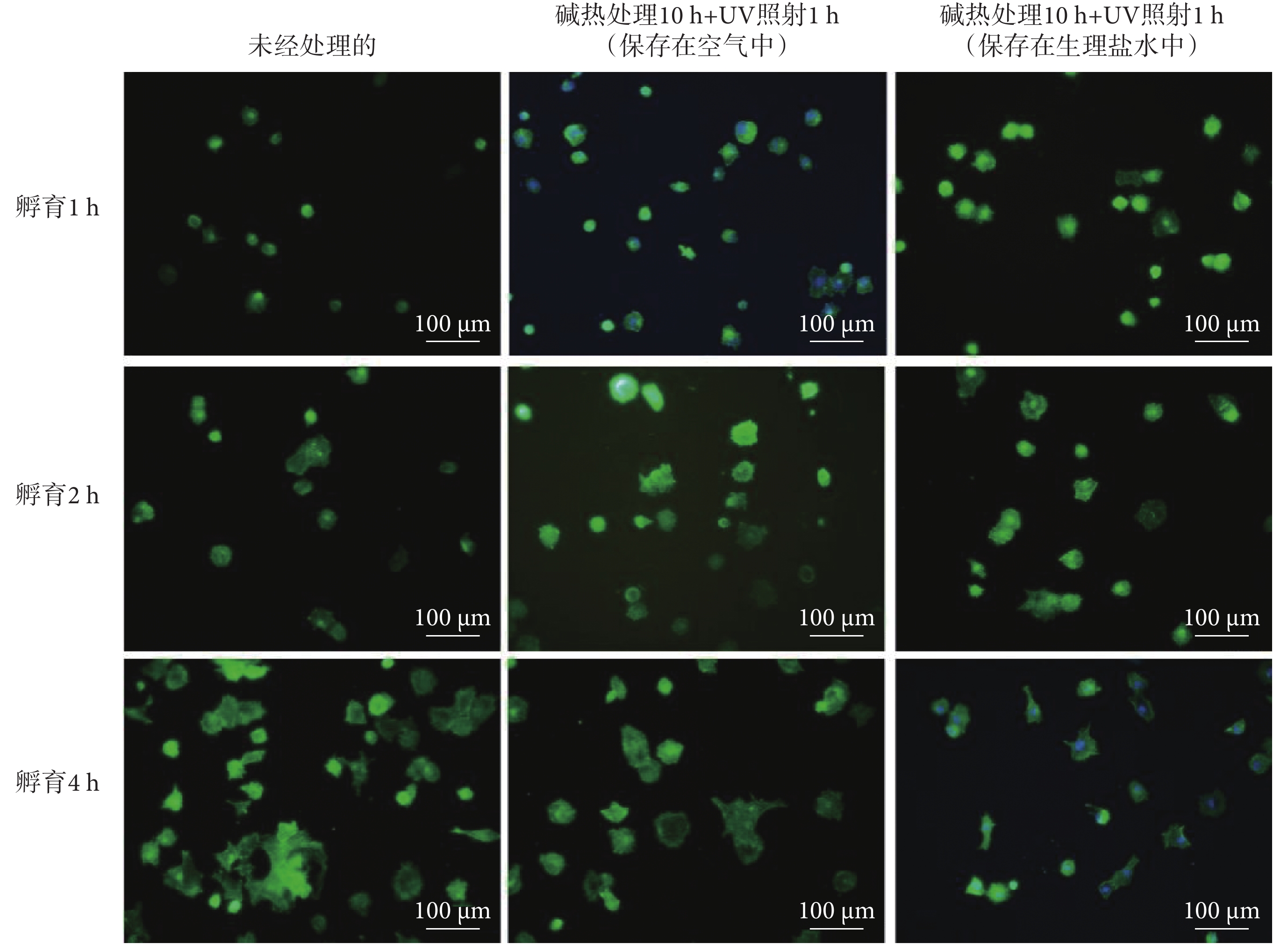
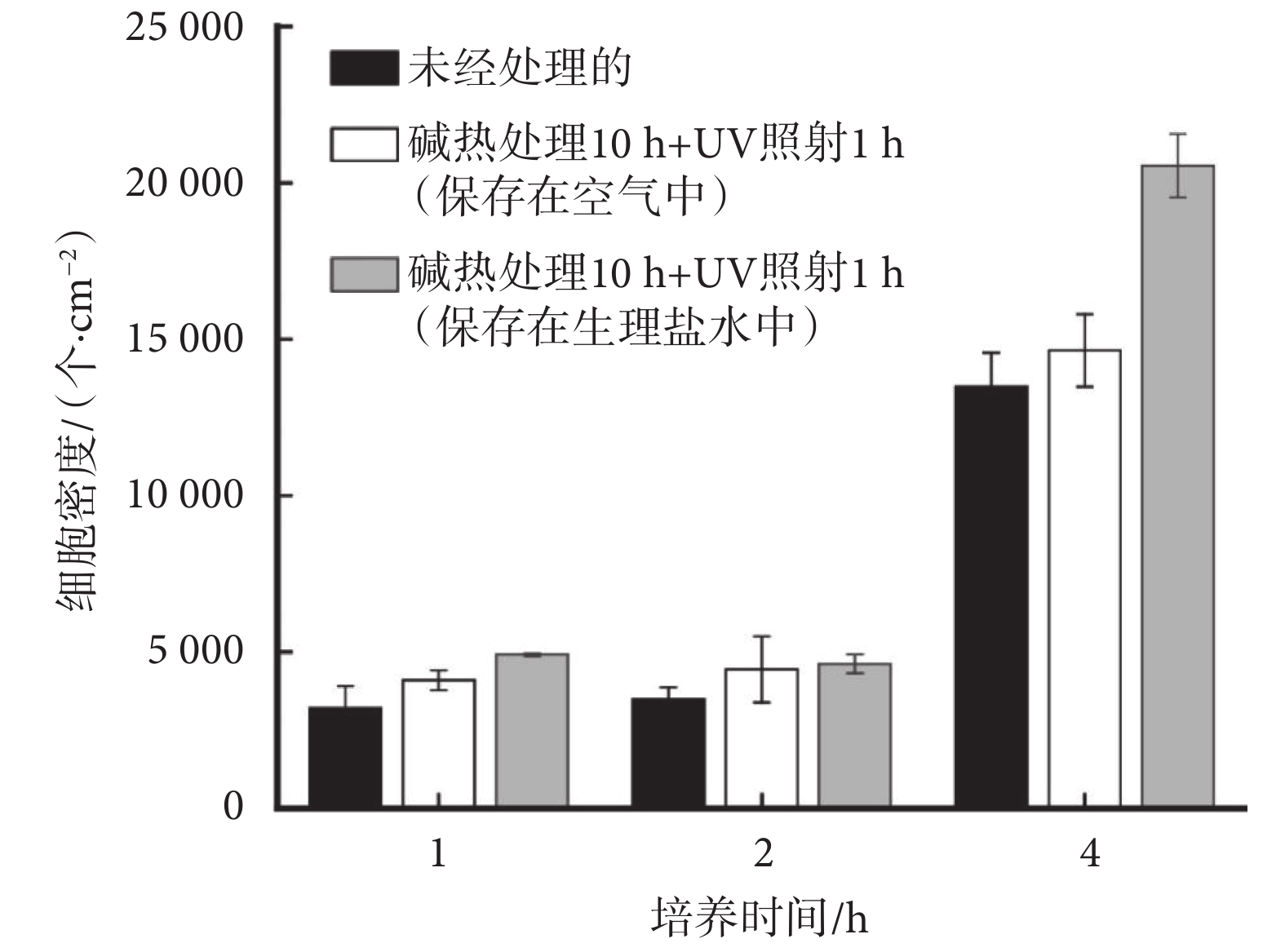
如圖4所示,由MC3T3-E1細胞在樣品表面黏附后的染色結果可知,1~4 h細胞黏附期間內,三種樣品[未經處理的、堿熱處理10 h+UV照射1 h(保存在空氣中)、堿熱處理10 h+UV照射1 h(保存在生理鹽水中)]上細胞黏附數量都逐漸增多,當孵育時間達到4 h時,三組SLA-TA4樣品表面黏附的細胞數量均顯著增加,細胞在樣品表面的鋪展性也隨孵育時間而增加。如圖5所示,細胞在堿熱處理10 h + UV照射1 h(保存在生理鹽水中)樣品上的黏附數量高于其他兩組,且差異明顯。與未經處理的SLA-TA4樣品相比,堿熱處理10 h + UV照射1 h和生理鹽水保存環境均能夠增加材料表面上細胞黏附數量,且有利于細胞鋪展。此外,對比不同孵育時間保存在生理鹽水中和保存在空氣中的細胞數量可以發現,生理鹽水保存能夠更好發揮鈦金屬表面的生物相容性。
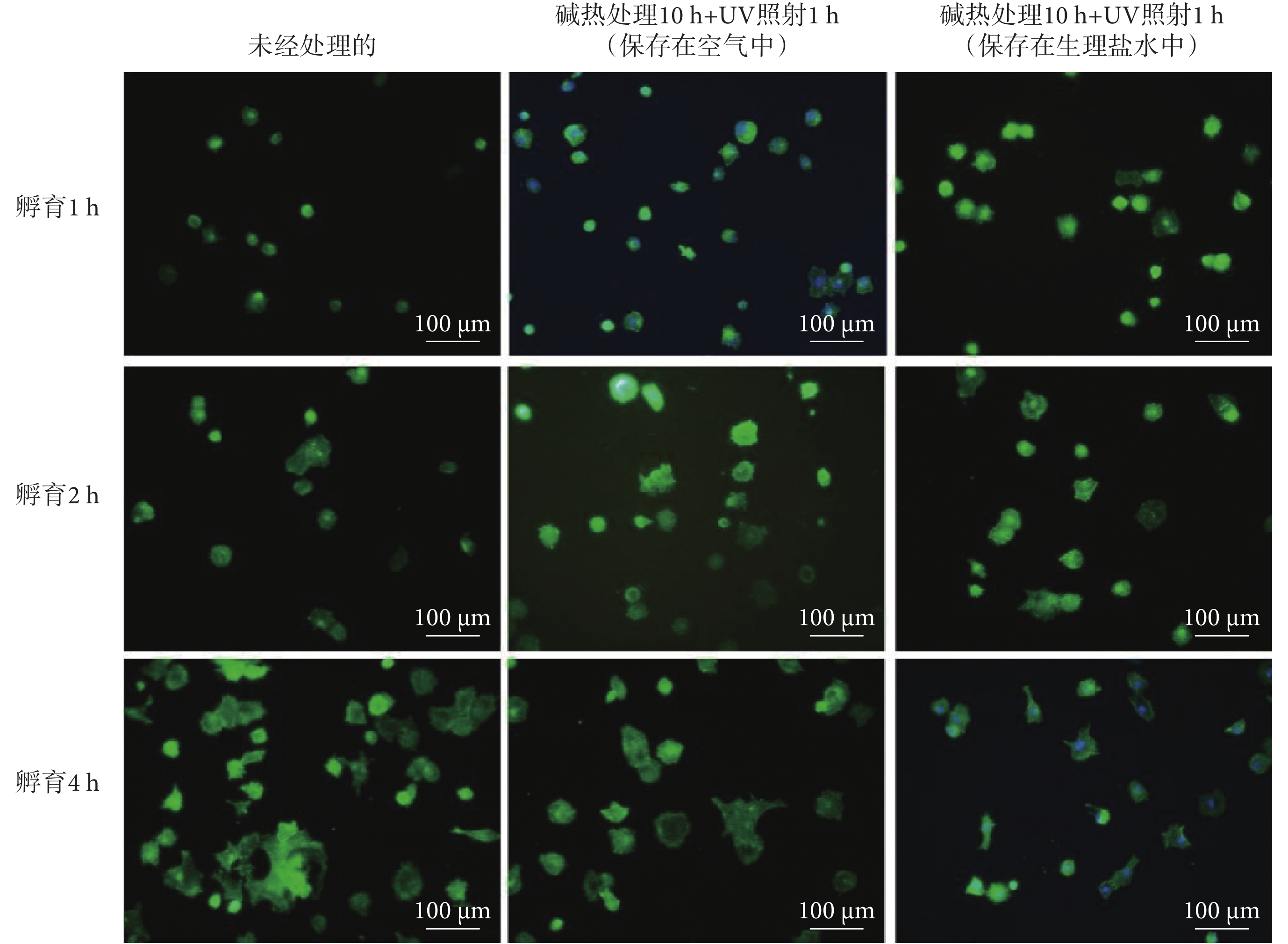 圖4
三種SAL-TA4上不同孵育時長的細胞染色圖
Figure4.
Staining images of cell cultured on three types of SAL-TA4 for different durations
圖4
三種SAL-TA4上不同孵育時長的細胞染色圖
Figure4.
Staining images of cell cultured on three types of SAL-TA4 for different durations
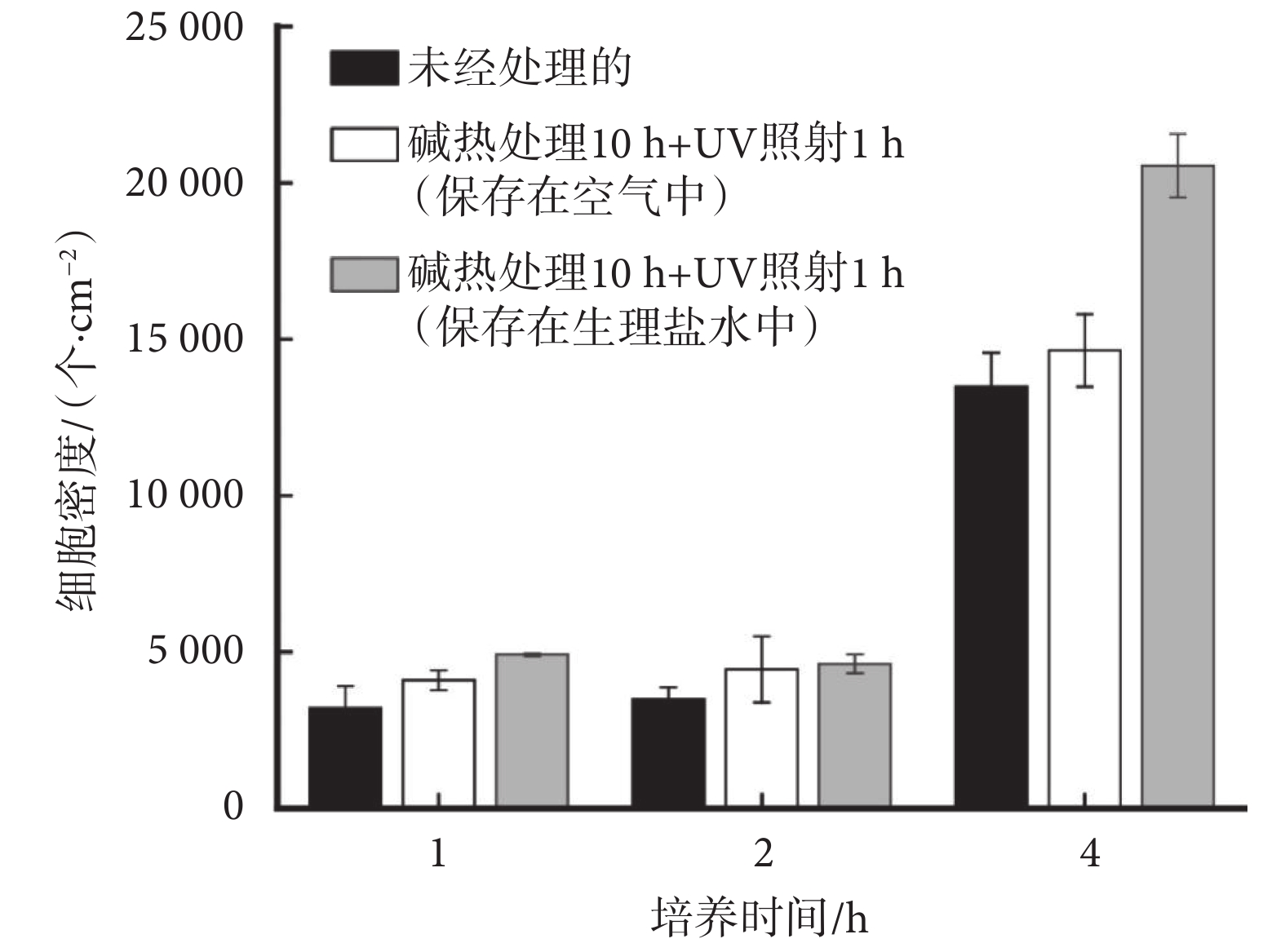 圖5
細胞在三種SAL-TA4上不同孵育時長的細胞數量
Figure5.
Count of cells cultured on three types of SAL-TA4 for different durations
圖5
細胞在三種SAL-TA4上不同孵育時長的細胞數量
Figure5.
Count of cells cultured on three types of SAL-TA4 for different durations
3 結論
本研究旨在探討表面處理技術對提升鈦金屬TA4表面的親水性和生物活性的效果。研究結果顯示,在SLA處理的基礎上,結合堿熱處理和UV光照能夠顯著提高鈦金屬表面的親水性和生物活性。進一步研究發現,經過這種復合處理后的SLA-TA4表面形成了穩定的納米線網絡結構,這種獨特的微觀結構對鈦金屬表面的性質起到了關鍵作用。此外,本研究還發現,保存環境介質對于維持鈦金屬表面的生物活性至關重要,其中生理鹽水作為保存介質更有利于細胞在鈦金屬表面的黏附。本研究的結果為鈦金屬在植入性醫療器械領域的應用提供了一定的科學參考。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻說明:楊開通負責論文撰寫、實驗實施與數據分析等;宋成龍負責實驗設計及實施、接觸角及表面形貌的數據獲取及分析;馬智豪負責文獻調研、實驗方案優化、以及細胞染色實驗的指導;汪杰負責論文審校、實驗方案指導和資助支持。
0 引言
鈦金屬(Ti)及其合金因出色的物理機械性能和優異的生物相容性,被廣泛選用作為口腔種植體的材料[1-2]。然而,純鈦的生物惰性以及與骨組織在結構和性質上的巨大差異,使得純鈦種植體在植入人體后,其生物學活性并不理想,難以與骨組織穩固結合。為了提升種植體與骨組織的結合強度,對鈦金屬及其合金進行表面改性是一種行之有效的方法。眾多研究顯示,經過適當的表面改性,鈦金屬及其合金能夠展現出骨誘導性,有效促進骨細胞在其表面黏附、增殖、分化和礦化[3-5]。即,改性處理能夠改變鈦金屬及其合金的表面特征、化學組成、粗糙度和親水性,這些變化有利于促進鈦金屬與骨結合,改善其生物學活性。
針對鈦及其合金的表面改性,現已廣泛采用的一系列方法技術包括:機械加工表面處理、可吸收噴砂介質處理、鈦漿涂層表面處理、羥基磷灰石涂層及改良、大顆粒噴砂酸蝕(sand-blasted large grift acid-etched,SLA)處理、親水大顆粒噴砂酸蝕處理等[6-9]。此外,表面納米化技術正成為鈦及其合金改性的一種趨勢。該技術通過特定的工藝,在材料表面形成納米級別的結構,例如納米顆粒、納米纖維、納米孔或納米晶體膜[10-13]。研究顯示,這種納米化結構具有與生物骨組織相似的性質,能有效提升骨結合效率[14]。
外部光輻照,特別是紫外光(ultraviolet,UV)照射,能夠顯著影響鈦金屬及其合金的性質[15-16]。例如,UV照射可以改變二氧化鈦(TiO2)的生物活性,這一過程被稱為光功能化[17]。鈦種植體的TiO2氧化層經UV照射后,不僅具有獨特的物理和化學性質,還增強了其生物相容性[18]。首先,TiO2表面的電荷屬性會發生顯著變化,從原本的負電位轉變為正電位[19]。這種電荷的轉變有助于帶負電荷的分子更容易吸附在鈦金屬表面,從而促進細胞的黏附反應,并最終促進細胞外基質(extracellular,ECM)在鈦金屬醫療器械表面的形成[20]。此外,光功能化還能使長期存放的鈦金屬表面的親水性得以恢復,這有利于血液在鈦金屬表面的延展和潤濕。研究表明,UV處理后的鈦金屬表面疏水性降低,骨整合過程加速[21-22],為鈦金屬及其合金在醫療器械領域的應用奠定了基礎。
基于上述研究,本文將對鈦金屬表面進行多種表面改性處理,表征鈦金屬片表面生成的納米線網絡結構,分析表面處理對于材料的元素組成、親水性能及表面粗糙度的影響,以及不同表面處理方式對細胞黏附的影響,并探究鈦金屬經表面處理后其生物活性增強的機制。本研究通過系統梳理不同表面處理方式對于鈦金屬表面理化性質和生物活性的影響,以期為鈦金屬種植體和其他類型鈦金屬醫療器械的研究提供思路和借鑒。
1 材料與方法
1.1 主要試劑和儀器
胎牛血清(fetal bovine serum,FBS)和最低必須培養基(alpha-minimum essential medium,α-MEM)購自大連美侖生物技術有限公司(中國);異硫氰酸熒光素(fluorescein isothiocyanate isomer,FITC)購自北京欣華綠源科技有限公司(中國);鬼筆環肽和4%多聚甲醛固定液購自碧云天生物技術有限公司(中國);生理鹽水RHAWN?購自北農雨禾科技有限公司(中國);氫氧化鈉(NaOH)購自阿拉丁試劑有限公司(中國);無水乙醇購自國藥集團化學試劑有限公司(中國)。
1.2 預處理制備SLA-TA4
首先,把鈦金屬A4(Ti-A4,TA4)加工成直徑為5.0 mm、厚度為1.5 mm的鈦金屬片(以下簡稱:鈦片)。隨后,對鈦片進行表面除油處理:先使用Micro 90清潔劑進行初步清洗,再通過純化水超聲波清洗以去除殘留油污。接著,采用100目的白剛玉對清洗后的鈦片進行噴砂處理,操作條件設定為壓縮空氣壓力6 kPa、噴射距離150 mm、噴砂時間20 s。完成噴砂處理后,將鈦片置于酸蝕液中進行酸蝕處理。該酸蝕液由體積比為1:1:2的硫酸(質量百分比98%)、鹽酸(質量百分比37%)和去離子水混合而成。酸蝕處理在60 ℃的溫度下進行,持續時間為60 min,最終得到的SLA-TA4鈦片。
1.2.1 堿熱處理
將SLA-TA4鈦片置于提前配置好的NaOH(5 mol/L)溶液中,進行初步的堿化處理,隨后將其轉移至65 ℃真空干燥箱中,保溫處理0.5、4.0、10.0 h后,待其自然冷卻至室溫,用無水乙醇和去離子水分別清洗3次,水浴超聲處理20 min后取出,干燥備用。
1.2.2 等離子體轟擊處理
將SLA-TA4鈦片放入真空等離子表面處理系統(PTL-VM500,普特勒電器科技有限公司,中國),在真空環境、功率500 W條件下,放電處理5 min。
1.2.3 UV照射處理
將SLA-TA4鈦片置于45 W的UV光源下,照射1 h。
1.2.4 高溫煅燒
將SLA-TA4鈦片置于管式爐中,在氮氣(N2)保護下升溫至450或700 ℃,熱處理1 h,自然冷卻至室溫備用。
1.3 接觸角測量
采用接觸角測量儀(JC2000C1,上海中晨數字技術設備有限公司,中國)分析樣品(n=6)表面的水接觸角。將純水滴在直徑(φ)為5.0 mm、厚度為1.5 mm的SLA-TA4鈦片樣品表面,通過成相系統分析接觸角的大小,衡量材料表面的親水性。
1.4 不同處理樣品的表面形貌分析
將制備的各組SLA-TA4樣品進行噴金處理后,采用掃描電子顯微鏡(scanning electron microscope,SEM)(JSM-7800F,日本電子株式會社,日本)在20 kV加速電壓下觀察樣品的表面形貌(放大倍數:10 000 ×和30 000 ×)。
1.5 不同處理樣品的表面元素分析
采用X射線光電子能譜儀(x-ray photoelectron spectroscopy,XPS)[Nexsa,賽默飛世爾(蘇州)儀器有限公司,中國]在高真空、150 W 射線輻射、15 kV電壓條件下對各組SLA-TA4樣品的表面元素組成進行檢測。
1.6 不同處理組樣品的粗糙度分析
采用激光共聚焦掃描顯微鏡(laser scanning confocal microscope,LSCM)(IX83,北京瑞科中儀科技有限公司,中國)分別對每個樣品表面選取120 × 120 μm2和20 × 20 μm2 兩處進行三維形貌掃描,并進行粗糙度分析。
1.7 成骨細胞培養
使用α-MEM培養基(含10%滅活胎牛血清、1% 鏈霉素和青霉素)將小鼠胚胎成骨前體細胞MC3T3-E1培養于37 ℃、5% CO2飽和濕度條件的恒溫培養箱中,每2~3 d換1次培養基,細胞鋪滿度為90%時進行傳代操作。將無菌鈦片材料放入24孔板中,接種MC3T3-E1細胞,密度為2×104 個/孔。
1.8 FITC染色評估細胞黏附
首先,配制濃度為0.1 mmol/L的FITC 標記的鬼筆環肽染液,將上述接種細胞的鈦片置于37 ℃磷酸緩沖液中浸泡1 min,然后置于4%多聚甲醛固定液中固定15 min,再使用磷酸緩沖液清洗鈦片2 次,每次清洗10 min,取一定量配制好的鬼筆環肽染液將鈦片覆蓋,于37 ℃條件下避光染色30 min;最后再次使用磷酸緩沖液清洗鈦片2 次,每次10 min,隨后將鈦片置于熒光顯微鏡下觀察細胞黏附情況。
2 結果與分析
2.1 單一表面處理方式對鈦金屬表面親水性的影響
研究發現,鈦金屬表面親水性對于植入人體后的鈦金屬醫療器械生物活性影響較大[23]。而且據以往研究發現,SLA-TA4雖然具有良好親水性,但其親水性不能長期保持[24]。因此,在本研究的初始階段,首先將TA4進行噴砂酸蝕處理成為SLA-TA4,以提高鈦金屬親水性。隨后,本研究對SLA-TA4進行UV光照、等離子體轟擊、高溫煅燒(450 ℃煅燒1 h)、堿熱處理(0.5 h)等多種不同表面處理,并評價這些單一表面處理對SLA鈦金屬的表面親水性的影響。如表1所示,未經處理的SLA-TA4鈦片作為對照組,表面表現出明顯的疏水狀態,空氣中靜置0、24、168 h后,接觸角分別為:115.18°、116.22°、118.73°。然而,經過鹽酸酸蝕、UV光照、高溫煅燒、等離子體轟擊和堿熱處理后,SLA鈦片表面的親水性得到了顯著提升。盡管如此,隨著材料在大氣環境中保存時間的延長,除了堿熱處理之外,其他四種方法處理的鈦片在空氣中的親水性難以維持長期穩定,無法滿足鈦金屬醫療器械長期保存的需求。因此,在后續的研究中,本文重點研究了以堿熱處理為基礎的多種表面處理組合,以尋求更穩定的親水性改善方案。
2.2 堿熱處理在鈦金材料表面形成的納米線網絡結構
基于上述研究發現,SLA-TA4表面經過單一堿熱處理后表現出極佳親水性能,本文進一步探究了堿熱處理時長對材料親水性能及表面形貌的影響。通過對樣品表面的水接觸角測試發現,不同時長的堿熱處理使得樣品表面親水性發生變化。如圖1所示,經0.5、4.0、10.0 h堿熱處理后,SLA-TA4樣品的接觸角分別為8.38°、6.34°、3.32°,遠低于未經處理的SLA表面接觸角123.44°,且接觸角度數隨著堿熱處理時長的增加而逐漸降低。
 圖1
不同時長堿熱處理后SLA-TA4的接觸角和SEM圖像
Figure1.
Contact angle and SEM images of SLA-TA4 after alkali heat treatment of different duration
圖1
不同時長堿熱處理后SLA-TA4的接觸角和SEM圖像
Figure1.
Contact angle and SEM images of SLA-TA4 after alkali heat treatment of different duration
如圖1所示,未經處理的SLA表面呈現出光滑的微坑。堿熱處理0.5 h后,微坑邊緣銳化,形成隨機堆積狀態的納米線結構,樣品表面的粗糙度明顯提高;堿熱處理4.0 h后,SLA-TA4表面的納米結構更加密集,納米線長度增加。堿熱處理10.0 h后形成了典型納米線網絡結構,該結構中的納米級孔洞密集,存在大量的間隙,更易引發虹吸效應。由此可見,長時間的堿熱處理會豐富其表面納米結構,而納米線結構具有更穩定的暴露晶面,具備該結構的樣品表面與各種溶劑分子之間存在著更強的相互作用。除此之外,納米線網絡結構中電荷的轉移以及物質的擴散會更快,這些都將有利于鈦金屬材料表面親水性能的提升。
2.3 堿熱處理SLA-TA4樣品的粗糙度及元素分析
首先,通過LSCM對三種樣品,分別是:未經處理的SLA-TA4、保存在空氣中堿熱處理10 h的SLA-TA4、保存在生理鹽水中堿熱處理10 h的SLA-TA4,進行微坑深度測量和三維形貌的表征。此外,對堿熱處理的SLA-TA4樣品進行表面粗糙度和XPS元素分析,以闡明堿熱處理對SLA-TA4表面親水性能的影響機制。如圖2所示,三種樣品表面微坑最大深度分別為16.2、18.6、 22.2 μm,微坑平均深度為11.683 ± 0.073、12.149 ± 0.131、14.277 ± 0.218 μm,在生理鹽水中保存的樣品微坑最深,波動也相對最大。隨后,又測量了這三種樣品的表面粗糙度,其粗糙度平均值分別為1.914±0.0143、2.148 ± 0.066、2.335 ± 0.098 μm。其中,SLA-TA4經堿熱處理后并保存在生理鹽水中的樣品表面粗糙度更大,其親水性能也更好。
 圖2
堿熱處理對SLA-TA4樣品表面的影響
Figure2.
Effect of alkali heat treatment on SLA-TA4 sample surface
圖2
堿熱處理對SLA-TA4樣品表面的影響
Figure2.
Effect of alkali heat treatment on SLA-TA4 sample surface
通過XPS元素分析可以發現,經過堿熱處理后的SLA-TA4樣品表面開始出現鈉(Na)元素的沉積。這是因為暴露在空氣中的鈦金屬表面一般會存在TiO2層,強堿NaOH會與TiO2發生反應,生成鈦酸鈉凝膠層[25]。在隨后的高溫熱處理中,鈦酸鈉凝膠層會逐漸轉變為無規則形貌的碳酸鈉涂層,其結構會更加穩定并且能夠顯著增強金屬基體之間的結合力[26-27]。此外,SLA-TA4鈦片表面沉積的鈉離子(Na+)會與水中的水合氫離子(H3O+)發生離子交換,可以形成表面富含鈦羥基(TiOH)的活化層,從而賦予了材料更好的親水性能和生物活性[28],也有利于誘導鈣離子(Ca2+)及磷酸根離子的沉積。對經過不同時長堿熱處理后的樣品表面進行元素含量分析,其中氧(O)元素含量基本保持不變,但碳(C)和Na的元素含量逐漸升高,長時間的堿熱處理使得樣品表面的碳酸鈉涂層更加穩固,這也使得材料具備了更優良的親水性。
2.4 基于堿熱處理的多種表面處理方式
為了提升材料表面的親水性能并增強其支持細胞增殖與分化的能力,本研究探討了以SLA處理后的堿熱處理為基本步驟,輔以其他表面處理技術作為二次處理的復合改性策略,旨在進一步優化材料的表面特性。
由表2所示,4種不同復合處理方式處理后的SLA-TA4樣品均展現出卓越的親水性能,彼此之間并無明顯差異。然而,隨著樣品在空氣中的保存時間延長至24 h和168 h,堿熱處理 + 高溫煅燒(450、700 ℃)、堿熱處理 + 等離子體轟擊等幾組樣品的接觸角會隨著時間變化而逐漸變大,表明親水性能有所下降。只有堿熱處理+UV光照處理的樣品保持穩定的親水性。另外,經過復合表面處理的樣品其接觸角均低于任何單一的表面處理方式形成的接觸角,且在長期穩定性方面表現更佳。這表明,通過復合表面處理方法可以顯著提升鈦金屬表面的親水性能。
由于700 ℃條件下的高溫煅燒容易使材料發生脆裂,導致材料表面的微納結構和組織成分發生破壞[29],在后續研究中重點分析另外3種復合處理手段,即:以堿熱處理為基礎步驟的處理時間均為10 h;450 ℃煅燒時間為1 h;等離子體轟擊時間為1.2.1小節描述的5 min;UV照射為1 h。利用SEM對上述3種復合處理方式的SLA-TA4樣品進行表面形貌表征。如圖3所示,經過不同表面處理后的樣品,表面形貌發生明顯變化。由未經處理的SLA-TA4表面的淺坑衍生為尖銳的毛細纖維形貌,并且有明顯的蜂窩孔洞結構出現,表面粗糙度明顯增加。對比發現,堿熱處理+UV光照得到的樣品表面毛細纖維更尖銳,表面孔洞數量也明顯更多。除此之外,研究發現堿熱處理SLA-TA4后繼續進行1 h的UV光照,可以有效地減小樣品表面所存在的碳氫化合物含量,從而進一步提升樣品的表面親水性能,這也將有利于成骨細胞的黏附[30]。
 圖3
不同表面處理方式協同堿熱處理的SLA-TA4的SEM圖像
Figure3.
SEM images of SLA-TA4 after different surface treatments in conjunction with alkali heat treatment
圖3
不同表面處理方式協同堿熱處理的SLA-TA4的SEM圖像
Figure3.
SEM images of SLA-TA4 after different surface treatments in conjunction with alkali heat treatment
2.5 SLA-TA4的細胞活性實驗
前文實驗結果表明,通過堿熱處理10 h與UV照射1 h的復合表面處理方法能夠顯著提升SLA-TA4表面的親水性。接下來,本文將以MC3T3-E1細胞實驗進一步驗證該方法對細胞黏附和活性的影響。為了探究不同保存介質對結果的影響,將經過堿熱處理10 h+UV照射1 h的SLA-TA4樣品分別置于空氣和生理鹽水中保存,并以未經處理的SLA-TA4作為對照,在這些樣品上進行細胞接種實驗。
如圖4所示,由MC3T3-E1細胞在樣品表面黏附后的染色結果可知,1~4 h細胞黏附期間內,三種樣品[未經處理的、堿熱處理10 h+UV照射1 h(保存在空氣中)、堿熱處理10 h+UV照射1 h(保存在生理鹽水中)]上細胞黏附數量都逐漸增多,當孵育時間達到4 h時,三組SLA-TA4樣品表面黏附的細胞數量均顯著增加,細胞在樣品表面的鋪展性也隨孵育時間而增加。如圖5所示,細胞在堿熱處理10 h + UV照射1 h(保存在生理鹽水中)樣品上的黏附數量高于其他兩組,且差異明顯。與未經處理的SLA-TA4樣品相比,堿熱處理10 h + UV照射1 h和生理鹽水保存環境均能夠增加材料表面上細胞黏附數量,且有利于細胞鋪展。此外,對比不同孵育時間保存在生理鹽水中和保存在空氣中的細胞數量可以發現,生理鹽水保存能夠更好發揮鈦金屬表面的生物相容性。
 圖4
三種SAL-TA4上不同孵育時長的細胞染色圖
Figure4.
Staining images of cell cultured on three types of SAL-TA4 for different durations
圖4
三種SAL-TA4上不同孵育時長的細胞染色圖
Figure4.
Staining images of cell cultured on three types of SAL-TA4 for different durations
 圖5
細胞在三種SAL-TA4上不同孵育時長的細胞數量
Figure5.
Count of cells cultured on three types of SAL-TA4 for different durations
圖5
細胞在三種SAL-TA4上不同孵育時長的細胞數量
Figure5.
Count of cells cultured on three types of SAL-TA4 for different durations
3 結論
本研究旨在探討表面處理技術對提升鈦金屬TA4表面的親水性和生物活性的效果。研究結果顯示,在SLA處理的基礎上,結合堿熱處理和UV光照能夠顯著提高鈦金屬表面的親水性和生物活性。進一步研究發現,經過這種復合處理后的SLA-TA4表面形成了穩定的納米線網絡結構,這種獨特的微觀結構對鈦金屬表面的性質起到了關鍵作用。此外,本研究還發現,保存環境介質對于維持鈦金屬表面的生物活性至關重要,其中生理鹽水作為保存介質更有利于細胞在鈦金屬表面的黏附。本研究的結果為鈦金屬在植入性醫療器械領域的應用提供了一定的科學參考。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻說明:楊開通負責論文撰寫、實驗實施與數據分析等;宋成龍負責實驗設計及實施、接觸角及表面形貌的數據獲取及分析;馬智豪負責文獻調研、實驗方案優化、以及細胞染色實驗的指導;汪杰負責論文審校、實驗方案指導和資助支持。