冷凍干燥是一種使生物樣本在干燥狀態下保存的技術,有利于儲存、運輸并節省成本。本文使用聚乙二醇(PEG)和海藻糖(Tre)組成的凍干保護劑處理牛心包,進行冷凍干燥。結果表明:使用PEG + 10% w/v Tre處理牛心包進行冷凍干燥后,其力學性能優于使用戊二醛(GA)固定的牛心包。卡爾費休法測定,牛心包復水后的濕態含水量為(74.81 ± 1.44)%,與GA固定的牛心包無明顯差異。干態含水量為(8.64 ± 1.52)%,說明在冷凍干燥過程中能有效脫水。差示掃描量熱儀(DSC)的測試結果顯示,牛心包的熱皺縮溫度為(84.96 ± 0.49)℃比GA固定的牛心包(83.14 ± 0.11)℃高,說明具有更高的熱穩定性。傅里葉變換紅外光譜(FTIR)結果顯示,在冷凍干燥過程中,蛋白質結構并未受到破壞。蘇木精-伊紅(HE)染色表明,冷凍干燥過程可以減少孔隙的產生,防止冰晶的生長,使組織纖維結構排列更緊密。細胞存活率與溶血率檢測結果顯示,細胞增殖率為(77.87 ± 0.49)%,毒性分級為1級,溶血率為(0.17 ± 0.02)%,低于5%的標準,即經過冷凍干燥處理的牛心包在細胞毒性和溶血方面表現良好,符合相關標準。綜上,使用PEG + 10% w/v Tre處理牛心包進行冷凍干燥后的性能符合要求。
引用本文: 黃偉, 李維杰, 劉寶林. 使用聚乙二醇和海藻糖的組合冷凍干燥牛心包的性能影響. 生物醫學工程學雜志, 2024, 41(2): 368-375. doi: 10.7507/1001-5515.202311035 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
心血管疾病是導致人群死亡的重要原因[1],瓣膜性心臟病又是常見的心血管疾病之一,主要癥狀有瓣膜狹窄、反流[2-3]。研究表明,中國大約有2 500萬的患者患有心臟瓣膜病[4],美國每年大約有30萬人需要做心臟瓣膜手術[5],并且由于老年人口的增加,預計到2050年大約有80萬人需要做心臟瓣膜手術[6-7]。目前,有效的治療方式是人工心臟瓣膜置換,主要包括機械瓣膜和人工生物心臟瓣膜[8-9]。由于人工生物心臟瓣膜與機械瓣膜相比具有良好的生物相容性和血流動力學性能,因此人工生物瓣膜的使用頻率高于機械瓣膜[10-11]。心包主要由膠原蛋白、纖維及心臟周圍組織組成[12-13],心包的膠原纖維具有多層結構且每層的排列方向不同,使心包具有優異的機械性能,因此常用來作為生物瓣膜的原材料。目前,常用的生物瓣膜主要使用0.625%戊二醛(glutaraldehyde,GA)固定的牛心包或豬心包制成[14-15]。
目前,牛心包材料有玻璃化保存或者在–80℃下保存等低溫保存方式[16-17],但在心包保存過程中會造成不利影響,如細胞活力與線粒體形態的受損[18],以及生物力學性能的改變和冰晶形成破壞細胞外基質等[19-20]。冷凍干燥技術是使組織材料、蛋白質藥物或疫苗在干燥狀態下保存的技術[21],主要分為預冷、一次干燥、二次干燥等階段[22]。冷凍干燥技術已廣泛應用于藥品及食品領域[23],最近,也有研究應用于牛心包的保存研究[24]。Wang等[25]與Goecke等[26]使用蔗糖作為凍干保護劑對豬瓣膜進行冷凍干燥,發現瓣膜經復水后,凍干的瓣膜具有良好的組織結構和細胞再生的能力。因此,冷凍干燥是替代低溫保存的有效方法,可以保持細胞質基質的結構,并能在室溫下保存,達到降低儲藏與運輸成本的目的。目前,常用的凍干保護劑主要有糖、醇、聚合物、氨基酸等[27]。
本文通過添加聚乙二醇(polyethylene glycol,PEG)和海藻糖(trehalose,Tre)組成的凍干保護劑對經GA固定的心包進行處理并冷凍干燥,研究冷凍干燥后牛心包的厚度、力學性能、組織學形態、含水量、傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)等方法,對牛心包冷凍干燥后的性能進行初步探討。
1 材料與方法
1.1 材料與試劑
小鼠成纖維細胞(L929細胞)(中國科學院典型培養物保藏委員會細胞庫),新鮮兔血與抗凝劑(上海安助醫療科技有限公司),聚乙二醇(Adams,瑞士)、海藻糖(Adamas,瑞士),卡爾費休試劑(honeywell,德國)、無水甲醇(honeywell,德國),噻唑藍(MTT,Sigma公司,美國),胎牛血清(Corning公司,美國),MEM培養基(HyClone公司,美國),異丙醇(國藥集團化學試劑有限公司,中國),生理鹽水(河南科倫藥業有限公司,中國),牛心包由微創心通醫療科技有限公司提供。
1.2 儀器
冷凍干燥機(Advantage 2.0 Benchtop Freeze Drye,美國),萬能材料試驗機(E1F1G1-5943,ISTRON公司,美國),傅里葉紅外光譜儀(Thermo Nicolet iS5,美國),卡氏水分儀(Metrohm,瑞士),顯微鏡(BX40,日本),酶標儀(SYNERGYH1,Thermo Fisher公司,美國),恒溫搖床(THZ100,中國),測厚儀(CHB10120,中國)。
2 試驗方法
2.1 冷凍干燥保護劑的配制
將PEG與不同濃度的Tre溶液混合配置成不同濃度的混合凍干保護劑,具體濃度為5% w/v、10% w/v、15% w/v的海藻糖溶液混合,GA固定處理的心包為對照組。
2.2 牛心包的處理
將牛心包經生理鹽水沖洗5 min,共3次,去除掉心包上殘留的GA,將牛心包放入凍干保護劑中浸泡,置于恒溫搖床上震蕩,條件設置為37 ℃、70 r/min、4 h。
牛心包放入冷凍干燥機中并冷凍干燥,冷凍干燥程序參考Wang等[25]的方法進行修改,具體參數設置為:預冷溫度設置–40 ℃,時間300 min;一次干燥溫度設置–30 ℃,時間設置1 200 min,壓強15 Pa;二次干燥溫度設置20 ℃,時間設置360 min,壓強15 Pa;冷凍干燥完成后牛心包經環氧乙烷滅菌后進行性能測定。
2.3 測定指標
2.3.1 心包厚度測定
使用測厚儀測定心包冷凍干燥前后的厚度值(n = 6),每片心包測定4個點,用測厚儀讀取10 s后的數值,對冷凍干燥前后的厚度進行比較測定。
2.3.2 力學性能的測定
(1)斷裂性能:將心包裁剪成5 mm × 25 mm的心包條(n = 6),使用測厚儀記錄心包條的厚度,通過萬能材料試驗機以拉伸速率100 mm/min的速度進行拉伸,測定心包冷凍干燥后斷裂力、斷裂強度、斷裂伸長率的變化。
(2)破裂性能:將心包裁剪成33 mm × 33 mm的心包片(n = 6),使用測厚儀記錄心包片的厚度,通過萬能材料試驗機以壓縮速率100 mm/min對心包進行壓縮,測定心包冷凍干燥后破裂力、破裂強度的變化。
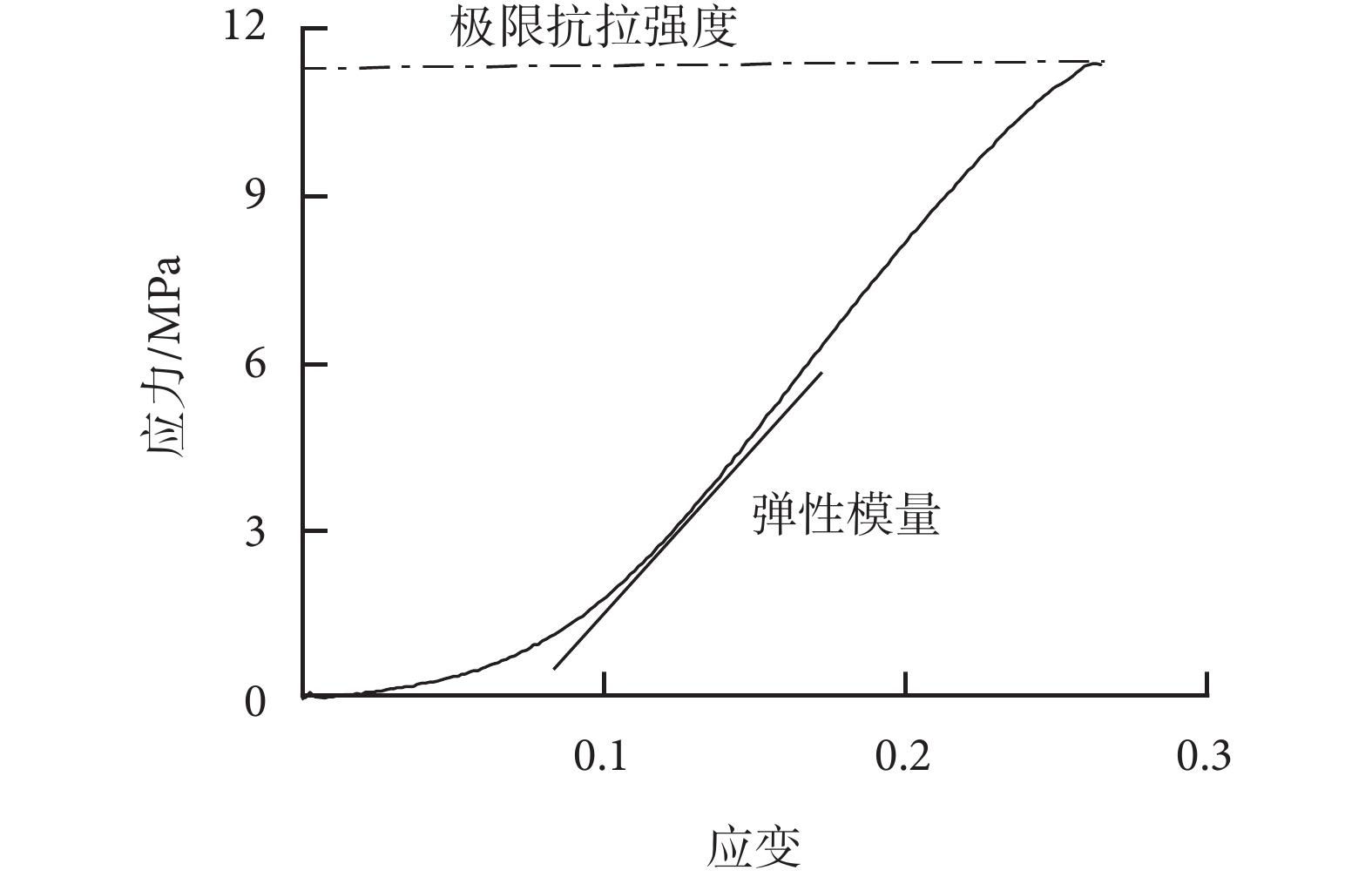
(3)應力-應變曲線:根據牛心包在拉伸時的數據計算出牛心包的應力、應變。根據應力-應變曲線(見圖1)計算出牛心包的彈性模量與極限抗拉強度。
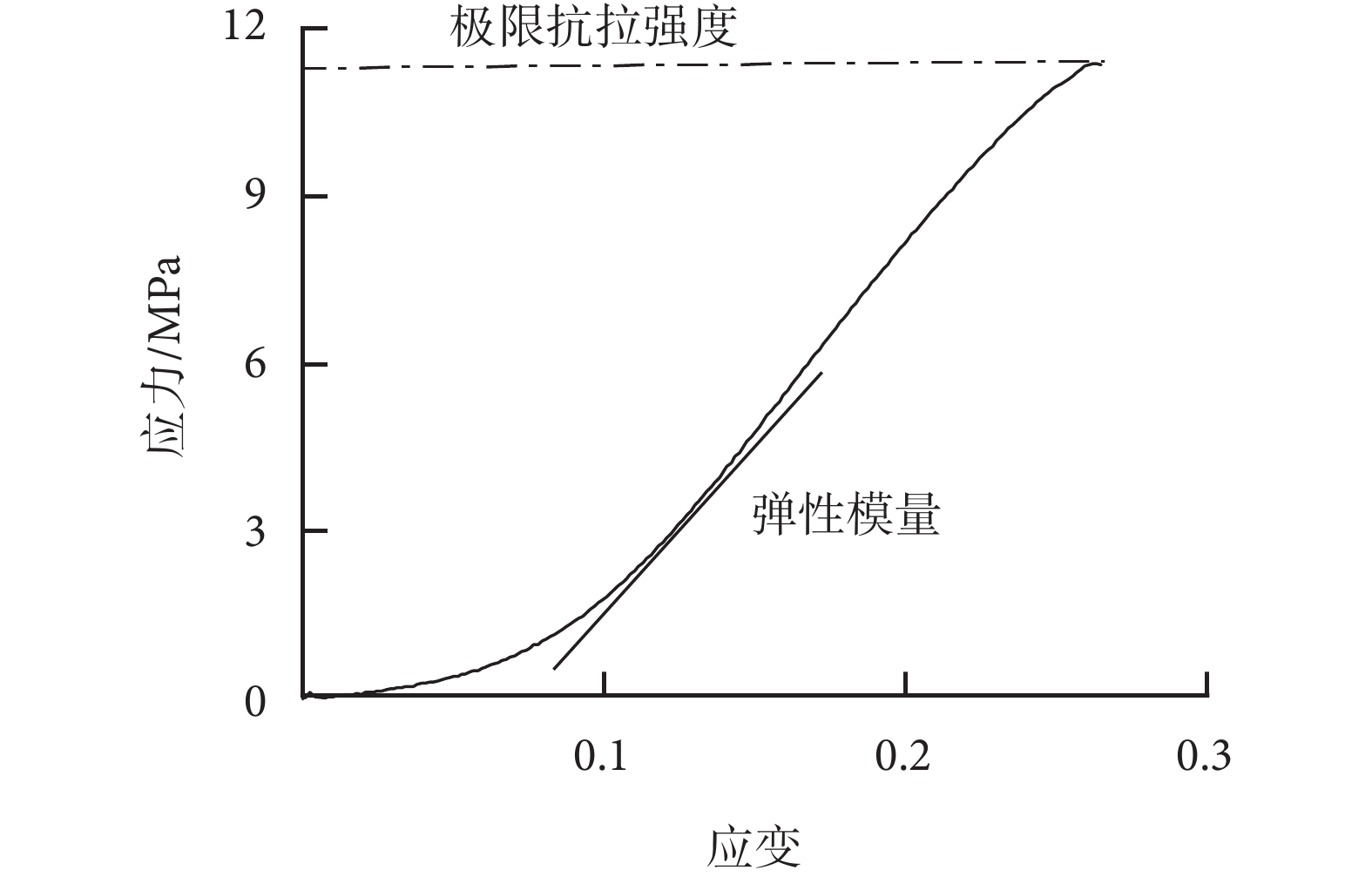 圖1
應力-應變曲線
Figure1.
Stress-strain curve
圖1
應力-應變曲線
Figure1.
Stress-strain curve
2.3.3 牛心包含水量的測定
在測定心包含水量前,使用超純水進行滴定度測定(3次),滴定結果為4.5~5.5 mg/mL時符合反應條件,對心包進行含水量的測定;剪取30~50 mg的牛心包樣品放入樣品瓶(n = 10),放入卡氏爐中在氮氣氛圍下進行加熱,氮氣流速為50 mL/min,加熱溫度升至150 ℃使組織中的水分完全蒸發至卡氏反應爐中,在反應爐中水分通過與無水甲醇和卡爾費休試劑進行反應,通過卡爾費休庫倫滴定法測定出牛心包的含水量。
2.3.4 牛心包熱穩定性測定
將冷凍干燥后的牛心包樣品經生理鹽水復水后,將牛心包剪成5~10 mg的塊狀,使用差示掃描量熱儀對心包進行熱皺縮溫度的分析,升溫范圍為20~100 ℃,升溫速率為10 ℃/min。
2.3.5 牛心包傅里葉紅外變換光譜掃描
通過紅外光譜對冷凍干燥后的心包進行表征處理,測定蛋白質結構的變化。將冷凍干燥后的心包進行裁剪1 cm × 1 cm的小塊,對心包進行掃描處理,紅外光譜的掃描范圍為4 000~400 cm?1,分辨率4 cm?1,掃描次數32次。
2.3.6 蘇木精-伊紅染色
對冷凍干燥的牛心包進行組織學評價,使用蘇木精-伊紅(hematoxylin-eosin,HE)染色觀察心包的組織形態,將冷凍干燥后的心包裁剪成1 cm × 1 cm的小樣,石蠟包埋、切片,經HE染色后,將制成的切片置于光學顯微鏡下觀察心包的組織形態并拍照。
2.3.7 體外細胞毒性評價
依據GB/T 16886.5醫療器械標準規范進行細胞毒性檢測,選擇MTT細胞毒性實驗對冷凍干燥后的心包材料進行細胞毒性檢測。選取細胞濃度為1 × 105/mL的L929細胞,在96孔板中接種100 μL,放在二氧化碳培養箱中培養24 h,吸出培養基,每孔分別加入100 μL的空白對照液、陰性對照液、陽性對照液、樣品浸提液,再次培養24 h,棄去培養液加入50 μL的MTT溶液孵育2 h;棄去孔內液體,加入100 μL異丙醇,震蕩混勻,用酶標儀在570 nm出測定吸光度,計算細胞的存活率。細胞增殖率大于等于75%時,即細胞毒性小于等于1級時符合標準規范。
2.3.8 溶血性能測定
依據GB/T 16886.4醫療器械標準規范進行溶血性能的檢測,將經過環氧乙烷滅菌的牛心包材料按照6 cm2/L的比例加入浸提介質,與陰性對照組、陽性對照組一起放入37 ℃水浴鍋中孵育30 min,取出后按照6 cm2/L的比例加入新鮮抗凝兔血、在37 ℃水浴孵育60 min,吸出管內液體以800 g離心5 min,取上清液,用酶標儀在545 nm處測定吸光度并計算溶血率。
2.4 統計學分析
實驗數據均使用GraphPad Prism10.0軟件進行統計學數據處理,多組數據之間采用單因素方差分析(one-way ANOVA檢驗),兩組數據比較間采用t檢驗;數據均表示為均值 ± 標準差,檢驗水準為0.05。
3 結果與討論
3.1 厚度
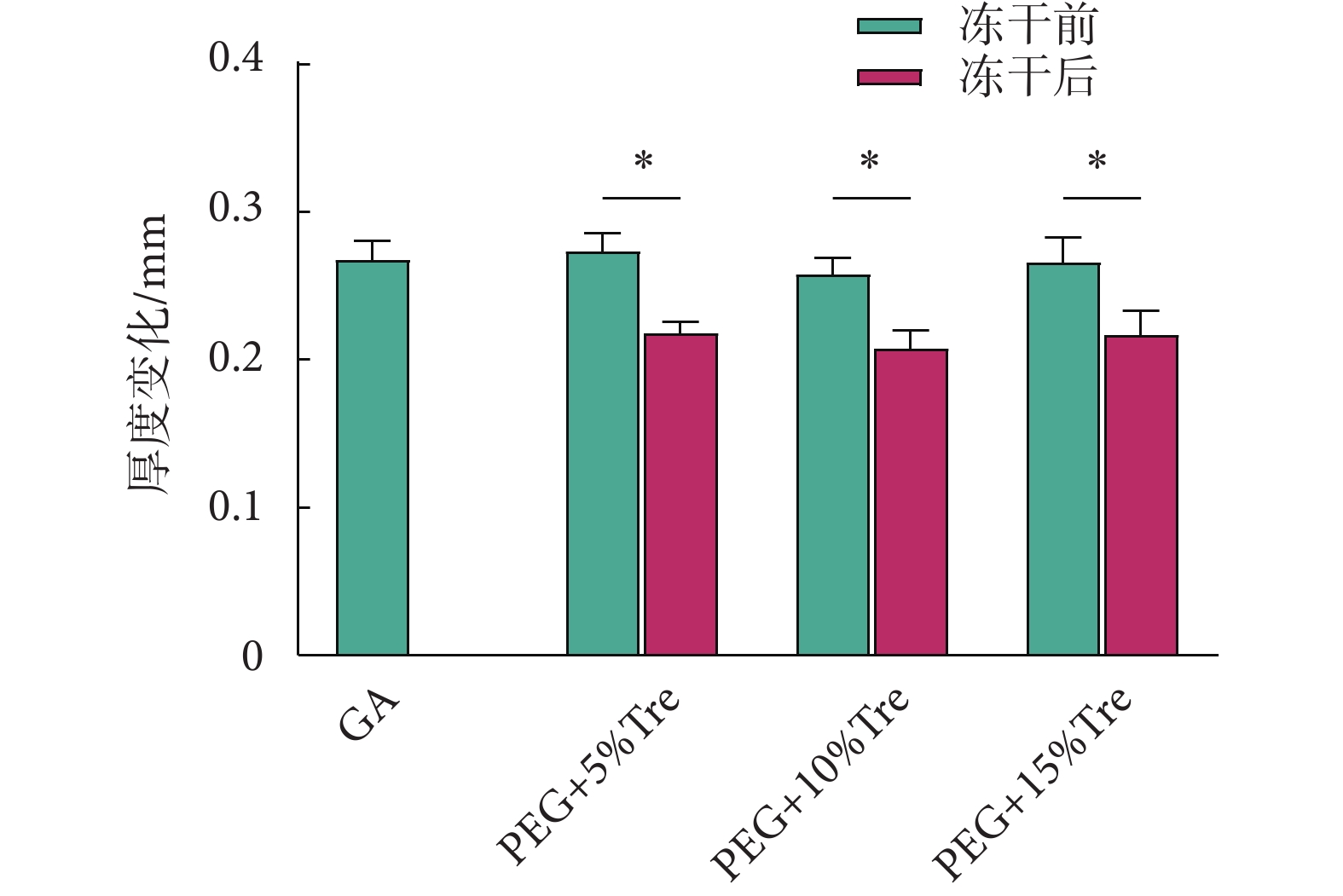
圖2為測定的牛心包凍干前后的厚度。冷凍干燥后的牛心包經復水10 min后與凍干的牛心包相比,凍干的牛心包厚度更薄(P < 0.05),說明心包在冷凍干燥過程中能有效脫水,導致厚度變薄。
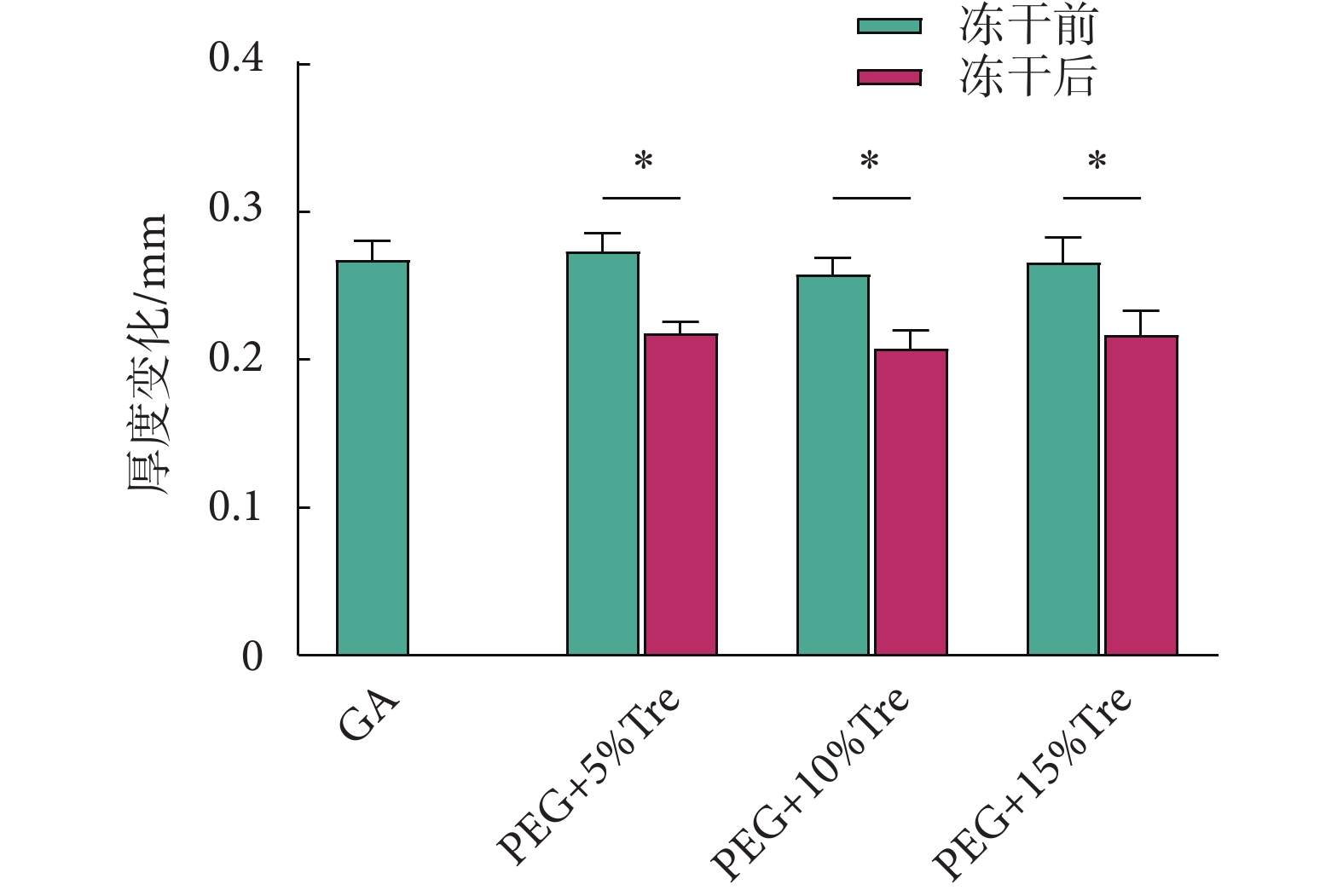 圖2
牛心包冷凍干燥前后的厚度(*P < 0.05)
Figure2.
Thickness of bovine pericardium before and after freeze-drying (*P < 0.05)
圖2
牛心包冷凍干燥前后的厚度(*P < 0.05)
Figure2.
Thickness of bovine pericardium before and after freeze-drying (*P < 0.05)
3.2 力學性能
3.2.1 斷裂性能
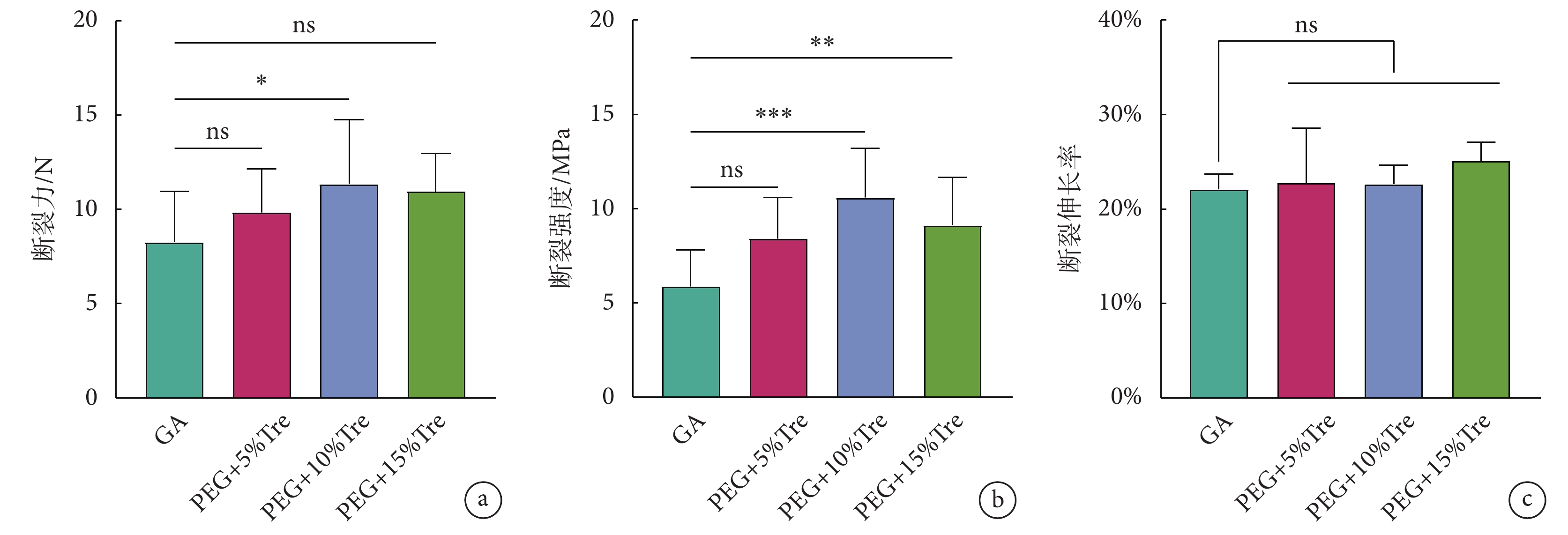
牛心包的斷裂性能如圖3所示。圖3a、b顯示冷凍干燥后的牛心包斷裂性能優于GA固定的牛心包,可以承受更高強度的力;圖3c顯示GA組和凍干保護劑組牛心包后的斷裂伸長率無明顯差異。
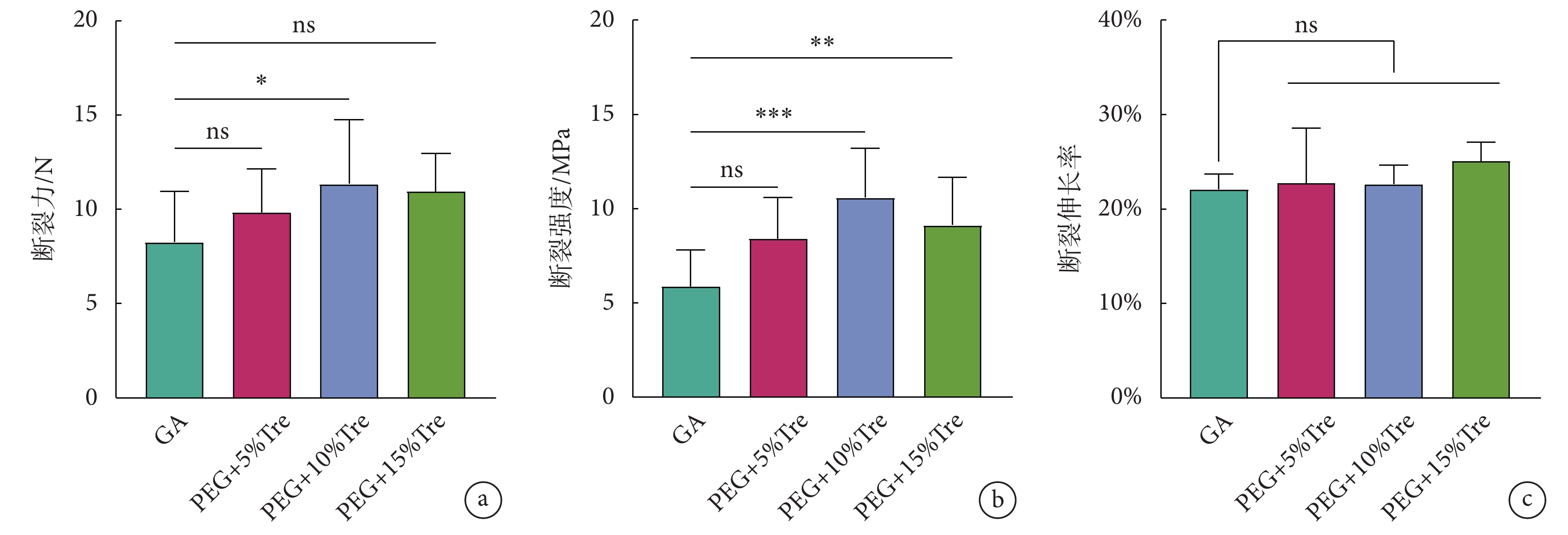 圖3
牛心包冷凍干燥后的斷裂性能
圖3
牛心包冷凍干燥后的斷裂性能
a. 斷裂力;b. 斷裂強度;c. 斷裂伸長率;*
a. breaking force; b. breaking strength; c. breaking elongation; *
3.2.2 破裂性能
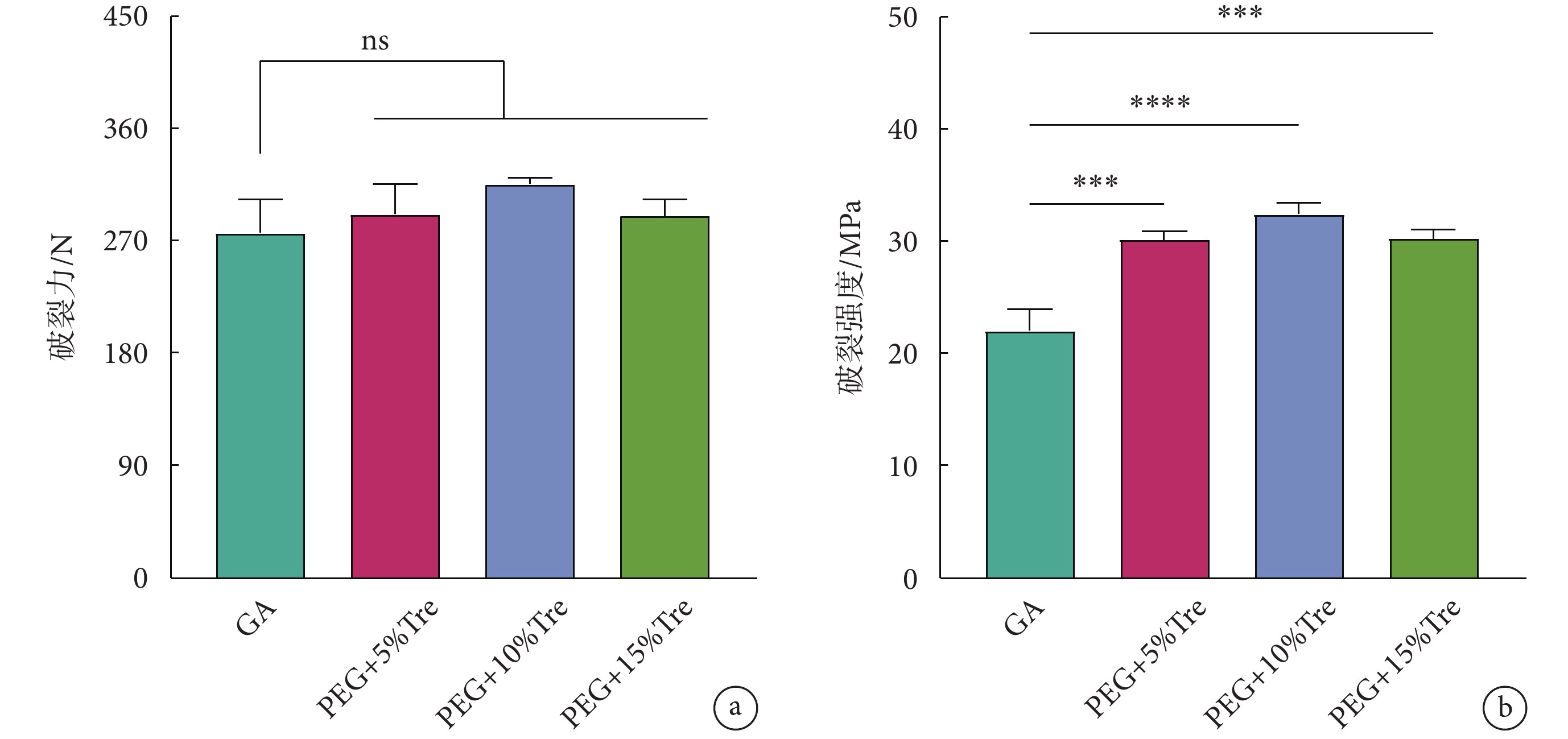
牛心包的破裂性能如圖4所示。圖4a為牛心包冷凍干燥后的破裂力,各組間均無明顯差異;圖4b為牛心包的破裂強度,凍干保護劑組的牛心包破裂強度均優于GA組,說明牛心包在冷凍干燥過程中有水分流失造成厚度減薄,圖2的結果再次得以證實。
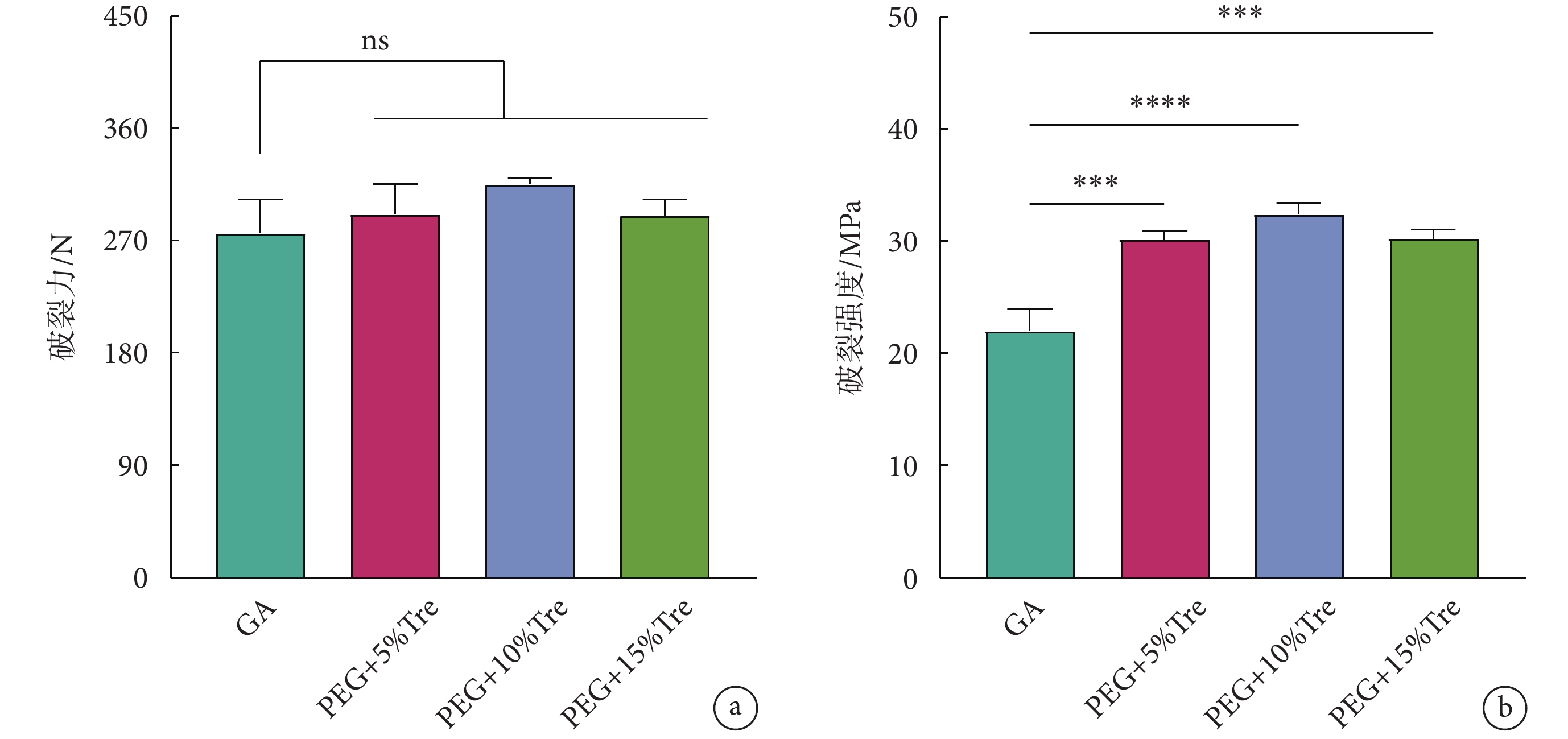 圖4
牛心包冷凍干燥后的破裂性能
圖4
牛心包冷凍干燥后的破裂性能
a. 破裂力;b. 破裂強度;***
a. rupture force; b. rupture strength; ***
3.2.3 應力-應變曲線
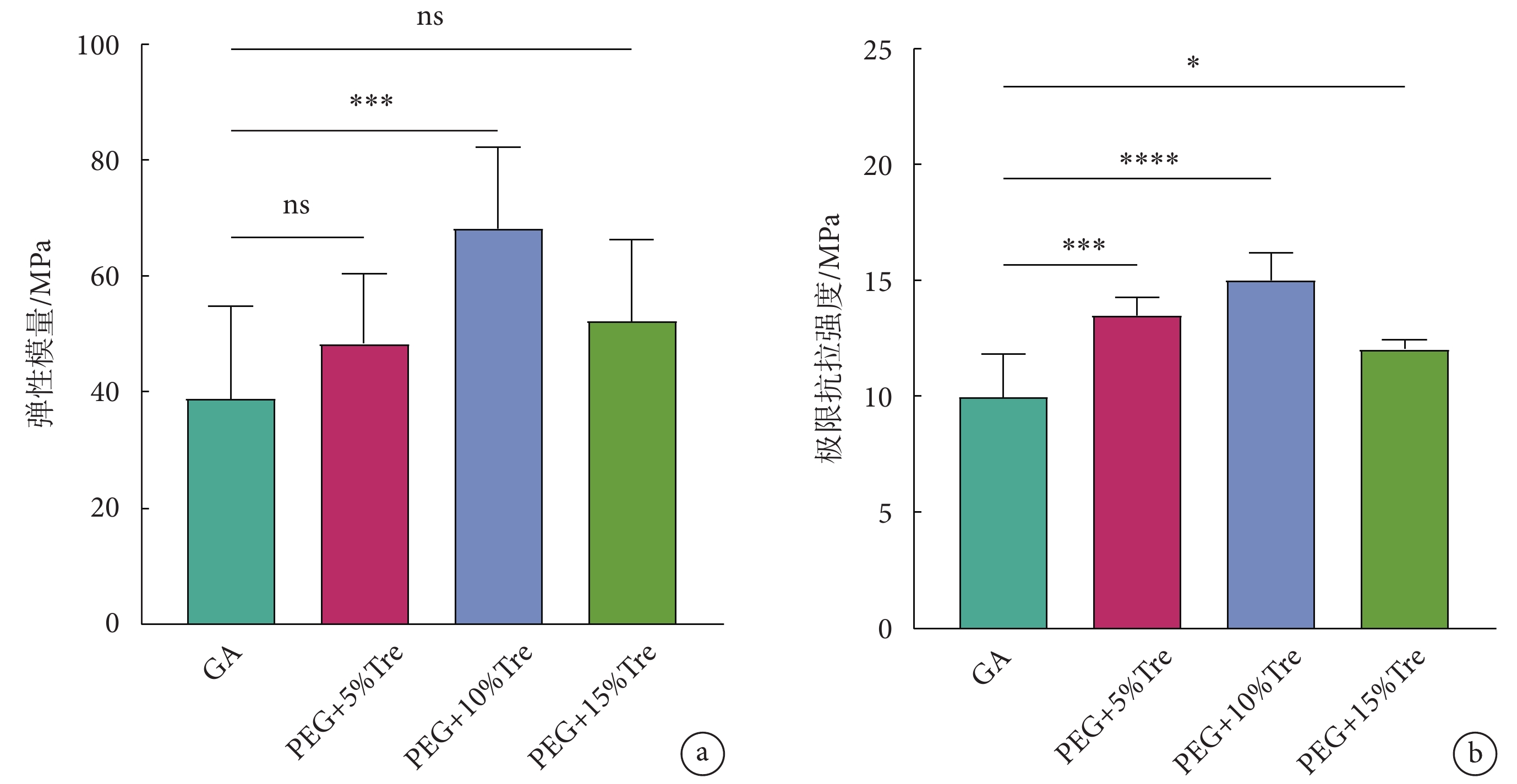
應力-應變曲線主要反映彈性模量與抗拉強度的大小,如圖5所示。圖5a為牛心包的彈性模量,PEG + 10% w/v Tre組的彈性模量優于GA組和其余實驗組,說明PEG + 10% w/v Tre組處理的牛心包具有更好的抵抗形變的能力;圖5b為牛心包的極限抗拉強度,PEG + 10% w/v Tre組的極限抗拉強度優于其他實驗組與對照組,說明PEG + 10% w/v Tre組牛心包經冷凍干燥后增強了機械性能,可以承受更高的負荷。
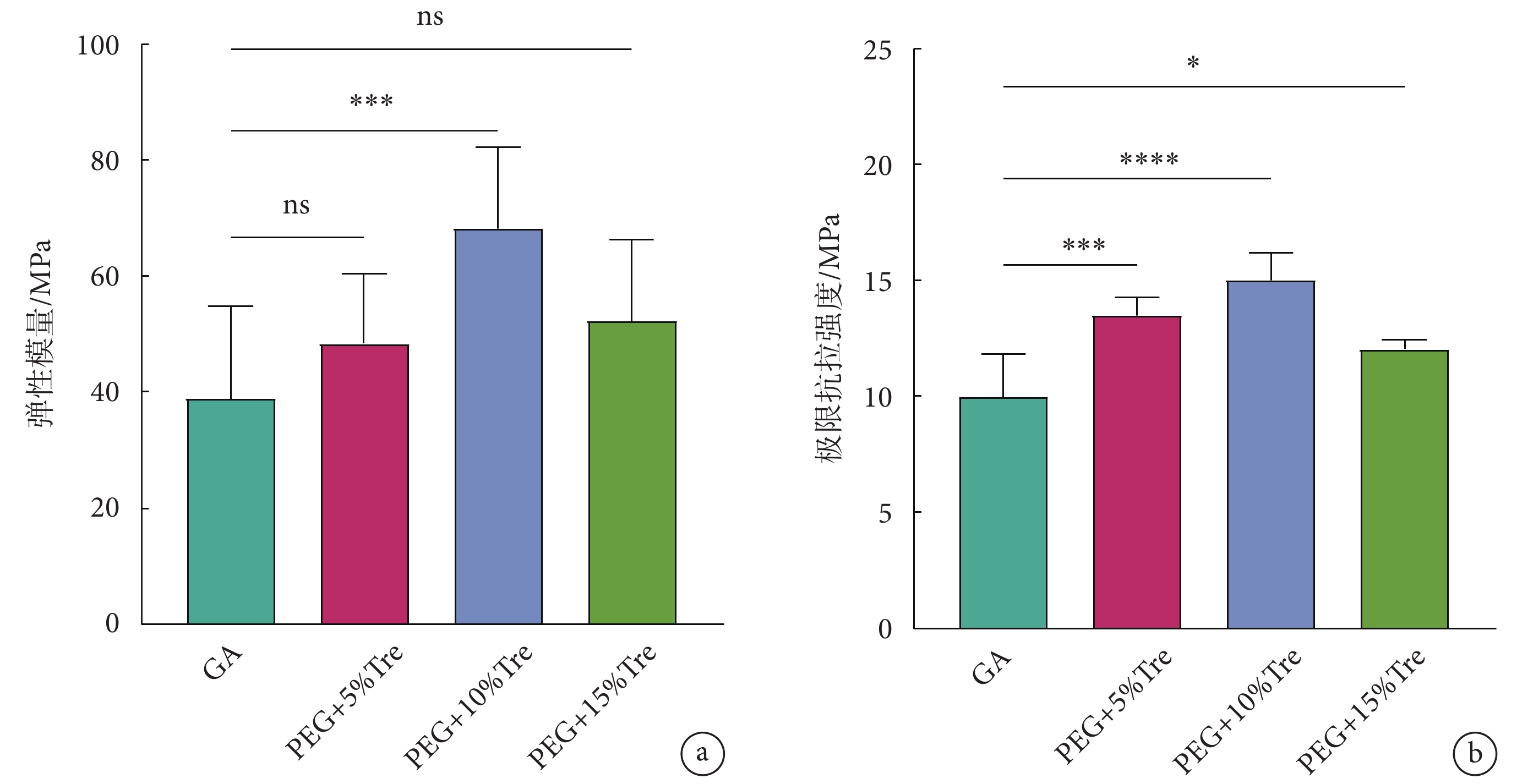 圖5
牛心包冷凍干燥后的彈性模量及極限抗拉強度
圖5
牛心包冷凍干燥后的彈性模量及極限抗拉強度
a. 彈性模量;b. 極限抗拉強度;*
a. elastic modulus; b. ultimate tensile strength; *
3.3 含水量
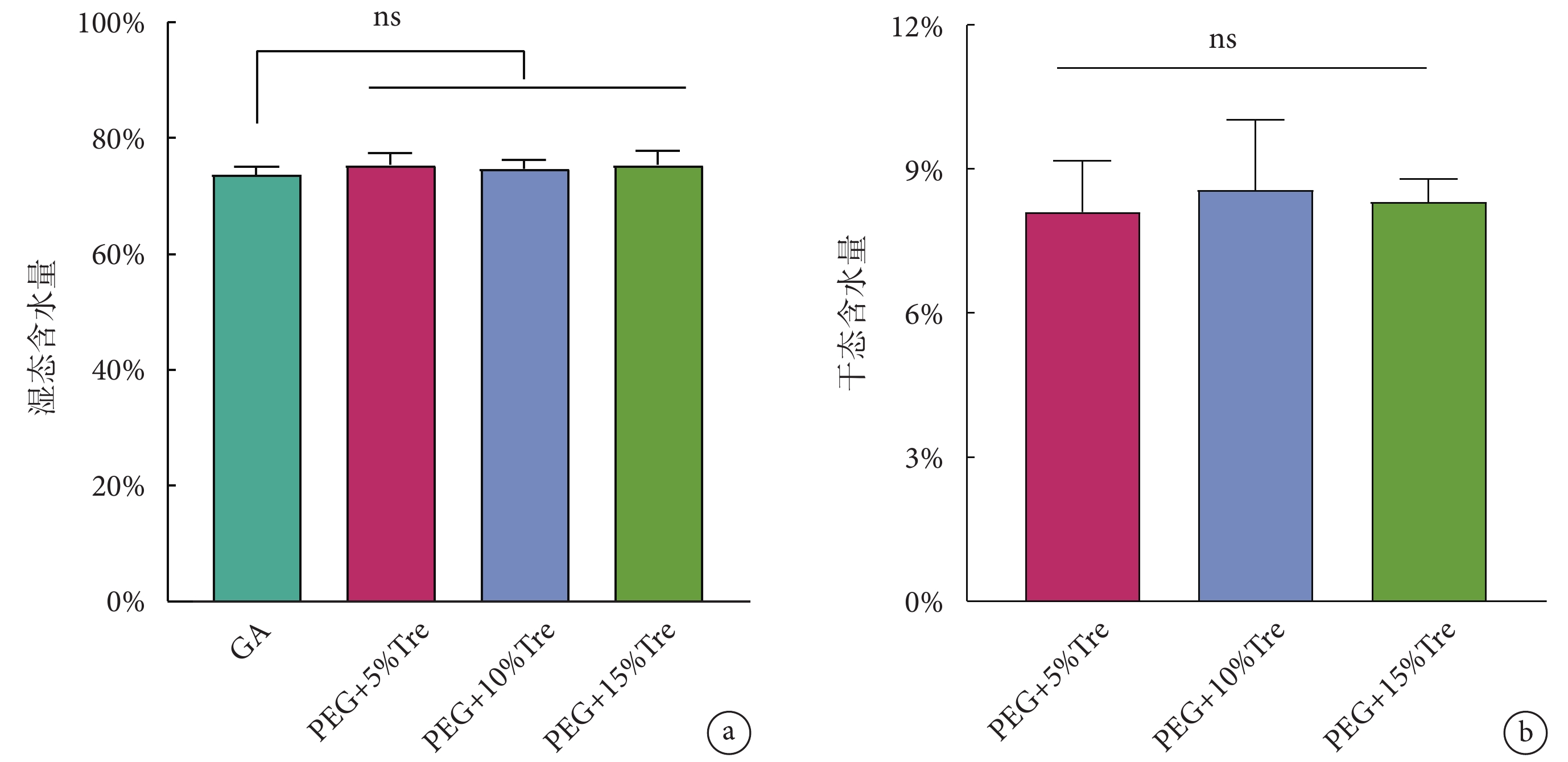
圖6為通過卡爾費休庫倫滴定法測定牛心包的含水量。各組牛心包的濕態含水量非常接近(P > 0.05),如圖6a所示,說明凍干后的牛心包能夠快速復水;圖6b為牛心包的干態含水量,PEG + 5%Tre、PEG + 10%Tre、PEG + 15%Tre組的結果分別為:(8.10 ± 1.01)%、(8.64 ± 1.52)%、(8.31 ± 0.51)%(P > 0.05),表明凍干保護劑處理的牛心包在凍干的過程中能夠有效脫水。
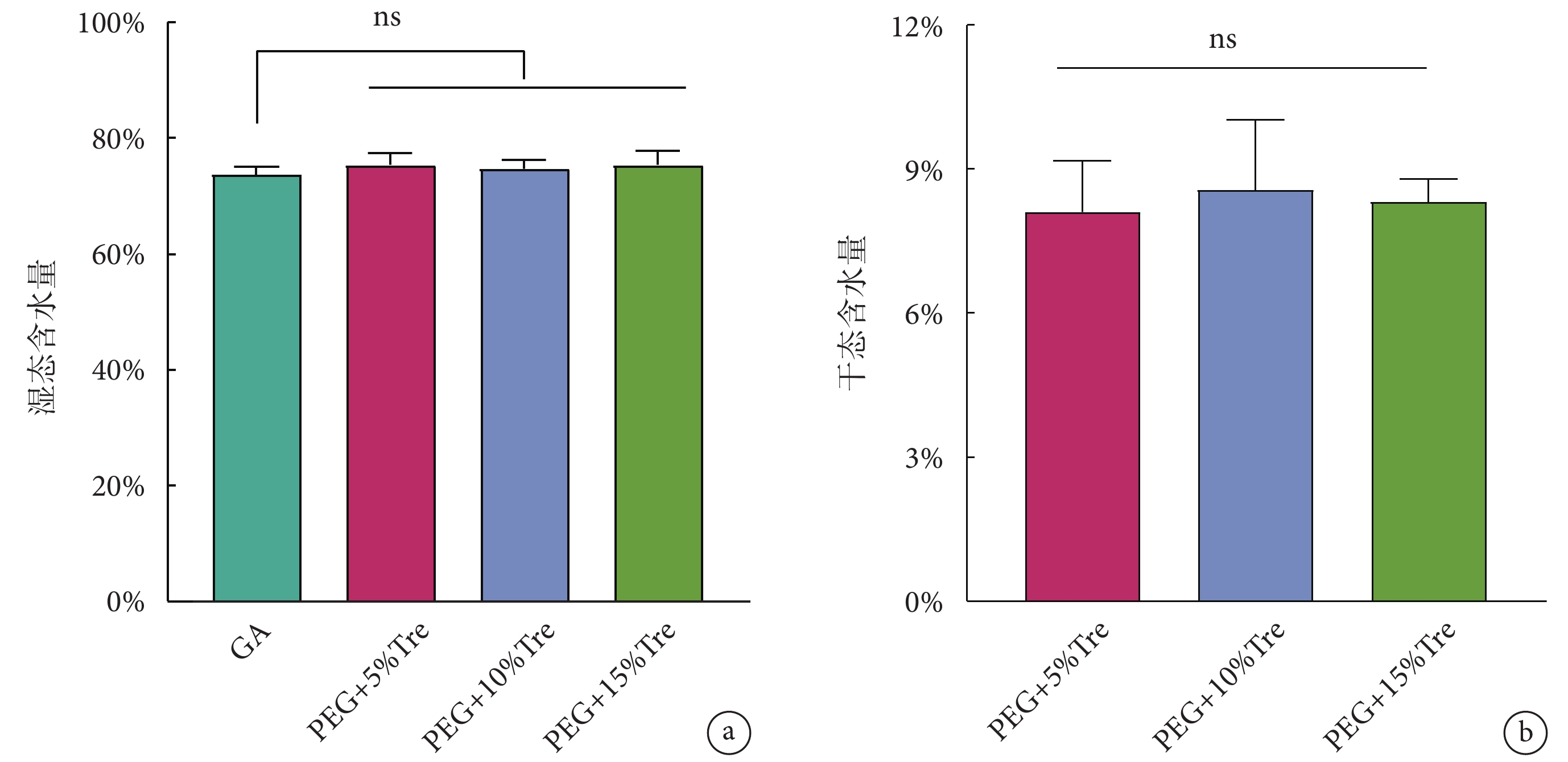 圖6
牛心包冷凍干燥后的含水量
圖6
牛心包冷凍干燥后的含水量
a. 復水后的濕態含水量;b. 干態含水量;ns表示無顯著差異
Figure6. Water content of bovine pericardium after freeze-dryinga. wet water content after rehydration; b. dry water content; ns means no significant difference
3.4 熱皺縮溫度
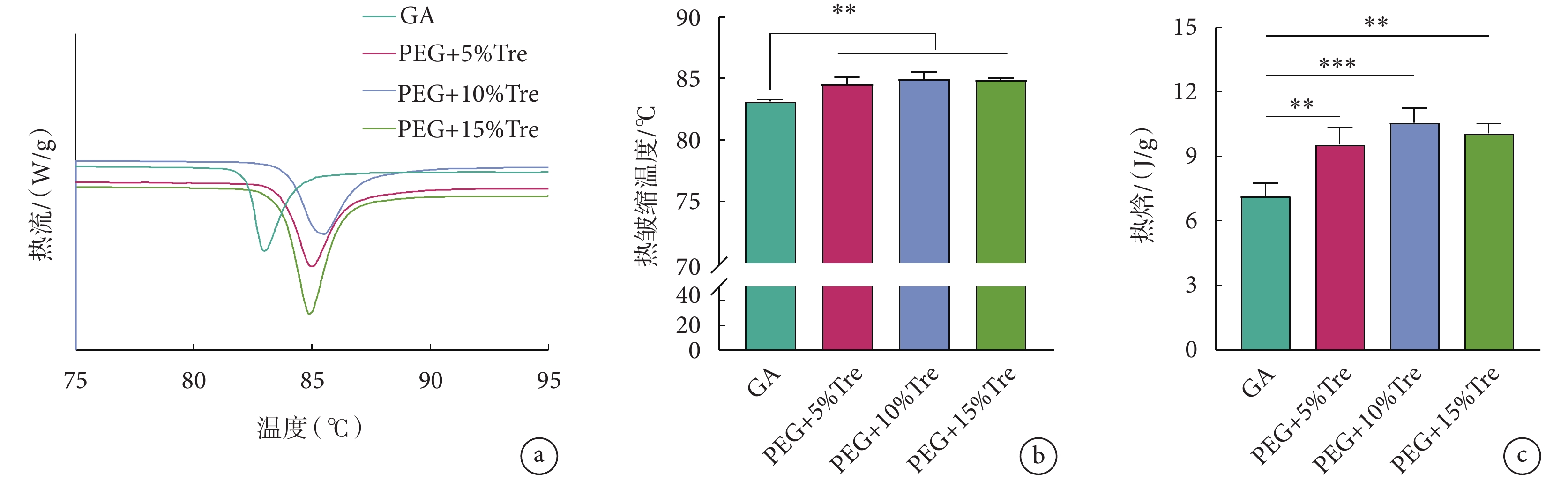
熱皺縮溫度說明蛋白質的熱穩定性,凍干后牛心包的熱皺縮溫度如圖7所示。圖7a表示牛心包在使用差示掃描量熱儀測試過程中的升溫曲線,根據曲線可以測定牛心包的熱皺縮溫度,如圖7b所示。圖7b顯示使用凍干保護劑處理的牛心包的熱皺縮溫度優于GA固定的牛心包。圖7c為牛心包凍干后的熱焓值。凍干保護劑組牛心包的熱焓值高于GA組,說明在凍干保護劑處理牛心包的過程中可促進內部膠原蛋白質的交聯,使膠原蛋白的熱穩定性增加,這與圖7a結果一致,說明凍干保護劑對牛心包的處理可以增加牛心包的熱穩定性,穩定蛋白質結構。
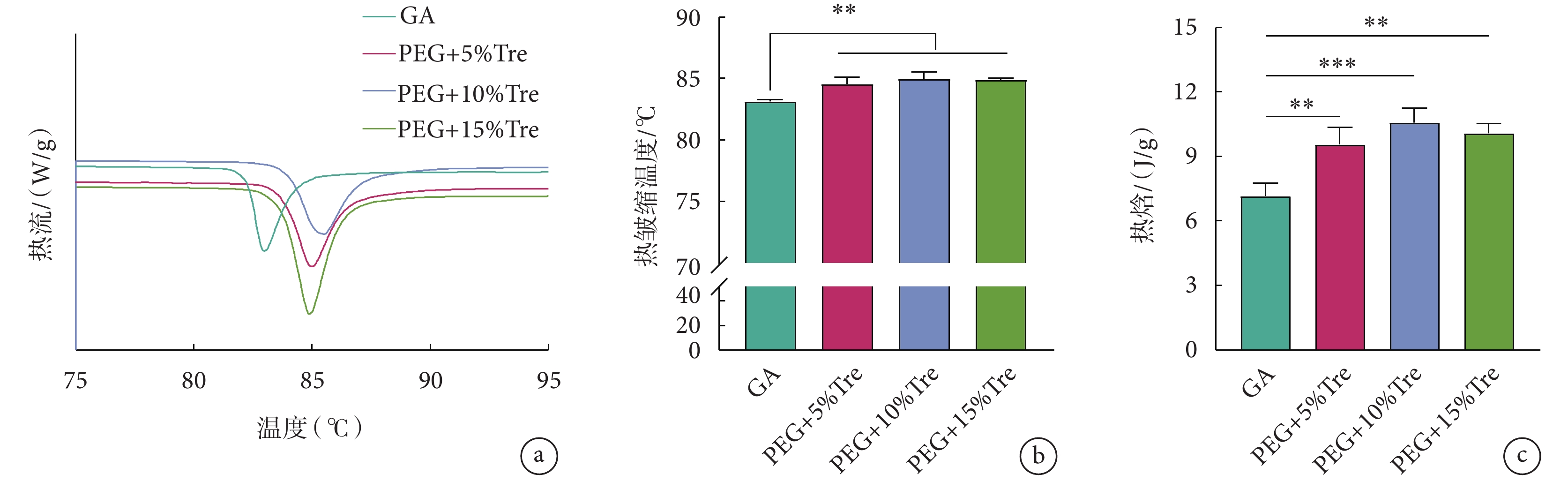 圖7
牛心包冷凍干燥后的DSC結果
圖7
牛心包冷凍干燥后的DSC結果
a. 牛心包的升溫曲線;b. 熱皺縮溫度;c. 熱焓;**
a. DSC thermophysical properties curve; b. thermal shrinkage temperature; c. enthalpy; **
3.5 傅里葉紅外變換光譜
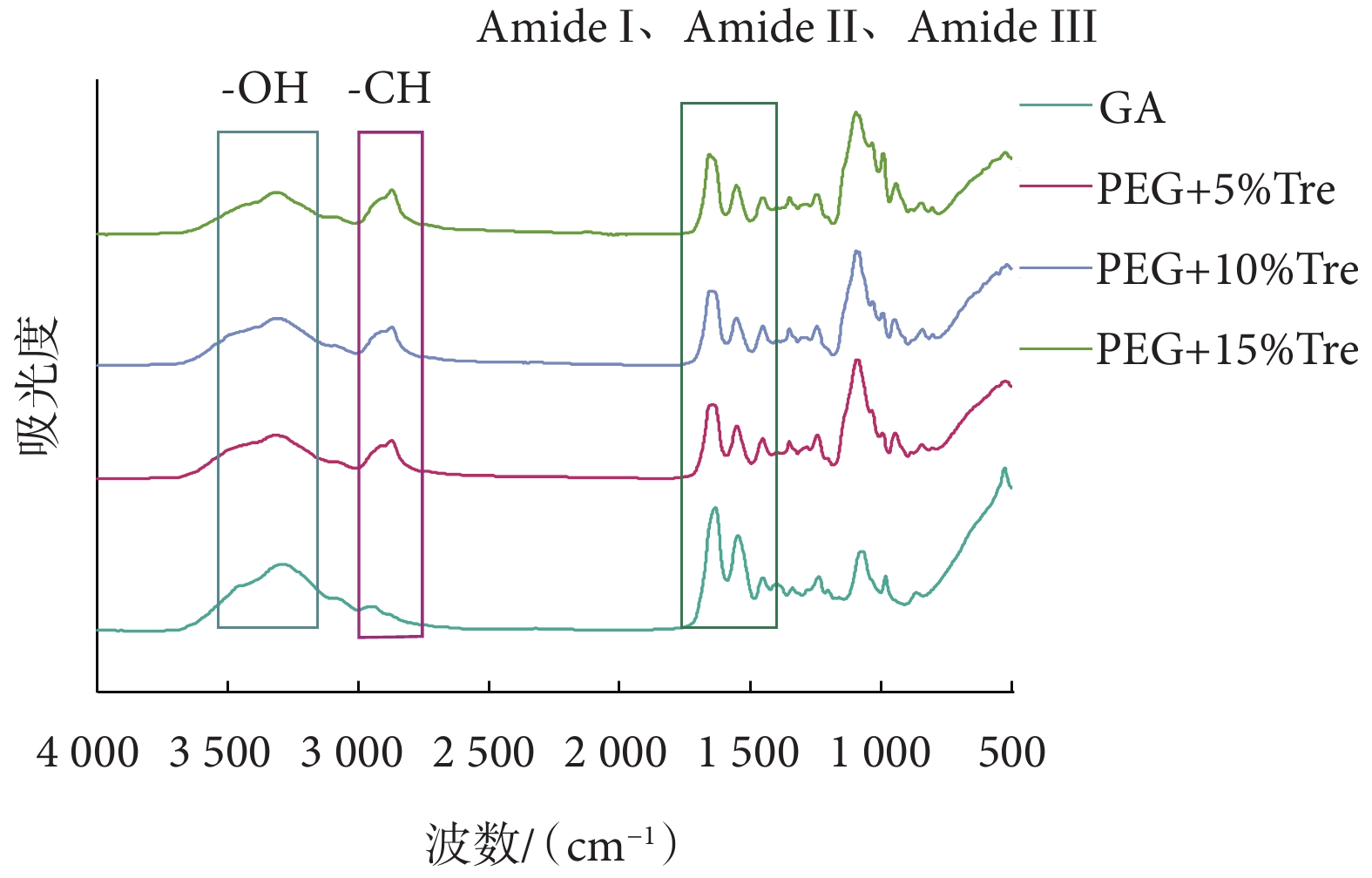
膠原蛋白在傅里葉紅外變換光譜中具有明顯的吸收峰,如位于1 655 cm?1、1 560 cm?1處的酰胺I、酰胺II光譜帶及以1 245 cm?1為中心的酰胺III[28]。通過FTIR光譜可以判斷蛋白質結構的改變,牛心包膠原蛋白的吸收峰在1 630~1 600 cm?1處[29]。圖8中各組紅外光譜在1 630~1 600 cm?1處均有相同的吸收峰,表明牛心包在冷凍干燥過程中不會破壞膠原蛋白結構。FTIR光譜在3 393~3 317 cm?1存在差異,造成原因可能是―OH鍵的拉伸;在2 869~2 857 cm?1處凍干保護劑處理的牛心包具有明顯的峰,可能是―CH與膠原蛋白反應,拉伸導致出現不同強度的峰。
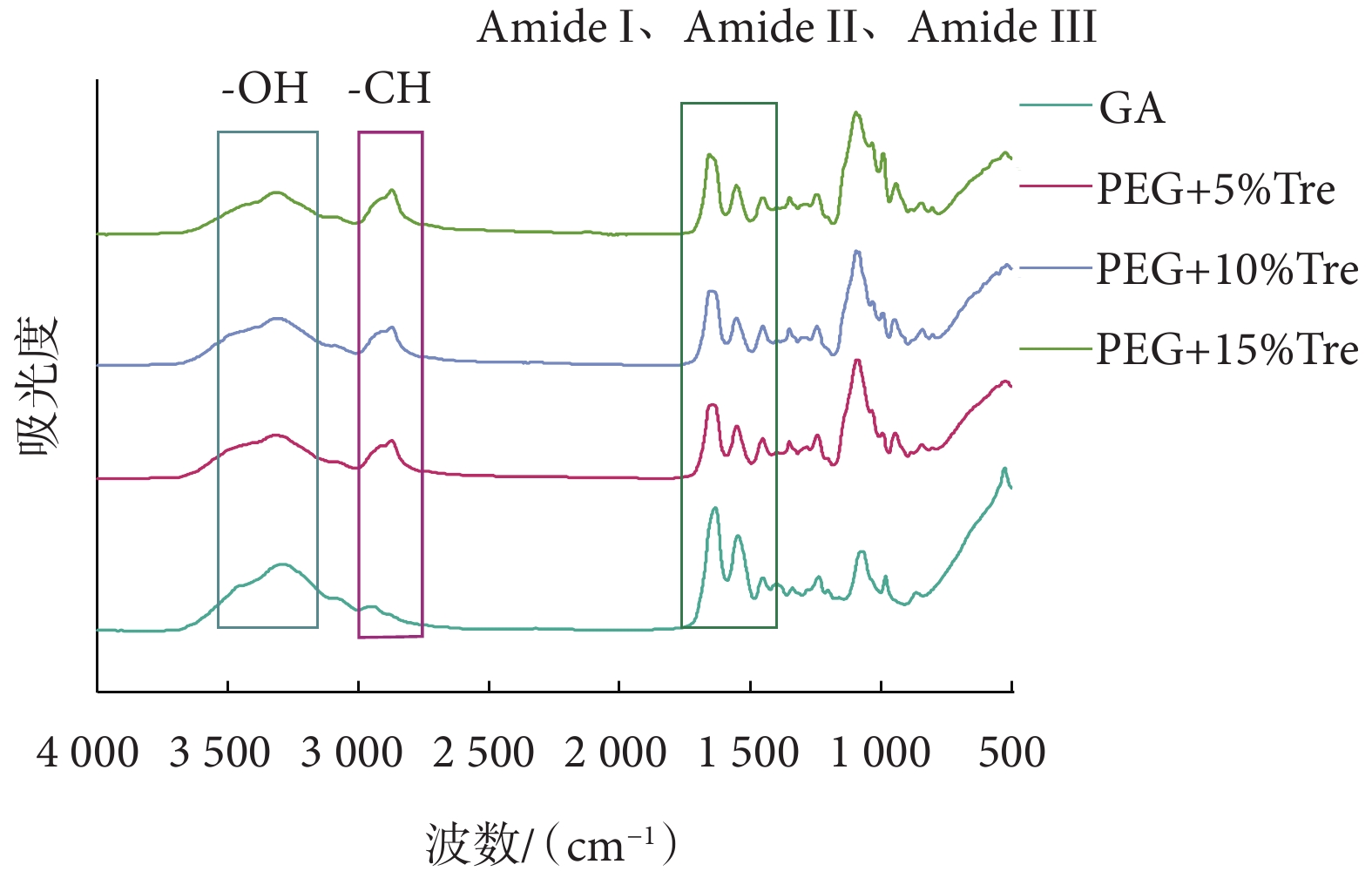 圖8
牛心包傅里葉變換紅外光譜
Figure8.
Fourier transform infrared spectrum of bovine pericardium
圖8
牛心包傅里葉變換紅外光譜
Figure8.
Fourier transform infrared spectrum of bovine pericardium
3.6 HE染色
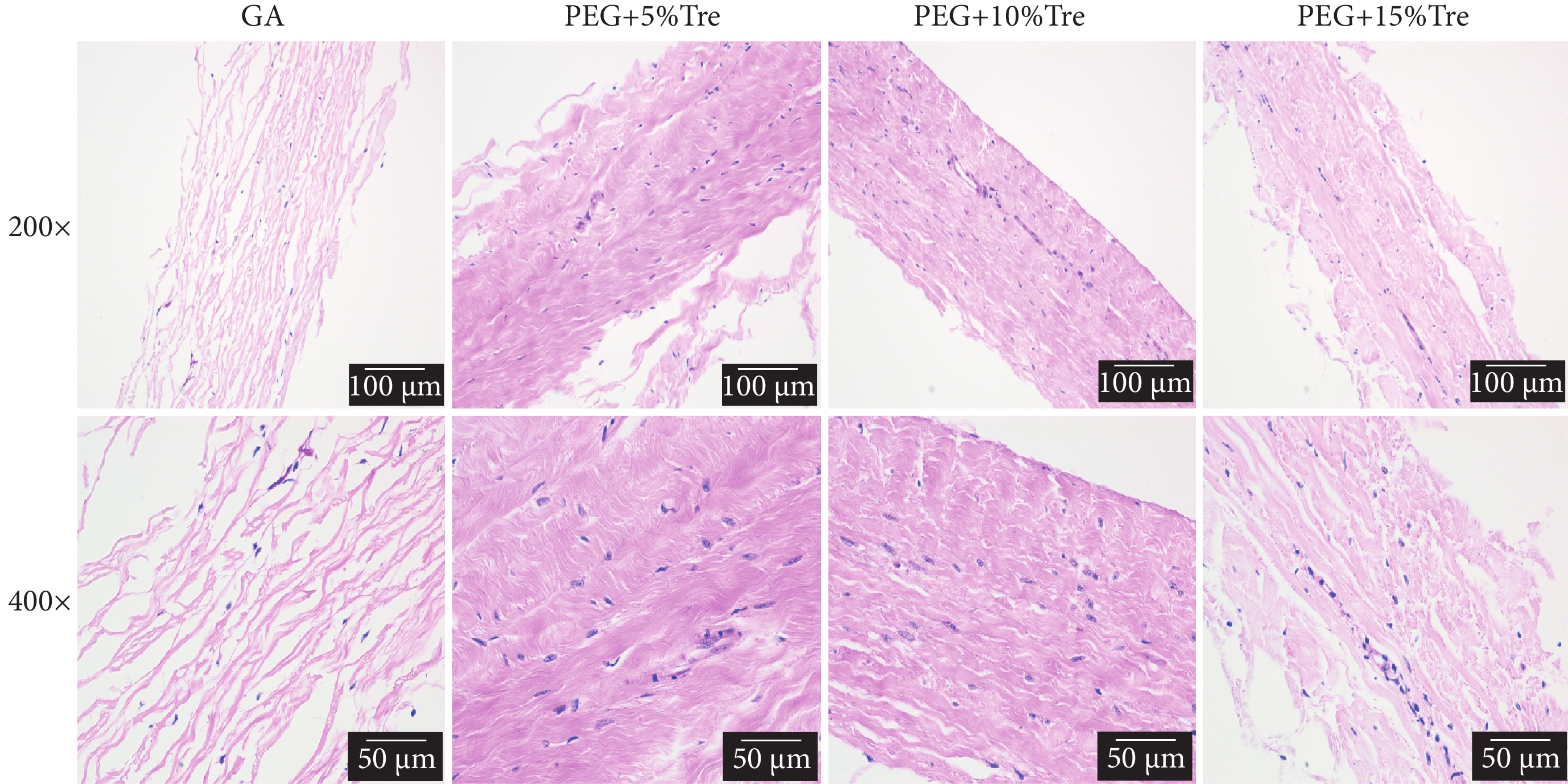
圖9為牛心包凍干后的HE染色結果。可見GA固定的牛心包組冷凍干燥后,膠原纖維排列疏松、纖維間的孔隙較大,推測在冷凍干燥過程中有冰晶產生,導致孔隙增大;凍干保護劑處理的牛心包,HE染色表明膠原纖維排列緊密、孔隙較小,說明凍干保護劑的添加在凍干過程中可以減少冰晶的產生,使組織纖維排列緊湊。
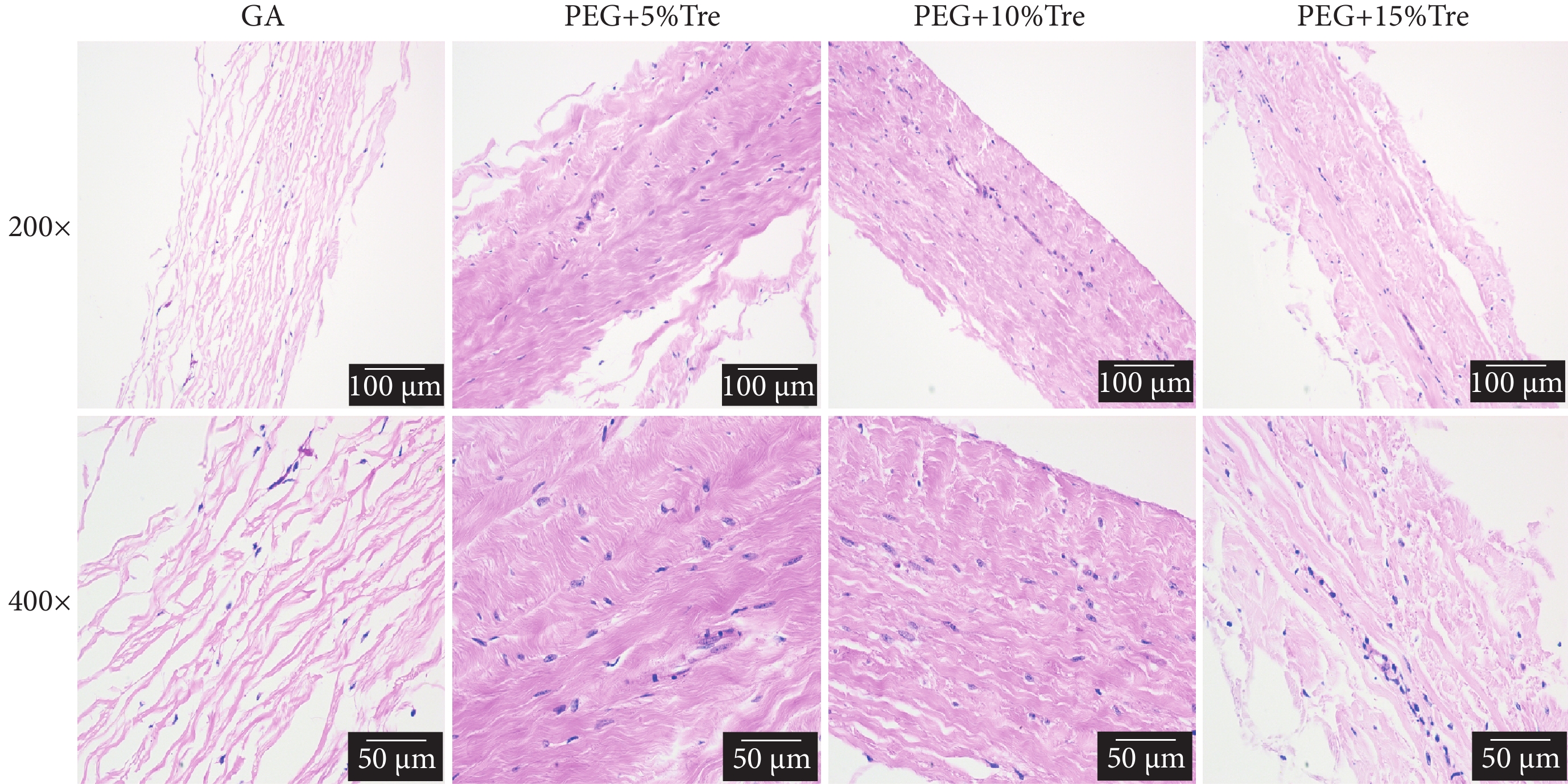 圖9
牛心包的HE染色圖
Figure9.
HE staining of bovine pericardium
圖9
牛心包的HE染色圖
Figure9.
HE staining of bovine pericardium
3.7 細胞毒性評價
根據牛心包力學性能的檢測結果,選取性能最優的PEG + 10% w/v Tre組處理的牛心包進行細胞毒性的檢測,采用MTT法檢測細胞毒性實驗,其細胞毒為(77.87 ± 0.49)%,為1級,符合GB/T 16886.3標準規范。
3.8 溶血性評價
使用酶標儀測定的吸光度計算其溶血率,PEG + 10% w/v Tre組處理的牛心包測得的溶血率為(0.17 ± 0.02)%,其結果低于5%,符合GB/T 16886.4-2003的醫療標準。
4 討論與結論
瓣膜在冷凍保存過程中會出現冰晶產生、機械性能降低等問題[19-20],因而在臨床應用中受到限制。而本文通過使用PEG與Tre組成的凍干保護劑對牛心包進行冷凍干燥,保留了牛心包的基本性能,為其臨床應用提供了基礎研究信息。
力學研究表明,凍干保護劑處理的牛心包力學性能在整體上優于GA固定的牛心包,力學性能的差異與膠原纖維的排列結構相關[30],凍干保護劑處理的牛心包在凍干后,HE結果顯示組織纖維結構排列緊密,導致牛心包力學性能的改變;凍干后牛心包的彈性模量與極限抗拉強度的提高,表明牛心包可以抵抗更大的形變并可以承受更高負荷。FTIR結果表明,凍干的過程不會破壞蛋白質結構,會保留原有的組織結構;熱皺縮溫度檢測結果顯示凍干保護劑在處理牛心包的過程中促進了內部膠原蛋白之間的交聯,使牛心包的熱穩定性升高。
綜上,冷凍干燥技術是一種用于生物組織材料保存的有效方式,對各種生物醫學應用具有重要意義以及巨大的潛力。本文使用糖與醇等組成的凍干保護劑對牛心包進行冷凍干燥,凍干后的牛心包表現出更好的機械性能、細胞增殖、血液相容性和組織結構的完整性,展示了凍干瓣膜具有廣闊的應用前景。但是,要將凍干的瓣膜用于臨床,需進一步對牛心包進行性能研究,如抗鈣化能力、體內動物實驗等。由于冷凍干燥保存的瓣膜易于儲存、運輸,未來有望成為臨床的首要選擇。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:黃偉參與了論文的選題、實驗設計、數據采集和分析、論文寫作;李維杰和劉寶林參與了論文的選題、實驗設計、論文內容指導和論文修改。
0 引言
心血管疾病是導致人群死亡的重要原因[1],瓣膜性心臟病又是常見的心血管疾病之一,主要癥狀有瓣膜狹窄、反流[2-3]。研究表明,中國大約有2 500萬的患者患有心臟瓣膜病[4],美國每年大約有30萬人需要做心臟瓣膜手術[5],并且由于老年人口的增加,預計到2050年大約有80萬人需要做心臟瓣膜手術[6-7]。目前,有效的治療方式是人工心臟瓣膜置換,主要包括機械瓣膜和人工生物心臟瓣膜[8-9]。由于人工生物心臟瓣膜與機械瓣膜相比具有良好的生物相容性和血流動力學性能,因此人工生物瓣膜的使用頻率高于機械瓣膜[10-11]。心包主要由膠原蛋白、纖維及心臟周圍組織組成[12-13],心包的膠原纖維具有多層結構且每層的排列方向不同,使心包具有優異的機械性能,因此常用來作為生物瓣膜的原材料。目前,常用的生物瓣膜主要使用0.625%戊二醛(glutaraldehyde,GA)固定的牛心包或豬心包制成[14-15]。
目前,牛心包材料有玻璃化保存或者在–80℃下保存等低溫保存方式[16-17],但在心包保存過程中會造成不利影響,如細胞活力與線粒體形態的受損[18],以及生物力學性能的改變和冰晶形成破壞細胞外基質等[19-20]。冷凍干燥技術是使組織材料、蛋白質藥物或疫苗在干燥狀態下保存的技術[21],主要分為預冷、一次干燥、二次干燥等階段[22]。冷凍干燥技術已廣泛應用于藥品及食品領域[23],最近,也有研究應用于牛心包的保存研究[24]。Wang等[25]與Goecke等[26]使用蔗糖作為凍干保護劑對豬瓣膜進行冷凍干燥,發現瓣膜經復水后,凍干的瓣膜具有良好的組織結構和細胞再生的能力。因此,冷凍干燥是替代低溫保存的有效方法,可以保持細胞質基質的結構,并能在室溫下保存,達到降低儲藏與運輸成本的目的。目前,常用的凍干保護劑主要有糖、醇、聚合物、氨基酸等[27]。
本文通過添加聚乙二醇(polyethylene glycol,PEG)和海藻糖(trehalose,Tre)組成的凍干保護劑對經GA固定的心包進行處理并冷凍干燥,研究冷凍干燥后牛心包的厚度、力學性能、組織學形態、含水量、傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)等方法,對牛心包冷凍干燥后的性能進行初步探討。
1 材料與方法
1.1 材料與試劑
小鼠成纖維細胞(L929細胞)(中國科學院典型培養物保藏委員會細胞庫),新鮮兔血與抗凝劑(上海安助醫療科技有限公司),聚乙二醇(Adams,瑞士)、海藻糖(Adamas,瑞士),卡爾費休試劑(honeywell,德國)、無水甲醇(honeywell,德國),噻唑藍(MTT,Sigma公司,美國),胎牛血清(Corning公司,美國),MEM培養基(HyClone公司,美國),異丙醇(國藥集團化學試劑有限公司,中國),生理鹽水(河南科倫藥業有限公司,中國),牛心包由微創心通醫療科技有限公司提供。
1.2 儀器
冷凍干燥機(Advantage 2.0 Benchtop Freeze Drye,美國),萬能材料試驗機(E1F1G1-5943,ISTRON公司,美國),傅里葉紅外光譜儀(Thermo Nicolet iS5,美國),卡氏水分儀(Metrohm,瑞士),顯微鏡(BX40,日本),酶標儀(SYNERGYH1,Thermo Fisher公司,美國),恒溫搖床(THZ100,中國),測厚儀(CHB10120,中國)。
2 試驗方法
2.1 冷凍干燥保護劑的配制
將PEG與不同濃度的Tre溶液混合配置成不同濃度的混合凍干保護劑,具體濃度為5% w/v、10% w/v、15% w/v的海藻糖溶液混合,GA固定處理的心包為對照組。
2.2 牛心包的處理
將牛心包經生理鹽水沖洗5 min,共3次,去除掉心包上殘留的GA,將牛心包放入凍干保護劑中浸泡,置于恒溫搖床上震蕩,條件設置為37 ℃、70 r/min、4 h。
牛心包放入冷凍干燥機中并冷凍干燥,冷凍干燥程序參考Wang等[25]的方法進行修改,具體參數設置為:預冷溫度設置–40 ℃,時間300 min;一次干燥溫度設置–30 ℃,時間設置1 200 min,壓強15 Pa;二次干燥溫度設置20 ℃,時間設置360 min,壓強15 Pa;冷凍干燥完成后牛心包經環氧乙烷滅菌后進行性能測定。
2.3 測定指標
2.3.1 心包厚度測定
使用測厚儀測定心包冷凍干燥前后的厚度值(n = 6),每片心包測定4個點,用測厚儀讀取10 s后的數值,對冷凍干燥前后的厚度進行比較測定。
2.3.2 力學性能的測定
(1)斷裂性能:將心包裁剪成5 mm × 25 mm的心包條(n = 6),使用測厚儀記錄心包條的厚度,通過萬能材料試驗機以拉伸速率100 mm/min的速度進行拉伸,測定心包冷凍干燥后斷裂力、斷裂強度、斷裂伸長率的變化。
(2)破裂性能:將心包裁剪成33 mm × 33 mm的心包片(n = 6),使用測厚儀記錄心包片的厚度,通過萬能材料試驗機以壓縮速率100 mm/min對心包進行壓縮,測定心包冷凍干燥后破裂力、破裂強度的變化。
(3)應力-應變曲線:根據牛心包在拉伸時的數據計算出牛心包的應力、應變。根據應力-應變曲線(見圖1)計算出牛心包的彈性模量與極限抗拉強度。
 圖1
應力-應變曲線
Figure1.
Stress-strain curve
圖1
應力-應變曲線
Figure1.
Stress-strain curve
2.3.3 牛心包含水量的測定
在測定心包含水量前,使用超純水進行滴定度測定(3次),滴定結果為4.5~5.5 mg/mL時符合反應條件,對心包進行含水量的測定;剪取30~50 mg的牛心包樣品放入樣品瓶(n = 10),放入卡氏爐中在氮氣氛圍下進行加熱,氮氣流速為50 mL/min,加熱溫度升至150 ℃使組織中的水分完全蒸發至卡氏反應爐中,在反應爐中水分通過與無水甲醇和卡爾費休試劑進行反應,通過卡爾費休庫倫滴定法測定出牛心包的含水量。
2.3.4 牛心包熱穩定性測定
將冷凍干燥后的牛心包樣品經生理鹽水復水后,將牛心包剪成5~10 mg的塊狀,使用差示掃描量熱儀對心包進行熱皺縮溫度的分析,升溫范圍為20~100 ℃,升溫速率為10 ℃/min。
2.3.5 牛心包傅里葉紅外變換光譜掃描
通過紅外光譜對冷凍干燥后的心包進行表征處理,測定蛋白質結構的變化。將冷凍干燥后的心包進行裁剪1 cm × 1 cm的小塊,對心包進行掃描處理,紅外光譜的掃描范圍為4 000~400 cm?1,分辨率4 cm?1,掃描次數32次。
2.3.6 蘇木精-伊紅染色
對冷凍干燥的牛心包進行組織學評價,使用蘇木精-伊紅(hematoxylin-eosin,HE)染色觀察心包的組織形態,將冷凍干燥后的心包裁剪成1 cm × 1 cm的小樣,石蠟包埋、切片,經HE染色后,將制成的切片置于光學顯微鏡下觀察心包的組織形態并拍照。
2.3.7 體外細胞毒性評價
依據GB/T 16886.5醫療器械標準規范進行細胞毒性檢測,選擇MTT細胞毒性實驗對冷凍干燥后的心包材料進行細胞毒性檢測。選取細胞濃度為1 × 105/mL的L929細胞,在96孔板中接種100 μL,放在二氧化碳培養箱中培養24 h,吸出培養基,每孔分別加入100 μL的空白對照液、陰性對照液、陽性對照液、樣品浸提液,再次培養24 h,棄去培養液加入50 μL的MTT溶液孵育2 h;棄去孔內液體,加入100 μL異丙醇,震蕩混勻,用酶標儀在570 nm出測定吸光度,計算細胞的存活率。細胞增殖率大于等于75%時,即細胞毒性小于等于1級時符合標準規范。
2.3.8 溶血性能測定
依據GB/T 16886.4醫療器械標準規范進行溶血性能的檢測,將經過環氧乙烷滅菌的牛心包材料按照6 cm2/L的比例加入浸提介質,與陰性對照組、陽性對照組一起放入37 ℃水浴鍋中孵育30 min,取出后按照6 cm2/L的比例加入新鮮抗凝兔血、在37 ℃水浴孵育60 min,吸出管內液體以800 g離心5 min,取上清液,用酶標儀在545 nm處測定吸光度并計算溶血率。
2.4 統計學分析
實驗數據均使用GraphPad Prism10.0軟件進行統計學數據處理,多組數據之間采用單因素方差分析(one-way ANOVA檢驗),兩組數據比較間采用t檢驗;數據均表示為均值 ± 標準差,檢驗水準為0.05。
3 結果與討論
3.1 厚度
圖2為測定的牛心包凍干前后的厚度。冷凍干燥后的牛心包經復水10 min后與凍干的牛心包相比,凍干的牛心包厚度更薄(P < 0.05),說明心包在冷凍干燥過程中能有效脫水,導致厚度變薄。
 圖2
牛心包冷凍干燥前后的厚度(*P < 0.05)
Figure2.
Thickness of bovine pericardium before and after freeze-drying (*P < 0.05)
圖2
牛心包冷凍干燥前后的厚度(*P < 0.05)
Figure2.
Thickness of bovine pericardium before and after freeze-drying (*P < 0.05)
3.2 力學性能
3.2.1 斷裂性能
牛心包的斷裂性能如圖3所示。圖3a、b顯示冷凍干燥后的牛心包斷裂性能優于GA固定的牛心包,可以承受更高強度的力;圖3c顯示GA組和凍干保護劑組牛心包后的斷裂伸長率無明顯差異。
 圖3
牛心包冷凍干燥后的斷裂性能
圖3
牛心包冷凍干燥后的斷裂性能
a. 斷裂力;b. 斷裂強度;c. 斷裂伸長率;*
a. breaking force; b. breaking strength; c. breaking elongation; *
3.2.2 破裂性能
牛心包的破裂性能如圖4所示。圖4a為牛心包冷凍干燥后的破裂力,各組間均無明顯差異;圖4b為牛心包的破裂強度,凍干保護劑組的牛心包破裂強度均優于GA組,說明牛心包在冷凍干燥過程中有水分流失造成厚度減薄,圖2的結果再次得以證實。
 圖4
牛心包冷凍干燥后的破裂性能
圖4
牛心包冷凍干燥后的破裂性能
a. 破裂力;b. 破裂強度;***
a. rupture force; b. rupture strength; ***
3.2.3 應力-應變曲線
應力-應變曲線主要反映彈性模量與抗拉強度的大小,如圖5所示。圖5a為牛心包的彈性模量,PEG + 10% w/v Tre組的彈性模量優于GA組和其余實驗組,說明PEG + 10% w/v Tre組處理的牛心包具有更好的抵抗形變的能力;圖5b為牛心包的極限抗拉強度,PEG + 10% w/v Tre組的極限抗拉強度優于其他實驗組與對照組,說明PEG + 10% w/v Tre組牛心包經冷凍干燥后增強了機械性能,可以承受更高的負荷。
 圖5
牛心包冷凍干燥后的彈性模量及極限抗拉強度
圖5
牛心包冷凍干燥后的彈性模量及極限抗拉強度
a. 彈性模量;b. 極限抗拉強度;*
a. elastic modulus; b. ultimate tensile strength; *
3.3 含水量
圖6為通過卡爾費休庫倫滴定法測定牛心包的含水量。各組牛心包的濕態含水量非常接近(P > 0.05),如圖6a所示,說明凍干后的牛心包能夠快速復水;圖6b為牛心包的干態含水量,PEG + 5%Tre、PEG + 10%Tre、PEG + 15%Tre組的結果分別為:(8.10 ± 1.01)%、(8.64 ± 1.52)%、(8.31 ± 0.51)%(P > 0.05),表明凍干保護劑處理的牛心包在凍干的過程中能夠有效脫水。
 圖6
牛心包冷凍干燥后的含水量
圖6
牛心包冷凍干燥后的含水量
a. 復水后的濕態含水量;b. 干態含水量;ns表示無顯著差異
Figure6. Water content of bovine pericardium after freeze-dryinga. wet water content after rehydration; b. dry water content; ns means no significant difference
3.4 熱皺縮溫度
熱皺縮溫度說明蛋白質的熱穩定性,凍干后牛心包的熱皺縮溫度如圖7所示。圖7a表示牛心包在使用差示掃描量熱儀測試過程中的升溫曲線,根據曲線可以測定牛心包的熱皺縮溫度,如圖7b所示。圖7b顯示使用凍干保護劑處理的牛心包的熱皺縮溫度優于GA固定的牛心包。圖7c為牛心包凍干后的熱焓值。凍干保護劑組牛心包的熱焓值高于GA組,說明在凍干保護劑處理牛心包的過程中可促進內部膠原蛋白質的交聯,使膠原蛋白的熱穩定性增加,這與圖7a結果一致,說明凍干保護劑對牛心包的處理可以增加牛心包的熱穩定性,穩定蛋白質結構。
 圖7
牛心包冷凍干燥后的DSC結果
圖7
牛心包冷凍干燥后的DSC結果
a. 牛心包的升溫曲線;b. 熱皺縮溫度;c. 熱焓;**
a. DSC thermophysical properties curve; b. thermal shrinkage temperature; c. enthalpy; **
3.5 傅里葉紅外變換光譜
膠原蛋白在傅里葉紅外變換光譜中具有明顯的吸收峰,如位于1 655 cm?1、1 560 cm?1處的酰胺I、酰胺II光譜帶及以1 245 cm?1為中心的酰胺III[28]。通過FTIR光譜可以判斷蛋白質結構的改變,牛心包膠原蛋白的吸收峰在1 630~1 600 cm?1處[29]。圖8中各組紅外光譜在1 630~1 600 cm?1處均有相同的吸收峰,表明牛心包在冷凍干燥過程中不會破壞膠原蛋白結構。FTIR光譜在3 393~3 317 cm?1存在差異,造成原因可能是―OH鍵的拉伸;在2 869~2 857 cm?1處凍干保護劑處理的牛心包具有明顯的峰,可能是―CH與膠原蛋白反應,拉伸導致出現不同強度的峰。
 圖8
牛心包傅里葉變換紅外光譜
Figure8.
Fourier transform infrared spectrum of bovine pericardium
圖8
牛心包傅里葉變換紅外光譜
Figure8.
Fourier transform infrared spectrum of bovine pericardium
3.6 HE染色
圖9為牛心包凍干后的HE染色結果。可見GA固定的牛心包組冷凍干燥后,膠原纖維排列疏松、纖維間的孔隙較大,推測在冷凍干燥過程中有冰晶產生,導致孔隙增大;凍干保護劑處理的牛心包,HE染色表明膠原纖維排列緊密、孔隙較小,說明凍干保護劑的添加在凍干過程中可以減少冰晶的產生,使組織纖維排列緊湊。
 圖9
牛心包的HE染色圖
Figure9.
HE staining of bovine pericardium
圖9
牛心包的HE染色圖
Figure9.
HE staining of bovine pericardium
3.7 細胞毒性評價
根據牛心包力學性能的檢測結果,選取性能最優的PEG + 10% w/v Tre組處理的牛心包進行細胞毒性的檢測,采用MTT法檢測細胞毒性實驗,其細胞毒為(77.87 ± 0.49)%,為1級,符合GB/T 16886.3標準規范。
3.8 溶血性評價
使用酶標儀測定的吸光度計算其溶血率,PEG + 10% w/v Tre組處理的牛心包測得的溶血率為(0.17 ± 0.02)%,其結果低于5%,符合GB/T 16886.4-2003的醫療標準。
4 討論與結論
瓣膜在冷凍保存過程中會出現冰晶產生、機械性能降低等問題[19-20],因而在臨床應用中受到限制。而本文通過使用PEG與Tre組成的凍干保護劑對牛心包進行冷凍干燥,保留了牛心包的基本性能,為其臨床應用提供了基礎研究信息。
力學研究表明,凍干保護劑處理的牛心包力學性能在整體上優于GA固定的牛心包,力學性能的差異與膠原纖維的排列結構相關[30],凍干保護劑處理的牛心包在凍干后,HE結果顯示組織纖維結構排列緊密,導致牛心包力學性能的改變;凍干后牛心包的彈性模量與極限抗拉強度的提高,表明牛心包可以抵抗更大的形變并可以承受更高負荷。FTIR結果表明,凍干的過程不會破壞蛋白質結構,會保留原有的組織結構;熱皺縮溫度檢測結果顯示凍干保護劑在處理牛心包的過程中促進了內部膠原蛋白之間的交聯,使牛心包的熱穩定性升高。
綜上,冷凍干燥技術是一種用于生物組織材料保存的有效方式,對各種生物醫學應用具有重要意義以及巨大的潛力。本文使用糖與醇等組成的凍干保護劑對牛心包進行冷凍干燥,凍干后的牛心包表現出更好的機械性能、細胞增殖、血液相容性和組織結構的完整性,展示了凍干瓣膜具有廣闊的應用前景。但是,要將凍干的瓣膜用于臨床,需進一步對牛心包進行性能研究,如抗鈣化能力、體內動物實驗等。由于冷凍干燥保存的瓣膜易于儲存、運輸,未來有望成為臨床的首要選擇。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:黃偉參與了論文的選題、實驗設計、數據采集和分析、論文寫作;李維杰和劉寶林參與了論文的選題、實驗設計、論文內容指導和論文修改。