缺血性卒中常會引起認知功能障礙,從而延緩了患者的康復進程,然而,其發病機制尚未明確。本文以腦缺血再灌注模型為實驗對象,以海馬齒狀回(DG)為目標腦區,TTC染色評估腦梗死程度,采集神經元膜電位和局部場電位(LFPs)信號,旨在探究腦缺血再灌注小鼠認知功能的損傷機制。結果發現,模型組小鼠大腦右側梗死區呈白色;該模型小鼠海馬DG神經元靜息膜電位、動作電位放電個數、后超極化電位和最大上升斜率顯著低于對照組(P < 0.01),動作電位達峰時間、半波寬、閾值和最大下降斜率均顯著高于對照組(P < 0.01)。缺血和缺血再灌注組小鼠在θ和γ頻段的LFPs信號時頻能量值顯著降低(P < 0.01),但缺血再灌注組比缺血組明顯提高(P < 0.01);缺血及缺血再灌注組的LFPs信號復雜度顯著降低(P < 0.05),但缺血再灌注組與缺血組相比信號復雜度明顯增加(P < 0.05)。綜上所述,腦缺血再灌注使小鼠海馬DG區神經元興奮性降低;腦缺血使神經元放電活動和信號復雜度降低,經再灌注后電生理指標有所恢復,但實驗周期內沒能恢復到正常水平。
引用本文: 朱俞燦, 于洪麗, 趙秀芝, 王春方. 腦缺血再灌注小鼠海馬齒狀回神經興奮性分析. 生物醫學工程學雜志, 2024, 41(5): 926-934. doi: 10.7507/1001-5515.202311055 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
缺血性腦卒中由區域腦血流量的短暫或永久性減少引起。據最新統計,每年有超過760萬例新發缺血性卒中[1]。缺血性卒中除了可能導致肢體活動和語言能力等神經功能缺損以外,認知和記憶障礙是卒中后常見的后遺癥之一[2]。有研究表明,認知損害與缺血性卒中患者的梗死程度以及病灶位置[3]、腦血管病變[4]、神經炎癥[5]和血腦屏障破壞[6]等因素相關。海馬是與認知功能密切相關的腦區[7],其中,齒狀回(dentate gyrus,DG)顆粒細胞在認知及神經系統發育過程中發揮著關鍵作用[8]。然而,缺血性卒中對海馬DG區神經活動的影響機制尚未明確。
電生理學方法一直是人們研究大腦神經活動的重要手段。先前的研究表明神經興奮性的變化可能與認知缺陷相關[9-10],而神經元中安靜時的靜息膜電位、受到刺激時產生的動作電位的發放頻率及其相關電特性指標是衡量神經元興奮性的重要指標。局部場電位(local field potentials,LFPs)能夠反映大腦局部神經元集群突觸活動所造成的電場變化[11]。其中,θ頻段(4~12 Hz)與學習和記憶有關[12],γ頻段(30~100 Hz)在工作記憶的提取、形成等認知過程中發揮關鍵作用[13]。LFPs記錄已被用于識別神經疾病的病理變化,檢測進行性神經障礙的損傷程度。然而,以往關于缺血性卒中認知損傷的動物研究大多以行為學實驗或者細胞生物學來展開探索[14-15],從電生理學角度研究卒中引起的海馬神經活動變化的潛在機制較少。
缺血性卒中最常見于大腦中動脈及其分支阻塞[16]。再灌注現象指缺血性卒中在一段時間的缺血后重新獲得血液供應的過程,腦缺血再灌注損傷是缺血性卒中的普遍特征。故本文以大腦中動脈阻塞再灌注小鼠為實驗對象,海馬DG區為目標腦區,采用2, 3, 5-氯化三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride,TTC)評估該模型腦梗死程度,通過離體膜片鉗和在體大腦LFPs探究腦缺血再灌注對小鼠海馬DG神經元電生理特性的影響。
1 材料和方法
1.1 實驗動物
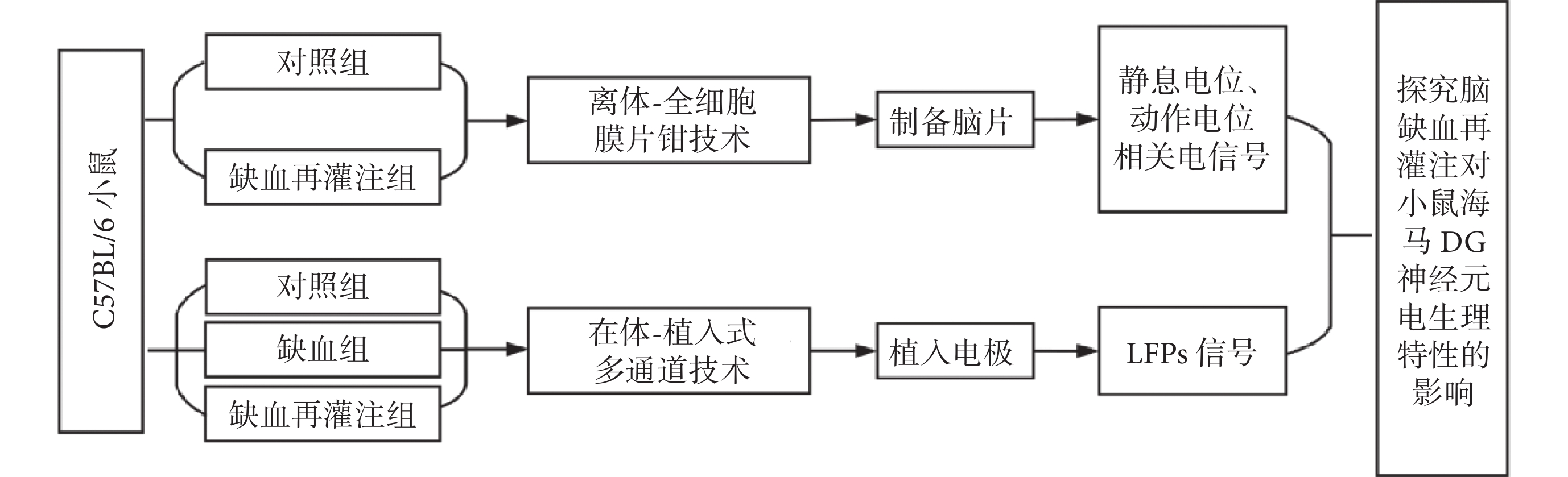
本研究采用健康雄性C57BL/6小鼠,6~8周齡,體重(23 ± 3)g,共計26只。購自北京華阜康生物科技股份有限公司,實驗動物許可證號:SCXK(京)2019 - 0008。飼養環境溫度維持在26 ℃左右,術前過夜禁食不禁水。所有實驗均獲得河北工業大學生物醫學倫理委員會批準。本文總體研究路線圖如圖1所示。
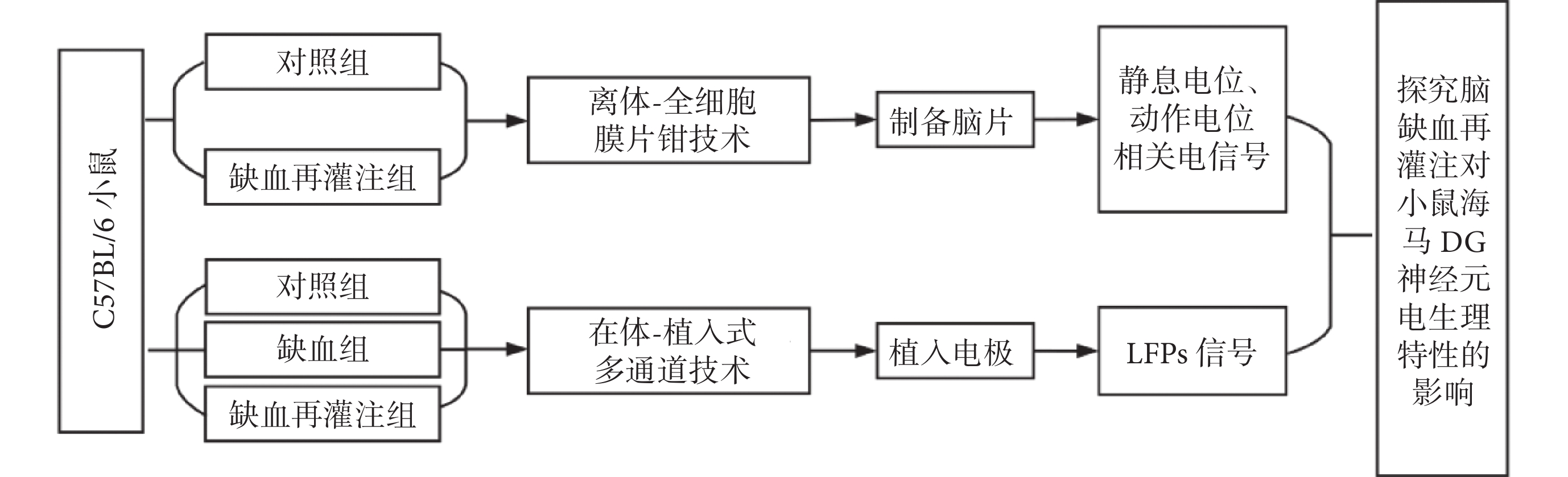 圖1
總體研究路線圖
Figure1.
Overall research roadmap
圖1
總體研究路線圖
Figure1.
Overall research roadmap
1.2 模型制備
采用線栓法[17]制備大腦中動脈阻塞再灌注小鼠模型。采用異氟烷搭配通氧的麻醉機對小鼠進行氣麻,進入深度麻醉后,分離小鼠左側頸總、頸外和頸內動脈,在頸總動脈上扎一小口,將線栓沿著頸內動脈插入,直至遇到輕微阻力不能再前送為止。整個手術過程為15~20 min,缺血60 min后拔除線栓實現再灌注。待小鼠有自主活動、刺激反應、正常姿勢以及自主進食飲水等表現則表示小鼠完全清醒,后采用Zea-Longa神經功能評分對實驗小鼠的神經功能缺陷程度進行評估,評分標準如表1所示。
采用TTC染色對腦組織損傷程度進行神經病理學評估,隨機分為對照組和模型組,每組4只。術后24 h,采用異氟烷待小鼠深度麻醉,斷頭取腦,切為連續冠狀切片,放入2% TTC溶液中染色,后沖洗、固定腦片;染色結束后,選擇適當的光源和角度,使用相機對腦片進行拍照以觀察梗死面積。腦片中白色部分為梗死區域,紅色部分為正常組織區域。
1.3 離體腦片膜片鉗實驗
1.3.1 試劑
① 人工腦脊液成分(單位均為mmol/L):NaCl 124、NaH2PO4 1.625、NaHCO3 26、葡萄糖 11、HEPES 5、KCl 3、CaCl2 2、MgCl2 2。② 高糖切片液成分(單位均為mmol/L):NaH2PO4 1.625、NaHCO3 26、葡萄糖 11、蔗糖 220、KCl 2.5、CaCl2 1、MgCl2 6。③ 膜片鉗玻璃微電極內液成分(單位均為mmol/L):葡萄糖酸鉀 140、MgCl2 1、HEPES 10、EGTA 0.2、Mg-ATP 4、Na2-GTP 0.3、磷酸肌酸鈉 10。
1.3.2 腦片的制備與孵育
由于離體實驗無法實時記錄缺血期的膜電位信號,故本實驗將小鼠隨機分為兩組:對照組和缺血再灌注組,每組6只。異氟烷麻醉小鼠后斷頭取腦,浸入氧飽和的冰水混合切片液;取出后大腦大口朝下粘于切片槽;使用振動切片機(VT1200S,Leica,德國)將大腦切成300 μm厚的切片;將有完整海馬的腦片置于氧飽和的人工腦脊液中,后者盛于由亞克力板制成的容器盒內,于水浴鍋中恒溫28 ℃孵育60 min。
1.3.3 全細胞膜片鉗記錄
DG顆粒細胞作為信號記錄的目標神經元。微電極拉制儀(P-97,SUTTER,美國)拉制玻璃微電極,用加液器將解凍后的電極內液經過濾充灌進電極尖端1/3處。將孵育好的腦片移入膜片鉗操作臺記錄槽上,電極入液后調節微操將電極尖端移至細胞標記位置;電極尖端與細胞膜高阻封接后破膜,采用膜片鉗信號放大器(EPC-10,HEKA,德國)全細胞電流鉗記錄模式,記錄顆粒細胞的靜息膜電位和動作電位等信號。
1.4 植入式多通道實驗
1.4.1 電極植入與信號采集
本實驗隨機選取6只小鼠為實驗對象,小鼠電極植入手術完成后分別采集對照、腦缺血和腦缺血再灌注三組靜息狀態下的LFPs信號。對所有小鼠進行16通道微電極陣列(4 × 4,Plexon,美國)植入手術,參考小鼠腦立體定位圖譜[18],確定電極植入的位置。本實驗中的微電極絲采用鎳鉻合金材質,每根電極絲的有效長度為15 mm,電極絲之間的垂直距離為200 μm。以前囟點為參考原點,定位海馬DG區(前囟后1.5~2.5 mm,右旁開0.7~1.7 mm,深度2.5~2.6 mm)。之后在顱骨的目標區域鉆1 mm × 1 mm的矩形窗口。將微電極陣列使用電動微推進器緩慢向下推進至目標腦區,最后封裝固定電極。待小鼠恢復數天后,制備模型以采集缺血和再灌注信號。手術完成后待小鼠完全清醒,在缺血50 min左右開始記錄缺血信號。拔除線栓后待小鼠恢復30 min左右開始采集再灌注信號。應用在體多通道神經電生理信號采集系統(OmniPlex128,Plexon,美國)采集小鼠損傷側海馬DG區的LFPs信號,信號的采樣頻率是1 kHz。
1.4.2 數據處理與分析
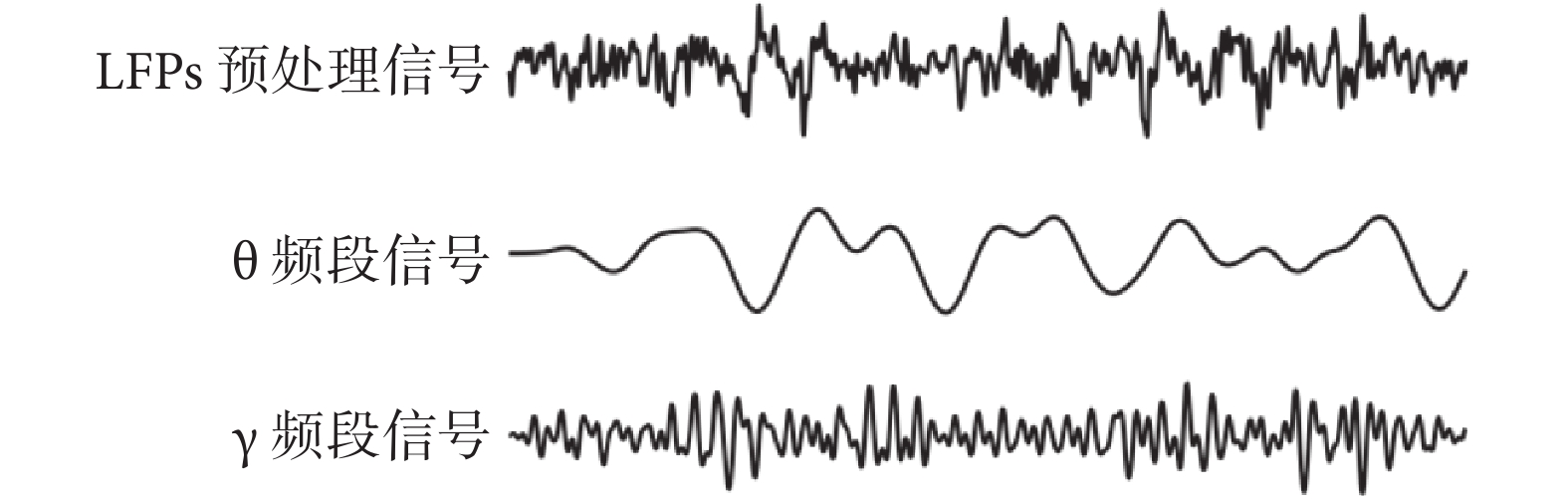
長時間記錄LFPs信號會引入一些噪聲干擾,如工頻干擾和基線漂移等。因此,需對原始信號做預處理,如陷波濾波器去除50 Hz工頻干擾及coif5小波基的小波重構去除基線漂移。基線漂移通常是低頻信號的結果。對于非平穩信號,小波變換通過其多尺度分析能力可在低頻尺度有效捕捉和分離成分同時盡量保留信號的有用信息,以得到平穩的16通道LFPs信號。隨后應用巴特沃斯濾波器對預處理之后的信號提取與認知相關的θ與γ頻段,頻段信號波形圖如圖2所示。
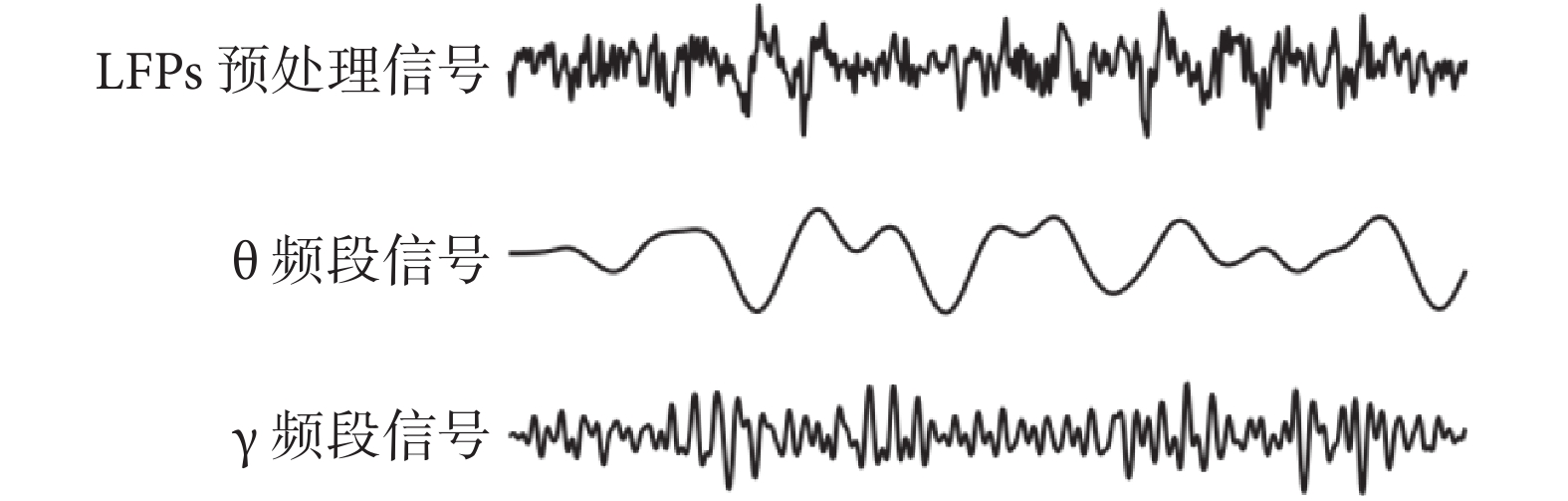 圖2
θ頻段與γ頻段信號提取
Figure2.
θ-band and γ-band signal extraction
圖2
θ頻段與γ頻段信號提取
Figure2.
θ-band and γ-band signal extraction
短時傅里葉變換(short-time Fourier transform,STFT)[19]能夠在時間上對信號進行分段處理并應用傅里葉變換。因此,本實驗采用STFT分析缺血再灌注對小鼠海馬DG區θ和γ頻段信號時頻能量的影響。其中,窗函數為hamming窗,窗口長度和移動步長分別為1 s和0.2 s。多尺度樣本熵[20]通過粗粒化過程來衡量信號在不同時間尺度上的復雜性。它能更大程度地表征出腦神經電信號的非線性動力學特征,有助于疾病的診斷和監測。因此,使用多尺度樣本熵算法計算三組小鼠海馬DG區θ和γ頻段信號的熵值,以探究缺血再灌注對小鼠海馬LFPs信號復雜度的影響。其中,重構維數m = 2,閾值大小r = 0.15,尺度因子τ = 20。
1.4.3 電極植入位置的組織學檢驗
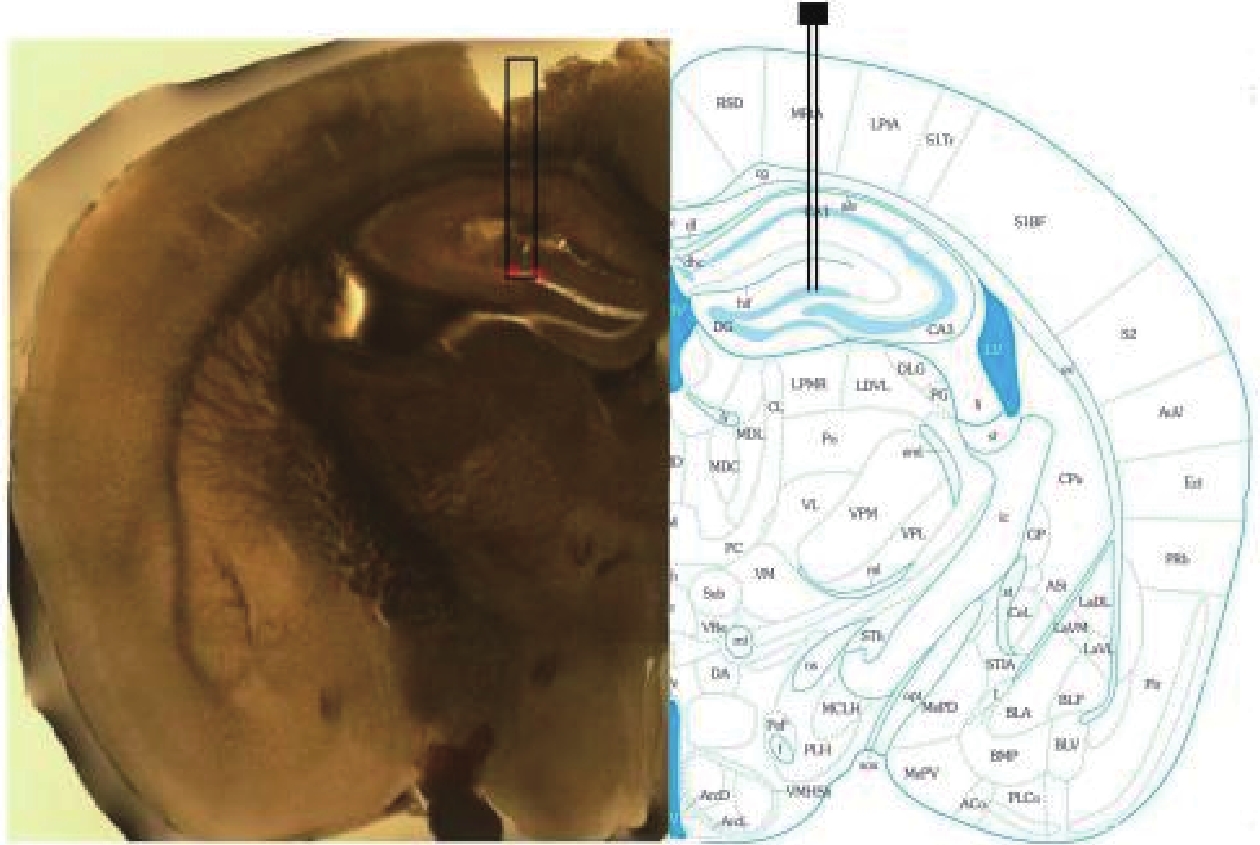
為了驗證電極是否到達指定位置,在完成信號采集后對小鼠斷頭取腦,進行電極植入位置的組織學檢驗,結果如圖3所示。通過小鼠腦組織的切片及相應的腦圖譜對比分析,發現電極準確植入于海馬DG區,符合實驗預期。
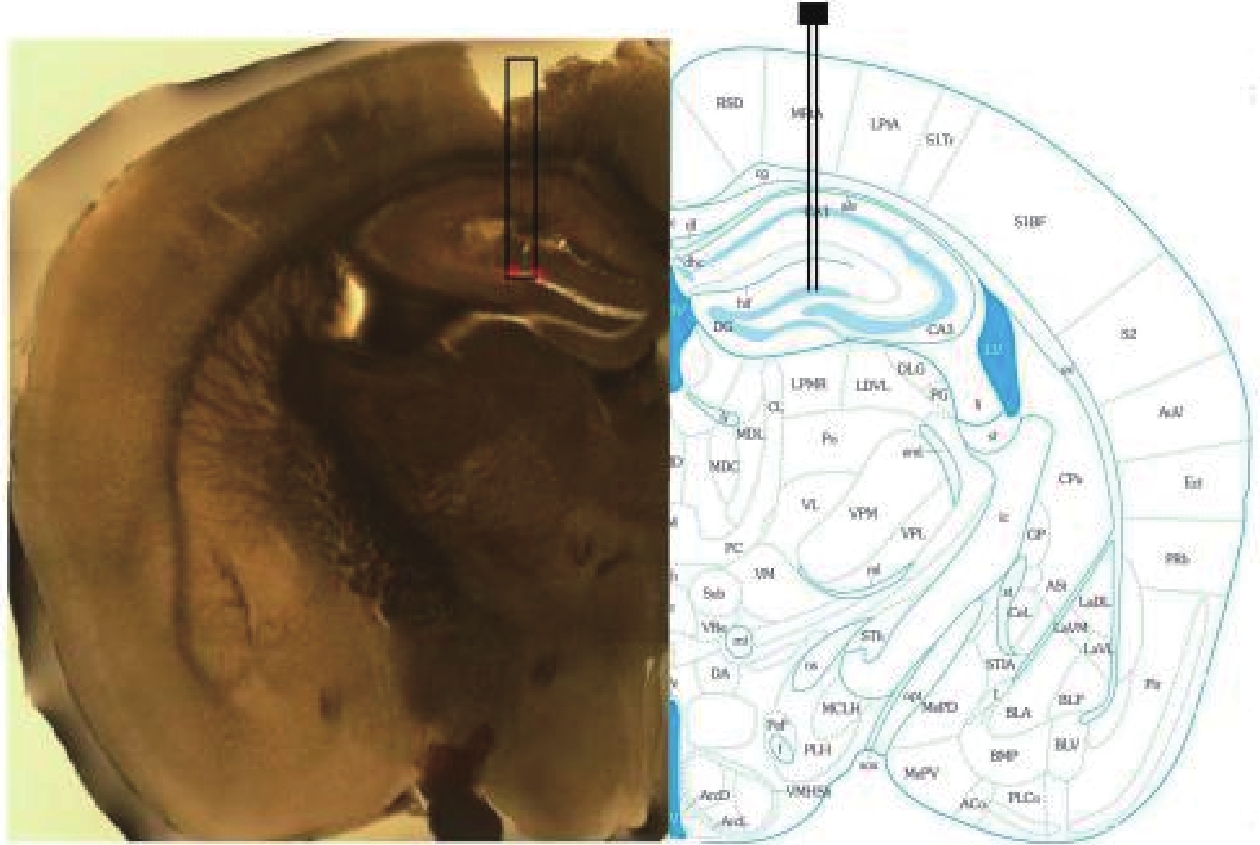 圖3
電極植入海馬位置的組織切片驗證
Figure3.
Tissue section validation of electrode implantation in hippocampal locations
圖3
電極植入海馬位置的組織切片驗證
Figure3.
Tissue section validation of electrode implantation in hippocampal locations
1.5 統計學分析
數據分析采用單因素方差分析方法,事后分析采用Tukey-test檢驗方法進行組間比較。統計結果均表示為均數±標準誤。檢驗水準為0.05。
2 結果
2.1 模型評估
本文采用神經功能評分和TTC染色兩種方法來評估腦缺血再灌注小鼠造模是否成功。其中神經功能評分結果顯示,線栓法建立模型的方法評分在2~6分左右。與對照組相比,模型組有明顯的神經功能缺損表現(P < 0.05),之后選取符合評分標準的小鼠納入后續實驗。腦缺血再灌注24 h后,模型組小鼠大腦右側梗死區呈白色,如圖4所示。模型組腦梗死面積占大腦總面積的(37.88 ± 12.30)%,與對照組(0%)比較,差異具有統計學意義(P < 0.05)。以上結果說明本文使用線栓法誘導大腦中動脈阻塞再灌注模型造模成功。
 圖4
TTC染色結果
Figure4.
TTC staining results
圖4
TTC染色結果
Figure4.
TTC staining results
2.2 缺血再灌注對海馬DG顆粒細胞神經興奮性的影響
在全細胞電流鉗模式中,對照組和缺血再灌注組各選取18個顆粒細胞,記錄并分析兩組神經元細胞的神經興奮性相關電特性指標。誘發刺激程序設置為初始值0 pA、固定步長10 pA、時長為500 ms的去極化電流誘發神經放電。其中,膜電位相關指標示意圖如圖5所示。
 圖5
神經元膜電位指標示意圖
Figure5.
Diagram of nerve cell membrane potential index
圖5
神經元膜電位指標示意圖
Figure5.
Diagram of nerve cell membrane potential index
對兩組小鼠神經元靜息膜電位及動作電位相關指標的分析結果如圖6所示。從圖中可以看出,缺血再灌注組的靜息膜電位顯著低于對照組(P < 0.01),兩組小鼠之間的峰值電位差異無統計學意義(P > 0.05),缺血再灌注組的動作電位放電個數、后超極化電位和最大上升斜率均顯著低于對照組(P < 0.01),缺血再灌注組的動作電位達峰時間、半波寬、閾值電位和最大下降斜率均顯著高于對照組(P < 0.01)。
 圖6
神經元靜息膜電位及動作電位相關指標(**P < 0.01)
Figure6.
Relative indexes of resting membrane potential and action potential of nerve cells (**P < 0.01)
圖6
神經元靜息膜電位及動作電位相關指標(**P < 0.01)
Figure6.
Relative indexes of resting membrane potential and action potential of nerve cells (**P < 0.01)
2.3 缺血再灌注小鼠海馬DG區局部場電位信號分析
2.3.1 時頻分析結果
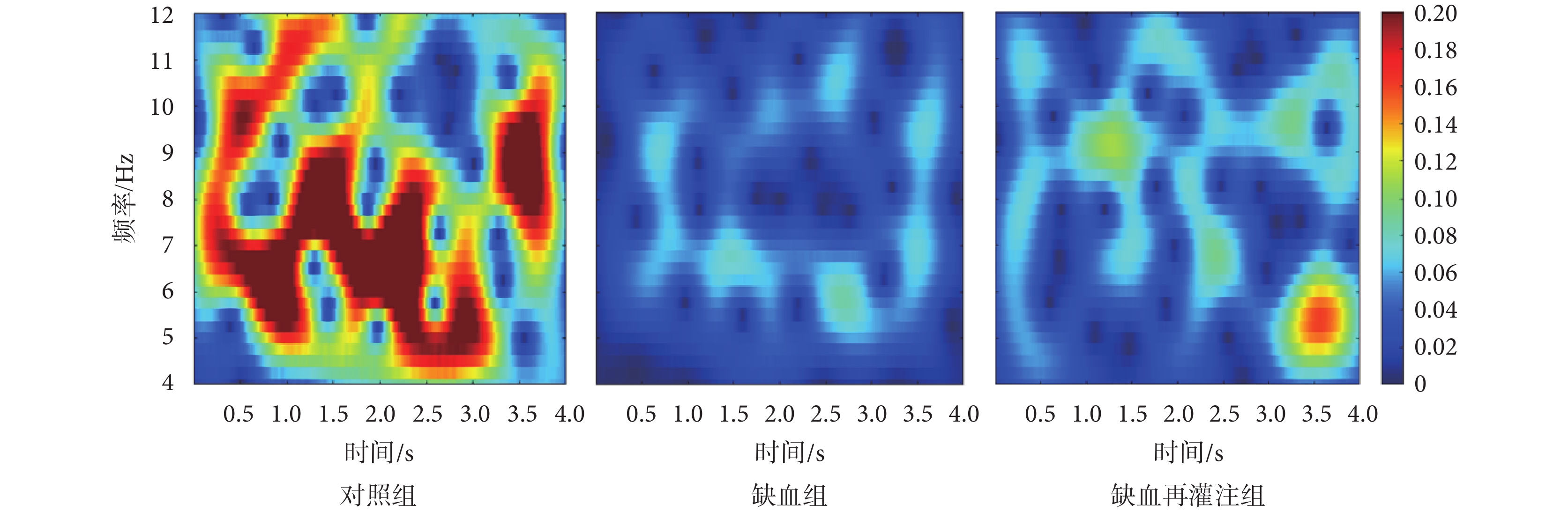
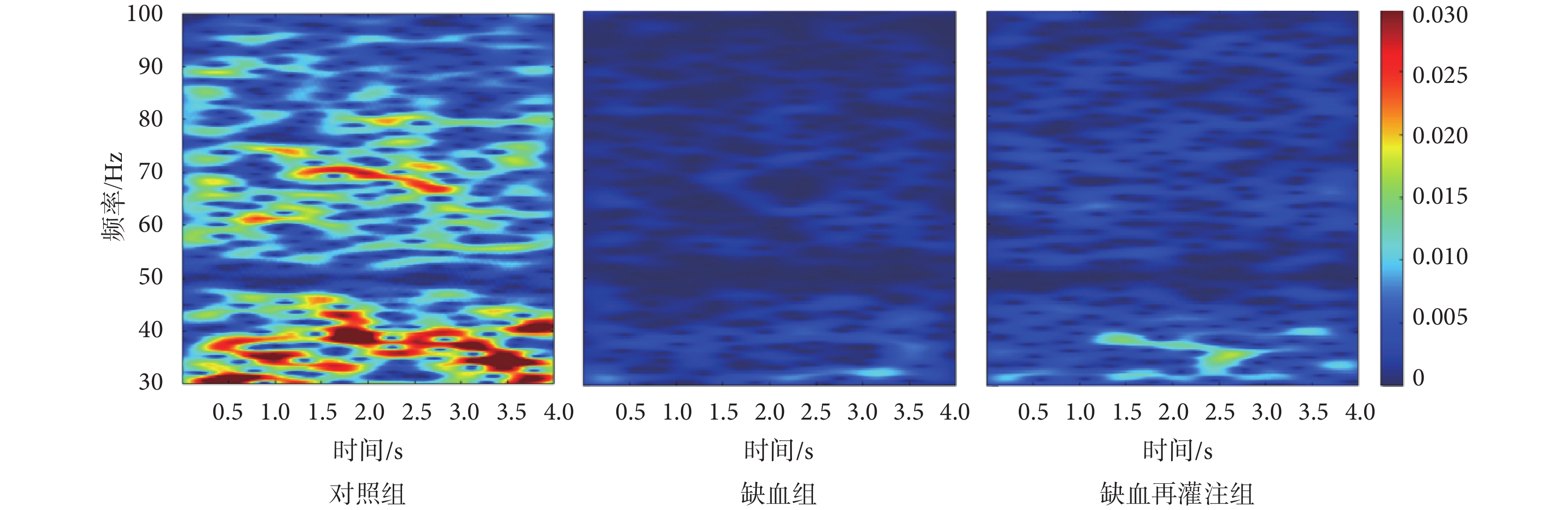
選取每只小鼠30次、每次4 000 ms的LFPs信號,分析其低頻θ和高頻γ頻段時頻特性。圖7為對照組、缺血組和缺血再灌注組小鼠θ頻段信號的時頻能量分布圖。由圖可以看出,與對照組相比,缺血組和缺血再灌注組小鼠時頻能量均降低,同時缺血再灌注組時頻能量高于缺血組小鼠。圖8為三組小鼠γ頻段信號的時頻能量分布圖。由圖可以看出,與對照組相比,缺血組和缺血再灌注組小鼠γ頻段能量值整體較低;而與缺血組相比,缺血再灌注組小鼠能量有所增強。
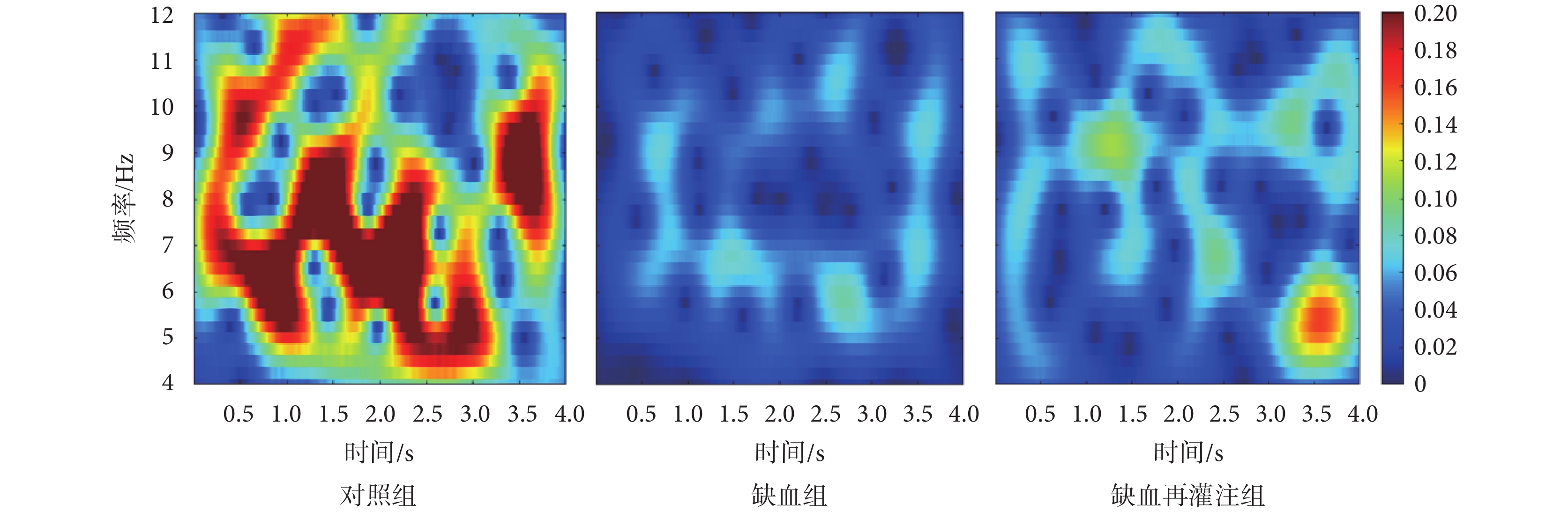 圖7
θ頻段LFPs時頻能量分布
Figure7.
Time-frequency energy distribution of LFPs in θ band
圖7
θ頻段LFPs時頻能量分布
Figure7.
Time-frequency energy distribution of LFPs in θ band
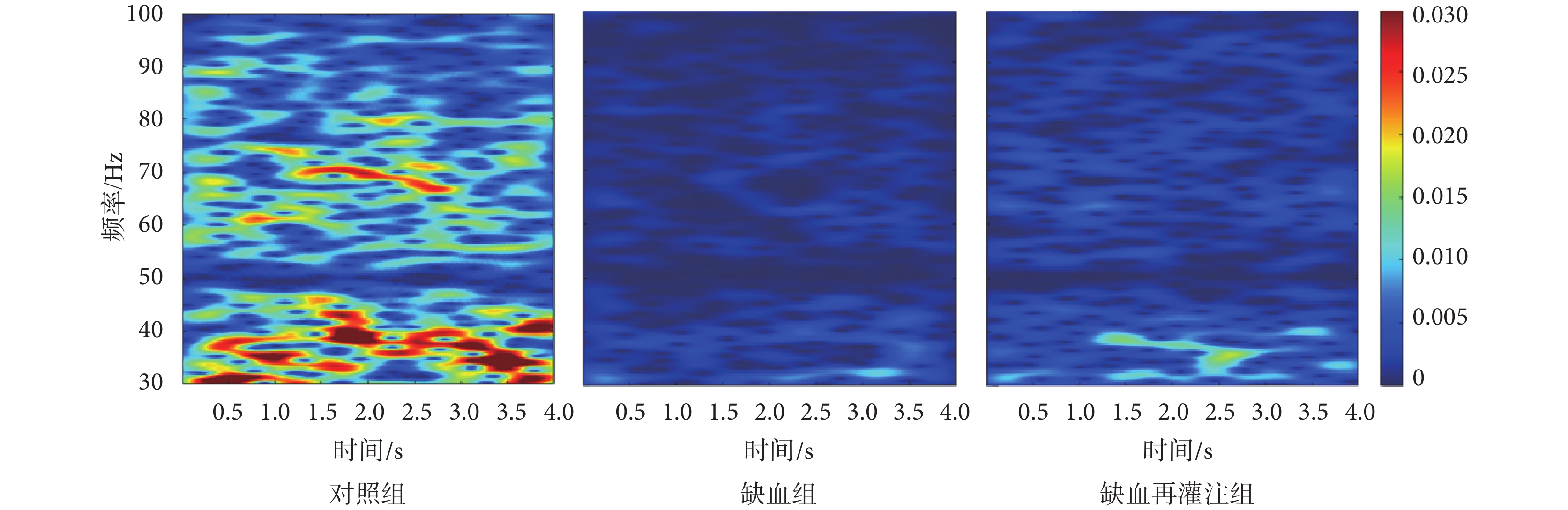 圖8
γ頻段LFPs時頻能量分布
Figure8.
Time-frequency energy distribution of LFPs in γ band
圖8
γ頻段LFPs時頻能量分布
Figure8.
Time-frequency energy distribution of LFPs in γ band
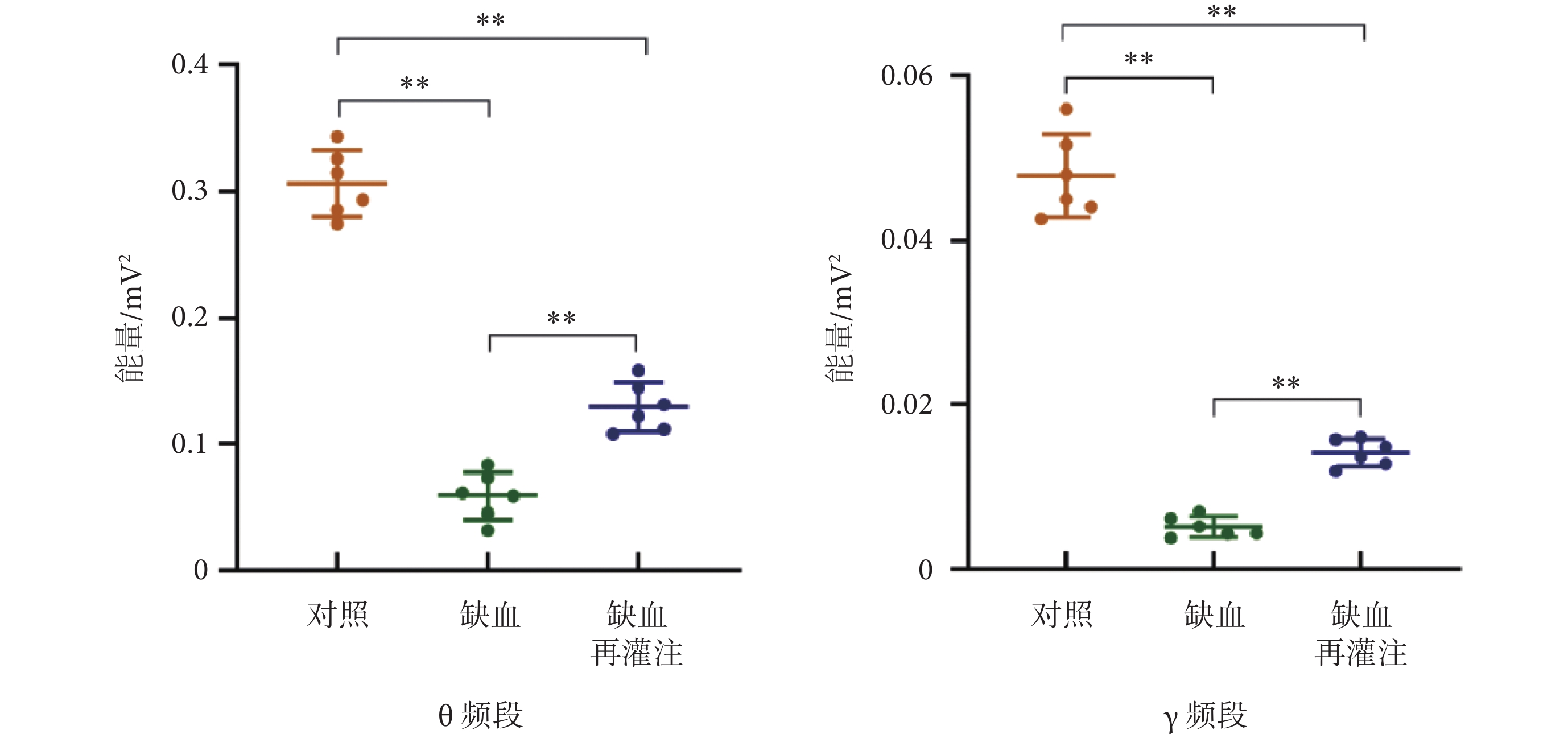
將LFPs信號時頻能量值進行平均,結果如圖9所示。經統計分析發現,缺血組和缺血再灌注組θ頻段信號的平均能量值均低于對照組且有明顯差異(P < 0.01),而缺血再灌注組θ頻段信號的平均能量值顯著高于缺血組(P < 0.01);同樣,缺血和缺血再灌注組γ頻段信號的平均能量值均低于對照組(P < 0.01),但缺血再灌注組γ頻段信號的平均能量值高于缺血組(P < 0.01)。
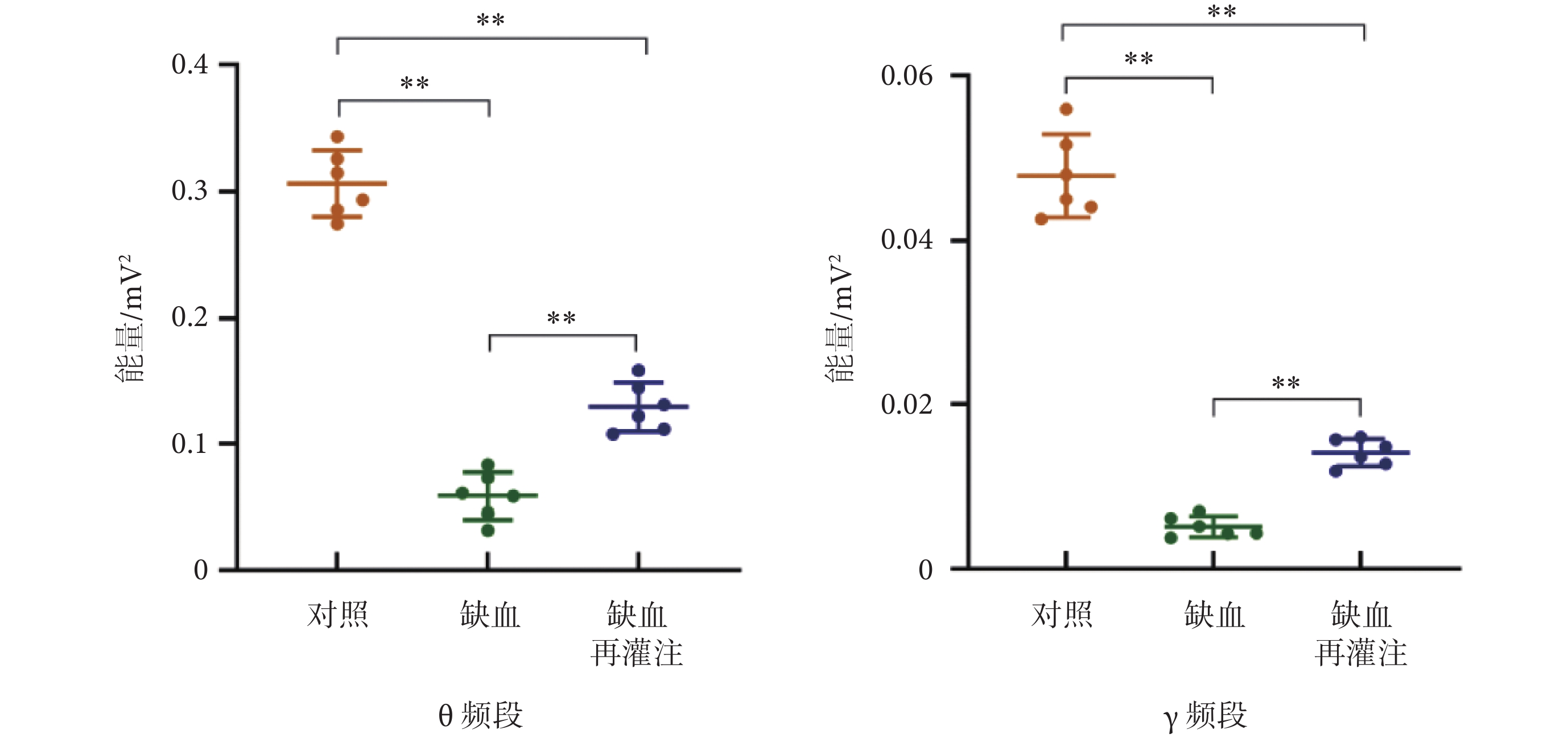 圖9
兩頻段平均能量對比(**P < 0.01)
Figure9.
Average energy comparison of two frequency bands (**P < 0.01)
圖9
兩頻段平均能量對比(**P < 0.01)
Figure9.
Average energy comparison of two frequency bands (**P < 0.01)
2.3.2 信號復雜度分析結果
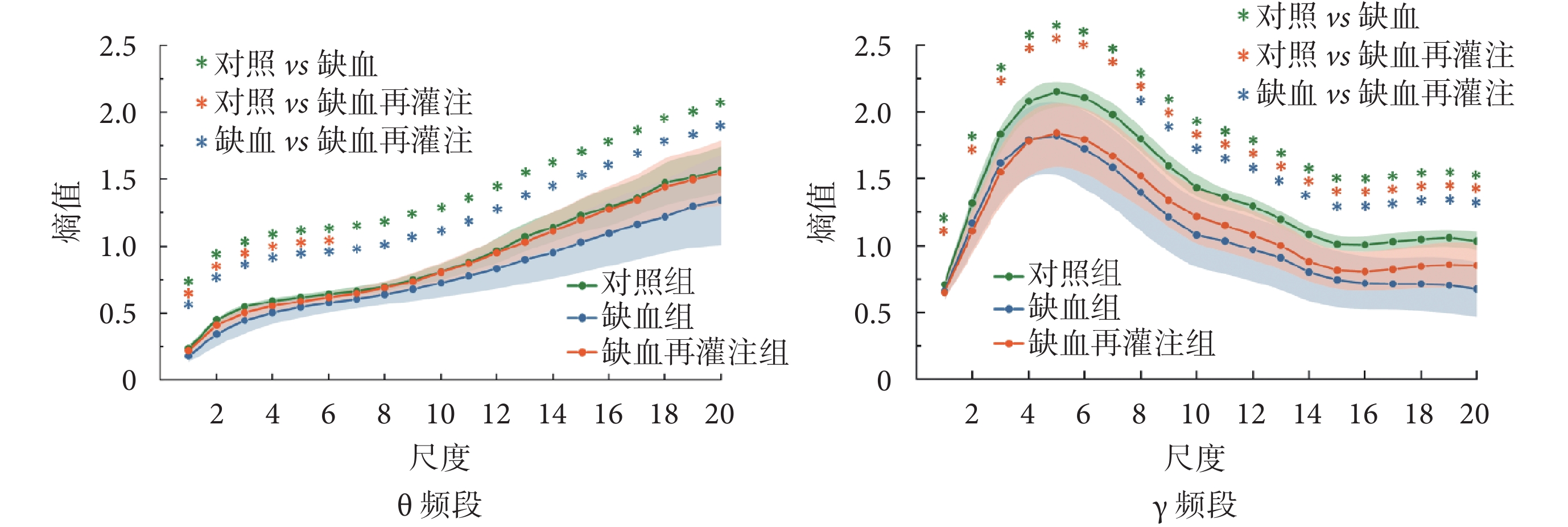
計算θ頻段信號多尺度樣本熵,結果如圖10左圖所示。可以看出,三組小鼠海馬DG區θ頻段信號熵值均隨尺度的增大不斷增加,且對照組熵值在所有尺度上均顯著高于缺血組(P < 0.05),部分尺度上顯著高于缺血再灌注組(P < 0.05);缺血組熵值在所有尺度上均低于缺血再灌注組(P < 0.05)。
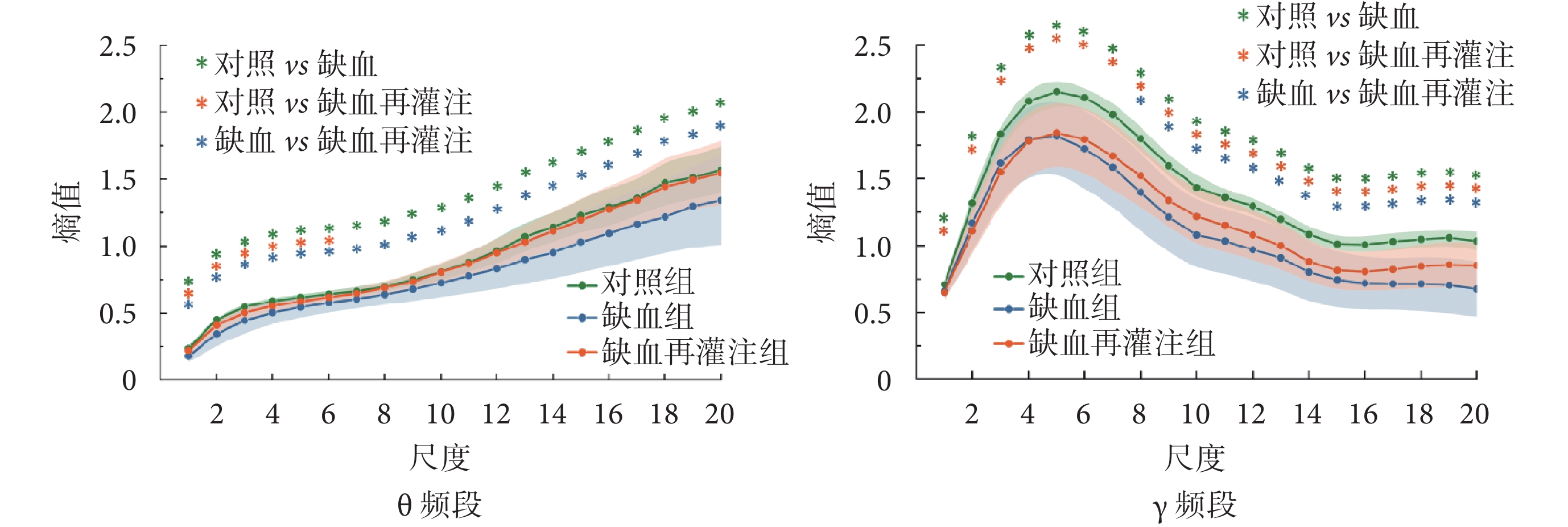 圖10
LFPs信號兩頻段復雜度對比(*P < 0.05)
Figure10.
Complexity comparison of two bands of LFPs signals (*P < 0.05)
圖10
LFPs信號兩頻段復雜度對比(*P < 0.05)
Figure10.
Complexity comparison of two bands of LFPs signals (*P < 0.05)
γ頻段信號多尺度樣本熵值如圖10右圖所示。可以看出,三組小鼠海馬DG區γ頻段信號熵值隨尺度先增加后減小。對照組熵值在所有尺度上均顯著高于缺血組和缺血再灌注組(P < 0.05);缺血組熵值在部分尺度上低于缺血再灌注組(P < 0.05)。
3 討論
不同大腦區域的局部損傷可能會導致一定程度的認知缺陷,該現象在缺血性卒中后較為常見[21-22]。有研究指出海馬DG區受損時,大部分海馬依賴的認知功能也會降低[23]。然而,缺血性卒中是否會影響大腦海馬DG區神經元電活動目前還尚未明確。本文通過靜息膜電位及動作電位相關指標分析發現,腦缺血再灌注降低了小鼠海馬DG區神經元的靜息膜電位;在去極化電流刺激作用下,腦缺血再灌注小鼠的動作電位放電個數顯著減少,誘發放電頻率減弱,說明該模型鼠在靜息狀態下神經元興奮性降低,細胞膜去極化產生神經放電所需的刺激更大;動作電位達峰時間與最大上升斜率的變化趨勢基本一致,達峰時間越長代表離子通道的開放與關閉的速度越慢,去極化的過程越緩慢,上升斜率越小;最大下降斜率越大說明復極化的過程越迅速;半波寬反映整個動作電位的時程,閾值電位是神經元受到刺激時剛好能觸發動作電位膜電位的臨界值,半波寬和閾值電位的增加意味著神經元將更難產生動作電位。后超極化電位的降低說明復極化后神經元靜息膜電位處于更低水平,再次受到刺激時神經元將更難以興奮。綜合以上結果說明腦缺血再灌注有可能會導致小鼠海馬DG區神經元電特性指標異常,神經元興奮性降低。而神經元興奮性是維持神經系統正常功能的基礎,神經元興奮性的異常調節可能與相關神經性疾病認知障礙等癥狀的發展有關[24]。之前有研究發現海馬中的神經元可能是通過調節DG區網絡的興奮性來促進認知過程的[25],缺血再灌注的改善可能與增強同側半球神經元的興奮性等因素有關[26]。由此我們認為,腦缺血再灌注過程可導致海馬等認知功能相關腦區神經元興奮性降低,這可能是缺血性卒中引發認知功能障礙的機制之一。
對海馬DG區LFPs信號分析結果顯示,缺血組小鼠海馬DG區LFPs信號θ和γ頻段能量減弱,再灌注后信號能量有所增強。腦缺血還降低了小鼠海馬DG區θ和γ頻段的信號復雜度,經再灌注后信號復雜度有一定程度提升,但仍低于正常小鼠水平。分析原因可能是缺血時期大腦血流受阻,區域腦組織神經元電活動受到抑制,信號復雜度降低。而再灌注后血流得到回升,神經元電活動得以恢復,信號復雜度升高,但有限時間內仍無法達到正常水平。之前有學者指出缺血性卒中對海馬區電生理學的影響表現為破壞銳波相關漣漪和海馬體內以及皮層與海馬間的相位振幅耦合,從而改變了大腦狀態[27]。He等[28]研究發現腦缺血可能破壞海馬體興奮性和抑制性回路之間的平衡,大鼠大腦遠端中動脈閉塞期間海馬θ和γ振蕩功率暫時降低和高θ持續時間縮短,只有缺血再灌注后才檢測到對記憶鞏固至關重要的尖銳波相關波紋增加。Sutherland等[29]監測腦缺血和再灌注過程中的大腦活動以及時間依賴性神經生理學和血流動力學反應,結果發現該模型的誘發血流量、組織氧合和神經元活動減弱,并在再灌注過程中部分恢復。Sato等[30]也提到腦梗死發生后由于能量供應缺乏使神經元和神經膠質細胞發生去極化,而再灌注一段時間后該過程停止。綜合以上分析來看,本文研究結果與前述研究結論具有較好的一致性。
4 結論
本文通過離體和在體電生理方法探究了缺血再灌注小鼠海馬DG區神經元電生理特性的變化。對靜息膜電位、動作電位及其相關電特性進行分析,結果發現缺血再灌注嚴重影響了小鼠海馬DG區顆粒細胞神經元的活動變化,表現為神經元電特性指標異常,神經元興奮性降低。LFPs信號分析結果表明,腦缺血后小鼠海馬DG區θ和γ頻段信號的神經放電活動減弱,信號復雜度降低,經再灌注后神經放電活動和信號復雜度有一定程度提升,但實驗周期內沒能恢復到正常水平。本研究為進一步探究缺血性卒中引起海馬神經活動變化的潛在機制提供了一定的實驗依據。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:朱俞燦參與了實驗設計、數據采集、數據分析和論文寫作;于洪麗參與了論文的選題、實驗設計和論文內容審核;趙秀芝參與了實驗設計和數據采集;王春方參與了實驗設計和論文修改。
倫理聲明:本研究通過了河北工業大學實驗動物倫理委員會的審批(批文編號:HEBUTaCUC2022066)。
0 引言
缺血性腦卒中由區域腦血流量的短暫或永久性減少引起。據最新統計,每年有超過760萬例新發缺血性卒中[1]。缺血性卒中除了可能導致肢體活動和語言能力等神經功能缺損以外,認知和記憶障礙是卒中后常見的后遺癥之一[2]。有研究表明,認知損害與缺血性卒中患者的梗死程度以及病灶位置[3]、腦血管病變[4]、神經炎癥[5]和血腦屏障破壞[6]等因素相關。海馬是與認知功能密切相關的腦區[7],其中,齒狀回(dentate gyrus,DG)顆粒細胞在認知及神經系統發育過程中發揮著關鍵作用[8]。然而,缺血性卒中對海馬DG區神經活動的影響機制尚未明確。
電生理學方法一直是人們研究大腦神經活動的重要手段。先前的研究表明神經興奮性的變化可能與認知缺陷相關[9-10],而神經元中安靜時的靜息膜電位、受到刺激時產生的動作電位的發放頻率及其相關電特性指標是衡量神經元興奮性的重要指標。局部場電位(local field potentials,LFPs)能夠反映大腦局部神經元集群突觸活動所造成的電場變化[11]。其中,θ頻段(4~12 Hz)與學習和記憶有關[12],γ頻段(30~100 Hz)在工作記憶的提取、形成等認知過程中發揮關鍵作用[13]。LFPs記錄已被用于識別神經疾病的病理變化,檢測進行性神經障礙的損傷程度。然而,以往關于缺血性卒中認知損傷的動物研究大多以行為學實驗或者細胞生物學來展開探索[14-15],從電生理學角度研究卒中引起的海馬神經活動變化的潛在機制較少。
缺血性卒中最常見于大腦中動脈及其分支阻塞[16]。再灌注現象指缺血性卒中在一段時間的缺血后重新獲得血液供應的過程,腦缺血再灌注損傷是缺血性卒中的普遍特征。故本文以大腦中動脈阻塞再灌注小鼠為實驗對象,海馬DG區為目標腦區,采用2, 3, 5-氯化三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride,TTC)評估該模型腦梗死程度,通過離體膜片鉗和在體大腦LFPs探究腦缺血再灌注對小鼠海馬DG神經元電生理特性的影響。
1 材料和方法
1.1 實驗動物
本研究采用健康雄性C57BL/6小鼠,6~8周齡,體重(23 ± 3)g,共計26只。購自北京華阜康生物科技股份有限公司,實驗動物許可證號:SCXK(京)2019 - 0008。飼養環境溫度維持在26 ℃左右,術前過夜禁食不禁水。所有實驗均獲得河北工業大學生物醫學倫理委員會批準。本文總體研究路線圖如圖1所示。
 圖1
總體研究路線圖
Figure1.
Overall research roadmap
圖1
總體研究路線圖
Figure1.
Overall research roadmap
1.2 模型制備
采用線栓法[17]制備大腦中動脈阻塞再灌注小鼠模型。采用異氟烷搭配通氧的麻醉機對小鼠進行氣麻,進入深度麻醉后,分離小鼠左側頸總、頸外和頸內動脈,在頸總動脈上扎一小口,將線栓沿著頸內動脈插入,直至遇到輕微阻力不能再前送為止。整個手術過程為15~20 min,缺血60 min后拔除線栓實現再灌注。待小鼠有自主活動、刺激反應、正常姿勢以及自主進食飲水等表現則表示小鼠完全清醒,后采用Zea-Longa神經功能評分對實驗小鼠的神經功能缺陷程度進行評估,評分標準如表1所示。
采用TTC染色對腦組織損傷程度進行神經病理學評估,隨機分為對照組和模型組,每組4只。術后24 h,采用異氟烷待小鼠深度麻醉,斷頭取腦,切為連續冠狀切片,放入2% TTC溶液中染色,后沖洗、固定腦片;染色結束后,選擇適當的光源和角度,使用相機對腦片進行拍照以觀察梗死面積。腦片中白色部分為梗死區域,紅色部分為正常組織區域。
1.3 離體腦片膜片鉗實驗
1.3.1 試劑
① 人工腦脊液成分(單位均為mmol/L):NaCl 124、NaH2PO4 1.625、NaHCO3 26、葡萄糖 11、HEPES 5、KCl 3、CaCl2 2、MgCl2 2。② 高糖切片液成分(單位均為mmol/L):NaH2PO4 1.625、NaHCO3 26、葡萄糖 11、蔗糖 220、KCl 2.5、CaCl2 1、MgCl2 6。③ 膜片鉗玻璃微電極內液成分(單位均為mmol/L):葡萄糖酸鉀 140、MgCl2 1、HEPES 10、EGTA 0.2、Mg-ATP 4、Na2-GTP 0.3、磷酸肌酸鈉 10。
1.3.2 腦片的制備與孵育
由于離體實驗無法實時記錄缺血期的膜電位信號,故本實驗將小鼠隨機分為兩組:對照組和缺血再灌注組,每組6只。異氟烷麻醉小鼠后斷頭取腦,浸入氧飽和的冰水混合切片液;取出后大腦大口朝下粘于切片槽;使用振動切片機(VT1200S,Leica,德國)將大腦切成300 μm厚的切片;將有完整海馬的腦片置于氧飽和的人工腦脊液中,后者盛于由亞克力板制成的容器盒內,于水浴鍋中恒溫28 ℃孵育60 min。
1.3.3 全細胞膜片鉗記錄
DG顆粒細胞作為信號記錄的目標神經元。微電極拉制儀(P-97,SUTTER,美國)拉制玻璃微電極,用加液器將解凍后的電極內液經過濾充灌進電極尖端1/3處。將孵育好的腦片移入膜片鉗操作臺記錄槽上,電極入液后調節微操將電極尖端移至細胞標記位置;電極尖端與細胞膜高阻封接后破膜,采用膜片鉗信號放大器(EPC-10,HEKA,德國)全細胞電流鉗記錄模式,記錄顆粒細胞的靜息膜電位和動作電位等信號。
1.4 植入式多通道實驗
1.4.1 電極植入與信號采集
本實驗隨機選取6只小鼠為實驗對象,小鼠電極植入手術完成后分別采集對照、腦缺血和腦缺血再灌注三組靜息狀態下的LFPs信號。對所有小鼠進行16通道微電極陣列(4 × 4,Plexon,美國)植入手術,參考小鼠腦立體定位圖譜[18],確定電極植入的位置。本實驗中的微電極絲采用鎳鉻合金材質,每根電極絲的有效長度為15 mm,電極絲之間的垂直距離為200 μm。以前囟點為參考原點,定位海馬DG區(前囟后1.5~2.5 mm,右旁開0.7~1.7 mm,深度2.5~2.6 mm)。之后在顱骨的目標區域鉆1 mm × 1 mm的矩形窗口。將微電極陣列使用電動微推進器緩慢向下推進至目標腦區,最后封裝固定電極。待小鼠恢復數天后,制備模型以采集缺血和再灌注信號。手術完成后待小鼠完全清醒,在缺血50 min左右開始記錄缺血信號。拔除線栓后待小鼠恢復30 min左右開始采集再灌注信號。應用在體多通道神經電生理信號采集系統(OmniPlex128,Plexon,美國)采集小鼠損傷側海馬DG區的LFPs信號,信號的采樣頻率是1 kHz。
1.4.2 數據處理與分析
長時間記錄LFPs信號會引入一些噪聲干擾,如工頻干擾和基線漂移等。因此,需對原始信號做預處理,如陷波濾波器去除50 Hz工頻干擾及coif5小波基的小波重構去除基線漂移。基線漂移通常是低頻信號的結果。對于非平穩信號,小波變換通過其多尺度分析能力可在低頻尺度有效捕捉和分離成分同時盡量保留信號的有用信息,以得到平穩的16通道LFPs信號。隨后應用巴特沃斯濾波器對預處理之后的信號提取與認知相關的θ與γ頻段,頻段信號波形圖如圖2所示。
 圖2
θ頻段與γ頻段信號提取
Figure2.
θ-band and γ-band signal extraction
圖2
θ頻段與γ頻段信號提取
Figure2.
θ-band and γ-band signal extraction
短時傅里葉變換(short-time Fourier transform,STFT)[19]能夠在時間上對信號進行分段處理并應用傅里葉變換。因此,本實驗采用STFT分析缺血再灌注對小鼠海馬DG區θ和γ頻段信號時頻能量的影響。其中,窗函數為hamming窗,窗口長度和移動步長分別為1 s和0.2 s。多尺度樣本熵[20]通過粗粒化過程來衡量信號在不同時間尺度上的復雜性。它能更大程度地表征出腦神經電信號的非線性動力學特征,有助于疾病的診斷和監測。因此,使用多尺度樣本熵算法計算三組小鼠海馬DG區θ和γ頻段信號的熵值,以探究缺血再灌注對小鼠海馬LFPs信號復雜度的影響。其中,重構維數m = 2,閾值大小r = 0.15,尺度因子τ = 20。
1.4.3 電極植入位置的組織學檢驗
為了驗證電極是否到達指定位置,在完成信號采集后對小鼠斷頭取腦,進行電極植入位置的組織學檢驗,結果如圖3所示。通過小鼠腦組織的切片及相應的腦圖譜對比分析,發現電極準確植入于海馬DG區,符合實驗預期。
 圖3
電極植入海馬位置的組織切片驗證
Figure3.
Tissue section validation of electrode implantation in hippocampal locations
圖3
電極植入海馬位置的組織切片驗證
Figure3.
Tissue section validation of electrode implantation in hippocampal locations
1.5 統計學分析
數據分析采用單因素方差分析方法,事后分析采用Tukey-test檢驗方法進行組間比較。統計結果均表示為均數±標準誤。檢驗水準為0.05。
2 結果
2.1 模型評估
本文采用神經功能評分和TTC染色兩種方法來評估腦缺血再灌注小鼠造模是否成功。其中神經功能評分結果顯示,線栓法建立模型的方法評分在2~6分左右。與對照組相比,模型組有明顯的神經功能缺損表現(P < 0.05),之后選取符合評分標準的小鼠納入后續實驗。腦缺血再灌注24 h后,模型組小鼠大腦右側梗死區呈白色,如圖4所示。模型組腦梗死面積占大腦總面積的(37.88 ± 12.30)%,與對照組(0%)比較,差異具有統計學意義(P < 0.05)。以上結果說明本文使用線栓法誘導大腦中動脈阻塞再灌注模型造模成功。
 圖4
TTC染色結果
Figure4.
TTC staining results
圖4
TTC染色結果
Figure4.
TTC staining results
2.2 缺血再灌注對海馬DG顆粒細胞神經興奮性的影響
在全細胞電流鉗模式中,對照組和缺血再灌注組各選取18個顆粒細胞,記錄并分析兩組神經元細胞的神經興奮性相關電特性指標。誘發刺激程序設置為初始值0 pA、固定步長10 pA、時長為500 ms的去極化電流誘發神經放電。其中,膜電位相關指標示意圖如圖5所示。
 圖5
神經元膜電位指標示意圖
Figure5.
Diagram of nerve cell membrane potential index
圖5
神經元膜電位指標示意圖
Figure5.
Diagram of nerve cell membrane potential index
對兩組小鼠神經元靜息膜電位及動作電位相關指標的分析結果如圖6所示。從圖中可以看出,缺血再灌注組的靜息膜電位顯著低于對照組(P < 0.01),兩組小鼠之間的峰值電位差異無統計學意義(P > 0.05),缺血再灌注組的動作電位放電個數、后超極化電位和最大上升斜率均顯著低于對照組(P < 0.01),缺血再灌注組的動作電位達峰時間、半波寬、閾值電位和最大下降斜率均顯著高于對照組(P < 0.01)。
 圖6
神經元靜息膜電位及動作電位相關指標(**P < 0.01)
Figure6.
Relative indexes of resting membrane potential and action potential of nerve cells (**P < 0.01)
圖6
神經元靜息膜電位及動作電位相關指標(**P < 0.01)
Figure6.
Relative indexes of resting membrane potential and action potential of nerve cells (**P < 0.01)
2.3 缺血再灌注小鼠海馬DG區局部場電位信號分析
2.3.1 時頻分析結果
選取每只小鼠30次、每次4 000 ms的LFPs信號,分析其低頻θ和高頻γ頻段時頻特性。圖7為對照組、缺血組和缺血再灌注組小鼠θ頻段信號的時頻能量分布圖。由圖可以看出,與對照組相比,缺血組和缺血再灌注組小鼠時頻能量均降低,同時缺血再灌注組時頻能量高于缺血組小鼠。圖8為三組小鼠γ頻段信號的時頻能量分布圖。由圖可以看出,與對照組相比,缺血組和缺血再灌注組小鼠γ頻段能量值整體較低;而與缺血組相比,缺血再灌注組小鼠能量有所增強。
 圖7
θ頻段LFPs時頻能量分布
Figure7.
Time-frequency energy distribution of LFPs in θ band
圖7
θ頻段LFPs時頻能量分布
Figure7.
Time-frequency energy distribution of LFPs in θ band
 圖8
γ頻段LFPs時頻能量分布
Figure8.
Time-frequency energy distribution of LFPs in γ band
圖8
γ頻段LFPs時頻能量分布
Figure8.
Time-frequency energy distribution of LFPs in γ band
將LFPs信號時頻能量值進行平均,結果如圖9所示。經統計分析發現,缺血組和缺血再灌注組θ頻段信號的平均能量值均低于對照組且有明顯差異(P < 0.01),而缺血再灌注組θ頻段信號的平均能量值顯著高于缺血組(P < 0.01);同樣,缺血和缺血再灌注組γ頻段信號的平均能量值均低于對照組(P < 0.01),但缺血再灌注組γ頻段信號的平均能量值高于缺血組(P < 0.01)。
 圖9
兩頻段平均能量對比(**P < 0.01)
Figure9.
Average energy comparison of two frequency bands (**P < 0.01)
圖9
兩頻段平均能量對比(**P < 0.01)
Figure9.
Average energy comparison of two frequency bands (**P < 0.01)
2.3.2 信號復雜度分析結果
計算θ頻段信號多尺度樣本熵,結果如圖10左圖所示。可以看出,三組小鼠海馬DG區θ頻段信號熵值均隨尺度的增大不斷增加,且對照組熵值在所有尺度上均顯著高于缺血組(P < 0.05),部分尺度上顯著高于缺血再灌注組(P < 0.05);缺血組熵值在所有尺度上均低于缺血再灌注組(P < 0.05)。
 圖10
LFPs信號兩頻段復雜度對比(*P < 0.05)
Figure10.
Complexity comparison of two bands of LFPs signals (*P < 0.05)
圖10
LFPs信號兩頻段復雜度對比(*P < 0.05)
Figure10.
Complexity comparison of two bands of LFPs signals (*P < 0.05)
γ頻段信號多尺度樣本熵值如圖10右圖所示。可以看出,三組小鼠海馬DG區γ頻段信號熵值隨尺度先增加后減小。對照組熵值在所有尺度上均顯著高于缺血組和缺血再灌注組(P < 0.05);缺血組熵值在部分尺度上低于缺血再灌注組(P < 0.05)。
3 討論
不同大腦區域的局部損傷可能會導致一定程度的認知缺陷,該現象在缺血性卒中后較為常見[21-22]。有研究指出海馬DG區受損時,大部分海馬依賴的認知功能也會降低[23]。然而,缺血性卒中是否會影響大腦海馬DG區神經元電活動目前還尚未明確。本文通過靜息膜電位及動作電位相關指標分析發現,腦缺血再灌注降低了小鼠海馬DG區神經元的靜息膜電位;在去極化電流刺激作用下,腦缺血再灌注小鼠的動作電位放電個數顯著減少,誘發放電頻率減弱,說明該模型鼠在靜息狀態下神經元興奮性降低,細胞膜去極化產生神經放電所需的刺激更大;動作電位達峰時間與最大上升斜率的變化趨勢基本一致,達峰時間越長代表離子通道的開放與關閉的速度越慢,去極化的過程越緩慢,上升斜率越小;最大下降斜率越大說明復極化的過程越迅速;半波寬反映整個動作電位的時程,閾值電位是神經元受到刺激時剛好能觸發動作電位膜電位的臨界值,半波寬和閾值電位的增加意味著神經元將更難產生動作電位。后超極化電位的降低說明復極化后神經元靜息膜電位處于更低水平,再次受到刺激時神經元將更難以興奮。綜合以上結果說明腦缺血再灌注有可能會導致小鼠海馬DG區神經元電特性指標異常,神經元興奮性降低。而神經元興奮性是維持神經系統正常功能的基礎,神經元興奮性的異常調節可能與相關神經性疾病認知障礙等癥狀的發展有關[24]。之前有研究發現海馬中的神經元可能是通過調節DG區網絡的興奮性來促進認知過程的[25],缺血再灌注的改善可能與增強同側半球神經元的興奮性等因素有關[26]。由此我們認為,腦缺血再灌注過程可導致海馬等認知功能相關腦區神經元興奮性降低,這可能是缺血性卒中引發認知功能障礙的機制之一。
對海馬DG區LFPs信號分析結果顯示,缺血組小鼠海馬DG區LFPs信號θ和γ頻段能量減弱,再灌注后信號能量有所增強。腦缺血還降低了小鼠海馬DG區θ和γ頻段的信號復雜度,經再灌注后信號復雜度有一定程度提升,但仍低于正常小鼠水平。分析原因可能是缺血時期大腦血流受阻,區域腦組織神經元電活動受到抑制,信號復雜度降低。而再灌注后血流得到回升,神經元電活動得以恢復,信號復雜度升高,但有限時間內仍無法達到正常水平。之前有學者指出缺血性卒中對海馬區電生理學的影響表現為破壞銳波相關漣漪和海馬體內以及皮層與海馬間的相位振幅耦合,從而改變了大腦狀態[27]。He等[28]研究發現腦缺血可能破壞海馬體興奮性和抑制性回路之間的平衡,大鼠大腦遠端中動脈閉塞期間海馬θ和γ振蕩功率暫時降低和高θ持續時間縮短,只有缺血再灌注后才檢測到對記憶鞏固至關重要的尖銳波相關波紋增加。Sutherland等[29]監測腦缺血和再灌注過程中的大腦活動以及時間依賴性神經生理學和血流動力學反應,結果發現該模型的誘發血流量、組織氧合和神經元活動減弱,并在再灌注過程中部分恢復。Sato等[30]也提到腦梗死發生后由于能量供應缺乏使神經元和神經膠質細胞發生去極化,而再灌注一段時間后該過程停止。綜合以上分析來看,本文研究結果與前述研究結論具有較好的一致性。
4 結論
本文通過離體和在體電生理方法探究了缺血再灌注小鼠海馬DG區神經元電生理特性的變化。對靜息膜電位、動作電位及其相關電特性進行分析,結果發現缺血再灌注嚴重影響了小鼠海馬DG區顆粒細胞神經元的活動變化,表現為神經元電特性指標異常,神經元興奮性降低。LFPs信號分析結果表明,腦缺血后小鼠海馬DG區θ和γ頻段信號的神經放電活動減弱,信號復雜度降低,經再灌注后神經放電活動和信號復雜度有一定程度提升,但實驗周期內沒能恢復到正常水平。本研究為進一步探究缺血性卒中引起海馬神經活動變化的潛在機制提供了一定的實驗依據。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:朱俞燦參與了實驗設計、數據采集、數據分析和論文寫作;于洪麗參與了論文的選題、實驗設計和論文內容審核;趙秀芝參與了實驗設計和數據采集;王春方參與了實驗設計和論文修改。
倫理聲明:本研究通過了河北工業大學實驗動物倫理委員會的審批(批文編號:HEBUTaCUC2022066)。