經顱磁刺激(TMS)作為一種無創的神經調控技術現已用于神經和精神類疾病的臨床治療,但不同頻率與模式TMS的刺激效果及其神經調控機制尚未明確。本文從神經電生理角度探究不同頻率重復TMS(rTMS)和短陣快速脈沖TMS(bTMS)對小鼠學習記憶和神經元興奮性的影響。本文實驗采用8周的昆明小鼠42只,隨機分為偽刺激組和刺激組;刺激組包括:不同頻率(1、5、10 Hz)的 rTMS刺激組;不同頻率(1、5、10 Hz)的bTMS刺激組。其中,刺激組接受連續14 d的刺激。刺激結束后,小鼠進行新物體識別與跳臺實驗以檢測小鼠記憶能力;隨后進行腦片膜片鉗實驗分析小鼠海馬齒狀回(DG)顆粒細胞興奮性。結果表明,與偽刺激組相比,高頻(5、10 Hz)的rTMS與bTMS能提高小鼠記憶能力和神經元興奮性,而低頻(1 Hz)的rTMS與bTMS則無顯著效果;同頻率下兩種刺激模式對小鼠記憶功能與神經元興奮性的影響無明顯差別。本文研究結果提示,高頻TMS可通過提高海馬DG顆粒神經元興奮性來提高小鼠記憶功能。本文為TMS改善認知功能的機制研究和臨床應用提供實驗和理論依據。
引用本文: 付蕊, 朱海軍, 丁沖, 徐桂芝. 不同頻率重復脈沖與短陣快速脈沖經顱磁刺激對小鼠記憶功能和神經元興奮性影響的對比分析. 生物醫學工程學雜志, 2024, 41(5): 935-944. doi: 10.7507/1001-5515.202312017 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
經顱磁刺激(transcranial magnetic stimulation,TMS)是Barker等[1]在1985年提出的作為間接、非侵入的神經調控技術,并于2008年經美國食品藥品監督管理局批準,用于治療重度抑郁癥[2]。目前,TMS技術已在疾病診斷及治療中展現出一定潛力。除抑郁癥外,也嘗試將TMS用于治療焦慮癥、阿爾茨海默病、帕金森病、血管性認知障礙、卒中后運動功能損傷等[3-6]。TMS可以誘導大腦活動變化,已成為研究人腦生理和行為關系的有力工具[7]。此外,TMS還可以與腦電圖相結合,評估電磁感應對皮層振蕩的影響[8]。
TMS的治療效果取決于刺激的頻率、脈沖數、強度、時長和潛在的大腦皮層活動狀態[9-12]。其中,刺激頻率被認為是決定刺激后效果的主要因素之一[13]。一般來說,較低頻率(1 ≤ f < 5 Hz)的重復TMS(repetitive TMS,rTMS)會抑制皮層興奮性;而較高頻率(f ≥ 5 Hz,一般在5~25 Hz之間)的rTMS會增加皮質興奮性[13-15]。即,低頻rTMS抑制作用優于促進作用,而高頻rTMS促進作用優于抑制作用[7]。但也有研究者在rTMS對皮質脊髓興奮性影響的研究中發現,10 Hz組在該研究的全部療程中均未發現明顯變化[16]。θ短陣快速脈沖刺激(theta burst stimulation,TBS)與rTMS相較,能在較低的刺激強度和較短的刺激時間內產生強大而持久的效果[11, 17]。經典的TBS刺激模仿腦電發放的θ和γ節律,由γ頻段3個50 Hz的高頻短陣脈沖耦合5 Hz的θ頻段節律組成,即3個50 Hz的高頻短陣脈沖每200 ms發出一次[12, 14, 18]。短陣快速脈沖TMS(burst TMS,bTMS)是參考TBS模式后更改叢間頻率而來,其中5 Hz的bTMS與標準TBS模式一致。目前,刺激頻率與模式各異導致TMS改善認知功能的效果并不一致,且多從單一角度分析,很少有不同頻率與模式的共同分析報道。基于此,本研究旨在研究不同頻率與模式的TMS對小鼠學習記憶能力及海馬齒狀回(dentate gyrus,DG)顆粒神經元興奮性的影響,以期從神經元興奮性角度理解TMS改善認知功能的機制,為臨床應用提供實驗和理論依據。
1 材料與方法
1.1 實驗設計
本研究對8周齡的昆明小鼠進行隨機分組后,開展為期兩周的刺激和偽刺激(sham)實驗,采用新物體識別和跳臺實驗檢測小鼠學習記憶能力,隨后進行腦片膜片鉗實驗檢測其神經元興奮性,具體實驗流程如圖1所示。
 圖1
實驗流程圖
Figure1.
Experimental flowchart
圖1
實驗流程圖
Figure1.
Experimental flowchart
1.2 實驗動物和分組
本研究所有實驗過程符合實驗動物的使用準則,符合河北省動物實驗開展要求,已通過河北工業大學動物倫理委員會的審批(批文編號:HEBUTacuc2022028)。實驗所用動物購自華阜康生物科技有限公司;將8周齡昆明小鼠隨機分成sham組和6種不同刺激方式的刺激組,共7組,每組6只。
(1)sham組:線圈垂直放置遠離小鼠頭部,小鼠只聽到刺激聲音,不接受TMS;
(2)1 Hz rTMS組:施加頻率為1 Hz的rTMS,共60串脈沖,串持續時間為10 s,串間隔為10 s;
(3)5 Hz rTMS組:施加頻率為5 Hz的rTMS,共20串脈沖,串持續時間為6 s,串間隔為10 s;
(4)10 Hz rTMS組:施加頻率為10 Hz的rTMS,共20串脈沖,串持續時間為3 s,串間隔為10 s;
(5)1 Hz bTMS組:施加頻率為1 Hz的bTMS,共20串脈沖,串持續時間為10 s,串間隔為10 s,串內脈沖均由3個50 Hz短陣快速脈沖組成;
(6)5 Hz bTMS組:施加頻率為5 Hz的bTMS,共20串脈沖,串持續時間為2 s,串間隔為10 s,串內脈沖均由3個50 Hz短陣快速脈沖組成;
(7)10 Hz bTMS組:施加頻率為10 Hz的bTMS,共20串脈沖,串持續時間為1 s,串間隔為10 s,串內脈沖均由3個50 Hz短陣快速脈沖組成。
1.3 經顱磁刺激
TMS設備采用重復脈沖磁刺激儀Rapid2(Magstim,英國),線圈采用標準八字形線圈D70 P/N9925-00(Magstim,英國),線圈輸出的最大磁場強度為2.2 T。刺激組的刺激強度為15%線圈輸出最大強度(約為0.3 T),每天進行600個脈沖刺激,連續進行14 d,刺激模式分別為rTMS和bTMS,頻率分別為1、5、10 Hz。TMS方案如附圖1所示。
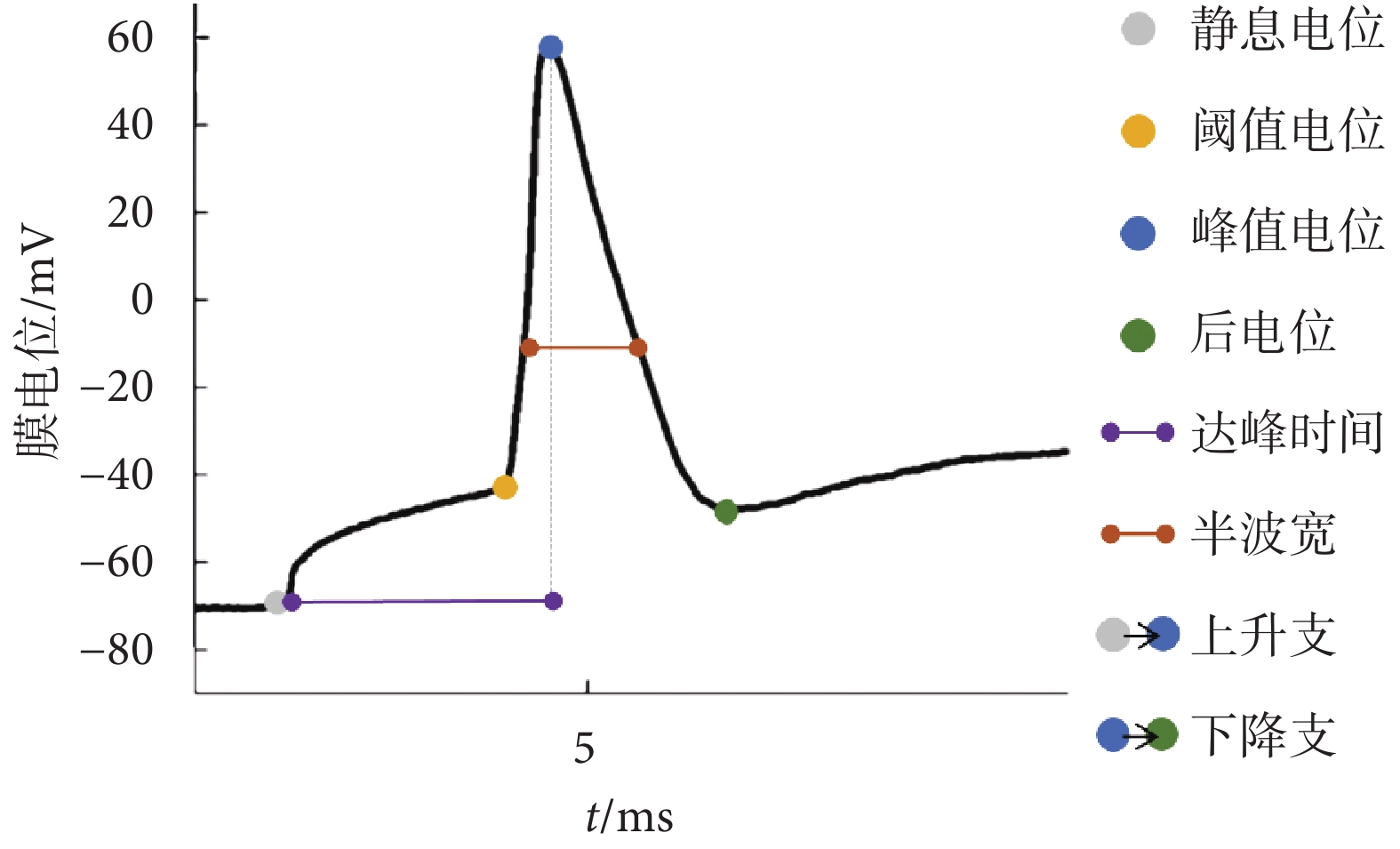
1.4 新物體識別實驗
新物體識別實驗共分為四個階段,分別是空箱適應期、物體熟悉期、測試Ⅰ期以及測試Ⅱ期;實驗流程如附圖2所示。在測試I期與測試II期錄制視頻用于分析,小鼠鼻尖觸碰物體視為對物體的探索行為,分析小鼠在測試Ⅰ、Ⅱ期的認知指數來評估小鼠的空間學習記憶能力,認知指數由探索新物體時間除以探索新舊物體總時間計算所得。
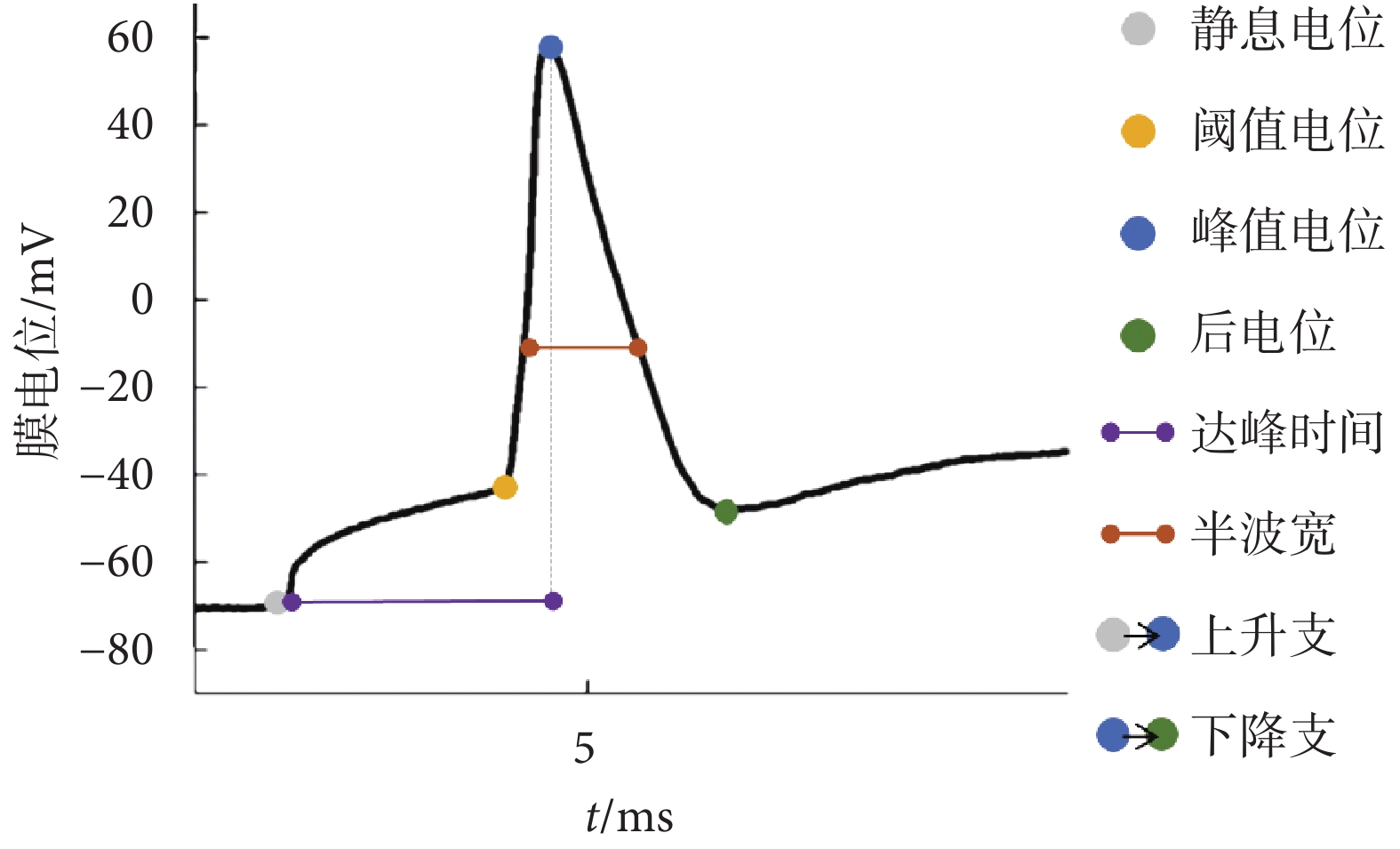 圖2
動作電位示意圖
Figure2.
Schematic diagram of the action potential
圖2
動作電位示意圖
Figure2.
Schematic diagram of the action potential
1.5 跳臺實驗
跳臺實驗共分為四個階段,分別是適應期、適應測試期、電刺激期以及被動逃避期;整個實驗過程中,箱體內均有燈光光照;且在電刺激期以及被動逃避期,對跳臺底部柵極施加幅值為28 V的電壓;實驗流程如附圖3所示。適應測試期,小鼠首次跳下臺子的時間記為適應潛伏期;電刺激期,從小鼠受到電擊跳上臺子開始計時,小鼠跳下跳臺的次數記為錯誤次數;被動逃避期,小鼠首次跳下臺子的時間記為逃避潛伏期,小鼠跳下的次數記為錯誤次數。
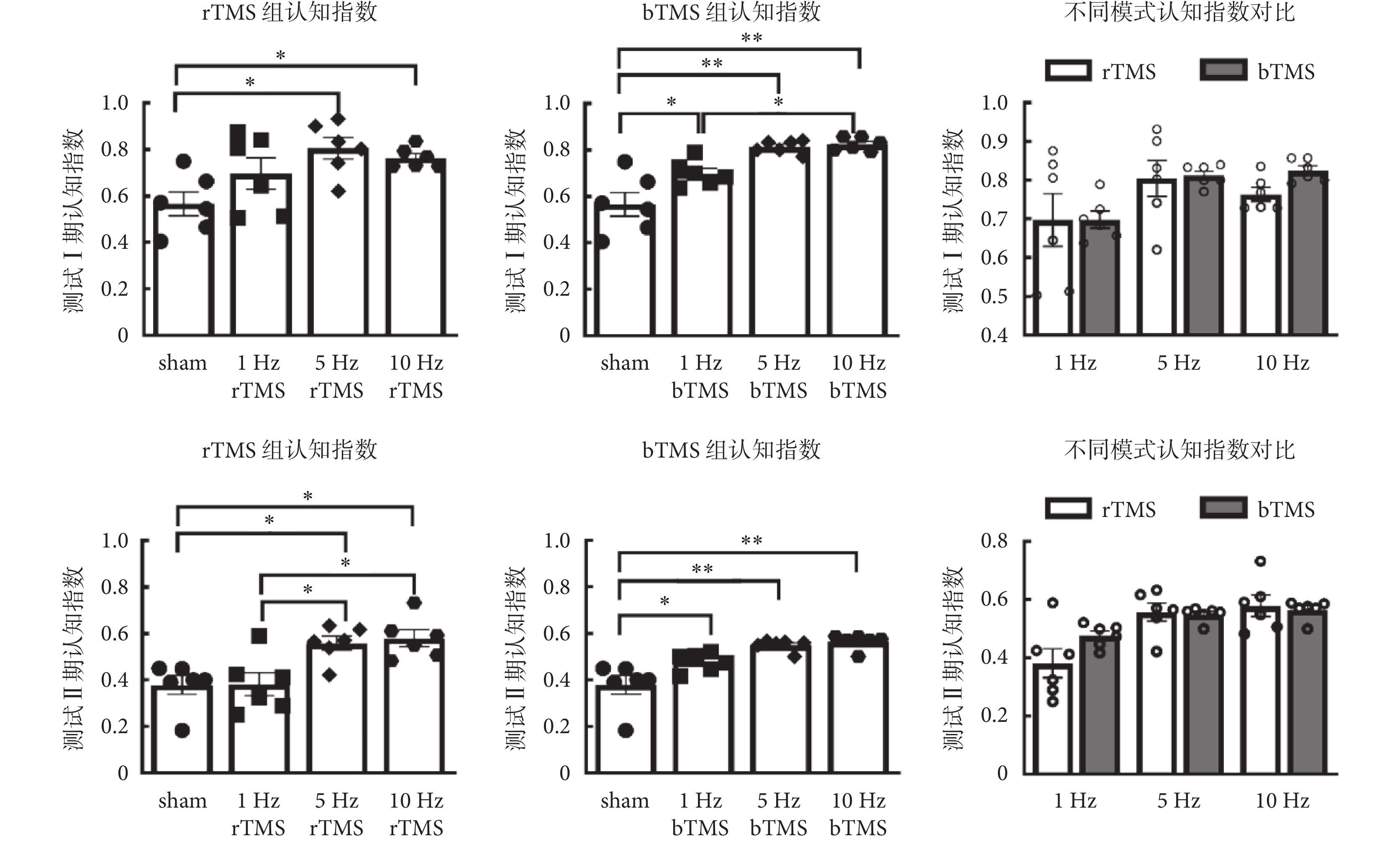 圖3
新物體識別認知指數
圖3
新物體識別認知指數
*
*
1.6 急性海馬腦片制備
小鼠在麻醉狀態下快速斷頭取腦,并將小鼠腦組織置于冰水混合且氧飽和的切片液中。使用振動切片機在大腦冠狀平面上切取7~8片含有海馬腦區的300 μm厚度的腦片。將腦片置于裝有30 °C且氧飽和的人工腦脊液中,孵育1 h備用。溶液成分參考文獻[19]所述,如附表1所示。
1.7 腦片膜片鉗實驗
采用全細胞記錄模式,選取海馬DG區顆粒細胞為目標細胞,目標細胞與充灌有電極內液的玻璃微電極形成高阻封接,細胞抽吸破膜后記錄10 s內的電位值記為細胞的靜息膜電位。選取靜息膜電位在?70 mV左右的細胞,記錄細胞在100、150、200 pA電流鉗制下,500 ms內所誘發的動作電位個數,進行動作電位誘發頻率分析。記錄細胞在150 pA電流鉗制下所誘發的單個動作電位,做動作電位動力學分析;動作電位特征包括閾值電位、閾值電位減后電位、達峰時間(指細胞從靜息電位到達峰值電位的時間)、半波寬,以及上升支和下降支平均斜率,如圖2所示。每只小鼠選取2個細胞信號,所有初始數據在多通道數據采集軟件PatchMaster(HEKA,德國)上記錄。電極內液成分參考文獻[19]所述,如附表1所示。
1.8 數據統計分析
所有數據均以均值 標準誤的形式表示,刺激組與sham組對比采用單因素方差方法進行統計分析,不同模式刺激組之間采用雙因素方差方法進行統計分析,檢驗標準為0.05,事后分析采用圖基多重比較。
標準誤的形式表示,刺激組與sham組對比采用單因素方差方法進行統計分析,不同模式刺激組之間采用雙因素方差方法進行統計分析,檢驗標準為0.05,事后分析采用圖基多重比較。
2 結果
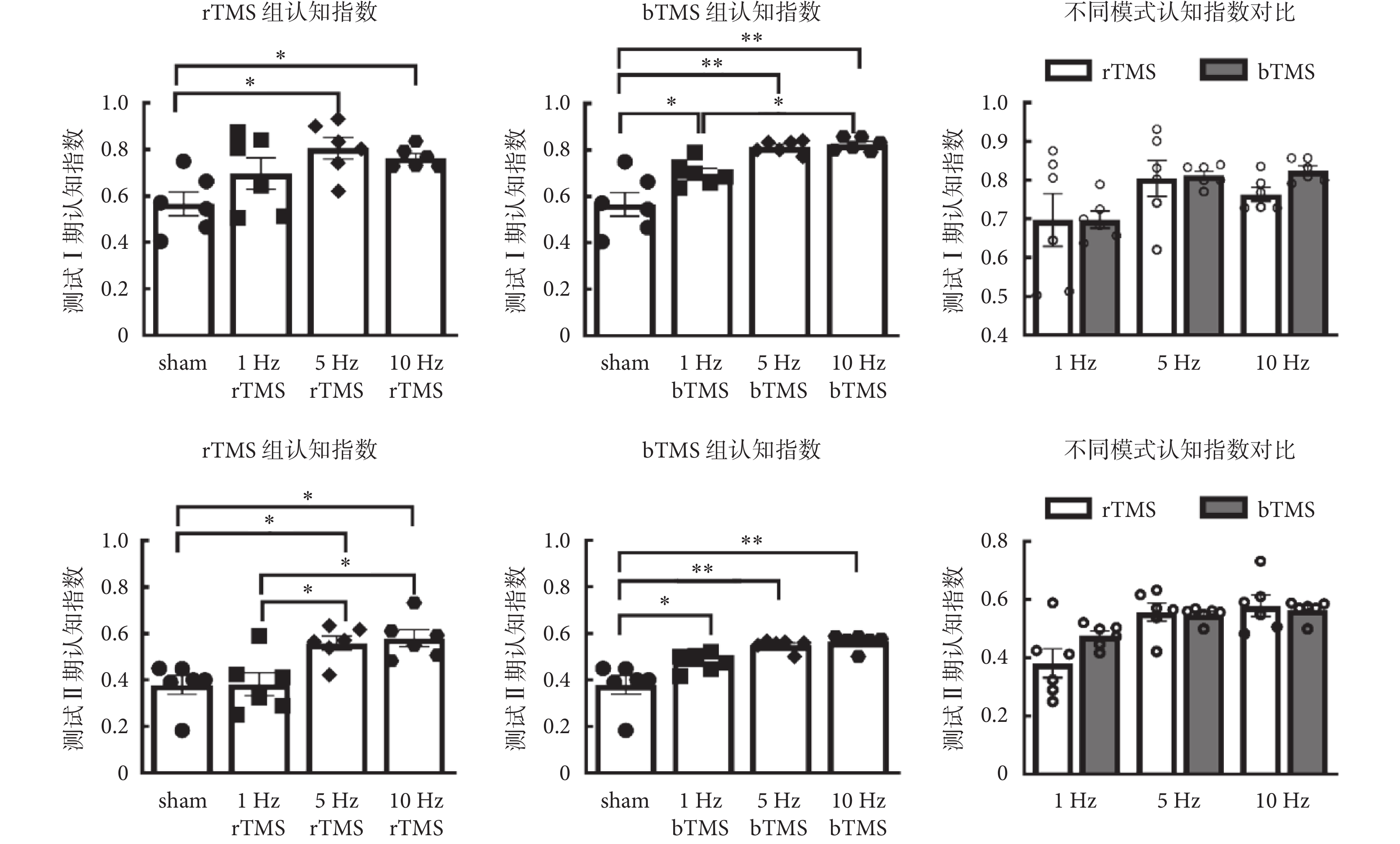
2.1 新物體識別實驗結果
如圖3所示為新物體識別實驗認知指數分析,刺激頻率在測試Ⅰ期認知指數[rTMS:F(3,20) = 4.49,P =
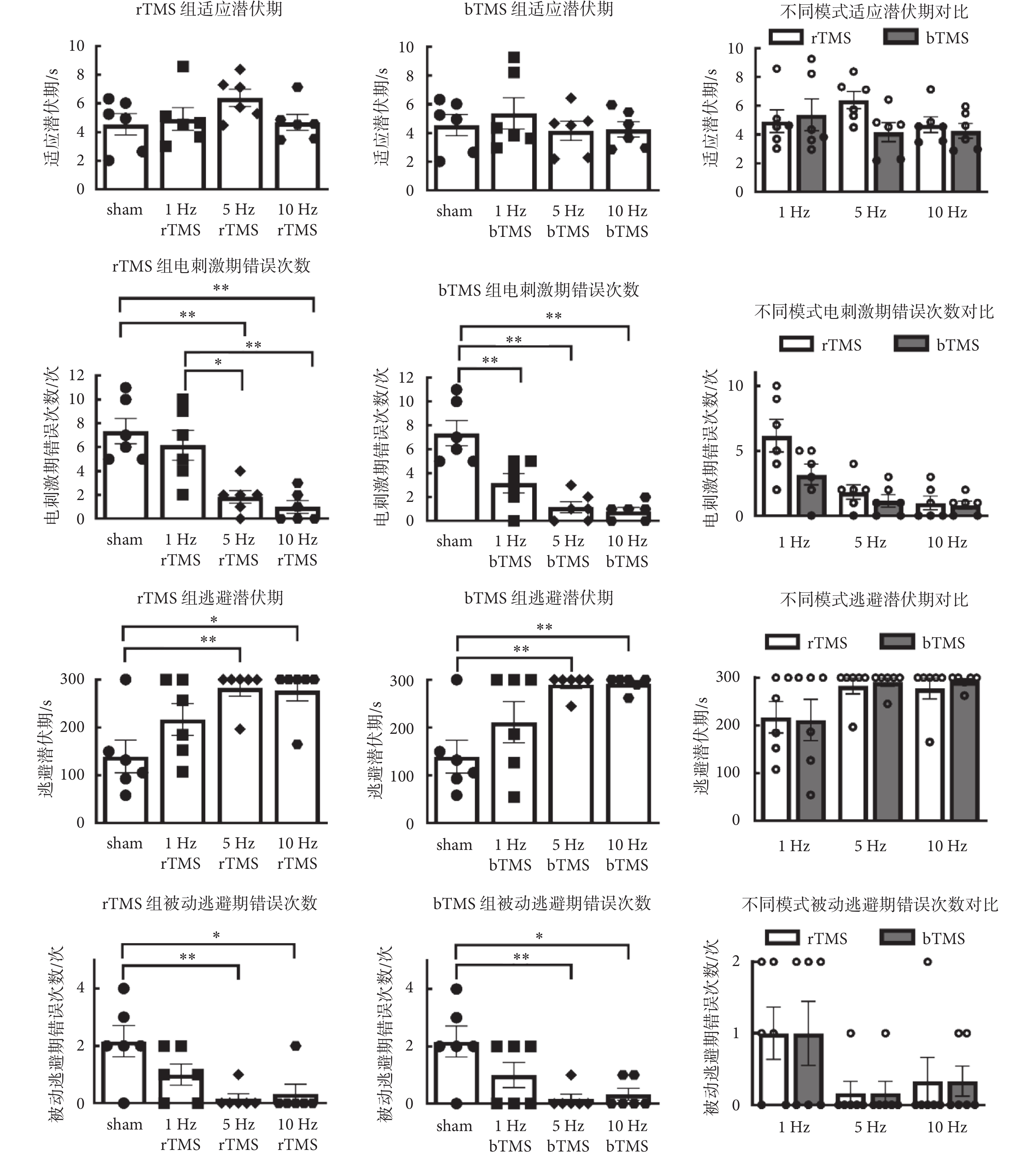
2.2 跳臺實驗結果
如圖4所示為跳臺實驗結果分析,各組小鼠的適應潛伏期差異無統計學意義,雙因素方差分析中,刺激頻率與刺激模式主效應沒有統計學意義。在電刺激期錯誤次數分析中,刺激頻率[rTMS:F(3,20) = 12.15,P < 0.01;bTMS:F(3,20) = 17.34,P < 0.01]主效應有統計學意義,5、10 Hz的rTMS組以及1、5、10 Hz的bTMS組,與sham組的錯誤次數差異有統計學意義;均少于sham組的錯誤次數[(7.3 ± 1.05)次];雙因素方差分析中,刺激頻率[F(2,30) = 15.9,P < 0.01]和刺激模式[F(1,30) = 4.783,P =
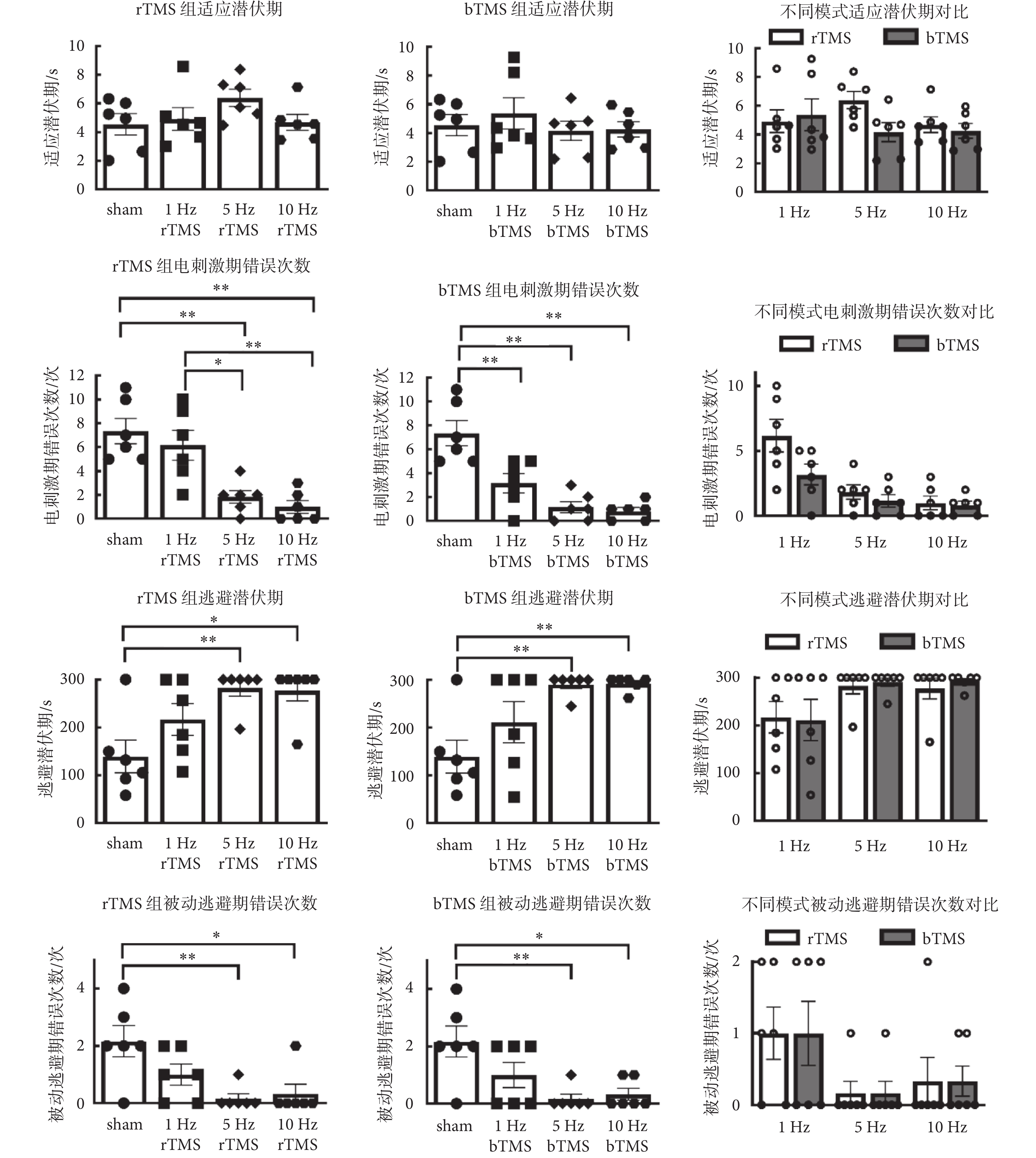 圖4
跳臺實驗結果分析
圖4
跳臺實驗結果分析
*
*
2.3 電生理實驗結果
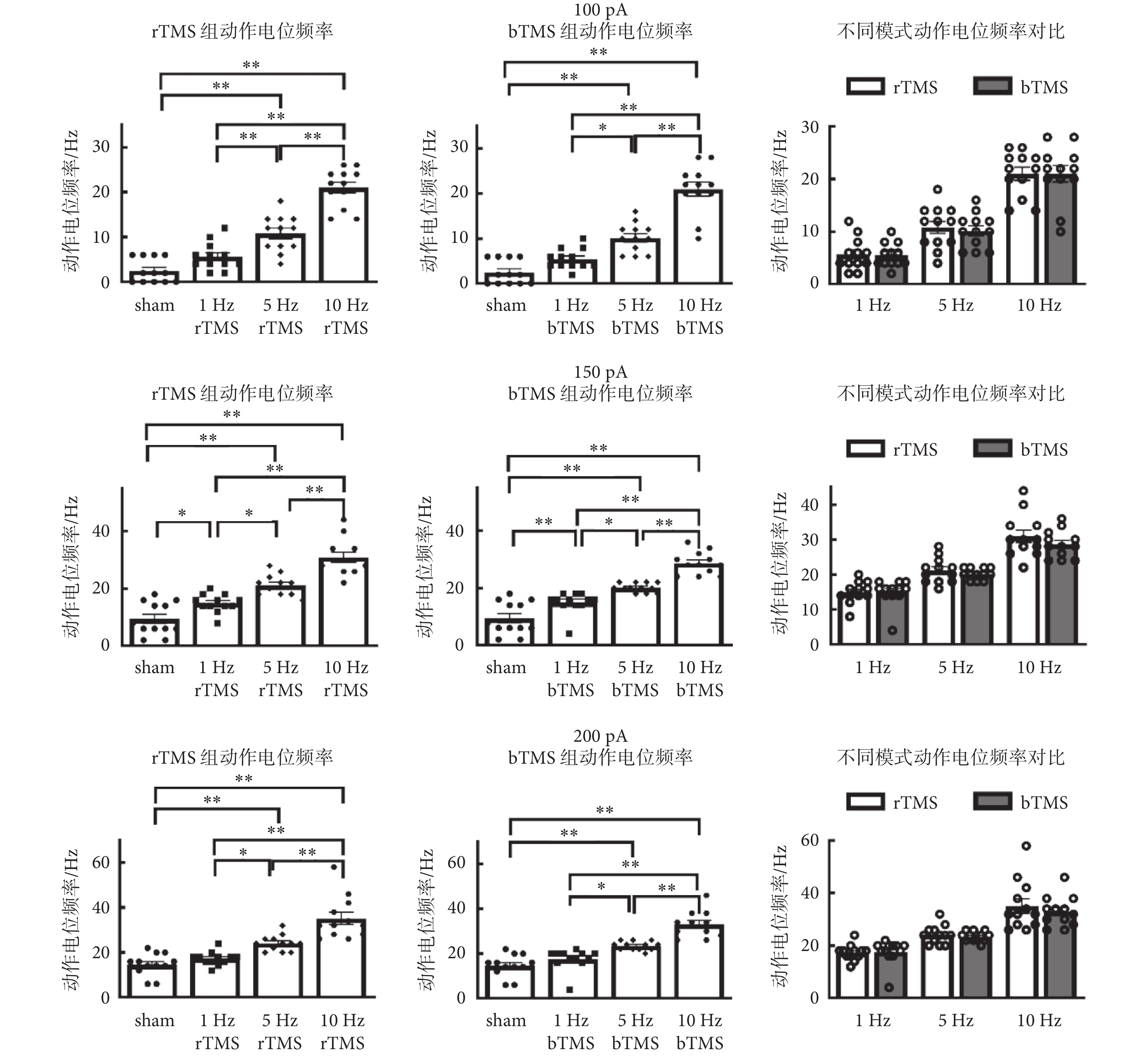
2.3.1 不同電流鉗制下動作電位頻率分析
如圖5所示為神經元動作電位頻率分析,在100 pA[rTMS:F(3,44) = 61.03,P < 0.01;bTMS:F(3,44) = 60.13,P < 0.01]、150 pA[rTMS:F(3,44) = 43.6,P < 0.01;bTMS:F(3,44) = 49.03,P < 0.01]和200 pA[rTMS:F(3,44) = 29.26,P < 0.01;bTMS:F(3,44) = 37.49,P < 0.01]下刺激頻率主效應有統計學意義,5、10 Hz的rTMS組以及5、10 Hz的bTMS組,與sham組的動作電位頻率差異有統計學意義,均高于sham組動作電位頻率[100 pA:(2.5 ± 0.78)Hz;150 pA:(9.5 ± 1.65)Hz;200 pA:(17.7 ± 1.44)Hz]。雙因素方差分析中,刺激頻率[100 pA:F(2,66) = 99.93,P < 0.01;150 pA:F(2,66) = 86.84,P < 0.01;200 pA:F(2,66) = 59.08,P < 0.01]主效應有統計學意義,刺激模式主效應沒有統計學意義,二者不存在交互效應。
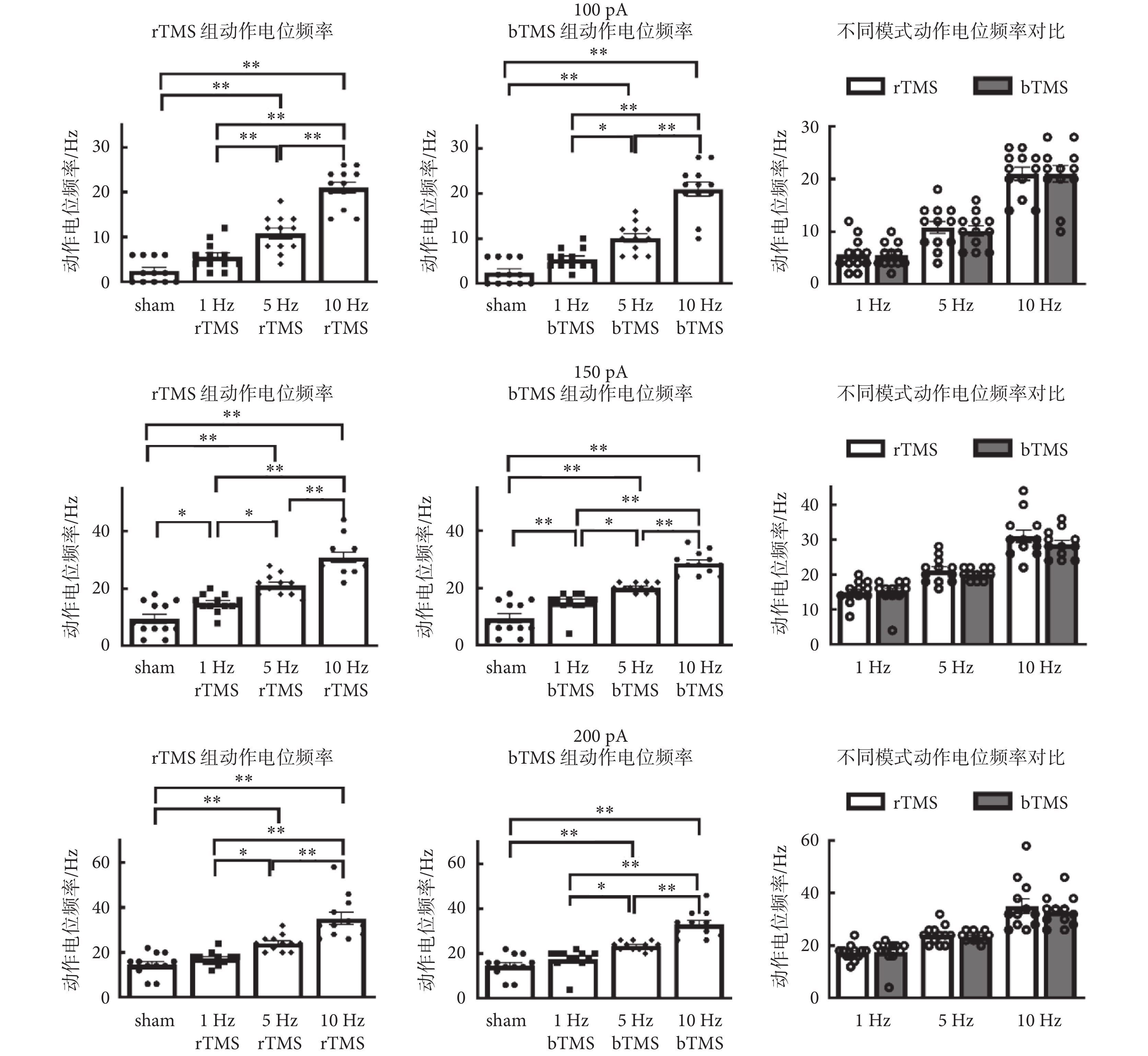 圖5
動作電位頻率分析
圖5
動作電位頻率分析
*
*
2.3.2 動作電位動力學分析
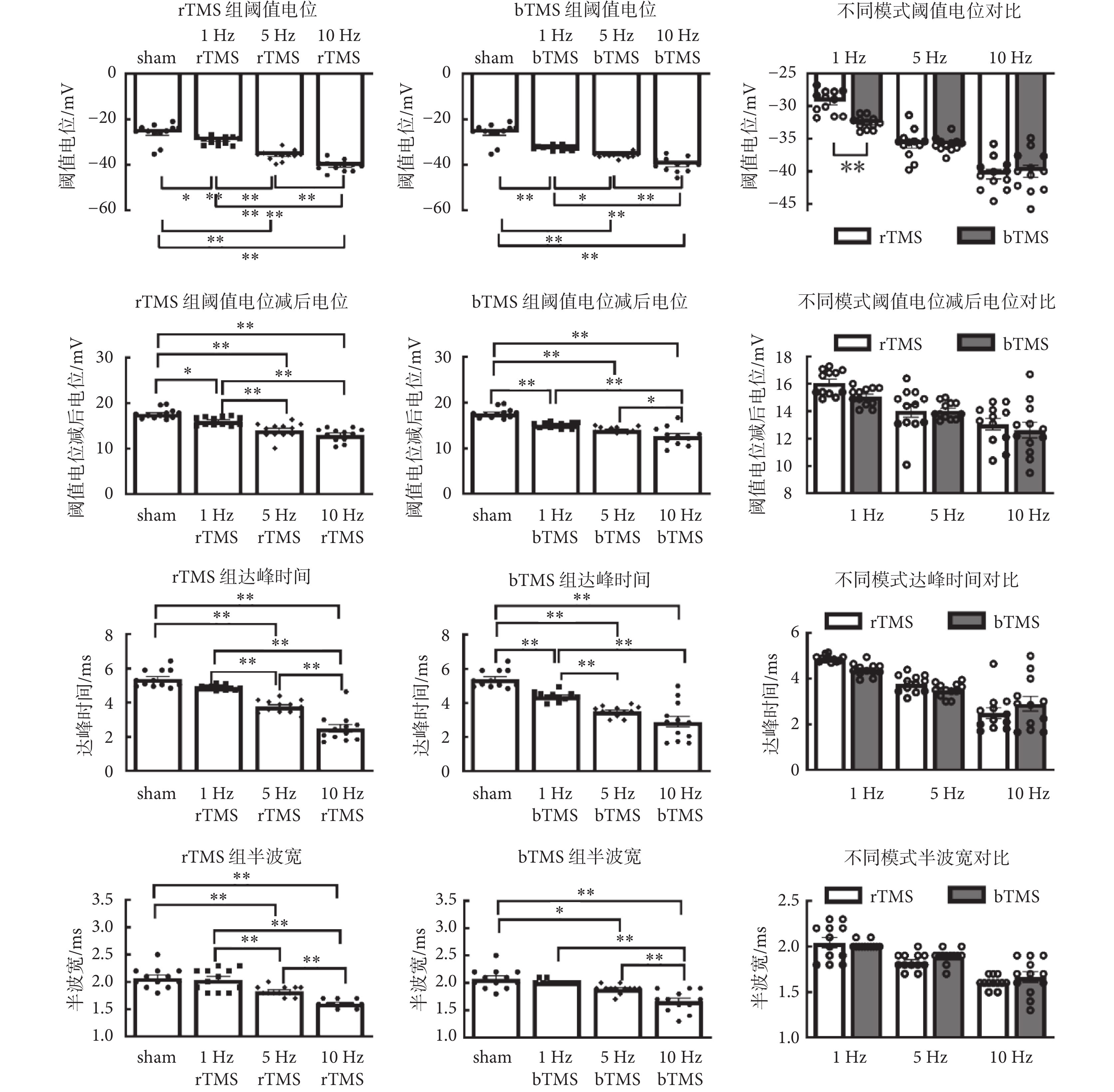
如圖6所示為神經元動作電位特征分析,刺激頻率在動作電位的閾值電位[rTMS:F(3,44) = 64.3,P < 0.01;bTMS:F(3,44) = 56.9,P < 0.01]、閾值電位減后電位[rTMS:F(3,44) = 30.11,P < 0.01;bTMS:F(3,44) = 37.06,P < 0.01]、達峰時間[rTMS:F(3,44) = 73.44,P < 0.01;bTMS:F(3,44) = 33.63,P < 0.01]和半波寬[rTMS:F(3,44) = 25.96,P < 0.01;bTMS:F(3,44) = 19.3,P < 0.01]中主效應有統計學意義,5、10 Hz的rTMS組以及5、10 Hz的bTMS組,與sham組的差異有統計學意義,較sham組閾值電位[(?25.9 ± 1.22)mV]向靜息電位方向移動;較sham組閾值電位減后電位[(17.7 ± 0.32)mV]減小,意味更加接近閾值電位,更利于產生動作電位;較sham組達峰時間[(5.4 ± 0.15) ms]縮短,較sham組半波寬[(2.1 ± 0.05)ms]減小。在雙因素方差分析中,刺激頻率在閾值電位[F(2,66) = 120.3,P < 0.01]、閾值電位減后電位[F(2,66) = 26.14,P < 0.01]、達峰時間[F(2,66) = 60.74,P < 0.01]和半波寬[F(2,66) = 56.8,P < 0.01]主效應有統計學意義,刺激模式主效應沒有統計學意義。刺激頻率與刺激模式僅在閾值電位中存在交互效應[F(2,66) = 5.663,P < 0.01];事后分析表明,1 Hz的bTMS組閾值電位[(?32.6 ± 0.28)mV]較1 Hz的rTMS組閾值電位[(?29.3 ± 0.50)mV]向靜息電位方向移動;其余指標中刺激頻率與刺激模式不存在交互效應。
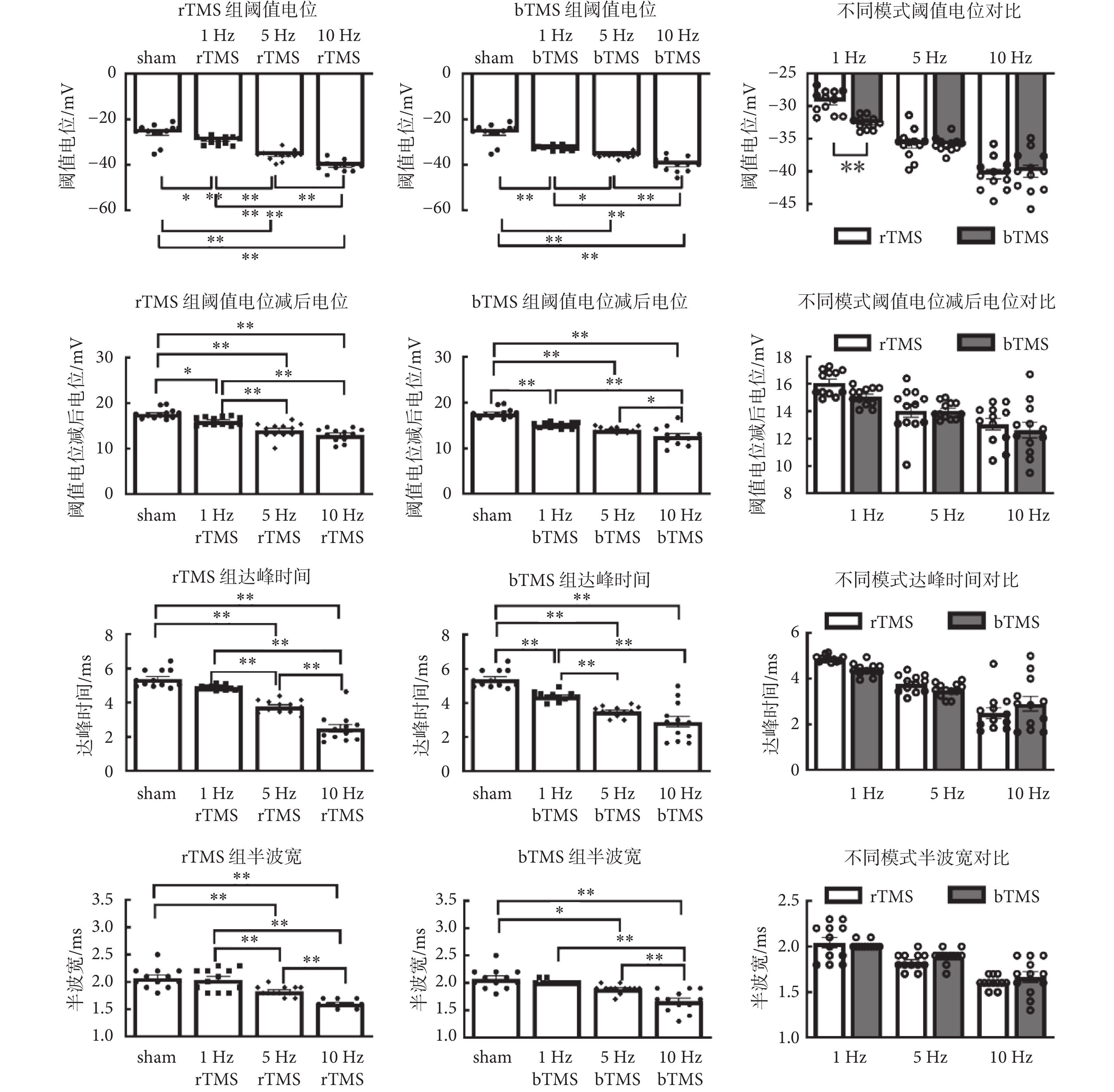 圖6
動作電位特征分析
圖6
動作電位特征分析
*
*
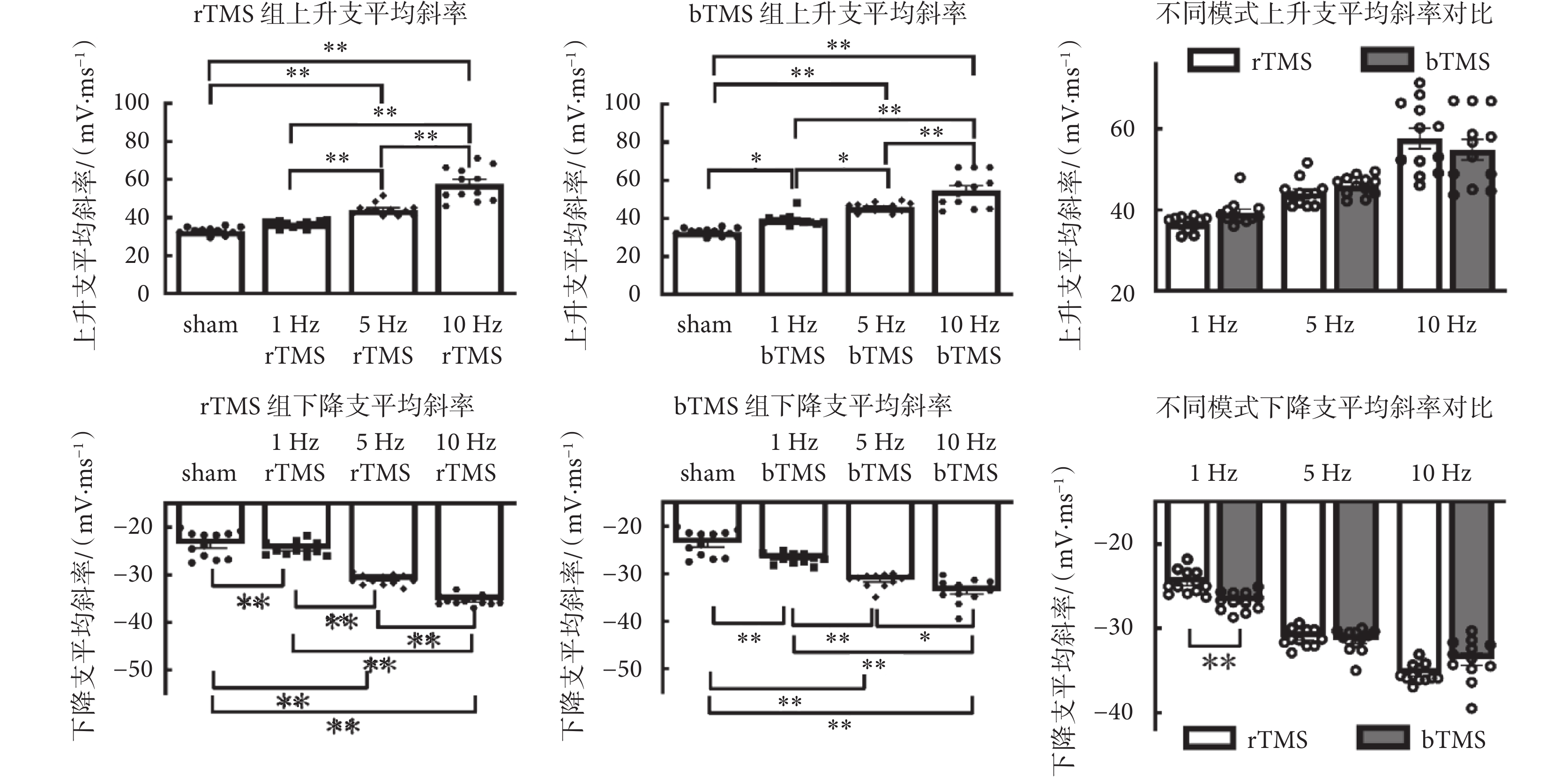
如圖7所示為神經元動作電位斜率分析,刺激頻率在上升支平均斜率[rTMS:F(3,44) = 62.38,P < 0.01;bTMS:F(3,44) = 43.14,P < 0.01]與下降支平均斜率[rTMS:F(3,44) = 130,P < 0.01;bTMS:F(3,44) = 58.56,P < 0.01]中主效應有統計學意義,5、10 Hz的rTMS組以及1、5、10 Hz的bTMS組,與sham組的動作電位上升支平均斜率、下降支平均斜率差異有統計學意義,較sham組上升支平均斜率[(32.9 ± 0.60)mV/ms]與下降支平均斜率[(?23.6 ± 0.78)mV/ms]增加。雙因素方差分析中,刺激頻率在上升支平均斜率[F(2,66) = 67.3,P < 0.01]、下降支平均斜率[F(2,66) = 209.9,P < 0.01]中主效應有統計學意義,刺激模式主效應沒有統計學意義,刺激頻率與刺激模式在下降支平均斜率中存在交互效應[F(2,66) = 10.24,P < 0.01]。事后分析表明,1 Hz的bTMS組下降支平均斜率[(?26.8 ± 0.32)mV/ms]較1 Hz的rTMS組[(?24.6 ± 0.40)mV/ms]增加。
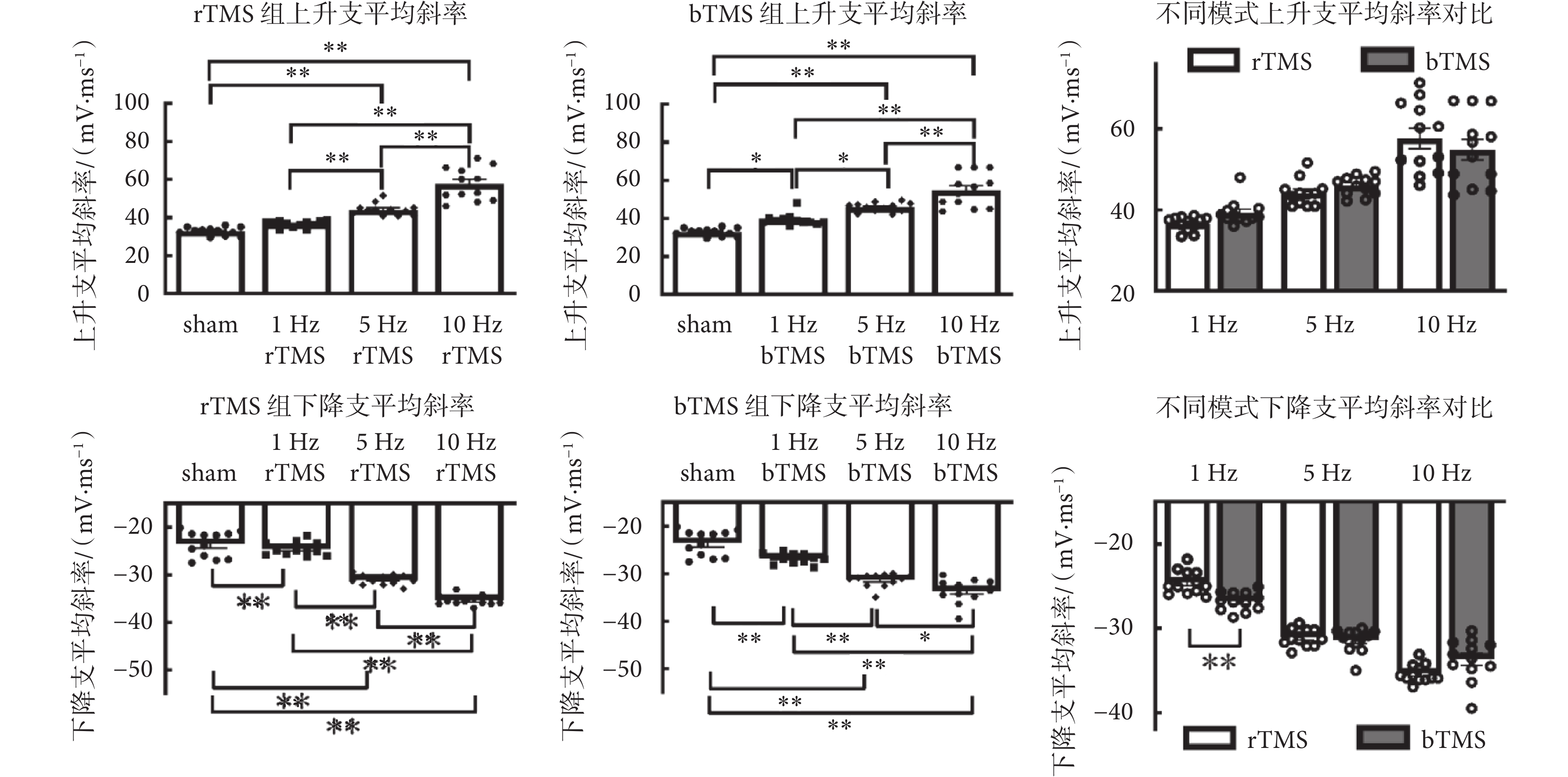 圖7
動作電位斜率分析
圖7
動作電位斜率分析
*
*
3 討論
本文通過新物體識別及跳臺實驗,探究不同頻率和模式的TMS對小鼠記憶功能的影響;并通過腦片膜片鉗實驗采集小鼠海馬DG區顆粒神經元的動作電位,通過分析動作電位誘發頻率、達峰時間、閾值電位、半波寬等相關特征探究TMS影響小鼠記憶功能的神經電生理機制。結果表明,高頻(5、10 Hz)的rTMS與bTMS均可提高小鼠記憶能力和神經元興奮性,提示高頻TMS可通過提高海馬DG區顆粒神經元興奮性來提高小鼠記憶功能。
新物體識別和跳臺實驗是經典的嚙齒類動物學習記憶認知功能實驗。在新物體識別中進行了短期和長期的空間記憶相關任務,結果顯示經高頻(5、10 Hz)的TMS后小鼠空間記憶相關認知能力有所提升。對比同一組別的測試Ⅰ期與測試Ⅱ期的認知指數,測試Ⅰ期認知指數均略高于測試Ⅱ期。已有研究表明,高頻TMS可以修復八齒鼠經睡眠剝奪后在新物體識別任務中認知功能的損傷[20-21];20 Hz高頻rTMS可以修復老年小鼠在老化過程中的認知損傷[19];與本研究結論一致。
跳臺實驗結果表明,在未受電刺激訓練的適應測試期中,各組小鼠適應潛伏期差異無統計學意義,表明無論是低頻還是高頻TMS均未對小鼠固有的運動能力產生明顯影響。電刺激期中的錯誤次數表明,經低頻(1 Hz)的bTMS和高頻(5、10 Hz)的rTMS、bTMS后,小鼠短期被動逃避學習能力有所增加。被動逃避期中的逃避潛伏期和錯誤次數表明,經高頻(5、10 Hz)TMS后,小鼠長期被動逃避學習能力有所增加。對比同一組別的電刺激期與被動逃避期數據,被動逃避期的錯誤次數低于電刺激期。已有研究表明,高頻(20、25 Hz)rTMS可以提高老年小鼠在跳臺實驗被動逃避任務中的表現[19, 22];與本研究結論一致。
海馬體對記憶的形成和提取至關重要[23-24],海馬體內神經元對生理活動、疾病過程及神經毒性等的敏感性已被證實[25]。DG區是海馬中學習記憶與空間編碼的輸入區,其功能之一是對傳入信息進行預處理[26-27]。DG區顆粒細胞接受來自內嗅皮層的興奮性神經元輸入,并通過苔蘚纖維將興奮性輸出發送到海馬角3區;顆粒細胞還會參與記憶的維護,是海馬實現記憶所必需的[24, 28]。細胞動作電位誘發頻率通常表征細胞的興奮性,頻率越高表明細胞越易興奮,對比行為學和細胞誘發動作電位頻率可得,小鼠經不同頻率TMS,其學習記憶能力與動作電位頻率呈現同相變化趨勢,猜測TMS是通過影響海馬DG區顆粒神經元興奮性來影響小鼠學習記憶能力。神經元興奮性依賴于閾值電位[29],動作電位特征分析表明,經過高頻TMS后,閾值電位向靜息電位方向靠近,表征了該神經元更易興奮;閾值電位減后電位的減小表征了在超極化狀態下,細胞更易恢復到可興奮的狀態;這二者變化表明,經高頻TMS后給予相對低的電流刺激就可以誘發神經元的放電,表現為神經元興奮性的提高。達峰時間的減少與上升支平均斜率的增加表征膜電位去極化過程的速率增加;下降支平均斜率的增加表征膜電位復極化速率的增加;這些變化與半波寬的減少呈現一致性;均表征了經高頻TMS后細胞興奮性的增加,與各組動作電位頻率的增加呈現出高度的一致性。本研究結果顯示,經高頻(5、10 Hz)TMS后,小鼠海馬DG區顆粒神經元興奮性提高,此結果與已報道的研究結論一致[30-31]。
關于不同刺激模式之間的對比分析,本研究結果表明,在同一刺激頻率下,眾多結果分析中,只有閾值電位和動作電位下降支平均斜率在1 Hz時,不同刺激模式下的差異有統計學意義。雙因素方差分析表明,除小鼠跳臺實驗適應潛伏期外,頻率因素均表現為主效應有統計學意義;而除小鼠跳臺電刺激期錯誤次數外,模式因素均未表現出主效應有統計學意義。同一頻率下兩種刺激模式結果無顯著變化,其原因可能是各組的刺激脈沖數和刺激天數相同,因此導致bTMS和rTMS兩種刺激對認知功能和神經元興奮性的影響差異不具有統計學意義。在相同刺激頻率和脈沖數下,bTMS組所需刺激時間更短,效率更高。
膜電位的變化與離子通道的開放密切相關,研究發現4周的10 Hz的rTMS可以改善小鼠的抑郁樣行為,并在小鼠額葉區切片電生理中觀測到TMS可使被抑制的大電導鈣激活鉀通道恢復活性[32]。電壓門控鈉離子通道參與大多數海馬電興奮性細胞動作電位的起始與傳播,主要體現在動作電位的上升支。電壓門控鉀離子通道是神經元興奮性的關鍵調節通道,主要體現在動作電位的下降支,同時也與靜息膜電位的維持有關。電壓門控鈣離子通道同樣也與動作電位的產生相關。有研究表明,連續14 d的TMS可以使小鼠海馬角1區神經元動作電位的峰值和上升支最大斜率增加;同時觀測到細胞電壓門控鈉、鈣離子通道幅值的增加及鉀離子通道幅值的降低[33]。有研究表明,20 Hz的rTMS即時作用可增加小鼠急性腦組織切片DG顆粒細胞動作電位的頻率,影響電壓門控鈉、鉀離子通道的變化;鈉通道激活曲線向負電壓方向移動,失活曲線向正電壓方向移動,且恢復速度加快;鉀通道激活曲線和失活曲線向負電壓方向移動,且恢復速度變慢;提示激活鈉通道、抑制鉀通道可能是rTMS增強顆粒細胞興奮性的機制之一[34]。由此推測,TMS對離子通道有重要的調節作用,故不同頻率TMS對離子通道動力學的研究是下一步的重要工作;深入探究TMS對神經調控的生理機制仍是未來電磁神經調控研究的重點。
4 結論
本文研究表明,高頻(5、10 Hz)rTMS與bTMS能提高小鼠記憶能力和神經元興奮性,改變神經元電生理特征;通過調節海馬DG區顆粒神經元興奮性改變小鼠學習記憶行為,可能是TMS改善記憶功能的電生理機制之一。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:付蕊主要負責實驗數據的采集和處理、論文撰寫;朱海軍主要負責實驗指導以及數據分析指導;丁沖和徐桂芝主要負責論文審閱修訂。
倫理聲明:本研究通過了河北工業大學動物倫理委員會的審批(批文編號:HEBUTacuc2022028)。
0 引言
經顱磁刺激(transcranial magnetic stimulation,TMS)是Barker等[1]在1985年提出的作為間接、非侵入的神經調控技術,并于2008年經美國食品藥品監督管理局批準,用于治療重度抑郁癥[2]。目前,TMS技術已在疾病診斷及治療中展現出一定潛力。除抑郁癥外,也嘗試將TMS用于治療焦慮癥、阿爾茨海默病、帕金森病、血管性認知障礙、卒中后運動功能損傷等[3-6]。TMS可以誘導大腦活動變化,已成為研究人腦生理和行為關系的有力工具[7]。此外,TMS還可以與腦電圖相結合,評估電磁感應對皮層振蕩的影響[8]。
TMS的治療效果取決于刺激的頻率、脈沖數、強度、時長和潛在的大腦皮層活動狀態[9-12]。其中,刺激頻率被認為是決定刺激后效果的主要因素之一[13]。一般來說,較低頻率(1 ≤ f < 5 Hz)的重復TMS(repetitive TMS,rTMS)會抑制皮層興奮性;而較高頻率(f ≥ 5 Hz,一般在5~25 Hz之間)的rTMS會增加皮質興奮性[13-15]。即,低頻rTMS抑制作用優于促進作用,而高頻rTMS促進作用優于抑制作用[7]。但也有研究者在rTMS對皮質脊髓興奮性影響的研究中發現,10 Hz組在該研究的全部療程中均未發現明顯變化[16]。θ短陣快速脈沖刺激(theta burst stimulation,TBS)與rTMS相較,能在較低的刺激強度和較短的刺激時間內產生強大而持久的效果[11, 17]。經典的TBS刺激模仿腦電發放的θ和γ節律,由γ頻段3個50 Hz的高頻短陣脈沖耦合5 Hz的θ頻段節律組成,即3個50 Hz的高頻短陣脈沖每200 ms發出一次[12, 14, 18]。短陣快速脈沖TMS(burst TMS,bTMS)是參考TBS模式后更改叢間頻率而來,其中5 Hz的bTMS與標準TBS模式一致。目前,刺激頻率與模式各異導致TMS改善認知功能的效果并不一致,且多從單一角度分析,很少有不同頻率與模式的共同分析報道。基于此,本研究旨在研究不同頻率與模式的TMS對小鼠學習記憶能力及海馬齒狀回(dentate gyrus,DG)顆粒神經元興奮性的影響,以期從神經元興奮性角度理解TMS改善認知功能的機制,為臨床應用提供實驗和理論依據。
1 材料與方法
1.1 實驗設計
本研究對8周齡的昆明小鼠進行隨機分組后,開展為期兩周的刺激和偽刺激(sham)實驗,采用新物體識別和跳臺實驗檢測小鼠學習記憶能力,隨后進行腦片膜片鉗實驗檢測其神經元興奮性,具體實驗流程如圖1所示。
 圖1
實驗流程圖
Figure1.
Experimental flowchart
圖1
實驗流程圖
Figure1.
Experimental flowchart
1.2 實驗動物和分組
本研究所有實驗過程符合實驗動物的使用準則,符合河北省動物實驗開展要求,已通過河北工業大學動物倫理委員會的審批(批文編號:HEBUTacuc2022028)。實驗所用動物購自華阜康生物科技有限公司;將8周齡昆明小鼠隨機分成sham組和6種不同刺激方式的刺激組,共7組,每組6只。
(1)sham組:線圈垂直放置遠離小鼠頭部,小鼠只聽到刺激聲音,不接受TMS;
(2)1 Hz rTMS組:施加頻率為1 Hz的rTMS,共60串脈沖,串持續時間為10 s,串間隔為10 s;
(3)5 Hz rTMS組:施加頻率為5 Hz的rTMS,共20串脈沖,串持續時間為6 s,串間隔為10 s;
(4)10 Hz rTMS組:施加頻率為10 Hz的rTMS,共20串脈沖,串持續時間為3 s,串間隔為10 s;
(5)1 Hz bTMS組:施加頻率為1 Hz的bTMS,共20串脈沖,串持續時間為10 s,串間隔為10 s,串內脈沖均由3個50 Hz短陣快速脈沖組成;
(6)5 Hz bTMS組:施加頻率為5 Hz的bTMS,共20串脈沖,串持續時間為2 s,串間隔為10 s,串內脈沖均由3個50 Hz短陣快速脈沖組成;
(7)10 Hz bTMS組:施加頻率為10 Hz的bTMS,共20串脈沖,串持續時間為1 s,串間隔為10 s,串內脈沖均由3個50 Hz短陣快速脈沖組成。
1.3 經顱磁刺激
TMS設備采用重復脈沖磁刺激儀Rapid2(Magstim,英國),線圈采用標準八字形線圈D70 P/N9925-00(Magstim,英國),線圈輸出的最大磁場強度為2.2 T。刺激組的刺激強度為15%線圈輸出最大強度(約為0.3 T),每天進行600個脈沖刺激,連續進行14 d,刺激模式分別為rTMS和bTMS,頻率分別為1、5、10 Hz。TMS方案如附圖1所示。
1.4 新物體識別實驗
新物體識別實驗共分為四個階段,分別是空箱適應期、物體熟悉期、測試Ⅰ期以及測試Ⅱ期;實驗流程如附圖2所示。在測試I期與測試II期錄制視頻用于分析,小鼠鼻尖觸碰物體視為對物體的探索行為,分析小鼠在測試Ⅰ、Ⅱ期的認知指數來評估小鼠的空間學習記憶能力,認知指數由探索新物體時間除以探索新舊物體總時間計算所得。
 圖2
動作電位示意圖
Figure2.
Schematic diagram of the action potential
圖2
動作電位示意圖
Figure2.
Schematic diagram of the action potential
1.5 跳臺實驗
跳臺實驗共分為四個階段,分別是適應期、適應測試期、電刺激期以及被動逃避期;整個實驗過程中,箱體內均有燈光光照;且在電刺激期以及被動逃避期,對跳臺底部柵極施加幅值為28 V的電壓;實驗流程如附圖3所示。適應測試期,小鼠首次跳下臺子的時間記為適應潛伏期;電刺激期,從小鼠受到電擊跳上臺子開始計時,小鼠跳下跳臺的次數記為錯誤次數;被動逃避期,小鼠首次跳下臺子的時間記為逃避潛伏期,小鼠跳下的次數記為錯誤次數。
 圖3
新物體識別認知指數
圖3
新物體識別認知指數
*
*
1.6 急性海馬腦片制備
小鼠在麻醉狀態下快速斷頭取腦,并將小鼠腦組織置于冰水混合且氧飽和的切片液中。使用振動切片機在大腦冠狀平面上切取7~8片含有海馬腦區的300 μm厚度的腦片。將腦片置于裝有30 °C且氧飽和的人工腦脊液中,孵育1 h備用。溶液成分參考文獻[19]所述,如附表1所示。
1.7 腦片膜片鉗實驗
采用全細胞記錄模式,選取海馬DG區顆粒細胞為目標細胞,目標細胞與充灌有電極內液的玻璃微電極形成高阻封接,細胞抽吸破膜后記錄10 s內的電位值記為細胞的靜息膜電位。選取靜息膜電位在?70 mV左右的細胞,記錄細胞在100、150、200 pA電流鉗制下,500 ms內所誘發的動作電位個數,進行動作電位誘發頻率分析。記錄細胞在150 pA電流鉗制下所誘發的單個動作電位,做動作電位動力學分析;動作電位特征包括閾值電位、閾值電位減后電位、達峰時間(指細胞從靜息電位到達峰值電位的時間)、半波寬,以及上升支和下降支平均斜率,如圖2所示。每只小鼠選取2個細胞信號,所有初始數據在多通道數據采集軟件PatchMaster(HEKA,德國)上記錄。電極內液成分參考文獻[19]所述,如附表1所示。
1.8 數據統計分析
所有數據均以均值 標準誤的形式表示,刺激組與sham組對比采用單因素方差方法進行統計分析,不同模式刺激組之間采用雙因素方差方法進行統計分析,檢驗標準為0.05,事后分析采用圖基多重比較。
標準誤的形式表示,刺激組與sham組對比采用單因素方差方法進行統計分析,不同模式刺激組之間采用雙因素方差方法進行統計分析,檢驗標準為0.05,事后分析采用圖基多重比較。
2 結果
2.1 新物體識別實驗結果
如圖3所示為新物體識別實驗認知指數分析,刺激頻率在測試Ⅰ期認知指數[rTMS:F(3,20) = 4.49,P =
2.2 跳臺實驗結果
如圖4所示為跳臺實驗結果分析,各組小鼠的適應潛伏期差異無統計學意義,雙因素方差分析中,刺激頻率與刺激模式主效應沒有統計學意義。在電刺激期錯誤次數分析中,刺激頻率[rTMS:F(3,20) = 12.15,P < 0.01;bTMS:F(3,20) = 17.34,P < 0.01]主效應有統計學意義,5、10 Hz的rTMS組以及1、5、10 Hz的bTMS組,與sham組的錯誤次數差異有統計學意義;均少于sham組的錯誤次數[(7.3 ± 1.05)次];雙因素方差分析中,刺激頻率[F(2,30) = 15.9,P < 0.01]和刺激模式[F(1,30) = 4.783,P =
 圖4
跳臺實驗結果分析
圖4
跳臺實驗結果分析
*
*
2.3 電生理實驗結果
2.3.1 不同電流鉗制下動作電位頻率分析
如圖5所示為神經元動作電位頻率分析,在100 pA[rTMS:F(3,44) = 61.03,P < 0.01;bTMS:F(3,44) = 60.13,P < 0.01]、150 pA[rTMS:F(3,44) = 43.6,P < 0.01;bTMS:F(3,44) = 49.03,P < 0.01]和200 pA[rTMS:F(3,44) = 29.26,P < 0.01;bTMS:F(3,44) = 37.49,P < 0.01]下刺激頻率主效應有統計學意義,5、10 Hz的rTMS組以及5、10 Hz的bTMS組,與sham組的動作電位頻率差異有統計學意義,均高于sham組動作電位頻率[100 pA:(2.5 ± 0.78)Hz;150 pA:(9.5 ± 1.65)Hz;200 pA:(17.7 ± 1.44)Hz]。雙因素方差分析中,刺激頻率[100 pA:F(2,66) = 99.93,P < 0.01;150 pA:F(2,66) = 86.84,P < 0.01;200 pA:F(2,66) = 59.08,P < 0.01]主效應有統計學意義,刺激模式主效應沒有統計學意義,二者不存在交互效應。
 圖5
動作電位頻率分析
圖5
動作電位頻率分析
*
*
2.3.2 動作電位動力學分析
如圖6所示為神經元動作電位特征分析,刺激頻率在動作電位的閾值電位[rTMS:F(3,44) = 64.3,P < 0.01;bTMS:F(3,44) = 56.9,P < 0.01]、閾值電位減后電位[rTMS:F(3,44) = 30.11,P < 0.01;bTMS:F(3,44) = 37.06,P < 0.01]、達峰時間[rTMS:F(3,44) = 73.44,P < 0.01;bTMS:F(3,44) = 33.63,P < 0.01]和半波寬[rTMS:F(3,44) = 25.96,P < 0.01;bTMS:F(3,44) = 19.3,P < 0.01]中主效應有統計學意義,5、10 Hz的rTMS組以及5、10 Hz的bTMS組,與sham組的差異有統計學意義,較sham組閾值電位[(?25.9 ± 1.22)mV]向靜息電位方向移動;較sham組閾值電位減后電位[(17.7 ± 0.32)mV]減小,意味更加接近閾值電位,更利于產生動作電位;較sham組達峰時間[(5.4 ± 0.15) ms]縮短,較sham組半波寬[(2.1 ± 0.05)ms]減小。在雙因素方差分析中,刺激頻率在閾值電位[F(2,66) = 120.3,P < 0.01]、閾值電位減后電位[F(2,66) = 26.14,P < 0.01]、達峰時間[F(2,66) = 60.74,P < 0.01]和半波寬[F(2,66) = 56.8,P < 0.01]主效應有統計學意義,刺激模式主效應沒有統計學意義。刺激頻率與刺激模式僅在閾值電位中存在交互效應[F(2,66) = 5.663,P < 0.01];事后分析表明,1 Hz的bTMS組閾值電位[(?32.6 ± 0.28)mV]較1 Hz的rTMS組閾值電位[(?29.3 ± 0.50)mV]向靜息電位方向移動;其余指標中刺激頻率與刺激模式不存在交互效應。
 圖6
動作電位特征分析
圖6
動作電位特征分析
*
*
如圖7所示為神經元動作電位斜率分析,刺激頻率在上升支平均斜率[rTMS:F(3,44) = 62.38,P < 0.01;bTMS:F(3,44) = 43.14,P < 0.01]與下降支平均斜率[rTMS:F(3,44) = 130,P < 0.01;bTMS:F(3,44) = 58.56,P < 0.01]中主效應有統計學意義,5、10 Hz的rTMS組以及1、5、10 Hz的bTMS組,與sham組的動作電位上升支平均斜率、下降支平均斜率差異有統計學意義,較sham組上升支平均斜率[(32.9 ± 0.60)mV/ms]與下降支平均斜率[(?23.6 ± 0.78)mV/ms]增加。雙因素方差分析中,刺激頻率在上升支平均斜率[F(2,66) = 67.3,P < 0.01]、下降支平均斜率[F(2,66) = 209.9,P < 0.01]中主效應有統計學意義,刺激模式主效應沒有統計學意義,刺激頻率與刺激模式在下降支平均斜率中存在交互效應[F(2,66) = 10.24,P < 0.01]。事后分析表明,1 Hz的bTMS組下降支平均斜率[(?26.8 ± 0.32)mV/ms]較1 Hz的rTMS組[(?24.6 ± 0.40)mV/ms]增加。
 圖7
動作電位斜率分析
圖7
動作電位斜率分析
*
*
3 討論
本文通過新物體識別及跳臺實驗,探究不同頻率和模式的TMS對小鼠記憶功能的影響;并通過腦片膜片鉗實驗采集小鼠海馬DG區顆粒神經元的動作電位,通過分析動作電位誘發頻率、達峰時間、閾值電位、半波寬等相關特征探究TMS影響小鼠記憶功能的神經電生理機制。結果表明,高頻(5、10 Hz)的rTMS與bTMS均可提高小鼠記憶能力和神經元興奮性,提示高頻TMS可通過提高海馬DG區顆粒神經元興奮性來提高小鼠記憶功能。
新物體識別和跳臺實驗是經典的嚙齒類動物學習記憶認知功能實驗。在新物體識別中進行了短期和長期的空間記憶相關任務,結果顯示經高頻(5、10 Hz)的TMS后小鼠空間記憶相關認知能力有所提升。對比同一組別的測試Ⅰ期與測試Ⅱ期的認知指數,測試Ⅰ期認知指數均略高于測試Ⅱ期。已有研究表明,高頻TMS可以修復八齒鼠經睡眠剝奪后在新物體識別任務中認知功能的損傷[20-21];20 Hz高頻rTMS可以修復老年小鼠在老化過程中的認知損傷[19];與本研究結論一致。
跳臺實驗結果表明,在未受電刺激訓練的適應測試期中,各組小鼠適應潛伏期差異無統計學意義,表明無論是低頻還是高頻TMS均未對小鼠固有的運動能力產生明顯影響。電刺激期中的錯誤次數表明,經低頻(1 Hz)的bTMS和高頻(5、10 Hz)的rTMS、bTMS后,小鼠短期被動逃避學習能力有所增加。被動逃避期中的逃避潛伏期和錯誤次數表明,經高頻(5、10 Hz)TMS后,小鼠長期被動逃避學習能力有所增加。對比同一組別的電刺激期與被動逃避期數據,被動逃避期的錯誤次數低于電刺激期。已有研究表明,高頻(20、25 Hz)rTMS可以提高老年小鼠在跳臺實驗被動逃避任務中的表現[19, 22];與本研究結論一致。
海馬體對記憶的形成和提取至關重要[23-24],海馬體內神經元對生理活動、疾病過程及神經毒性等的敏感性已被證實[25]。DG區是海馬中學習記憶與空間編碼的輸入區,其功能之一是對傳入信息進行預處理[26-27]。DG區顆粒細胞接受來自內嗅皮層的興奮性神經元輸入,并通過苔蘚纖維將興奮性輸出發送到海馬角3區;顆粒細胞還會參與記憶的維護,是海馬實現記憶所必需的[24, 28]。細胞動作電位誘發頻率通常表征細胞的興奮性,頻率越高表明細胞越易興奮,對比行為學和細胞誘發動作電位頻率可得,小鼠經不同頻率TMS,其學習記憶能力與動作電位頻率呈現同相變化趨勢,猜測TMS是通過影響海馬DG區顆粒神經元興奮性來影響小鼠學習記憶能力。神經元興奮性依賴于閾值電位[29],動作電位特征分析表明,經過高頻TMS后,閾值電位向靜息電位方向靠近,表征了該神經元更易興奮;閾值電位減后電位的減小表征了在超極化狀態下,細胞更易恢復到可興奮的狀態;這二者變化表明,經高頻TMS后給予相對低的電流刺激就可以誘發神經元的放電,表現為神經元興奮性的提高。達峰時間的減少與上升支平均斜率的增加表征膜電位去極化過程的速率增加;下降支平均斜率的增加表征膜電位復極化速率的增加;這些變化與半波寬的減少呈現一致性;均表征了經高頻TMS后細胞興奮性的增加,與各組動作電位頻率的增加呈現出高度的一致性。本研究結果顯示,經高頻(5、10 Hz)TMS后,小鼠海馬DG區顆粒神經元興奮性提高,此結果與已報道的研究結論一致[30-31]。
關于不同刺激模式之間的對比分析,本研究結果表明,在同一刺激頻率下,眾多結果分析中,只有閾值電位和動作電位下降支平均斜率在1 Hz時,不同刺激模式下的差異有統計學意義。雙因素方差分析表明,除小鼠跳臺實驗適應潛伏期外,頻率因素均表現為主效應有統計學意義;而除小鼠跳臺電刺激期錯誤次數外,模式因素均未表現出主效應有統計學意義。同一頻率下兩種刺激模式結果無顯著變化,其原因可能是各組的刺激脈沖數和刺激天數相同,因此導致bTMS和rTMS兩種刺激對認知功能和神經元興奮性的影響差異不具有統計學意義。在相同刺激頻率和脈沖數下,bTMS組所需刺激時間更短,效率更高。
膜電位的變化與離子通道的開放密切相關,研究發現4周的10 Hz的rTMS可以改善小鼠的抑郁樣行為,并在小鼠額葉區切片電生理中觀測到TMS可使被抑制的大電導鈣激活鉀通道恢復活性[32]。電壓門控鈉離子通道參與大多數海馬電興奮性細胞動作電位的起始與傳播,主要體現在動作電位的上升支。電壓門控鉀離子通道是神經元興奮性的關鍵調節通道,主要體現在動作電位的下降支,同時也與靜息膜電位的維持有關。電壓門控鈣離子通道同樣也與動作電位的產生相關。有研究表明,連續14 d的TMS可以使小鼠海馬角1區神經元動作電位的峰值和上升支最大斜率增加;同時觀測到細胞電壓門控鈉、鈣離子通道幅值的增加及鉀離子通道幅值的降低[33]。有研究表明,20 Hz的rTMS即時作用可增加小鼠急性腦組織切片DG顆粒細胞動作電位的頻率,影響電壓門控鈉、鉀離子通道的變化;鈉通道激活曲線向負電壓方向移動,失活曲線向正電壓方向移動,且恢復速度加快;鉀通道激活曲線和失活曲線向負電壓方向移動,且恢復速度變慢;提示激活鈉通道、抑制鉀通道可能是rTMS增強顆粒細胞興奮性的機制之一[34]。由此推測,TMS對離子通道有重要的調節作用,故不同頻率TMS對離子通道動力學的研究是下一步的重要工作;深入探究TMS對神經調控的生理機制仍是未來電磁神經調控研究的重點。
4 結論
本文研究表明,高頻(5、10 Hz)rTMS與bTMS能提高小鼠記憶能力和神經元興奮性,改變神經元電生理特征;通過調節海馬DG區顆粒神經元興奮性改變小鼠學習記憶行為,可能是TMS改善記憶功能的電生理機制之一。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:付蕊主要負責實驗數據的采集和處理、論文撰寫;朱海軍主要負責實驗指導以及數據分析指導;丁沖和徐桂芝主要負責論文審閱修訂。
倫理聲明:本研究通過了河北工業大學動物倫理委員會的審批(批文編號:HEBUTacuc2022028)。