經顱直流電刺激(tDCS)是治療精神疾病和神經退行性疾病的重要手段。本文分別通過大鼠腦片染色圖像和磁共振成像(MRI)數據重建了兩個離體腦片模型,并使用有限元計算得出tDCS皮層后大鼠腦區海馬處的電流密度。隨后,通過神經元模型計算這些電流密度下大鼠海馬錐體神經元的響應,比較兩種模型在不同刺激參數下的神經元反應。結果顯示,基于腦片染色圖像的模型中,刺激電壓最小為17 V時可引起海馬錐體神經元的興奮,而基于MRI的模型需24 V。分析表明,基于腦片染色圖像的模型在精細度和電場傳播模擬方面更具優勢,結果更接近真實測量值,可為tDCS參數選擇提供指導,并為精準刺激提供科學依據。
引用本文: 何世紀, 張廣浩, 吳昌哲, 霍小林, 張李君, 張競兮, 張丞. 基于大鼠腦片的經顱直流電刺激參數優化仿真研究. 生物醫學工程學雜志, 2024, 41(5): 945-950. doi: 10.7507/1001-5515.202402007 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
腦部電刺激術是一種重要的神經調控技術,對于精神疾病和神經系統退行性疾病的治療和康復發揮著重要作用。腦部電刺激術包括腦深部電刺激(deep brain stimulation,DBS)、腦皮層電刺激(cerebral cortex stimulation,CCS)、經顱直流電刺激(transcranial direct current stimulation,tDCS)、經顱交流電刺激(transcranial alternating current stimulation,tACS)等[1-4]。相較于DBS和CCS,tDCS與tACS不需要將電極植入人體即可實現對神經的調控,具有無創、安全、成本低等優點。tDCS通過表面電極向頭部注入低強度電流(1~2 mA),以在頭部生成電場和電流密度場的形式影響神經元靜息電位的亞閾值,從而實現對皮質興奮性的調節[5-8]。且,由于頭骨對高頻電流的高阻抗,使得25 Hz以上的刺激大部分被衰減,所以tDCS對組織的刺激相較于tACS更加直接[9]。
目前,tDCS已廣泛應用于臨床實踐。在使用過程中,需要特別關注電極構成、裝配、電流強度、持續時間等刺激參數。其中,電流強度是一個重要參數,選擇合適的電流強度不僅能夠通過刺激特定靶點的神經細胞來調節神經網絡,從而精準作用于病灶,還可以減少對其他無關神經細胞或神經網絡的刺激,降低可能的副作用。但tDCS對人體腦部刺激的具體效果具有顯著的個體差異,即不同刺激方案和受試個體會產生不同的效果,而不當的刺激方式甚至會給受試個體造成損傷[10-15]。因此選擇合適的實驗模型探究tDCS的作用機制,并快速、低風險地篩選刺激方案,對其臨床應用具有重要指導作用。
在動物實驗中,根據對tDCS施加方式的不同分為經顱刺激、顱內刺激、體外組織刺激 [16]。其中,體外組織刺激(如腦切片)的方式廣泛應用于電生理學、藥理學,遺傳學及成像技術研究[17-19]。相較于tDCS 的在體研究,tDCS體外組織的刺激效果不容易受到大腦表面溝回和電極蒙太奇等多種因素的影響,該刺激方式可以對大腦進行精準刺激并提供高分辨率的實驗數據進行后續實驗分析,并為tDCS在體研究提供補充[16, 20-21]。
tDCS方案的研究有很多是基于頭模型的構建和有限元的仿真計算。例如,Saypol等[22]提出了人的3層球形頭模型(頭皮、頭骨和大腦),并計算了tDCS產生的電場分布,但是真實人頭部并不是標準的球形,這導致了計算結果與實際結果的誤差較大。Cerri等[23]使用磁共振成像(magnetic resonance imaging,MRI)圖像重建了真實人頭模型,并根據像元灰度賦予腦內不同組織不同電導率。鐘剛亮等[24]也根據MRI圖像建立了包含頭骨、頭皮、腦脊液、灰質、白質的5層真實頭模型。Nadeem等[25]則使用人體切片重建了包含頭骨、頭皮、腦脊液、灰質、白質、小腦等24種組織結構的頭部模型。除了人頭模型外,也有學者建立體積更小的動物(如大鼠)的頭模型,有簡單的球頭模型也有真實頭模型,如鄭建斌等[26]使用MRI圖像建立肌肉、顱骨、大腦和腦脊液的4層頭模型,杜百川[27]則使用計算機斷層掃描(computed tomography,CT)和冷凍切片建立了頭皮、顱骨、大腦的3層頭模型。但是上述研究都是基于頭模型對不同電極設計或電流強度下的腦內組織的電場宏觀仿真,并沒有考慮這些刺激下神經元的反應,無法更好地對刺激強度的選擇進行指導。
鑒于上述問題,本文使用有限元仿真和神經元模型結合的方式,通過有限元方式計算電流在腦組織中形成的電場,使用神經元模型評估電場中神經元的興奮性;并將神經元是否興奮作為標志,確定腦組織中刺激特定區域引起目標神經元興奮的刺激閾值,從而為tDCS在使用過程中的參數選擇提供實驗基礎。
1 方法
1.1 實驗動物
本實驗所用動物為清潔級成年雌性斯潑累格—多雷(Sprague-Dawley,SD)大鼠[SCXK(京)2020-0004],體重220~250 g,購自北京華阜康生物科技股份有限公司。動物的實驗過程依照《北京市實驗動物管理條例》相關規定進行,經中國科學院電工研究所倫理委員會批準通過(LL202401)。
1.2 基于腦片染色圖像重建大鼠腦片模型
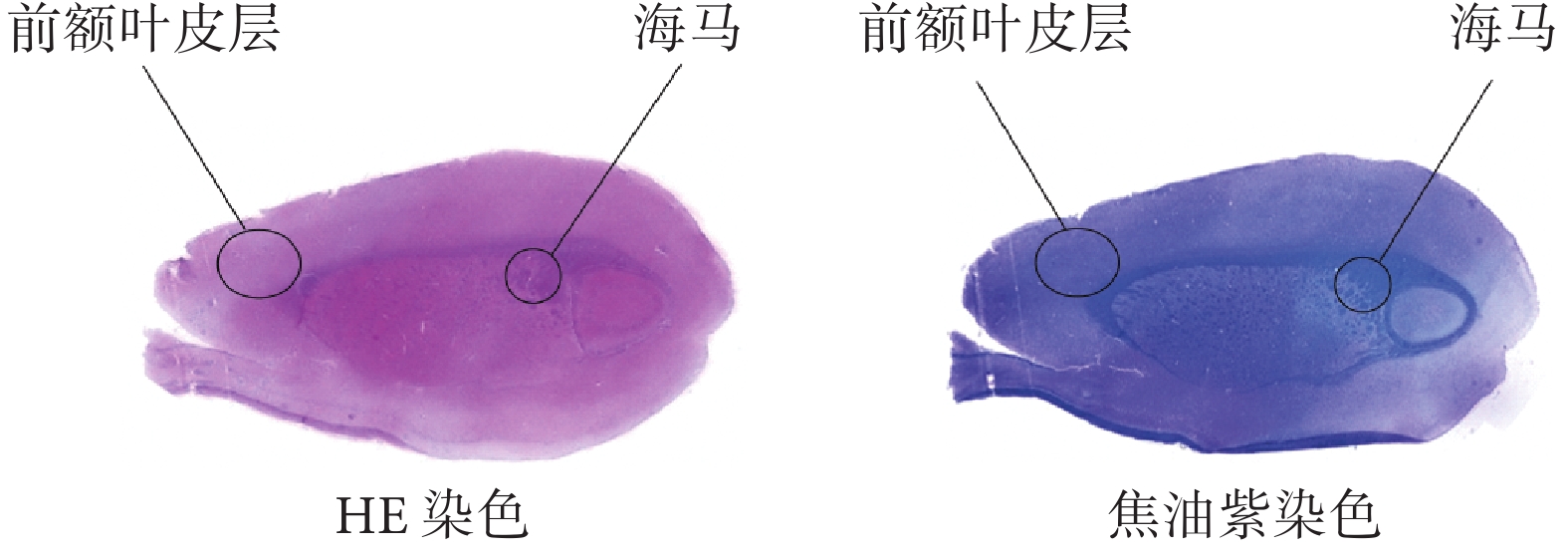
本文首先基于大鼠“前額葉皮層及海馬”聯合切片重建腦片模型。該腦切片的切片深度約為2 280 μm,切片厚度為30 μm。如圖1所示,使用常規方法對切片進行蘇木精—伊紅(hematoxylin-eosin,HE)染色和焦油紫染色可以觀察到腦切片中神經纖維束的走行(深藍色部分)。
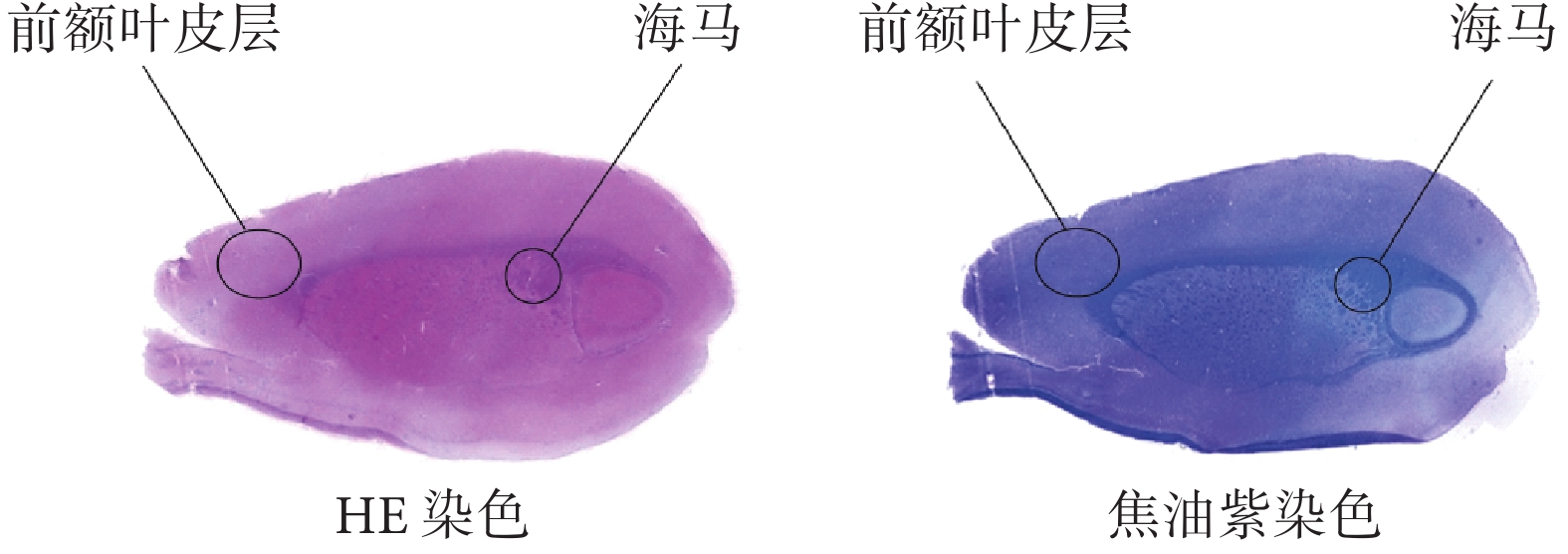 圖1
HE染色和焦油紫染色后的腦切片
Figure1.
Brain sections after HE staining and cresyl violet staining
圖1
HE染色和焦油紫染色后的腦切片
Figure1.
Brain sections after HE staining and cresyl violet staining
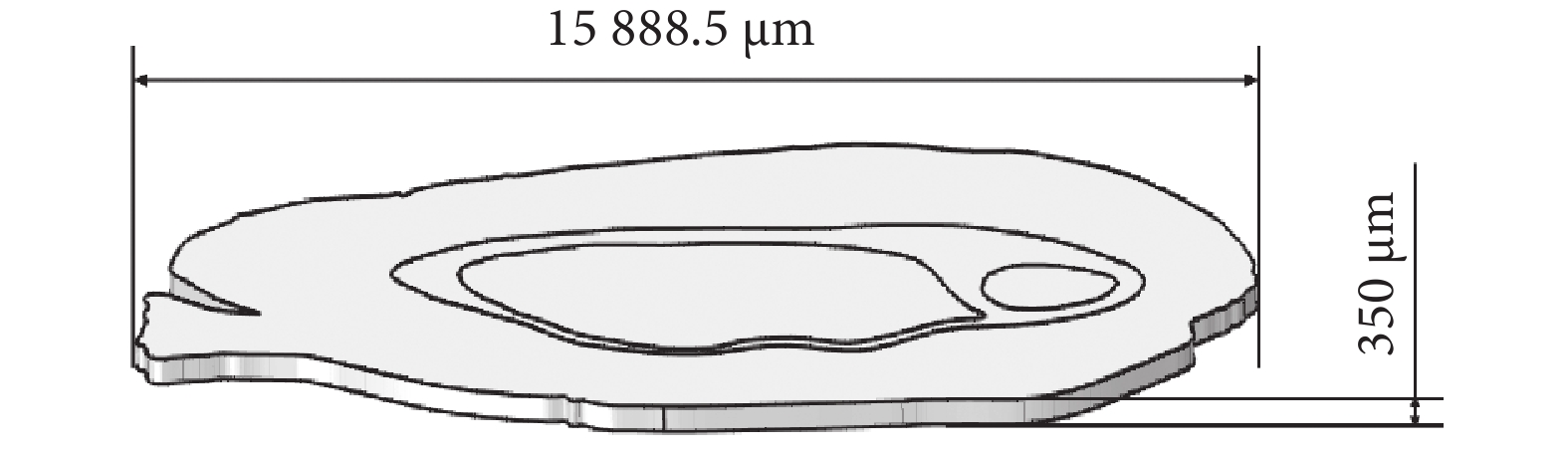
鑒于從腦切片可以直接觀察到神經纖維束(腦白質),本文使用繪畫軟件PaintTool SAI 2(Systemax,日本)對腦片圖像進行預處理,去除腦切片外部輪廓和神經纖維束以外的所有內部結構,僅保留灰質和白質的邊界。使用圖像處理軟件ImageJ 1.54c(National Institutes of Health,美國)獲得的腦切片圖像中腦片的前后方向長度為15 888.5 μm。使用多物理場仿真軟件COMSOL Multiphysics 5.6(COMSOL,瑞典)提供的插件(image to curve)提取預處理后的腦片的輪廓線,并建立如圖2所示的厚度350 μm、前后方向長度為15 888.5 μm的腦切片模型。
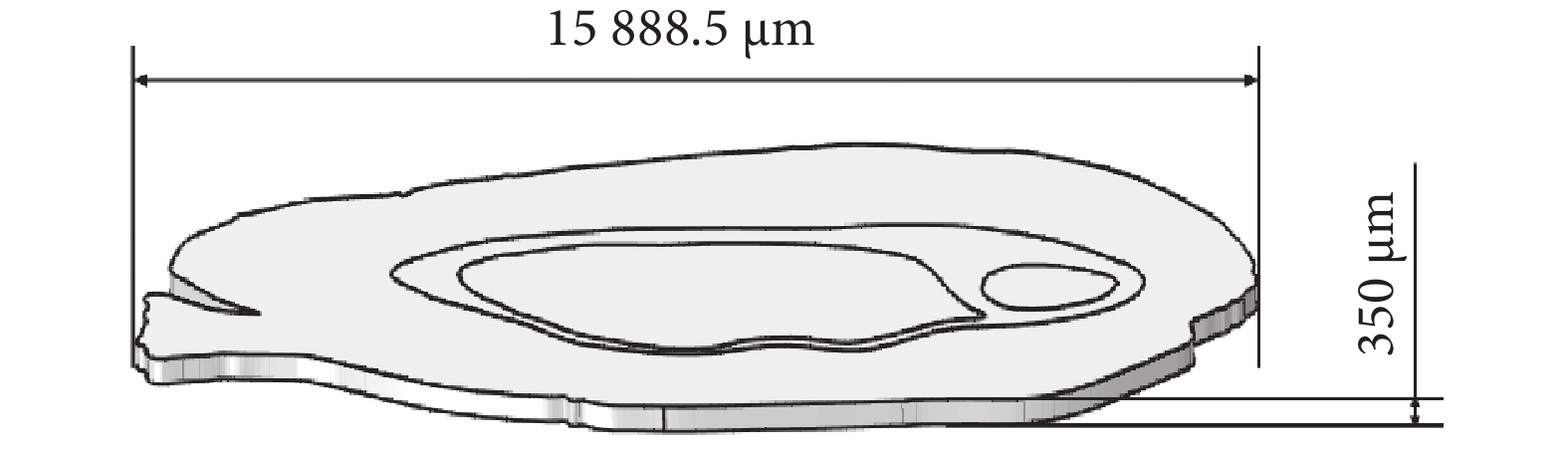 圖2
基于腦片染色圖像重建的大鼠腦片模型
Figure2.
Reconstruction of rat brain slice model based on brain slice staining images
圖2
基于腦片染色圖像重建的大鼠腦片模型
Figure2.
Reconstruction of rat brain slice model based on brain slice staining images
1.3 基于MRI重建大鼠腦片模型
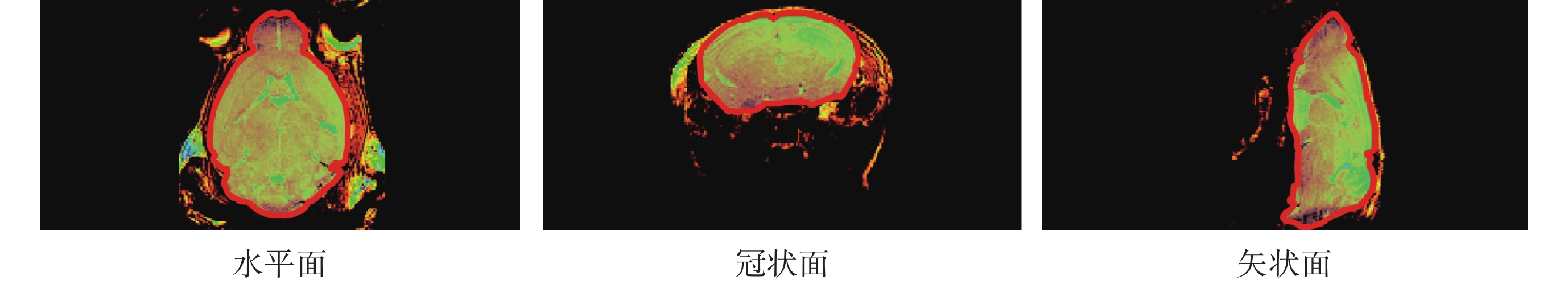
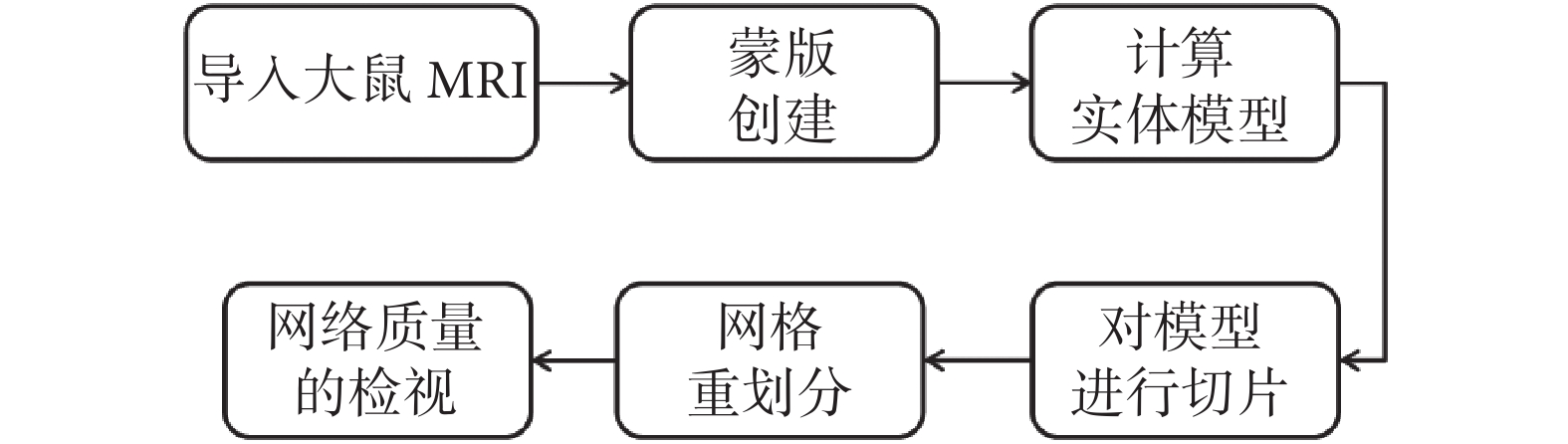
本文隨后采用如圖3所示的MRI T2加權像對腦實質進行重建。使用三維醫學圖像處理軟件MIMICS RESEARCH 21.0(Materialise,比利時)重建大鼠腦片,操作過程如圖4所示。
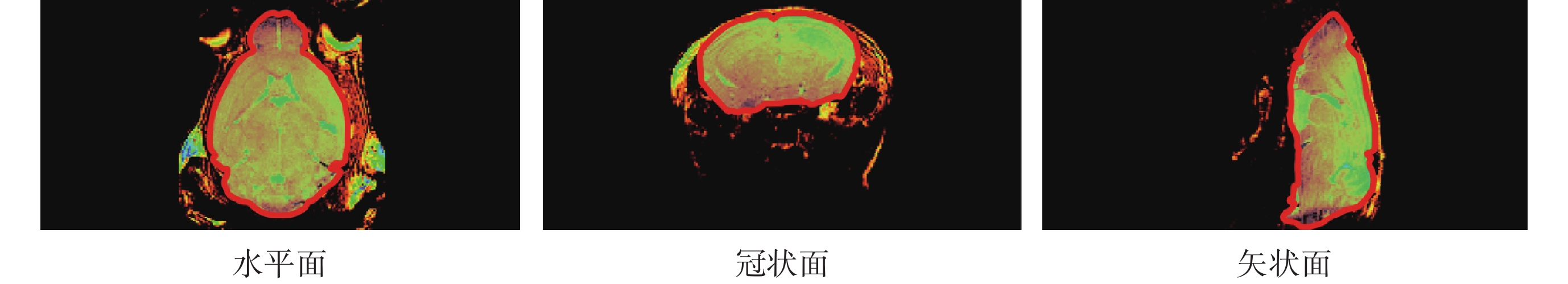 圖3
T2加權圖像
Figure3.
T2-weighted images
圖3
T2加權圖像
Figure3.
T2-weighted images
 圖4
MIMICS重建大鼠腦片模型的過程
Figure4.
Process of MIMICS reconstruction of rat brain slice model
圖4
MIMICS重建大鼠腦片模型的過程
Figure4.
Process of MIMICS reconstruction of rat brain slice model
使用三維醫學圖像處理軟件MIMICS RESEARCH 21.0(Materialise,比利時)對圖像進行灰度值分析,通過閾值分割、區域增長、蒙版編輯、計算實體等操作去除頭皮組織等,創建腦實質模型。然后根據本課題組前期的研究[28],在三維醫學圖像處理軟件中去除嗅球和小腦部分,提取出包含大鼠前額葉皮層及海馬的切片。.
1.4 腦片的tDCS仿真
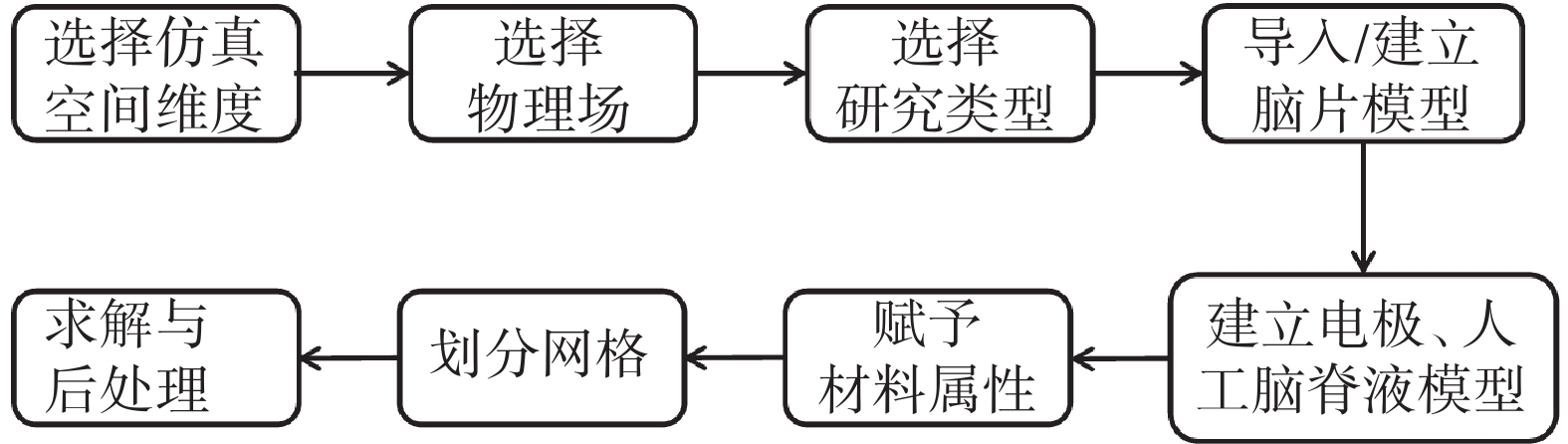
本文采用多物理場仿真軟件COMSOL Multiphysics 5.6(COMSOL,瑞典)進行大鼠腦片tDCS仿真研究。軟件的仿真流程如圖5所示。
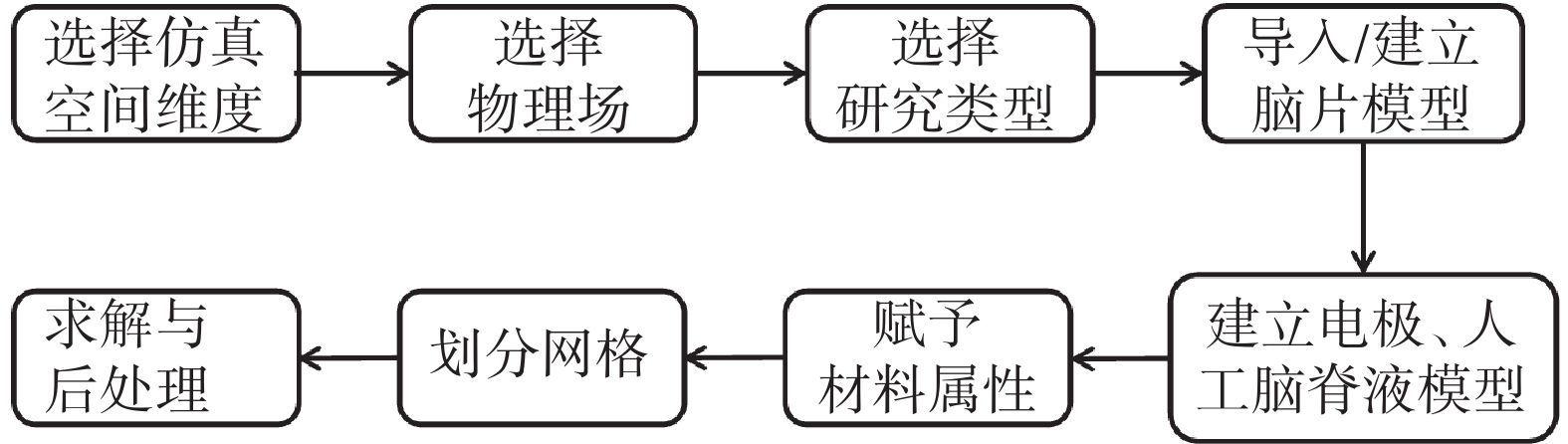 圖5
COMSOL仿真流程
Figure5.
COMSOL simulation process
圖5
COMSOL仿真流程
Figure5.
COMSOL simulation process
根據實際實驗過程中的腦片tDCS環境,在多物理場仿真軟件中建立1個刺激電極和3個檢測電極。參考大鼠的腦圖譜將檢測電極的正極置于海馬附近,負極和地相連并置于腦片檢測槽的一角,刺激電極置于前額葉皮層。所有電極均簡化為直徑為200 μm的球體,球體上半部絕緣,下半部插入腦片。人工腦脊液模型是根據組織切片記錄槽RC-27L(Warner,美國)的形狀,設置為底面為六邊形的柱體,高度為1 mm,底面寬度2 cm,底邊長2.4 cm和4 cm。本研究假設生物組織的電導率是線性、各向同性均勻分布的[29]。大鼠腦組織的電導率參考Datta等[30]提供的人類腦組織數據,電極的電導率從材料性能數據庫(Material Property Data,MatWeb)獲得,具體的電導率賦值如表1所示。
1.5 神經元響應仿真
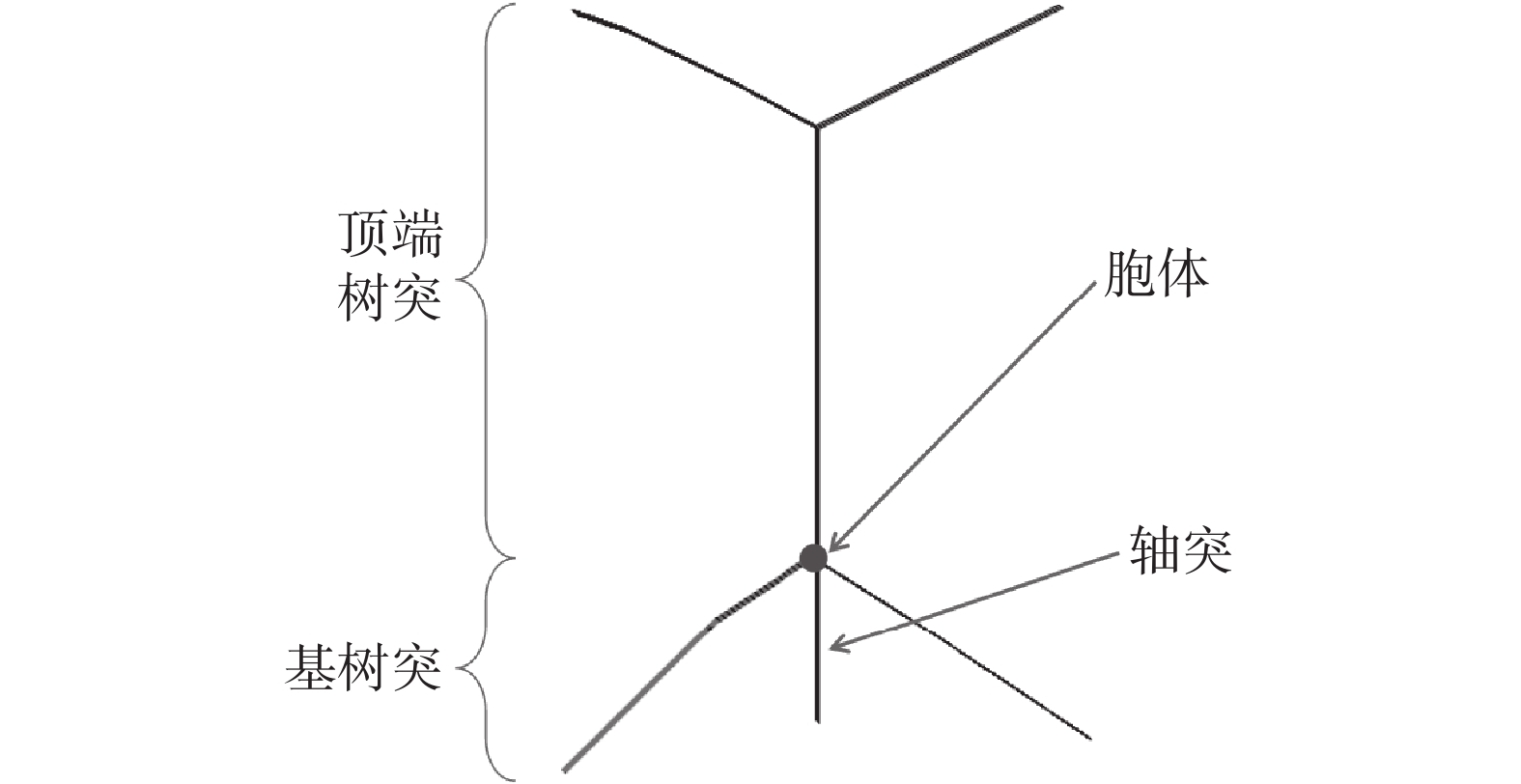
本文使用神經元和網絡模擬軟件NEURON 8.2.0(Yale University,美國)研究電流強度對海馬神經元電活動的影響。本文采用錐體細胞作為被刺激細胞,使用Cutsuridis等[31]提供的海馬錐體神經元模型參數,在NEURON 8.2.0中建立一個如圖6所示的海馬錐體神經元模型。該海馬神經元具有一個長800 μm的尖頂樹突,兩個長300 μm的基樹突,表面積為314 μm2的胞體和一個長150 μm的軸突。胞體的比膜電導為5×10?5 S/cm2,軸向電阻為150 Ω·cm,比膜電容為1 μF/cm2。
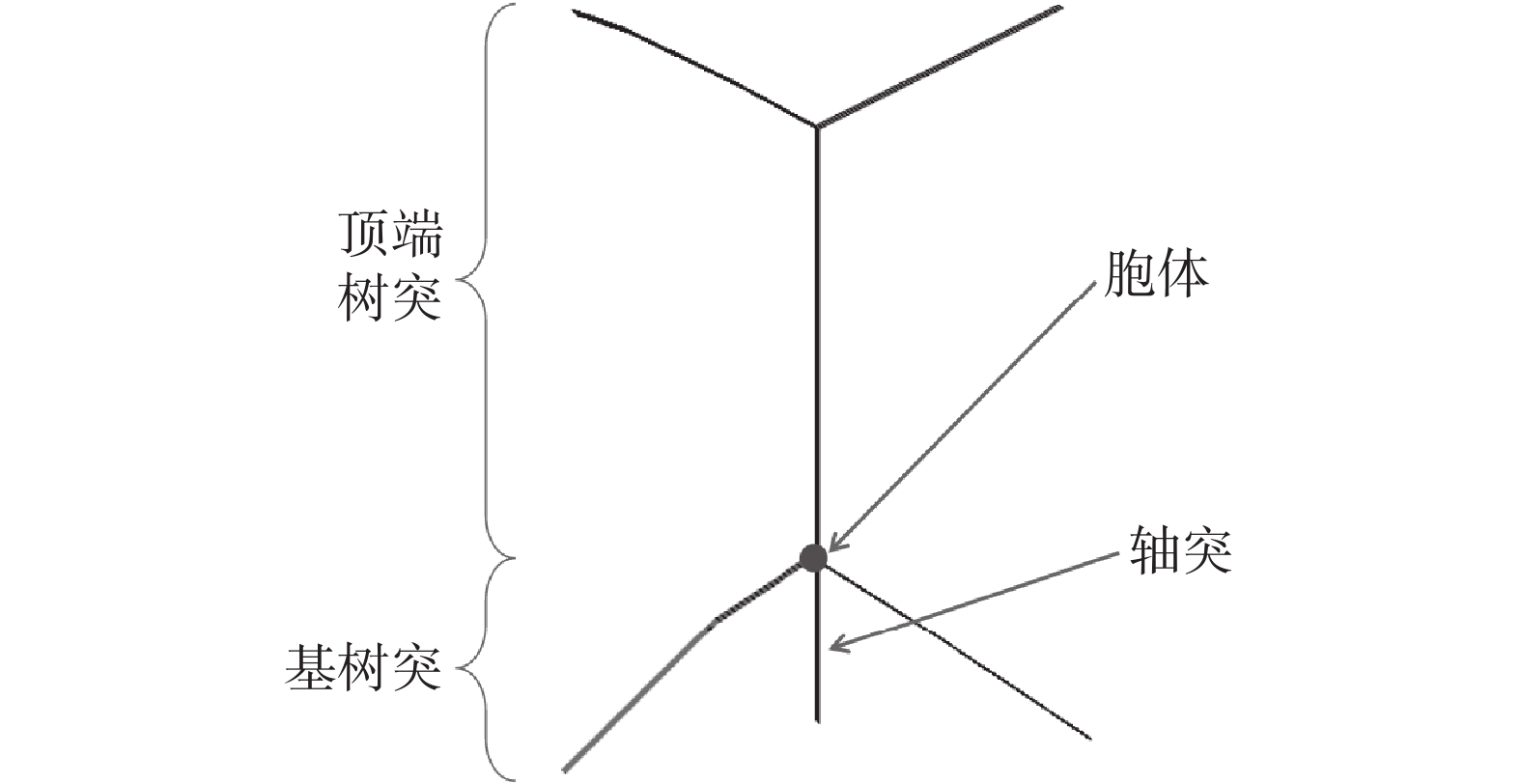 圖6
海馬椎體神經元
Figure6.
Hippocampal pyramidal neurons
圖6
海馬椎體神經元
Figure6.
Hippocampal pyramidal neurons
本文在胞體表面施加一個電流鉗(電流延遲50 ms,持續時間0.1 ms),仿真不同刺激強度下神經元的興奮性,以確定使神經元興奮的最小刺激強度。
2 結果
2.1 腦片電場分布
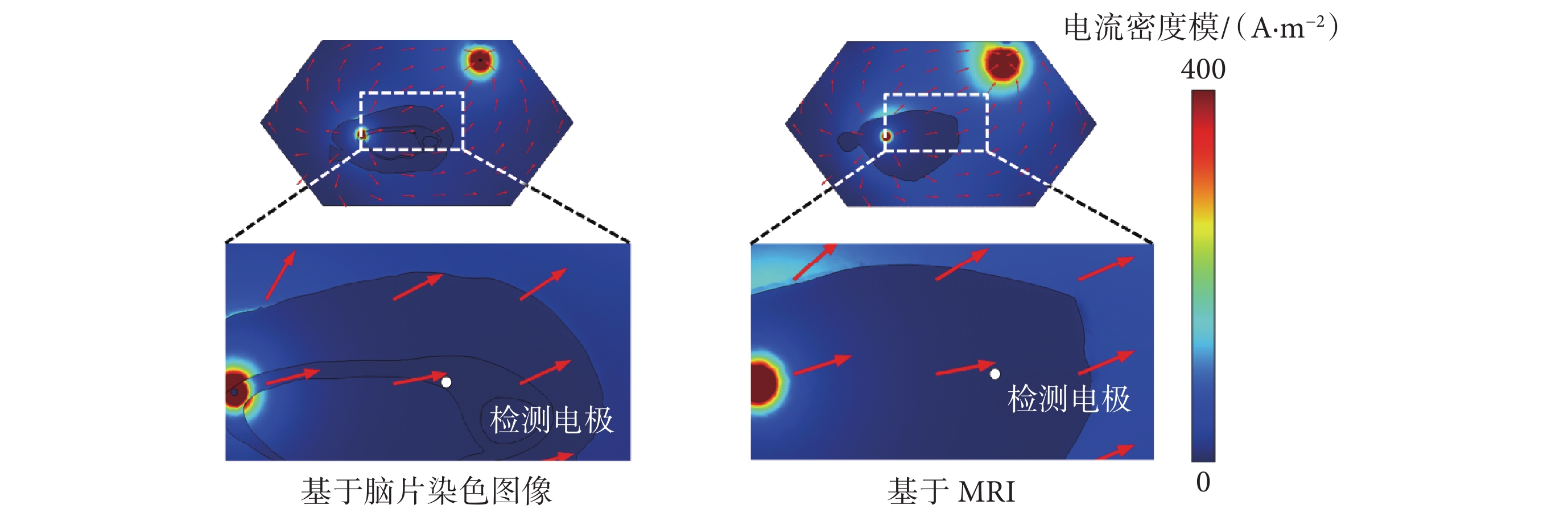
通過仿真得到1V的tDCS作用下海馬附近的檢測電極處的電勢和電流密度,結果如圖7所示。可以觀察到電流在腦片中的傳播方向,以及在灰質、白質和腦脊液這3類介質中的傳播特性。
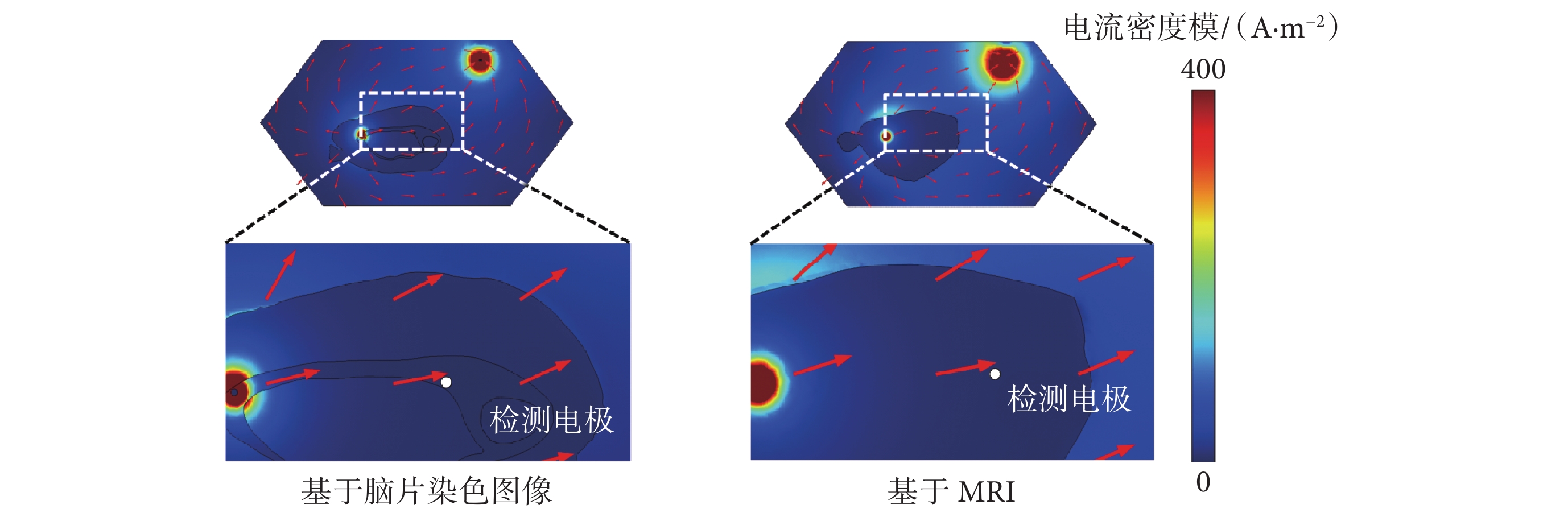 圖7
不同模型中電流場的分布
Figure7.
Distribution of current fields in different models
圖7
不同模型中電流場的分布
Figure7.
Distribution of current fields in different models
2.2 神經元興奮性特性
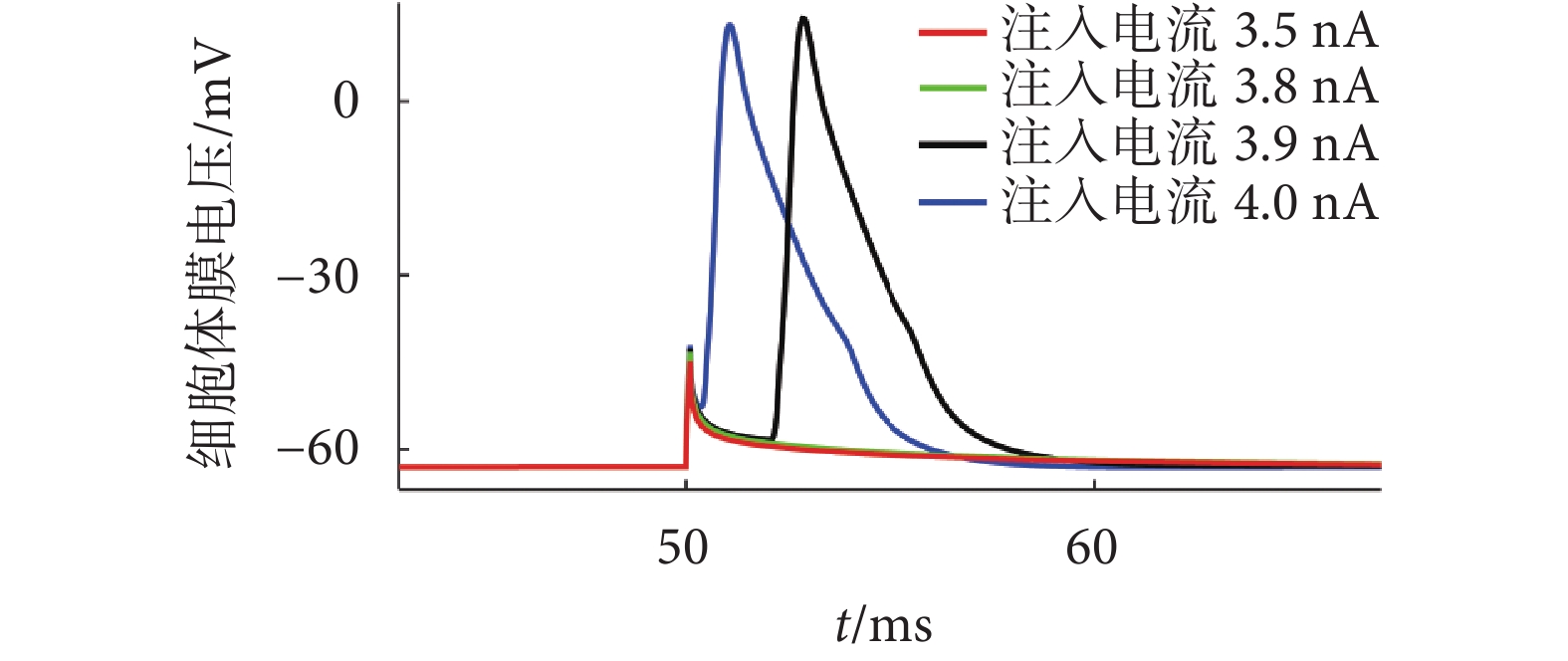
注入電流分別為3.5、3.8、3.9、4.0 nA時海馬錐體神經元胞體膜電壓隨時間的變化如圖8所示,可以觀察到輸入胞體的電流大于3.9 nA時能夠引發動作電位,小于或等于3.8 nA時僅引發局部電位。
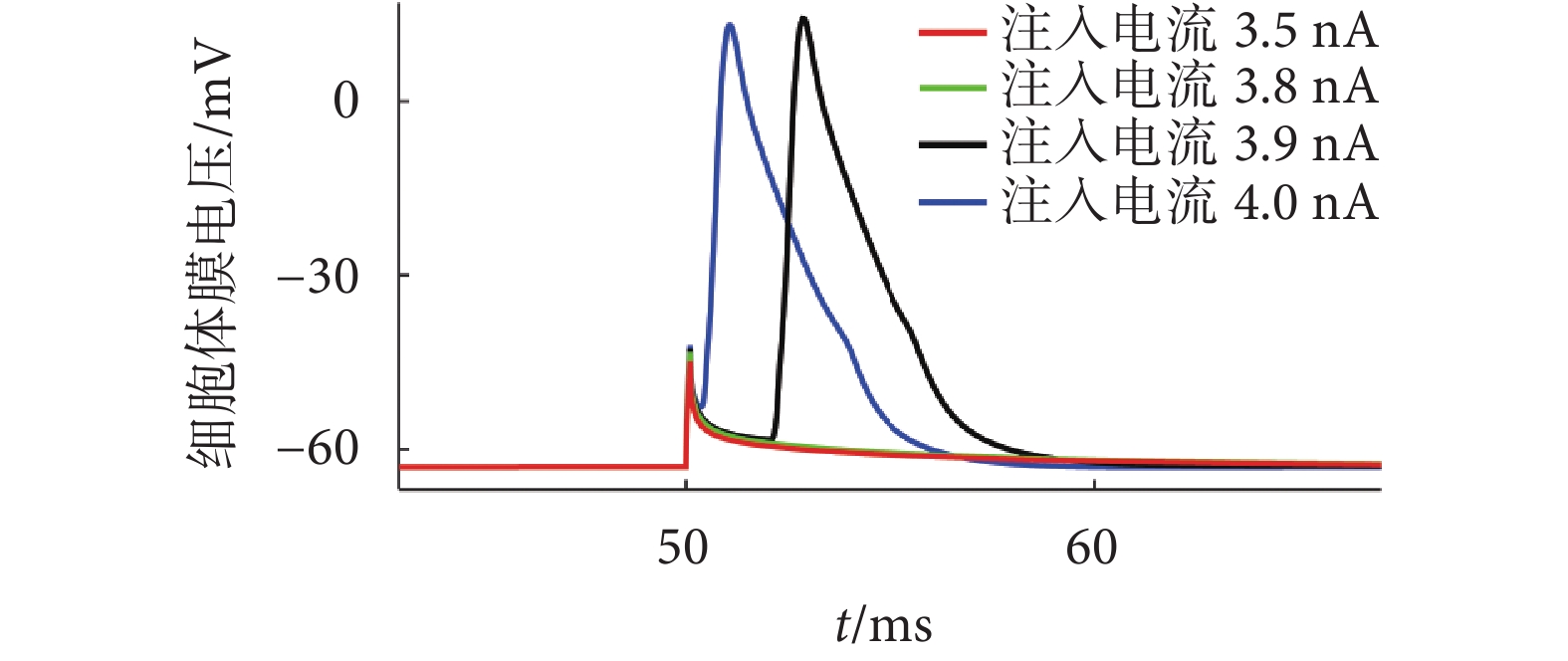 圖8
不同注入電流下胞體膜電壓隨時間的變化
Figure8.
Changes of cell membrane voltage with time under different injection currents
圖8
不同注入電流下胞體膜電壓隨時間的變化
Figure8.
Changes of cell membrane voltage with time under different injection currents
2.3 刺激電壓與神經元興奮性的關系測量
本文已經通過有限元仿真得到了刺激電極電壓為1 V時海馬組織處檢測電極頂點的電流密度模,因此可以方便地得到任意刺激電壓下,海馬組織處檢測電極頂點的電流密度。將海馬組織處檢測電極頂點的電流密度模轉化為刺激海馬錐體神經元的注入電流,如式(1)所示:
 |
其中,I為海馬錐體神經元胞體的注入電流,S為胞體的表面積,J為海馬組織處的電流密度模,因此結合圖8建立刺激電極的電壓和大鼠海馬神經元的興奮性的關系,如表2和表3所示。在基于腦片染色圖像的模型中,要使海馬組織中的錐體神經元興奮所需的最小刺激電壓為17 V,而在基于MRI的模型中,這一數值則增至24 V。
3 討論
本文將電場的有限元仿真和神經元電學模型相結合,分別采用大鼠腦片染色圖像和大鼠MRI數據提供大腦組織的解剖學信息建立有限元模型,獲得刺激電極產生的電場分布,然后使用神經元模型模擬tDCS下大鼠海馬組織的神經元響應,旨在通過仿真建立一個理論上更優的可以模擬tDCS對大鼠腦深部海馬神經元影響的模型,以期該模型可以指導tDCS的刺激參數的選擇,減少對目標神經元外神經的刺激和tDCS的副作用。
研究結果顯示,在基于腦片染色圖像的模型中使海馬組織錐體神經元興奮的最小刺激電壓為17 V,而在基于MRI的模型中使海馬組織錐體神經元興奮的最小刺激電壓為24 V,基于MRI的模型得到最小刺激電壓約為基于腦片染色圖像的模型最小刺激電壓的1.4倍。
產生這種差異的主要原因有以下三點。首先,這兩種模型的解剖信息來源不同。一種是基于大鼠腦片染色圖像建模,而另一種則基于MRI圖像。前者的圖像分辨率可以達到微米級,而后者圖像的分辨率由于圖像采集手段的限制,只有毫米級,因此前者提供了更加精細的腦組織細節結構,理論上仿真的結果更加準確[32]。其次, MRI圖像中灰質和白質的灰度值差異不大,因此基于MRI建立的腦片模型缺乏對白質和灰質的分隔。此外本文更關注電場在白質中的傳播情況,故對整個腦片賦予了白質的電導率。本文參考大鼠腦圖譜在兩個重建的腦片模型中的前額葉皮層放置刺激電極,在海馬放置檢測電極,但在基于MRI的腦片模型中沒有對白質和灰質進行區分,從而造成該模型缺乏內部組織結構信息,難以準確確定刺激電極和檢測電極的位置(參考基于腦片染色圖像的模型中電極的位置放置),可能使得電極位置與實際位置存在一定偏差。綜合分析上述因素,本研究認為基于腦片染色圖像的模型與神經元電學模型結合得到的結果更優,可以輔助tDCS選擇更小的刺激強度,減少可能的副作用。
本研究目前還僅限于模擬實驗,在將來的研究中,將進一步進行刺激電場的實際測量并驗證這些模型的仿真結果,為tDCS精準刺激提供更為精準可靠的前期科學實驗依據。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:張丞和張李君進行了動物實驗,何世紀進行了仿真實驗并撰寫初稿。張廣浩、吳昌哲和霍小林提出了研究思路并提供了修改建議。張丞、何世紀和張競兮對初稿進行了修訂。
倫理聲明:本研究通過了中國科學院電工研究所倫理委員會的審批(批文編號:LL202401)。
0 引言
腦部電刺激術是一種重要的神經調控技術,對于精神疾病和神經系統退行性疾病的治療和康復發揮著重要作用。腦部電刺激術包括腦深部電刺激(deep brain stimulation,DBS)、腦皮層電刺激(cerebral cortex stimulation,CCS)、經顱直流電刺激(transcranial direct current stimulation,tDCS)、經顱交流電刺激(transcranial alternating current stimulation,tACS)等[1-4]。相較于DBS和CCS,tDCS與tACS不需要將電極植入人體即可實現對神經的調控,具有無創、安全、成本低等優點。tDCS通過表面電極向頭部注入低強度電流(1~2 mA),以在頭部生成電場和電流密度場的形式影響神經元靜息電位的亞閾值,從而實現對皮質興奮性的調節[5-8]。且,由于頭骨對高頻電流的高阻抗,使得25 Hz以上的刺激大部分被衰減,所以tDCS對組織的刺激相較于tACS更加直接[9]。
目前,tDCS已廣泛應用于臨床實踐。在使用過程中,需要特別關注電極構成、裝配、電流強度、持續時間等刺激參數。其中,電流強度是一個重要參數,選擇合適的電流強度不僅能夠通過刺激特定靶點的神經細胞來調節神經網絡,從而精準作用于病灶,還可以減少對其他無關神經細胞或神經網絡的刺激,降低可能的副作用。但tDCS對人體腦部刺激的具體效果具有顯著的個體差異,即不同刺激方案和受試個體會產生不同的效果,而不當的刺激方式甚至會給受試個體造成損傷[10-15]。因此選擇合適的實驗模型探究tDCS的作用機制,并快速、低風險地篩選刺激方案,對其臨床應用具有重要指導作用。
在動物實驗中,根據對tDCS施加方式的不同分為經顱刺激、顱內刺激、體外組織刺激 [16]。其中,體外組織刺激(如腦切片)的方式廣泛應用于電生理學、藥理學,遺傳學及成像技術研究[17-19]。相較于tDCS 的在體研究,tDCS體外組織的刺激效果不容易受到大腦表面溝回和電極蒙太奇等多種因素的影響,該刺激方式可以對大腦進行精準刺激并提供高分辨率的實驗數據進行后續實驗分析,并為tDCS在體研究提供補充[16, 20-21]。
tDCS方案的研究有很多是基于頭模型的構建和有限元的仿真計算。例如,Saypol等[22]提出了人的3層球形頭模型(頭皮、頭骨和大腦),并計算了tDCS產生的電場分布,但是真實人頭部并不是標準的球形,這導致了計算結果與實際結果的誤差較大。Cerri等[23]使用磁共振成像(magnetic resonance imaging,MRI)圖像重建了真實人頭模型,并根據像元灰度賦予腦內不同組織不同電導率。鐘剛亮等[24]也根據MRI圖像建立了包含頭骨、頭皮、腦脊液、灰質、白質的5層真實頭模型。Nadeem等[25]則使用人體切片重建了包含頭骨、頭皮、腦脊液、灰質、白質、小腦等24種組織結構的頭部模型。除了人頭模型外,也有學者建立體積更小的動物(如大鼠)的頭模型,有簡單的球頭模型也有真實頭模型,如鄭建斌等[26]使用MRI圖像建立肌肉、顱骨、大腦和腦脊液的4層頭模型,杜百川[27]則使用計算機斷層掃描(computed tomography,CT)和冷凍切片建立了頭皮、顱骨、大腦的3層頭模型。但是上述研究都是基于頭模型對不同電極設計或電流強度下的腦內組織的電場宏觀仿真,并沒有考慮這些刺激下神經元的反應,無法更好地對刺激強度的選擇進行指導。
鑒于上述問題,本文使用有限元仿真和神經元模型結合的方式,通過有限元方式計算電流在腦組織中形成的電場,使用神經元模型評估電場中神經元的興奮性;并將神經元是否興奮作為標志,確定腦組織中刺激特定區域引起目標神經元興奮的刺激閾值,從而為tDCS在使用過程中的參數選擇提供實驗基礎。
1 方法
1.1 實驗動物
本實驗所用動物為清潔級成年雌性斯潑累格—多雷(Sprague-Dawley,SD)大鼠[SCXK(京)2020-0004],體重220~250 g,購自北京華阜康生物科技股份有限公司。動物的實驗過程依照《北京市實驗動物管理條例》相關規定進行,經中國科學院電工研究所倫理委員會批準通過(LL202401)。
1.2 基于腦片染色圖像重建大鼠腦片模型
本文首先基于大鼠“前額葉皮層及海馬”聯合切片重建腦片模型。該腦切片的切片深度約為2 280 μm,切片厚度為30 μm。如圖1所示,使用常規方法對切片進行蘇木精—伊紅(hematoxylin-eosin,HE)染色和焦油紫染色可以觀察到腦切片中神經纖維束的走行(深藍色部分)。
 圖1
HE染色和焦油紫染色后的腦切片
Figure1.
Brain sections after HE staining and cresyl violet staining
圖1
HE染色和焦油紫染色后的腦切片
Figure1.
Brain sections after HE staining and cresyl violet staining
鑒于從腦切片可以直接觀察到神經纖維束(腦白質),本文使用繪畫軟件PaintTool SAI 2(Systemax,日本)對腦片圖像進行預處理,去除腦切片外部輪廓和神經纖維束以外的所有內部結構,僅保留灰質和白質的邊界。使用圖像處理軟件ImageJ 1.54c(National Institutes of Health,美國)獲得的腦切片圖像中腦片的前后方向長度為15 888.5 μm。使用多物理場仿真軟件COMSOL Multiphysics 5.6(COMSOL,瑞典)提供的插件(image to curve)提取預處理后的腦片的輪廓線,并建立如圖2所示的厚度350 μm、前后方向長度為15 888.5 μm的腦切片模型。
 圖2
基于腦片染色圖像重建的大鼠腦片模型
Figure2.
Reconstruction of rat brain slice model based on brain slice staining images
圖2
基于腦片染色圖像重建的大鼠腦片模型
Figure2.
Reconstruction of rat brain slice model based on brain slice staining images
1.3 基于MRI重建大鼠腦片模型
本文隨后采用如圖3所示的MRI T2加權像對腦實質進行重建。使用三維醫學圖像處理軟件MIMICS RESEARCH 21.0(Materialise,比利時)重建大鼠腦片,操作過程如圖4所示。
 圖3
T2加權圖像
Figure3.
T2-weighted images
圖3
T2加權圖像
Figure3.
T2-weighted images
 圖4
MIMICS重建大鼠腦片模型的過程
Figure4.
Process of MIMICS reconstruction of rat brain slice model
圖4
MIMICS重建大鼠腦片模型的過程
Figure4.
Process of MIMICS reconstruction of rat brain slice model
使用三維醫學圖像處理軟件MIMICS RESEARCH 21.0(Materialise,比利時)對圖像進行灰度值分析,通過閾值分割、區域增長、蒙版編輯、計算實體等操作去除頭皮組織等,創建腦實質模型。然后根據本課題組前期的研究[28],在三維醫學圖像處理軟件中去除嗅球和小腦部分,提取出包含大鼠前額葉皮層及海馬的切片。.
1.4 腦片的tDCS仿真
本文采用多物理場仿真軟件COMSOL Multiphysics 5.6(COMSOL,瑞典)進行大鼠腦片tDCS仿真研究。軟件的仿真流程如圖5所示。
 圖5
COMSOL仿真流程
Figure5.
COMSOL simulation process
圖5
COMSOL仿真流程
Figure5.
COMSOL simulation process
根據實際實驗過程中的腦片tDCS環境,在多物理場仿真軟件中建立1個刺激電極和3個檢測電極。參考大鼠的腦圖譜將檢測電極的正極置于海馬附近,負極和地相連并置于腦片檢測槽的一角,刺激電極置于前額葉皮層。所有電極均簡化為直徑為200 μm的球體,球體上半部絕緣,下半部插入腦片。人工腦脊液模型是根據組織切片記錄槽RC-27L(Warner,美國)的形狀,設置為底面為六邊形的柱體,高度為1 mm,底面寬度2 cm,底邊長2.4 cm和4 cm。本研究假設生物組織的電導率是線性、各向同性均勻分布的[29]。大鼠腦組織的電導率參考Datta等[30]提供的人類腦組織數據,電極的電導率從材料性能數據庫(Material Property Data,MatWeb)獲得,具體的電導率賦值如表1所示。
1.5 神經元響應仿真
本文使用神經元和網絡模擬軟件NEURON 8.2.0(Yale University,美國)研究電流強度對海馬神經元電活動的影響。本文采用錐體細胞作為被刺激細胞,使用Cutsuridis等[31]提供的海馬錐體神經元模型參數,在NEURON 8.2.0中建立一個如圖6所示的海馬錐體神經元模型。該海馬神經元具有一個長800 μm的尖頂樹突,兩個長300 μm的基樹突,表面積為314 μm2的胞體和一個長150 μm的軸突。胞體的比膜電導為5×10?5 S/cm2,軸向電阻為150 Ω·cm,比膜電容為1 μF/cm2。
 圖6
海馬椎體神經元
Figure6.
Hippocampal pyramidal neurons
圖6
海馬椎體神經元
Figure6.
Hippocampal pyramidal neurons
本文在胞體表面施加一個電流鉗(電流延遲50 ms,持續時間0.1 ms),仿真不同刺激強度下神經元的興奮性,以確定使神經元興奮的最小刺激強度。
2 結果
2.1 腦片電場分布
通過仿真得到1V的tDCS作用下海馬附近的檢測電極處的電勢和電流密度,結果如圖7所示。可以觀察到電流在腦片中的傳播方向,以及在灰質、白質和腦脊液這3類介質中的傳播特性。
 圖7
不同模型中電流場的分布
Figure7.
Distribution of current fields in different models
圖7
不同模型中電流場的分布
Figure7.
Distribution of current fields in different models
2.2 神經元興奮性特性
注入電流分別為3.5、3.8、3.9、4.0 nA時海馬錐體神經元胞體膜電壓隨時間的變化如圖8所示,可以觀察到輸入胞體的電流大于3.9 nA時能夠引發動作電位,小于或等于3.8 nA時僅引發局部電位。
 圖8
不同注入電流下胞體膜電壓隨時間的變化
Figure8.
Changes of cell membrane voltage with time under different injection currents
圖8
不同注入電流下胞體膜電壓隨時間的變化
Figure8.
Changes of cell membrane voltage with time under different injection currents
2.3 刺激電壓與神經元興奮性的關系測量
本文已經通過有限元仿真得到了刺激電極電壓為1 V時海馬組織處檢測電極頂點的電流密度模,因此可以方便地得到任意刺激電壓下,海馬組織處檢測電極頂點的電流密度。將海馬組織處檢測電極頂點的電流密度模轉化為刺激海馬錐體神經元的注入電流,如式(1)所示:
 |
其中,I為海馬錐體神經元胞體的注入電流,S為胞體的表面積,J為海馬組織處的電流密度模,因此結合圖8建立刺激電極的電壓和大鼠海馬神經元的興奮性的關系,如表2和表3所示。在基于腦片染色圖像的模型中,要使海馬組織中的錐體神經元興奮所需的最小刺激電壓為17 V,而在基于MRI的模型中,這一數值則增至24 V。
3 討論
本文將電場的有限元仿真和神經元電學模型相結合,分別采用大鼠腦片染色圖像和大鼠MRI數據提供大腦組織的解剖學信息建立有限元模型,獲得刺激電極產生的電場分布,然后使用神經元模型模擬tDCS下大鼠海馬組織的神經元響應,旨在通過仿真建立一個理論上更優的可以模擬tDCS對大鼠腦深部海馬神經元影響的模型,以期該模型可以指導tDCS的刺激參數的選擇,減少對目標神經元外神經的刺激和tDCS的副作用。
研究結果顯示,在基于腦片染色圖像的模型中使海馬組織錐體神經元興奮的最小刺激電壓為17 V,而在基于MRI的模型中使海馬組織錐體神經元興奮的最小刺激電壓為24 V,基于MRI的模型得到最小刺激電壓約為基于腦片染色圖像的模型最小刺激電壓的1.4倍。
產生這種差異的主要原因有以下三點。首先,這兩種模型的解剖信息來源不同。一種是基于大鼠腦片染色圖像建模,而另一種則基于MRI圖像。前者的圖像分辨率可以達到微米級,而后者圖像的分辨率由于圖像采集手段的限制,只有毫米級,因此前者提供了更加精細的腦組織細節結構,理論上仿真的結果更加準確[32]。其次, MRI圖像中灰質和白質的灰度值差異不大,因此基于MRI建立的腦片模型缺乏對白質和灰質的分隔。此外本文更關注電場在白質中的傳播情況,故對整個腦片賦予了白質的電導率。本文參考大鼠腦圖譜在兩個重建的腦片模型中的前額葉皮層放置刺激電極,在海馬放置檢測電極,但在基于MRI的腦片模型中沒有對白質和灰質進行區分,從而造成該模型缺乏內部組織結構信息,難以準確確定刺激電極和檢測電極的位置(參考基于腦片染色圖像的模型中電極的位置放置),可能使得電極位置與實際位置存在一定偏差。綜合分析上述因素,本研究認為基于腦片染色圖像的模型與神經元電學模型結合得到的結果更優,可以輔助tDCS選擇更小的刺激強度,減少可能的副作用。
本研究目前還僅限于模擬實驗,在將來的研究中,將進一步進行刺激電場的實際測量并驗證這些模型的仿真結果,為tDCS精準刺激提供更為精準可靠的前期科學實驗依據。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:張丞和張李君進行了動物實驗,何世紀進行了仿真實驗并撰寫初稿。張廣浩、吳昌哲和霍小林提出了研究思路并提供了修改建議。張丞、何世紀和張競兮對初稿進行了修訂。
倫理聲明:本研究通過了中國科學院電工研究所倫理委員會的審批(批文編號:LL202401)。