糖尿病及其并發癥對人類生命健康構成了嚴重威脅,已成為全球廣泛關注的公共衛生問題。目前,臨床上主要采用注射胰島素進行治療,然而手動注射胰島素的方式還存在諸多不足之處。近年來,隨著研究的深入,發現結合連續血糖監測裝置與胰島素泵的自動胰島素輸送(AID)系統,能夠顯著改善糖尿病治療效果并且降低患者并發癥的發生率。本文首先介紹了AID系統的組成及其工作原理,然后從連續血糖監測技術、胰島素泵以及閉環控制算法的發展等方面,詳細介紹了相關技術的發展歷程及現狀。最后,本文展望了AID系統在糖尿病治療領域的應用前景及未來發展方向,為進一步的研究提供理論參考。
引用本文: 俞志超, 孫宇帆, 黃志健, 李嶄虹, 龍建軍, 朱志剛. 自動胰島素輸送系統在糖尿病管理領域的研究進展. 生物醫學工程學雜志, 2024, 41(6): 1279-1285. doi: 10.7507/1001-5515.202406060 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
糖尿病是一種由多種致病因素相互作用引起的慢性自身免疫性疾病,其主要特征是血糖濃度長期超出正常范圍[1]。糖尿病會導致胰島功能紊亂或生物作用受損,進而破壞患者血糖調節能力。長期高血糖會對血管造成損傷,并導致一系列糖尿病并發癥[2]。根據統計數據,2021年全球糖尿病成人患者數約為5.36億人,患病率達到10.5%。每年,全球糖尿病相關的醫療費用支出接近1萬億美元,因此糖尿病已成為全球性的重要醫療健康問題[3]。
按照《糖尿病分型診斷中國專家共識》,糖尿病可分為6種類型:Ⅰ型糖尿病(type 1 diabetes mellitus,T1DM)、Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)、妊娠型糖尿病、單基因糖尿病、繼發性糖尿病及未定型糖尿病[4]。糖尿病的長期并發癥包括糖尿病視網膜病變、糖尿病腎病、糖尿病足等多種類型[5]。在糖尿病患者中,T2DM患者占比超過90%,通常通過口服降糖藥或胰島素治療等方式控制血糖。當口服藥物無法達到血糖控制目標時,患者需依賴外源性胰島素治療[6],而T2DM患者血糖波動較大,采用每日多次注射(multiple daily injections,MDI)胰島素方式治療效果較差[7],因此,許多患者選擇持續皮下胰島素輸注(continuous subcutaneous insulin infusion,CSII)療法。CSII療法主要通過自動胰島素輸送(automated insulin delivery,AID)系統來完成。本文將詳細介紹AID系統的研究現狀,涵蓋了其起源、發展歷程及最新進展。連續血糖監測(continuous glucose monitoring,CGM)技術與胰島素泵及閉環控制算法的結合,標志著糖尿病管理進入了一個全新的時代。這些技術的集成,不僅提高了血糖控制的準確性和安全性,也顯著改善了患者的生活質量。
1 AID系統組成及工作原理
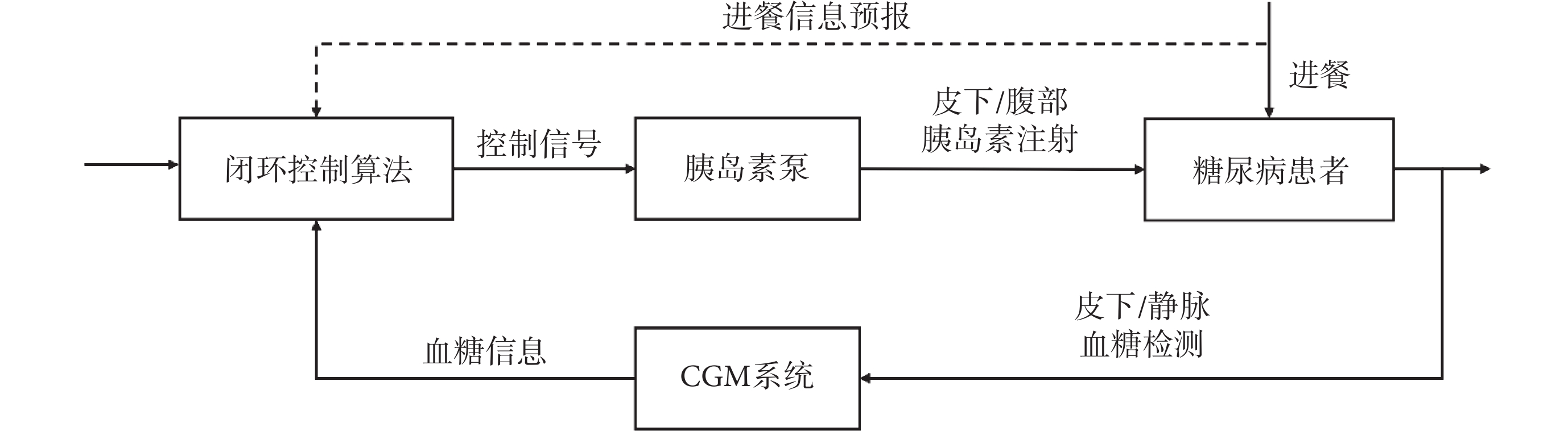
AID系統是一種將CGM設備和胰島素泵集成在一起的閉環控制系統,旨在實現對血糖水平的精確管理和自動調節。AID系統主要包含三個部分:① 胰島素泵,用于定量輸注胰島素;② CGM設備,實時監測患者血糖濃度;③ 閉環控制算法,根據血糖數據計算并調整胰島素的輸注量。AID系統的控制原理如圖1所示。
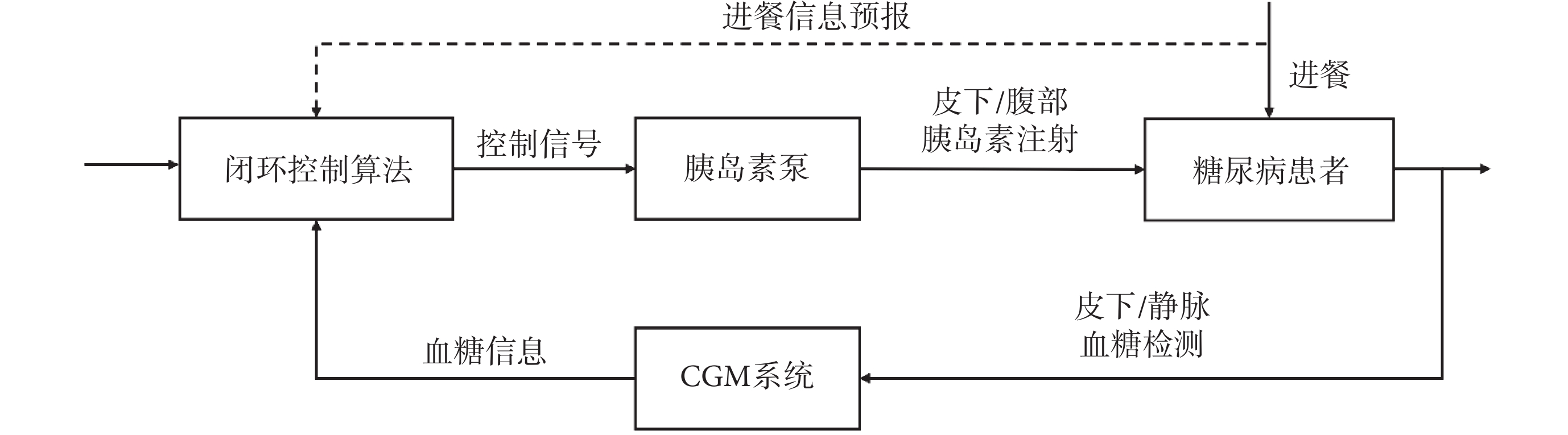 圖1
AID系統控制原理示意圖
Figure1.
Schematic diagram of the control principle of the AID system
圖1
AID系統控制原理示意圖
Figure1.
Schematic diagram of the control principle of the AID system
AID系統通過CGM設備采集實時血糖數據[8],并傳遞給閉環控制算法。閉環控制算法結合當前血糖值、目標血糖值及進餐信息等多因素進行計算[9],從而得出精確的胰島素注射量,并控制胰島素泵實現胰島素的自動輸注。CGM設備持續監測血糖,并與目標值比較,周而復始,完成對血糖的閉環控制。這種方法能夠有效地降低患者的血糖波動,預防高血糖相關并發癥。此外,該療法顯著減輕了患者的痛苦,降低了夜間低血糖事件的發生概率,從而有助于提高患者生活質量。目前,AID系統被認為是最具前景的糖尿病治療方案,臨床應用進展迅速,并已經逐步向社區醫療機構普及。
2 AID系統研究現狀
AID技術的歷史可以追溯到19世紀60年代, Kadish博士設計了全球首臺胰島素泵裝置。然而,由于該設備笨重,因此未能得到推廣。隨著葡萄糖測量和靜脈注射胰島素等技術的發展,多個團隊開始投入到閉環式胰島素泵的研究。1977年,第一臺商用閉環胰島素泵問世,該設備首次實現了計算機控制,可根據葡萄糖分析儀反饋的血糖水平計算并輸注胰島素,但因操作復雜,患者在日常生活中使用困難。
1979年,Bergman等[10]提出了葡萄糖動力學最小模型,為閉環控制算法奠定了理論基礎。此后,許多研究人員投入到閉環控制算法的設計研究中,并開發了一系列基于人體胰腺生理建模的計算機控制系統。本章將從CGM技術、胰島素泵和閉環控制算法的發展等方面,詳細介紹AID系統相關技術的發展歷程。
2.1 CGM技術
在AID概念提出的早期,胰島素輸送系統通常由控制器和胰島素泵兩部分組成,缺少血糖監測設備,無法構成完整的控制回路,因此被稱為開環胰島素輸送系統。當時,患者仍需要采用傳統的血糖監測方式來觀測血糖水平,并手動控制胰島素泵進行給藥,這在很大程度上限制了患者的日常生活。此外,由于胰島素泵的價格較為昂貴,多數患者仍選擇MDI療法,使得AID系統未得到普及。
CGM技術出現于20世紀90年代末期,并在2000年首次投入商用。CGM設備可每5 min自動測量組織間液中的葡萄糖濃度,為患者提供全天的血糖數據,避免了頻繁采血的疼痛。與傳統的生化分析儀或指尖血檢測相比,CGM可以更好地反映血糖波動情況,展現出顯著的優勢,是糖尿病患者理想的監測方式。
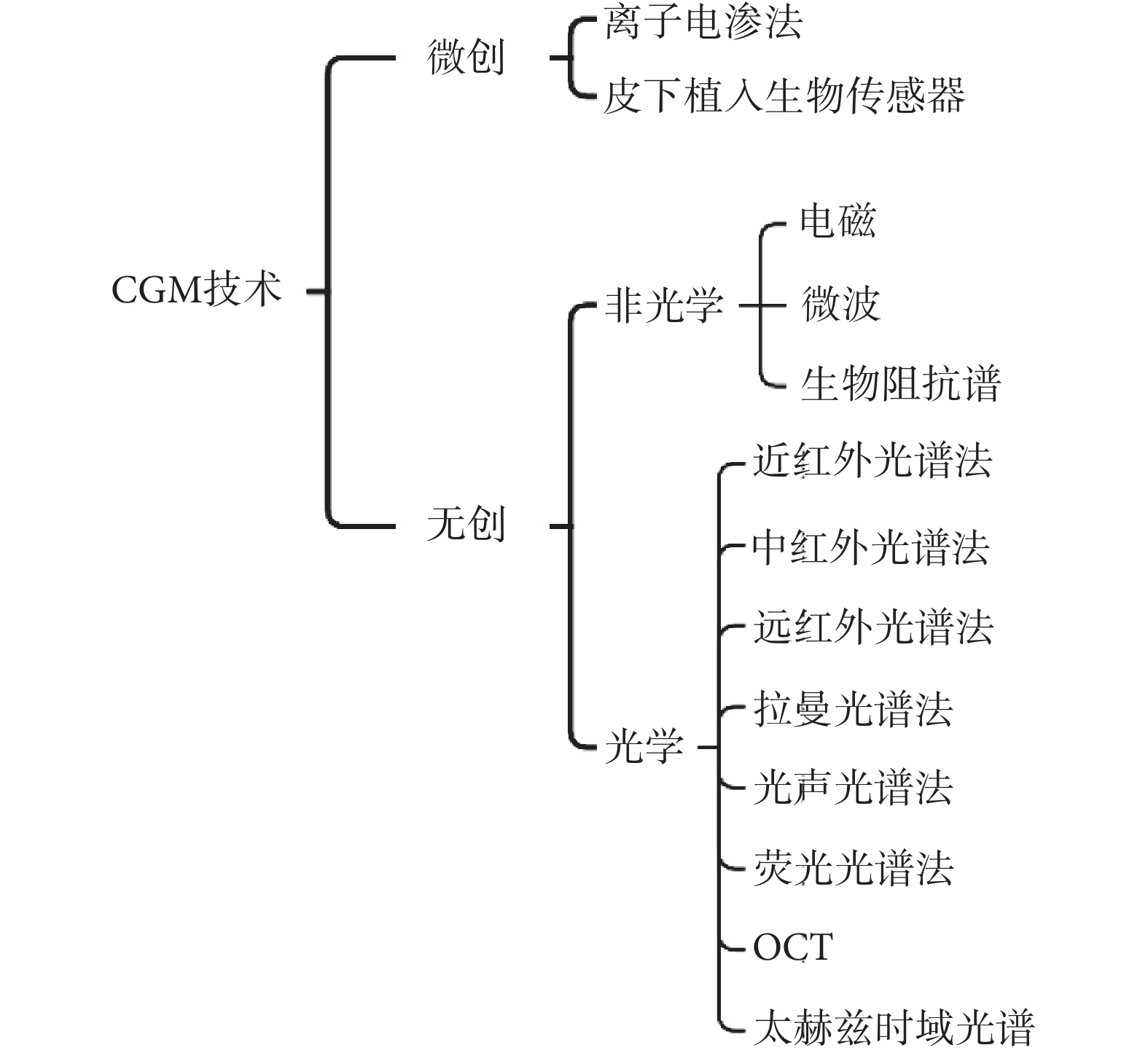
目前的血糖監測技術主要分為有創、微創和無創三類,而在CGM領域以微創和無創為主要研究方向[11]。近年來,國內外研究者提出了多種血糖監測技術,如圖2所示。
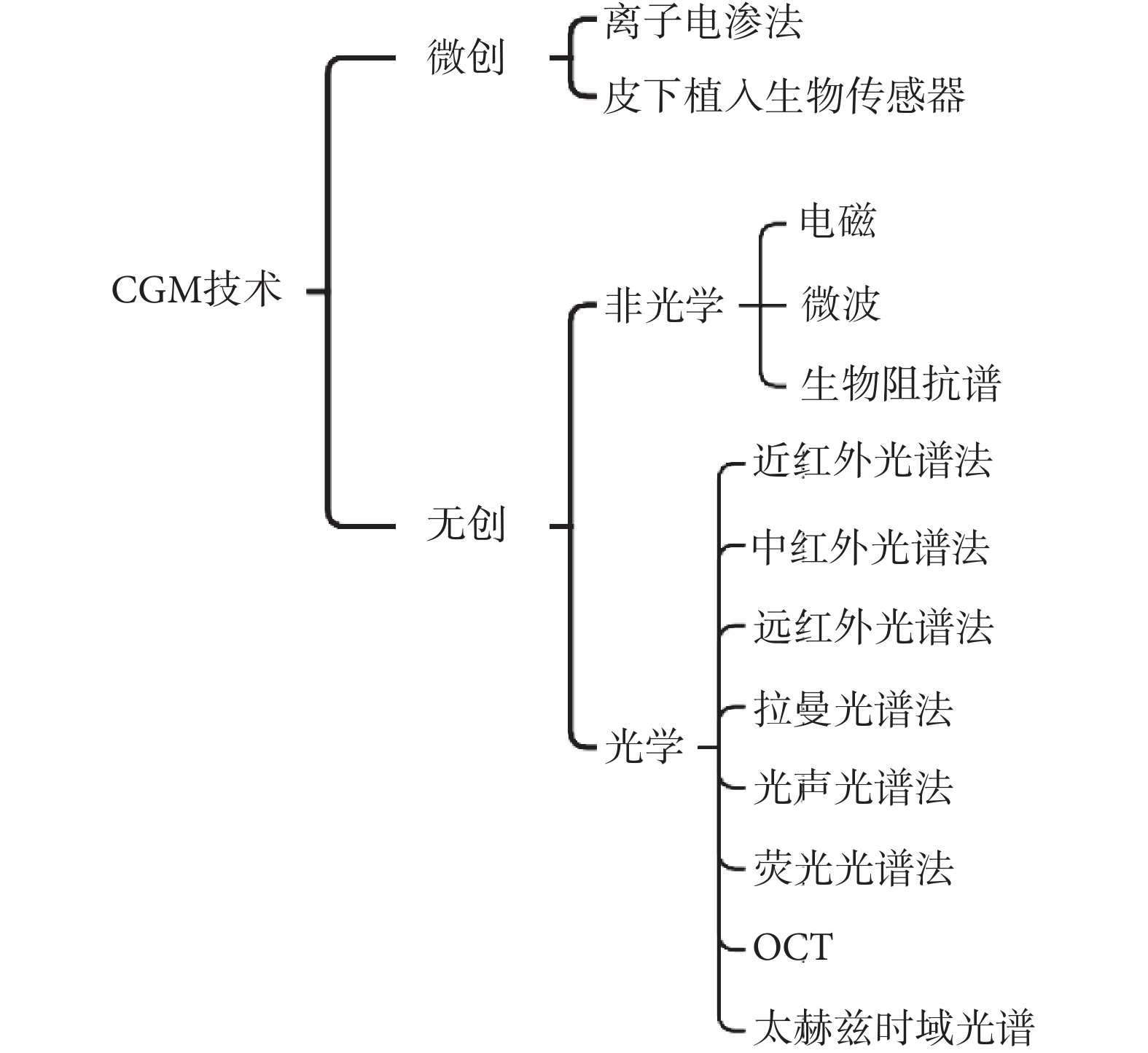 圖2
CGM主要技術分類
Figure2.
Main technical classification of CGM
圖2
CGM主要技術分類
Figure2.
Main technical classification of CGM
目前,較為熱點的CGM技術包括:光學CGM和電化學CGM。光學CGM是一種無創的血糖監測技術,包括近紅外光譜法、拉曼光譜法、熒光光譜法及光學相干層析成像(optical coherence tomography,OCT)等。近年來,研究人員基于相關技術,提出了多種光學無創血糖監測方法。早在2002年,Larin等[12]就開始通過OCT技術進行無創血糖檢測,臨床研究結果表明,OCT信號的斜率與實際血糖濃度之間存在良好的相關性。2017年,Ali等[13]提出了一種基于可見激光折射率變化的血糖監測方法,該方法通過測定不同波長的激光在透過水和人的手指時的透光率和吸光度,進而選擇出最適波長;該研究發現折射率會隨葡萄糖濃度增加而增加,從而提高光學傳感器的輸出電壓,最終將電壓值轉換為等效的葡萄糖濃度水平,2019年,Rachim等[14]開發了一種基于可見光—近紅外(visible-near infrared,Vis-NIR)的生物傳感器,利用腕部組織血糖濃度變化過程中的動脈血容量脈動信息,結合Vis-NIR光譜法測量反射光信號,并建立反射光信號值與血糖濃度之間的模型,進而就可以得到對應的血糖值。
盡管光學CGM的監測效果表現優異且潛力巨大,但仍需克服靈敏度、穩定性和特異性不足等問題。因此,當前血糖監測的金標準仍是有創或微創檢測。電化學CGM是一種微創血糖監測技術,其原理是在皮下植入生物傳感器,通過傳感器上的酶與組織間液中的葡萄糖發生反應,產生電流信號,并將該電流信號轉換為組織間液中的葡萄糖濃度值[15]。電化學CGM技術具有良好的穩定性、低檢出限、快速響應和操作簡單等優點[16]。
電化學CGM技術自面世以來,經過了20多年的發展,主要分為回顧式CGM、實時CGM以及胰島素泵集成使用三個階段[17-18]。其核心部件是葡萄糖生物傳感器,其靈敏度直接決定了CGM系統的性能和檢測精度,因而成為當前CGM領域的研究熱點之一。Alam等[19]開發了一種基于銅天然氧化物的電化學傳感器,用于汗液葡萄糖檢測。該傳感器通過銅氧化物將葡萄糖電氧化為葡萄糖酸內脂,再轉化為葡萄糖酸,產生氧化電流,并將電流信號轉換為汗液葡萄糖濃度。Parrilla等[20]設計了一種用于葡萄糖透皮電化學監測的可穿戴中空微針傳感貼片,該傳感器采用了葡萄糖氧化酶和普魯士藍/六氰基鐵酸鎳修飾的絲網印刷電極,并在工作電極上沉積了限制擴散的全氟磺酸層,以提高檢測所需的線性度,使得該傳感貼片能夠實現糖尿病患者的可穿戴血糖監測。本課題組也開展了相關研究,采用螺旋型鉑銥合金電極設計,以實現提高植入式葡萄糖生物傳感器的葡萄糖氧化酶擔載量并增大工作電極的電化學活性面積的目的。本課題組所制備的螺旋型傳感器靈敏度在20~30 nA/mmol,可在人體生理條件范圍內線性檢測葡萄糖濃度(2~30 mmol/L)[21]。
隨著CGM技術的不斷發展,其在檢測精度、佩戴舒適度等方面有了顯著提升,部分CGM設備還提供預警功能,使患者能夠更有效應對高血糖或低血糖事件。目前,在商用CGM領域,主要進展是與胰島素泵集成使用,構建閉環胰島素輸送系統,從而更便捷有效地控制血糖[22]。未來,CGM技術還可以與微針等無痛檢測技術及智能手表等可穿戴設備結合,進一步提高用戶體驗。隨著CGM技術的進步,其在糖尿病管理中的應用將越來越廣泛,未來將有更多智能化和個性化的解決方案出現,并有望進一步深入糖尿病患者市場。
2.2 胰島素泵
胰島素泵是用于連續輸注胰島素的醫用設備,其主體結構包括推進注射裝置、胰島素儲藥艙和導管[23]。通過植入皮下組織的輸液導管,胰島素泵可在24 h內以緩慢的基礎率進行胰島素輸注,該速率可根據患者實際情況進行調整。針對患者用餐后出現的血糖升高現象,系統也可以預先設定,根據攝入的碳水化合物量,自動計算出所需胰島素劑量,并在指定的用餐時間進行額外補充給藥,這一過程被稱為餐前大劑量輸注[24]。有研究顯示,經過多項臨床試驗及患者實際使用驗證,與傳統的MDI方式相比,CSII療法能夠顯著改善糖尿病患者的血糖控制[25-28],具體表現在糖化血紅蛋白(HbA1c)和平均血糖水平的控制效果上,且不會產生明顯的不良反應。
目前, CSII療法已經成為許多醫生及T1DM患者的優先選擇,因為胰島素泵的工作模式是模仿人體胰腺生理性分泌胰島素,通過基礎率與大劑量輸注相結合,有效降低患者一天內的血糖波動。研究顯示,血糖波動引發的糖尿病慢性并發癥風險有時要比長期高血糖更高[29],而常規皮下注射很難模擬24 h內的人體正常血糖波動,常常導致在兩次進餐之間因胰島素過量而出現低血糖,而在餐后血糖逐漸達到峰值時胰島素水平較低導致高血糖事件,這會對患者糖尿病并發癥的預防產生不利影響[30]。
美敦力公司于1983年推出的胰島素泵MiniMed 502(Medtronic Inc.,美國)是全球首款通過美國食品藥品監督管理局(food and drug administration,FDA)認證的商用胰島素泵,標志著胰島素泵技術的商業化。此后,坦德姆(Tandem)糖尿病護理公司、銀休特(Insulet)公司和羅氏(Roche)公司等廠家也先后推出了各自的胰島素泵產品[31],并獲得FDA認證。其中,Insulet公司推出的胰島素泵OmniPod(Insulet Corp.,美國)是首款無線胰島素泵,采用貼片式、無管路化設計,將胰島素的存儲、輸送和控制都集成在一個裝置中,無需使用輸液管和輸液針[32]。胰島素泵OmniPod(Insulet Corp.,美國)配備了遠程控制器和手機應用程序,用戶可以使用手機應用程序調整胰島素輸送速率、查看和記錄血糖數據,以及設置提醒功能。這種貼片式、無管路化、可穿戴設計大大提升了患者的使用體驗。
隨著人們對胰島素泵在糖尿病治療中的作用深入了解,胰島素泵的市場規模持續擴大,預計到2030年,全球市場規模將達到200億美元。未來,科技的進步和醫療技術的創新,將推動胰島素泵向智能化和便攜化發展,為糖尿病患者提供更加靈活舒適的血糖管理方案。
2.3 閉環控制算法
在生理上,人體血糖穩態由一個相互連接的負反饋調節回路系統維持,胰腺在胰島α細胞和胰島β細胞的作用下分泌激素,將血糖水平控制在正常范圍內。然而,在實際應用中,由于傳感器檢測和胰島素作用時間之間存在延遲,因此該系統是一個典型的時滯系統。此外,患者的進餐、運動和睡眠等生理因素也會影響血糖水平,這要求系統能夠根據CGM系統反饋的血糖值以及患者的進食量和運動時間等信息,計算出精確的胰島素注射量及注射時間,將患者的血糖控制在正常范圍。其中,閉環控制算法是實現這一目標的關鍵技術[33]。
自閉環式胰島素輸送系統的概念提出以來,國內外許多研究人員先后投入該領域研究。得益于對葡萄糖代謝生理模型的深入研究,閉環控制算法取得了顯著進展,提出并應用的閉環控制算法日益增多。經過數十年的發展,當前的閉環控制算法基本可分為以下幾類:比例—積分—微分(proportional–integral–derivative,PID)控制算法、模型預測控制(model predictive control,MPC)算法和模糊邏輯(fuzzy logical,FL)算法。
2.3.1 PID控制算法
PID控制是一種在工業領域得到廣泛應用的控制器,具有控制原理簡單、魯棒性好和可靠性高的特點。PID控制算法的核心是將比例(proportional)、積分(integral)和微分(derivative)三種控制環節有機結合。通過計算偏差的比例、積分和微分,PID控制器將這三者通過線性組合構成控制量,以此調節被控對象的狀態。在AID系統中,PID控制器根據血糖測量值與設定目標血糖值之間的偏差進行調節:比例分量部分快速響應偏差,確定所需的胰島素輸注量;積分分量部分消除穩態誤差,保證血糖在目標值附近穩定;微分分量部分則預測偏差變化趨勢,以應對血糖變化并進行胰島素輸注量調節[34]。
由于人體對胰島素的反應具有非線性和時變特性,且患者的運動、飲食、情緒變化等都會造成血糖波動,因此,傳統的PID控制算法無法滿足所有患者以及同一患者在不同情況下的血糖控制需求。為此,研究者們開發了多種改進的PID控制算法,如自適應PID控制、神經網絡PID控制等,以提高控制效果。Li等[35]提出了一種基于反向傳播神經網絡調節血糖水平的PID控制算法,對參數進行自適應調整,通過科學計算軟件MATLAB(2006a,MathWorks Inc.,美國)進行仿真驗證,與經典PID控制器比較,該算法響應速度更快,具有更好的控制效果。
盡管改進的PID控制算法在性能上有了顯著提升,但仍難以適應人體復雜的生理動態變化,且由于傳感器時滯等因素,難以實現及時有效的控制。此外,PID控制算法在個體差異的適應能力上的不足,使其控制效果在很大程度上依賴于患者血糖模型的準確度,而建立精準的血糖模型同樣面臨挑戰。盡管PID控制算法在血糖控制領域的研究很早便開始,但在實際應用中仍有較大局限性,因此需要開發一種更精確、更能適應個體差異的血糖控制方法。
2.3.2 MPC算法
MPC算法通過建立系統的數學模型,并根據當前狀態和對未來一段時間內系統狀態的預測進行參數優化,以實現對系統的控制。MPC算法廣泛應用于工業自動化、汽車控制、過程控制等領域,尤其適合于具有時滯、非線性和約束條件的復雜系統。
MPC算法通過預測未來一段時間內的血糖變化趨勢,優化胰島素輸注劑量,可實現對血糖水平的精確控制,決定其控制效果的主要因素是預測模型的準確性。當患者存在個體差異時,使用固定預測模型會帶來較大偏差。因此,需要對MPC算法的參數進行持續調整,以優化預測模型,減小患者差異帶來的影響。針對上述問題,Eren-Oruklu等[36]在MPC的基礎上提出了廣義預測控制(generalized predictive control,GPC)方法,在模型中增加了一個數字濾波器和延遲補償器,以實現動態檢測血糖波動。該模型根據新的血糖值更新模型參數,能夠適用于不同患者,且無需額外的干擾建模和患者手動輸入,可有效改善糖尿病的管理。Wu等[37]基于MPC提出了一種區域MPC策略,設計了基于該策略的血糖控制系統,并通過臨床數據建立虛擬患者來評估系統性能。結果表明,該系統的各項評價指標相較于傳統MPC算法均有所提升,可有效預防低血糖事件發生。
近年來,許多學者提出將機器學習、神經網絡等人工智能(artificial intelligence,AI)技術與MPC結合,綜合MPC的優化策略和機器學習的泛化能力,設計出穩定性更好、預測精度更高的控制系統。但由于部分AI技術(如深度學習技術)的決策過程缺乏透明度,導致其在醫療領域很難被醫生和患者接受,且復雜的模型同時需要大量的計算資源,這在移動設備或實時控制系統中難以實現。因此,盡管將MPC與AI技術結合這一策略在血糖控制領域具有巨大潛力,但實際應用過程仍面臨許多技術挑戰。
2.3.3 FL算法
FL控制本質上是一種基于規則的專家系統,它不依賴于精確的數學模型,而是通過模糊規則來處理糖尿病患者在血糖控制過程中的不確定性和模糊性。將FL控制應用于AID系統時,首先需總結糖尿病臨床治療中的經驗和規則,建立專家知識庫;然后,將臨床經驗中的規則和操作方法、條件轉換為模糊集合,輸入到知識庫中;最后根據CGM監測的實時血糖數據,將其輸入到知識庫中,并基于知識庫中的規則和輸入的模糊集合進行推理,得到相對應的胰島素輸注劑量值。
FL算法的決策推理過程主要依賴于根據臨床經驗所構建的專家知識庫。然而,在構建過程中,對模糊規則和隸屬度函數的選取存在一定的主觀性,導致決策過程的透明性不足。因此,部分學者嘗試將FL控制與MPC結合,利用FL控制對不確定性事件處理的優勢和MPC的優化能力,來提高血糖控制的性能。
3 AID系統的未來發展
當前,全閉環胰島素輸送系統的研究正在全球范圍內開展,AID技術已顯示出在提升血糖控制效果、降低低血糖事件發生概率及改善患者生活質量等方面的潛力。現有研究表明,使用AID系統可有效降低HbA1c,增加葡萄糖目標范圍內時間(time in range,TIR),減少低血糖事件。未來,AID系統有望進一步減少對患者碳水化合物計數、運動數據等其他生理數據的依賴。
為了進一步提高AID設備的普及度,還需要解決多個問題,例如進一步提高CGM設備、胰島素泵與閉環控制算法三者的有機融合。要實現這一目標,首先要解決數據標準化問題,采用統一的數據格式和通信協議,以確保不同設備之間的有效協同。此外,還可以考慮在CGM設備中加入信號處理算法減少噪聲干擾,提高CGM技術的精度;開發新型傳感器材料,并通過預測算法來補償延遲,降低傳感器的延遲時間;利用機器學習技術分析患者歷史生理數據,進行多維度分析,以此構建個性化的血糖預測模型等。
除了商業閉環系統外,自制人工胰腺系統(do-it-yourself artificial pancreas systems,DIYAPS)也受到越來越多的關注,是未來人工胰腺的發展方向之一[38]。DIYAPS將胰島素泵、CGM設備及控制系統整合起來,用戶可以自由選擇所使用的設備品牌和型號。當前主要的DIYAPS主要包括開源人工胰腺系統(open artificial pancreas system,Open APS)、環路(LOOP)和安卓人工胰腺系統(Android artificial pancreas system,Android APS),分別使用小型計算機、蘋果(Apple)設備和安卓(Android)設備作為控制器。
鑒于DIYAPS尚未投入商用,有關其市場效益的研究較少,但與商業閉環系統相比,使用DIYAPS可以有效減輕患者的經濟負擔。然而,DIYAPS的臨床安全性仍需驗證,且對患者的使用要求較高,包括軟硬件的配置調試等,都需要一定的專業門檻。因此,未來需要專業技術人員對患者進行培訓,并由相應機構進行監管,以確保其安全性。
隨著技術的不斷進步,未來的AID系統將更加智能化和個性化,例如利用機器學習等AI技術提高算法的預測能力和自適應性;根據患者的個人情況提供個性化的管理建議等。此外,與可穿戴設備進行更緊密的集成以及雙激素胰島素泵的研發,也是未來的發展方向之一。隨著全球糖尿病患病率的上升,越來越多的企業和研究機構投入其中,市場前景十分廣闊。
AID系統的出現從根本上改變了糖尿病管理的策略,極大地改善了患者的體驗,使其無需再頻繁進行血糖監測和胰島素注射,顯著提升了生活質量,如今已成為T1DM和部分T2DM患者的優選治療方案之一。未來,AID系統的發展將聚焦于技術創新、用戶體驗提升和臨床應用擴展等多個方面。當前投入商用的AID系統多為半閉環和混合閉環系統,要實現全閉環AID系統還需克服諸多挑戰。AID系統的問世與發展切實改善了糖尿病患者的生活,隨著各項核心技術的發展進步,各設備之間的結合應用將變得更加緊密,其整體性能也將不斷提高,逐步為糖尿病患者提供更高質量的血糖管理方案。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:俞志超完成了文獻綜述及文章的撰寫,黃志健、孫宇帆完成了相關文獻搜集、整理工作,朱志剛完成了文章的審閱和校對,李嶄虹、龍建軍協助了稿件的修訂。
0 引言
糖尿病是一種由多種致病因素相互作用引起的慢性自身免疫性疾病,其主要特征是血糖濃度長期超出正常范圍[1]。糖尿病會導致胰島功能紊亂或生物作用受損,進而破壞患者血糖調節能力。長期高血糖會對血管造成損傷,并導致一系列糖尿病并發癥[2]。根據統計數據,2021年全球糖尿病成人患者數約為5.36億人,患病率達到10.5%。每年,全球糖尿病相關的醫療費用支出接近1萬億美元,因此糖尿病已成為全球性的重要醫療健康問題[3]。
按照《糖尿病分型診斷中國專家共識》,糖尿病可分為6種類型:Ⅰ型糖尿病(type 1 diabetes mellitus,T1DM)、Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)、妊娠型糖尿病、單基因糖尿病、繼發性糖尿病及未定型糖尿病[4]。糖尿病的長期并發癥包括糖尿病視網膜病變、糖尿病腎病、糖尿病足等多種類型[5]。在糖尿病患者中,T2DM患者占比超過90%,通常通過口服降糖藥或胰島素治療等方式控制血糖。當口服藥物無法達到血糖控制目標時,患者需依賴外源性胰島素治療[6],而T2DM患者血糖波動較大,采用每日多次注射(multiple daily injections,MDI)胰島素方式治療效果較差[7],因此,許多患者選擇持續皮下胰島素輸注(continuous subcutaneous insulin infusion,CSII)療法。CSII療法主要通過自動胰島素輸送(automated insulin delivery,AID)系統來完成。本文將詳細介紹AID系統的研究現狀,涵蓋了其起源、發展歷程及最新進展。連續血糖監測(continuous glucose monitoring,CGM)技術與胰島素泵及閉環控制算法的結合,標志著糖尿病管理進入了一個全新的時代。這些技術的集成,不僅提高了血糖控制的準確性和安全性,也顯著改善了患者的生活質量。
1 AID系統組成及工作原理
AID系統是一種將CGM設備和胰島素泵集成在一起的閉環控制系統,旨在實現對血糖水平的精確管理和自動調節。AID系統主要包含三個部分:① 胰島素泵,用于定量輸注胰島素;② CGM設備,實時監測患者血糖濃度;③ 閉環控制算法,根據血糖數據計算并調整胰島素的輸注量。AID系統的控制原理如圖1所示。
 圖1
AID系統控制原理示意圖
Figure1.
Schematic diagram of the control principle of the AID system
圖1
AID系統控制原理示意圖
Figure1.
Schematic diagram of the control principle of the AID system
AID系統通過CGM設備采集實時血糖數據[8],并傳遞給閉環控制算法。閉環控制算法結合當前血糖值、目標血糖值及進餐信息等多因素進行計算[9],從而得出精確的胰島素注射量,并控制胰島素泵實現胰島素的自動輸注。CGM設備持續監測血糖,并與目標值比較,周而復始,完成對血糖的閉環控制。這種方法能夠有效地降低患者的血糖波動,預防高血糖相關并發癥。此外,該療法顯著減輕了患者的痛苦,降低了夜間低血糖事件的發生概率,從而有助于提高患者生活質量。目前,AID系統被認為是最具前景的糖尿病治療方案,臨床應用進展迅速,并已經逐步向社區醫療機構普及。
2 AID系統研究現狀
AID技術的歷史可以追溯到19世紀60年代, Kadish博士設計了全球首臺胰島素泵裝置。然而,由于該設備笨重,因此未能得到推廣。隨著葡萄糖測量和靜脈注射胰島素等技術的發展,多個團隊開始投入到閉環式胰島素泵的研究。1977年,第一臺商用閉環胰島素泵問世,該設備首次實現了計算機控制,可根據葡萄糖分析儀反饋的血糖水平計算并輸注胰島素,但因操作復雜,患者在日常生活中使用困難。
1979年,Bergman等[10]提出了葡萄糖動力學最小模型,為閉環控制算法奠定了理論基礎。此后,許多研究人員投入到閉環控制算法的設計研究中,并開發了一系列基于人體胰腺生理建模的計算機控制系統。本章將從CGM技術、胰島素泵和閉環控制算法的發展等方面,詳細介紹AID系統相關技術的發展歷程。
2.1 CGM技術
在AID概念提出的早期,胰島素輸送系統通常由控制器和胰島素泵兩部分組成,缺少血糖監測設備,無法構成完整的控制回路,因此被稱為開環胰島素輸送系統。當時,患者仍需要采用傳統的血糖監測方式來觀測血糖水平,并手動控制胰島素泵進行給藥,這在很大程度上限制了患者的日常生活。此外,由于胰島素泵的價格較為昂貴,多數患者仍選擇MDI療法,使得AID系統未得到普及。
CGM技術出現于20世紀90年代末期,并在2000年首次投入商用。CGM設備可每5 min自動測量組織間液中的葡萄糖濃度,為患者提供全天的血糖數據,避免了頻繁采血的疼痛。與傳統的生化分析儀或指尖血檢測相比,CGM可以更好地反映血糖波動情況,展現出顯著的優勢,是糖尿病患者理想的監測方式。
目前的血糖監測技術主要分為有創、微創和無創三類,而在CGM領域以微創和無創為主要研究方向[11]。近年來,國內外研究者提出了多種血糖監測技術,如圖2所示。
 圖2
CGM主要技術分類
Figure2.
Main technical classification of CGM
圖2
CGM主要技術分類
Figure2.
Main technical classification of CGM
目前,較為熱點的CGM技術包括:光學CGM和電化學CGM。光學CGM是一種無創的血糖監測技術,包括近紅外光譜法、拉曼光譜法、熒光光譜法及光學相干層析成像(optical coherence tomography,OCT)等。近年來,研究人員基于相關技術,提出了多種光學無創血糖監測方法。早在2002年,Larin等[12]就開始通過OCT技術進行無創血糖檢測,臨床研究結果表明,OCT信號的斜率與實際血糖濃度之間存在良好的相關性。2017年,Ali等[13]提出了一種基于可見激光折射率變化的血糖監測方法,該方法通過測定不同波長的激光在透過水和人的手指時的透光率和吸光度,進而選擇出最適波長;該研究發現折射率會隨葡萄糖濃度增加而增加,從而提高光學傳感器的輸出電壓,最終將電壓值轉換為等效的葡萄糖濃度水平,2019年,Rachim等[14]開發了一種基于可見光—近紅外(visible-near infrared,Vis-NIR)的生物傳感器,利用腕部組織血糖濃度變化過程中的動脈血容量脈動信息,結合Vis-NIR光譜法測量反射光信號,并建立反射光信號值與血糖濃度之間的模型,進而就可以得到對應的血糖值。
盡管光學CGM的監測效果表現優異且潛力巨大,但仍需克服靈敏度、穩定性和特異性不足等問題。因此,當前血糖監測的金標準仍是有創或微創檢測。電化學CGM是一種微創血糖監測技術,其原理是在皮下植入生物傳感器,通過傳感器上的酶與組織間液中的葡萄糖發生反應,產生電流信號,并將該電流信號轉換為組織間液中的葡萄糖濃度值[15]。電化學CGM技術具有良好的穩定性、低檢出限、快速響應和操作簡單等優點[16]。
電化學CGM技術自面世以來,經過了20多年的發展,主要分為回顧式CGM、實時CGM以及胰島素泵集成使用三個階段[17-18]。其核心部件是葡萄糖生物傳感器,其靈敏度直接決定了CGM系統的性能和檢測精度,因而成為當前CGM領域的研究熱點之一。Alam等[19]開發了一種基于銅天然氧化物的電化學傳感器,用于汗液葡萄糖檢測。該傳感器通過銅氧化物將葡萄糖電氧化為葡萄糖酸內脂,再轉化為葡萄糖酸,產生氧化電流,并將電流信號轉換為汗液葡萄糖濃度。Parrilla等[20]設計了一種用于葡萄糖透皮電化學監測的可穿戴中空微針傳感貼片,該傳感器采用了葡萄糖氧化酶和普魯士藍/六氰基鐵酸鎳修飾的絲網印刷電極,并在工作電極上沉積了限制擴散的全氟磺酸層,以提高檢測所需的線性度,使得該傳感貼片能夠實現糖尿病患者的可穿戴血糖監測。本課題組也開展了相關研究,采用螺旋型鉑銥合金電極設計,以實現提高植入式葡萄糖生物傳感器的葡萄糖氧化酶擔載量并增大工作電極的電化學活性面積的目的。本課題組所制備的螺旋型傳感器靈敏度在20~30 nA/mmol,可在人體生理條件范圍內線性檢測葡萄糖濃度(2~30 mmol/L)[21]。
隨著CGM技術的不斷發展,其在檢測精度、佩戴舒適度等方面有了顯著提升,部分CGM設備還提供預警功能,使患者能夠更有效應對高血糖或低血糖事件。目前,在商用CGM領域,主要進展是與胰島素泵集成使用,構建閉環胰島素輸送系統,從而更便捷有效地控制血糖[22]。未來,CGM技術還可以與微針等無痛檢測技術及智能手表等可穿戴設備結合,進一步提高用戶體驗。隨著CGM技術的進步,其在糖尿病管理中的應用將越來越廣泛,未來將有更多智能化和個性化的解決方案出現,并有望進一步深入糖尿病患者市場。
2.2 胰島素泵
胰島素泵是用于連續輸注胰島素的醫用設備,其主體結構包括推進注射裝置、胰島素儲藥艙和導管[23]。通過植入皮下組織的輸液導管,胰島素泵可在24 h內以緩慢的基礎率進行胰島素輸注,該速率可根據患者實際情況進行調整。針對患者用餐后出現的血糖升高現象,系統也可以預先設定,根據攝入的碳水化合物量,自動計算出所需胰島素劑量,并在指定的用餐時間進行額外補充給藥,這一過程被稱為餐前大劑量輸注[24]。有研究顯示,經過多項臨床試驗及患者實際使用驗證,與傳統的MDI方式相比,CSII療法能夠顯著改善糖尿病患者的血糖控制[25-28],具體表現在糖化血紅蛋白(HbA1c)和平均血糖水平的控制效果上,且不會產生明顯的不良反應。
目前, CSII療法已經成為許多醫生及T1DM患者的優先選擇,因為胰島素泵的工作模式是模仿人體胰腺生理性分泌胰島素,通過基礎率與大劑量輸注相結合,有效降低患者一天內的血糖波動。研究顯示,血糖波動引發的糖尿病慢性并發癥風險有時要比長期高血糖更高[29],而常規皮下注射很難模擬24 h內的人體正常血糖波動,常常導致在兩次進餐之間因胰島素過量而出現低血糖,而在餐后血糖逐漸達到峰值時胰島素水平較低導致高血糖事件,這會對患者糖尿病并發癥的預防產生不利影響[30]。
美敦力公司于1983年推出的胰島素泵MiniMed 502(Medtronic Inc.,美國)是全球首款通過美國食品藥品監督管理局(food and drug administration,FDA)認證的商用胰島素泵,標志著胰島素泵技術的商業化。此后,坦德姆(Tandem)糖尿病護理公司、銀休特(Insulet)公司和羅氏(Roche)公司等廠家也先后推出了各自的胰島素泵產品[31],并獲得FDA認證。其中,Insulet公司推出的胰島素泵OmniPod(Insulet Corp.,美國)是首款無線胰島素泵,采用貼片式、無管路化設計,將胰島素的存儲、輸送和控制都集成在一個裝置中,無需使用輸液管和輸液針[32]。胰島素泵OmniPod(Insulet Corp.,美國)配備了遠程控制器和手機應用程序,用戶可以使用手機應用程序調整胰島素輸送速率、查看和記錄血糖數據,以及設置提醒功能。這種貼片式、無管路化、可穿戴設計大大提升了患者的使用體驗。
隨著人們對胰島素泵在糖尿病治療中的作用深入了解,胰島素泵的市場規模持續擴大,預計到2030年,全球市場規模將達到200億美元。未來,科技的進步和醫療技術的創新,將推動胰島素泵向智能化和便攜化發展,為糖尿病患者提供更加靈活舒適的血糖管理方案。
2.3 閉環控制算法
在生理上,人體血糖穩態由一個相互連接的負反饋調節回路系統維持,胰腺在胰島α細胞和胰島β細胞的作用下分泌激素,將血糖水平控制在正常范圍內。然而,在實際應用中,由于傳感器檢測和胰島素作用時間之間存在延遲,因此該系統是一個典型的時滯系統。此外,患者的進餐、運動和睡眠等生理因素也會影響血糖水平,這要求系統能夠根據CGM系統反饋的血糖值以及患者的進食量和運動時間等信息,計算出精確的胰島素注射量及注射時間,將患者的血糖控制在正常范圍。其中,閉環控制算法是實現這一目標的關鍵技術[33]。
自閉環式胰島素輸送系統的概念提出以來,國內外許多研究人員先后投入該領域研究。得益于對葡萄糖代謝生理模型的深入研究,閉環控制算法取得了顯著進展,提出并應用的閉環控制算法日益增多。經過數十年的發展,當前的閉環控制算法基本可分為以下幾類:比例—積分—微分(proportional–integral–derivative,PID)控制算法、模型預測控制(model predictive control,MPC)算法和模糊邏輯(fuzzy logical,FL)算法。
2.3.1 PID控制算法
PID控制是一種在工業領域得到廣泛應用的控制器,具有控制原理簡單、魯棒性好和可靠性高的特點。PID控制算法的核心是將比例(proportional)、積分(integral)和微分(derivative)三種控制環節有機結合。通過計算偏差的比例、積分和微分,PID控制器將這三者通過線性組合構成控制量,以此調節被控對象的狀態。在AID系統中,PID控制器根據血糖測量值與設定目標血糖值之間的偏差進行調節:比例分量部分快速響應偏差,確定所需的胰島素輸注量;積分分量部分消除穩態誤差,保證血糖在目標值附近穩定;微分分量部分則預測偏差變化趨勢,以應對血糖變化并進行胰島素輸注量調節[34]。
由于人體對胰島素的反應具有非線性和時變特性,且患者的運動、飲食、情緒變化等都會造成血糖波動,因此,傳統的PID控制算法無法滿足所有患者以及同一患者在不同情況下的血糖控制需求。為此,研究者們開發了多種改進的PID控制算法,如自適應PID控制、神經網絡PID控制等,以提高控制效果。Li等[35]提出了一種基于反向傳播神經網絡調節血糖水平的PID控制算法,對參數進行自適應調整,通過科學計算軟件MATLAB(2006a,MathWorks Inc.,美國)進行仿真驗證,與經典PID控制器比較,該算法響應速度更快,具有更好的控制效果。
盡管改進的PID控制算法在性能上有了顯著提升,但仍難以適應人體復雜的生理動態變化,且由于傳感器時滯等因素,難以實現及時有效的控制。此外,PID控制算法在個體差異的適應能力上的不足,使其控制效果在很大程度上依賴于患者血糖模型的準確度,而建立精準的血糖模型同樣面臨挑戰。盡管PID控制算法在血糖控制領域的研究很早便開始,但在實際應用中仍有較大局限性,因此需要開發一種更精確、更能適應個體差異的血糖控制方法。
2.3.2 MPC算法
MPC算法通過建立系統的數學模型,并根據當前狀態和對未來一段時間內系統狀態的預測進行參數優化,以實現對系統的控制。MPC算法廣泛應用于工業自動化、汽車控制、過程控制等領域,尤其適合于具有時滯、非線性和約束條件的復雜系統。
MPC算法通過預測未來一段時間內的血糖變化趨勢,優化胰島素輸注劑量,可實現對血糖水平的精確控制,決定其控制效果的主要因素是預測模型的準確性。當患者存在個體差異時,使用固定預測模型會帶來較大偏差。因此,需要對MPC算法的參數進行持續調整,以優化預測模型,減小患者差異帶來的影響。針對上述問題,Eren-Oruklu等[36]在MPC的基礎上提出了廣義預測控制(generalized predictive control,GPC)方法,在模型中增加了一個數字濾波器和延遲補償器,以實現動態檢測血糖波動。該模型根據新的血糖值更新模型參數,能夠適用于不同患者,且無需額外的干擾建模和患者手動輸入,可有效改善糖尿病的管理。Wu等[37]基于MPC提出了一種區域MPC策略,設計了基于該策略的血糖控制系統,并通過臨床數據建立虛擬患者來評估系統性能。結果表明,該系統的各項評價指標相較于傳統MPC算法均有所提升,可有效預防低血糖事件發生。
近年來,許多學者提出將機器學習、神經網絡等人工智能(artificial intelligence,AI)技術與MPC結合,綜合MPC的優化策略和機器學習的泛化能力,設計出穩定性更好、預測精度更高的控制系統。但由于部分AI技術(如深度學習技術)的決策過程缺乏透明度,導致其在醫療領域很難被醫生和患者接受,且復雜的模型同時需要大量的計算資源,這在移動設備或實時控制系統中難以實現。因此,盡管將MPC與AI技術結合這一策略在血糖控制領域具有巨大潛力,但實際應用過程仍面臨許多技術挑戰。
2.3.3 FL算法
FL控制本質上是一種基于規則的專家系統,它不依賴于精確的數學模型,而是通過模糊規則來處理糖尿病患者在血糖控制過程中的不確定性和模糊性。將FL控制應用于AID系統時,首先需總結糖尿病臨床治療中的經驗和規則,建立專家知識庫;然后,將臨床經驗中的規則和操作方法、條件轉換為模糊集合,輸入到知識庫中;最后根據CGM監測的實時血糖數據,將其輸入到知識庫中,并基于知識庫中的規則和輸入的模糊集合進行推理,得到相對應的胰島素輸注劑量值。
FL算法的決策推理過程主要依賴于根據臨床經驗所構建的專家知識庫。然而,在構建過程中,對模糊規則和隸屬度函數的選取存在一定的主觀性,導致決策過程的透明性不足。因此,部分學者嘗試將FL控制與MPC結合,利用FL控制對不確定性事件處理的優勢和MPC的優化能力,來提高血糖控制的性能。
3 AID系統的未來發展
當前,全閉環胰島素輸送系統的研究正在全球范圍內開展,AID技術已顯示出在提升血糖控制效果、降低低血糖事件發生概率及改善患者生活質量等方面的潛力。現有研究表明,使用AID系統可有效降低HbA1c,增加葡萄糖目標范圍內時間(time in range,TIR),減少低血糖事件。未來,AID系統有望進一步減少對患者碳水化合物計數、運動數據等其他生理數據的依賴。
為了進一步提高AID設備的普及度,還需要解決多個問題,例如進一步提高CGM設備、胰島素泵與閉環控制算法三者的有機融合。要實現這一目標,首先要解決數據標準化問題,采用統一的數據格式和通信協議,以確保不同設備之間的有效協同。此外,還可以考慮在CGM設備中加入信號處理算法減少噪聲干擾,提高CGM技術的精度;開發新型傳感器材料,并通過預測算法來補償延遲,降低傳感器的延遲時間;利用機器學習技術分析患者歷史生理數據,進行多維度分析,以此構建個性化的血糖預測模型等。
除了商業閉環系統外,自制人工胰腺系統(do-it-yourself artificial pancreas systems,DIYAPS)也受到越來越多的關注,是未來人工胰腺的發展方向之一[38]。DIYAPS將胰島素泵、CGM設備及控制系統整合起來,用戶可以自由選擇所使用的設備品牌和型號。當前主要的DIYAPS主要包括開源人工胰腺系統(open artificial pancreas system,Open APS)、環路(LOOP)和安卓人工胰腺系統(Android artificial pancreas system,Android APS),分別使用小型計算機、蘋果(Apple)設備和安卓(Android)設備作為控制器。
鑒于DIYAPS尚未投入商用,有關其市場效益的研究較少,但與商業閉環系統相比,使用DIYAPS可以有效減輕患者的經濟負擔。然而,DIYAPS的臨床安全性仍需驗證,且對患者的使用要求較高,包括軟硬件的配置調試等,都需要一定的專業門檻。因此,未來需要專業技術人員對患者進行培訓,并由相應機構進行監管,以確保其安全性。
隨著技術的不斷進步,未來的AID系統將更加智能化和個性化,例如利用機器學習等AI技術提高算法的預測能力和自適應性;根據患者的個人情況提供個性化的管理建議等。此外,與可穿戴設備進行更緊密的集成以及雙激素胰島素泵的研發,也是未來的發展方向之一。隨著全球糖尿病患病率的上升,越來越多的企業和研究機構投入其中,市場前景十分廣闊。
AID系統的出現從根本上改變了糖尿病管理的策略,極大地改善了患者的體驗,使其無需再頻繁進行血糖監測和胰島素注射,顯著提升了生活質量,如今已成為T1DM和部分T2DM患者的優選治療方案之一。未來,AID系統的發展將聚焦于技術創新、用戶體驗提升和臨床應用擴展等多個方面。當前投入商用的AID系統多為半閉環和混合閉環系統,要實現全閉環AID系統還需克服諸多挑戰。AID系統的問世與發展切實改善了糖尿病患者的生活,隨著各項核心技術的發展進步,各設備之間的結合應用將變得更加緊密,其整體性能也將不斷提高,逐步為糖尿病患者提供更高質量的血糖管理方案。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:俞志超完成了文獻綜述及文章的撰寫,黃志健、孫宇帆完成了相關文獻搜集、整理工作,朱志剛完成了文章的審閱和校對,李嶄虹、龍建軍協助了稿件的修訂。