膠原蛋白含有豐富的細胞結合基序,有利于細胞的黏附、遷移和分化,維持細胞的活力并促進細胞增殖。然而,純膠原水凝膠存在機械性能差、熱穩定性差和降解快等缺點。大量研究表明采用將膠原蛋白與多糖類天然高分子如海藻酸鹽、殼聚糖、透明質酸、纖維素相結合的方式可以改善其性能。本論文概述了膠原-海藻酸鹽復合水凝膠、膠原-殼聚糖水凝膠、膠原-透明質酸水凝膠、膠原-纖維素水凝膠四種復合水凝膠的研究現狀及其生物應用領域,介紹了四種復合水凝膠的常用制備方法,展望了膠原基復合水凝膠未來的發展方向。
引用本文: 胥美虹, 焦恩祥, 孫子茹, 袁坤山, 馮相蓺, 劉元標, 郭愷, 李坤, 張海軍, 張學海. 膠原基多糖復合水凝膠的制備及在生物醫用領域中的研究進展. 生物醫學工程學雜志, 2024, 41(6): 1286-1292. doi: 10.7507/1001-5515.202407008 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
水凝膠(hydrogel,Gel)是一種通過化學交聯或物理交聯所形成的具有三維網絡結構的親水性聚合物,能夠在水中吸收大量的水分并且可以保持一定的形狀。水凝膠具有良好的生物相容性和生物可降解性。其中生物相容性指的是材料在與身體器官接觸時,對周圍組織的損傷最小,不會引發不良免疫反應,但在醫療中發揮其預期功能的能力[1]。生物可降解性是指物質與生物元素相互作用后分解的能力,因為細胞需要空間來生長、遷移和增殖[2]。此外,水凝膠可以有效模擬天然細胞外基質,通過控制水凝膠的網絡結構(如孔徑大小、孔隙率等)來模擬天然細胞外基質的空間結構,通過使用天然聚合物或設計合成聚合物作為制備水凝膠的基材來模擬天然細胞外基質的功能特性等,在生物醫學領域具有廣泛的應用前景,涉及組織工程、藥物輸送、生物傳感、三維生物打印和傷口愈合等多個方面。
天然大分子是制備生物醫學應用水凝膠的起始材料,膠原蛋白是軟硬結締組織細胞外基質中的主要蛋白質成分。膠原蛋白在維持細胞外基質的結構和生物完整性方面也起著主導作用[3]。此外,各類膠原蛋白的總量占人體所有蛋白質的33%。膠原蛋白水凝膠通常通過冷卻獲得,存在機械性能低、熱穩定性差、降解快等缺點,限制了它們的使用。為了改善水凝膠的性能,研究人員已經開始探索交聯劑的使用,但大多數交聯劑存在細胞毒性等局限性[4],而近期的研究表明,制備生物復合材料可能是一個更有前景的方法。生物復合材料通過將膠原蛋白與其他材料混合,利用其高生物相容性來改善復合材料的機械性能[5]。因此,一些研究人員如Sardroud等[6]已開始利用聚己內酯(polycaprolactone,PCL)來改善膠原材料的力學性能。同時,El Soury等[7]在膠原水凝膠中加入纖維蛋白用以改善其熱穩定性。此外,多糖作為天然的生物材料具有優異的生物相容性以及來源廣泛、價格低廉等優點,膠原蛋白與這些生物活性化合物可以產生協同效應,這類復合材料不僅受益于每種化合物的特性,也受益于它們之間的相互作用。此外,研究表明在膠原基水凝膠中加入其他大分子物質如海藻酸鹽、殼聚糖、透明質酸等生物材料,在改善膠原基水凝膠力學性能的同時也可以提高水凝膠的治療效率。
本文綜述了膠原-天然聚合物水凝膠在生物醫學領域的研究進展,介紹了應用最廣泛的天然聚合物,概述了膠原-天然聚合物水凝膠的制備方法及其在生物醫用領域中的研究進展,重點描述了原料來源廣泛、價格低廉、更利于產業化且應用前景廣闊的四種水凝膠——膠原-海藻酸鹽復合水凝膠、膠原-纖維素復合水凝膠、膠原-殼聚糖復合水凝膠、膠原-透明質酸復合水凝膠。對膠原基水凝膠在給藥、傷口愈合和再生醫學方面的應用進行了綜述和討論,并對未來的發展趨勢提出了展望和總結。
1 膠原-海藻酸鹽復合水凝膠
海藻酸鹽是一種從褐藻中提取的天然多糖,具有可獲得性廣、成本效益高、生物相容性好、細胞毒性弱等優點[8-11],并且在二價陽離子存在下易發生凝膠化。由聚-β-1,4-二氨基苯甲酸(M單位)和α-1,4-L-葡萄糖醛酸(G單位)按不同比例組成,其水溶液具有較強的黏性。與其他材料相比,海藻酸鈉具有獨特的特性,如可降解性、可調節的機械性能,以及在溫和的條件下可以實現溶膠-凝膠的過渡[12]。這些特性使它在生物醫學領域包括藥物輸送、傷口敷料、組織再生和細胞封裝等得到了廣泛的應用[13-16]。由于海藻酸鹽缺乏細胞黏附位點,這在一定程度上限制了它作為生物醫學材料的應用[17]。由于天然膠原具有纖維結構,可作為合成肽(Arg-Gly-Asp,RGD)的黏附位點,因此海藻酸鹽-膠原復合水凝膠表現出一系列優良特性,包括縮短凝膠時間、增強機械強度、提高生物降解性以及降低免疫原性,可以為間充質干細胞提供更有利的生長環境,以及促進全層創面愈合。因此,這種復合水凝膠材料具有廣闊的應用前景。
膠原-海藻酸鈉復合水凝膠通常采用Ca2+交聯的方式制備,即將由氯化鈣(CaCl2)形成的鈣離子水溶液滴入海藻酸鈉溶液,隨著Ca2+濃度的增加,復合水凝膠的剛度逐漸增強,細胞黏附配體也隨著膠原濃度的增加而增加[18]。膠原-海藻酸鹽復合水凝膠可以充分模擬天然的細胞外基質結構,為細胞提供類似于體內的生長環境。利用膠原-海藻酸鹽復合水凝膠的這一特性,Wang等[19]通過Ca2+交聯制備了具有可調剛度的膠原-海藻酸鹽水凝膠,用于研究細胞外基質剛度對人乳腺癌細胞MDA-MD-231體積和遷移的影響,通過調節細胞體積穩態來調節細胞遷移行為,這可能為探索癌癥轉移和細胞機械轉導的潛在機制提供了新的視角。Zheng等[20]也利用上述方法制備了不同比例的膠原-海藻酸鹽復合水凝膠,1%的低黏度海藻酸鈉溶液在30%的膠原蛋白中攪拌數小時,將得到的溶液經孔徑0.22 μm的膜過濾消毒后,與人乳腺癌細胞MCF-7混合。將細胞懸浮液滴入膠原-海藻酸鹽溶液中,用23號針輕輕送入含有等滲氯化鈣溶液的凝膠浴中。海藻酸鹽液滴一旦與氯化鈣接觸就會凝結。在電場電壓的調節下,形成直徑1~3 mm的微球,每個微球約包被2 × 104個細胞。將人乳腺癌細胞MCF-7包封的復合水凝膠在培養基中培養48 h,構建人乳腺癌細胞MCF-7球體。結果表明,當膠原∶海藻酸鹽的比例為30∶1時,能夠為乳腺癌細胞的體外生長提供合適的環境,從而構建三維細胞培養模型,用以開發新的抗腫瘤藥物和治療乳腺癌的療法。
為改善膠原-海藻酸鹽復合水凝膠的力學性能,擴展其生物領域的應用,使之適用于不同的醫療和生物工程應用,通常在膠原-海藻酸鹽水凝膠中加入其他生物活性物質(如加入納米羥基磷灰石以增強其力學性能)或抗腫瘤、抗氧化的藥物等。如圖1所示,Mei等[21]將光熱藥物亞甲基藍(methylene blue,MB)和免疫藥物咪喹莫特(R837)包封于可注射的自組裝膠原/海藻酸鹽水凝膠中,制備了具有剪切變薄和自愈特性的膠原/海藻酸鹽水凝膠。形成的水凝膠可以使治療藥物長時間保持在所需的病變部位,從而實現局部可持續的藥物釋放。通過MB和R837的協同作用,聯合光熱治療(photothermal therapy,PTT)和免疫治療顯著提高了抗腫瘤療效。
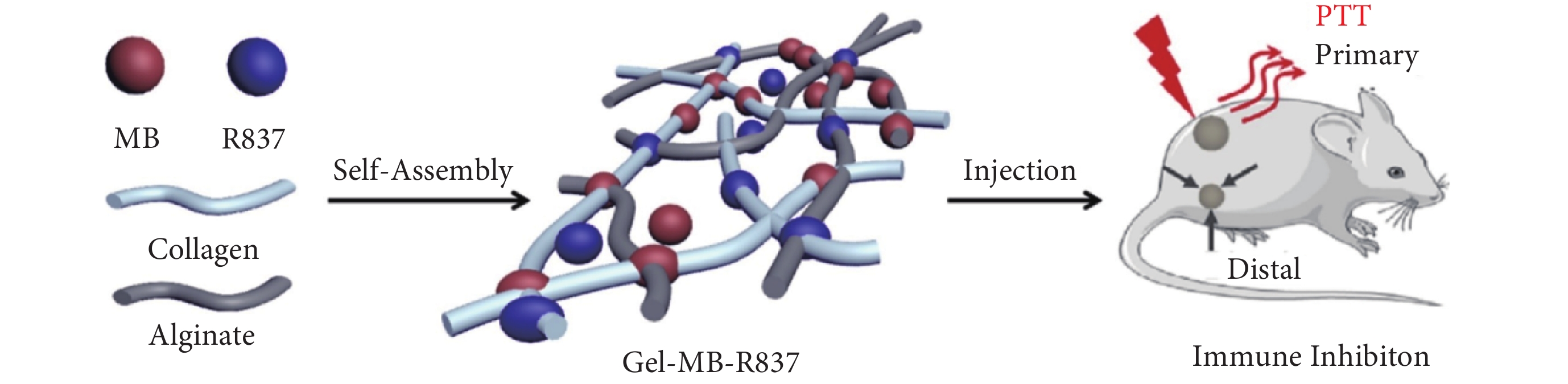 圖1
包封MB和R837的自組裝膠原/海藻酸鹽復合水凝膠利用光熱-免疫聯合腫瘤治療[21]
Figure1.
Schematic illustration of the self-assembled collagen/alginate hybrid hydrogel with encapsulation of MB and R837 for combinatorial photothermal and immuno tumor therapy
圖1
包封MB和R837的自組裝膠原/海藻酸鹽復合水凝膠利用光熱-免疫聯合腫瘤治療[21]
Figure1.
Schematic illustration of the self-assembled collagen/alginate hybrid hydrogel with encapsulation of MB and R837 for combinatorial photothermal and immuno tumor therapy
reprinted with permission from ref. [21] (Mei et al. 2019). Copyright 2019 Elsevier Press
2 膠原-殼聚糖復合水凝膠
殼聚糖作為一種天然的多糖類聚合物,具有來源廣泛、無細胞毒性和具有負電性等優點,在生物醫用領域具有廣泛的應用價值[22]。殼聚糖中存在的N-乙酰基D-氨基葡萄糖等基本結構單元是哺乳動物細胞外基質的主要成分之一[23-24]。基于以上優點,殼聚糖被廣泛應用于生物醫學領域。此外,殼聚糖可在水凝膠形成共價鍵,從而提高其機械性能和穩定性[25]。當殼聚糖與膠原蛋白結合時,膠原蛋白的羰基和殼聚糖的氨基之間形成靜電相互作用,此外,其余不解離的氨基羧基和銨基形成氫鍵相互作用,兩種生物聚合物之間的物理相互作用是其機械性能得到提高的重要原因[26]。
復合水凝膠的性能受多種因素的影響,包括溶液的pH值、交聯溫度、交聯劑,進而影響水凝膠的凝膠化程度。Sánchez-Cid等[27]通過物理交聯制備了膠原-殼聚糖復合水凝膠,通過調控溶液的pH值以及溫度來控制膠原蛋白和殼聚糖的凝膠化程度,制備了具有生物相容性和耐熱性的水凝膠。其中,pH值的變化(將pH值從3.2調整至7.0)會導致殼聚糖凝膠化,而溫度的降低則有助于膠原蛋白的凝膠化。在實驗中,先使殼聚糖凝膠化,隨后膠原蛋白凝膠化,這種順序能夠產生膠原蛋白和殼聚糖之間的協同作用。膠原蛋白和殼聚糖在復合水凝膠中的結合改善了單體體系的特性。通過這種方式,獲得了具有殼聚糖熱穩定性的系統,而不影響膠原蛋白在中性pH下的生物相容性。
眾所周知,天然細胞外基質中存在膠原以及糖胺聚糖,因此,通過調控膠原/殼聚糖的比例可以達到模擬骨和軟骨組織細胞外基質結構的效果。Deepthi等[28]制備了多孔性的殼聚糖-膠原復合水凝膠模擬腱鞘結構,應用于屈肌腱再生。由于其柔軟的性質,水凝膠可以模擬肌腱鞘,為細胞生長提供環境,并允許營養物質和細胞廢物通過彈性網絡擴散。殼聚糖是肌腱細胞外基質中發現的糖胺聚糖的結構類似物,也能加速細胞增殖。如圖2所示,采用靜電紡絲法制備了聚乳酸定向納米纖維,模擬排列的膠原纖維束。將殼聚糖-膠原復合水凝膠包覆于靜電紡絲膜上,外涂海藻酸鹽凝膠形成肌腱結構。
Sparks等[29]發現QHREDGS肽修飾的膠原-殼聚糖水凝膠(q肽水凝膠)的單一處理可以提高傷口愈合率,其中,QHREDGS肽與殼聚糖偶聯之后與膠原蛋白進行1∶1的混合。結果表明,修飾之后的水凝膠在支持角化細胞和成纖維細胞存活的同時,還能夠調節生物力學性能,使愈合組織更柔順,并且沒有明顯的負面影響,并將這一結果在大型動物模型中進行了驗證。
3 膠原-透明質酸復合水凝膠
透明質酸是目前組織工程中應用最廣泛的一種非磺化糖胺聚糖,具有優良的生物相容性、高吸水性、機械性能可調等優點,易于處理和修飾[30]。通過交聯透明質酸可控制細胞相互作用,尤其是它們的擴散和遷移行為。由膠原蛋白和透明質酸制備的復合水凝膠在模仿天然細胞外基質的結構和功能方面具有固有的優勢,在組織工程中具有廣泛的適用性。
磺化的透明質酸水凝膠可以隔離和釋放生長因子,指導并驅動干細胞分化行為,在治療慢性傷口和炎癥方面特別具有前景[31]。通過化學修飾使透明質酸含有硫酸鹽基團,并增加其負電荷,可促進透明質酸-膠原水凝膠結合生長因子,提高維持組織再生的能力。
關節軟骨主要由非磺化糖胺聚糖和膠原蛋白組成,因此在膠原支架中加入透明質酸可以模擬關節軟骨的細胞外基質結構,促進骨髓間充質干細胞向軟骨細胞分化,具有減震和機械負荷特性[32-34]。此外,在透明質酸-膠原水凝膠支架中加入生物活性因子可以彌補細胞親和力,提高細胞生物活性。然而,直接加入這些生物活性因子具有成本較高、有效時間短以及可能引發副作用等問題。Yuan等[35]將一種名為淫羊藿苷(icariin,Ica)的黃酮醇苷與透明質酸/膠原蛋白(HA/Col)水凝膠化學偶聯,水凝膠中被固定的淫羊藿苷逐漸釋放,能夠長效維持軟骨細胞形態并促進軟骨基質的生物合成。
除促進軟骨細胞的生長外,膠原-透明質酸復合水凝膠在藥物輸送方面也有著潛在的應用價值。Rodler等[36]合成并表征了膠原-透明質酸雜化網絡,用于模擬脂肪組織細胞外基質,如圖3所示為巰基和甲基丙烯酰基修飾的前體的分子結構,通過巰基-邁克爾和巰基-烯的光點擊反應,將甲基丙烯酰官能團化的Ⅰ型膠原與巰基功能化的透明質酸共價交聯形成網絡。研究蛋白質藥物在皮下間質空間的轉運,證明膠原-透明質酸是藥物轉運的理想體系。
在膠原-透明質酸水凝膠的基礎上,Jia等[37]還研制出了一種pH響應的“雙氫鍵”(氫鍵和腙鍵)透明質酸-膠原蛋白水凝膠。如圖4所示,其中一部分透明質酸用1-乙基-3-(3-二甲氨基丙基)碳二亞胺(EDC)和羥基苯并三唑(HOBT)活化羧基,另外一部分透明質酸用高碘酸鈉來氧化,隨后,將兩種透明質酸原液以及二甲雙胍負載的明膠微球進行混合,通過氫鍵和腙鍵的作用在5 min內快速凝膠化。在糖尿病創面的酸性炎癥微環境中,腙鍵被解鎖,二甲雙胍和膠原蛋白逐漸釋放。其中,二甲雙胍可以影響巨噬細胞的極化狀態,使巨噬細胞從M1向M2極化,從而加速成纖維細胞在高糖環境下的遷移和膠原蛋白的產生,進而支持細胞外基質的形成和沉積,加速傷口愈合過程。
4 膠原-纖維素復合水凝膠
纖維素作為自然界中分布最廣、含量最豐富的生物質多糖類聚合物,具有力學性能好、吸水性強、生物相容性好和易改性等性能。纖維素重復單元中含有大量的羥基,通過對之進行改性可以獲得一系列具有特殊性能的纖維素衍生物。此外,借助纖維素和纖維素衍生物優越的力學性能,通過與膠原蛋白復合,可以改善膠原蛋白的脆性問題和熱穩定性,從而擴展其應用范圍[38-39]。
張霞等[40]通過對纖維素進行氧化,得到醛基化的氧化纖維素,氧化纖維素中的醛基與膠原分子鏈上的氨基發生反應,制備出氧化纖維素改性的膠原水凝膠,與純膠原水凝膠相比,改性膠原水凝膠的力學性能和熱穩定性都得到了提高。
在生物體內,膠原蛋白通過分子間疏水作用、氫鍵、離子鍵等相互作用可形成微纖維,微纖維再進一步聚集成膠原纖維,從而為皮膚、跟腱、瓣膜等組織提供強大的生物力學性能。例如,依據膠原自組裝原理制備的納米復合水凝膠就是利用膠原蛋白與纖維素之間的氫鍵作用將膠原蛋白分子與纖維素納米晶體(cellulose nanocrystals,CNC)進行結合。與纖維素納米晶體結合后,不僅可以保留膠原蛋白的三螺旋結構,還可以顯著增強膠原蛋白的熱穩定性和儲存模量。
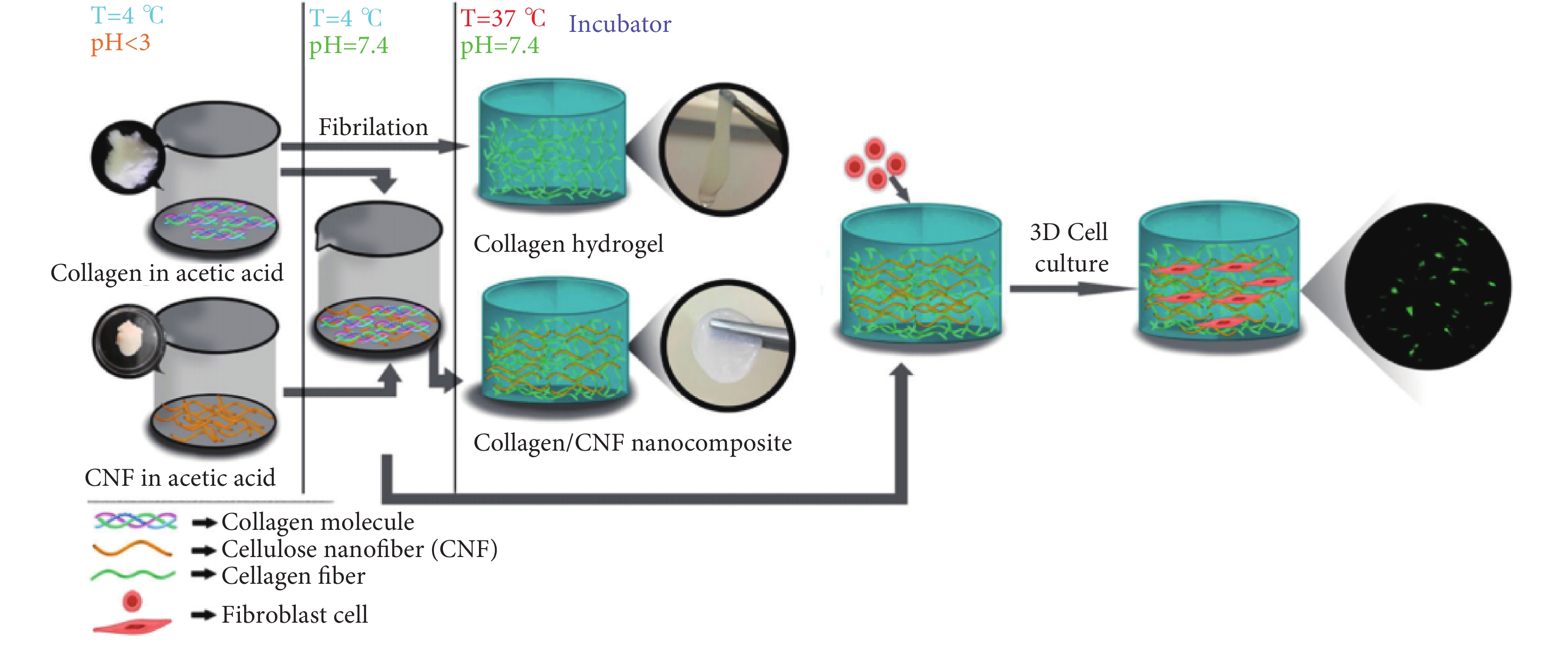
具有極高抗拉強度和剛性的纖維素納米纖維(cellulose nanofibers,CNF)常被用作聚合物基體的增強材料來提高復合材料的力學性能。如圖5所示,Lohrasbi等[41]將纖維素納米纖維添加到膠原蛋白溶液中,然后進行物理凝膠化過程,通過增加pH值和溫度,制備了以纖維素納米纖維為增強相、膠原蛋白為基質的復合水凝膠。在纖維素納米纖維的存在下,膠原水凝膠表現出組織良好的多孔結構、較低的凝膠化時間、較高的保水能力、較低的降解、較高的溶脹率和較高的壓縮強度,可用于三維細胞的培養。
細菌納米纖維素作為一種很有潛力的新型生物材料,不僅具有良好的生物親和性、相容性、降解性、適應性,且無過敏反應,還具有較高的持水性,在潮濕時具有高彈性模量和抗拉強度[42]。Moraes等[43]制備了新型細菌纖維素/膠原水凝膠傷口敷料,膠原蛋白提供了組織基質的強度和完整性,與市售的膠原酶軟膏相比,克服了膠原酶軟膏在傷口床上黏附性低的缺點,易于在傷口床上涂抹和黏附,可以控制傷口滲出液并為傷口愈合提供濕潤的環境,從而實現更快的組織修復。
5 展望
膠原-海藻酸鹽、膠原-殼聚糖、膠原-透明質酸和膠原-纖維素復合水凝膠具有可調的機械性能以及良好的熱穩定性和生物相容性等優點,在組織工程和生物醫學領域顯示出巨大的潛力。此外,膠原基復合水凝膠通過與其他藥物、生物活性因子和納米顆粒結合,可以獲得更好的生物應用性。然而,膠原基多糖復合水凝膠還存在著一些缺點,機械穩定性有限,對環境變化較為敏感,制備過程比較復雜,載藥能力有限且降解速度難以精確控制。未來,研發新型膠原基材料并利用新技術以提高其仿生性能將是關鍵。例如,利用立體光刻技術制造出孔徑可控的混合膠原-支架,利用噴墨生物打印和閥噴生物打印獲得混合膠原蛋白生物材料等。膠原基復合水凝膠在骨組織工程、腫瘤治療、傷口愈合、心臟組織工程、藥物遞送等各領域具有廣泛的潛在應用價值。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:胥美虹、焦恩祥和孫子茹負責撰寫論文初稿;張海軍和焦恩祥負責指導和修改;胥美虹、袁坤山、馮相蓺、劉元標、郭愷和李坤參與修改;張學海負責審校。
0 引言
水凝膠(hydrogel,Gel)是一種通過化學交聯或物理交聯所形成的具有三維網絡結構的親水性聚合物,能夠在水中吸收大量的水分并且可以保持一定的形狀。水凝膠具有良好的生物相容性和生物可降解性。其中生物相容性指的是材料在與身體器官接觸時,對周圍組織的損傷最小,不會引發不良免疫反應,但在醫療中發揮其預期功能的能力[1]。生物可降解性是指物質與生物元素相互作用后分解的能力,因為細胞需要空間來生長、遷移和增殖[2]。此外,水凝膠可以有效模擬天然細胞外基質,通過控制水凝膠的網絡結構(如孔徑大小、孔隙率等)來模擬天然細胞外基質的空間結構,通過使用天然聚合物或設計合成聚合物作為制備水凝膠的基材來模擬天然細胞外基質的功能特性等,在生物醫學領域具有廣泛的應用前景,涉及組織工程、藥物輸送、生物傳感、三維生物打印和傷口愈合等多個方面。
天然大分子是制備生物醫學應用水凝膠的起始材料,膠原蛋白是軟硬結締組織細胞外基質中的主要蛋白質成分。膠原蛋白在維持細胞外基質的結構和生物完整性方面也起著主導作用[3]。此外,各類膠原蛋白的總量占人體所有蛋白質的33%。膠原蛋白水凝膠通常通過冷卻獲得,存在機械性能低、熱穩定性差、降解快等缺點,限制了它們的使用。為了改善水凝膠的性能,研究人員已經開始探索交聯劑的使用,但大多數交聯劑存在細胞毒性等局限性[4],而近期的研究表明,制備生物復合材料可能是一個更有前景的方法。生物復合材料通過將膠原蛋白與其他材料混合,利用其高生物相容性來改善復合材料的機械性能[5]。因此,一些研究人員如Sardroud等[6]已開始利用聚己內酯(polycaprolactone,PCL)來改善膠原材料的力學性能。同時,El Soury等[7]在膠原水凝膠中加入纖維蛋白用以改善其熱穩定性。此外,多糖作為天然的生物材料具有優異的生物相容性以及來源廣泛、價格低廉等優點,膠原蛋白與這些生物活性化合物可以產生協同效應,這類復合材料不僅受益于每種化合物的特性,也受益于它們之間的相互作用。此外,研究表明在膠原基水凝膠中加入其他大分子物質如海藻酸鹽、殼聚糖、透明質酸等生物材料,在改善膠原基水凝膠力學性能的同時也可以提高水凝膠的治療效率。
本文綜述了膠原-天然聚合物水凝膠在生物醫學領域的研究進展,介紹了應用最廣泛的天然聚合物,概述了膠原-天然聚合物水凝膠的制備方法及其在生物醫用領域中的研究進展,重點描述了原料來源廣泛、價格低廉、更利于產業化且應用前景廣闊的四種水凝膠——膠原-海藻酸鹽復合水凝膠、膠原-纖維素復合水凝膠、膠原-殼聚糖復合水凝膠、膠原-透明質酸復合水凝膠。對膠原基水凝膠在給藥、傷口愈合和再生醫學方面的應用進行了綜述和討論,并對未來的發展趨勢提出了展望和總結。
1 膠原-海藻酸鹽復合水凝膠
海藻酸鹽是一種從褐藻中提取的天然多糖,具有可獲得性廣、成本效益高、生物相容性好、細胞毒性弱等優點[8-11],并且在二價陽離子存在下易發生凝膠化。由聚-β-1,4-二氨基苯甲酸(M單位)和α-1,4-L-葡萄糖醛酸(G單位)按不同比例組成,其水溶液具有較強的黏性。與其他材料相比,海藻酸鈉具有獨特的特性,如可降解性、可調節的機械性能,以及在溫和的條件下可以實現溶膠-凝膠的過渡[12]。這些特性使它在生物醫學領域包括藥物輸送、傷口敷料、組織再生和細胞封裝等得到了廣泛的應用[13-16]。由于海藻酸鹽缺乏細胞黏附位點,這在一定程度上限制了它作為生物醫學材料的應用[17]。由于天然膠原具有纖維結構,可作為合成肽(Arg-Gly-Asp,RGD)的黏附位點,因此海藻酸鹽-膠原復合水凝膠表現出一系列優良特性,包括縮短凝膠時間、增強機械強度、提高生物降解性以及降低免疫原性,可以為間充質干細胞提供更有利的生長環境,以及促進全層創面愈合。因此,這種復合水凝膠材料具有廣闊的應用前景。
膠原-海藻酸鈉復合水凝膠通常采用Ca2+交聯的方式制備,即將由氯化鈣(CaCl2)形成的鈣離子水溶液滴入海藻酸鈉溶液,隨著Ca2+濃度的增加,復合水凝膠的剛度逐漸增強,細胞黏附配體也隨著膠原濃度的增加而增加[18]。膠原-海藻酸鹽復合水凝膠可以充分模擬天然的細胞外基質結構,為細胞提供類似于體內的生長環境。利用膠原-海藻酸鹽復合水凝膠的這一特性,Wang等[19]通過Ca2+交聯制備了具有可調剛度的膠原-海藻酸鹽水凝膠,用于研究細胞外基質剛度對人乳腺癌細胞MDA-MD-231體積和遷移的影響,通過調節細胞體積穩態來調節細胞遷移行為,這可能為探索癌癥轉移和細胞機械轉導的潛在機制提供了新的視角。Zheng等[20]也利用上述方法制備了不同比例的膠原-海藻酸鹽復合水凝膠,1%的低黏度海藻酸鈉溶液在30%的膠原蛋白中攪拌數小時,將得到的溶液經孔徑0.22 μm的膜過濾消毒后,與人乳腺癌細胞MCF-7混合。將細胞懸浮液滴入膠原-海藻酸鹽溶液中,用23號針輕輕送入含有等滲氯化鈣溶液的凝膠浴中。海藻酸鹽液滴一旦與氯化鈣接觸就會凝結。在電場電壓的調節下,形成直徑1~3 mm的微球,每個微球約包被2 × 104個細胞。將人乳腺癌細胞MCF-7包封的復合水凝膠在培養基中培養48 h,構建人乳腺癌細胞MCF-7球體。結果表明,當膠原∶海藻酸鹽的比例為30∶1時,能夠為乳腺癌細胞的體外生長提供合適的環境,從而構建三維細胞培養模型,用以開發新的抗腫瘤藥物和治療乳腺癌的療法。
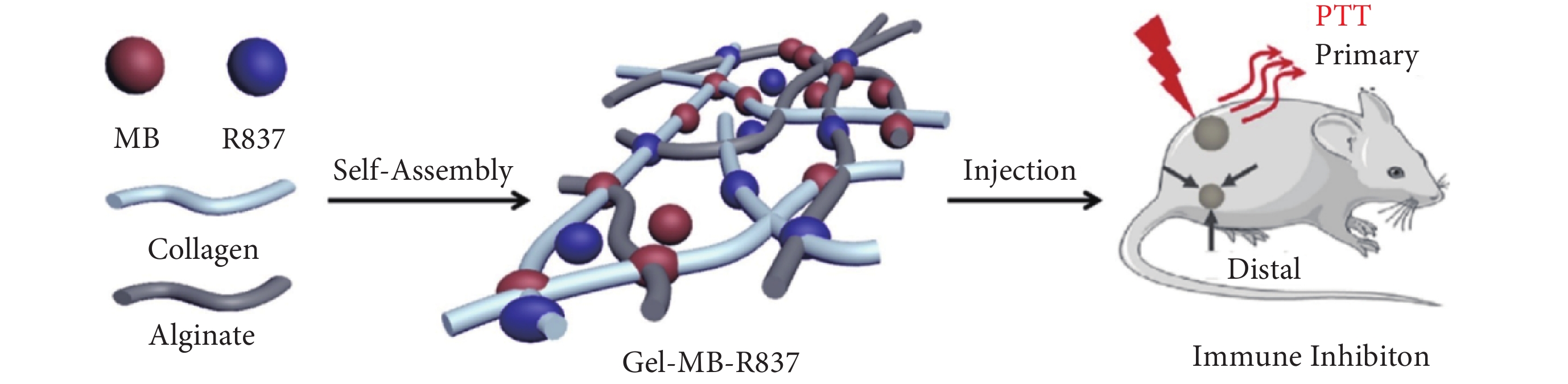
為改善膠原-海藻酸鹽復合水凝膠的力學性能,擴展其生物領域的應用,使之適用于不同的醫療和生物工程應用,通常在膠原-海藻酸鹽水凝膠中加入其他生物活性物質(如加入納米羥基磷灰石以增強其力學性能)或抗腫瘤、抗氧化的藥物等。如圖1所示,Mei等[21]將光熱藥物亞甲基藍(methylene blue,MB)和免疫藥物咪喹莫特(R837)包封于可注射的自組裝膠原/海藻酸鹽水凝膠中,制備了具有剪切變薄和自愈特性的膠原/海藻酸鹽水凝膠。形成的水凝膠可以使治療藥物長時間保持在所需的病變部位,從而實現局部可持續的藥物釋放。通過MB和R837的協同作用,聯合光熱治療(photothermal therapy,PTT)和免疫治療顯著提高了抗腫瘤療效。
 圖1
包封MB和R837的自組裝膠原/海藻酸鹽復合水凝膠利用光熱-免疫聯合腫瘤治療[21]
Figure1.
Schematic illustration of the self-assembled collagen/alginate hybrid hydrogel with encapsulation of MB and R837 for combinatorial photothermal and immuno tumor therapy
圖1
包封MB和R837的自組裝膠原/海藻酸鹽復合水凝膠利用光熱-免疫聯合腫瘤治療[21]
Figure1.
Schematic illustration of the self-assembled collagen/alginate hybrid hydrogel with encapsulation of MB and R837 for combinatorial photothermal and immuno tumor therapy
reprinted with permission from ref. [21] (Mei et al. 2019). Copyright 2019 Elsevier Press
2 膠原-殼聚糖復合水凝膠
殼聚糖作為一種天然的多糖類聚合物,具有來源廣泛、無細胞毒性和具有負電性等優點,在生物醫用領域具有廣泛的應用價值[22]。殼聚糖中存在的N-乙酰基D-氨基葡萄糖等基本結構單元是哺乳動物細胞外基質的主要成分之一[23-24]。基于以上優點,殼聚糖被廣泛應用于生物醫學領域。此外,殼聚糖可在水凝膠形成共價鍵,從而提高其機械性能和穩定性[25]。當殼聚糖與膠原蛋白結合時,膠原蛋白的羰基和殼聚糖的氨基之間形成靜電相互作用,此外,其余不解離的氨基羧基和銨基形成氫鍵相互作用,兩種生物聚合物之間的物理相互作用是其機械性能得到提高的重要原因[26]。
復合水凝膠的性能受多種因素的影響,包括溶液的pH值、交聯溫度、交聯劑,進而影響水凝膠的凝膠化程度。Sánchez-Cid等[27]通過物理交聯制備了膠原-殼聚糖復合水凝膠,通過調控溶液的pH值以及溫度來控制膠原蛋白和殼聚糖的凝膠化程度,制備了具有生物相容性和耐熱性的水凝膠。其中,pH值的變化(將pH值從3.2調整至7.0)會導致殼聚糖凝膠化,而溫度的降低則有助于膠原蛋白的凝膠化。在實驗中,先使殼聚糖凝膠化,隨后膠原蛋白凝膠化,這種順序能夠產生膠原蛋白和殼聚糖之間的協同作用。膠原蛋白和殼聚糖在復合水凝膠中的結合改善了單體體系的特性。通過這種方式,獲得了具有殼聚糖熱穩定性的系統,而不影響膠原蛋白在中性pH下的生物相容性。
眾所周知,天然細胞外基質中存在膠原以及糖胺聚糖,因此,通過調控膠原/殼聚糖的比例可以達到模擬骨和軟骨組織細胞外基質結構的效果。Deepthi等[28]制備了多孔性的殼聚糖-膠原復合水凝膠模擬腱鞘結構,應用于屈肌腱再生。由于其柔軟的性質,水凝膠可以模擬肌腱鞘,為細胞生長提供環境,并允許營養物質和細胞廢物通過彈性網絡擴散。殼聚糖是肌腱細胞外基質中發現的糖胺聚糖的結構類似物,也能加速細胞增殖。如圖2所示,采用靜電紡絲法制備了聚乳酸定向納米纖維,模擬排列的膠原纖維束。將殼聚糖-膠原復合水凝膠包覆于靜電紡絲膜上,外涂海藻酸鹽凝膠形成肌腱結構。
Sparks等[29]發現QHREDGS肽修飾的膠原-殼聚糖水凝膠(q肽水凝膠)的單一處理可以提高傷口愈合率,其中,QHREDGS肽與殼聚糖偶聯之后與膠原蛋白進行1∶1的混合。結果表明,修飾之后的水凝膠在支持角化細胞和成纖維細胞存活的同時,還能夠調節生物力學性能,使愈合組織更柔順,并且沒有明顯的負面影響,并將這一結果在大型動物模型中進行了驗證。
3 膠原-透明質酸復合水凝膠
透明質酸是目前組織工程中應用最廣泛的一種非磺化糖胺聚糖,具有優良的生物相容性、高吸水性、機械性能可調等優點,易于處理和修飾[30]。通過交聯透明質酸可控制細胞相互作用,尤其是它們的擴散和遷移行為。由膠原蛋白和透明質酸制備的復合水凝膠在模仿天然細胞外基質的結構和功能方面具有固有的優勢,在組織工程中具有廣泛的適用性。
磺化的透明質酸水凝膠可以隔離和釋放生長因子,指導并驅動干細胞分化行為,在治療慢性傷口和炎癥方面特別具有前景[31]。通過化學修飾使透明質酸含有硫酸鹽基團,并增加其負電荷,可促進透明質酸-膠原水凝膠結合生長因子,提高維持組織再生的能力。
關節軟骨主要由非磺化糖胺聚糖和膠原蛋白組成,因此在膠原支架中加入透明質酸可以模擬關節軟骨的細胞外基質結構,促進骨髓間充質干細胞向軟骨細胞分化,具有減震和機械負荷特性[32-34]。此外,在透明質酸-膠原水凝膠支架中加入生物活性因子可以彌補細胞親和力,提高細胞生物活性。然而,直接加入這些生物活性因子具有成本較高、有效時間短以及可能引發副作用等問題。Yuan等[35]將一種名為淫羊藿苷(icariin,Ica)的黃酮醇苷與透明質酸/膠原蛋白(HA/Col)水凝膠化學偶聯,水凝膠中被固定的淫羊藿苷逐漸釋放,能夠長效維持軟骨細胞形態并促進軟骨基質的生物合成。
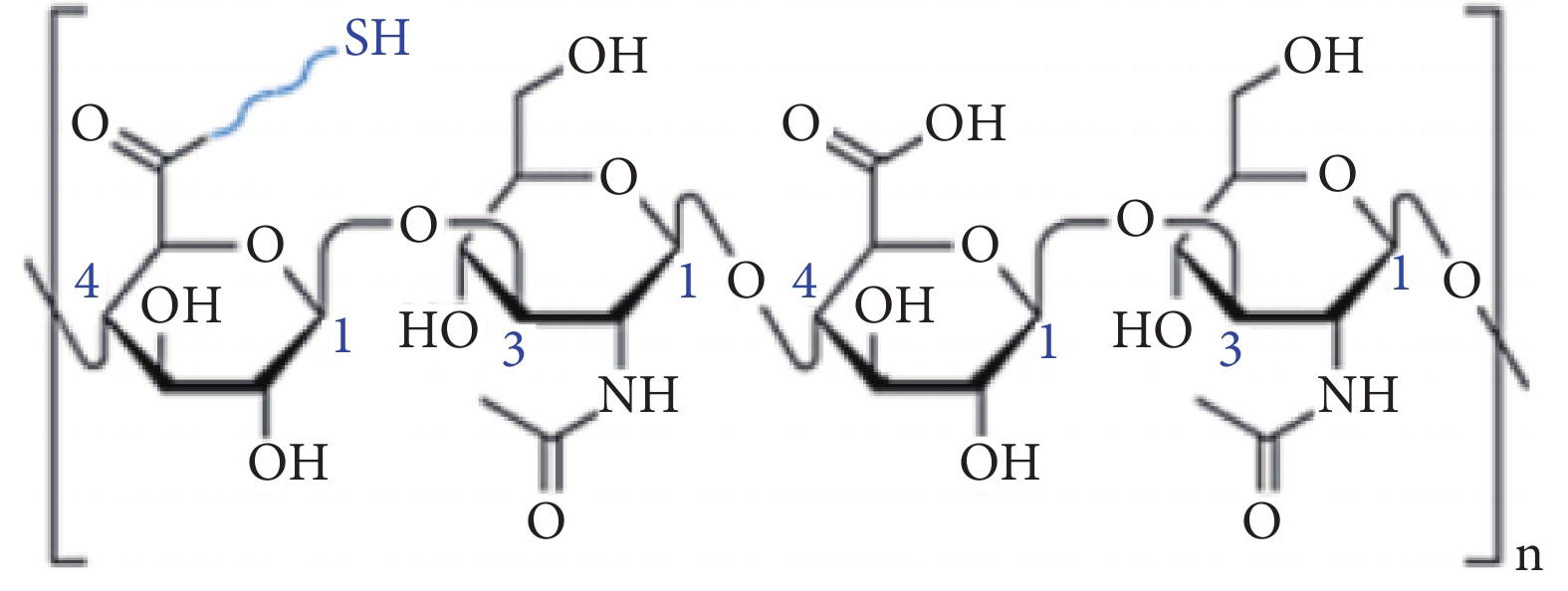
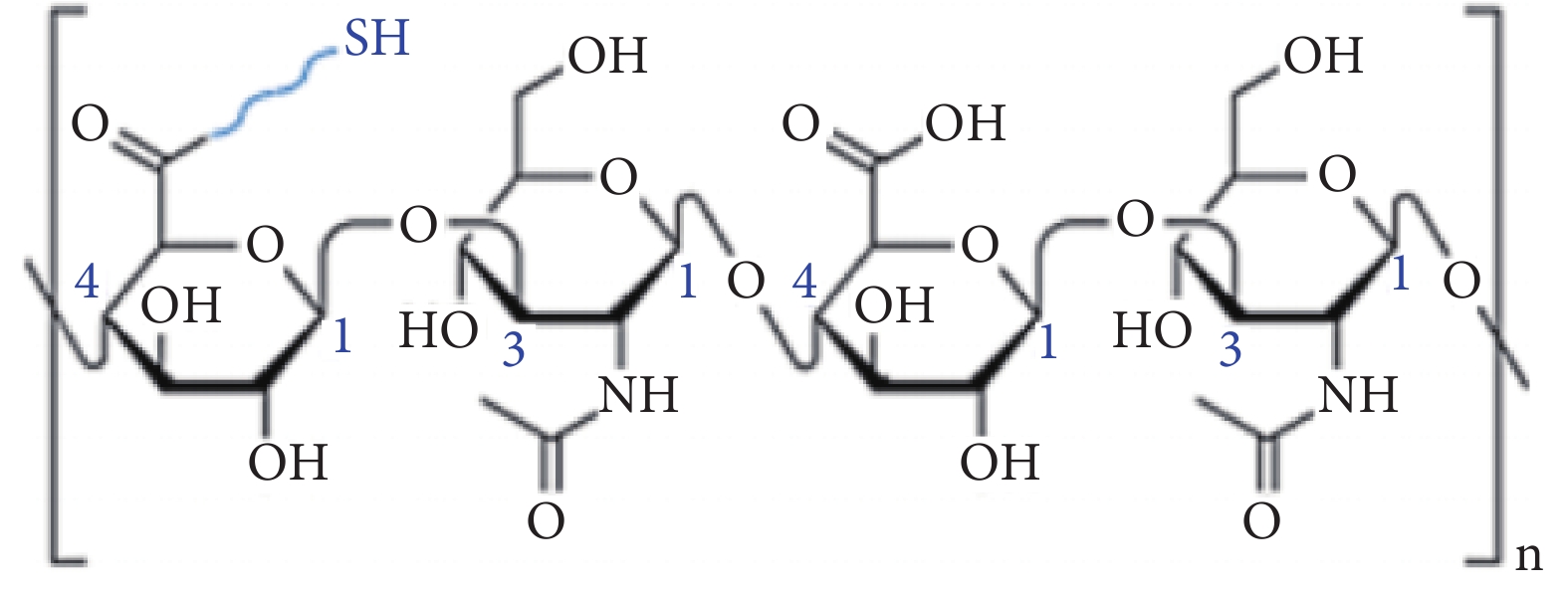
除促進軟骨細胞的生長外,膠原-透明質酸復合水凝膠在藥物輸送方面也有著潛在的應用價值。Rodler等[36]合成并表征了膠原-透明質酸雜化網絡,用于模擬脂肪組織細胞外基質,如圖3所示為巰基和甲基丙烯酰基修飾的前體的分子結構,通過巰基-邁克爾和巰基-烯的光點擊反應,將甲基丙烯酰官能團化的Ⅰ型膠原與巰基功能化的透明質酸共價交聯形成網絡。研究蛋白質藥物在皮下間質空間的轉運,證明膠原-透明質酸是藥物轉運的理想體系。
在膠原-透明質酸水凝膠的基礎上,Jia等[37]還研制出了一種pH響應的“雙氫鍵”(氫鍵和腙鍵)透明質酸-膠原蛋白水凝膠。如圖4所示,其中一部分透明質酸用1-乙基-3-(3-二甲氨基丙基)碳二亞胺(EDC)和羥基苯并三唑(HOBT)活化羧基,另外一部分透明質酸用高碘酸鈉來氧化,隨后,將兩種透明質酸原液以及二甲雙胍負載的明膠微球進行混合,通過氫鍵和腙鍵的作用在5 min內快速凝膠化。在糖尿病創面的酸性炎癥微環境中,腙鍵被解鎖,二甲雙胍和膠原蛋白逐漸釋放。其中,二甲雙胍可以影響巨噬細胞的極化狀態,使巨噬細胞從M1向M2極化,從而加速成纖維細胞在高糖環境下的遷移和膠原蛋白的產生,進而支持細胞外基質的形成和沉積,加速傷口愈合過程。
4 膠原-纖維素復合水凝膠
纖維素作為自然界中分布最廣、含量最豐富的生物質多糖類聚合物,具有力學性能好、吸水性強、生物相容性好和易改性等性能。纖維素重復單元中含有大量的羥基,通過對之進行改性可以獲得一系列具有特殊性能的纖維素衍生物。此外,借助纖維素和纖維素衍生物優越的力學性能,通過與膠原蛋白復合,可以改善膠原蛋白的脆性問題和熱穩定性,從而擴展其應用范圍[38-39]。
張霞等[40]通過對纖維素進行氧化,得到醛基化的氧化纖維素,氧化纖維素中的醛基與膠原分子鏈上的氨基發生反應,制備出氧化纖維素改性的膠原水凝膠,與純膠原水凝膠相比,改性膠原水凝膠的力學性能和熱穩定性都得到了提高。
在生物體內,膠原蛋白通過分子間疏水作用、氫鍵、離子鍵等相互作用可形成微纖維,微纖維再進一步聚集成膠原纖維,從而為皮膚、跟腱、瓣膜等組織提供強大的生物力學性能。例如,依據膠原自組裝原理制備的納米復合水凝膠就是利用膠原蛋白與纖維素之間的氫鍵作用將膠原蛋白分子與纖維素納米晶體(cellulose nanocrystals,CNC)進行結合。與纖維素納米晶體結合后,不僅可以保留膠原蛋白的三螺旋結構,還可以顯著增強膠原蛋白的熱穩定性和儲存模量。
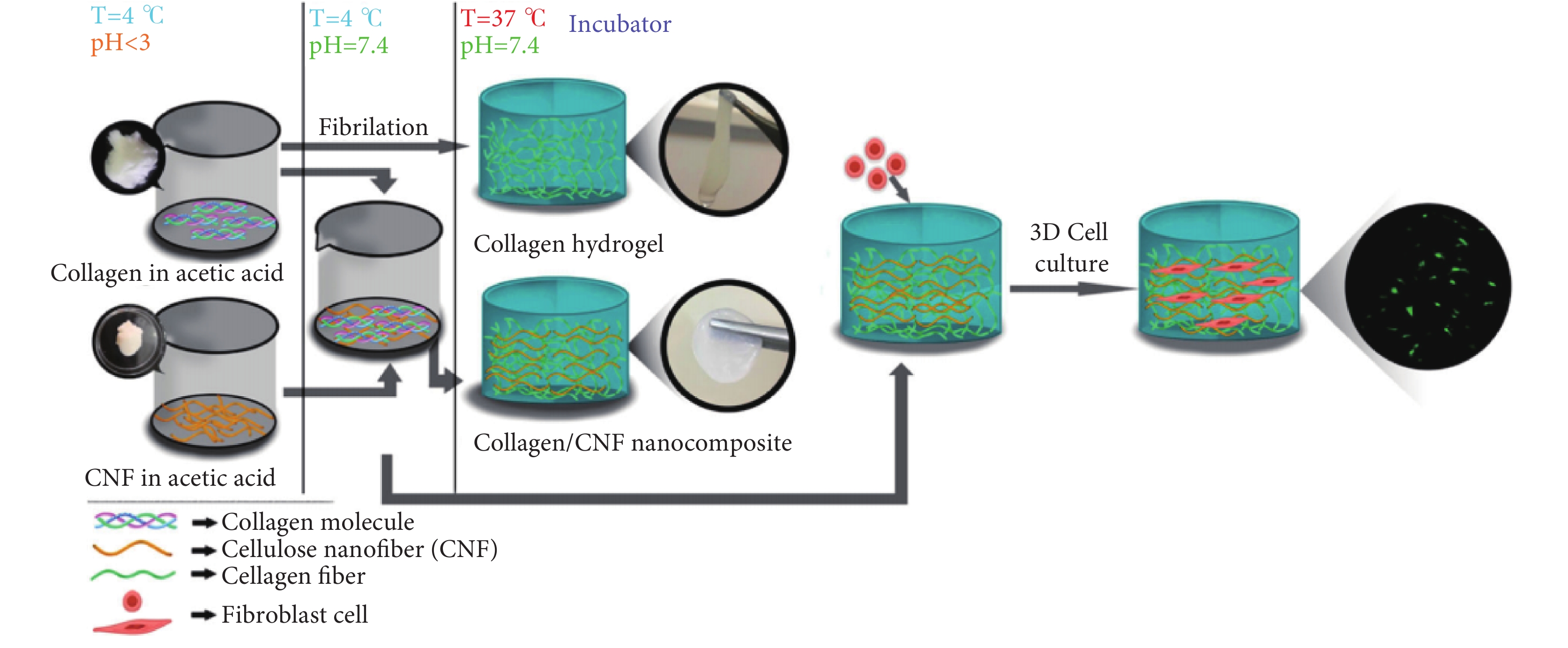
具有極高抗拉強度和剛性的纖維素納米纖維(cellulose nanofibers,CNF)常被用作聚合物基體的增強材料來提高復合材料的力學性能。如圖5所示,Lohrasbi等[41]將纖維素納米纖維添加到膠原蛋白溶液中,然后進行物理凝膠化過程,通過增加pH值和溫度,制備了以纖維素納米纖維為增強相、膠原蛋白為基質的復合水凝膠。在纖維素納米纖維的存在下,膠原水凝膠表現出組織良好的多孔結構、較低的凝膠化時間、較高的保水能力、較低的降解、較高的溶脹率和較高的壓縮強度,可用于三維細胞的培養。
細菌納米纖維素作為一種很有潛力的新型生物材料,不僅具有良好的生物親和性、相容性、降解性、適應性,且無過敏反應,還具有較高的持水性,在潮濕時具有高彈性模量和抗拉強度[42]。Moraes等[43]制備了新型細菌纖維素/膠原水凝膠傷口敷料,膠原蛋白提供了組織基質的強度和完整性,與市售的膠原酶軟膏相比,克服了膠原酶軟膏在傷口床上黏附性低的缺點,易于在傷口床上涂抹和黏附,可以控制傷口滲出液并為傷口愈合提供濕潤的環境,從而實現更快的組織修復。
5 展望
膠原-海藻酸鹽、膠原-殼聚糖、膠原-透明質酸和膠原-纖維素復合水凝膠具有可調的機械性能以及良好的熱穩定性和生物相容性等優點,在組織工程和生物醫學領域顯示出巨大的潛力。此外,膠原基復合水凝膠通過與其他藥物、生物活性因子和納米顆粒結合,可以獲得更好的生物應用性。然而,膠原基多糖復合水凝膠還存在著一些缺點,機械穩定性有限,對環境變化較為敏感,制備過程比較復雜,載藥能力有限且降解速度難以精確控制。未來,研發新型膠原基材料并利用新技術以提高其仿生性能將是關鍵。例如,利用立體光刻技術制造出孔徑可控的混合膠原-支架,利用噴墨生物打印和閥噴生物打印獲得混合膠原蛋白生物材料等。膠原基復合水凝膠在骨組織工程、腫瘤治療、傷口愈合、心臟組織工程、藥物遞送等各領域具有廣泛的潛在應用價值。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:胥美虹、焦恩祥和孫子茹負責撰寫論文初稿;張海軍和焦恩祥負責指導和修改;胥美虹、袁坤山、馮相蓺、劉元標、郭愷和李坤參與修改;張學海負責審校。