含銅胺氧化酶1(AOC1)是含銅胺氧化酶家族中的關鍵成員,催化組胺和腐胺的脫氨氧化反應。近年來,AOC1被發現與多種癌癥相關,它在某些癌細胞中的表達水平顯著升高,提示可能在癌癥進展中起到重要作用。然而,AOC1在脂代謝中的功能仍未被充分研究。通過遺傳學分析,我們發現AOC1與脂代謝存在潛在關聯。接著,我們構建了Aoc1?/?小鼠模型,并在標準飲食和高脂飲食條件下對其代謝表型進行了研究。實驗結果顯示,在高脂飲食條件下,Aoc1?/?小鼠表現出體脂含量增加和葡萄糖耐受不良,白色脂肪組織和肝臟中的脂質積累顯著增加。本研究揭示了AOC1在脂代謝中的潛在作用,以及它在代謝紊亂如肥胖和2型糖尿病中的潛在功能,為代謝性疾病的治療提供了新的靶點和研究方向。
引用本文: 向思婷, 劉莘穎, 李匡政, 趙同金, 王旭. 含銅胺氧化酶1在脂代謝中的功能研究. 生物醫學工程學雜志, 2024, 41(5): 1019-1025, 1034. doi: 10.7507/1001-5515.202407066 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
含銅胺氧化酶是一類可以催化生物胺脫氨氧化,生成相應的醛,并將氧氣還原為過氧化氫的酶[1]。哺乳動物含銅胺氧化酶家族主要由AOC1、AOC2、AOC3和AOC4構成。AOC1編碼二胺氧化酶,AOC2和AOC3編碼氨基脲敏感性胺氧化酶(semicarbazide-sensitive amine oxidase,SSAO),AOC4僅在某些動物中完整表達[2]。
AOC1又被稱為二胺氧化酶(diamine oxidase,DAO),絕大部分被儲存于細胞內,在刺激下會被釋放到局部,僅小部分會出現在外周循環中,半衰期約為1 h[2]。AOC1的主要底物為組胺和腐胺,在人的腸道、腎臟等組胺/腐胺攝取和排泄部位的表達豐度最高[3]。AOC1是胞外降解組胺的必需酶,組胺不耐受患者常表現出血清AOC1降低的表型[4]。AOC1還被報道與癌癥密切相關,癌細胞中AOC1的升高會促進腫瘤增殖、侵襲和遷移,下調AOC1可以抑制腫瘤生長[5-6]。AOC1催化的酶促反應受到多種因素的調控,包括銅、pH值、底物濃度和抑制劑等。銅是AOC1的必需輔因子,直接參與電子轉移過程,促進底物的氧化,銅離子的缺乏會顯著降低AOC1的活性[7]。
目前尚無AOC1在脂質代謝調節過程中發揮作用的相關報道。為了探究AOC1是否存在其他未知的功能,我們利用T2DKP數據庫[8]對AOC1進行了遺傳學分析,構建Aoc1全身敲除小鼠(Aoc1?/?),并在標準飲食與高脂飲食飼養條件下鑒定其代謝表型,探討了AOC1在機體脂質代謝中的功能,為相關疾病的治療與新藥研發提供理論支持。
1 材料與方法
1.1 材料
1.1.1 實驗動物
實驗動物選用雄性C57BL/6小鼠和Aoc1?/?小鼠,體重(20±1)g。Aoc1+/?小鼠(株NO.T027589)購自集萃藥康(中國南京)。實驗動物生產許可證號:SCXK(滬)2019-0002;實驗動物使用許可證號:SYXK(滬)2020-0032。高脂飲食組小鼠8對,標準飲食組小鼠6對。高脂飼料購自美國Research Diets公司,貨號D12492。標準飼料購自南京協同,貨號1010084。
1.1.2 主要試劑及配方
試劑:蛋白酶抑制劑、磷酸酶抑制劑I、磷酸酶抑制劑II購自美國MCE公司;EDTA、NaCl購自上海生工公司;HEPES-Na、SDS購自美國Sigma公司;Na2HPO4、KH2PO4、KCl購自國藥滬試公司;Tween-20購自美國Thermo公司;氯仿、甲醇購自國藥集團;Wako LabAssayTM試劑盒購自富士膠片和光(廣州)貿易有限公司;AOC1抗體購自美國Proteintech公司,16338-1-AP;GAPDH抗體購自美國Proteintech公司,60004-1-Ig。
配方:Buffer B(2 mmol/L EDTA,100 mmol/L HEPES-Na,2.5% SDS);PBST(8 mmol/L Na2HPO4,2 mmol/L KH2PO4,10 mmol/L KCl,140 mmol/L NaCl,0.05% Tween-20,pH 7.4)。
1.1.3 主要儀器
電子天平(瑞士METTLER TOLEDO公司,ME2002E)、核磁共振分析儀(美國Bruker公司,minispec LF50)、血糖儀和血糖試紙(美國拜爾公司,Contour plus)、小動物能量檢測系統(美國Columbus公司,CLAMS-16M)、微量分光光度計(美國Thermo公司,WI53711)、多模塊實時熒光定量PCR系統(美國Thermo公司,QuantStudio 7)、多用途金屬浴(杭州奧盛公司,MiniT-H2C)、
1.2 實驗方法
1.2.1 小鼠體重與體成分數據收集
每周稱量一次體重,每兩周檢測一次體成分。使用核磁共振分析儀進行小鼠身體組分測定,測定之前實驗動物不需要麻醉和特殊準備。每兩周周五的固定時間點測量體成分。
1.2.2 口服葡萄糖耐受實驗和胰島素耐受實驗
在口服葡萄糖耐受實驗(oral glucose tolerance test,OGTT)中,將小鼠禁食16 h,上午9點測定小鼠體重和空腹血糖,根據體重灌胃葡萄糖(標準飲食小鼠灌胃2 g/kg葡萄糖,高脂飲食小鼠灌胃1 g/kg葡萄糖),在15、30、60、90、120 min測定小鼠血糖并記錄。在胰島素耐受實驗(insulin tolerance test,ITT)中,將小鼠禁食6 h,下午2點測定小鼠體重和空腹血糖,然后腹腔注射胰島素(標準飲食小鼠注射劑量為0.5 U/kg,高脂飲食小鼠注射劑量為1 U/kg),在15、30、60、90、120 min測定小鼠血糖并記錄。
1.2.3 小腸上皮細胞的蛋白免疫印記法(western blot)
解剖小鼠,將粘連在十二指腸周圍的胰腺剔除干凈,分離十二指腸、空腸和回腸。將分離的腸道縱向剖開,在PBS緩沖液中清洗后,用蓋玻片將小腸上皮細胞刮下,并轉移至EP管內,液氮速凍保存。使用時,加入含蛋白酶抑制劑、磷酸酶抑制劑I和磷酸酶抑制劑II的Buffer B研磨組織,并進行BCA定量,根據定量結果取適量勻漿液加入對應體積的5×SDS,95 ℃金屬浴加熱10 min后即可上樣。SDS-PAGE電泳結束后,將分離好的蛋白轉到PVDF膜上,4 ℃過夜孵育一抗,所用抗體為AOC1和GAPDH。次日上午,用PBST洗膜三次,二抗室溫孵育1 h,使用ECL試劑盒進行顯影。
1.2.4 肝臟脂質含量測定
取0.1 g左右的肝臟組織,在4 mL氯仿甲醇(2∶1)混合溶劑中研磨至無明顯組織塊。研磨完成后,加入800 μL生理鹽水,混勻后在4 ℃、1 000 r/min條件下離心20 min。將下層有機相移動至5 mL玻璃容量瓶中,加入足量氯仿調整相分界線,使分界線靠近刻度線(略低),次日使用氯仿定容。在2 mL的圓底深孔板中,加入10 μL的Triton X-100與氯仿(2∶1)混合溶劑,根據Wako LabAssayTM試劑盒指導,逐一添加標準液以及20 μL的樣品溶液至相應的孔中,混勻后將深孔板放入干燥箱中過夜。次日,每孔加入300 μL的Wako LabAssayTM顯色劑,于37 ℃孵育箱中孵育。將樣品轉移至96孔酶標板中。在600 nm波長處測量吸光度,以確定樣品中甘油三酯的濃度。
1.2.5 代謝籠分析
使用小動物能量檢測系統進行代謝籠分析,檢測籠溫度為22 ℃,光周期為12 h明/12 h暗。實驗前一周將小鼠單獨飼養,并適應代謝籠環境2天,隨后對小鼠進行為期2天的代謝籠監測。
1.2.6 統計學分析方法
所有數據均使用SPSS 25.0軟件進行統計分析,結果以均值±標準差表示,并使用OriginLab作圖。組間比較采用學生t檢驗,檢驗水準為0.05。
2 結果
2.1 AOC1與代謝疾病強相關
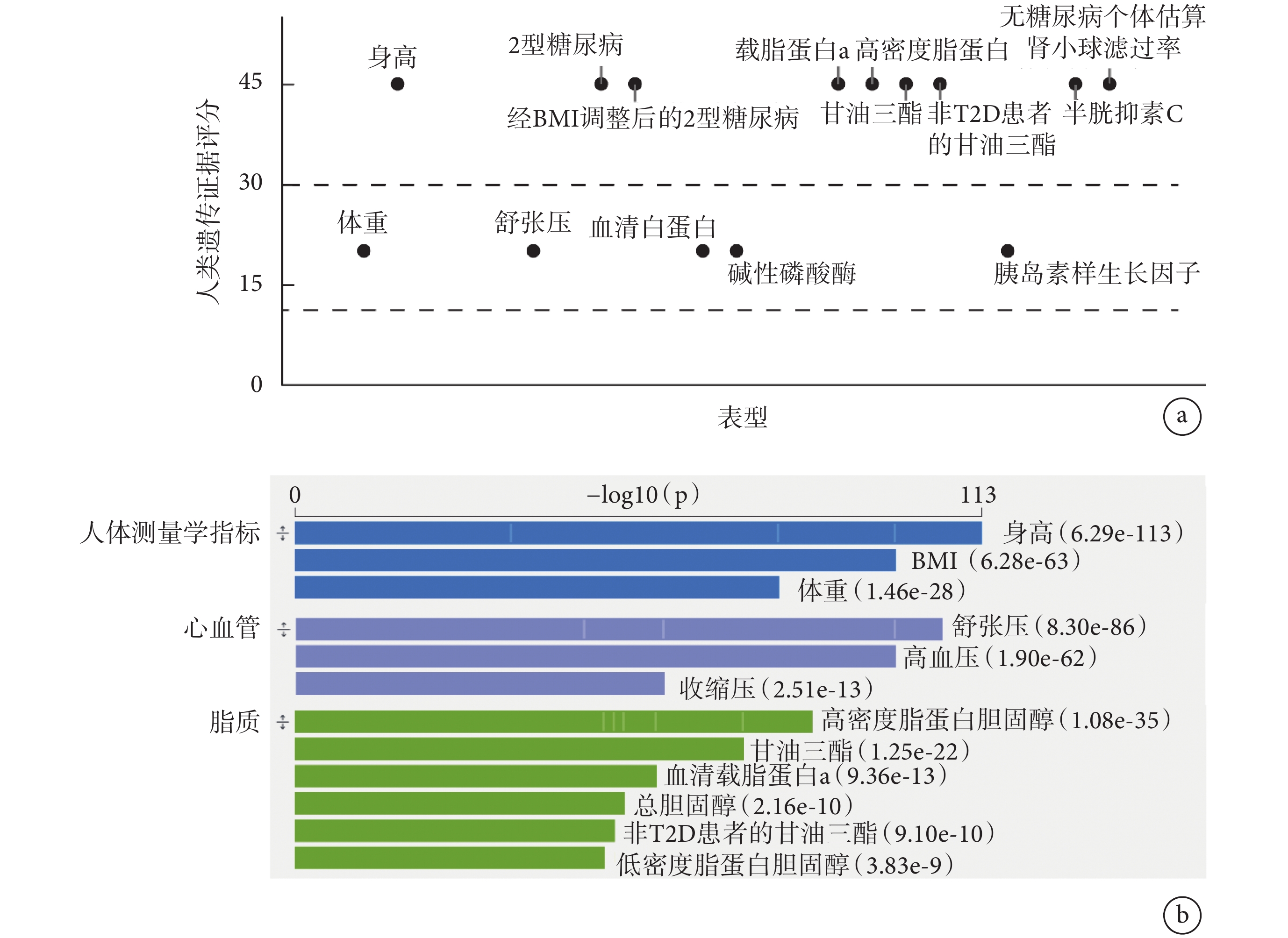
為了尋找AOC1與代謝性疾病的潛在關聯,我們利用T2DKP數據庫對AOC1基因進行了遺傳學分析。如圖1a所示,通過基因與表型關聯分析(關聯性非常強:HuGE≥30[9]),我們發現AOC1與多種代謝指標,如體重、載脂蛋白a、高密度脂蛋白膽固醇、甘油三酯等存在顯著關聯,這表明AOC1可能在代謝調節中起關鍵作用。如圖1b所示,遺傳變異分析顯示,AOC1基因區域內存在多個與脂代謝相關的變異,可能會影響體重、體重指數(body mass index,BMI)、舒張壓、血清白蛋白和高密度脂蛋白膽固醇等代謝指標(此處僅展示關聯性較強的表型,完整數據參見附件1)。此結果表明AOC1可能在脂質代謝中發揮重要作用。
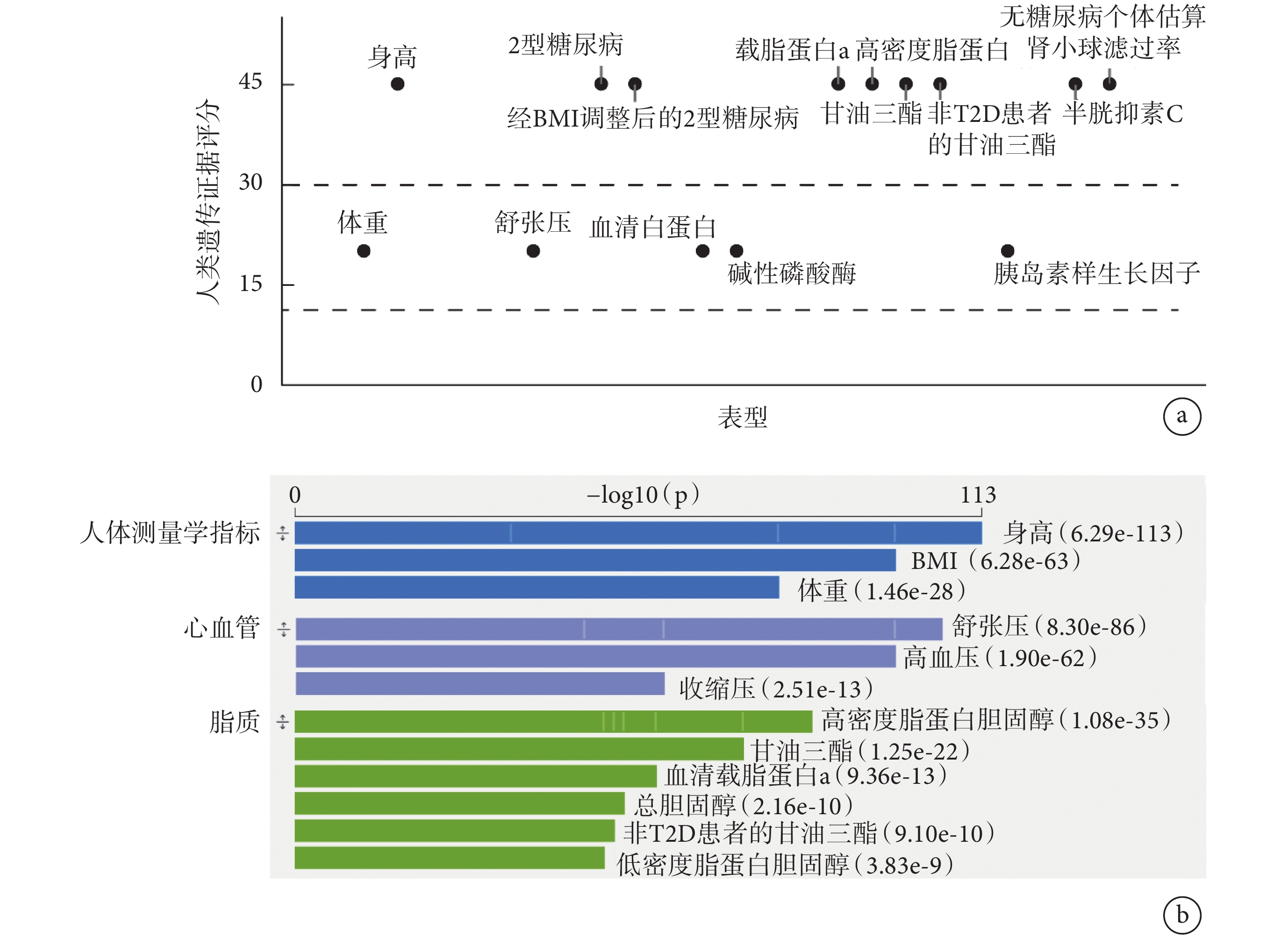 圖1
AOC1與人類疾病關聯性的綜合分析結果
圖1
AOC1與人類疾病關聯性的綜合分析結果
a:HuGE評分;b:
a. HuGE score; b. phenotypes that may be affected by variations within the
2.2 構建并驗證Aoc1?/?小鼠
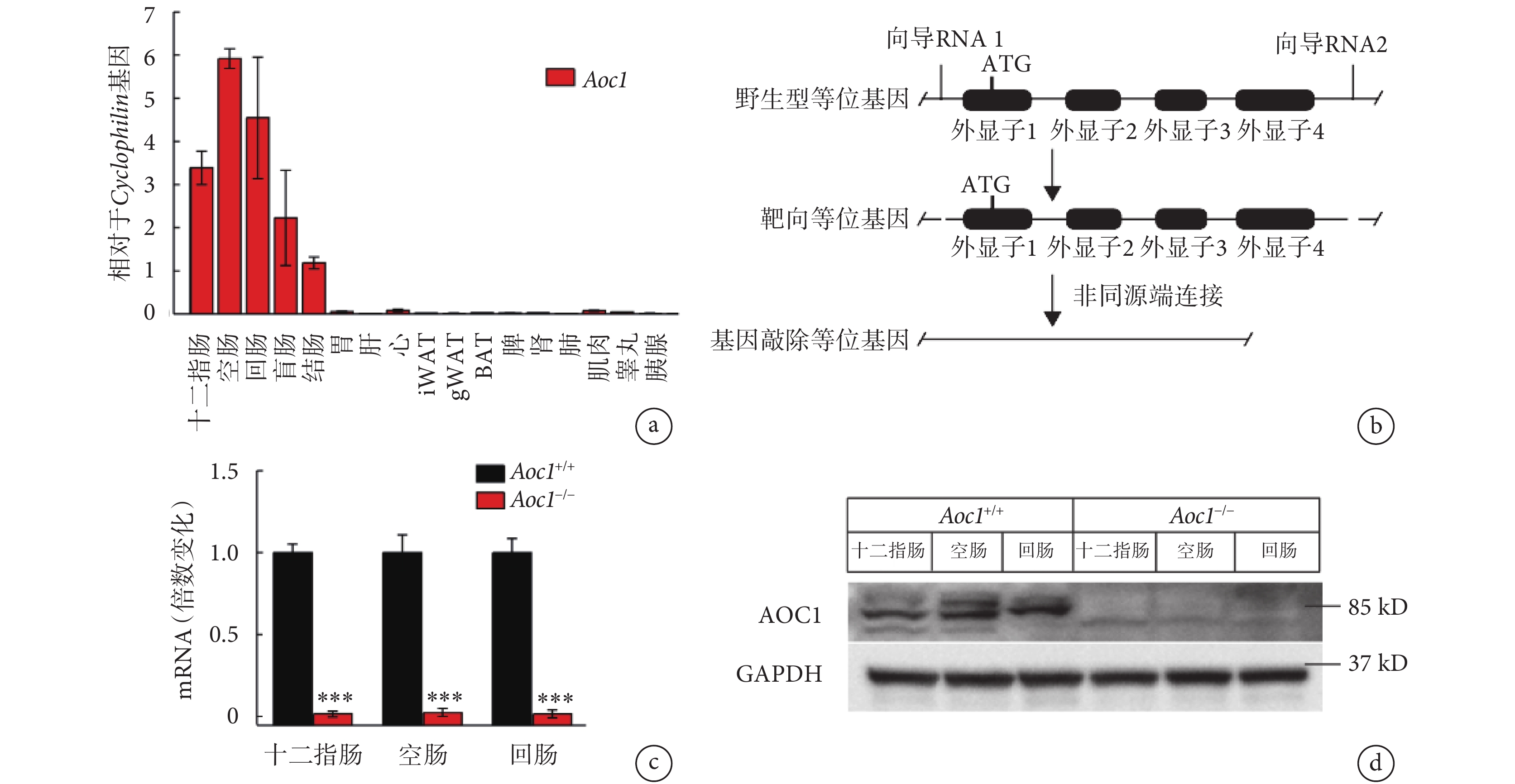
首先,我們在野生型小鼠(Aoc1+/+)的全身組織中檢測了Aoc1基因的表達水平,結果顯示其在腸道中表達豐度最高(見圖2a)。我們通過CRISPR-Cas9技術全身性敲除了小鼠的Aoc1基因(見圖2b),構建了Aoc1?/?小鼠品系。為驗證小鼠品系構建是否成功,本研究解剖了三對Aoc1+/+小鼠和Aoc1?/?小鼠,提取十二指腸、空腸和回腸的RNA和蛋白質,進行RT-PCR和western blot檢測。RT-PCR結果(見圖2c-d)顯示Aoc1?/?小鼠體內Aoc1基因的敲低效率達99.9%,western blot結果同樣證明了Aoc1?/?小鼠的構建是成功的。
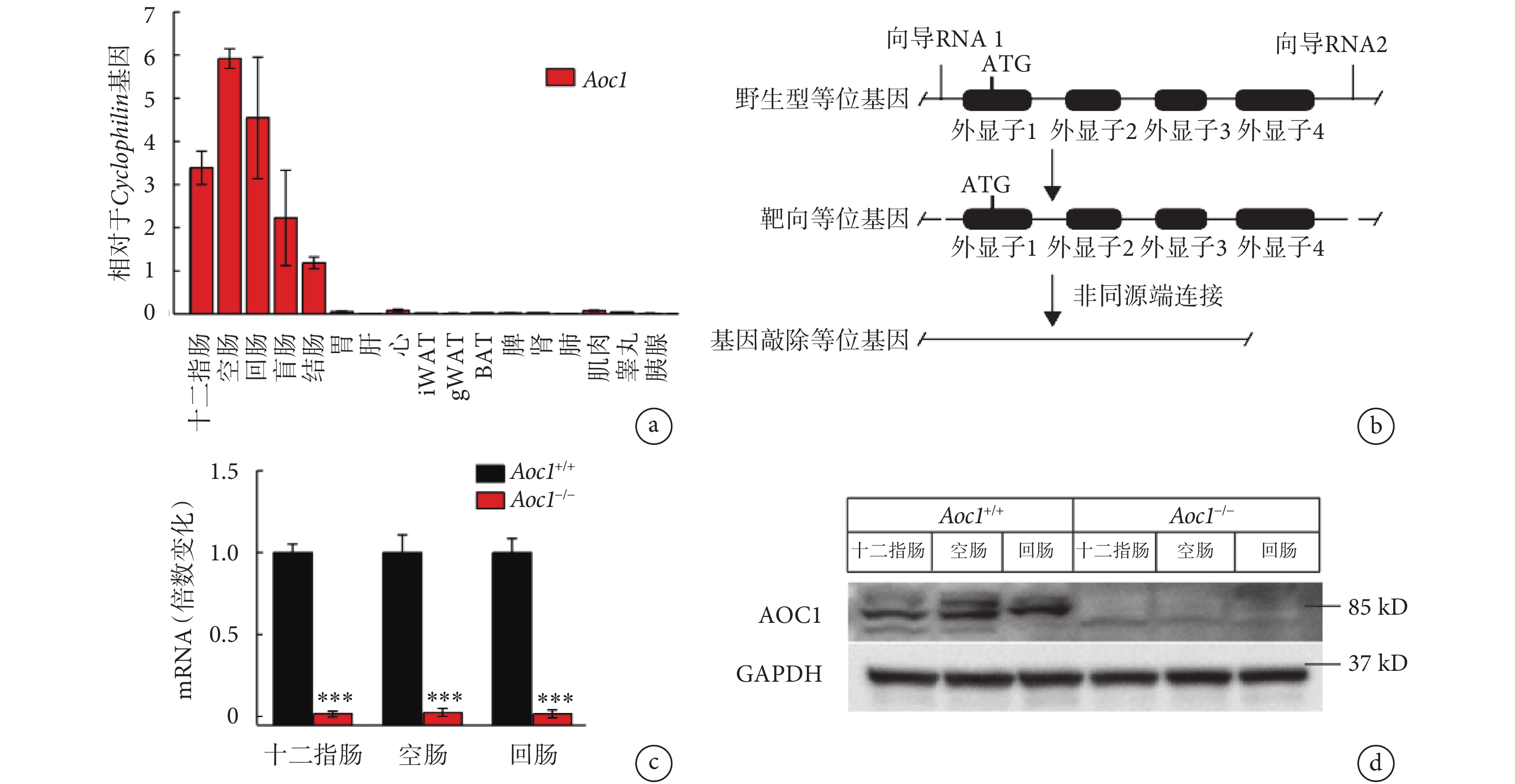 圖2
Aoc1?/?小鼠品系構建
圖2
Aoc1?/?小鼠品系構建
a.
a.
2.3 Aocl?/?小鼠在高脂飲食條件下體脂增加
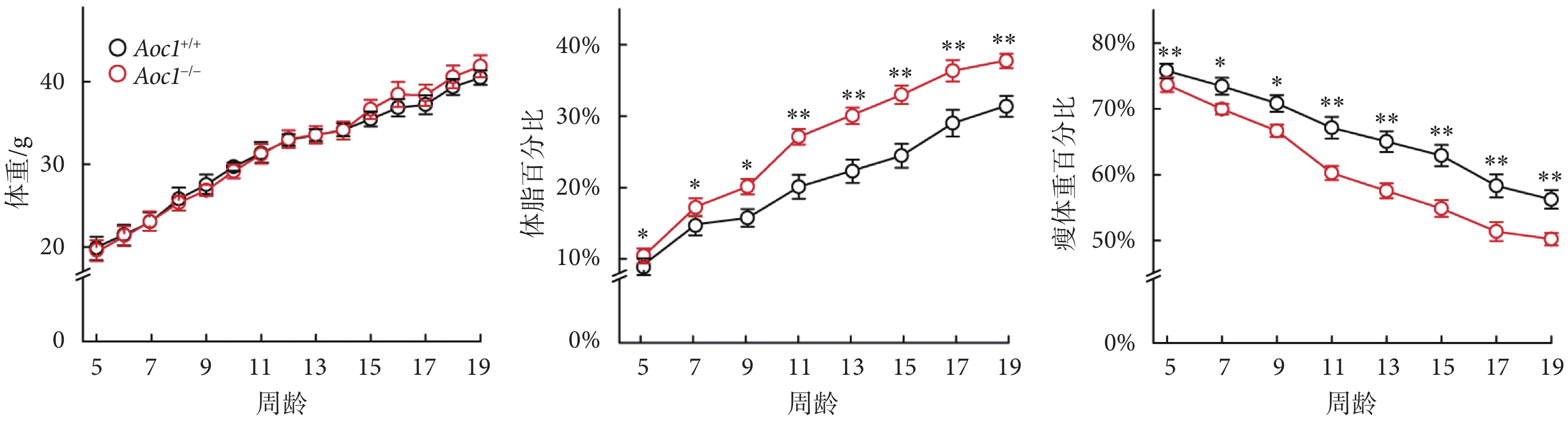
肥胖個體的體脂分布、代謝特征以及相關的代謝風險程度各不相同[10]。為了研究敲除Aoc1對脂質代謝產生的影響,我們分析了Aoc1+/+小鼠與Aoc1?/?小鼠在標準飲食和高脂飲食條件下的體重和體成分變化。結果顯示,在標準飲食條件下,Aoc1+/+小鼠與Aoc1?/?小鼠體重和體成分無顯著差異(具體數據見附件2);在高脂飲食條件下,雖然二者體重無顯著差異,但Aoc1?/?小鼠體脂率顯著高于Aoc1+/+小鼠,瘦體重含量相較于Aoc1+/+小鼠則顯著下降(見圖3)。
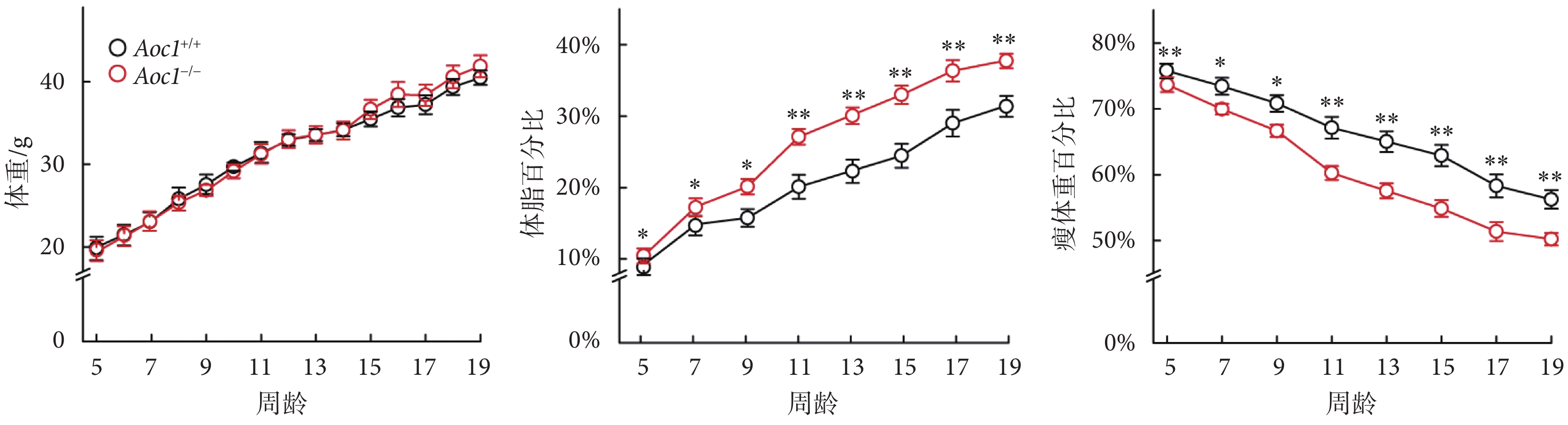 圖3
高脂飲食下Aoc1?/?小鼠脂肪積累增加(*P < 0.05,**P < 0.01)
Figure3.
Lipid accumulation increased in Aoc1?/? mice on HFD (*P < 0.05, **P < 0.01)
圖3
高脂飲食下Aoc1?/?小鼠脂肪積累增加(*P < 0.05,**P < 0.01)
Figure3.
Lipid accumulation increased in Aoc1?/? mice on HFD (*P < 0.05, **P < 0.01)
2.4 敲除Aoc1導致小鼠的葡萄糖耐受不良
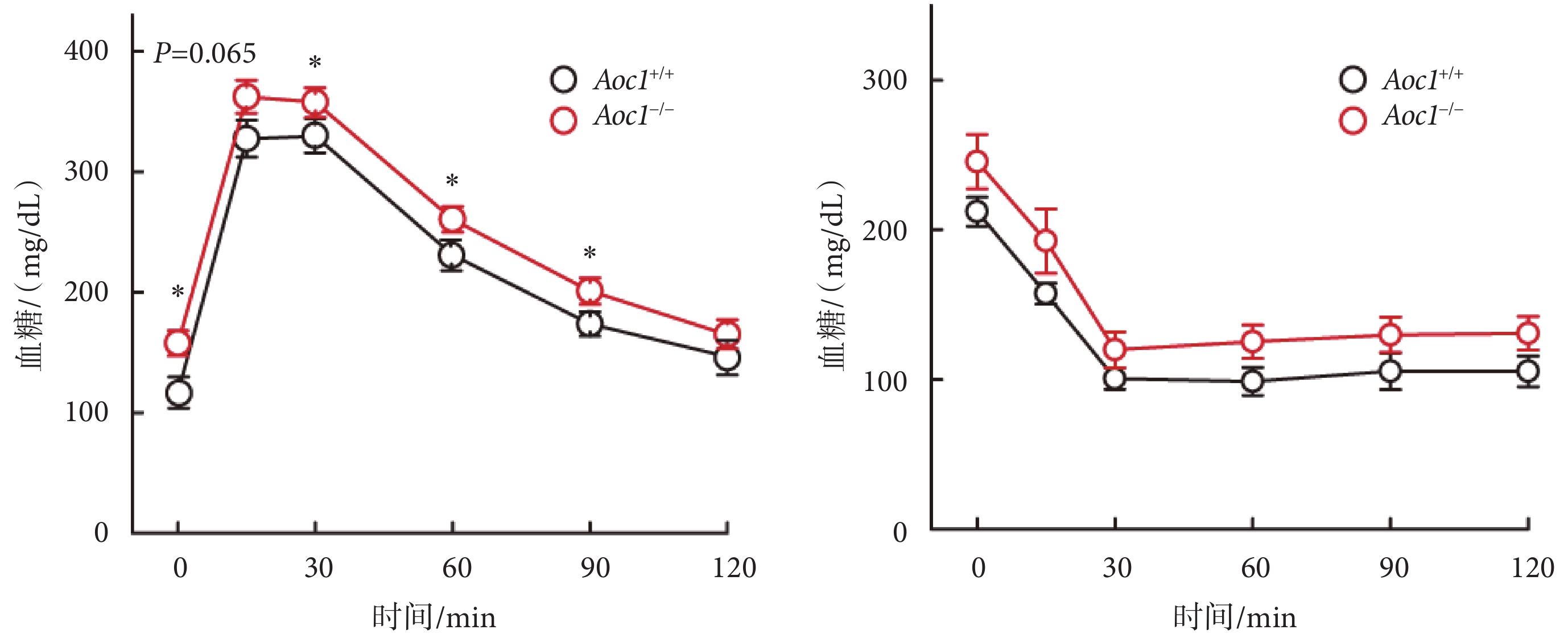
脂質積累的增加通常會導致糖耐受度的變化[11],因此我們對不同飲食條件下的Aoc1+/+小鼠與Aoc1?/?小鼠分別進行了OGTT和ITT實驗。在標準飲食喂養組,Aoc1的缺失并未影響小鼠的葡萄糖耐受(具體數據見附件3)。而在高脂飲食喂養組,敲除Aoc1使得小鼠葡萄糖耐受減退,在灌胃葡萄糖后Aoc1?/?小鼠血糖水平顯著高于Aoc1+/+小鼠;腹腔注射胰島素后二者血糖變化一致,Aoc1?/?小鼠血糖水平略高,但差異無統計學意義(見圖4)。
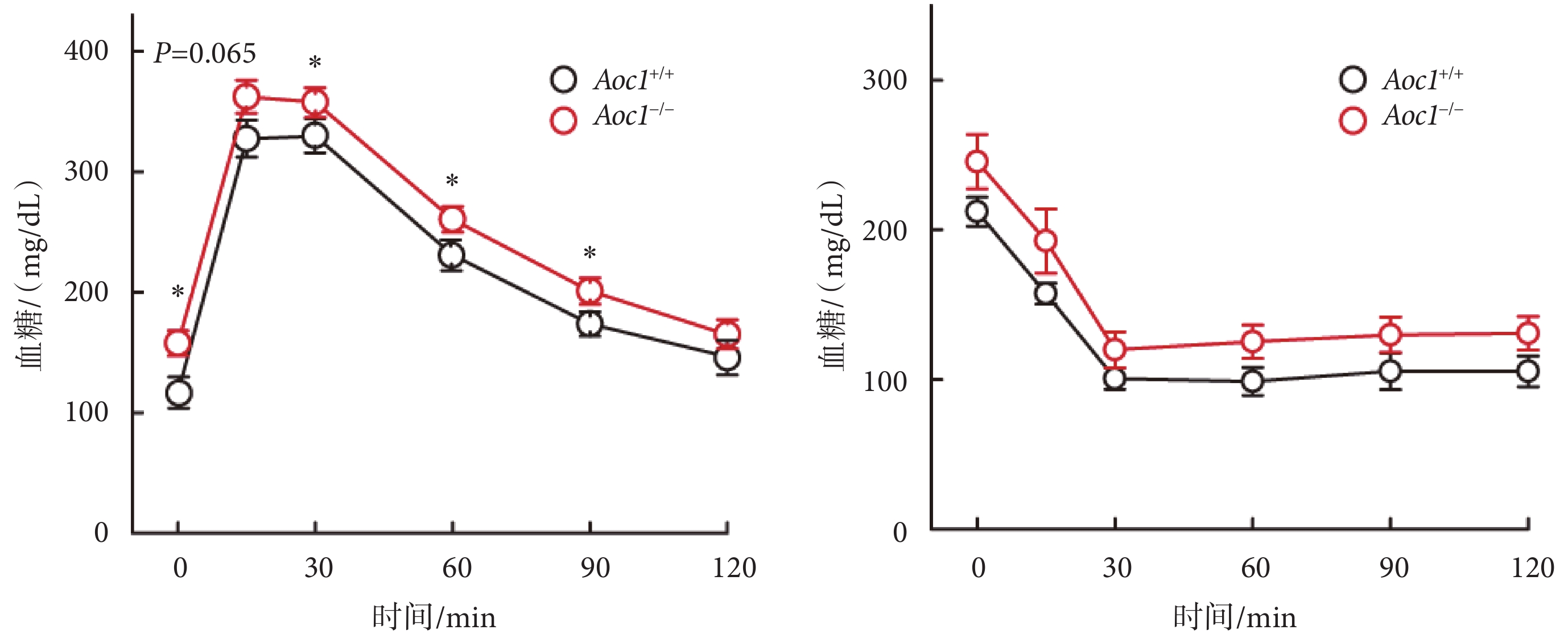 圖4
敲除Aoc1導致小鼠的葡萄糖耐受不良(*P<0.05)
Figure4.
Knockout of Aoc1 impaired glucose tolerance in mice (*P<0.05)
圖4
敲除Aoc1導致小鼠的葡萄糖耐受不良(*P<0.05)
Figure4.
Knockout of Aoc1 impaired glucose tolerance in mice (*P<0.05)
2.5 敲除Aoc1不影響進食與能量消耗
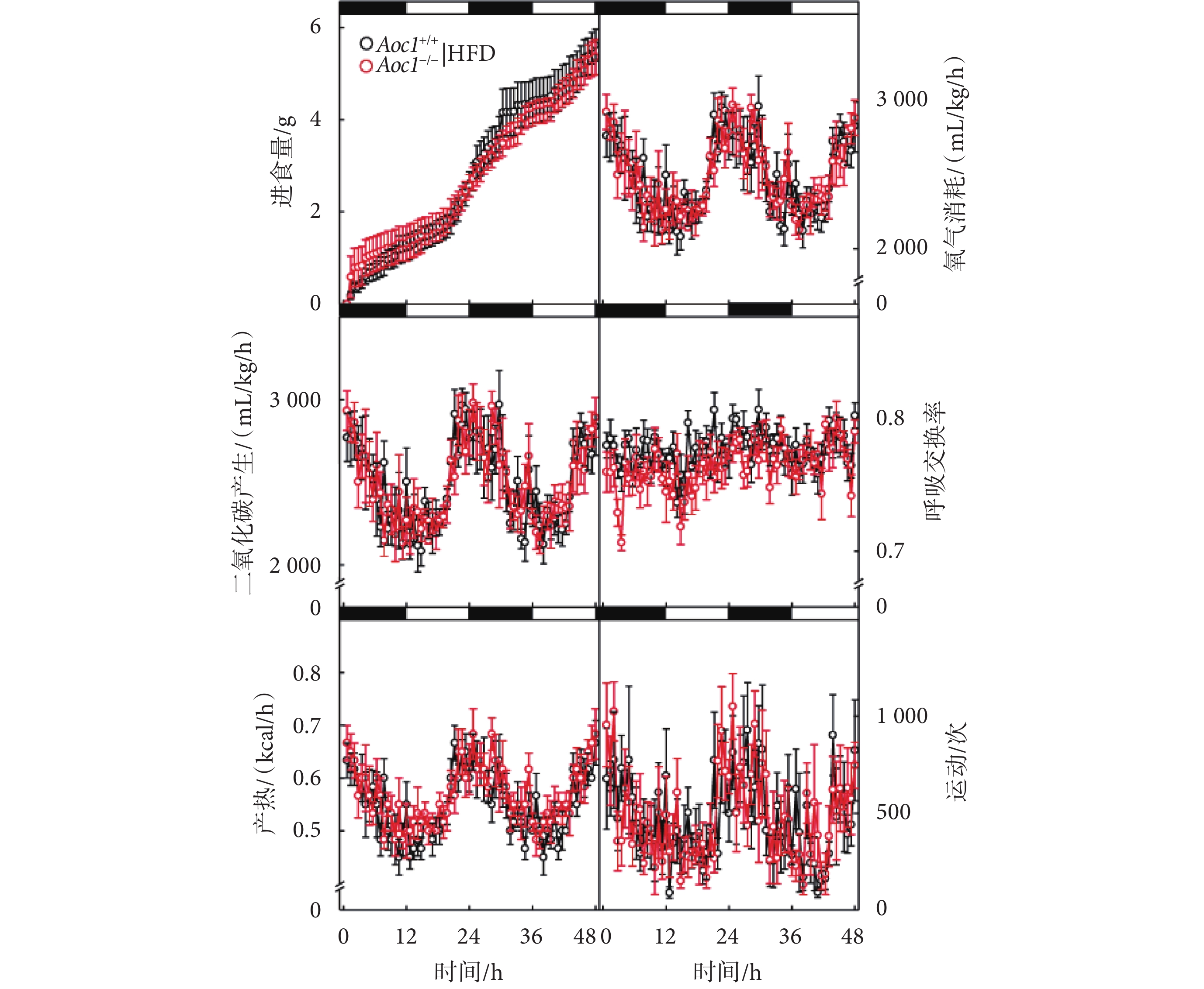
為了進一步探究Aoc1?/?小鼠脂質代謝平衡發生的變化,本研究對高脂飲食條件下的Aoc1+/+小鼠與Aoc1?/?小鼠進行了代謝籠實驗。結果顯示,二者在進食量、氧氣消耗速率、二氧化碳產生速率、呼吸交換率、熱量消耗和活動量等方面均未產生顯著差異(見圖5)。Aoc1+/+小鼠與Aoc1?/?小鼠在呼吸交換率(respiratory exchange ratio,RER)水平上未體現出差異,說明敲除Aoc1并未改變小鼠對能量利用的偏好。小鼠進食量無顯著差異證明小鼠的能量攝入并未增加,而產熱和活動量無顯著差異則證明能量消耗沒有增加,因此我們認為,高脂飲食條件下Aoc1?/?小鼠體脂增高,并非是進食量增加或能量消耗減少所導致的,具體原因還需進一步探索。
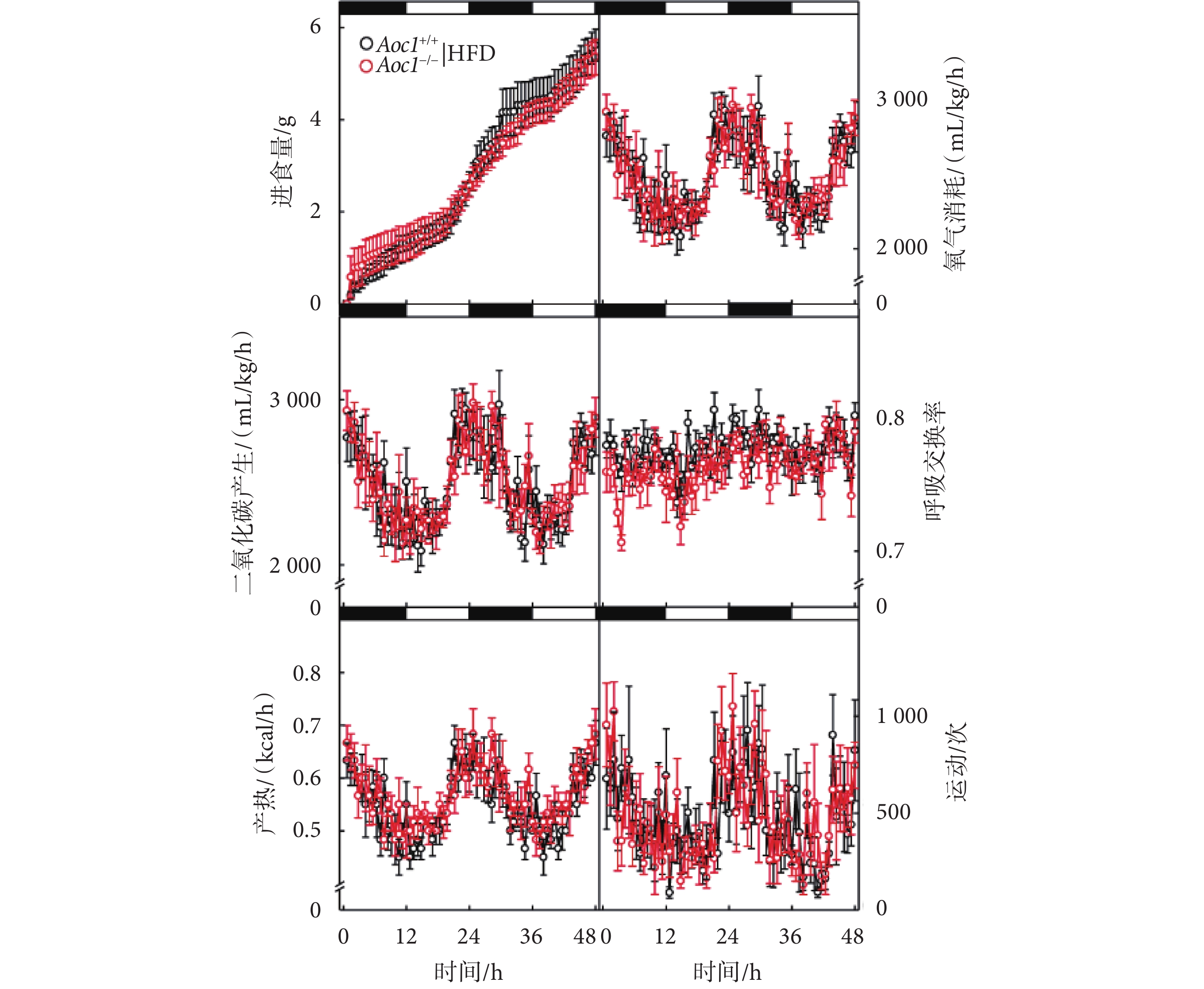 圖5
敲除Aoc1不影響進食與產熱
圖5
敲除Aoc1不影響進食與產熱
黑白區間代表光周期,運動次數代表小鼠在
the black and white intervals represent the photoperiod, and the movement counts represent the total activity of the mice along the
2.6 缺失Aoc1導致白色脂肪組織與肝臟的脂質積累增加
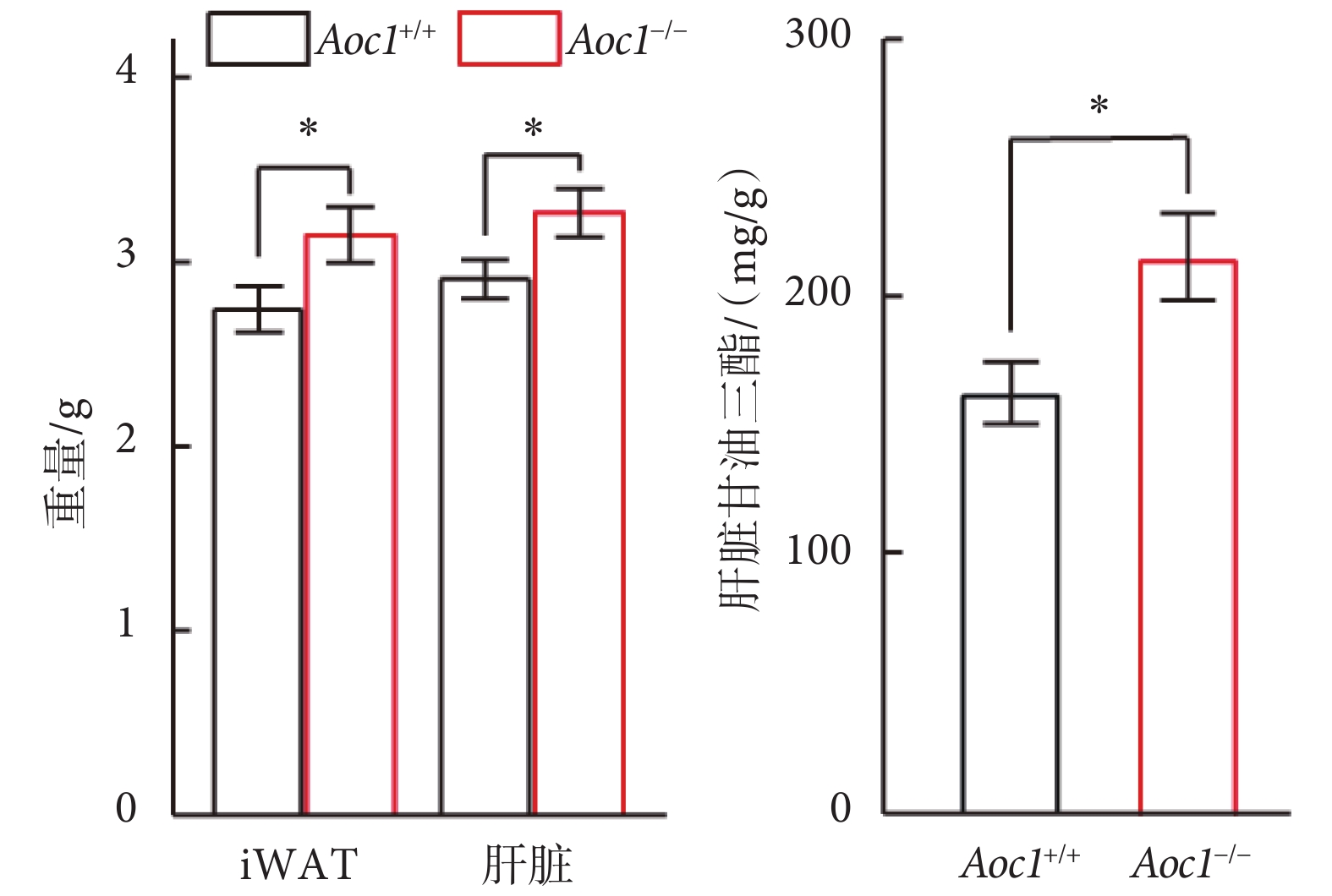
上述結果指出,敲除Aoc1未影響小鼠進食量和熱量消耗,但卻能引起脂肪積累,糖耐量減退。為了進一步探究脂質積累增加發生的具體部位,我們將高脂飲食組小鼠安樂死,對小鼠的各個組織進行稱重和取樣分析。結果顯示,Aoc1?/?小鼠的腹股溝白色脂肪組織(inguinal white adipose tissue,iWAT)和肝臟重量顯著增加(見圖6左圖)。脂肪是機體主要的能量儲存部位,肝臟則是短期脂肪存儲和轉換的場所,二者在脂質的儲存與利用中發揮著重要作用[12]。我們測定了肝臟中的脂質含量,結果顯示,Aoc1?/?小鼠肝臟甘油三酯的含量顯著增高(見圖6右圖)。
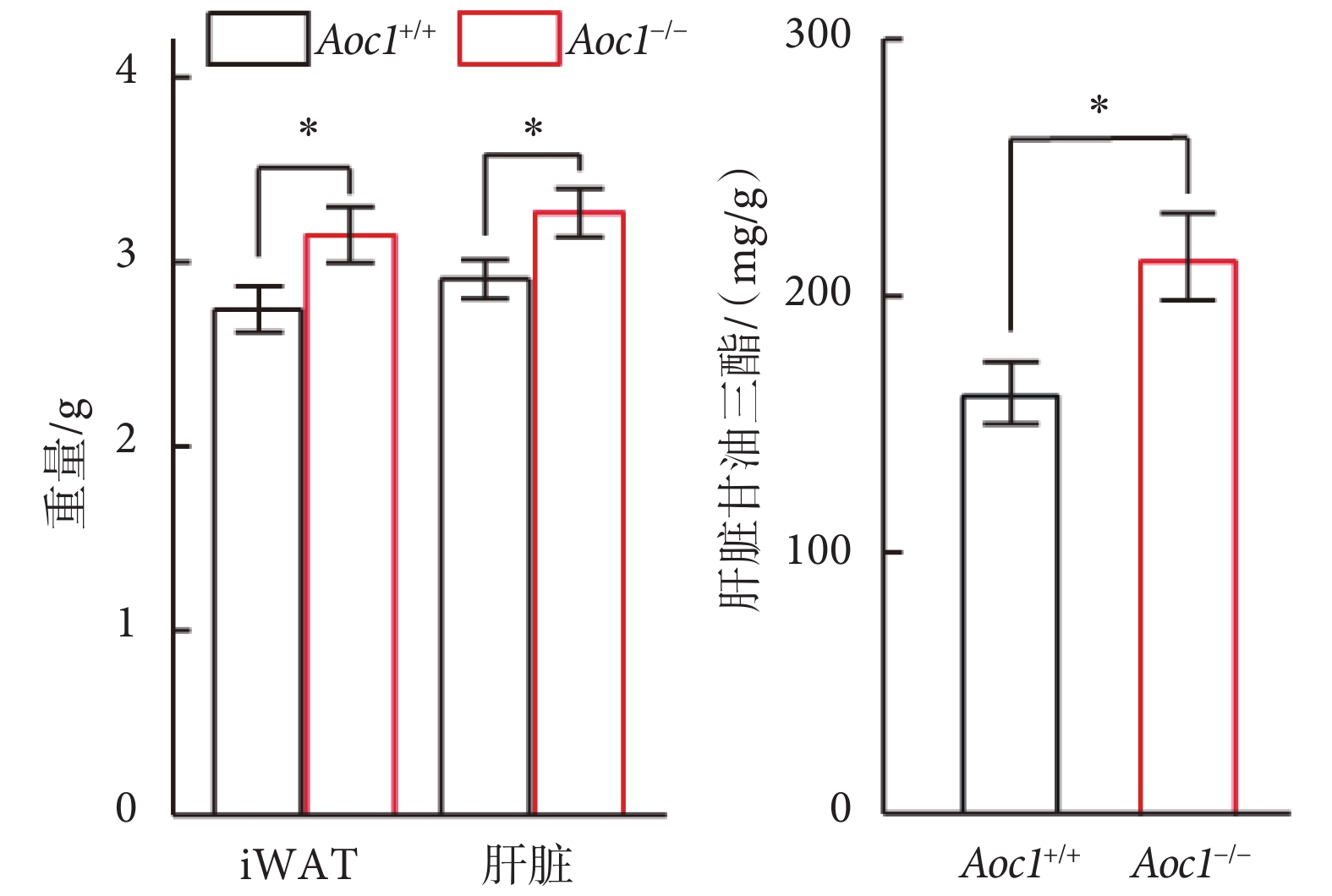 圖6
高脂飲食下Aoc1?/?小鼠iWAT與肝臟脂質積累增加(*P < 0.05)
Figure6.
Lipid accumulation of iWAT and liver increased in Aoc1?/? mice on HFD (*P < 0.05)
圖6
高脂飲食下Aoc1?/?小鼠iWAT與肝臟脂質積累增加(*P < 0.05)
Figure6.
Lipid accumulation of iWAT and liver increased in Aoc1?/? mice on HFD (*P < 0.05)
2.7 敲除Aoc1不影響小鼠肝臟脂質合成和葡萄糖代謝
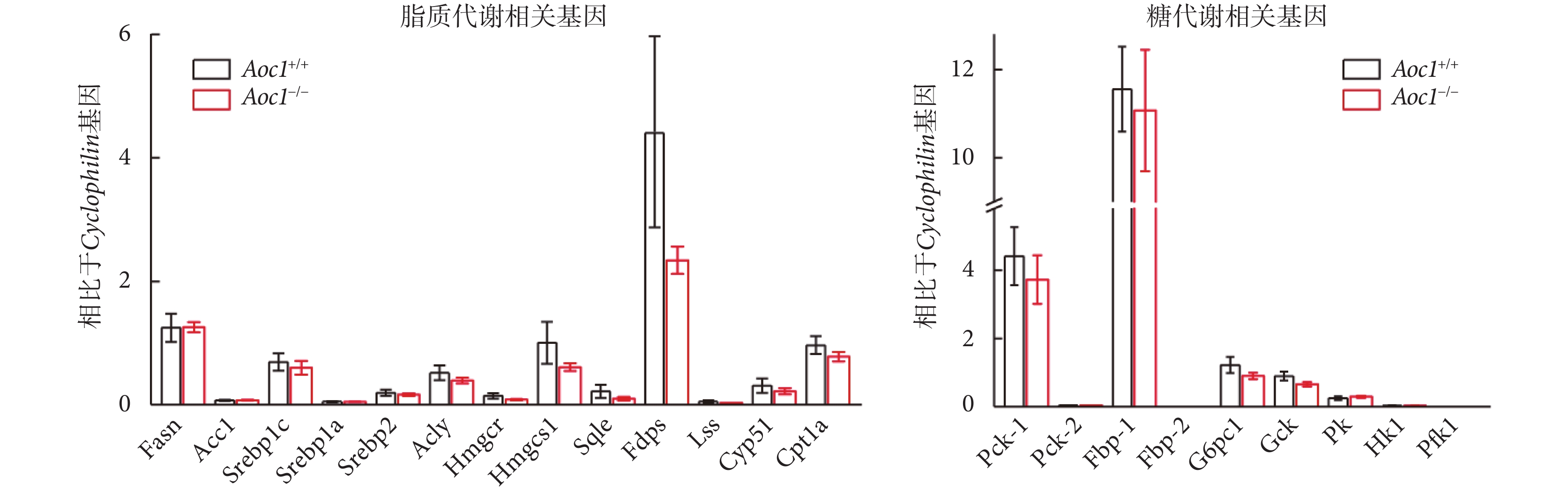
在高脂飲食條件下,敲除Aoc1后小鼠iWAT與肝臟的重量增加,肝臟中甘油三酯的含量也顯著增加,因此我們對肝臟脂質合成和葡萄糖代謝相關的基因水平進行了RT-PCR分析。結果顯示,在高脂飲食條件下,相比于Aoc1+/+小鼠,Aoc1?/?小鼠肝臟中脂質合成和葡萄糖代謝的相關基因表達水平無顯著變化(見圖7)。
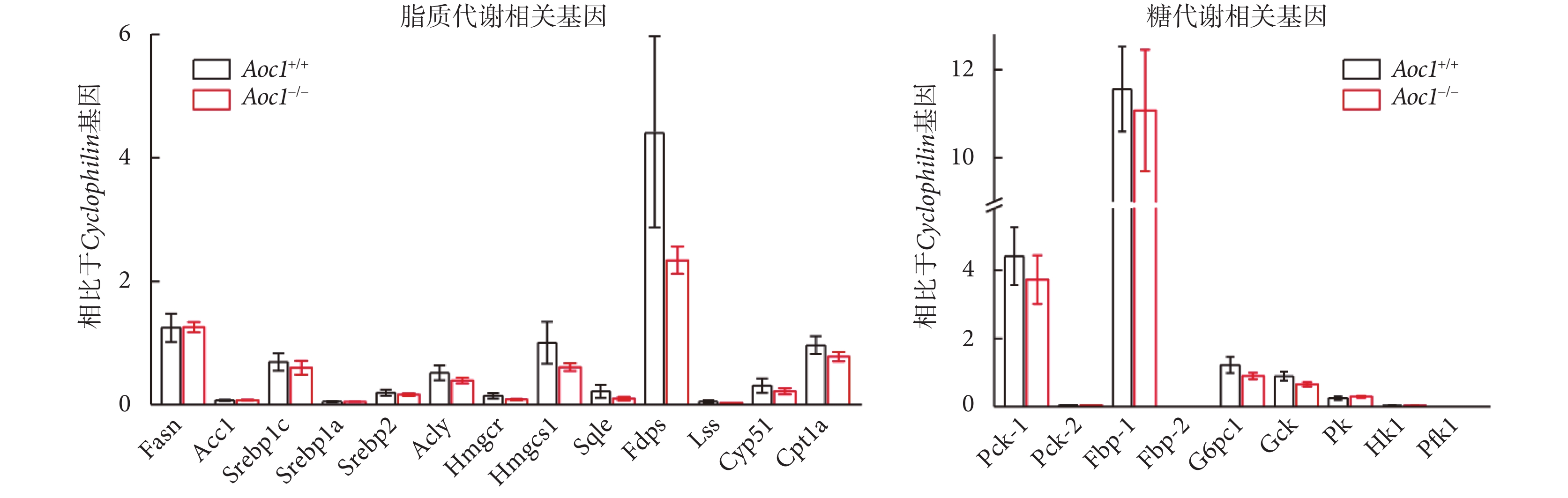 圖7
敲除Aoc1不影響脂質合成和葡萄糖代謝基因表達
Figure7.
Knockout of Aoc1 did not affect gene expression of lipid synthesis and glucose metabolism
圖7
敲除Aoc1不影響脂質合成和葡萄糖代謝基因表達
Figure7.
Knockout of Aoc1 did not affect gene expression of lipid synthesis and glucose metabolism
3 討論
AOC1是多胺代謝的關鍵酶,多胺代謝失調在癌癥中十分常見[13]。既往AOC1的相關研究大部分集中在癌癥領域,包括胃癌、結直腸癌、前列腺癌、鼻咽癌和肝細胞癌[14-16]。有研究構建了Aoc1?/?小鼠,但其主要聚焦于敲除Aoc1后對組胺代謝的影響,未研究AOC1與脂質代謝之間的關系[17]。截至目前,關于AOC1在脂質代謝中的功能研究十分有限。
通過遺傳學分析,本研究發現AOC1與體重、BMI、舒張壓、血清白蛋白和高密度脂蛋白膽固醇等多個代謝指標強相關。有研究指出在大鼠十二指腸中輸注脂質,可觀察到淋巴管內組胺濃度和AOC1活性顯著增加,并在輸注后1 h同時達到峰值,這表明AOC1與脂質吸收之間存在關聯[18]。因此,我們認為AOC1可能在脂質代謝中發揮重要生物學作用。
本研究通過構建Aoc1?/?小鼠品系并分析代謝表型,直觀地觀察敲除Aoc1對脂質代謝的影響。結果顯示,在高脂飲食條件下,Aoc1?/?小鼠和Aoc1+/+小鼠相比,體脂率顯著增高,葡萄糖耐受減退,iWAT與肝臟重量顯著增加,表現出了更差的代謝表型,這與遺傳學分析結果是一致的,證明敲除Aoc1會導致小鼠代謝表型顯著改變。
Aoc1?/?小鼠體脂率顯著增加,表明其脂質積累增加,因此我們猜測AOC1可能影響了小鼠的脂質代謝平衡。代謝籠檢測證明,Aoc1?/?小鼠與Aoc1+/+小鼠相比,進食量和能量消耗并無顯著差異,對能量物質的利用偏好也無顯著差異,因此脂質代謝平衡被破壞并非發生在能量食物攝取和能量消耗環節,我們推斷可能是脂質吸收或合成水平發生了變化,如脂質吸收或合成水平增加,均可以在進食和消耗無差異的情況下導致脂質積累增加。因此,后續我們計劃通過橄欖油灌胃實驗、小腸切片油紅染色以及測定糞便內甘油三酯含量等方法,檢測腸道脂質吸收有無差異;并通過測定脂肪酸合成和氧化關鍵酶的基因表達水平以及活性變化,檢測脂質合成能力的變化。
在高脂飲食條件下,Aoc1?/?小鼠與Aoc1+/+小鼠相比,脂質合成和葡萄糖代謝基因的表達水平并未發生顯著變化。我們推測這可能證明肝臟脂質異常積累并非是脂質合成增加引起的,也可能是由于高脂飲食喂養時間過長,引起小鼠產生代謝適應和代償機制,因此掩蓋了基因表達的初始差異。后續的研究中,我們會縮短高脂飲食喂養時間,測定肝臟和脂肪中的脂肪酸氧化基因的表達水平,以進一步驗證Aoc1缺失對脂肪酸氧化通路的影響。
Aoc1在腸道中CT值范圍為17至21,而在肝臟和脂肪組織中的CT值范圍為25至26,這表明盡管Aoc1在腸道中表達最高,但在肝臟和脂肪組織中仍有相對較低的表達。為了更好地探究AOC1是否在不同組織中發揮不同的代謝調控功能,我們后續將通過Aoc1f/f小鼠分別和Villin-cre、Albumin-cre和AdipoQ-cre小鼠交配,得到腸道、肝臟和脂肪組織特異性敲除小鼠,具體去探究AOC1在各個組織當中發揮著怎樣的功能。
AOC1是胞外代謝組胺的必需酶,催化組胺的氧化降解。組胺在外周組織可作為炎癥因子,參與調節免疫反應和炎癥發展的過程[19]。肥胖會引起慢性持續性低度炎癥,這種炎癥狀態已被證明是導致胰島素抵抗和2型糖尿病等代謝性疾病的關鍵因素之一[20-21]。在脂肪組織中,我們推測敲除Aoc1可能通過抑制組胺降解,促進脂肪組織的炎癥狀態,進而促進了脂肪組織重塑和擴張。后續我們將通過檢測脂肪組織中組胺濃度以及組胺引起的炎癥反應來驗證這一可能性
近年來有研究報道了銅穩態和脂質代謝之間的聯系[22–25]。細胞水平的實驗證明,胞內銅水平升高會促進脂質水解,銅水平下降則減少脂解反應的發生[26]。在白色脂肪組織中,銅通過影響SSAO酶的活性來調控脂解反應[26]。SSAO的活性隨局部銅含量的增多而增高,激活的SSAO可以反過來刺激葡萄糖和長鏈脂肪酸的攝取[27-28]。SSAO?/?小鼠的白色脂肪組織會增大,并產生輕度肥胖[29]。這與本研究的結果一致,高脂飲食下Aoc1?/?小鼠的體脂含量更高,iWAT重量增加,因此本研究推斷AOC1可能存在與SSAO類似的功能,并通過銅穩態參與調節脂質代謝,未來我們將會進一步探究銅穩態在AOC1介導的脂質代謝中的作用。
4 結論
本研究從代謝研究的角度出發,通過高脂飲食喂養構建出Aoc1?/?小鼠的肥胖模型,并觀察到Aoc1?/?小鼠體脂率顯著增高、葡萄糖耐受減退、白色脂肪組織和肝臟重量顯著增加等代謝表型,證明了AOC1在脂質代謝平衡中發揮著重要作用。此發現加深了我們對AOC1功能的了解,有助于揭示其在脂質代謝調節中的具體作用和潛在機制,在未來的研究中我們將進一步探究AOC1對于脂質代謝的影響。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:向思婷、劉莘穎和李匡政主要負責數據處理、數據分析與論文寫作;趙同金和王旭主要負責實驗指導、寫作指導和論文審閱。
倫理聲明:本研究通過了復旦大學倫理委員會的審批(批文編號:2020代謝整合院JS-006)。
本文附件見本刊網站的電子版本(biomedeng.cn)。
0 引言
含銅胺氧化酶是一類可以催化生物胺脫氨氧化,生成相應的醛,并將氧氣還原為過氧化氫的酶[1]。哺乳動物含銅胺氧化酶家族主要由AOC1、AOC2、AOC3和AOC4構成。AOC1編碼二胺氧化酶,AOC2和AOC3編碼氨基脲敏感性胺氧化酶(semicarbazide-sensitive amine oxidase,SSAO),AOC4僅在某些動物中完整表達[2]。
AOC1又被稱為二胺氧化酶(diamine oxidase,DAO),絕大部分被儲存于細胞內,在刺激下會被釋放到局部,僅小部分會出現在外周循環中,半衰期約為1 h[2]。AOC1的主要底物為組胺和腐胺,在人的腸道、腎臟等組胺/腐胺攝取和排泄部位的表達豐度最高[3]。AOC1是胞外降解組胺的必需酶,組胺不耐受患者常表現出血清AOC1降低的表型[4]。AOC1還被報道與癌癥密切相關,癌細胞中AOC1的升高會促進腫瘤增殖、侵襲和遷移,下調AOC1可以抑制腫瘤生長[5-6]。AOC1催化的酶促反應受到多種因素的調控,包括銅、pH值、底物濃度和抑制劑等。銅是AOC1的必需輔因子,直接參與電子轉移過程,促進底物的氧化,銅離子的缺乏會顯著降低AOC1的活性[7]。
目前尚無AOC1在脂質代謝調節過程中發揮作用的相關報道。為了探究AOC1是否存在其他未知的功能,我們利用T2DKP數據庫[8]對AOC1進行了遺傳學分析,構建Aoc1全身敲除小鼠(Aoc1?/?),并在標準飲食與高脂飲食飼養條件下鑒定其代謝表型,探討了AOC1在機體脂質代謝中的功能,為相關疾病的治療與新藥研發提供理論支持。
1 材料與方法
1.1 材料
1.1.1 實驗動物
實驗動物選用雄性C57BL/6小鼠和Aoc1?/?小鼠,體重(20±1)g。Aoc1+/?小鼠(株NO.T027589)購自集萃藥康(中國南京)。實驗動物生產許可證號:SCXK(滬)2019-0002;實驗動物使用許可證號:SYXK(滬)2020-0032。高脂飲食組小鼠8對,標準飲食組小鼠6對。高脂飼料購自美國Research Diets公司,貨號D12492。標準飼料購自南京協同,貨號1010084。
1.1.2 主要試劑及配方
試劑:蛋白酶抑制劑、磷酸酶抑制劑I、磷酸酶抑制劑II購自美國MCE公司;EDTA、NaCl購自上海生工公司;HEPES-Na、SDS購自美國Sigma公司;Na2HPO4、KH2PO4、KCl購自國藥滬試公司;Tween-20購自美國Thermo公司;氯仿、甲醇購自國藥集團;Wako LabAssayTM試劑盒購自富士膠片和光(廣州)貿易有限公司;AOC1抗體購自美國Proteintech公司,16338-1-AP;GAPDH抗體購自美國Proteintech公司,60004-1-Ig。
配方:Buffer B(2 mmol/L EDTA,100 mmol/L HEPES-Na,2.5% SDS);PBST(8 mmol/L Na2HPO4,2 mmol/L KH2PO4,10 mmol/L KCl,140 mmol/L NaCl,0.05% Tween-20,pH 7.4)。
1.1.3 主要儀器
電子天平(瑞士METTLER TOLEDO公司,ME2002E)、核磁共振分析儀(美國Bruker公司,minispec LF50)、血糖儀和血糖試紙(美國拜爾公司,Contour plus)、小動物能量檢測系統(美國Columbus公司,CLAMS-16M)、微量分光光度計(美國Thermo公司,WI53711)、多模塊實時熒光定量PCR系統(美國Thermo公司,QuantStudio 7)、多用途金屬浴(杭州奧盛公司,MiniT-H2C)、
1.2 實驗方法
1.2.1 小鼠體重與體成分數據收集
每周稱量一次體重,每兩周檢測一次體成分。使用核磁共振分析儀進行小鼠身體組分測定,測定之前實驗動物不需要麻醉和特殊準備。每兩周周五的固定時間點測量體成分。
1.2.2 口服葡萄糖耐受實驗和胰島素耐受實驗
在口服葡萄糖耐受實驗(oral glucose tolerance test,OGTT)中,將小鼠禁食16 h,上午9點測定小鼠體重和空腹血糖,根據體重灌胃葡萄糖(標準飲食小鼠灌胃2 g/kg葡萄糖,高脂飲食小鼠灌胃1 g/kg葡萄糖),在15、30、60、90、120 min測定小鼠血糖并記錄。在胰島素耐受實驗(insulin tolerance test,ITT)中,將小鼠禁食6 h,下午2點測定小鼠體重和空腹血糖,然后腹腔注射胰島素(標準飲食小鼠注射劑量為0.5 U/kg,高脂飲食小鼠注射劑量為1 U/kg),在15、30、60、90、120 min測定小鼠血糖并記錄。
1.2.3 小腸上皮細胞的蛋白免疫印記法(western blot)
解剖小鼠,將粘連在十二指腸周圍的胰腺剔除干凈,分離十二指腸、空腸和回腸。將分離的腸道縱向剖開,在PBS緩沖液中清洗后,用蓋玻片將小腸上皮細胞刮下,并轉移至EP管內,液氮速凍保存。使用時,加入含蛋白酶抑制劑、磷酸酶抑制劑I和磷酸酶抑制劑II的Buffer B研磨組織,并進行BCA定量,根據定量結果取適量勻漿液加入對應體積的5×SDS,95 ℃金屬浴加熱10 min后即可上樣。SDS-PAGE電泳結束后,將分離好的蛋白轉到PVDF膜上,4 ℃過夜孵育一抗,所用抗體為AOC1和GAPDH。次日上午,用PBST洗膜三次,二抗室溫孵育1 h,使用ECL試劑盒進行顯影。
1.2.4 肝臟脂質含量測定
取0.1 g左右的肝臟組織,在4 mL氯仿甲醇(2∶1)混合溶劑中研磨至無明顯組織塊。研磨完成后,加入800 μL生理鹽水,混勻后在4 ℃、1 000 r/min條件下離心20 min。將下層有機相移動至5 mL玻璃容量瓶中,加入足量氯仿調整相分界線,使分界線靠近刻度線(略低),次日使用氯仿定容。在2 mL的圓底深孔板中,加入10 μL的Triton X-100與氯仿(2∶1)混合溶劑,根據Wako LabAssayTM試劑盒指導,逐一添加標準液以及20 μL的樣品溶液至相應的孔中,混勻后將深孔板放入干燥箱中過夜。次日,每孔加入300 μL的Wako LabAssayTM顯色劑,于37 ℃孵育箱中孵育。將樣品轉移至96孔酶標板中。在600 nm波長處測量吸光度,以確定樣品中甘油三酯的濃度。
1.2.5 代謝籠分析
使用小動物能量檢測系統進行代謝籠分析,檢測籠溫度為22 ℃,光周期為12 h明/12 h暗。實驗前一周將小鼠單獨飼養,并適應代謝籠環境2天,隨后對小鼠進行為期2天的代謝籠監測。
1.2.6 統計學分析方法
所有數據均使用SPSS 25.0軟件進行統計分析,結果以均值±標準差表示,并使用OriginLab作圖。組間比較采用學生t檢驗,檢驗水準為0.05。
2 結果
2.1 AOC1與代謝疾病強相關
為了尋找AOC1與代謝性疾病的潛在關聯,我們利用T2DKP數據庫對AOC1基因進行了遺傳學分析。如圖1a所示,通過基因與表型關聯分析(關聯性非常強:HuGE≥30[9]),我們發現AOC1與多種代謝指標,如體重、載脂蛋白a、高密度脂蛋白膽固醇、甘油三酯等存在顯著關聯,這表明AOC1可能在代謝調節中起關鍵作用。如圖1b所示,遺傳變異分析顯示,AOC1基因區域內存在多個與脂代謝相關的變異,可能會影響體重、體重指數(body mass index,BMI)、舒張壓、血清白蛋白和高密度脂蛋白膽固醇等代謝指標(此處僅展示關聯性較強的表型,完整數據參見附件1)。此結果表明AOC1可能在脂質代謝中發揮重要作用。
 圖1
AOC1與人類疾病關聯性的綜合分析結果
圖1
AOC1與人類疾病關聯性的綜合分析結果
a:HuGE評分;b:
a. HuGE score; b. phenotypes that may be affected by variations within the
2.2 構建并驗證Aoc1?/?小鼠
首先,我們在野生型小鼠(Aoc1+/+)的全身組織中檢測了Aoc1基因的表達水平,結果顯示其在腸道中表達豐度最高(見圖2a)。我們通過CRISPR-Cas9技術全身性敲除了小鼠的Aoc1基因(見圖2b),構建了Aoc1?/?小鼠品系。為驗證小鼠品系構建是否成功,本研究解剖了三對Aoc1+/+小鼠和Aoc1?/?小鼠,提取十二指腸、空腸和回腸的RNA和蛋白質,進行RT-PCR和western blot檢測。RT-PCR結果(見圖2c-d)顯示Aoc1?/?小鼠體內Aoc1基因的敲低效率達99.9%,western blot結果同樣證明了Aoc1?/?小鼠的構建是成功的。
 圖2
Aoc1?/?小鼠品系構建
圖2
Aoc1?/?小鼠品系構建
a.
a.
2.3 Aocl?/?小鼠在高脂飲食條件下體脂增加
肥胖個體的體脂分布、代謝特征以及相關的代謝風險程度各不相同[10]。為了研究敲除Aoc1對脂質代謝產生的影響,我們分析了Aoc1+/+小鼠與Aoc1?/?小鼠在標準飲食和高脂飲食條件下的體重和體成分變化。結果顯示,在標準飲食條件下,Aoc1+/+小鼠與Aoc1?/?小鼠體重和體成分無顯著差異(具體數據見附件2);在高脂飲食條件下,雖然二者體重無顯著差異,但Aoc1?/?小鼠體脂率顯著高于Aoc1+/+小鼠,瘦體重含量相較于Aoc1+/+小鼠則顯著下降(見圖3)。
 圖3
高脂飲食下Aoc1?/?小鼠脂肪積累增加(*P < 0.05,**P < 0.01)
Figure3.
Lipid accumulation increased in Aoc1?/? mice on HFD (*P < 0.05, **P < 0.01)
圖3
高脂飲食下Aoc1?/?小鼠脂肪積累增加(*P < 0.05,**P < 0.01)
Figure3.
Lipid accumulation increased in Aoc1?/? mice on HFD (*P < 0.05, **P < 0.01)
2.4 敲除Aoc1導致小鼠的葡萄糖耐受不良
脂質積累的增加通常會導致糖耐受度的變化[11],因此我們對不同飲食條件下的Aoc1+/+小鼠與Aoc1?/?小鼠分別進行了OGTT和ITT實驗。在標準飲食喂養組,Aoc1的缺失并未影響小鼠的葡萄糖耐受(具體數據見附件3)。而在高脂飲食喂養組,敲除Aoc1使得小鼠葡萄糖耐受減退,在灌胃葡萄糖后Aoc1?/?小鼠血糖水平顯著高于Aoc1+/+小鼠;腹腔注射胰島素后二者血糖變化一致,Aoc1?/?小鼠血糖水平略高,但差異無統計學意義(見圖4)。
 圖4
敲除Aoc1導致小鼠的葡萄糖耐受不良(*P<0.05)
Figure4.
Knockout of Aoc1 impaired glucose tolerance in mice (*P<0.05)
圖4
敲除Aoc1導致小鼠的葡萄糖耐受不良(*P<0.05)
Figure4.
Knockout of Aoc1 impaired glucose tolerance in mice (*P<0.05)
2.5 敲除Aoc1不影響進食與能量消耗
為了進一步探究Aoc1?/?小鼠脂質代謝平衡發生的變化,本研究對高脂飲食條件下的Aoc1+/+小鼠與Aoc1?/?小鼠進行了代謝籠實驗。結果顯示,二者在進食量、氧氣消耗速率、二氧化碳產生速率、呼吸交換率、熱量消耗和活動量等方面均未產生顯著差異(見圖5)。Aoc1+/+小鼠與Aoc1?/?小鼠在呼吸交換率(respiratory exchange ratio,RER)水平上未體現出差異,說明敲除Aoc1并未改變小鼠對能量利用的偏好。小鼠進食量無顯著差異證明小鼠的能量攝入并未增加,而產熱和活動量無顯著差異則證明能量消耗沒有增加,因此我們認為,高脂飲食條件下Aoc1?/?小鼠體脂增高,并非是進食量增加或能量消耗減少所導致的,具體原因還需進一步探索。
 圖5
敲除Aoc1不影響進食與產熱
圖5
敲除Aoc1不影響進食與產熱
黑白區間代表光周期,運動次數代表小鼠在
the black and white intervals represent the photoperiod, and the movement counts represent the total activity of the mice along the
2.6 缺失Aoc1導致白色脂肪組織與肝臟的脂質積累增加
上述結果指出,敲除Aoc1未影響小鼠進食量和熱量消耗,但卻能引起脂肪積累,糖耐量減退。為了進一步探究脂質積累增加發生的具體部位,我們將高脂飲食組小鼠安樂死,對小鼠的各個組織進行稱重和取樣分析。結果顯示,Aoc1?/?小鼠的腹股溝白色脂肪組織(inguinal white adipose tissue,iWAT)和肝臟重量顯著增加(見圖6左圖)。脂肪是機體主要的能量儲存部位,肝臟則是短期脂肪存儲和轉換的場所,二者在脂質的儲存與利用中發揮著重要作用[12]。我們測定了肝臟中的脂質含量,結果顯示,Aoc1?/?小鼠肝臟甘油三酯的含量顯著增高(見圖6右圖)。
 圖6
高脂飲食下Aoc1?/?小鼠iWAT與肝臟脂質積累增加(*P < 0.05)
Figure6.
Lipid accumulation of iWAT and liver increased in Aoc1?/? mice on HFD (*P < 0.05)
圖6
高脂飲食下Aoc1?/?小鼠iWAT與肝臟脂質積累增加(*P < 0.05)
Figure6.
Lipid accumulation of iWAT and liver increased in Aoc1?/? mice on HFD (*P < 0.05)
2.7 敲除Aoc1不影響小鼠肝臟脂質合成和葡萄糖代謝
在高脂飲食條件下,敲除Aoc1后小鼠iWAT與肝臟的重量增加,肝臟中甘油三酯的含量也顯著增加,因此我們對肝臟脂質合成和葡萄糖代謝相關的基因水平進行了RT-PCR分析。結果顯示,在高脂飲食條件下,相比于Aoc1+/+小鼠,Aoc1?/?小鼠肝臟中脂質合成和葡萄糖代謝的相關基因表達水平無顯著變化(見圖7)。
 圖7
敲除Aoc1不影響脂質合成和葡萄糖代謝基因表達
Figure7.
Knockout of Aoc1 did not affect gene expression of lipid synthesis and glucose metabolism
圖7
敲除Aoc1不影響脂質合成和葡萄糖代謝基因表達
Figure7.
Knockout of Aoc1 did not affect gene expression of lipid synthesis and glucose metabolism
3 討論
AOC1是多胺代謝的關鍵酶,多胺代謝失調在癌癥中十分常見[13]。既往AOC1的相關研究大部分集中在癌癥領域,包括胃癌、結直腸癌、前列腺癌、鼻咽癌和肝細胞癌[14-16]。有研究構建了Aoc1?/?小鼠,但其主要聚焦于敲除Aoc1后對組胺代謝的影響,未研究AOC1與脂質代謝之間的關系[17]。截至目前,關于AOC1在脂質代謝中的功能研究十分有限。
通過遺傳學分析,本研究發現AOC1與體重、BMI、舒張壓、血清白蛋白和高密度脂蛋白膽固醇等多個代謝指標強相關。有研究指出在大鼠十二指腸中輸注脂質,可觀察到淋巴管內組胺濃度和AOC1活性顯著增加,并在輸注后1 h同時達到峰值,這表明AOC1與脂質吸收之間存在關聯[18]。因此,我們認為AOC1可能在脂質代謝中發揮重要生物學作用。
本研究通過構建Aoc1?/?小鼠品系并分析代謝表型,直觀地觀察敲除Aoc1對脂質代謝的影響。結果顯示,在高脂飲食條件下,Aoc1?/?小鼠和Aoc1+/+小鼠相比,體脂率顯著增高,葡萄糖耐受減退,iWAT與肝臟重量顯著增加,表現出了更差的代謝表型,這與遺傳學分析結果是一致的,證明敲除Aoc1會導致小鼠代謝表型顯著改變。
Aoc1?/?小鼠體脂率顯著增加,表明其脂質積累增加,因此我們猜測AOC1可能影響了小鼠的脂質代謝平衡。代謝籠檢測證明,Aoc1?/?小鼠與Aoc1+/+小鼠相比,進食量和能量消耗并無顯著差異,對能量物質的利用偏好也無顯著差異,因此脂質代謝平衡被破壞并非發生在能量食物攝取和能量消耗環節,我們推斷可能是脂質吸收或合成水平發生了變化,如脂質吸收或合成水平增加,均可以在進食和消耗無差異的情況下導致脂質積累增加。因此,后續我們計劃通過橄欖油灌胃實驗、小腸切片油紅染色以及測定糞便內甘油三酯含量等方法,檢測腸道脂質吸收有無差異;并通過測定脂肪酸合成和氧化關鍵酶的基因表達水平以及活性變化,檢測脂質合成能力的變化。
在高脂飲食條件下,Aoc1?/?小鼠與Aoc1+/+小鼠相比,脂質合成和葡萄糖代謝基因的表達水平并未發生顯著變化。我們推測這可能證明肝臟脂質異常積累并非是脂質合成增加引起的,也可能是由于高脂飲食喂養時間過長,引起小鼠產生代謝適應和代償機制,因此掩蓋了基因表達的初始差異。后續的研究中,我們會縮短高脂飲食喂養時間,測定肝臟和脂肪中的脂肪酸氧化基因的表達水平,以進一步驗證Aoc1缺失對脂肪酸氧化通路的影響。
Aoc1在腸道中CT值范圍為17至21,而在肝臟和脂肪組織中的CT值范圍為25至26,這表明盡管Aoc1在腸道中表達最高,但在肝臟和脂肪組織中仍有相對較低的表達。為了更好地探究AOC1是否在不同組織中發揮不同的代謝調控功能,我們后續將通過Aoc1f/f小鼠分別和Villin-cre、Albumin-cre和AdipoQ-cre小鼠交配,得到腸道、肝臟和脂肪組織特異性敲除小鼠,具體去探究AOC1在各個組織當中發揮著怎樣的功能。
AOC1是胞外代謝組胺的必需酶,催化組胺的氧化降解。組胺在外周組織可作為炎癥因子,參與調節免疫反應和炎癥發展的過程[19]。肥胖會引起慢性持續性低度炎癥,這種炎癥狀態已被證明是導致胰島素抵抗和2型糖尿病等代謝性疾病的關鍵因素之一[20-21]。在脂肪組織中,我們推測敲除Aoc1可能通過抑制組胺降解,促進脂肪組織的炎癥狀態,進而促進了脂肪組織重塑和擴張。后續我們將通過檢測脂肪組織中組胺濃度以及組胺引起的炎癥反應來驗證這一可能性
近年來有研究報道了銅穩態和脂質代謝之間的聯系[22–25]。細胞水平的實驗證明,胞內銅水平升高會促進脂質水解,銅水平下降則減少脂解反應的發生[26]。在白色脂肪組織中,銅通過影響SSAO酶的活性來調控脂解反應[26]。SSAO的活性隨局部銅含量的增多而增高,激活的SSAO可以反過來刺激葡萄糖和長鏈脂肪酸的攝取[27-28]。SSAO?/?小鼠的白色脂肪組織會增大,并產生輕度肥胖[29]。這與本研究的結果一致,高脂飲食下Aoc1?/?小鼠的體脂含量更高,iWAT重量增加,因此本研究推斷AOC1可能存在與SSAO類似的功能,并通過銅穩態參與調節脂質代謝,未來我們將會進一步探究銅穩態在AOC1介導的脂質代謝中的作用。
4 結論
本研究從代謝研究的角度出發,通過高脂飲食喂養構建出Aoc1?/?小鼠的肥胖模型,并觀察到Aoc1?/?小鼠體脂率顯著增高、葡萄糖耐受減退、白色脂肪組織和肝臟重量顯著增加等代謝表型,證明了AOC1在脂質代謝平衡中發揮著重要作用。此發現加深了我們對AOC1功能的了解,有助于揭示其在脂質代謝調節中的具體作用和潛在機制,在未來的研究中我們將進一步探究AOC1對于脂質代謝的影響。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:向思婷、劉莘穎和李匡政主要負責數據處理、數據分析與論文寫作;趙同金和王旭主要負責實驗指導、寫作指導和論文審閱。
倫理聲明:本研究通過了復旦大學倫理委員會的審批(批文編號:2020代謝整合院JS-006)。
本文附件見本刊網站的電子版本(biomedeng.cn)。