細菌耐藥性問題一直懸而未決,近些年來,受自然界啟發的仿生納米結構表面因通過力學機制展示殺菌特性而受到了極大的關注。本文綜述了納米結構力學殺菌表面領域的主要研究進展,包括具有力學殺菌性能的納米結構表面的各種制備方法,以及細菌與納米結構表面相互作用的基本機制和相關的物理模型;此外,還介紹了納米結構表面在生物醫學中的應用。最后,對力學殺菌研究面臨的重大挑戰和未來研究發展方向進行了展望。
引用本文: 陳世雄, 梁英, 田曉寶, 王凱. 基于力學殺菌機制的納米結構表面研究進展. 生物醫學工程學雜志, 2024, 41(5): 1046-1052, 1061. doi: 10.7507/1001-5515.202407099 復制
版權信息: ?四川大學華西醫院華西期刊社《生物醫學工程學雜志》版權所有,未經授權不得轉載、改編
0 引言
細菌耐藥性問題一直以來深受關注,對公共健康構成了巨大威脅。抗生素的濫用導致細菌變異產生抗性,而且生物膜提供的物理保護屏障和促進遺傳物質交換的通道,進一步加劇了細菌耐藥性問題。近些年來,研究者們通過模仿自然界中天然的微/納米結構表面,如昆蟲翅膀,開發了一種新型納米結構力學殺菌技術,依賴于高長寬比形貌的納米顆粒的力學作用來破壞細菌結構,實現了表面結構殺菌的功能,為解決細菌化學耐藥性問題提供了一種獨特的策略。
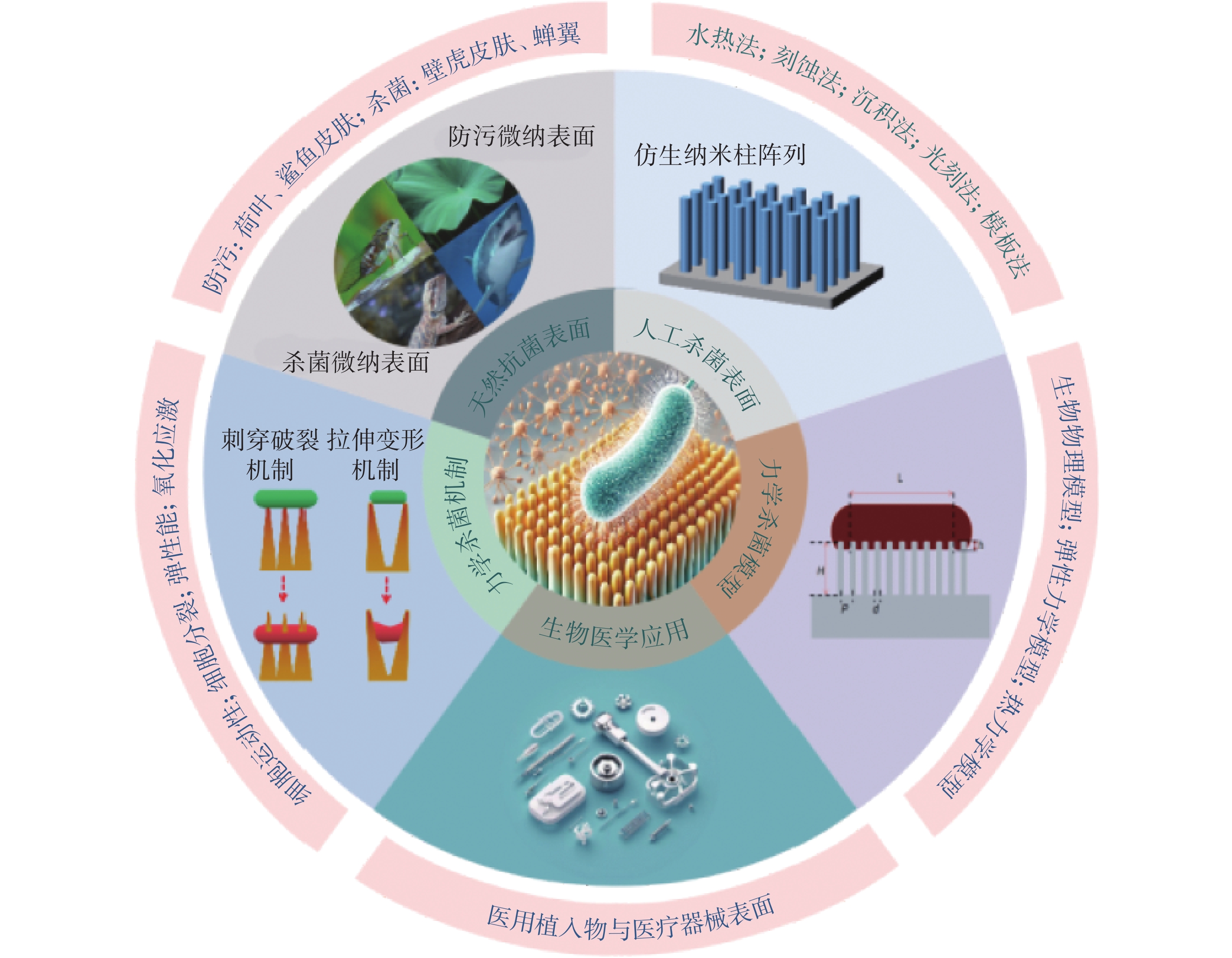
盡管這種納米結構力學殺菌技術展現出潛力,但它仍處于起步階段,其潛在的力學殺菌機制仍不確定。研究認為細胞黏附、納米柱的彈性變形、細胞分裂和運動所產生的物理力可能是關鍵因素。然而,納米結構力學殺菌的主導機制及其關鍵決定因素仍不明確。大量研究表明,納米結構表面幾何參數對殺菌率具有很大影響[1-6],且納米結構對細菌的黏附力是細菌變形死亡的驅動力[7-11]。但是由于納米尺度的形貌控制以及納牛(nN)尺度的作用力測定存在極大挑戰,細菌對納米結構力學響應導致的殺菌機制缺乏有效可靠的物理描述模型,這限制了對納米結構如何引起細菌變形直至破壞死亡的理解,也限制了對制備特定殺菌微納結構的設計指導,因而難以精確控制納米結構對細菌的殺滅作用。本文主要對力學殺菌表面的研究進展進行闡述,重點介紹了納米結構力學殺菌表面的制備方法和機制研究(見圖1)。
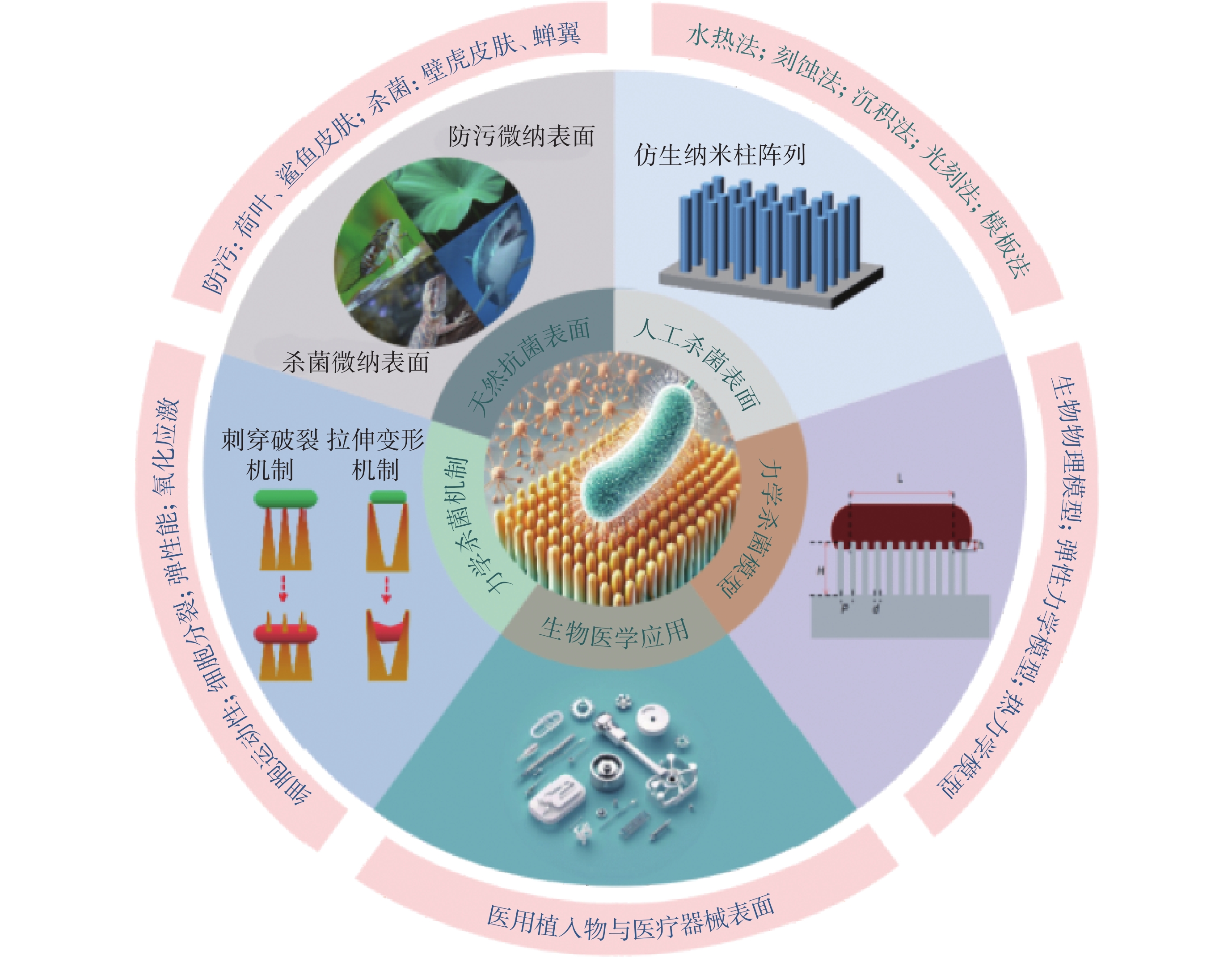 圖1
力學殺菌表面研究現狀示意圖
Figure1.
Schematic illustration of the current research status on mechanical bactericidal surfaces
圖1
力學殺菌表面研究現狀示意圖
Figure1.
Schematic illustration of the current research status on mechanical bactericidal surfaces
1 力學殺菌表面
理想的殺菌表面應該是無毒的、非特異性的,同時要具有耐久性和高效的廣譜抗菌性[12]。然而,現有技術尚未能克服開發這種殺菌表面所面臨的挑戰,這涉及到材料選擇、制造過程等多方面因素。因此,研究人員通過深入探究自然界中植物和動物表面的殺菌機制,尋找具有潛在抗菌特性的新方法,為創造新型抗菌表面提供新思路。
1.1 天然殺菌表面
在過去的十年里,研究人員發現鯊魚皮膚、壁虎皮膚、荷葉和昆蟲翅膀等表面具備有效的抗菌性[13]。這些表面均具有獨特的結構,荷葉和鯊魚皮膚通過微納結構的抗污染性質防止細菌的黏附,而壁虎皮膚和昆蟲翅膀表面的微納結構不僅抗菌更能高效殺菌。Ivanova等[14]研究了蟬翼表面,其殺菌特性是由高度有序的納米顆粒陣列與細菌的直接相互作用引起的,這與自清潔導致的抗污染特性不同。他們采用掃描電子顯微鏡和原子力顯微鏡(atomic force microscope,AFM)觀測了銅綠假單胞菌附著在蟬翼表面、下移直至被破壞的過程,并在蟬翼表面涂覆金膜來改性蟬翼表面,表面依然可殺菌,表明蟬翼不是化學殺菌而是通過結構殺菌。緊接著又研究了蟬翼對不同種類和形狀細菌的殺滅作用,實驗證明蟬翼對革蘭氏陽性菌的殺菌效率遠不如革蘭氏陰性菌[15],這可能是由于革蘭氏陽性菌的細胞壁由交聯肽聚糖網絡組成,能抵抗黏附時產生的應力。此外,革蘭氏陽性細菌具有較厚的細胞壁,能夠儲存更多的彈性能量,從而減輕了納米柱施加的拉伸力,并導致較弱的殺菌效果[16]。
Ivanova團隊發現蟬翼對細菌有殺菌作用后,對三種蜻蜓翅膀進行了類似的實驗,與蟬翼對比,其納米柱的高度更高,直徑和間距更小,并且尺寸更為隨機,結果發現它們對革蘭氏陽性菌和革蘭氏陰性菌均具有殺菌作用,且三種蜻蜓翅膀對細菌的致死率并不相同。研究認為,蜻蜓翅膀的殺菌能力和蟬翼一樣是由其表面納米結構產生的應力驅動的,這一新型殺菌機制的發現非常有價值,因為它揭示了一種完全由力學效應產生的殺菌特性[17]。
1.2 人工殺菌表面
受到自然界的啟發,人們已經制備出微米尺度的紋理表面。然而,微米級的紋理表面并不適合作為殺菌表面,因為尺度微小的細菌易于在微米結構之間的縫隙中定居,直至形成生物膜[18]。蟬翼和蜻蜓翅膀的納米陣列結構殺菌特性的發現,使它們成為合成力學殺菌表面的理想新模板。已有許多方法技術可用不同材料制備出仿生納米柱陣列結構表面,如水熱處理[19-21]、等離子刻蝕[22-24]、沉積[25-27]、光刻[28-30]和模板法[31-34],接下來介紹這幾種制備方法。
1.2.1 水熱處理
水熱處理是在水環境中調控溫度和壓力,控制表面的微納結構。例如,Zhao等[19]通過常壓低溫水熱合成了三種不同幾何特征的三維鈦表面納米結構——納米線簇、納米線/片狀簇和納米片簇,不同表面幾何形態與殺菌效率密切相關,為構建殺菌生物醫學植入物提供了新途徑。Bhadra等[20]通過一步水熱蝕刻工藝制備了仿蜻蜓翅膀的鈦表面結構,表征結果顯示這些結構能調控細菌附著并促進人成纖維細胞的有序生長,證實了通過設計鈦表面納米特征可控制細菌附著。
1.2.2 等離子刻蝕
等離子刻蝕是利用等離子體在材料表面產生的化學反應和物理碰撞作用,通過調整等離子體參數,如能量、功率、壓力和時間,調節材料表面的形貌和結構。例如,Roy等[22]利用氯等離子體進行無掩模蝕刻,在鈦表面上制造了具有殺菌活性的納米柱結構,研究發現其殺菌機制和效率主要取決于納米柱的長寬比。
1.2.3 沉積法
沉積法通過化學反應在材料表面形成殺菌薄膜或涂層,包括物理氣相沉積、化學氣相沉積、溶液沉積等[35]。例如,Yick等[26]通過熱化學氣相沉積技術,在經過熱氧化和氧化鋁(Al2O3)層濺射處理的硅片上,通過磁控濺射沉積鐵催化劑,然后在特定溫度和氣體混合條件下生長出垂直排列的碳納米管(carbon nanotube,CNT)陣列,發現經過等離子體處理的CNT陣列具有選擇性生物膜支持、選擇性形態完整性保持和生物相容性等重要特性。
1.2.4 光刻法
光刻法,又稱光化學蝕刻,是一種用于精細加工半導體、金屬和絕緣體等材料表面以制備納米結構的微納制造技術。該技術基于光敏抗蝕劑(光刻膠)在特定波長的光照射下發生化學反應的原理,通過光掩膜板上的圖案,將光束投射到涂有光刻膠的基底上,使光刻膠在曝光區域發生固化或溶解。Quilis等[28]開發了一種熱響應型水凝膠納米結構陣列,該陣列利用金納米顆粒陣列增強化學和生物傳感的靈敏度。通過四束紫外激光干涉光刻技術在聚N-異丙基丙烯酰胺(pNIPAAm)水凝膠上形成光刻膠圖案,隨后采用干法蝕刻工藝對水凝膠進行精細加工,最終形成所需的納米結構。
1.2.5 模板法
模板法是將材料與模板接觸,然后使用化學或物理方法,在模板的引導下進行材料的生長或沉積,最后去除模板即可得到具有特定結構的材料表面。例如Lee等[31]采用模板法制備了聚苯乙烯納米結構表面,通過將電化學制備的多孔陽極氧化鋁(anodic aluminum oxide,AAO)作為一種精細的復制模板,用于熱壓驅動的納米壓印工藝中,實現納米級圖案的高效轉移。Zhao等[33]利用AAO模板方法復制了具有力學殺菌性能的納米柱表面,隨后將聚多巴胺的薄光熱層迅速沉積在納米結構表面上,開發了一種具有光熱增強抗菌性能的力學殺菌納米結構表面,該表面表現出協同抗菌性能,對革蘭氏陽性菌和革蘭氏陰性菌的抗菌效率均顯著提高。
以上這些方法各有優勢和局限性,適用于不同的材料和應用場景(見表1)。
2 力學殺菌機制
目前,關于納米結構如何殺滅細菌的機制尚未形成共識,且可能因不同生物體表面結構的差異而有所不同。黏附被認為是殺死細菌的主要機制,細菌和納米結構相互作用導致細胞壁肽聚糖的變形,從而導致災難性的破裂及隨后的細胞內容物泄漏[6]。大多數研究者認為,這種相互作用主要是由非化學性的物理作用力,包括但不限于毛細力、重力、剪切力、擠壓力以及非特異性相互作用力,這種作用力可能直接作用于細菌細胞,它們可能單獨作用,也可能以某種組合形式共同影響細菌。此外,細胞外多糖也可能在這一過程中發揮間接作用。當細菌細胞懸浮于納米結構表面時,它們會遭受到足以撕裂或穿刺細胞膜的力量。如果這種力量超過了細胞膜的耐受極限,細菌就會因撕裂或穿刺而死亡。對于體積較小的細菌,它們更可能附著在納米結構的微刺側面或微刺之間的空隙中。在這種情況下,細菌細胞不會遭受穿刺,而是由于受到擠壓和剪切力的作用,導致細胞膜破裂[36]。在這一進展的背景下,不同的研究小組提出了其他殺菌機制來解釋他們的觀察結果。盡管這些機制在將細菌死亡歸因于物理效應方面有相似之處,但它們對這些力量的來源的假設有所不同,如細菌運動產生的剪切力、納米柱彎曲變形產生的彈性力、細菌細胞分裂受到的擠壓力以及納米柱對細菌產生的應力導致細菌自身的應激反應。
2.1 細菌運動性
一些材料表面的微觀結構可以限制細菌的自由運動,從而阻礙它在生長介質中的定位和生長。Bandara等[37]首次提出了細菌的運動可能在力學殺菌過程中發揮作用,通過采用先進的顯微技術觀察細菌細胞與納米柱界面之間的連續作用過程,對附著在蜻蜓翅膀上的大腸桿菌細胞的形態學分析,發現納米柱的穿透發生在細菌邊緣,而位于細菌下方的納米柱被細胞外多糖層覆蓋,與細菌細胞膜并未直接接觸,附著的細菌在試圖遠離不利的納米柱地形時推拉納米柱,從而對細菌膜施加剪切力,導致細菌內膜與外膜分離而造成了細菌膜損傷。
2.2 彈性能量的儲存和釋放
一些材料具有能夠吸收外部壓力并在適當時釋放的彈性性質,當細菌接觸到這些材料表面時,表面的彈性變化可以造成對細菌的壓力,從而導致細菌膜的破壞和細胞內部結構的損壞[2, 5]。Ivanova的團隊最初提出了黏附機制,后來提出了一種基于高縱橫比納米柱彈性能的存儲和釋放的替代機制[25]。通過評估短(高度=1 μm)和長(高度=30 μm)CNT的殺菌性能,他們發現與細菌接觸的納米柱通常是彎曲的,這表明它們可以儲存大量的彈性能量,從而損害細菌細胞。
2.3 細胞分裂
一些具有特定的結構和形狀的材料可以通過直接干擾細菌的細胞分裂過程來實現殺菌。例如,K?ller等[38]將鈦納米柱置于不影響細胞活力的不同營養水平細菌懸液中時,發現在營養豐富的條件下,細菌的死亡率更高,此外,在營養豐富的細菌懸浮液中使用DL-絲氨酸羥胺抑制了細菌增殖,反而降低了細菌的死亡率。研究表明細菌細胞分裂導致的細胞伸長會產生力學效應,可以使附著在納米柱上的細菌細胞變形并死亡。細胞分裂生長過程中的這種力學效應具體如何產生影響就不得而知了,可能是納米結構在細菌分裂時阻礙了細胞壁的形成或細胞分裂蛋白的功能,從而導致細胞死亡。
2.4 氧化應激
某些表面的納米結構與細菌作用導致細菌產生氧化物,如活性氧,這些物質具有高度氧化性,可以對細菌細胞膜和細胞內部產生損害,最終導致細菌的死亡[39-40]。Jenkins等[41]在研究二氧化鈦對不同細菌的殺菌活性時,提出氧化應激是一種潛在的殺菌驅動力。他們的研究發現,納米柱很少穿透和變形細胞膜,也幾乎沒有引起形態學變化。因此,他們認為生理效應可能在這一過程中發揮了作用。進一步的研究發現了納米柱表面的蛋白質組學差異,表明氧化應激可能抑制了細胞生長并引起了輕微的形態損傷。
雖然以上細胞運動性、納米柱的彈性變形、細胞分裂和細菌氧化應激被認為是驅動力學殺菌機制的關鍵因素,然而,主導機制及其關鍵決定因素仍然不清楚。因此,現階段對于納米微結構與細菌相互作用的力學殺菌機制尚缺乏清晰的理解。由于這一瓶頸問題的存在,盡管基于力學響應的納米微結構殺菌表面吸引了大量關注,但由于缺乏指導性的納米微結構殺菌設計策略,這些表面的精確制造和高效殺菌性能的實現仍然面臨挑戰。
3 納米陣列力學殺菌模型及力學微觀測試
最初,Pogodin等[42]通過開發生物物理模型,揭示了細菌與蟬翼表面納米柱結構相互作用的機制,其中細菌細胞在附著于納米柱時會經歷膜的非均勻拉伸,可能在柱間區域導致不可逆破裂和細胞死亡。他們還發現革蘭氏陽性菌因具有較高的細胞剛度而更具抵抗力。關鍵物理過程包括細菌細胞膜在納米柱上的吸附和拉伸,以及由持續拉伸引起的膜破裂。細胞的剛度和膜的初始拉伸程度是影響蟬翼表面殺菌作用敏感性的主要生物響應機制。然而該模型是靜態的,沒有考慮細菌的形狀尺寸,并未提及力學殺菌過程中的受力情況。Xue等[43]考慮了細胞膜與納米結構接觸時的力學平衡條件,建立了細菌與納米柱之間的彈性力學模型,模型中使用了細菌的密度、細胞壁的厚度和彈性模量等參數,利用拉伸理論研究細菌細胞的破裂過程,通過評估細胞壁的拉伸程度分析了表面納米粗糙度對細菌細胞的影響,得到并討論了革蘭氏陽性菌和革蘭氏陰性菌拉伸度與表面結構幾何參數的函數關系,當納米柱變得更尖銳且柱間距離更大時,納米柱表面的抗菌性能增強。但他認為是細菌重力導致變形,然而,細菌只是微米尺度,其重力遠小于所受到的界面張力。Li[44]運用熱力學分析,建立了一個理論模型,該模型考慮了細菌的拉伸模量、彎曲模量、細胞膜與表面之間的粘附能等參數,通過分析附著在圖案表面的細菌細胞的總自由能變化,包括膜的接觸粘附彎曲能、邊緣彎曲能以及粘附能,來闡明納米圖案表面的殺菌機制。該模型指出細菌與納米結構的接觸面積增大會促使細菌死亡,然而并未說明是什么力導致細菌變形。
以上模型雖然從一定角度解釋了納米結構殺菌的機制,但并未完全解釋納米結構殺菌的力學機制,這是由于納米結構力學殺菌的過程是復雜的,需要考慮多種因素的影響。例如,從納米結構的幾何尺寸角度,具有較高縱橫比的納米柱有助于增強細菌細胞的變形和破裂,提升殺菌效能[7, 45]。納米柱的直徑、高度和它們之間的間距是決定細菌黏附強度及細胞損傷的關鍵因素[1, 3-4]。Cui等[1]發現在聚碳酸酯表面上制造的納米結構對細菌的殺滅效果隨著納米柱之間距離的增大而增強,當間距達到170 nm時,殺菌效果達到峰值。然而,當間距超過這個值時,效果開始逐漸減弱。同時,他們還發現,當納米柱的高度增加至300 nm時,其殺菌效率呈現出指數級的顯著提升,但在超過這個高度后,效率的增長趨勢開始放緩并趨于穩定。此外,細菌的細胞壁厚度及其彈性模量是它們抵抗外部壓力的能力指標,這些因素決定了它們對納米結構的反應[2, 5, 25]。表面的粗糙度和化學組成等特征也會影響細菌的黏附能力及其隨后受到的力學影響,除了黏附力之外,其他外部力量,例如毛細管力,也能施加足夠的壓力,迅速消滅納米柱上的細菌[6]。Valiei等[46]研究發現親水性納米柱在無外力作用時對細菌不具有殺傷性,其作用依賴于外部力量,如空氣-液體界面移動產生的表面張力,可迅速殺死細菌,這一發現為設計快速有效的抗菌材料提供了新的理解。
在生物學上,判斷細菌死活通常依賴于它們的生長繁殖能力、新陳代謝能力、細胞膜的完整性以及復制轉錄能力。傳統的平板培養計數法是通過觀察細菌在培養基上的生長情況來判定,而更現代的方法包括使用熒光染料結合流式細胞儀、單細胞拉曼分析技術等[47]。例如,BB-
4 力學殺菌表面在醫學領域的應用
4.1 醫用植入物
力學殺菌表面在醫用植入物中的應用通過提供一種物理抗菌機制,有效預防和減少植入物相關感染,同時促進組織修復和提高生物相容性,減少對抗生素的依賴,有助于減緩抗生素耐藥性的發展,并改善植入物的整體性能和臨床效果。例如,de Sous等[52]利用水熱法成功制備了納米片狀鈦表面,該研究表明,即使在人血清蛋白吸附的情況下,這種表面也能高效殺滅金黃色葡萄球菌和銅綠假單胞菌,顯示出良好的抗生物污染性能和高殺菌效率;此外,該納米片表面還能促進M2型巨噬細胞的極化,增加抗炎細胞因子的分泌,有助于傷口愈合。de Sous等[53]還通過堿熱處理制備了兩種不同表面粗糙度的微納結構鈦表面,這些表面增強了MG-63細胞的黏附和分化,而且MN-HCl表面在促進細胞增殖方面表現更佳,并且展現出對細菌的高效殺菌活性;此外,研究還表明,通過調節微米和納米尺度上的表面粗糙度和結構,可以有效操縱成骨細胞反應,結合力學抗菌活性,可實現更優的生物相容性和抗菌效果。
4.2 醫療器械抗菌表面
Zhang等[32]利用低成本的AAO模板輔助方法和環保的層層組裝技術,結合鞣酸和鐵離子,制備了雜化納米柱,研究發現該表面通過結合光熱療法和力學殺菌特性,能夠有效殺滅革蘭氏陰性和陽性細菌,同時對哺乳動物細胞具有生物相容性。Yi等[54]設計了一種新型的納米柱表面,通過在氧化鋅納米柱上嫁接兩性離子聚合物(聚磺甜菜堿甲基丙烯酸酯,PSBMA),這種表面在干燥條件下表現出顯著的力學殺菌活性,而在水溶液中則能輕易地釋放殺死的細菌和碎片;研究還評估了這種表面對L929成纖維細胞的細胞相容性和對紅細胞的血液相容性,結果表明它具有較低的細胞毒性和溶血活性。Liu等[55]開發了一種通過在生物啟發的納米圖案表面嫁接鹽響應性聚兩性離子刷來制備的納米圖案表面。這種表面能夠在低離子強度展現高力學殺菌效率,而在高離子強度條件下,通過擴展的聚合物鏈使死亡的細菌殘留物容易脫落。該力學殺菌納米圖案表面在體外和體內均顯示出良好的生物相容性,并通過皮下植入模型展示了預防圍手術期感染的潛力。
5 總結與展望
生物醫學設備的進步對于提升醫療保健質量至關重要,但抗生素的濫用和抗菌涂層的限制已引發耐藥性問題,促使研究者探索新的抗菌策略。理想的抗菌表面應具備無毒、廣譜、持久且高效的特點。仿生學為此提供了解決方案,研究者通過模仿自然抗菌特性,利用水熱處理、等離子刻蝕、沉積法、光刻法和模板法等技術在不同材料上形成納米結構,創造高效且持久的抗菌表面。盡管已有物理模型揭示細菌與納米柱結構的相互作用機制,表明細菌細胞膜在納米柱之間伸展可能導致細胞的破裂,但殺菌機制的主導因素和實際作用尚不完全明確,需要進一步研究。未來研究可以構建黏附的力學模型和變形協調準則,分析和驗證黏附力模型和細菌捕獲、殺滅的動態行為,深入研究細菌與納米結構的相互作用機制,并且針對不同細菌和納米結構相互作用的力學殺菌機制,建立相應的物理模型,以便制定更加高效的抗菌設計策略。
因此,力學殺菌表面的研究雖然取得了顯著進展,但仍存在許多未解之謎和技術挑戰。未來的研究應集中在揭示力學殺菌機制、優化制備技術及開發多功能抗菌表面上,為抗菌材料的實際應用提供更可靠的解決方案。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:陳世雄收集、整理文獻并撰寫文章;梁英負責論文選題以及修改指導;田曉寶負責提供基金支持和論文修改指導;王凱負責對文章思路進行完善和審校論文。
0 引言
細菌耐藥性問題一直以來深受關注,對公共健康構成了巨大威脅。抗生素的濫用導致細菌變異產生抗性,而且生物膜提供的物理保護屏障和促進遺傳物質交換的通道,進一步加劇了細菌耐藥性問題。近些年來,研究者們通過模仿自然界中天然的微/納米結構表面,如昆蟲翅膀,開發了一種新型納米結構力學殺菌技術,依賴于高長寬比形貌的納米顆粒的力學作用來破壞細菌結構,實現了表面結構殺菌的功能,為解決細菌化學耐藥性問題提供了一種獨特的策略。
盡管這種納米結構力學殺菌技術展現出潛力,但它仍處于起步階段,其潛在的力學殺菌機制仍不確定。研究認為細胞黏附、納米柱的彈性變形、細胞分裂和運動所產生的物理力可能是關鍵因素。然而,納米結構力學殺菌的主導機制及其關鍵決定因素仍不明確。大量研究表明,納米結構表面幾何參數對殺菌率具有很大影響[1-6],且納米結構對細菌的黏附力是細菌變形死亡的驅動力[7-11]。但是由于納米尺度的形貌控制以及納牛(nN)尺度的作用力測定存在極大挑戰,細菌對納米結構力學響應導致的殺菌機制缺乏有效可靠的物理描述模型,這限制了對納米結構如何引起細菌變形直至破壞死亡的理解,也限制了對制備特定殺菌微納結構的設計指導,因而難以精確控制納米結構對細菌的殺滅作用。本文主要對力學殺菌表面的研究進展進行闡述,重點介紹了納米結構力學殺菌表面的制備方法和機制研究(見圖1)。
 圖1
力學殺菌表面研究現狀示意圖
Figure1.
Schematic illustration of the current research status on mechanical bactericidal surfaces
圖1
力學殺菌表面研究現狀示意圖
Figure1.
Schematic illustration of the current research status on mechanical bactericidal surfaces
1 力學殺菌表面
理想的殺菌表面應該是無毒的、非特異性的,同時要具有耐久性和高效的廣譜抗菌性[12]。然而,現有技術尚未能克服開發這種殺菌表面所面臨的挑戰,這涉及到材料選擇、制造過程等多方面因素。因此,研究人員通過深入探究自然界中植物和動物表面的殺菌機制,尋找具有潛在抗菌特性的新方法,為創造新型抗菌表面提供新思路。
1.1 天然殺菌表面
在過去的十年里,研究人員發現鯊魚皮膚、壁虎皮膚、荷葉和昆蟲翅膀等表面具備有效的抗菌性[13]。這些表面均具有獨特的結構,荷葉和鯊魚皮膚通過微納結構的抗污染性質防止細菌的黏附,而壁虎皮膚和昆蟲翅膀表面的微納結構不僅抗菌更能高效殺菌。Ivanova等[14]研究了蟬翼表面,其殺菌特性是由高度有序的納米顆粒陣列與細菌的直接相互作用引起的,這與自清潔導致的抗污染特性不同。他們采用掃描電子顯微鏡和原子力顯微鏡(atomic force microscope,AFM)觀測了銅綠假單胞菌附著在蟬翼表面、下移直至被破壞的過程,并在蟬翼表面涂覆金膜來改性蟬翼表面,表面依然可殺菌,表明蟬翼不是化學殺菌而是通過結構殺菌。緊接著又研究了蟬翼對不同種類和形狀細菌的殺滅作用,實驗證明蟬翼對革蘭氏陽性菌的殺菌效率遠不如革蘭氏陰性菌[15],這可能是由于革蘭氏陽性菌的細胞壁由交聯肽聚糖網絡組成,能抵抗黏附時產生的應力。此外,革蘭氏陽性細菌具有較厚的細胞壁,能夠儲存更多的彈性能量,從而減輕了納米柱施加的拉伸力,并導致較弱的殺菌效果[16]。
Ivanova團隊發現蟬翼對細菌有殺菌作用后,對三種蜻蜓翅膀進行了類似的實驗,與蟬翼對比,其納米柱的高度更高,直徑和間距更小,并且尺寸更為隨機,結果發現它們對革蘭氏陽性菌和革蘭氏陰性菌均具有殺菌作用,且三種蜻蜓翅膀對細菌的致死率并不相同。研究認為,蜻蜓翅膀的殺菌能力和蟬翼一樣是由其表面納米結構產生的應力驅動的,這一新型殺菌機制的發現非常有價值,因為它揭示了一種完全由力學效應產生的殺菌特性[17]。
1.2 人工殺菌表面
受到自然界的啟發,人們已經制備出微米尺度的紋理表面。然而,微米級的紋理表面并不適合作為殺菌表面,因為尺度微小的細菌易于在微米結構之間的縫隙中定居,直至形成生物膜[18]。蟬翼和蜻蜓翅膀的納米陣列結構殺菌特性的發現,使它們成為合成力學殺菌表面的理想新模板。已有許多方法技術可用不同材料制備出仿生納米柱陣列結構表面,如水熱處理[19-21]、等離子刻蝕[22-24]、沉積[25-27]、光刻[28-30]和模板法[31-34],接下來介紹這幾種制備方法。
1.2.1 水熱處理
水熱處理是在水環境中調控溫度和壓力,控制表面的微納結構。例如,Zhao等[19]通過常壓低溫水熱合成了三種不同幾何特征的三維鈦表面納米結構——納米線簇、納米線/片狀簇和納米片簇,不同表面幾何形態與殺菌效率密切相關,為構建殺菌生物醫學植入物提供了新途徑。Bhadra等[20]通過一步水熱蝕刻工藝制備了仿蜻蜓翅膀的鈦表面結構,表征結果顯示這些結構能調控細菌附著并促進人成纖維細胞的有序生長,證實了通過設計鈦表面納米特征可控制細菌附著。
1.2.2 等離子刻蝕
等離子刻蝕是利用等離子體在材料表面產生的化學反應和物理碰撞作用,通過調整等離子體參數,如能量、功率、壓力和時間,調節材料表面的形貌和結構。例如,Roy等[22]利用氯等離子體進行無掩模蝕刻,在鈦表面上制造了具有殺菌活性的納米柱結構,研究發現其殺菌機制和效率主要取決于納米柱的長寬比。
1.2.3 沉積法
沉積法通過化學反應在材料表面形成殺菌薄膜或涂層,包括物理氣相沉積、化學氣相沉積、溶液沉積等[35]。例如,Yick等[26]通過熱化學氣相沉積技術,在經過熱氧化和氧化鋁(Al2O3)層濺射處理的硅片上,通過磁控濺射沉積鐵催化劑,然后在特定溫度和氣體混合條件下生長出垂直排列的碳納米管(carbon nanotube,CNT)陣列,發現經過等離子體處理的CNT陣列具有選擇性生物膜支持、選擇性形態完整性保持和生物相容性等重要特性。
1.2.4 光刻法
光刻法,又稱光化學蝕刻,是一種用于精細加工半導體、金屬和絕緣體等材料表面以制備納米結構的微納制造技術。該技術基于光敏抗蝕劑(光刻膠)在特定波長的光照射下發生化學反應的原理,通過光掩膜板上的圖案,將光束投射到涂有光刻膠的基底上,使光刻膠在曝光區域發生固化或溶解。Quilis等[28]開發了一種熱響應型水凝膠納米結構陣列,該陣列利用金納米顆粒陣列增強化學和生物傳感的靈敏度。通過四束紫外激光干涉光刻技術在聚N-異丙基丙烯酰胺(pNIPAAm)水凝膠上形成光刻膠圖案,隨后采用干法蝕刻工藝對水凝膠進行精細加工,最終形成所需的納米結構。
1.2.5 模板法
模板法是將材料與模板接觸,然后使用化學或物理方法,在模板的引導下進行材料的生長或沉積,最后去除模板即可得到具有特定結構的材料表面。例如Lee等[31]采用模板法制備了聚苯乙烯納米結構表面,通過將電化學制備的多孔陽極氧化鋁(anodic aluminum oxide,AAO)作為一種精細的復制模板,用于熱壓驅動的納米壓印工藝中,實現納米級圖案的高效轉移。Zhao等[33]利用AAO模板方法復制了具有力學殺菌性能的納米柱表面,隨后將聚多巴胺的薄光熱層迅速沉積在納米結構表面上,開發了一種具有光熱增強抗菌性能的力學殺菌納米結構表面,該表面表現出協同抗菌性能,對革蘭氏陽性菌和革蘭氏陰性菌的抗菌效率均顯著提高。
以上這些方法各有優勢和局限性,適用于不同的材料和應用場景(見表1)。
2 力學殺菌機制
目前,關于納米結構如何殺滅細菌的機制尚未形成共識,且可能因不同生物體表面結構的差異而有所不同。黏附被認為是殺死細菌的主要機制,細菌和納米結構相互作用導致細胞壁肽聚糖的變形,從而導致災難性的破裂及隨后的細胞內容物泄漏[6]。大多數研究者認為,這種相互作用主要是由非化學性的物理作用力,包括但不限于毛細力、重力、剪切力、擠壓力以及非特異性相互作用力,這種作用力可能直接作用于細菌細胞,它們可能單獨作用,也可能以某種組合形式共同影響細菌。此外,細胞外多糖也可能在這一過程中發揮間接作用。當細菌細胞懸浮于納米結構表面時,它們會遭受到足以撕裂或穿刺細胞膜的力量。如果這種力量超過了細胞膜的耐受極限,細菌就會因撕裂或穿刺而死亡。對于體積較小的細菌,它們更可能附著在納米結構的微刺側面或微刺之間的空隙中。在這種情況下,細菌細胞不會遭受穿刺,而是由于受到擠壓和剪切力的作用,導致細胞膜破裂[36]。在這一進展的背景下,不同的研究小組提出了其他殺菌機制來解釋他們的觀察結果。盡管這些機制在將細菌死亡歸因于物理效應方面有相似之處,但它們對這些力量的來源的假設有所不同,如細菌運動產生的剪切力、納米柱彎曲變形產生的彈性力、細菌細胞分裂受到的擠壓力以及納米柱對細菌產生的應力導致細菌自身的應激反應。
2.1 細菌運動性
一些材料表面的微觀結構可以限制細菌的自由運動,從而阻礙它在生長介質中的定位和生長。Bandara等[37]首次提出了細菌的運動可能在力學殺菌過程中發揮作用,通過采用先進的顯微技術觀察細菌細胞與納米柱界面之間的連續作用過程,對附著在蜻蜓翅膀上的大腸桿菌細胞的形態學分析,發現納米柱的穿透發生在細菌邊緣,而位于細菌下方的納米柱被細胞外多糖層覆蓋,與細菌細胞膜并未直接接觸,附著的細菌在試圖遠離不利的納米柱地形時推拉納米柱,從而對細菌膜施加剪切力,導致細菌內膜與外膜分離而造成了細菌膜損傷。
2.2 彈性能量的儲存和釋放
一些材料具有能夠吸收外部壓力并在適當時釋放的彈性性質,當細菌接觸到這些材料表面時,表面的彈性變化可以造成對細菌的壓力,從而導致細菌膜的破壞和細胞內部結構的損壞[2, 5]。Ivanova的團隊最初提出了黏附機制,后來提出了一種基于高縱橫比納米柱彈性能的存儲和釋放的替代機制[25]。通過評估短(高度=1 μm)和長(高度=30 μm)CNT的殺菌性能,他們發現與細菌接觸的納米柱通常是彎曲的,這表明它們可以儲存大量的彈性能量,從而損害細菌細胞。
2.3 細胞分裂
一些具有特定的結構和形狀的材料可以通過直接干擾細菌的細胞分裂過程來實現殺菌。例如,K?ller等[38]將鈦納米柱置于不影響細胞活力的不同營養水平細菌懸液中時,發現在營養豐富的條件下,細菌的死亡率更高,此外,在營養豐富的細菌懸浮液中使用DL-絲氨酸羥胺抑制了細菌增殖,反而降低了細菌的死亡率。研究表明細菌細胞分裂導致的細胞伸長會產生力學效應,可以使附著在納米柱上的細菌細胞變形并死亡。細胞分裂生長過程中的這種力學效應具體如何產生影響就不得而知了,可能是納米結構在細菌分裂時阻礙了細胞壁的形成或細胞分裂蛋白的功能,從而導致細胞死亡。
2.4 氧化應激
某些表面的納米結構與細菌作用導致細菌產生氧化物,如活性氧,這些物質具有高度氧化性,可以對細菌細胞膜和細胞內部產生損害,最終導致細菌的死亡[39-40]。Jenkins等[41]在研究二氧化鈦對不同細菌的殺菌活性時,提出氧化應激是一種潛在的殺菌驅動力。他們的研究發現,納米柱很少穿透和變形細胞膜,也幾乎沒有引起形態學變化。因此,他們認為生理效應可能在這一過程中發揮了作用。進一步的研究發現了納米柱表面的蛋白質組學差異,表明氧化應激可能抑制了細胞生長并引起了輕微的形態損傷。
雖然以上細胞運動性、納米柱的彈性變形、細胞分裂和細菌氧化應激被認為是驅動力學殺菌機制的關鍵因素,然而,主導機制及其關鍵決定因素仍然不清楚。因此,現階段對于納米微結構與細菌相互作用的力學殺菌機制尚缺乏清晰的理解。由于這一瓶頸問題的存在,盡管基于力學響應的納米微結構殺菌表面吸引了大量關注,但由于缺乏指導性的納米微結構殺菌設計策略,這些表面的精確制造和高效殺菌性能的實現仍然面臨挑戰。
3 納米陣列力學殺菌模型及力學微觀測試
最初,Pogodin等[42]通過開發生物物理模型,揭示了細菌與蟬翼表面納米柱結構相互作用的機制,其中細菌細胞在附著于納米柱時會經歷膜的非均勻拉伸,可能在柱間區域導致不可逆破裂和細胞死亡。他們還發現革蘭氏陽性菌因具有較高的細胞剛度而更具抵抗力。關鍵物理過程包括細菌細胞膜在納米柱上的吸附和拉伸,以及由持續拉伸引起的膜破裂。細胞的剛度和膜的初始拉伸程度是影響蟬翼表面殺菌作用敏感性的主要生物響應機制。然而該模型是靜態的,沒有考慮細菌的形狀尺寸,并未提及力學殺菌過程中的受力情況。Xue等[43]考慮了細胞膜與納米結構接觸時的力學平衡條件,建立了細菌與納米柱之間的彈性力學模型,模型中使用了細菌的密度、細胞壁的厚度和彈性模量等參數,利用拉伸理論研究細菌細胞的破裂過程,通過評估細胞壁的拉伸程度分析了表面納米粗糙度對細菌細胞的影響,得到并討論了革蘭氏陽性菌和革蘭氏陰性菌拉伸度與表面結構幾何參數的函數關系,當納米柱變得更尖銳且柱間距離更大時,納米柱表面的抗菌性能增強。但他認為是細菌重力導致變形,然而,細菌只是微米尺度,其重力遠小于所受到的界面張力。Li[44]運用熱力學分析,建立了一個理論模型,該模型考慮了細菌的拉伸模量、彎曲模量、細胞膜與表面之間的粘附能等參數,通過分析附著在圖案表面的細菌細胞的總自由能變化,包括膜的接觸粘附彎曲能、邊緣彎曲能以及粘附能,來闡明納米圖案表面的殺菌機制。該模型指出細菌與納米結構的接觸面積增大會促使細菌死亡,然而并未說明是什么力導致細菌變形。
以上模型雖然從一定角度解釋了納米結構殺菌的機制,但并未完全解釋納米結構殺菌的力學機制,這是由于納米結構力學殺菌的過程是復雜的,需要考慮多種因素的影響。例如,從納米結構的幾何尺寸角度,具有較高縱橫比的納米柱有助于增強細菌細胞的變形和破裂,提升殺菌效能[7, 45]。納米柱的直徑、高度和它們之間的間距是決定細菌黏附強度及細胞損傷的關鍵因素[1, 3-4]。Cui等[1]發現在聚碳酸酯表面上制造的納米結構對細菌的殺滅效果隨著納米柱之間距離的增大而增強,當間距達到170 nm時,殺菌效果達到峰值。然而,當間距超過這個值時,效果開始逐漸減弱。同時,他們還發現,當納米柱的高度增加至300 nm時,其殺菌效率呈現出指數級的顯著提升,但在超過這個高度后,效率的增長趨勢開始放緩并趨于穩定。此外,細菌的細胞壁厚度及其彈性模量是它們抵抗外部壓力的能力指標,這些因素決定了它們對納米結構的反應[2, 5, 25]。表面的粗糙度和化學組成等特征也會影響細菌的黏附能力及其隨后受到的力學影響,除了黏附力之外,其他外部力量,例如毛細管力,也能施加足夠的壓力,迅速消滅納米柱上的細菌[6]。Valiei等[46]研究發現親水性納米柱在無外力作用時對細菌不具有殺傷性,其作用依賴于外部力量,如空氣-液體界面移動產生的表面張力,可迅速殺死細菌,這一發現為設計快速有效的抗菌材料提供了新的理解。
在生物學上,判斷細菌死活通常依賴于它們的生長繁殖能力、新陳代謝能力、細胞膜的完整性以及復制轉錄能力。傳統的平板培養計數法是通過觀察細菌在培養基上的生長情況來判定,而更現代的方法包括使用熒光染料結合流式細胞儀、單細胞拉曼分析技術等[47]。例如,BB-
4 力學殺菌表面在醫學領域的應用
4.1 醫用植入物
力學殺菌表面在醫用植入物中的應用通過提供一種物理抗菌機制,有效預防和減少植入物相關感染,同時促進組織修復和提高生物相容性,減少對抗生素的依賴,有助于減緩抗生素耐藥性的發展,并改善植入物的整體性能和臨床效果。例如,de Sous等[52]利用水熱法成功制備了納米片狀鈦表面,該研究表明,即使在人血清蛋白吸附的情況下,這種表面也能高效殺滅金黃色葡萄球菌和銅綠假單胞菌,顯示出良好的抗生物污染性能和高殺菌效率;此外,該納米片表面還能促進M2型巨噬細胞的極化,增加抗炎細胞因子的分泌,有助于傷口愈合。de Sous等[53]還通過堿熱處理制備了兩種不同表面粗糙度的微納結構鈦表面,這些表面增強了MG-63細胞的黏附和分化,而且MN-HCl表面在促進細胞增殖方面表現更佳,并且展現出對細菌的高效殺菌活性;此外,研究還表明,通過調節微米和納米尺度上的表面粗糙度和結構,可以有效操縱成骨細胞反應,結合力學抗菌活性,可實現更優的生物相容性和抗菌效果。
4.2 醫療器械抗菌表面
Zhang等[32]利用低成本的AAO模板輔助方法和環保的層層組裝技術,結合鞣酸和鐵離子,制備了雜化納米柱,研究發現該表面通過結合光熱療法和力學殺菌特性,能夠有效殺滅革蘭氏陰性和陽性細菌,同時對哺乳動物細胞具有生物相容性。Yi等[54]設計了一種新型的納米柱表面,通過在氧化鋅納米柱上嫁接兩性離子聚合物(聚磺甜菜堿甲基丙烯酸酯,PSBMA),這種表面在干燥條件下表現出顯著的力學殺菌活性,而在水溶液中則能輕易地釋放殺死的細菌和碎片;研究還評估了這種表面對L929成纖維細胞的細胞相容性和對紅細胞的血液相容性,結果表明它具有較低的細胞毒性和溶血活性。Liu等[55]開發了一種通過在生物啟發的納米圖案表面嫁接鹽響應性聚兩性離子刷來制備的納米圖案表面。這種表面能夠在低離子強度展現高力學殺菌效率,而在高離子強度條件下,通過擴展的聚合物鏈使死亡的細菌殘留物容易脫落。該力學殺菌納米圖案表面在體外和體內均顯示出良好的生物相容性,并通過皮下植入模型展示了預防圍手術期感染的潛力。
5 總結與展望
生物醫學設備的進步對于提升醫療保健質量至關重要,但抗生素的濫用和抗菌涂層的限制已引發耐藥性問題,促使研究者探索新的抗菌策略。理想的抗菌表面應具備無毒、廣譜、持久且高效的特點。仿生學為此提供了解決方案,研究者通過模仿自然抗菌特性,利用水熱處理、等離子刻蝕、沉積法、光刻法和模板法等技術在不同材料上形成納米結構,創造高效且持久的抗菌表面。盡管已有物理模型揭示細菌與納米柱結構的相互作用機制,表明細菌細胞膜在納米柱之間伸展可能導致細胞的破裂,但殺菌機制的主導因素和實際作用尚不完全明確,需要進一步研究。未來研究可以構建黏附的力學模型和變形協調準則,分析和驗證黏附力模型和細菌捕獲、殺滅的動態行為,深入研究細菌與納米結構的相互作用機制,并且針對不同細菌和納米結構相互作用的力學殺菌機制,建立相應的物理模型,以便制定更加高效的抗菌設計策略。
因此,力學殺菌表面的研究雖然取得了顯著進展,但仍存在許多未解之謎和技術挑戰。未來的研究應集中在揭示力學殺菌機制、優化制備技術及開發多功能抗菌表面上,為抗菌材料的實際應用提供更可靠的解決方案。
重要聲明
利益沖突聲明:本文全體作者均聲明不存在利益沖突。
作者貢獻聲明:陳世雄收集、整理文獻并撰寫文章;梁英負責論文選題以及修改指導;田曉寶負責提供基金支持和論文修改指導;王凱負責對文章思路進行完善和審校論文。