引用本文: 余思婷, 王軍, 劉磊, 羅婷. pT1-2N1M0 乳腺癌不同分子亞型的臨床病理特征及對放療的指導價值. 華西醫學, 2025, 40(1): 42-47. doi: 10.7507/1002-0179.202302178 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
2020 年全球新發癌癥患者
1 對象與方法
1.1 研究對象
本研究
1.2 分子分型方法及標準
根據雌激素受體(estrogen receptor, ER)、孕激素受體(progesterone receptor, PR)、Her-2 及 Ki-67 等 4 種免疫組織化學(immunohistochemistry, IHC)標志進行乳腺癌分子分型[5, 9-10],將患者分為 4 組:① Luminal A 型:ER 和/或 PR 陽性,Her-2 陰性,Ki-67 陽性率≤30%。② Luminal B 型:包括 2 種亞型,一種為 ER 和/或 PR 陽性,Her-2 陰性,Ki-67 陽性率>30%;另一種為 ER 和/或 PR 陽性,Her-2 陽性,Ki-67 表達在任何水平。③ Her-2 過表達型:ER 陰性,PR 陰性,Her-2 陽性。④ 三陰性(Basal like 型):ER 陰性,PR 陰性,Her-2 陰性。其中,依據 IHC 結果,ER 和 PR 陽性定義為>10% 的腫瘤細胞激素受體表達陽性[11]。Her-2 的判定標準參照《人表皮生長因子受體 2 陽性乳腺癌臨床診療專家共識(2021 版)》,IHC(1+)判定為陰性,IHC(3+)判定為陽性,IHC(2+)需進一步行原位雜交,原位雜交(+)判定為陽性,原位雜交(–)判定為陰性[12]。
1.3 研究方法及指標
通過電話隨訪,了解患者是否出現復發轉移及死亡等情況,所有患者均從術后第 1 天開始計算生存時間。本研究以 OS、乳腺癌特異性生存(breast cancer-specific survival, BCSS)為主要研究指標。OS 時間為從乳腺癌術后第 1 天至任何原因引起的死亡或最后一次隨訪的時間間隔,BCSS 時間為從乳腺癌術后第 1 天至發生乳腺癌特異性死亡的時間間隔。
1.4 統計學方法
應用 SPSS 26.0 軟件分析數據。計量資料用均數±標準差(x±s)表示,組間比較采用 t 檢驗。計數資料用例數和/或百分數表示,組間比較采用χ2 檢驗。生存分析采用 Kaplan-Meier 法,運用對數秩檢驗對比分析 4 種分子亞型的乳腺癌患者 OS、BCSS 的生存差異。運用 Cox 回歸分析確定 OS 的預測因子,尋找乳腺癌根治術后與患者預后相關的危險因素。雙側檢驗水準 α=0.05。
2 結果
2.1 一般資料
本研究共納入
2.2 不同分子亞型預后分析
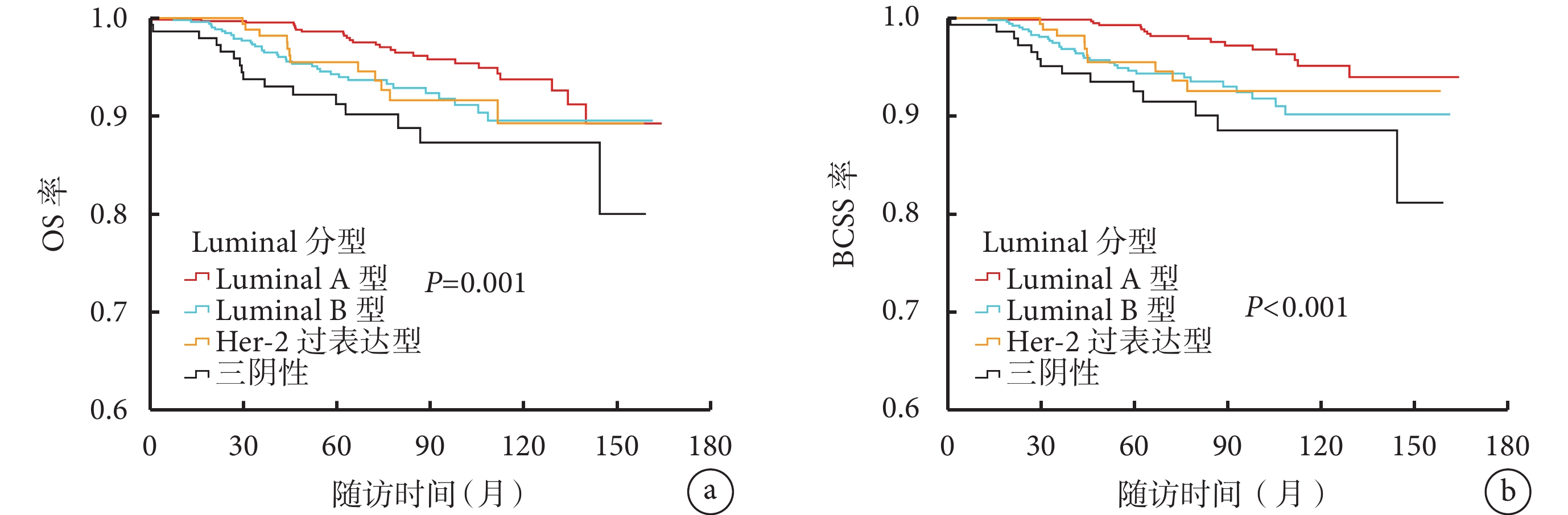
Luminal A 型、Luminal B 型、Her-2 過表達型、三陰性乳腺癌患者的 5 年 OS 率分別為 98.6%、94.3%、95.5%、91.2%(χ2=11.712,P=0.001),5 年 BCSS 率分別為 99.3%、94.6%、95.5%、92.5%(χ2=18.547,P<0.001)。兩兩比較結果顯示,與 Luminal A 型比較,三陰性患者 5 年 OS 率(P=0.001)及 5 年 BCSS 率(P<0.001)更低。見圖1。
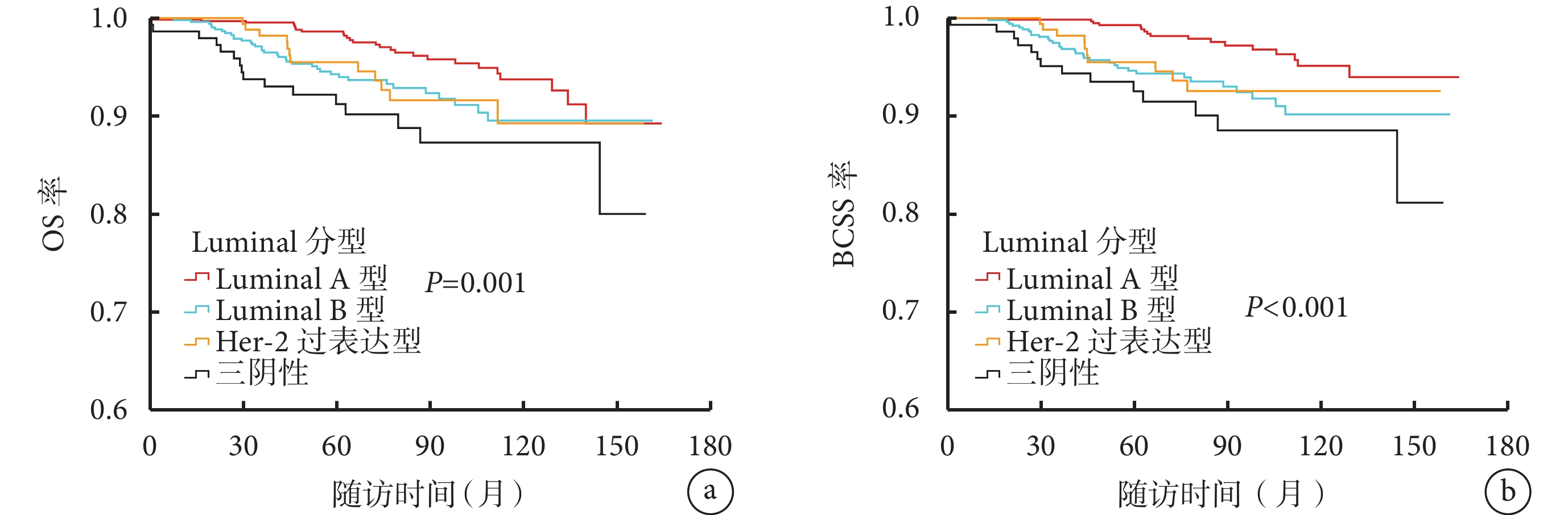 圖1
不同分子亞型乳腺癌患者的 OS 率與 BCSS 率比較
圖1
不同分子亞型乳腺癌患者的 OS 率與 BCSS 率比較
a. OS 率;b. BCSS 率。OS:總生存;BCSS:乳腺癌特異性生存;Her-2:人表皮生長因子受體 2
2.3 影響乳腺癌根治術后患者生存情況的因素分析
對患者的年齡、月經狀態、病理類型、腫瘤大小、ER 狀態、PR 狀態、Her-2 狀態、Luminal 分型、第 7 版 AJCC 分期、組織學分級、是否放療、是否內分泌治療、初診時是否靶向治療進行單因素分析,將單因素分析結果為 P<0.10 的指標納入多因素 Cox 回歸分析,考慮 ER 以及 PR 與 Luminal 分型存在共性,多因素分析時暫不分析。多因素分析顯示,是否絕經[風險比=0.483,95% 置信區間(0.253,0.923),P=0.028]、是否內分泌治療[風險比=2.021,95% 置信區間(1.012,4.034),P=0.046]是影響患者術后 OS 率的獨立因素。變量賦值表詳見表3,單因素和多因素分析結果見表4~5。
3 討論
乳腺癌是高度異質性腫瘤,即使具有相同病理類型和臨床分期的乳腺癌,其臨床表現、治療療效及預后也往往存在明顯的差異[13-14]。乳腺癌分子分型的提出,為探討乳腺癌異質性、個體化治療方案、預后評估等提供了新的依據[15]。目前,根據臨床常用的 IHC 指標通常將乳腺癌分為 4 種亞型,即 Luminal A 型、Luminal B 型、Her-2 過表達型、三陰性。
本研究結果顯示,不同分子亞型 pT1-2N1M0 乳腺癌患者中 Luminal A 型最為常見(44.2%),各亞型均以浸潤性導管癌為主。≥50 歲的患者比例在 Her-2 過表達型中最高(60.9%),與既往報道年輕女性更容易發展為侵襲性較高的三陰性和 Her-2 過表達型而 Luminal 型更容易出現在老年患者中結論不一致[16],考慮可能與本研究群體為早期乳腺癌患者及地區差異有關。Luminal A 型和 Luminal B 型絕經前患者比例較高,Her-2 過表達型和三陰性絕經后患者所占比例較高,與既往研究結果 Her-2 陽性型患者多為絕經后女性一致[17-18]。三陰性患者 T2 期比例及ⅡB 期的比例最高(77.0%),可見三陰性病例一經發現,相比其他亞型分期晚。
是否遠處轉移是乳腺癌治療成敗的關鍵,本研究顯示,在 4 種亞型中 Her-2 過表達型患者遠處轉移率最高(13.2%),更容易出現骨、腦等遠處轉移的情況,提示該型惡性程度高,預后比較差。Tseng 等[19]發現 Her-2 陽性乳腺癌患者根治切除術后使用曲妥珠單抗可以有效降低局部復發及遠處轉移率。因此對于 Her-2 過表達型患者,術后行靶向治療具有重要的意義。在本研究中,Luminal A 型患者 OS 率最高(98.6%),提示 Luminal A 型預后最好。三陰性乳腺癌患者 5 年 OS 率(91.2%)和 5 年 BCSS 率(92.5%)顯著低于其他亞型,一方面考慮與三陰性患者發病年輕有關,另一方面,三陰性乳腺癌缺乏 ER 和 Her-2 受體,對內分泌治療及靶向治療完全不敏感,復發風險又高于其他亞型,因此尋找新的治療靶點對于三陰性乳腺癌的治療具有重要的意義。
近幾年研究評估了放療在早期乳腺癌患者術后輔助治療中的作用,結論并不一致[20-21]。目前如何結合高危因素對 pT1-2N1M0 乳腺癌患者進行風險分層,從而指導患者術后輔助放療是一個研究熱點[22-23]。在眾多的危險因素中,分子分型被證實是乳腺癌術后復發的一個高危因素,且研究表明放療敏感性在各亞組之間并不相同[24]。然而,本研究 Cox 回歸分析提示是否絕經以及是否內分泌治療是影響 pT1-2N1M0 乳腺癌患者術后 5 年 OS 率的預后因素(P<0.05),但尚不能認為 Luminal 分型和術后放療與否是影響該部分患者術后 5 年 OS 率的預后因素(P>0.05)。分析原因可能是 Luminal 分型的標準不同,以及研究對象的組織學分級、病理類型等方面均可能與既往的研究存在差異。此外,本研究為回顧性、單中心研究,可能存在信息偏倚以及樣本量不足。因此,如何結合高危因素對 pT1-2N1M0 乳腺癌患者進行風險分層,從 pT1-2N1M0 乳腺癌患者中篩選出放療獲益的患者,還需要進一步多中心、大樣本的臨床隨機對照研究。
綜上所述,本研究顯示出 pT1-2N1M0 不同分子分型乳腺癌患者在臨床病理特征及預后方面存在差異,且乳腺癌術后患者的月經狀態以及是否內分泌治療與患者的預后相關,而分子分型以及術后放療與否與乳腺癌患者術后生存情況有無關系,今后還需進一步行多中心、大樣本的前瞻性研究。
利益沖突:所有作者聲明不存在利益沖突。
2020 年全球新發癌癥患者
1 對象與方法
1.1 研究對象
本研究
1.2 分子分型方法及標準
根據雌激素受體(estrogen receptor, ER)、孕激素受體(progesterone receptor, PR)、Her-2 及 Ki-67 等 4 種免疫組織化學(immunohistochemistry, IHC)標志進行乳腺癌分子分型[5, 9-10],將患者分為 4 組:① Luminal A 型:ER 和/或 PR 陽性,Her-2 陰性,Ki-67 陽性率≤30%。② Luminal B 型:包括 2 種亞型,一種為 ER 和/或 PR 陽性,Her-2 陰性,Ki-67 陽性率>30%;另一種為 ER 和/或 PR 陽性,Her-2 陽性,Ki-67 表達在任何水平。③ Her-2 過表達型:ER 陰性,PR 陰性,Her-2 陽性。④ 三陰性(Basal like 型):ER 陰性,PR 陰性,Her-2 陰性。其中,依據 IHC 結果,ER 和 PR 陽性定義為>10% 的腫瘤細胞激素受體表達陽性[11]。Her-2 的判定標準參照《人表皮生長因子受體 2 陽性乳腺癌臨床診療專家共識(2021 版)》,IHC(1+)判定為陰性,IHC(3+)判定為陽性,IHC(2+)需進一步行原位雜交,原位雜交(+)判定為陽性,原位雜交(–)判定為陰性[12]。
1.3 研究方法及指標
通過電話隨訪,了解患者是否出現復發轉移及死亡等情況,所有患者均從術后第 1 天開始計算生存時間。本研究以 OS、乳腺癌特異性生存(breast cancer-specific survival, BCSS)為主要研究指標。OS 時間為從乳腺癌術后第 1 天至任何原因引起的死亡或最后一次隨訪的時間間隔,BCSS 時間為從乳腺癌術后第 1 天至發生乳腺癌特異性死亡的時間間隔。
1.4 統計學方法
應用 SPSS 26.0 軟件分析數據。計量資料用均數±標準差(x±s)表示,組間比較采用 t 檢驗。計數資料用例數和/或百分數表示,組間比較采用χ2 檢驗。生存分析采用 Kaplan-Meier 法,運用對數秩檢驗對比分析 4 種分子亞型的乳腺癌患者 OS、BCSS 的生存差異。運用 Cox 回歸分析確定 OS 的預測因子,尋找乳腺癌根治術后與患者預后相關的危險因素。雙側檢驗水準 α=0.05。
2 結果
2.1 一般資料
本研究共納入
2.2 不同分子亞型預后分析
Luminal A 型、Luminal B 型、Her-2 過表達型、三陰性乳腺癌患者的 5 年 OS 率分別為 98.6%、94.3%、95.5%、91.2%(χ2=11.712,P=0.001),5 年 BCSS 率分別為 99.3%、94.6%、95.5%、92.5%(χ2=18.547,P<0.001)。兩兩比較結果顯示,與 Luminal A 型比較,三陰性患者 5 年 OS 率(P=0.001)及 5 年 BCSS 率(P<0.001)更低。見圖1。
 圖1
不同分子亞型乳腺癌患者的 OS 率與 BCSS 率比較
圖1
不同分子亞型乳腺癌患者的 OS 率與 BCSS 率比較
a. OS 率;b. BCSS 率。OS:總生存;BCSS:乳腺癌特異性生存;Her-2:人表皮生長因子受體 2
2.3 影響乳腺癌根治術后患者生存情況的因素分析
對患者的年齡、月經狀態、病理類型、腫瘤大小、ER 狀態、PR 狀態、Her-2 狀態、Luminal 分型、第 7 版 AJCC 分期、組織學分級、是否放療、是否內分泌治療、初診時是否靶向治療進行單因素分析,將單因素分析結果為 P<0.10 的指標納入多因素 Cox 回歸分析,考慮 ER 以及 PR 與 Luminal 分型存在共性,多因素分析時暫不分析。多因素分析顯示,是否絕經[風險比=0.483,95% 置信區間(0.253,0.923),P=0.028]、是否內分泌治療[風險比=2.021,95% 置信區間(1.012,4.034),P=0.046]是影響患者術后 OS 率的獨立因素。變量賦值表詳見表3,單因素和多因素分析結果見表4~5。
3 討論
乳腺癌是高度異質性腫瘤,即使具有相同病理類型和臨床分期的乳腺癌,其臨床表現、治療療效及預后也往往存在明顯的差異[13-14]。乳腺癌分子分型的提出,為探討乳腺癌異質性、個體化治療方案、預后評估等提供了新的依據[15]。目前,根據臨床常用的 IHC 指標通常將乳腺癌分為 4 種亞型,即 Luminal A 型、Luminal B 型、Her-2 過表達型、三陰性。
本研究結果顯示,不同分子亞型 pT1-2N1M0 乳腺癌患者中 Luminal A 型最為常見(44.2%),各亞型均以浸潤性導管癌為主。≥50 歲的患者比例在 Her-2 過表達型中最高(60.9%),與既往報道年輕女性更容易發展為侵襲性較高的三陰性和 Her-2 過表達型而 Luminal 型更容易出現在老年患者中結論不一致[16],考慮可能與本研究群體為早期乳腺癌患者及地區差異有關。Luminal A 型和 Luminal B 型絕經前患者比例較高,Her-2 過表達型和三陰性絕經后患者所占比例較高,與既往研究結果 Her-2 陽性型患者多為絕經后女性一致[17-18]。三陰性患者 T2 期比例及ⅡB 期的比例最高(77.0%),可見三陰性病例一經發現,相比其他亞型分期晚。
是否遠處轉移是乳腺癌治療成敗的關鍵,本研究顯示,在 4 種亞型中 Her-2 過表達型患者遠處轉移率最高(13.2%),更容易出現骨、腦等遠處轉移的情況,提示該型惡性程度高,預后比較差。Tseng 等[19]發現 Her-2 陽性乳腺癌患者根治切除術后使用曲妥珠單抗可以有效降低局部復發及遠處轉移率。因此對于 Her-2 過表達型患者,術后行靶向治療具有重要的意義。在本研究中,Luminal A 型患者 OS 率最高(98.6%),提示 Luminal A 型預后最好。三陰性乳腺癌患者 5 年 OS 率(91.2%)和 5 年 BCSS 率(92.5%)顯著低于其他亞型,一方面考慮與三陰性患者發病年輕有關,另一方面,三陰性乳腺癌缺乏 ER 和 Her-2 受體,對內分泌治療及靶向治療完全不敏感,復發風險又高于其他亞型,因此尋找新的治療靶點對于三陰性乳腺癌的治療具有重要的意義。
近幾年研究評估了放療在早期乳腺癌患者術后輔助治療中的作用,結論并不一致[20-21]。目前如何結合高危因素對 pT1-2N1M0 乳腺癌患者進行風險分層,從而指導患者術后輔助放療是一個研究熱點[22-23]。在眾多的危險因素中,分子分型被證實是乳腺癌術后復發的一個高危因素,且研究表明放療敏感性在各亞組之間并不相同[24]。然而,本研究 Cox 回歸分析提示是否絕經以及是否內分泌治療是影響 pT1-2N1M0 乳腺癌患者術后 5 年 OS 率的預后因素(P<0.05),但尚不能認為 Luminal 分型和術后放療與否是影響該部分患者術后 5 年 OS 率的預后因素(P>0.05)。分析原因可能是 Luminal 分型的標準不同,以及研究對象的組織學分級、病理類型等方面均可能與既往的研究存在差異。此外,本研究為回顧性、單中心研究,可能存在信息偏倚以及樣本量不足。因此,如何結合高危因素對 pT1-2N1M0 乳腺癌患者進行風險分層,從 pT1-2N1M0 乳腺癌患者中篩選出放療獲益的患者,還需要進一步多中心、大樣本的臨床隨機對照研究。
綜上所述,本研究顯示出 pT1-2N1M0 不同分子分型乳腺癌患者在臨床病理特征及預后方面存在差異,且乳腺癌術后患者的月經狀態以及是否內分泌治療與患者的預后相關,而分子分型以及術后放療與否與乳腺癌患者術后生存情況有無關系,今后還需進一步行多中心、大樣本的前瞻性研究。
利益沖突:所有作者聲明不存在利益沖突。