引用本文: 張應杰, 吳再輝, 李曉龍, 李林. 轉移相關蛋白 3 通過活性氧參與膠質瘤耐藥的分子機制研究. 華西醫學, 2024, 39(5): 732-738. doi: 10.7507/1002-0179.202305202 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
膠質瘤是成人和兒童中最常見的中樞神經系統腫瘤。在膠質瘤中具有自我更新能力和未成熟表型的小細胞群稱為膠質瘤干細胞(glioma stem cells, GSC),其表現出干細胞特性并具有啟動和繁殖腫瘤的能力[1]。GSC 還具有對化學治療(化療)和放射治療(放療)耐藥性高的特點[2]。由于 DNA 損傷檢查點和 DNA 修復的激活增加,GSC 顯示出對輻射的抵抗力,而 GSC 的化學耐藥性與 ATP 結合轉運體 ABCG2 轉運蛋白引起的藥物外排增加有關[3]。因此,闡明 GSC 治療耐藥性的分子機制將有助于治療干預的新靶點和延長患者生存期。
活性氧是有氧代謝的副產物,在腫瘤發生、轉移和癌癥的治療耐藥中起關鍵作用,活性氧在癌癥干細胞(cancer stem cell, CSC)中的作用,包括 GSC,仍然知之甚少[4]。盡管已有研究表明,與非致瘤后代相比,乳腺癌干細胞含有較低的活性氧水平和增強的活性氧防御,這可能有助于腫瘤的放射耐藥性[5]。但對活性氧的生物學效應及其在 GSC 中的調節機制知之甚少。而轉移相關蛋白(metastasis-associated protein, MTA)3 最初被發現是一個小蛋白家族的成員,是 Mi-2/NuRD 染色質重塑復合物的亞基[6-7]。MTA3 在乳腺癌、子宮內膜癌和卵巢癌中的表達減少,MTA3 上調通過直接抑制 Snail 表達來預防上皮間充質轉化,從而上調乳腺癌中的 E-鈣黏蛋白水平[8]。MTA3 還抑制乳腺上皮細胞中的 Wnt 靶基因[9],并可促進增殖小鼠顆粒細胞中的 G2/M 進展[10]。這些研究表明 MTA3 在不同類型的人類癌癥中有不同的作用。然而,MTA3 在 GSC 中的蛋白表達及其與臨床病理因素的關系尚未得到檢驗。因此,本研究旨在探究 MTA3 通過活性氧參與膠質瘤耐藥的分子機制,以期為后續研究提供參考。
1 材料與方法
1.1 主要材料和儀器
采用購自中國科學院模式培養物庫的非 GSC 膠質瘤細胞系 U87 和 SHG44。把細胞放在 Dulbecco 改良 Eagle 培養基(營養混合物 F-12 培養基中添加 10%胎牛血清,37℃,含 5%二氧化碳)的溫箱中培養。人 GSC 膠質瘤細胞培養物 U87s 來源于人膠質瘤細胞系 U87,使用無血清克隆形成方法與干細胞培養基進行富集。患者源性 GSC 膠質瘤細胞培養物 SU-2 是由唐山弘慈醫院提供,由手術標本分離。
GSC 在 20 ng/mL 表皮生長因子和 10 ng/mL 堿性成纖維細胞生長因子的無血清營養混合液 F-12 中培養產生神經球。每 3 天替換新鮮培養基進行培養。通過使用 NeuroCult 化學分離試劑盒分離球體來進行細胞傳代。
1.2 實驗方法
1.2.1 克隆細胞存活試驗
為了測試 GSC 和非 GSC 的自我更新能力,在無血清培養基中培養細胞以產生神經球。在室溫下,用 PRIMUS 加速器(中國西門子,型號 PR3562)對 U87、U87s、SU-2 和 SHG44 細胞進行 X 線照射(6 MV,劑量率為 200 cGy/min)。照射后,將特定數量的細胞(0 或 2 Gy 照射細胞 100 個,4 Gy 照射細胞 200 個,6、8 和 10 Gy 照射細胞 2 000 個)分別在培養皿中復制 3 個,用于克隆生成實驗。將細胞孵育 11 d,用 37%甲醛溶液固定菌落,結晶紫染色,計數菌落 50 個左右。在 48 Gy X 線照射后 5 h 使用流式細胞術定量測量 GSC 的凋亡,計算細胞存活分數和氧增強比(oxygen enhancement ratio, OER)。其中,OER 為缺氧與常氧之比,并采用線性二次模型計算 X 線照射后的平均致死劑量。在常氧條件下暴露于 0、2、4、6、8、10 Gy X 線照射后(大氣條件,21%O2)或缺氧條件(24 h,1%O2),檢查細胞存活分數和細胞存活曲線。
1.2.2 活性氧檢測
用于測試了輻照 GSC 中的活性氧形成是否受到抑制。使用加載 2’-7’-二氯二氫熒光素二乙酸鹽(2’-7’-dichlorodihydrofluorescein diacetate, H2DCFH-DA)的細胞檢查活性氧形成。U87、U87s、SU-2 和 SHG44 細胞用 20 μmol/L 的 H2DCFH-DA 或 5 μmol/L Cell ROX?深紅色試劑在 37°C 黑暗環境中孵育 30 min,通過胰蛋白酶法收集細胞,并在流式細胞術分析前清洗去除染料。
1.2.3 熒光定量聚合酶鏈反應(fluorescent quantitative polymerase chain reaction, qPCR)
根據制造商說明書進行總 RNA 提取和逆轉錄。使用雙鏈嵌合熒光染色 PCR 試劑盒(日本大阪東洋紡)的標準方案進行 qPCR。甘油醛-3-磷酸脫氫酶被用作參考信使核糖核酸(messenger RNA, mRNA),使用 SuperScriptⅢ逆轉錄酶用寡核苷酸(dT)引物將總 mRNA 反轉錄成互補 DNA(complementary DNA, cDNA),在 ABI Prism 7900(中國上海艾研生物科技有限公司)序列檢測系統上進行定量實時 PCR,從 1 μL cDNA、序列特異性引物和雙鏈嵌合熒光染色實時 PCR 預混液進行混合,在以下加熱條件下:95℃下加熱 10 min,40 s 循環,在 95℃下持續加熱 15 s,60℃持續 1 min。通過比較循環閾值(cycle threshold, Ct)方法計算相對 mRNA 水平(2?ΔΔCt 式)用β-actin 進行歸一化。
1.2.4 蛋白質印跡分析
從 U87、U87s、SU-2 和 SHG44 細胞中提取的蛋白質,其具有 1 mmol/L 蛋白酶抑制劑(稀釋比例 1∶100)。在 10%聚丙烯酰胺凝膠(Bio-Rad)上分餾 20 μg 蛋白質,在 4℃下以 200 mA 轉移到聚二氟乙烯膜中 2 h。在由 50 mmol/L Tris、133 mmol/L 氯化鈉組成,pH 值為 7.4的 Tris 緩沖鹽水(tris buffered saline, TBS)和 5%稀釋的脫脂奶粉中阻斷膜 2 h 后,與 MTA3 一抗抗體一起在室溫下在 1%牛奶和 TBS 中孵育 2 h。在 0.5% Tween-20 的 TBS 中洗滌后,將聚偏氟乙烯 Poly 膜與辣根過氧化物酶偶聯二抗兔抗大鼠 lgG2b(稀釋比例 1∶4 000)在 TBS 和 1%牛奶中在室溫下孵育 2 h,后使用化學發光底物使條帶可視化。
1.2.5 過表達 MTA3
本文旨在研究過表達 MTA3 對 GSC 的活性氧產生、凋亡和放射敏感性的影響,因此將 U87s 和 SU-2 細胞都各分為 Lv-MTA3、Lv-scr 組。首先,通過慢端膜介導的基因轉移產生具有 MTA3 成熟序列或爭奪序列穩定整合的 GSC。為了產生相應病毒,用慢病毒載體 pGLV-miR-293-GFP 或 pGLV-scr-GFP 以及包裝質粒 PG-P153-VSVG、PG-P1-REV 和 PG-P2-RRE 轉染 3T 細胞;編碼 MTA3 或加擾序列的病毒感染目標 GSC,并使用嘌呤霉素進行選擇,為 Lv-MTA3 組(過表達 MTA3)。Lv-scr 組為加未感染編碼 MTA3 或加擾序列的病毒處理。
1.2.6 流式細胞術分析
根據膜聯蛋白-V-PE/7-氨基放線菌素 D 凋亡檢測試劑盒制造商說明(中國南京凱基生物),通過流式細胞儀(中國碧迪)進行分析。其中,藻紅蛋白陽性和 7-氨基放線菌素 D 陰性細胞被視為凋亡細胞。
1.2.7 神經球形成測定
將 U87s 和 SU-2 以每孔 10、100 或
1.2.8 干細胞標志物和分化標志物的免疫熒光染色
對干細胞標志物 CD133 和巢蛋白以及分化標志物神經膠質纖維酸性蛋白(glial fibrillary acidic protein, GFAP)和神經元類型Ⅲβ-微管蛋白克隆(neuron type ⅲβ-tubulin cloning, Tuj-1)進行免疫熒光染色。將 GSC 在室溫下固定在 4%多聚甲醛中 15 min,使用 0.1%曲拉通 X-100(Triton-X100)透化 20 min,并在室溫下封閉在 5%牛血清白蛋白中 1 h。用針對人 CD133(稀釋比例 1∶200),巢蛋白(濃度為 1∶300),GFAP(稀釋比例 1∶500)和 Tuj-1(稀釋比例 1∶500)的小鼠抗體免疫染色 GSC 在黑暗中孵育 45 min。隨后用德克薩斯紅偶聯抗小鼠免疫球蛋白 G(中國艾博抗,稀釋比例 133∶1)在室溫下對干細胞標志物 CD1 和巢蛋白以及分化標志物 GFAP 和 Tuj-1 進行 30 min 的可視化,并用 4’,6’-二脒基-2-苯基吲哚(稀釋比例 1∶500)對細胞核進行復染,用熒光顯微鏡捕獲熒光圖像。
1.3 統計學方法
采用 SPSS 21.0 統計軟件進行數據分析。符合正態分布的計量資料以均數±標準差表示,組間比較采用單因素方差分析。雙側檢驗水準α=0.05。
2 結果
2.1 MTA3 在膠質瘤細胞中的表達
蛋白質印跡檢測 MTA3 在膠質瘤細胞中的表達發現,U87(16.78±3.45)、SHG44(19.230±3.090)、U87s(1.180±0.490)和 SU-2(12.190±2.410)細胞的 MTA3 表達比較,差異有統計學意義(F=12.440,P=0.001)。
qPCR 檢測 MTA3 在膠質瘤細胞中的表達結果顯示,過表達 MTA3 后,在 U87s 細胞中,Lv-MTA3 組和 LV-scr 組的 MTA3 分為別(1.280±0.580)、(16.290±4.010);在 SU-2 中,Lv-MTA3 組和 Lv-scr 組的 MTA3 分為別(1.240±0.530)、(12.210±3.890)。在 U87s 和 SU-2 中,Lv-MTA3 組的 MTA3 表達均高于 Lv-scr 組(P<0.05)。
2.2 GSC 和非 GSC 的放射敏感性和活性氧形成
神經球形成試驗表明,神經球形成率在 GSC[U87s(31.110±7.420)、SU-2 組(43.120±8.430)]、非 GSC[U87(2.720±1.410)和 SHG44(2.540±1.170)]間比較,差異有統計學意義(F=12.344,P=0.001)。
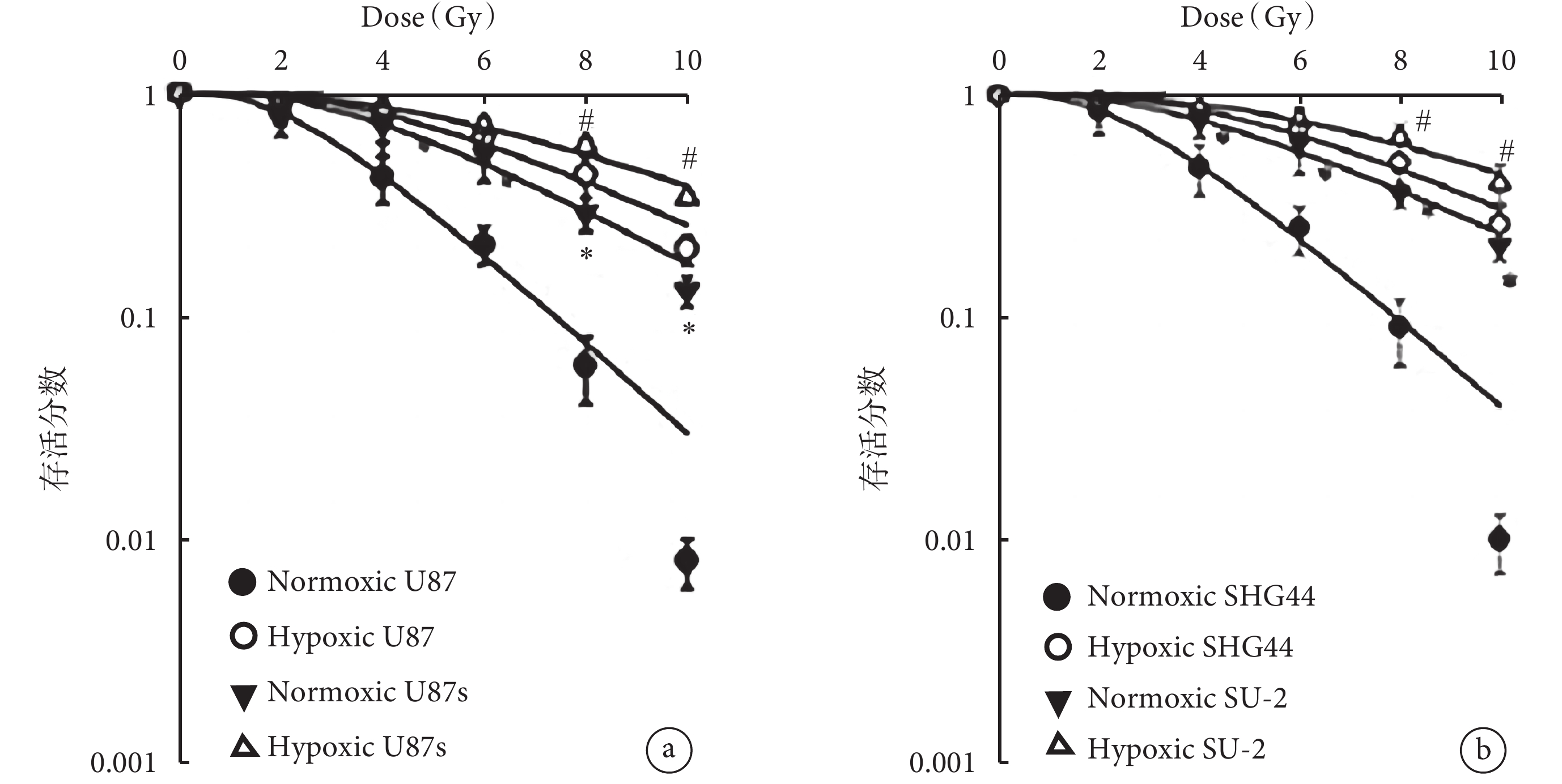
不同劑量 X 線照射后細胞存活分數比較見圖1。可見,在常氧和缺氧條件下,0、2、4、6 Gy X 線照射后,不用組間比較差異均無統計學意義(P>0.05);在 8 Gy 照射下,在缺氧條件下,U87s(0.810±0.100)、SU-2(0.720±0.110)、U87(0.120±0.010)和 SHG44(0.150±0.07)具有放射抗性,差異有統計學意義(F=11.324,P=0.001);在常氧條件下,U87s(0.140±0.060)和 SU-2(0.120±0.07)比 U87(
 圖1
不同劑量 X 線照射后細胞存活分數比較
圖1
不同劑量 X 線照射后細胞存活分數比較
a. U87 和 U87s 細胞,b. SHG44 和 SU-2 細胞。dose:劑量;Normoxic:常氧;Hypoxic:缺氧。*與常氧組比較,
H2DCFH-DA 探針在 GSC 和非 GSC 中對活性氧形成進行流式細胞術分析結果顯示,與非 GSC[U87(5.720±1.030)和 SHG44(5.210±1.010)]比較,GSC[U87s(1.880±0.790)和 SU-2 組(1.990±0.680)]基底活性氧形成減少(F=16.347,P=0.001)。
2.3 過表達 MTA3 對 GSC 的活性氧產生、凋亡和放射敏感性的影響
在 U87s 細胞中,與 Lv-scr 組(1.110±0.410)比較,Lv-MTA3 組的(5.610±0.820)的活性氧生成增加(F=16.355,P=0.001),在 SU-2 組細胞中,與 Lv-scr 組(1.180±0.390)比較,Lv-MTA3 組的(5.880±
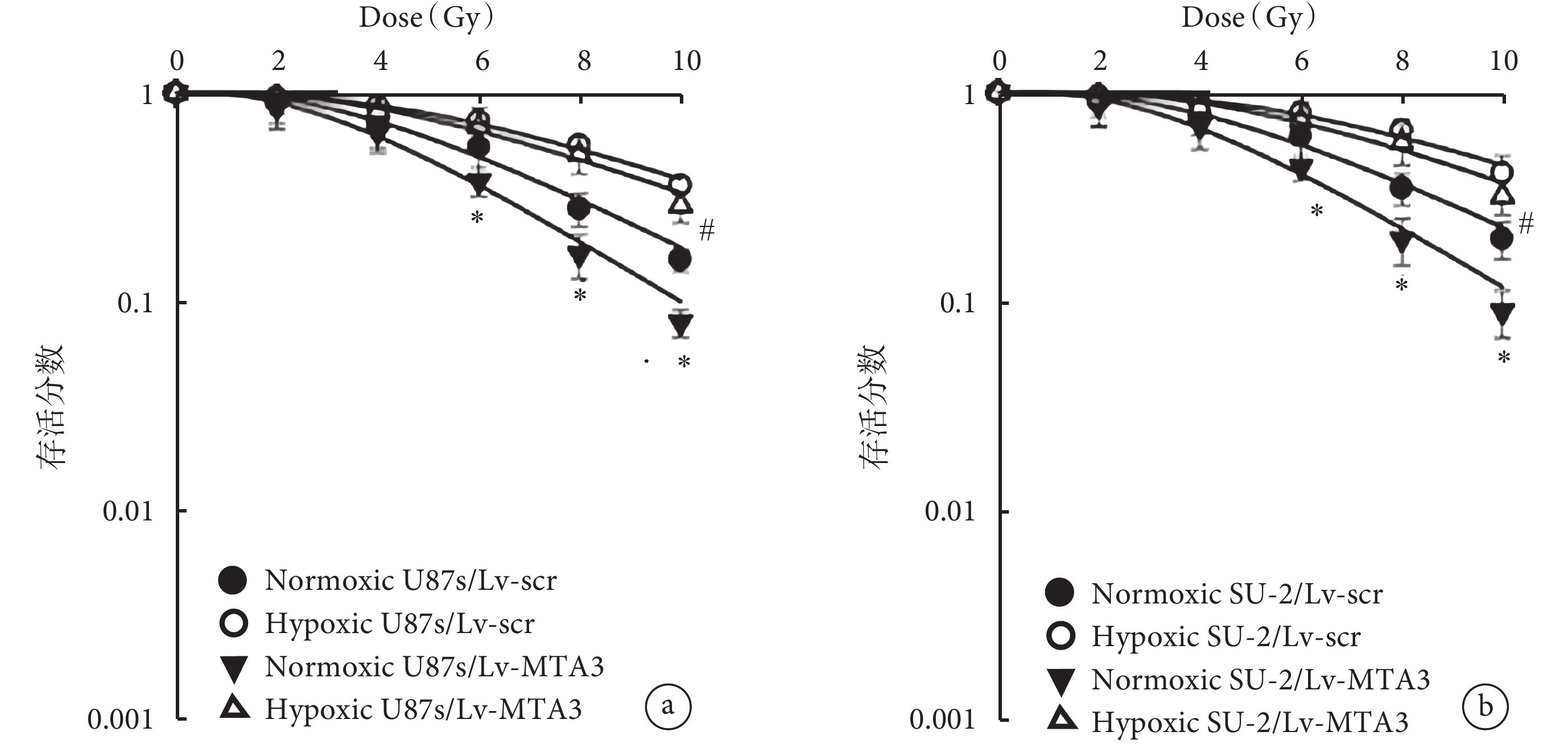
過表達 MTA3 下不同劑量 X 線照射后細胞存活分數的影響比較見圖2。可見,在常氧和缺氧條件下,0、2、4、6 Gy X 線照射后,不同組間比較差異均無統計學意義(P>0.05);在 10 Gy X 線照射后,在缺氧條件下,在 U87s 細胞中,Lv-MTA3 組(
 圖2
過表達 MTA3 下不同劑量 X 線照射后細胞存活分數的影響比較
圖2
過表達 MTA3 下不同劑量 X 線照射后細胞存活分數的影響比較
a. U87 和 U87s 細胞,b. SHG44 和 SU-2 細胞。dose:劑量;Normoxic:常氧;Hypoxic:缺氧;MTA3:轉移相關蛋白3。*與常氧組比較,
流式細胞術分析顯示在 U87s 細胞中,Lv-MTA3 組的凋亡率(21.190±3.520)高于 Lv-scr 組(3.890±0.520)和 Lv-scr 組(4.160±0.510),差異有統計學意義(F=21.341,P=0.001);在 SU-2 組細胞中,Lv-MTA3 組的凋亡率(13.150±3.230)高于 Lv-scr 組(3.190±0.400)和 Lv-scr 組(3.960±0.560),差異有統計學意義(F=11.241,P=0.001)。
2.4 過表達 MTA3 對 GSC 的神經球形成能力和干性(神經發生能力)的影響
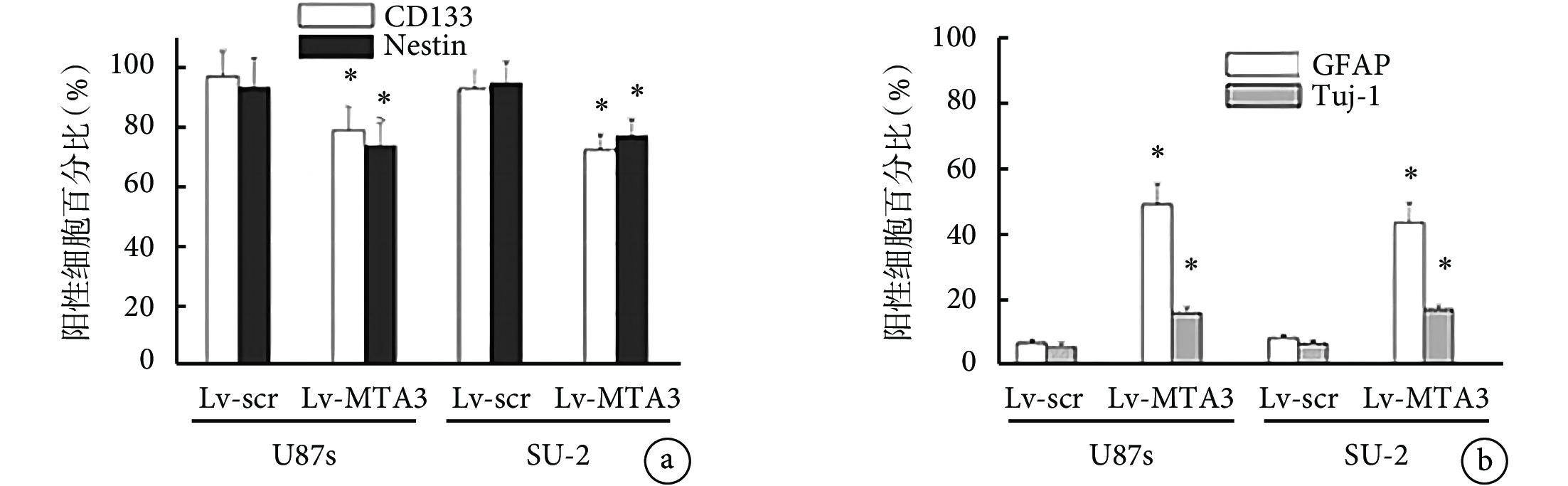
過表達 MTA3 對 GSC 的神經球形成能力和干性的影響見圖3。對干細胞標志物 CD133 和巢蛋白以及分化標志物膠質纖維酸性蛋白(GFAP)(星形膠質細胞)和 Tuj-1(神經元)進行免疫熒光染色結果表明,在 U87s 細胞中,與 Lv-scr 組的 CD133(97.110±4.430)和巢蛋白免疫抑素(95.160±5.460)比較,Lv-MTA3 組降低了 CD133(81.160±3.460)和巢蛋白免疫抑素(76.160±6.420)的表達(F=11.321、14.566,P均=0.001);與 Lv-scr 組的 GFAP(8.180±1.220)和 Tuj-1(54.140±4.360)比較,Lv- MTA3 組增加了 GFAP(56.860±4.560)和 Tuj-1(21.110±1.960)的表達(F=8.388、18.367,P均=0.001)。
 圖3
過表達 MTA3 對 GSC 的神經球形成能力和干性的影響
圖3
過表達 MTA3 對 GSC 的神經球形成能力和干性的影響
a. 過表達 MTA3 對 GSC 的神經球形成能力(CD133 和巢蛋白)的影響;b. 過表達 MTA3 對 GSC 的神經球形成能力(GFAP 和 Tuj-1)的影響。Nestin:巢蛋白;GFAP:神經膠質纖維酸性蛋白;Tuj-1:神經元類型Ⅲβ-微管蛋白克隆;MTA3:轉移相關蛋白3。*與Lv-scr比較,
在 SU-2 組細胞中,與 Lv-scr 組的 CD133(98.180±5.330)和巢蛋白免疫抑素(98.810±4.480)比較,Lv- MTA3 組降低了 CD133(76.140±5.310)和巢蛋白免疫抑素(76.130±4.350)的表達(F=10.324、5.354,P均=0.001);與 Lv-scr 組的 GFAP(9.230±1.130)和 Tuj-1(8.670±1.410)比較,Lv- MTA3 組增加了 GFAP(58.190±3.370)和 Tuj-1(19.140±2.340)的表達(F=12.394、17.774,P均=0.001)。免疫染色結果表明,Lv- MTA3 組降低了 GSC 的干性并誘導了分化,差異有統計學意義(P<0.05)。
3 討論
膠質瘤是成人中最常見的原發性腦惡性腫瘤,目前尚無有效治療方法,標準的非手術治療(包括放化療)只能產生適度的益處,部分原因是 GSC 的耐藥性,GSC 表現出干細胞特性和對放射治療的高耐藥性[11]。在本研究中,GSC 表現出比非 GSC 膠質瘤細胞更低的放射敏感性和活性氧水平,過表達 MTA3 導致活性氧產生增加和 GSC 的放射增敏。此外,過表達 MTA3 導致神經球形成能力和干細胞標志物表達降低。
MTA3 最初是作為小蛋白家族(包括 MTA1、MTA2 和 MTA3)的成員被發現的,這些家族都是 Mi-2/NuRD 染色質重塑復合物的亞基,MTA3 在人類癌癥中的報道最初非常有限。研究發現,MTA3 參與 B 淋巴細胞發育,在漿細胞瘤細胞系中,BCL6 和 MTA3 的過表達下調漿細胞分化基因[10]。雖然 MTA1 和 MTA2 通常被認為是致癌基因,主要是因為它們能夠增強轉移,但 MTA3 可以作為癌癥阻遏因子或癌基因,具體取決于癌癥類型。
已有研究發現,MTA3 下調見于乳腺癌、子宮內膜癌和卵巢癌,而 MTA3 表達的上調與人類絨毛膜癌有關,MTA3 過表達可作為判斷子宮非子宮內膜異位癌患者生存率的預后標志物[12]。然而,MTA3 的表達模式及其與臨床和病理因素的相關性尚未在膠質瘤中確定。研究顯示 MTA3 在中樞神經系統的發育和功能中起著至關重要的作用,而且在中樞神經系統疾病的發病機制中也起著至關重要的作用,例如帕金森病和阿爾茨海默病[12]。與正常腦組織相比,MTA3 在神經膠質瘤中顯著下調,并通過靶向膠質瘤細胞系中的 Bcl-2和骨髓細胞白血病序列 1基因來減少細胞增殖并增加細胞凋亡[13]。本研究結果發現 MTA3 在 GSC 中下調,MTA3 抑制 CD133+GSC 的自我更新能力并誘導細胞凋亡。
盡管癌細胞中的活性氧水平高于正常細胞,但異常高水平的活性氧產生會引發各種細胞死亡,壞死性凋亡的發生通常伴有活性氧產生過多[14]。活性氧的產生在許多藥物誘發的壞死性凋亡病例中起著至關重要的作用,同時,活性氧的產生經常伴隨著線粒體損傷和基質金屬蛋白酶的減少[15]。活性氧是細胞代謝的重要副產物,維持活性氧穩態對癌細胞存活至關重要,與正常組織干細胞類似,CSC 可能含有比塊狀腫瘤細胞更低水平的 活性氧,這促進了 CSC 的自我更新和腫瘤治療耐藥性,低水平的活性氧對于維持CSC及其抵抗治療的能力至關重要,活性氧在干細胞維持中起著至關重要的作用[16]。本研究發現,MTA3 過表達影響了谷氨酸酶代謝,增加了活性氧的產生,細胞凋亡和放射敏感性,并降低了神經球形成能力和干細胞標志物的表達。
綜上所述,本結果發現 MTA3 在 GSC 中下調,MTA3 過表達降低了 GSC 在體外和體內的耐輻射性和干性。這些發現表明,MTA3 在通過活性氧調節 GSC 的放射敏感性和干性方面起重要作用,MTA3 可能是開發膠質瘤治療策略的新方法。
利益沖突:所有作者聲明不存在利益沖突。
膠質瘤是成人和兒童中最常見的中樞神經系統腫瘤。在膠質瘤中具有自我更新能力和未成熟表型的小細胞群稱為膠質瘤干細胞(glioma stem cells, GSC),其表現出干細胞特性并具有啟動和繁殖腫瘤的能力[1]。GSC 還具有對化學治療(化療)和放射治療(放療)耐藥性高的特點[2]。由于 DNA 損傷檢查點和 DNA 修復的激活增加,GSC 顯示出對輻射的抵抗力,而 GSC 的化學耐藥性與 ATP 結合轉運體 ABCG2 轉運蛋白引起的藥物外排增加有關[3]。因此,闡明 GSC 治療耐藥性的分子機制將有助于治療干預的新靶點和延長患者生存期。
活性氧是有氧代謝的副產物,在腫瘤發生、轉移和癌癥的治療耐藥中起關鍵作用,活性氧在癌癥干細胞(cancer stem cell, CSC)中的作用,包括 GSC,仍然知之甚少[4]。盡管已有研究表明,與非致瘤后代相比,乳腺癌干細胞含有較低的活性氧水平和增強的活性氧防御,這可能有助于腫瘤的放射耐藥性[5]。但對活性氧的生物學效應及其在 GSC 中的調節機制知之甚少。而轉移相關蛋白(metastasis-associated protein, MTA)3 最初被發現是一個小蛋白家族的成員,是 Mi-2/NuRD 染色質重塑復合物的亞基[6-7]。MTA3 在乳腺癌、子宮內膜癌和卵巢癌中的表達減少,MTA3 上調通過直接抑制 Snail 表達來預防上皮間充質轉化,從而上調乳腺癌中的 E-鈣黏蛋白水平[8]。MTA3 還抑制乳腺上皮細胞中的 Wnt 靶基因[9],并可促進增殖小鼠顆粒細胞中的 G2/M 進展[10]。這些研究表明 MTA3 在不同類型的人類癌癥中有不同的作用。然而,MTA3 在 GSC 中的蛋白表達及其與臨床病理因素的關系尚未得到檢驗。因此,本研究旨在探究 MTA3 通過活性氧參與膠質瘤耐藥的分子機制,以期為后續研究提供參考。
1 材料與方法
1.1 主要材料和儀器
采用購自中國科學院模式培養物庫的非 GSC 膠質瘤細胞系 U87 和 SHG44。把細胞放在 Dulbecco 改良 Eagle 培養基(營養混合物 F-12 培養基中添加 10%胎牛血清,37℃,含 5%二氧化碳)的溫箱中培養。人 GSC 膠質瘤細胞培養物 U87s 來源于人膠質瘤細胞系 U87,使用無血清克隆形成方法與干細胞培養基進行富集。患者源性 GSC 膠質瘤細胞培養物 SU-2 是由唐山弘慈醫院提供,由手術標本分離。
GSC 在 20 ng/mL 表皮生長因子和 10 ng/mL 堿性成纖維細胞生長因子的無血清營養混合液 F-12 中培養產生神經球。每 3 天替換新鮮培養基進行培養。通過使用 NeuroCult 化學分離試劑盒分離球體來進行細胞傳代。
1.2 實驗方法
1.2.1 克隆細胞存活試驗
為了測試 GSC 和非 GSC 的自我更新能力,在無血清培養基中培養細胞以產生神經球。在室溫下,用 PRIMUS 加速器(中國西門子,型號 PR3562)對 U87、U87s、SU-2 和 SHG44 細胞進行 X 線照射(6 MV,劑量率為 200 cGy/min)。照射后,將特定數量的細胞(0 或 2 Gy 照射細胞 100 個,4 Gy 照射細胞 200 個,6、8 和 10 Gy 照射細胞 2 000 個)分別在培養皿中復制 3 個,用于克隆生成實驗。將細胞孵育 11 d,用 37%甲醛溶液固定菌落,結晶紫染色,計數菌落 50 個左右。在 48 Gy X 線照射后 5 h 使用流式細胞術定量測量 GSC 的凋亡,計算細胞存活分數和氧增強比(oxygen enhancement ratio, OER)。其中,OER 為缺氧與常氧之比,并采用線性二次模型計算 X 線照射后的平均致死劑量。在常氧條件下暴露于 0、2、4、6、8、10 Gy X 線照射后(大氣條件,21%O2)或缺氧條件(24 h,1%O2),檢查細胞存活分數和細胞存活曲線。
1.2.2 活性氧檢測
用于測試了輻照 GSC 中的活性氧形成是否受到抑制。使用加載 2’-7’-二氯二氫熒光素二乙酸鹽(2’-7’-dichlorodihydrofluorescein diacetate, H2DCFH-DA)的細胞檢查活性氧形成。U87、U87s、SU-2 和 SHG44 細胞用 20 μmol/L 的 H2DCFH-DA 或 5 μmol/L Cell ROX?深紅色試劑在 37°C 黑暗環境中孵育 30 min,通過胰蛋白酶法收集細胞,并在流式細胞術分析前清洗去除染料。
1.2.3 熒光定量聚合酶鏈反應(fluorescent quantitative polymerase chain reaction, qPCR)
根據制造商說明書進行總 RNA 提取和逆轉錄。使用雙鏈嵌合熒光染色 PCR 試劑盒(日本大阪東洋紡)的標準方案進行 qPCR。甘油醛-3-磷酸脫氫酶被用作參考信使核糖核酸(messenger RNA, mRNA),使用 SuperScriptⅢ逆轉錄酶用寡核苷酸(dT)引物將總 mRNA 反轉錄成互補 DNA(complementary DNA, cDNA),在 ABI Prism 7900(中國上海艾研生物科技有限公司)序列檢測系統上進行定量實時 PCR,從 1 μL cDNA、序列特異性引物和雙鏈嵌合熒光染色實時 PCR 預混液進行混合,在以下加熱條件下:95℃下加熱 10 min,40 s 循環,在 95℃下持續加熱 15 s,60℃持續 1 min。通過比較循環閾值(cycle threshold, Ct)方法計算相對 mRNA 水平(2?ΔΔCt 式)用β-actin 進行歸一化。
1.2.4 蛋白質印跡分析
從 U87、U87s、SU-2 和 SHG44 細胞中提取的蛋白質,其具有 1 mmol/L 蛋白酶抑制劑(稀釋比例 1∶100)。在 10%聚丙烯酰胺凝膠(Bio-Rad)上分餾 20 μg 蛋白質,在 4℃下以 200 mA 轉移到聚二氟乙烯膜中 2 h。在由 50 mmol/L Tris、133 mmol/L 氯化鈉組成,pH 值為 7.4的 Tris 緩沖鹽水(tris buffered saline, TBS)和 5%稀釋的脫脂奶粉中阻斷膜 2 h 后,與 MTA3 一抗抗體一起在室溫下在 1%牛奶和 TBS 中孵育 2 h。在 0.5% Tween-20 的 TBS 中洗滌后,將聚偏氟乙烯 Poly 膜與辣根過氧化物酶偶聯二抗兔抗大鼠 lgG2b(稀釋比例 1∶4 000)在 TBS 和 1%牛奶中在室溫下孵育 2 h,后使用化學發光底物使條帶可視化。
1.2.5 過表達 MTA3
本文旨在研究過表達 MTA3 對 GSC 的活性氧產生、凋亡和放射敏感性的影響,因此將 U87s 和 SU-2 細胞都各分為 Lv-MTA3、Lv-scr 組。首先,通過慢端膜介導的基因轉移產生具有 MTA3 成熟序列或爭奪序列穩定整合的 GSC。為了產生相應病毒,用慢病毒載體 pGLV-miR-293-GFP 或 pGLV-scr-GFP 以及包裝質粒 PG-P153-VSVG、PG-P1-REV 和 PG-P2-RRE 轉染 3T 細胞;編碼 MTA3 或加擾序列的病毒感染目標 GSC,并使用嘌呤霉素進行選擇,為 Lv-MTA3 組(過表達 MTA3)。Lv-scr 組為加未感染編碼 MTA3 或加擾序列的病毒處理。
1.2.6 流式細胞術分析
根據膜聯蛋白-V-PE/7-氨基放線菌素 D 凋亡檢測試劑盒制造商說明(中國南京凱基生物),通過流式細胞儀(中國碧迪)進行分析。其中,藻紅蛋白陽性和 7-氨基放線菌素 D 陰性細胞被視為凋亡細胞。
1.2.7 神經球形成測定
將 U87s 和 SU-2 以每孔 10、100 或
1.2.8 干細胞標志物和分化標志物的免疫熒光染色
對干細胞標志物 CD133 和巢蛋白以及分化標志物神經膠質纖維酸性蛋白(glial fibrillary acidic protein, GFAP)和神經元類型Ⅲβ-微管蛋白克隆(neuron type ⅲβ-tubulin cloning, Tuj-1)進行免疫熒光染色。將 GSC 在室溫下固定在 4%多聚甲醛中 15 min,使用 0.1%曲拉通 X-100(Triton-X100)透化 20 min,并在室溫下封閉在 5%牛血清白蛋白中 1 h。用針對人 CD133(稀釋比例 1∶200),巢蛋白(濃度為 1∶300),GFAP(稀釋比例 1∶500)和 Tuj-1(稀釋比例 1∶500)的小鼠抗體免疫染色 GSC 在黑暗中孵育 45 min。隨后用德克薩斯紅偶聯抗小鼠免疫球蛋白 G(中國艾博抗,稀釋比例 133∶1)在室溫下對干細胞標志物 CD1 和巢蛋白以及分化標志物 GFAP 和 Tuj-1 進行 30 min 的可視化,并用 4’,6’-二脒基-2-苯基吲哚(稀釋比例 1∶500)對細胞核進行復染,用熒光顯微鏡捕獲熒光圖像。
1.3 統計學方法
采用 SPSS 21.0 統計軟件進行數據分析。符合正態分布的計量資料以均數±標準差表示,組間比較采用單因素方差分析。雙側檢驗水準α=0.05。
2 結果
2.1 MTA3 在膠質瘤細胞中的表達
蛋白質印跡檢測 MTA3 在膠質瘤細胞中的表達發現,U87(16.78±3.45)、SHG44(19.230±3.090)、U87s(1.180±0.490)和 SU-2(12.190±2.410)細胞的 MTA3 表達比較,差異有統計學意義(F=12.440,P=0.001)。
qPCR 檢測 MTA3 在膠質瘤細胞中的表達結果顯示,過表達 MTA3 后,在 U87s 細胞中,Lv-MTA3 組和 LV-scr 組的 MTA3 分為別(1.280±0.580)、(16.290±4.010);在 SU-2 中,Lv-MTA3 組和 Lv-scr 組的 MTA3 分為別(1.240±0.530)、(12.210±3.890)。在 U87s 和 SU-2 中,Lv-MTA3 組的 MTA3 表達均高于 Lv-scr 組(P<0.05)。
2.2 GSC 和非 GSC 的放射敏感性和活性氧形成
神經球形成試驗表明,神經球形成率在 GSC[U87s(31.110±7.420)、SU-2 組(43.120±8.430)]、非 GSC[U87(2.720±1.410)和 SHG44(2.540±1.170)]間比較,差異有統計學意義(F=12.344,P=0.001)。
不同劑量 X 線照射后細胞存活分數比較見圖1。可見,在常氧和缺氧條件下,0、2、4、6 Gy X 線照射后,不用組間比較差異均無統計學意義(P>0.05);在 8 Gy 照射下,在缺氧條件下,U87s(0.810±0.100)、SU-2(0.720±0.110)、U87(0.120±0.010)和 SHG44(0.150±0.07)具有放射抗性,差異有統計學意義(F=11.324,P=0.001);在常氧條件下,U87s(0.140±0.060)和 SU-2(0.120±0.07)比 U87(
 圖1
不同劑量 X 線照射后細胞存活分數比較
圖1
不同劑量 X 線照射后細胞存活分數比較
a. U87 和 U87s 細胞,b. SHG44 和 SU-2 細胞。dose:劑量;Normoxic:常氧;Hypoxic:缺氧。*與常氧組比較,
H2DCFH-DA 探針在 GSC 和非 GSC 中對活性氧形成進行流式細胞術分析結果顯示,與非 GSC[U87(5.720±1.030)和 SHG44(5.210±1.010)]比較,GSC[U87s(1.880±0.790)和 SU-2 組(1.990±0.680)]基底活性氧形成減少(F=16.347,P=0.001)。
2.3 過表達 MTA3 對 GSC 的活性氧產生、凋亡和放射敏感性的影響
在 U87s 細胞中,與 Lv-scr 組(1.110±0.410)比較,Lv-MTA3 組的(5.610±0.820)的活性氧生成增加(F=16.355,P=0.001),在 SU-2 組細胞中,與 Lv-scr 組(1.180±0.390)比較,Lv-MTA3 組的(5.880±
過表達 MTA3 下不同劑量 X 線照射后細胞存活分數的影響比較見圖2。可見,在常氧和缺氧條件下,0、2、4、6 Gy X 線照射后,不同組間比較差異均無統計學意義(P>0.05);在 10 Gy X 線照射后,在缺氧條件下,在 U87s 細胞中,Lv-MTA3 組(
 圖2
過表達 MTA3 下不同劑量 X 線照射后細胞存活分數的影響比較
圖2
過表達 MTA3 下不同劑量 X 線照射后細胞存活分數的影響比較
a. U87 和 U87s 細胞,b. SHG44 和 SU-2 細胞。dose:劑量;Normoxic:常氧;Hypoxic:缺氧;MTA3:轉移相關蛋白3。*與常氧組比較,
流式細胞術分析顯示在 U87s 細胞中,Lv-MTA3 組的凋亡率(21.190±3.520)高于 Lv-scr 組(3.890±0.520)和 Lv-scr 組(4.160±0.510),差異有統計學意義(F=21.341,P=0.001);在 SU-2 組細胞中,Lv-MTA3 組的凋亡率(13.150±3.230)高于 Lv-scr 組(3.190±0.400)和 Lv-scr 組(3.960±0.560),差異有統計學意義(F=11.241,P=0.001)。
2.4 過表達 MTA3 對 GSC 的神經球形成能力和干性(神經發生能力)的影響
過表達 MTA3 對 GSC 的神經球形成能力和干性的影響見圖3。對干細胞標志物 CD133 和巢蛋白以及分化標志物膠質纖維酸性蛋白(GFAP)(星形膠質細胞)和 Tuj-1(神經元)進行免疫熒光染色結果表明,在 U87s 細胞中,與 Lv-scr 組的 CD133(97.110±4.430)和巢蛋白免疫抑素(95.160±5.460)比較,Lv-MTA3 組降低了 CD133(81.160±3.460)和巢蛋白免疫抑素(76.160±6.420)的表達(F=11.321、14.566,P均=0.001);與 Lv-scr 組的 GFAP(8.180±1.220)和 Tuj-1(54.140±4.360)比較,Lv- MTA3 組增加了 GFAP(56.860±4.560)和 Tuj-1(21.110±1.960)的表達(F=8.388、18.367,P均=0.001)。
 圖3
過表達 MTA3 對 GSC 的神經球形成能力和干性的影響
圖3
過表達 MTA3 對 GSC 的神經球形成能力和干性的影響
a. 過表達 MTA3 對 GSC 的神經球形成能力(CD133 和巢蛋白)的影響;b. 過表達 MTA3 對 GSC 的神經球形成能力(GFAP 和 Tuj-1)的影響。Nestin:巢蛋白;GFAP:神經膠質纖維酸性蛋白;Tuj-1:神經元類型Ⅲβ-微管蛋白克隆;MTA3:轉移相關蛋白3。*與Lv-scr比較,
在 SU-2 組細胞中,與 Lv-scr 組的 CD133(98.180±5.330)和巢蛋白免疫抑素(98.810±4.480)比較,Lv- MTA3 組降低了 CD133(76.140±5.310)和巢蛋白免疫抑素(76.130±4.350)的表達(F=10.324、5.354,P均=0.001);與 Lv-scr 組的 GFAP(9.230±1.130)和 Tuj-1(8.670±1.410)比較,Lv- MTA3 組增加了 GFAP(58.190±3.370)和 Tuj-1(19.140±2.340)的表達(F=12.394、17.774,P均=0.001)。免疫染色結果表明,Lv- MTA3 組降低了 GSC 的干性并誘導了分化,差異有統計學意義(P<0.05)。
3 討論
膠質瘤是成人中最常見的原發性腦惡性腫瘤,目前尚無有效治療方法,標準的非手術治療(包括放化療)只能產生適度的益處,部分原因是 GSC 的耐藥性,GSC 表現出干細胞特性和對放射治療的高耐藥性[11]。在本研究中,GSC 表現出比非 GSC 膠質瘤細胞更低的放射敏感性和活性氧水平,過表達 MTA3 導致活性氧產生增加和 GSC 的放射增敏。此外,過表達 MTA3 導致神經球形成能力和干細胞標志物表達降低。
MTA3 最初是作為小蛋白家族(包括 MTA1、MTA2 和 MTA3)的成員被發現的,這些家族都是 Mi-2/NuRD 染色質重塑復合物的亞基,MTA3 在人類癌癥中的報道最初非常有限。研究發現,MTA3 參與 B 淋巴細胞發育,在漿細胞瘤細胞系中,BCL6 和 MTA3 的過表達下調漿細胞分化基因[10]。雖然 MTA1 和 MTA2 通常被認為是致癌基因,主要是因為它們能夠增強轉移,但 MTA3 可以作為癌癥阻遏因子或癌基因,具體取決于癌癥類型。
已有研究發現,MTA3 下調見于乳腺癌、子宮內膜癌和卵巢癌,而 MTA3 表達的上調與人類絨毛膜癌有關,MTA3 過表達可作為判斷子宮非子宮內膜異位癌患者生存率的預后標志物[12]。然而,MTA3 的表達模式及其與臨床和病理因素的相關性尚未在膠質瘤中確定。研究顯示 MTA3 在中樞神經系統的發育和功能中起著至關重要的作用,而且在中樞神經系統疾病的發病機制中也起著至關重要的作用,例如帕金森病和阿爾茨海默病[12]。與正常腦組織相比,MTA3 在神經膠質瘤中顯著下調,并通過靶向膠質瘤細胞系中的 Bcl-2和骨髓細胞白血病序列 1基因來減少細胞增殖并增加細胞凋亡[13]。本研究結果發現 MTA3 在 GSC 中下調,MTA3 抑制 CD133+GSC 的自我更新能力并誘導細胞凋亡。
盡管癌細胞中的活性氧水平高于正常細胞,但異常高水平的活性氧產生會引發各種細胞死亡,壞死性凋亡的發生通常伴有活性氧產生過多[14]。活性氧的產生在許多藥物誘發的壞死性凋亡病例中起著至關重要的作用,同時,活性氧的產生經常伴隨著線粒體損傷和基質金屬蛋白酶的減少[15]。活性氧是細胞代謝的重要副產物,維持活性氧穩態對癌細胞存活至關重要,與正常組織干細胞類似,CSC 可能含有比塊狀腫瘤細胞更低水平的 活性氧,這促進了 CSC 的自我更新和腫瘤治療耐藥性,低水平的活性氧對于維持CSC及其抵抗治療的能力至關重要,活性氧在干細胞維持中起著至關重要的作用[16]。本研究發現,MTA3 過表達影響了谷氨酸酶代謝,增加了活性氧的產生,細胞凋亡和放射敏感性,并降低了神經球形成能力和干細胞標志物的表達。
綜上所述,本結果發現 MTA3 在 GSC 中下調,MTA3 過表達降低了 GSC 在體外和體內的耐輻射性和干性。這些發現表明,MTA3 在通過活性氧調節 GSC 的放射敏感性和干性方面起重要作用,MTA3 可能是開發膠質瘤治療策略的新方法。
利益沖突:所有作者聲明不存在利益沖突。