引用本文: 陸晴, 劉茜輝, 李貴星, 宋昊嵐. 三種腫瘤合并致難治性高血鈣一例. 華西醫學, 2024, 39(8): 1335-1336. doi: 10.7507/1002-0179.202306167 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患者,女,66 歲,10+ d 前無明顯誘因出現腰背部疼痛,為間斷性疼痛,不伴血尿,無尿頻尿急尿痛等癥狀于外院就診。外院 CT 示:右腎占位,考慮腫瘤性病變,透明細胞癌?雙腎囊腫,肝臟囊腫,肝內膽管擴張。患者為求進一步診治,遂于 2022 年 8 月 31 日至四川大學華西醫院泌尿外科就診。入院體格檢查:體溫 36.7℃,呼吸 20 次/min,心率 90 次/min,血壓 117/87 mm Hg(1 mm Hg=0.133 kPa),腹部外形正常,全腹軟,無壓痛及反跳痛,腹部未觸及包塊,肝臟肋下未觸及,脾臟肋下未觸及,雙腎未觸及。2022 年 9 月 1 日實驗室生化提示血鈣 3.79 mmol/L,肌酐 81 μmol/L,尿素氮 3.2 mmol/L,尿酸 347 μmol/L,白細胞介素(interleukin, IL)-6 3.55 pg/mL。CT 示:右腎體積增大,下極見類圓形軟組織密度腫塊影,增強后不均勻明顯強化;胸 2、3、6 椎體見骨質破壞伴軟組織密度影。單光子發射計算機斷層掃描(single photon emission computed tomography, SPECT)腎顯像示:右腎位置下移,下份見放射性稀疏缺損。正電子發射斷層顯像/X 線計算機體層成像儀示:① 右腎下極腫塊符合腎癌改變;② 骨質疏松,胸椎多處溶骨性病變。血清蛋白電泳結果示:M-蛋白 39.70%。免疫固定電泳結果示:免疫球蛋白 G-LAM 型 M 蛋白(+)。骨髓穿刺結果示:漿細胞比例占 14%,以原、幼漿細胞為主占 13%。骨髓流式細胞術結果示:P1 群(紅色)細胞約占有核細胞 8%,表達 CD38、CD138 和 CD56,限制性表達胞漿 lambda 輕鏈。甲狀旁腺激素(parathyroid hormone, PTH)40.65 pmol/L,25-羥基維生素 D 17.1 nmol/L,β-膠原降解產物 2.210 ng/mL,總Ⅰ型膠原氨基端延長肽 38.50 ng/mL,甲狀腺彩色多普勒超聲專科檢查示:甲狀腺實質雙側葉查見數個大小 1~2 mm 的無回聲結節,彩色多普勒血流顯像示:腺體內未見異常血流信號。SPECT 甲狀旁腺融合顯像示:甲狀腺左葉下極的下方結節攝取甲氧基異丁基異腈局限性增高。
2022 年 9 月 3 日,患者行機器人輔助經腹腹腔鏡腎部分切除術,右腎周粘連術,右腎固定術。術后病理免疫組化:細胞角蛋白 CK7(?)、上皮細胞膜抗原 EMA(部分+)、轉錄因子 Pax-8(+)、琥珀酸脫氫酶乙型 SDHB(+、無缺失)、基因 TFE3(?)、轉錄因子 TFEB(?)、蛋白 FH(+、無缺失)、黑色素相關抗原 MART-1(?)、碳酸酐酶 CA Ⅸ(+)、腎小管細胞表面蛋白 KSP-Cadherin(?)。診斷:右腎透明細胞腎細胞癌(國際泌尿病理協會/世界衛生組織分級標準 2 級)。2022 年 10 月 19 日,患者發生高鈣血癥引起的昏迷,意識喪失 12 h。予補液水化,鮭魚降鈣素注射液降鈣等治療。2022 年 10 月 24 日,熒光原位雜交結果示:RB1 和 D13S319 位點信號缺失,陽性率均為 17%;CKS1B(1q21)位點信號擴增,陽性率為 16%;TP53 外顯子上檢測到一個錯義變異:c.215>G;p.Pro72Arg(純和)。診斷為:多發性骨髓瘤免疫球蛋白 G-LAM 型(骨髓瘤細胞數量分期 ⅢA 期,預后判斷分期Ⅱ期,修正預后判斷分期Ⅱ期,美國東部腫瘤協作組評分 1 分)。予硼替佐米+地塞米松 2 次/周,持續抗腫瘤治療。2022 年 11 月 9 日,行頸部探查+左下甲狀旁腺(瘤)切除+術中喉返神經探查監測術。術后病理免疫組化結果示:PTH(+)、Pax 基因的編碼蛋白、癌胚抗原、甲狀腺轉錄因子-1 均(?),抑癌基因 P53[(+),約 60%]、腫瘤增殖相關抗原 Ki-67[(+),約 2%];網狀纖維 Foot 染色示網織纖維減少。診斷為:左下甲狀旁腺腺瘤。
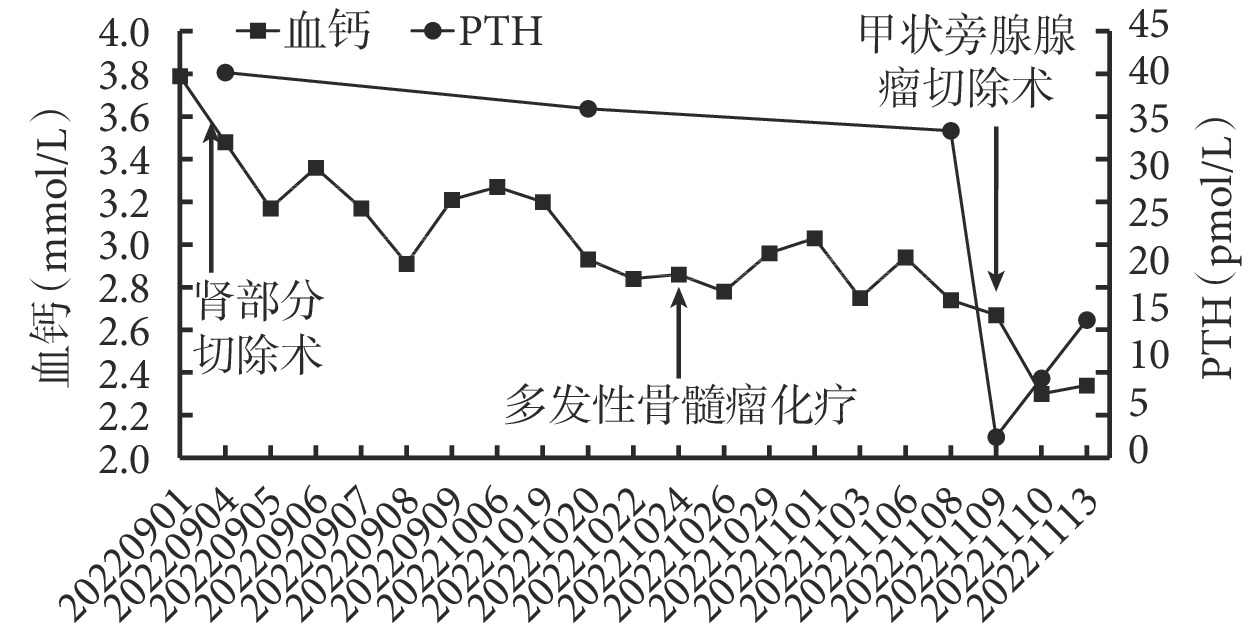
患者治療期間,血鈣、PTH 動態水平變化見圖1。可見,腎腫瘤切除術后,血鈣水平在 2.8~3.5 mmol/L,PTH 水平變化不大,術后發生 1 次高鈣血癥引起的昏迷,血鈣 3.2 mmol/L;多發性骨髓瘤規范化療后,血鈣水平在 2.6~3.2 mmol/L,PTH 水平略降;甲狀旁腺腺瘤切除術后,血鈣維持在 2.3 mmol/L,PTH 迅速下降。
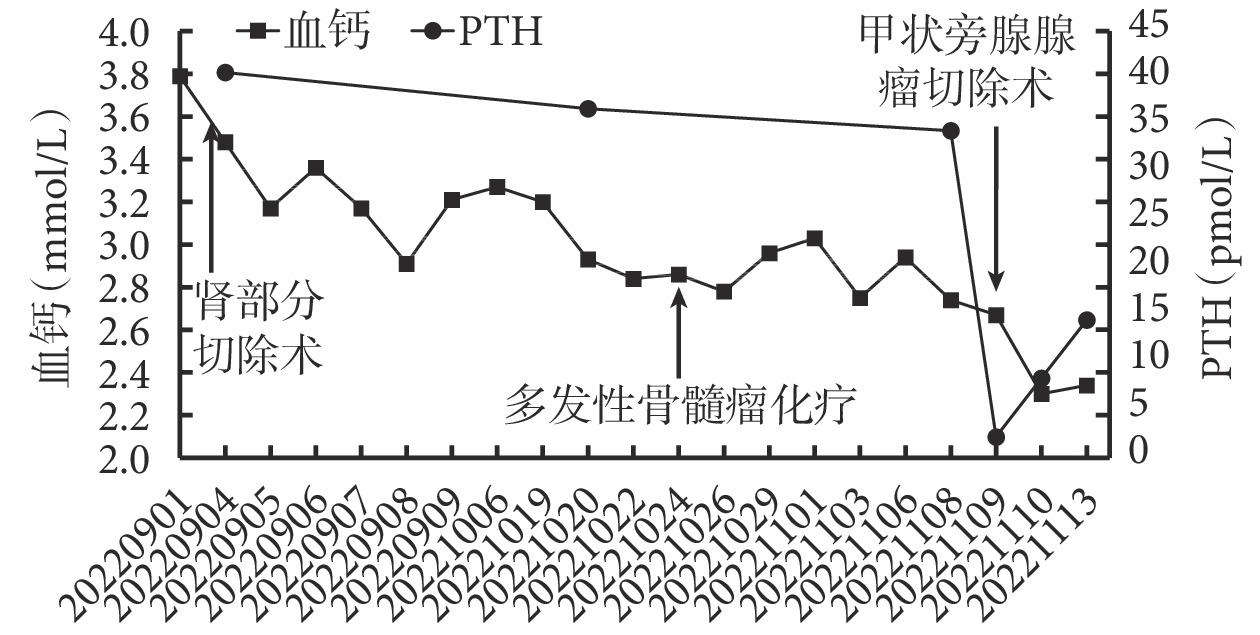 圖1
血鈣、PTH 動態水平變化情況
圖1
血鈣、PTH 動態水平變化情況
PTH :甲狀旁腺激素
討論 該例患者入院血鈣為 3.79 mmol/L,腎腫瘤切除術后,血鈣水平雖下降緩慢,波動幅度稍大,但較入院血鈣明顯下降。患者因高鈣血癥引起昏迷時,血鈣受多發性骨髓瘤和甲狀旁腺腺瘤兩者作用,說明多發性骨髓瘤和甲狀旁腺腺瘤對血鈣影響作用大于腎癌骨轉移。當患者行多發性骨髓瘤規范化療后,血鈣水平仍高但波動幅度有所下降,此時血鈣僅受甲狀旁腺腺瘤作用;行甲狀旁腺腺瘤切除術后,患者血鈣水平趨于正常且穩定。由此可見,血鈣來源于 3 種腫瘤的共同作用,故出現較高程度的高鈣血癥。血鈣升高最重要的原因是甲狀旁腺腺瘤,其次是多發性骨髓瘤,最后是腎癌骨轉移。隨著對病因的確定性治療,血鈣、PTH 水平的持續下降,患者疾病轉歸較好。
高血鈣是常見的危及生命的代謝紊亂,當血清總鈣>2.75 mmol/L 為高鈣血癥;當血清總鈣水平≥ 3.75 mmol/L 時為高鈣危象,可危及生命,需緊急處理。高鈣血癥的發生率隨著引起高鈣血癥疾病的進展而增加,預示原發疾病的預后不良。在高鈣血癥的病因中,惡性腫瘤相關性高鈣血癥及原發性甲狀旁腺功能亢進最常見(80%~90%)[1];其次為維生素 D 毒性、繼發性甲狀旁腺功能亢進、肉芽腫性疾病及其他罕見病因[2]。在惡性腫瘤相關性高鈣血癥中最常見病因為惡性實體瘤,其次為血液系統惡性腫瘤[3]。原發性甲狀旁腺功能亢進 85%~90%源自孤立性甲狀旁腺腺瘤[4]。
人體內鈣穩態受 PTH、維生素 D、降鈣素的共同調節,它們通過骨骼、腎臟、腸道發揮作用。其中 PTH 是最重要的調節因子,其分泌受血鈣的負反饋調節,同時 PTH 也正反饋調節血鈣水平。高鈣血癥根據甲狀旁腺細胞是否過度分泌 PTH 分為非 PTH 和 PTH 依賴性高鈣血癥。
在非 PTH 依賴性高鈣血癥中,惡性腫瘤相關性高鈣血癥最為多見,其引起血鈣升高的常見機制有以下 4 種:① 轉移引起的骨質溶解;② 甲狀旁腺激素相關蛋白(parathyroid hormone related protein, PTHrP);③ 過量的 1, 25-雙羥維生素 D 產生;④ 罕見分泌異位 PTH[5]。轉移引起的骨質溶解高鈣血癥是由于骨質溶解源自癌細胞刺激破骨細胞活化導致局部溶骨性破壞,破骨細胞分泌不同的骨源性生長因子和細胞因子,包括轉化生長因子-β、成纖維細胞生長因子、胰島素樣生長因子和骨形態發生蛋白等導致骨破壞[6]。多發性骨髓瘤則是漿細胞產生各種細胞因子,如 IL-1、IL-3、IL-6、腫瘤壞死因子α和轉化生長因子β,刺激成骨細胞產生核因子 κB 受體活化因子配體并激活破骨細胞將鈣釋放到循環中。PTHrP 高鈣血癥是腫瘤細胞可能分泌 PTHrp,PTHrp 在結構上類似于 PTH,它與 PTH 骨受體結合進而發揮升血鈣的作用[7]。過量的 1, 25-雙羥維生素 D 引起的高鈣血癥是腫瘤表達 1 α 羥化酶,1, 25-雙羥維生素 D 過量產生引起的高鈣血癥,多見于淋巴瘤[8];PTH 的異位產生引起血鈣升高則非常罕見。
PTH 依賴性高鈣血癥中原發性甲狀旁腺功能亢進最為常見,其引起血鈣升高的機制是甲狀旁腺功能亢進分泌過多 PTH,PTH 與骨和腎臟的 PTH 受體結合,使骨吸收增加,致鈣釋放入血,腎小管鈣重吸收增加,并增加腎臟 1, 25-雙羥基維生素 D3 到活性維生素 D 的合成,后者促進腸道鈣吸收,導致血鈣升高[9]。該例患者同時存在透明細胞腎細胞癌伴骨轉移、多發性骨髓瘤、甲狀旁腺腺瘤,均是引起高鈣血癥常見病因,但其升高血鈣的機制均不同。
回顧以往病例,Law 等[10]于 1977 年首次報道了多發性骨髓瘤和腎細胞癌共存的病例。此后,多發性骨髓瘤合并腎細胞癌的病例報道越來越多。Chisholm 等[11]于 1982 年描述了 1 例同時患有甲狀旁腺腺瘤和κ輕鏈骨髓瘤的老年患者,該患者最終死于難治性高鈣血癥。多發性骨髓瘤與甲狀旁腺腺瘤共同作用引起的高鈣血癥也被更多臨床醫生熟知。Wong 等[12]于 2005 年報道了 1 例甲狀旁腺腺瘤表現為繼發于腎細胞癌的副腫瘤綜合征。相對而言,甲狀旁腺腺瘤與腎細胞癌合并的病例報道較少。近年,腎細胞癌、多發性骨髓瘤、甲狀旁腺腺瘤兩兩合并的病例逐漸增多,并引起了大家重視,但三者合并的病例暫無報道。
綜上,該例患者同時合并 3 種腫瘤的情況少見,實體瘤和血液系統性腫瘤共存更為少見,3 種腫瘤均可致血鈣水平升高,出現血鈣難以控制的情況。總之,高血鈣病因復雜多樣且可在同一例患者中多種病因共存,臨床中如遇高血鈣,應結合患者癥狀體征、影像學及 PTH 等指標綜合分析診斷,如在治療后依然存在持續高血鈣,則提示可能存在其他病因,應積極查找病因,不可盲目使用降鈣藥物。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,女,66 歲,10+ d 前無明顯誘因出現腰背部疼痛,為間斷性疼痛,不伴血尿,無尿頻尿急尿痛等癥狀于外院就診。外院 CT 示:右腎占位,考慮腫瘤性病變,透明細胞癌?雙腎囊腫,肝臟囊腫,肝內膽管擴張。患者為求進一步診治,遂于 2022 年 8 月 31 日至四川大學華西醫院泌尿外科就診。入院體格檢查:體溫 36.7℃,呼吸 20 次/min,心率 90 次/min,血壓 117/87 mm Hg(1 mm Hg=0.133 kPa),腹部外形正常,全腹軟,無壓痛及反跳痛,腹部未觸及包塊,肝臟肋下未觸及,脾臟肋下未觸及,雙腎未觸及。2022 年 9 月 1 日實驗室生化提示血鈣 3.79 mmol/L,肌酐 81 μmol/L,尿素氮 3.2 mmol/L,尿酸 347 μmol/L,白細胞介素(interleukin, IL)-6 3.55 pg/mL。CT 示:右腎體積增大,下極見類圓形軟組織密度腫塊影,增強后不均勻明顯強化;胸 2、3、6 椎體見骨質破壞伴軟組織密度影。單光子發射計算機斷層掃描(single photon emission computed tomography, SPECT)腎顯像示:右腎位置下移,下份見放射性稀疏缺損。正電子發射斷層顯像/X 線計算機體層成像儀示:① 右腎下極腫塊符合腎癌改變;② 骨質疏松,胸椎多處溶骨性病變。血清蛋白電泳結果示:M-蛋白 39.70%。免疫固定電泳結果示:免疫球蛋白 G-LAM 型 M 蛋白(+)。骨髓穿刺結果示:漿細胞比例占 14%,以原、幼漿細胞為主占 13%。骨髓流式細胞術結果示:P1 群(紅色)細胞約占有核細胞 8%,表達 CD38、CD138 和 CD56,限制性表達胞漿 lambda 輕鏈。甲狀旁腺激素(parathyroid hormone, PTH)40.65 pmol/L,25-羥基維生素 D 17.1 nmol/L,β-膠原降解產物 2.210 ng/mL,總Ⅰ型膠原氨基端延長肽 38.50 ng/mL,甲狀腺彩色多普勒超聲專科檢查示:甲狀腺實質雙側葉查見數個大小 1~2 mm 的無回聲結節,彩色多普勒血流顯像示:腺體內未見異常血流信號。SPECT 甲狀旁腺融合顯像示:甲狀腺左葉下極的下方結節攝取甲氧基異丁基異腈局限性增高。
2022 年 9 月 3 日,患者行機器人輔助經腹腹腔鏡腎部分切除術,右腎周粘連術,右腎固定術。術后病理免疫組化:細胞角蛋白 CK7(?)、上皮細胞膜抗原 EMA(部分+)、轉錄因子 Pax-8(+)、琥珀酸脫氫酶乙型 SDHB(+、無缺失)、基因 TFE3(?)、轉錄因子 TFEB(?)、蛋白 FH(+、無缺失)、黑色素相關抗原 MART-1(?)、碳酸酐酶 CA Ⅸ(+)、腎小管細胞表面蛋白 KSP-Cadherin(?)。診斷:右腎透明細胞腎細胞癌(國際泌尿病理協會/世界衛生組織分級標準 2 級)。2022 年 10 月 19 日,患者發生高鈣血癥引起的昏迷,意識喪失 12 h。予補液水化,鮭魚降鈣素注射液降鈣等治療。2022 年 10 月 24 日,熒光原位雜交結果示:RB1 和 D13S319 位點信號缺失,陽性率均為 17%;CKS1B(1q21)位點信號擴增,陽性率為 16%;TP53 外顯子上檢測到一個錯義變異:c.215>G;p.Pro72Arg(純和)。診斷為:多發性骨髓瘤免疫球蛋白 G-LAM 型(骨髓瘤細胞數量分期 ⅢA 期,預后判斷分期Ⅱ期,修正預后判斷分期Ⅱ期,美國東部腫瘤協作組評分 1 分)。予硼替佐米+地塞米松 2 次/周,持續抗腫瘤治療。2022 年 11 月 9 日,行頸部探查+左下甲狀旁腺(瘤)切除+術中喉返神經探查監測術。術后病理免疫組化結果示:PTH(+)、Pax 基因的編碼蛋白、癌胚抗原、甲狀腺轉錄因子-1 均(?),抑癌基因 P53[(+),約 60%]、腫瘤增殖相關抗原 Ki-67[(+),約 2%];網狀纖維 Foot 染色示網織纖維減少。診斷為:左下甲狀旁腺腺瘤。
患者治療期間,血鈣、PTH 動態水平變化見圖1。可見,腎腫瘤切除術后,血鈣水平在 2.8~3.5 mmol/L,PTH 水平變化不大,術后發生 1 次高鈣血癥引起的昏迷,血鈣 3.2 mmol/L;多發性骨髓瘤規范化療后,血鈣水平在 2.6~3.2 mmol/L,PTH 水平略降;甲狀旁腺腺瘤切除術后,血鈣維持在 2.3 mmol/L,PTH 迅速下降。
 圖1
血鈣、PTH 動態水平變化情況
圖1
血鈣、PTH 動態水平變化情況
PTH :甲狀旁腺激素
討論 該例患者入院血鈣為 3.79 mmol/L,腎腫瘤切除術后,血鈣水平雖下降緩慢,波動幅度稍大,但較入院血鈣明顯下降。患者因高鈣血癥引起昏迷時,血鈣受多發性骨髓瘤和甲狀旁腺腺瘤兩者作用,說明多發性骨髓瘤和甲狀旁腺腺瘤對血鈣影響作用大于腎癌骨轉移。當患者行多發性骨髓瘤規范化療后,血鈣水平仍高但波動幅度有所下降,此時血鈣僅受甲狀旁腺腺瘤作用;行甲狀旁腺腺瘤切除術后,患者血鈣水平趨于正常且穩定。由此可見,血鈣來源于 3 種腫瘤的共同作用,故出現較高程度的高鈣血癥。血鈣升高最重要的原因是甲狀旁腺腺瘤,其次是多發性骨髓瘤,最后是腎癌骨轉移。隨著對病因的確定性治療,血鈣、PTH 水平的持續下降,患者疾病轉歸較好。
高血鈣是常見的危及生命的代謝紊亂,當血清總鈣>2.75 mmol/L 為高鈣血癥;當血清總鈣水平≥ 3.75 mmol/L 時為高鈣危象,可危及生命,需緊急處理。高鈣血癥的發生率隨著引起高鈣血癥疾病的進展而增加,預示原發疾病的預后不良。在高鈣血癥的病因中,惡性腫瘤相關性高鈣血癥及原發性甲狀旁腺功能亢進最常見(80%~90%)[1];其次為維生素 D 毒性、繼發性甲狀旁腺功能亢進、肉芽腫性疾病及其他罕見病因[2]。在惡性腫瘤相關性高鈣血癥中最常見病因為惡性實體瘤,其次為血液系統惡性腫瘤[3]。原發性甲狀旁腺功能亢進 85%~90%源自孤立性甲狀旁腺腺瘤[4]。
人體內鈣穩態受 PTH、維生素 D、降鈣素的共同調節,它們通過骨骼、腎臟、腸道發揮作用。其中 PTH 是最重要的調節因子,其分泌受血鈣的負反饋調節,同時 PTH 也正反饋調節血鈣水平。高鈣血癥根據甲狀旁腺細胞是否過度分泌 PTH 分為非 PTH 和 PTH 依賴性高鈣血癥。
在非 PTH 依賴性高鈣血癥中,惡性腫瘤相關性高鈣血癥最為多見,其引起血鈣升高的常見機制有以下 4 種:① 轉移引起的骨質溶解;② 甲狀旁腺激素相關蛋白(parathyroid hormone related protein, PTHrP);③ 過量的 1, 25-雙羥維生素 D 產生;④ 罕見分泌異位 PTH[5]。轉移引起的骨質溶解高鈣血癥是由于骨質溶解源自癌細胞刺激破骨細胞活化導致局部溶骨性破壞,破骨細胞分泌不同的骨源性生長因子和細胞因子,包括轉化生長因子-β、成纖維細胞生長因子、胰島素樣生長因子和骨形態發生蛋白等導致骨破壞[6]。多發性骨髓瘤則是漿細胞產生各種細胞因子,如 IL-1、IL-3、IL-6、腫瘤壞死因子α和轉化生長因子β,刺激成骨細胞產生核因子 κB 受體活化因子配體并激活破骨細胞將鈣釋放到循環中。PTHrP 高鈣血癥是腫瘤細胞可能分泌 PTHrp,PTHrp 在結構上類似于 PTH,它與 PTH 骨受體結合進而發揮升血鈣的作用[7]。過量的 1, 25-雙羥維生素 D 引起的高鈣血癥是腫瘤表達 1 α 羥化酶,1, 25-雙羥維生素 D 過量產生引起的高鈣血癥,多見于淋巴瘤[8];PTH 的異位產生引起血鈣升高則非常罕見。
PTH 依賴性高鈣血癥中原發性甲狀旁腺功能亢進最為常見,其引起血鈣升高的機制是甲狀旁腺功能亢進分泌過多 PTH,PTH 與骨和腎臟的 PTH 受體結合,使骨吸收增加,致鈣釋放入血,腎小管鈣重吸收增加,并增加腎臟 1, 25-雙羥基維生素 D3 到活性維生素 D 的合成,后者促進腸道鈣吸收,導致血鈣升高[9]。該例患者同時存在透明細胞腎細胞癌伴骨轉移、多發性骨髓瘤、甲狀旁腺腺瘤,均是引起高鈣血癥常見病因,但其升高血鈣的機制均不同。
回顧以往病例,Law 等[10]于 1977 年首次報道了多發性骨髓瘤和腎細胞癌共存的病例。此后,多發性骨髓瘤合并腎細胞癌的病例報道越來越多。Chisholm 等[11]于 1982 年描述了 1 例同時患有甲狀旁腺腺瘤和κ輕鏈骨髓瘤的老年患者,該患者最終死于難治性高鈣血癥。多發性骨髓瘤與甲狀旁腺腺瘤共同作用引起的高鈣血癥也被更多臨床醫生熟知。Wong 等[12]于 2005 年報道了 1 例甲狀旁腺腺瘤表現為繼發于腎細胞癌的副腫瘤綜合征。相對而言,甲狀旁腺腺瘤與腎細胞癌合并的病例報道較少。近年,腎細胞癌、多發性骨髓瘤、甲狀旁腺腺瘤兩兩合并的病例逐漸增多,并引起了大家重視,但三者合并的病例暫無報道。
綜上,該例患者同時合并 3 種腫瘤的情況少見,實體瘤和血液系統性腫瘤共存更為少見,3 種腫瘤均可致血鈣水平升高,出現血鈣難以控制的情況。總之,高血鈣病因復雜多樣且可在同一例患者中多種病因共存,臨床中如遇高血鈣,應結合患者癥狀體征、影像學及 PTH 等指標綜合分析診斷,如在治療后依然存在持續高血鈣,則提示可能存在其他病因,應積極查找病因,不可盲目使用降鈣藥物。
利益沖突:所有作者聲明不存在利益沖突。