引用本文: 李旭, 唐雪, 王杉杉, 楊瑩瑩, 茍慎菊, 張凌. 蛋白 A 免疫吸附治療抗中性粒細胞胞質抗體相關性血管炎一例. 華西醫學, 2024, 39(5): 841-844. doi: 10.7507/1002-0179.202307037 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患者,男,68 歲,因“肉眼血尿 2+ 個月,發現腎功能異常 10+ d”于 2023 年 5 月 4 日入四川大學華西醫院(以下簡稱“我院”)腎臟內科。入院前 2+ 個月,患者無明顯誘因出現全程無痛性肉眼血尿,伴倦怠、乏力,間斷出現面部及雙下肢對稱性水腫,晨輕暮重,患者未予以重視,未就診,癥狀無明顯緩解。入院前 10+ d,患者出現頭昏、頭痛,伴活動后心累氣緊,伴咳嗽、咳痰,痰中帶血絲,遂至當地醫院就診,測血壓升高(具體不詳),輔助檢查提示血紅蛋白 89 g/L,血肌酐 307.6 μmol/L,白蛋白 38.7 g/L,尿蛋白++,尿紅細胞+++;胸部 CT 提示雙肺散在斑片影。考慮“腎功能不全、腎性貧血、腎性高血壓、肺部感染”,給予“控制血壓、抗感染、糾正貧血、降肌酐”等對癥支持治療(具體不詳),患者咳嗽咳痰稍減輕,仍解肉眼血尿,感全身乏力、納差,復查血肌酐 453.2 μmol/L。遂于我院就診,門診考慮“急進性腎小球腎炎”收入腎臟內科進一步治療。患者既往史及家族史無特殊。
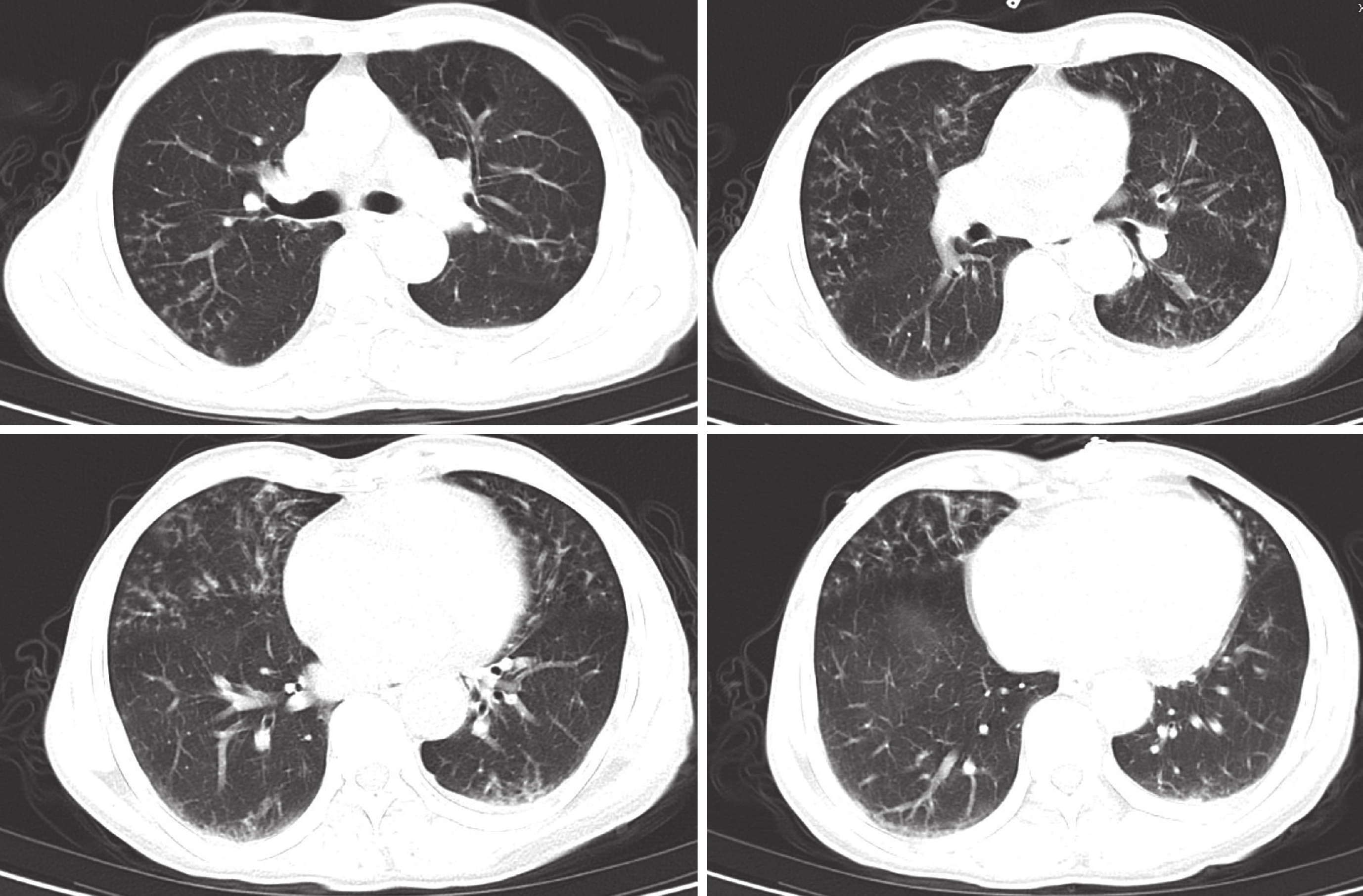
入院體格檢查:體溫 36.9℃,呼吸 24 次/min,血壓 158/93 mm Hg(1 mm Hg=0.133 kPa),脈搏 90 次/min;身高 170 cm,體重 55 kg;神志清楚,精神欠佳,皮膚無黃染及明顯皮疹;心瓣膜區未聞及雜音,雙肺呼吸音清,雙下肺可聞及少許濕啰音;雙下肢輕微水腫。完善輔助檢查,血細胞分析:紅細胞計數 2.94×1012/L,血紅蛋白 84 g/L,血小板計數 113×109/L,白細胞計數 7.09×109/L,中性粒細胞百分比 74.3%;血生化:白蛋白 36.1 g/L,肌酐 742.00 μmol/L,鈉 141.4 mmol/L,鉀 3.45 mmol/L,鈣 2.22 mmol/L,磷 1.6 mmol/L,二氧化碳結合力 26.0 mmol/L;尿常規:尿蛋白+++,紅細胞++++/HP(HP 表示高倍鏡視野),白細胞 16 個/HP;尿紅細胞形態分析:紅細胞異常形態百分率 30%,查見皺縮紅細胞、棘形紅細胞;抗核抗體 1∶320(+),核周型抗中性粒細胞胞質抗體(anti-neutrophil cytoplasmic antibody, ANCA)1∶10(+),抗髓過氧化物酶(myeloperoxidase, MPO)抗體滴度 206.00 AU/mL,抗蛋白酶 3 抗體滴度<2.00 AU/mL;抗雙鏈 DNA 抗體、抗 ENA 抗體譜、抗腎小球基底膜抗體、免疫球蛋白(immunoglobin, Ig)G4 亞型、免疫固定電泳檢測陰性;補體 C3 0.813 g/L,補體 C4 0.272 g/L;凝血常規:血漿凝血酶原時間 12.1 s,活化部分凝血活酶時間 28.8 s,國際標準化比值 1.06,纖維蛋白原 4.90 g/L,D-二聚體 0.86 mg/L FEU(FEU 表示纖維蛋白原等價單位);降鈣素原 0.40 ng/mL,C 反應蛋白 23.70 mg/L,白細胞介素-6 12.07 pg/mL。腎臟彩色多普勒超聲示:右腎大小 9.5 cm×4.5 cm×4.7 cm,左腎大小 9.5 cm×4.2 cm×4.8 cm,雙腎實質回聲增強,皮髓質分界不清。CT 胸部普通掃描(圖1)報告回示“雙肺散在斑片、結節影,考慮感染,部分支氣管稍擴張;心包少量積液;左側胸腔少量積液;建議治療后復查除外合并其他”。主要診斷考慮 ANCA 相關性血管炎、血管炎腎損害、急進性腎小球腎炎、腎性高血壓、肺部感染合并間質性損害等,按照伯明翰血管炎活動度評分為 32 分[1-2]。予加用鹽酸阿羅洛爾片(10 mg/次,2 次/d)控制血壓,哌拉西林他唑巴坦鈉(4.5 g/次,每 12 小時 1 次)抗感染,甲潑尼龍靜脈滴注(40 mg/次,1 次/d)調節免疫;安置股靜脈臨時透析導管,分別于 5 月 4 日、6 日、9 日行血液透析治療,超濾量分別為 500、
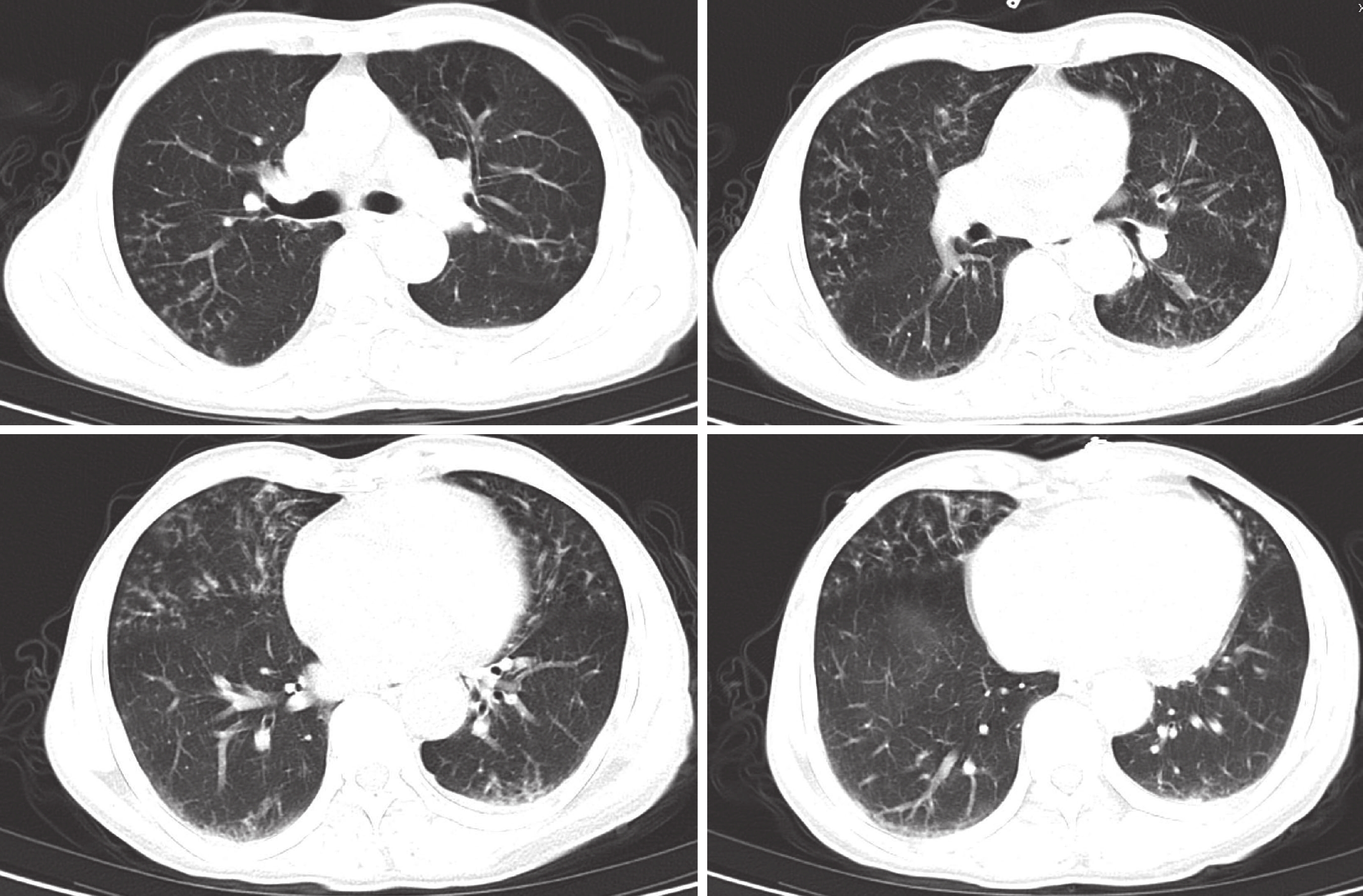 圖1
患者入院后胸部 CT 像
圖1
患者入院后胸部 CT 像
患者自 2023 年 5 月 8 日起行蛋白 A 免疫吸附治療,治療均采用 JUN-55X 血液凈化設備(日本來福恩株式會社),耗材選用 OP-08W 膜型血漿分離器(日本旭化成株式會社)、KCIA08 蛋白 A 吸附柱(廣州康盛生物科技股份有限公司)。抗凝方式為低分子肝素鈉,首劑
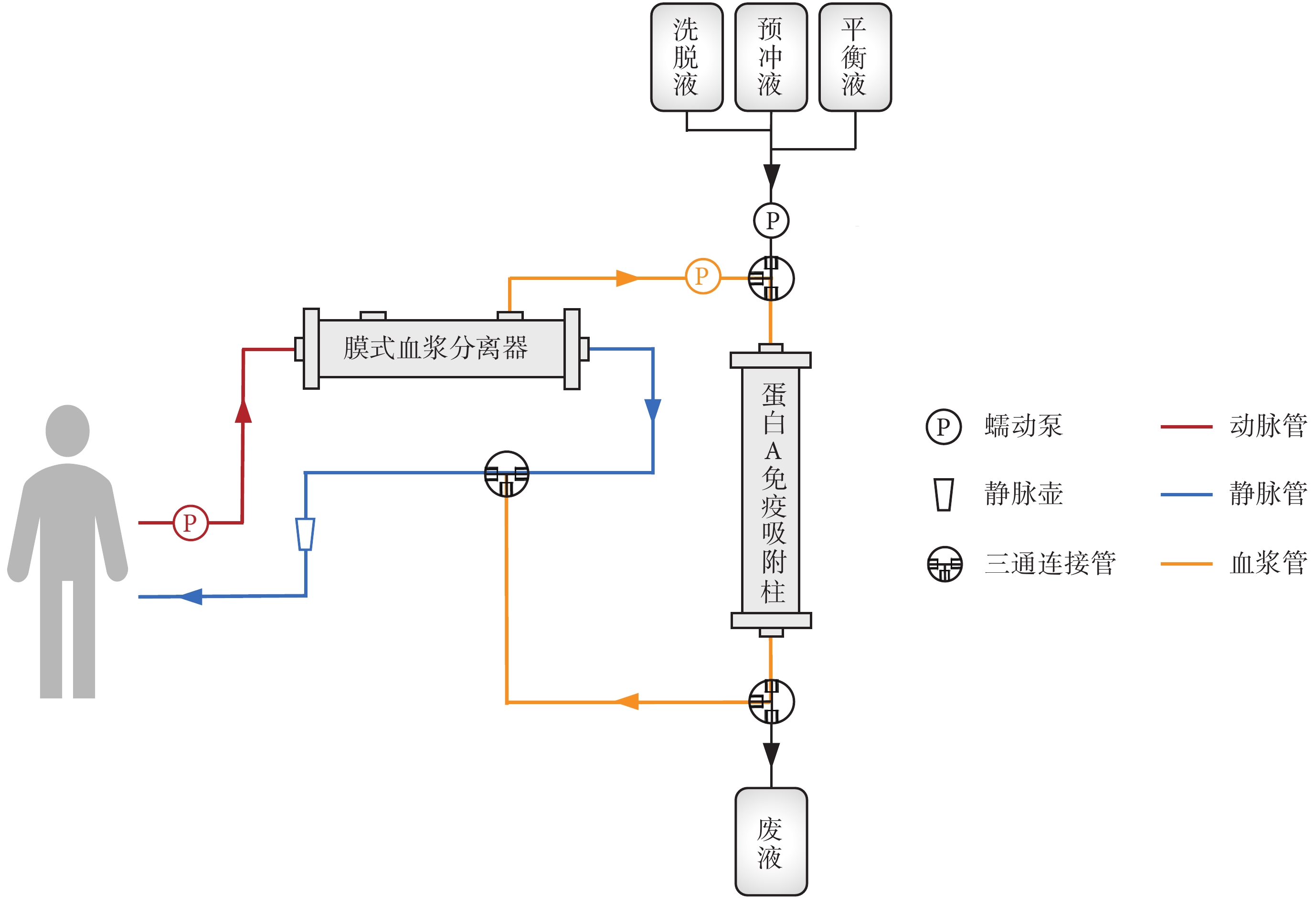 圖2
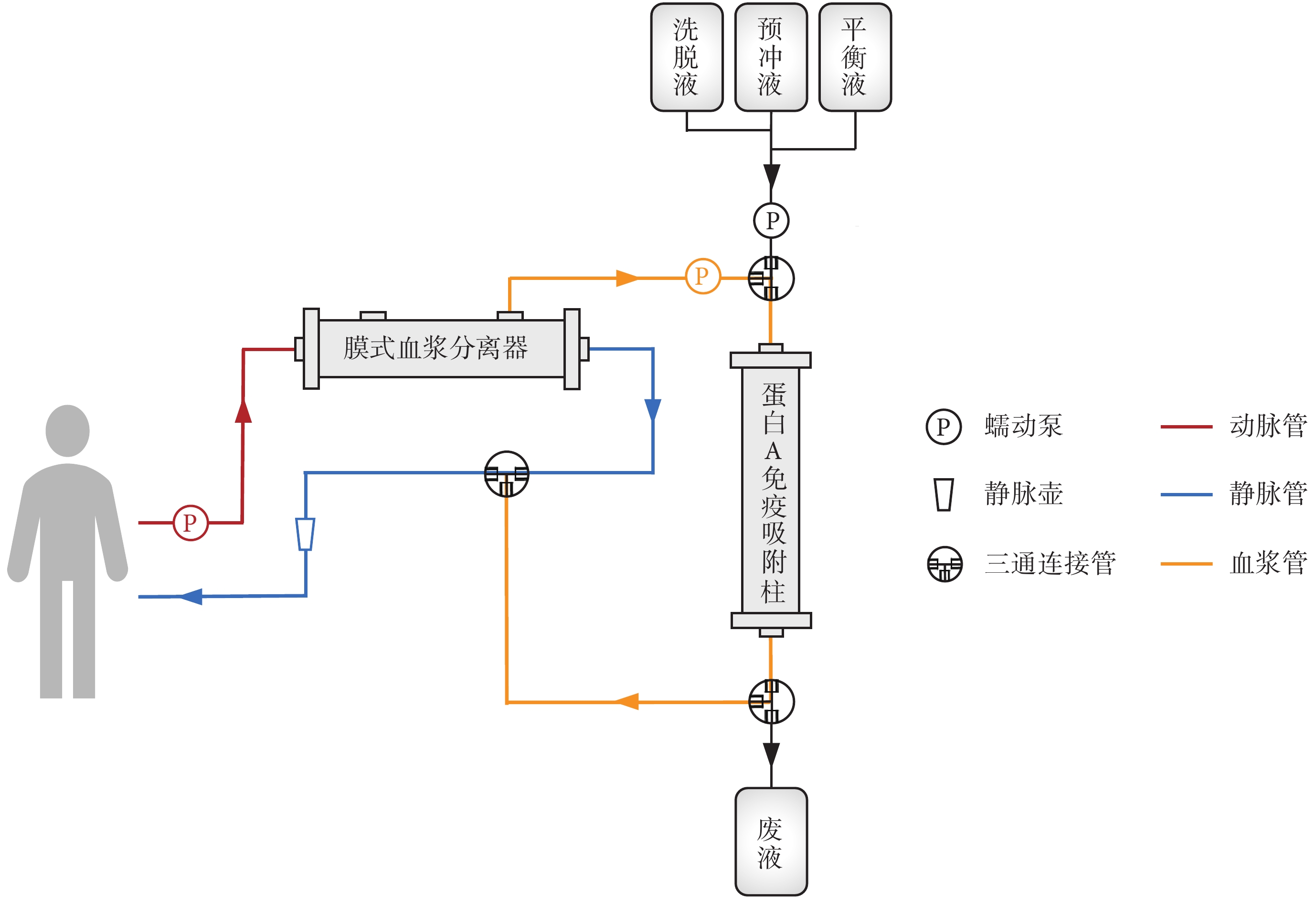
蛋白 A 免疫吸附治療模式圖
圖2
蛋白 A 免疫吸附治療模式圖
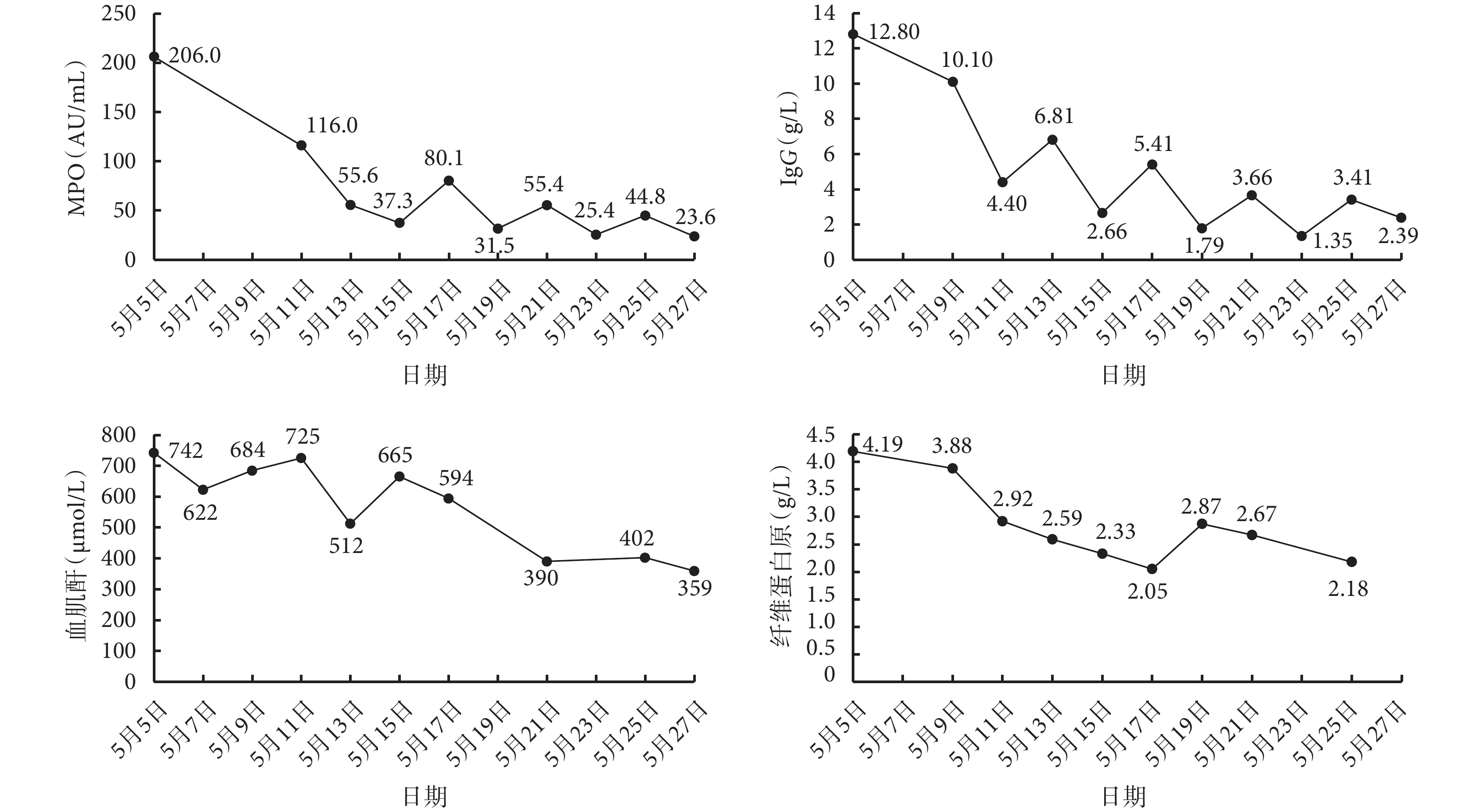 圖3
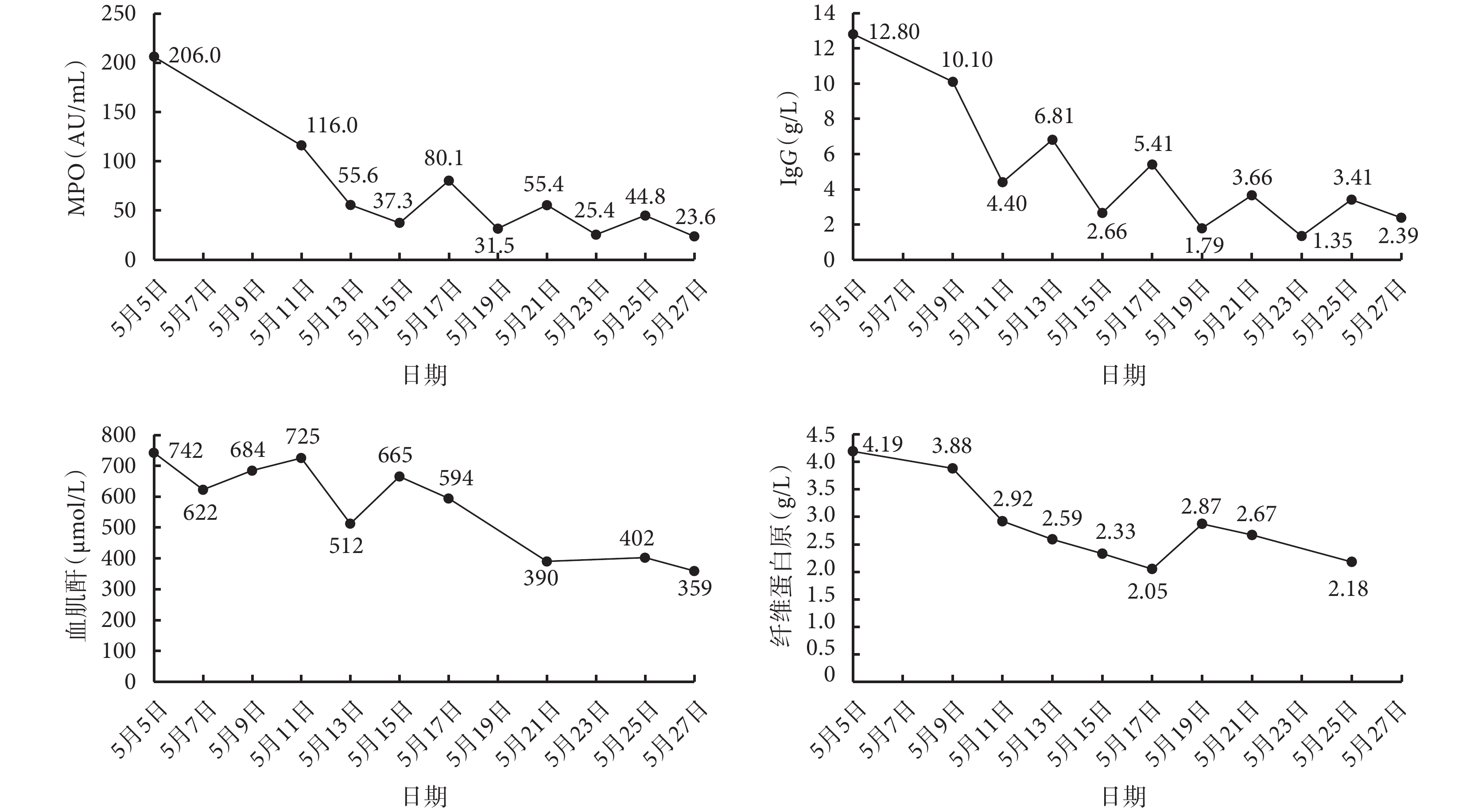
主要檢驗指標變化趨勢
圖3
主要檢驗指標變化趨勢
MPO:髓過氧化物酶;IgG:免疫球蛋白 G
討論 ANCA 相關性血管炎是一組以血清中能檢測到 ANCA 為最突出特點的系統性小血管炎,主要特征性病理改變為小血管壁的纖維素樣壞死。ANCA 相關性血管炎包括肉芽腫性多血管炎、顯微鏡下多血管炎(microscopic polyangitis, MPA)和嗜酸性肉芽腫性多血管炎。其中 MPA 最常累及腎臟,部分患者以急進性腎小球腎炎起病,80% 以上的 MPA 患者 ANCA 陽性,大部分為核周型 ANCA 陽性和 MPO 陽性,少部分為胞質型 ANCA 陽性[1]。ANCA 相關性血管炎多為進展性,未及時治療將引起不可逆的臟器損害,治療原則為快速明確診斷、快速開始誘導治療、早期誘導緩解[1]。誘導緩解的經典藥物是糖皮質激素聯合免疫抑制劑(最常用為環磷酰胺);近年來以 B 細胞為靶向的單克隆抗體治療亦逐步應用[1, 3-5]。對于合并肺泡出血,和/或因急進性腎小球腎炎導致的血肌酐>500 μmol/L 或需要透析的患者,需要行血漿置換治療[1, 5-6]。研究顯示,單膜血漿置換與雙膜血漿置換在改善 ANCA 相關性血管炎伴嚴重腎功能損傷患者的近遠期預后方面療效相當,而后者較前者更節省血漿資源[7]。然而血漿置換的開展受到血漿資源的限制,臨床上可能因血漿緊缺導致治療無法開展;且血漿置換治療中的血漿相關過敏反應較為常見[8],也是導致治療中止的常見因素。
蛋白 A 免疫吸附是一種較為新型的血液凈化技術,其借助葡萄球菌蛋白 A(staphylococcal protein A, SPA)能特異性與人體 IgG 的 Fc 片段高效結合的機理,通過體外循環的方法,有效清除患者體內以 IgG 為主(或屬于 IgG 型)的致病性抗體,已被臨床應用于治療自身免疫性疾病及其他一些與抗體相關的疾病[9-11]。SPA 與抗體的吸附是可逆的:在中性條件下,SPA 可以迅速結合抗體;在酸性條件下,抗體與 SPA 解離,從吸附劑上被洗脫下來;SPA 在酸性條件下不失活,恢復至中性條件后可恢復吸附能力;故蛋白 A 免疫吸附柱可循環吸附、多次使用。蛋白 A 免疫吸附治療不需要外源性血漿,不受血漿資源緊缺的限制,也可避免血漿相關過敏反應。
一項隨機對照臨床研究納入了 44 例急進性腎小球腎炎患者(其中含 33 例 ANCA 相關性血管炎)并分為兩組,在甲潑尼龍和環磷酰胺治療的基礎上分別使用免疫吸附和血漿置換,結果顯示免疫吸附組患者 6 個月內脫離透析的比例較雙膜血漿置換組更高[12]。國內有報道免疫吸附與雙膜血漿置換在抗腎小球基底膜病中的比較,兩組清除抗腎小球基底膜抗體的效應相當,兩組患者預后亦無明顯差異[10]。另有報道提示蛋白 A 免疫吸附在清除抗人組織相容性抗原抗體方面效果優于血漿置換,后者在清除抗體方面特異性較低且存在凝血因子消耗的缺點[13]。
本例患者共行 7 次蛋白 A 免疫吸附治療,檢測結果提示單次治療可顯著降低 IgG 與 MPO 水平,治療間期(治療結束至下次治療前)有一定反彈;多次吸附治療后 MPO 穩定下降,在完成第 2 次蛋白 A 免疫吸附治療后,該患者未再行血液透析治療,肌酐下降且相對穩定,尿量正常,成功脫離透析,提示在激素聯合環磷酰胺方案基礎上聯合蛋白 A 免疫吸附治療對于該例急進性腎小球腎炎療效滿意。同時我們觀察到蛋白 A 免疫吸附治療期間患者纖維蛋白原水平較為穩定。既往研究顯示,單次蛋白 A 免疫吸附對 IgG 的選擇性清除明顯高于連續 3 次的血漿置換對 IgG 的清除效果,而后者引起的纖維蛋白原的下降明顯高于前者[14]。
該病例為我院首例蛋白 A 免疫吸附治療,該技術可有效清除 ANCA,而纖維蛋白原損耗不明顯,但同時伴隨總 IgG 的下降;治療過程中患者耐受性好,未發生不良事件,提示該技術安全性較高。本例患者經糖皮質激素聯合環磷酰胺沖擊治療及蛋白 A 免疫吸附治療后,腎功能部分恢復,成功脫離透析,臨床療效滿意。與我院常規開展的雙膜血漿置換治療 ANCA 相關急進性腎炎相比,采用蛋白 A 免疫吸附的治療費用基本相當;考慮到該耗材的可復用性、治療過程中不需要外源性血漿,可能更適用于臨床判斷需要多次血液凈化治療清除抗體的患者,以及有血漿過敏史的患者。在護理方面,治療過程中操作步驟較多,尤其應注意準確計時以及監測相關液體 pH 值,以保證治療安全有效進行。在今后的研究中可擴大樣本量以更好地評估該技術對于自身抗體介導的急進性腎小球腎炎的治療效果。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,男,68 歲,因“肉眼血尿 2+ 個月,發現腎功能異常 10+ d”于 2023 年 5 月 4 日入四川大學華西醫院(以下簡稱“我院”)腎臟內科。入院前 2+ 個月,患者無明顯誘因出現全程無痛性肉眼血尿,伴倦怠、乏力,間斷出現面部及雙下肢對稱性水腫,晨輕暮重,患者未予以重視,未就診,癥狀無明顯緩解。入院前 10+ d,患者出現頭昏、頭痛,伴活動后心累氣緊,伴咳嗽、咳痰,痰中帶血絲,遂至當地醫院就診,測血壓升高(具體不詳),輔助檢查提示血紅蛋白 89 g/L,血肌酐 307.6 μmol/L,白蛋白 38.7 g/L,尿蛋白++,尿紅細胞+++;胸部 CT 提示雙肺散在斑片影。考慮“腎功能不全、腎性貧血、腎性高血壓、肺部感染”,給予“控制血壓、抗感染、糾正貧血、降肌酐”等對癥支持治療(具體不詳),患者咳嗽咳痰稍減輕,仍解肉眼血尿,感全身乏力、納差,復查血肌酐 453.2 μmol/L。遂于我院就診,門診考慮“急進性腎小球腎炎”收入腎臟內科進一步治療。患者既往史及家族史無特殊。
入院體格檢查:體溫 36.9℃,呼吸 24 次/min,血壓 158/93 mm Hg(1 mm Hg=0.133 kPa),脈搏 90 次/min;身高 170 cm,體重 55 kg;神志清楚,精神欠佳,皮膚無黃染及明顯皮疹;心瓣膜區未聞及雜音,雙肺呼吸音清,雙下肺可聞及少許濕啰音;雙下肢輕微水腫。完善輔助檢查,血細胞分析:紅細胞計數 2.94×1012/L,血紅蛋白 84 g/L,血小板計數 113×109/L,白細胞計數 7.09×109/L,中性粒細胞百分比 74.3%;血生化:白蛋白 36.1 g/L,肌酐 742.00 μmol/L,鈉 141.4 mmol/L,鉀 3.45 mmol/L,鈣 2.22 mmol/L,磷 1.6 mmol/L,二氧化碳結合力 26.0 mmol/L;尿常規:尿蛋白+++,紅細胞++++/HP(HP 表示高倍鏡視野),白細胞 16 個/HP;尿紅細胞形態分析:紅細胞異常形態百分率 30%,查見皺縮紅細胞、棘形紅細胞;抗核抗體 1∶320(+),核周型抗中性粒細胞胞質抗體(anti-neutrophil cytoplasmic antibody, ANCA)1∶10(+),抗髓過氧化物酶(myeloperoxidase, MPO)抗體滴度 206.00 AU/mL,抗蛋白酶 3 抗體滴度<2.00 AU/mL;抗雙鏈 DNA 抗體、抗 ENA 抗體譜、抗腎小球基底膜抗體、免疫球蛋白(immunoglobin, Ig)G4 亞型、免疫固定電泳檢測陰性;補體 C3 0.813 g/L,補體 C4 0.272 g/L;凝血常規:血漿凝血酶原時間 12.1 s,活化部分凝血活酶時間 28.8 s,國際標準化比值 1.06,纖維蛋白原 4.90 g/L,D-二聚體 0.86 mg/L FEU(FEU 表示纖維蛋白原等價單位);降鈣素原 0.40 ng/mL,C 反應蛋白 23.70 mg/L,白細胞介素-6 12.07 pg/mL。腎臟彩色多普勒超聲示:右腎大小 9.5 cm×4.5 cm×4.7 cm,左腎大小 9.5 cm×4.2 cm×4.8 cm,雙腎實質回聲增強,皮髓質分界不清。CT 胸部普通掃描(圖1)報告回示“雙肺散在斑片、結節影,考慮感染,部分支氣管稍擴張;心包少量積液;左側胸腔少量積液;建議治療后復查除外合并其他”。主要診斷考慮 ANCA 相關性血管炎、血管炎腎損害、急進性腎小球腎炎、腎性高血壓、肺部感染合并間質性損害等,按照伯明翰血管炎活動度評分為 32 分[1-2]。予加用鹽酸阿羅洛爾片(10 mg/次,2 次/d)控制血壓,哌拉西林他唑巴坦鈉(4.5 g/次,每 12 小時 1 次)抗感染,甲潑尼龍靜脈滴注(40 mg/次,1 次/d)調節免疫;安置股靜脈臨時透析導管,分別于 5 月 4 日、6 日、9 日行血液透析治療,超濾量分別為 500、
 圖1
患者入院后胸部 CT 像
圖1
患者入院后胸部 CT 像
患者自 2023 年 5 月 8 日起行蛋白 A 免疫吸附治療,治療均采用 JUN-55X 血液凈化設備(日本來福恩株式會社),耗材選用 OP-08W 膜型血漿分離器(日本旭化成株式會社)、KCIA08 蛋白 A 吸附柱(廣州康盛生物科技股份有限公司)。抗凝方式為低分子肝素鈉,首劑
 圖2
蛋白 A 免疫吸附治療模式圖
圖2
蛋白 A 免疫吸附治療模式圖
 圖3
主要檢驗指標變化趨勢
圖3
主要檢驗指標變化趨勢
MPO:髓過氧化物酶;IgG:免疫球蛋白 G
討論 ANCA 相關性血管炎是一組以血清中能檢測到 ANCA 為最突出特點的系統性小血管炎,主要特征性病理改變為小血管壁的纖維素樣壞死。ANCA 相關性血管炎包括肉芽腫性多血管炎、顯微鏡下多血管炎(microscopic polyangitis, MPA)和嗜酸性肉芽腫性多血管炎。其中 MPA 最常累及腎臟,部分患者以急進性腎小球腎炎起病,80% 以上的 MPA 患者 ANCA 陽性,大部分為核周型 ANCA 陽性和 MPO 陽性,少部分為胞質型 ANCA 陽性[1]。ANCA 相關性血管炎多為進展性,未及時治療將引起不可逆的臟器損害,治療原則為快速明確診斷、快速開始誘導治療、早期誘導緩解[1]。誘導緩解的經典藥物是糖皮質激素聯合免疫抑制劑(最常用為環磷酰胺);近年來以 B 細胞為靶向的單克隆抗體治療亦逐步應用[1, 3-5]。對于合并肺泡出血,和/或因急進性腎小球腎炎導致的血肌酐>500 μmol/L 或需要透析的患者,需要行血漿置換治療[1, 5-6]。研究顯示,單膜血漿置換與雙膜血漿置換在改善 ANCA 相關性血管炎伴嚴重腎功能損傷患者的近遠期預后方面療效相當,而后者較前者更節省血漿資源[7]。然而血漿置換的開展受到血漿資源的限制,臨床上可能因血漿緊缺導致治療無法開展;且血漿置換治療中的血漿相關過敏反應較為常見[8],也是導致治療中止的常見因素。
蛋白 A 免疫吸附是一種較為新型的血液凈化技術,其借助葡萄球菌蛋白 A(staphylococcal protein A, SPA)能特異性與人體 IgG 的 Fc 片段高效結合的機理,通過體外循環的方法,有效清除患者體內以 IgG 為主(或屬于 IgG 型)的致病性抗體,已被臨床應用于治療自身免疫性疾病及其他一些與抗體相關的疾病[9-11]。SPA 與抗體的吸附是可逆的:在中性條件下,SPA 可以迅速結合抗體;在酸性條件下,抗體與 SPA 解離,從吸附劑上被洗脫下來;SPA 在酸性條件下不失活,恢復至中性條件后可恢復吸附能力;故蛋白 A 免疫吸附柱可循環吸附、多次使用。蛋白 A 免疫吸附治療不需要外源性血漿,不受血漿資源緊缺的限制,也可避免血漿相關過敏反應。
一項隨機對照臨床研究納入了 44 例急進性腎小球腎炎患者(其中含 33 例 ANCA 相關性血管炎)并分為兩組,在甲潑尼龍和環磷酰胺治療的基礎上分別使用免疫吸附和血漿置換,結果顯示免疫吸附組患者 6 個月內脫離透析的比例較雙膜血漿置換組更高[12]。國內有報道免疫吸附與雙膜血漿置換在抗腎小球基底膜病中的比較,兩組清除抗腎小球基底膜抗體的效應相當,兩組患者預后亦無明顯差異[10]。另有報道提示蛋白 A 免疫吸附在清除抗人組織相容性抗原抗體方面效果優于血漿置換,后者在清除抗體方面特異性較低且存在凝血因子消耗的缺點[13]。
本例患者共行 7 次蛋白 A 免疫吸附治療,檢測結果提示單次治療可顯著降低 IgG 與 MPO 水平,治療間期(治療結束至下次治療前)有一定反彈;多次吸附治療后 MPO 穩定下降,在完成第 2 次蛋白 A 免疫吸附治療后,該患者未再行血液透析治療,肌酐下降且相對穩定,尿量正常,成功脫離透析,提示在激素聯合環磷酰胺方案基礎上聯合蛋白 A 免疫吸附治療對于該例急進性腎小球腎炎療效滿意。同時我們觀察到蛋白 A 免疫吸附治療期間患者纖維蛋白原水平較為穩定。既往研究顯示,單次蛋白 A 免疫吸附對 IgG 的選擇性清除明顯高于連續 3 次的血漿置換對 IgG 的清除效果,而后者引起的纖維蛋白原的下降明顯高于前者[14]。
該病例為我院首例蛋白 A 免疫吸附治療,該技術可有效清除 ANCA,而纖維蛋白原損耗不明顯,但同時伴隨總 IgG 的下降;治療過程中患者耐受性好,未發生不良事件,提示該技術安全性較高。本例患者經糖皮質激素聯合環磷酰胺沖擊治療及蛋白 A 免疫吸附治療后,腎功能部分恢復,成功脫離透析,臨床療效滿意。與我院常規開展的雙膜血漿置換治療 ANCA 相關急進性腎炎相比,采用蛋白 A 免疫吸附的治療費用基本相當;考慮到該耗材的可復用性、治療過程中不需要外源性血漿,可能更適用于臨床判斷需要多次血液凈化治療清除抗體的患者,以及有血漿過敏史的患者。在護理方面,治療過程中操作步驟較多,尤其應注意準確計時以及監測相關液體 pH 值,以保證治療安全有效進行。在今后的研究中可擴大樣本量以更好地評估該技術對于自身抗體介導的急進性腎小球腎炎的治療效果。
利益沖突:所有作者聲明不存在利益沖突。