該文報道了 1 例法洛四聯癥矯治術后重度肺動脈瓣反流的 16 歲患者,其右心室流出道至主肺動脈形態呈錐體型,極具挑戰性。入院后采用自膨脹式瓣膜,成功行經皮肺動脈瓣置換術,患者術后 2 年隨訪期間病情穩定。該病例旨在為錐體型右心室流出道患者行經皮肺動脈瓣置換術治療提供參考。
引用本文: 何芊蓓, 李怡堅, 趙振剛, 李僑, 李曉, 李翔, 馮沅. 自膨脹式瓣膜經皮肺動脈瓣置換術治療錐體型右心室流出道患者一例. 華西醫學, 2024, 39(9): 1383-1386. doi: 10.7507/1002-0179.202310034 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患者,女,16 歲,因“法洛四聯癥術后 16 年,活動后氣促 1 年”于 2021 年 6 月 14 日入四川大學華西醫院。入院前 16 年患者檢查發現法洛四聯癥(tetralogy of Fallot, TOF),于外院行 TOF 矯治術,采用跨瓣補片重建右心室流出道(right ventricular outflow tract, RVOT),術后定期復查,未訴不適。入院前 1 年患者間斷出現活動后氣促不適,行心肺運動試驗提示運動耐量下降,復查超聲心動圖提示肺動脈瓣重度反流,遂由四川大學華西醫院門診收入院。
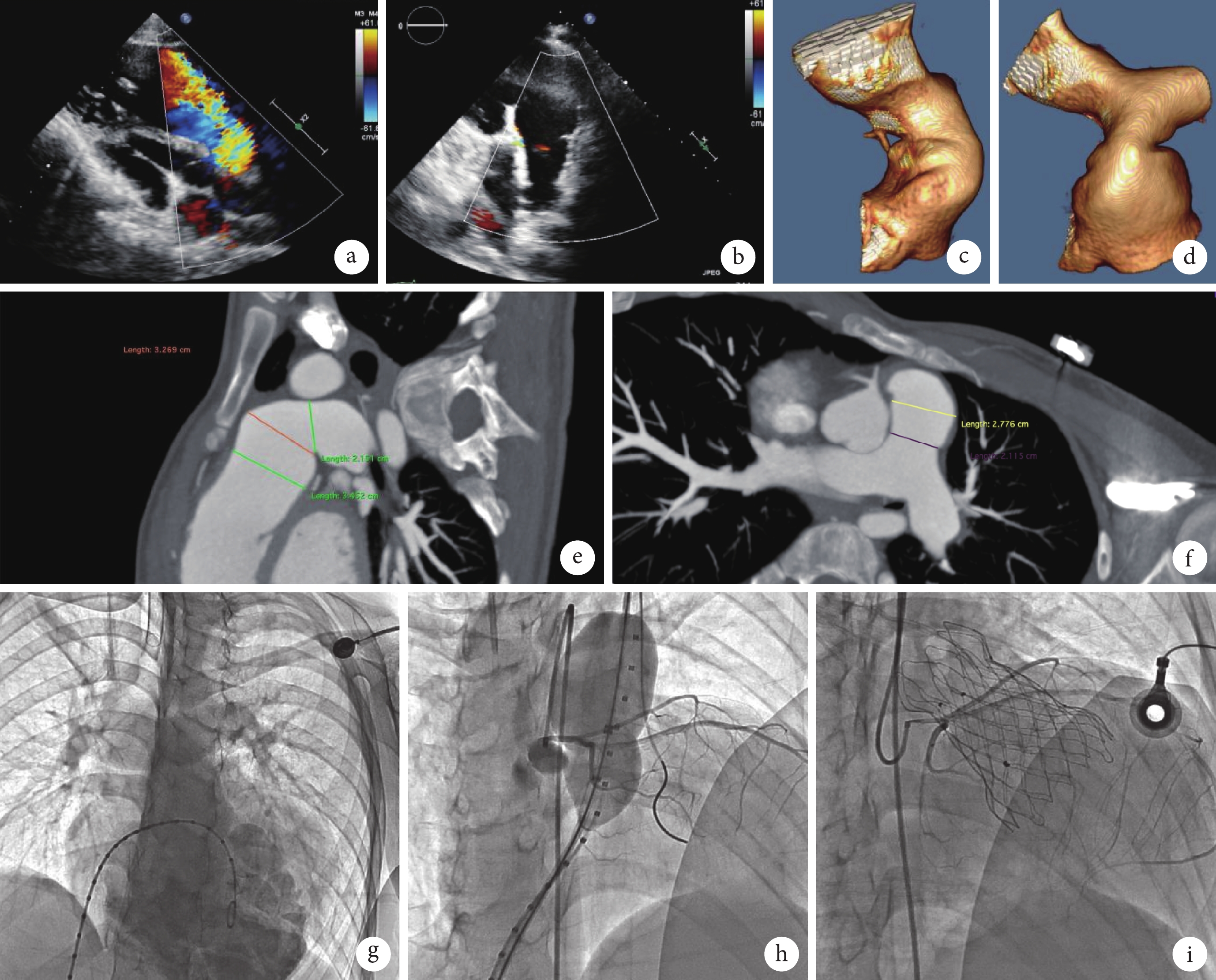
入院體格檢查:體溫 36.2℃,脈搏 70 次/min,呼吸頻率 20 次/min,血壓 110/66 mm Hg(1 mm Hg=0.133 kPa)。頸靜脈充盈,肝頸靜脈回流征陽性,心界擴大,心律齊,雙下肢輕度水腫。2020 年 8 月 15 日心臟 MRI 增強掃描顯示心臟增大,以右心室增大為著,右心室舒張末期容量指數為 190 mL/m2,右心室收縮末期容量指數為 95 mL/m2。2020 年 8 月 25 日心肺運動試驗顯示運動耐量下降;最大攝氧量 1.05 L/min,低于正常值 1.85 L/min(57%);無氧閾 0.63 L/min,占正常最大攝氧量的 34%。2021 年 1 月 19 日超聲心動圖顯示右心室明顯增大,RVOT 室上嵴位置呈瘤樣膨出,重度肺動脈反流,肺動脈主干(瓣環水平)前向血流峰值流速為 2.9 m/s,跨瓣壓差 35 mm Hg,大量反流,血流峰值流速為 2.7 m/s(圖1)。左心室收縮功能測量值正常,右心室收縮功能測量值減低。2021 年 1 月 19 日心電圖顯示:① 竇性心律;② 完全性右束支傳導阻滯;③ ST-T 改變,QRS 170 ms(表1)。2021 年 5 月 31 日血管成像 CT 增強掃描顯示先天性心臟病術后,未見確切左向右分流征;心臟增大明顯,以右心室增大為著;肺動脈瓣結構未見確切顯示,肺動脈干明顯增粗;降主動脈纖細。根據 Schievano 等[1]對 TOF 術后的 RVOT 解剖形態改變的研究,該患者 RVOT 至主肺動脈形態呈錐體型(Type Ⅰ),主肺動脈近心端 33 mm,遠心端 26 mm(圖1)。
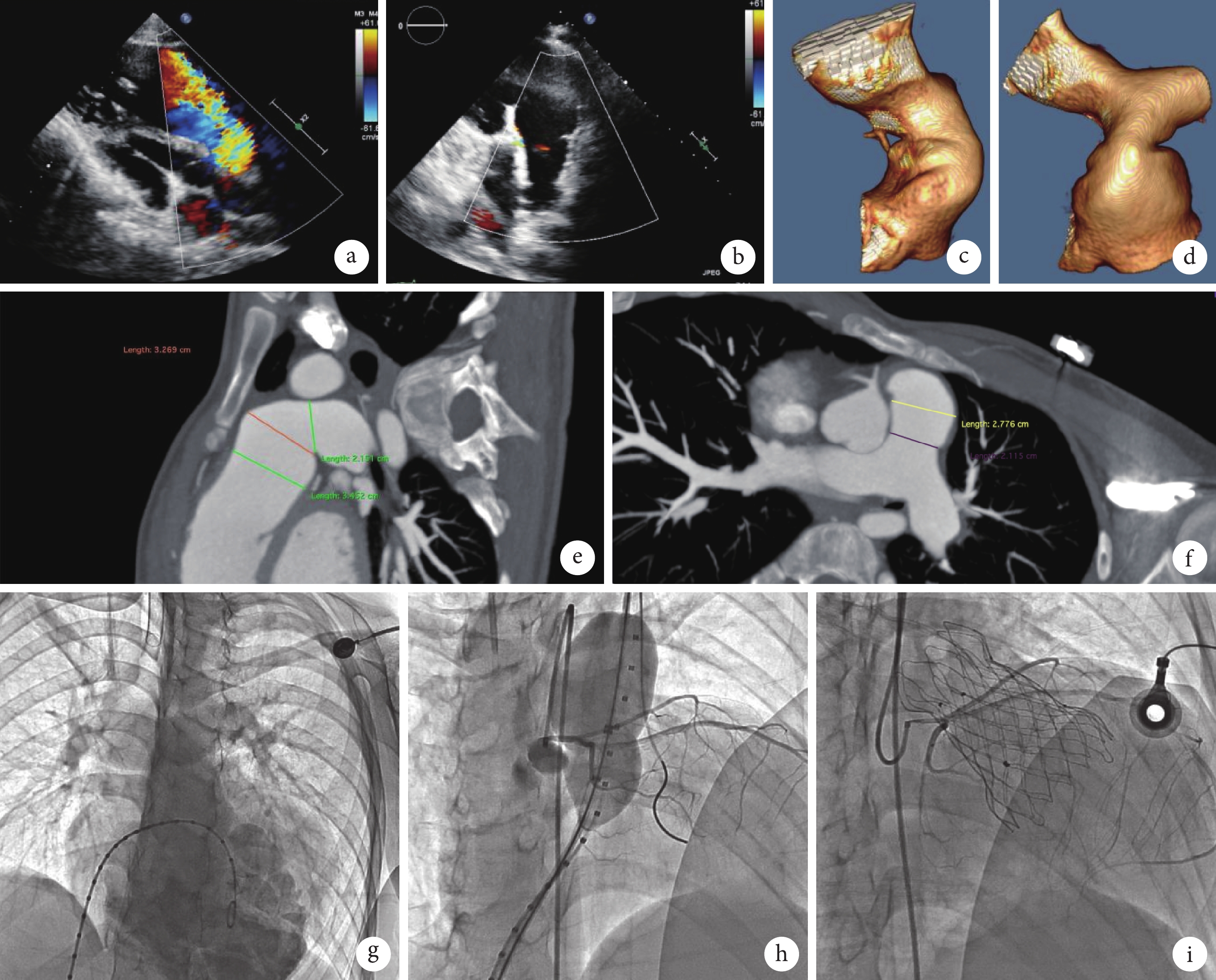 圖1
患者診療相關圖像
圖1
患者診療相關圖像
a. 術前超聲心動圖顯示肺動脈大量反流;b. 術后超聲心動圖顯示瓣口微量反流;c. 矢狀位肺動脈三維重建 CT 圖像;d. 冠狀位肺動脈三維重建 CT 圖像;e. 矢狀位血管增強 CT 顯示右肺動脈寬度 21.51 mm,近心端 34.52 mm,遠心端 32.69 mm;f. 冠狀位血管增強 CT 顯示近心端 27.76 mm,遠心端 21.15 mm;g. 術中造影顯示肺動脈重度反流;h. 術中球囊擴張時冠狀動脈造影;i. 瓣膜釋放完成后冠狀動脈造影
入院后心臟內外科團隊就患者病情進行討論,患者存在重度肺動脈瓣反流及心力衰竭相關臨床表現,肺動脈瓣干預指征明確,其解剖形態呈錐體型,選擇行經皮肺動脈瓣置換術(percutaneous pulmonary valve replacement, PPVR)極具挑戰性,但創傷小、住院時間短,可減少患者全生命期開胸手術次數,綜合考慮更適合使用自膨脹式肺動脈瓣膜。
2021 年 6 月 17 日進行介入治療,具體過程:穿刺左側股動脈及雙側股靜脈建立通道,以右股靜脈為主入路。完成心導管檢查,結果顯示肺動脈與右心室無明顯壓力階差,無 RVOT 梗阻。左股靜脈輔助入路金標豬尾導管為標尺,分別于肺動脈及右心室造影,并使用順應性球囊完成球囊直徑測試及冠狀動脈壓迫評估。根據術前 CT、術中造影及球囊直徑三者測量的綜合數據(主肺動脈近端平均徑 33 mm,遠端平均徑 26 mm),最終確定瓣膜型號為:32 mm×30 mm Venus P-Valve(杭州啟明醫療器械股份有限公司)。經右股靜脈導入 22F 外鞘管,Lunderquist 超硬鋼絲建立右肺動脈-右股靜脈軌道,緩慢釋放瓣膜,利用左右肺動脈分叉下的相對徑線較小的主肺動脈錨定瓣架,植入后的瓣架形態亦呈錐體型,瓣架遠心端為錨定區,近心端懸吊。術中造影及超聲檢查提示肺動脈無明顯反流及梗阻,瓣口微量反流(圖1),結束手術。患者術后 2 年隨訪期間病情穩定(表1),活動耐量恢復正常,未發生支架斷裂、瓣膜移位、人工瓣膜瓣周漏、感染性心內膜炎等并發癥,多次復查超聲心動圖提示人工肺動脈瓣功能正常,氨基末端腦鈉肽前體水平在正常范圍內。
討論 TOF 患者常在嬰幼兒或兒童早期施行外科矯治術,常采用跨瓣/非跨瓣補片技術,或者帶瓣/無瓣膜人工管道技術以重建 RVOT。TOF 患者行矯治術后常殘余不同程度肺動脈瓣反流和/或梗阻,導致心肌重構和心功能進行性受損。若不及時干預,右心室容量負荷顯著增加將影響患者生活質量及生存期。傳統的外科肺動脈瓣置換術(surgical pulmonary valve replacement, SPVR)創傷大、風險高、住院時間長。自 2000 年 Bonhoeffer 等[2]完成了首例 PPVR 的人體植入后,肺動脈瓣置換進入介入治療時代。德國慕尼黑心臟中心開展了一項納入 452 例行肺動脈瓣置換患者的前瞻性、單中心臨床研究,經過 12 年的隨訪,發現在免受二次外科手術換瓣的情況下,PPVR 植入 Melody 瓣膜(球囊膨脹式肺動脈瓣)組和 SPVR 組的 10 年生存率無明顯差異(兩組均為 87%,P=0.54);在首次植入肺動脈瓣的患者中,兩組的 10 年生存率也無明顯差異(80% vs. 73%,P=0.35)[3]。一項納入 18 項研究的 Meta 分析對
PPVR 術前影像學檢查的核心是評估 RVOT-主肺動脈的解剖結構。超聲心動圖可評估心臟整體形態及功能,獲取肺動脈瓣血流速度及平均跨瓣壓差等重要指標。術前進行先天性心臟病血管成像增強 CT 并測量 RVOT、肺動脈瓣環、主肺動脈及其左右分支的徑線,可幫助確定合適的瓣膜型號及錨定區。瓣膜型號過大可能導致支架斷裂或冠狀動脈壓迫,瓣膜型號過小可導致瓣膜移位或嚴重瓣周漏。TOF 患者矯治術后 RVOT 的形態變異極大,Schievano 等[1]將其大致分為五大類型,本例患者屬于較常見的錐體型。該患者有明確的肺動脈瓣干預指征,術前超聲心動圖提示肺動脈瓣重度反流,肺動脈干明顯增粗,不適合使用直徑較小的球囊膨脹式肺動脈瓣,因此選擇自膨脹式 Venus P-Valve 瓣膜,該患者近端寬、遠端窄的錐體型結構使瓣膜移位的風險升高,為手術帶來挑戰。筆者所在醫療中心曾經成功完成 4 例錐體型解剖的肺動脈瓣置換,已積累了對這類患者行 PPVR 的一定臨床經驗。在手術策略上,利用肺動脈分叉下方相對徑線較小的主肺動脈錨定瓣架,植入后的瓣架形態亦呈錐體型,瓣架遠心端作為錨定區,近心端懸吊,最終瓣膜固定穩妥,介入治療效果滿意。
綜上,PPVR 是解剖結構合適患者的首選治療手段,雖然本例患者錐體型的 RVOT 為瓣膜植入增加了難度,且存在瓣膜移位的風險,但術前進行詳細的影像分析并選擇合適的瓣膜型號,PPVR 依然具有可行性。隨著 PPVR 臨床應用經驗不斷積累,瓣膜器械不斷研發改進,PPVR 有望應用于更多解剖形態的肺動脈瓣反流患者。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,女,16 歲,因“法洛四聯癥術后 16 年,活動后氣促 1 年”于 2021 年 6 月 14 日入四川大學華西醫院。入院前 16 年患者檢查發現法洛四聯癥(tetralogy of Fallot, TOF),于外院行 TOF 矯治術,采用跨瓣補片重建右心室流出道(right ventricular outflow tract, RVOT),術后定期復查,未訴不適。入院前 1 年患者間斷出現活動后氣促不適,行心肺運動試驗提示運動耐量下降,復查超聲心動圖提示肺動脈瓣重度反流,遂由四川大學華西醫院門診收入院。
入院體格檢查:體溫 36.2℃,脈搏 70 次/min,呼吸頻率 20 次/min,血壓 110/66 mm Hg(1 mm Hg=0.133 kPa)。頸靜脈充盈,肝頸靜脈回流征陽性,心界擴大,心律齊,雙下肢輕度水腫。2020 年 8 月 15 日心臟 MRI 增強掃描顯示心臟增大,以右心室增大為著,右心室舒張末期容量指數為 190 mL/m2,右心室收縮末期容量指數為 95 mL/m2。2020 年 8 月 25 日心肺運動試驗顯示運動耐量下降;最大攝氧量 1.05 L/min,低于正常值 1.85 L/min(57%);無氧閾 0.63 L/min,占正常最大攝氧量的 34%。2021 年 1 月 19 日超聲心動圖顯示右心室明顯增大,RVOT 室上嵴位置呈瘤樣膨出,重度肺動脈反流,肺動脈主干(瓣環水平)前向血流峰值流速為 2.9 m/s,跨瓣壓差 35 mm Hg,大量反流,血流峰值流速為 2.7 m/s(圖1)。左心室收縮功能測量值正常,右心室收縮功能測量值減低。2021 年 1 月 19 日心電圖顯示:① 竇性心律;② 完全性右束支傳導阻滯;③ ST-T 改變,QRS 170 ms(表1)。2021 年 5 月 31 日血管成像 CT 增強掃描顯示先天性心臟病術后,未見確切左向右分流征;心臟增大明顯,以右心室增大為著;肺動脈瓣結構未見確切顯示,肺動脈干明顯增粗;降主動脈纖細。根據 Schievano 等[1]對 TOF 術后的 RVOT 解剖形態改變的研究,該患者 RVOT 至主肺動脈形態呈錐體型(Type Ⅰ),主肺動脈近心端 33 mm,遠心端 26 mm(圖1)。
 圖1
患者診療相關圖像
圖1
患者診療相關圖像
a. 術前超聲心動圖顯示肺動脈大量反流;b. 術后超聲心動圖顯示瓣口微量反流;c. 矢狀位肺動脈三維重建 CT 圖像;d. 冠狀位肺動脈三維重建 CT 圖像;e. 矢狀位血管增強 CT 顯示右肺動脈寬度 21.51 mm,近心端 34.52 mm,遠心端 32.69 mm;f. 冠狀位血管增強 CT 顯示近心端 27.76 mm,遠心端 21.15 mm;g. 術中造影顯示肺動脈重度反流;h. 術中球囊擴張時冠狀動脈造影;i. 瓣膜釋放完成后冠狀動脈造影
入院后心臟內外科團隊就患者病情進行討論,患者存在重度肺動脈瓣反流及心力衰竭相關臨床表現,肺動脈瓣干預指征明確,其解剖形態呈錐體型,選擇行經皮肺動脈瓣置換術(percutaneous pulmonary valve replacement, PPVR)極具挑戰性,但創傷小、住院時間短,可減少患者全生命期開胸手術次數,綜合考慮更適合使用自膨脹式肺動脈瓣膜。
2021 年 6 月 17 日進行介入治療,具體過程:穿刺左側股動脈及雙側股靜脈建立通道,以右股靜脈為主入路。完成心導管檢查,結果顯示肺動脈與右心室無明顯壓力階差,無 RVOT 梗阻。左股靜脈輔助入路金標豬尾導管為標尺,分別于肺動脈及右心室造影,并使用順應性球囊完成球囊直徑測試及冠狀動脈壓迫評估。根據術前 CT、術中造影及球囊直徑三者測量的綜合數據(主肺動脈近端平均徑 33 mm,遠端平均徑 26 mm),最終確定瓣膜型號為:32 mm×30 mm Venus P-Valve(杭州啟明醫療器械股份有限公司)。經右股靜脈導入 22F 外鞘管,Lunderquist 超硬鋼絲建立右肺動脈-右股靜脈軌道,緩慢釋放瓣膜,利用左右肺動脈分叉下的相對徑線較小的主肺動脈錨定瓣架,植入后的瓣架形態亦呈錐體型,瓣架遠心端為錨定區,近心端懸吊。術中造影及超聲檢查提示肺動脈無明顯反流及梗阻,瓣口微量反流(圖1),結束手術。患者術后 2 年隨訪期間病情穩定(表1),活動耐量恢復正常,未發生支架斷裂、瓣膜移位、人工瓣膜瓣周漏、感染性心內膜炎等并發癥,多次復查超聲心動圖提示人工肺動脈瓣功能正常,氨基末端腦鈉肽前體水平在正常范圍內。
討論 TOF 患者常在嬰幼兒或兒童早期施行外科矯治術,常采用跨瓣/非跨瓣補片技術,或者帶瓣/無瓣膜人工管道技術以重建 RVOT。TOF 患者行矯治術后常殘余不同程度肺動脈瓣反流和/或梗阻,導致心肌重構和心功能進行性受損。若不及時干預,右心室容量負荷顯著增加將影響患者生活質量及生存期。傳統的外科肺動脈瓣置換術(surgical pulmonary valve replacement, SPVR)創傷大、風險高、住院時間長。自 2000 年 Bonhoeffer 等[2]完成了首例 PPVR 的人體植入后,肺動脈瓣置換進入介入治療時代。德國慕尼黑心臟中心開展了一項納入 452 例行肺動脈瓣置換患者的前瞻性、單中心臨床研究,經過 12 年的隨訪,發現在免受二次外科手術換瓣的情況下,PPVR 植入 Melody 瓣膜(球囊膨脹式肺動脈瓣)組和 SPVR 組的 10 年生存率無明顯差異(兩組均為 87%,P=0.54);在首次植入肺動脈瓣的患者中,兩組的 10 年生存率也無明顯差異(80% vs. 73%,P=0.35)[3]。一項納入 18 項研究的 Meta 分析對
PPVR 術前影像學檢查的核心是評估 RVOT-主肺動脈的解剖結構。超聲心動圖可評估心臟整體形態及功能,獲取肺動脈瓣血流速度及平均跨瓣壓差等重要指標。術前進行先天性心臟病血管成像增強 CT 并測量 RVOT、肺動脈瓣環、主肺動脈及其左右分支的徑線,可幫助確定合適的瓣膜型號及錨定區。瓣膜型號過大可能導致支架斷裂或冠狀動脈壓迫,瓣膜型號過小可導致瓣膜移位或嚴重瓣周漏。TOF 患者矯治術后 RVOT 的形態變異極大,Schievano 等[1]將其大致分為五大類型,本例患者屬于較常見的錐體型。該患者有明確的肺動脈瓣干預指征,術前超聲心動圖提示肺動脈瓣重度反流,肺動脈干明顯增粗,不適合使用直徑較小的球囊膨脹式肺動脈瓣,因此選擇自膨脹式 Venus P-Valve 瓣膜,該患者近端寬、遠端窄的錐體型結構使瓣膜移位的風險升高,為手術帶來挑戰。筆者所在醫療中心曾經成功完成 4 例錐體型解剖的肺動脈瓣置換,已積累了對這類患者行 PPVR 的一定臨床經驗。在手術策略上,利用肺動脈分叉下方相對徑線較小的主肺動脈錨定瓣架,植入后的瓣架形態亦呈錐體型,瓣架遠心端作為錨定區,近心端懸吊,最終瓣膜固定穩妥,介入治療效果滿意。
綜上,PPVR 是解剖結構合適患者的首選治療手段,雖然本例患者錐體型的 RVOT 為瓣膜植入增加了難度,且存在瓣膜移位的風險,但術前進行詳細的影像分析并選擇合適的瓣膜型號,PPVR 依然具有可行性。隨著 PPVR 臨床應用經驗不斷積累,瓣膜器械不斷研發改進,PPVR 有望應用于更多解剖形態的肺動脈瓣反流患者。
利益沖突:所有作者聲明不存在利益沖突。