四葉式主動脈瓣(quadricuspid aortic valve, QAV)作為一種罕見的先天性心臟病,其遠期病變類型多以反流為主。經導管主動脈瓣置換術(transcatheter aortic valve replacement, TAVR)在這類患者中的應用極為少見。該文報道了一例 QAV 合并嚴重反流且存在瓣下小隔膜的高齡患者,通過術前評估及心臟團隊的討論指導,選擇較高過膨脹率(oversize 率)的可回收瓣膜,順利完成了 TAVR 手術,并通過調整瓣膜植入深度一站式覆蓋了瓣下隔膜,術后患者心悸等癥狀明顯改善,未見明顯瓣周漏以及反流,為該類患者的 TAVR 手術方案提供了參考。
引用本文: 陳智成, 李怡堅, 馮沅, 趙振剛, 魏薪. 經導管主動脈瓣置換術治療四葉式主動脈瓣一例. 華西醫學, 2024, 39(9): 1379-1382. doi: 10.7507/1002-0179.202408151 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患者,女,77 歲,因“心悸 3 年余”于 2023 年 12 月 9 日入四川大學華西醫院。入院前 3 年余患者輕微體力活動后心前區出現心悸,每次持續約 1 h,每周發作 3~4 次,休息后可緩解,勞累后癥狀加重,伴有明顯頭暈,無胸悶、氣緊、胸痛,無暈厥、黑矇、心律不齊,無咳嗽、咳痰,無腹痛等不適。于外院就診完善心臟彩色多普勒超聲(彩超)提示主動脈瓣關閉不全,給予對癥處理后癥狀緩解(具體藥物及治療經過不詳)。病程中上述癥狀反復發作,且患者多次于外院行藥物保守治療效果欠佳,為求進一步治療入院。患者家族史、既往史無特殊。
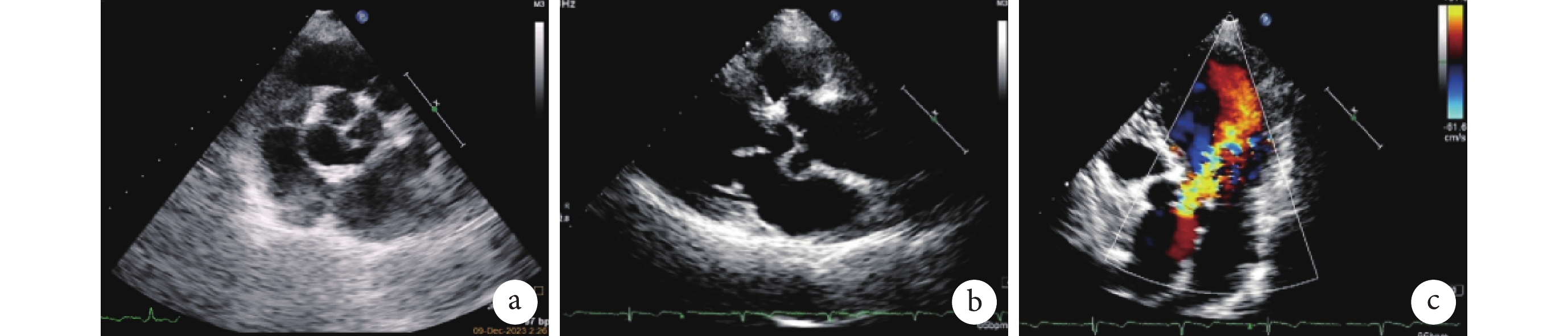
入院體格檢查:體溫 36.6°C,心率 73 次/min,呼吸頻率 20 次/min,血壓 123/56 mm Hg(1 mm Hg=0.133 kPa)。心界向左擴大,心律齊,主動脈瓣第二聽診區可聞及舒張期雜音。肝脾肋下未觸及,雙下肢無水腫。2023 年 12 月 9 日輔助檢查顯示氨基末端腦鈉肽前體 167 ng/L。心臟彩超顯示左心室舒張末期內徑 57 mm,左心室收縮末期內徑 35 mm,升主動脈內徑 40 mm,射血分數 68%;主動脈瓣呈四葉式開閉,瓣下見一長約 4 mm 的短小隔膜樣回聲,前向血流稍加快,血流峰值流速為 2.2 m/s,瓣下大量反流,縮流頸寬度為 6.7 mm(圖1)。診斷為四葉式主動脈瓣(quadricuspid aortic valve, QAV)畸形、重度主動脈瓣反流(aortic regurgitation, AR)、主動脈瓣下短小隔膜(紐約心臟協會心功能分級Ⅱ級)。
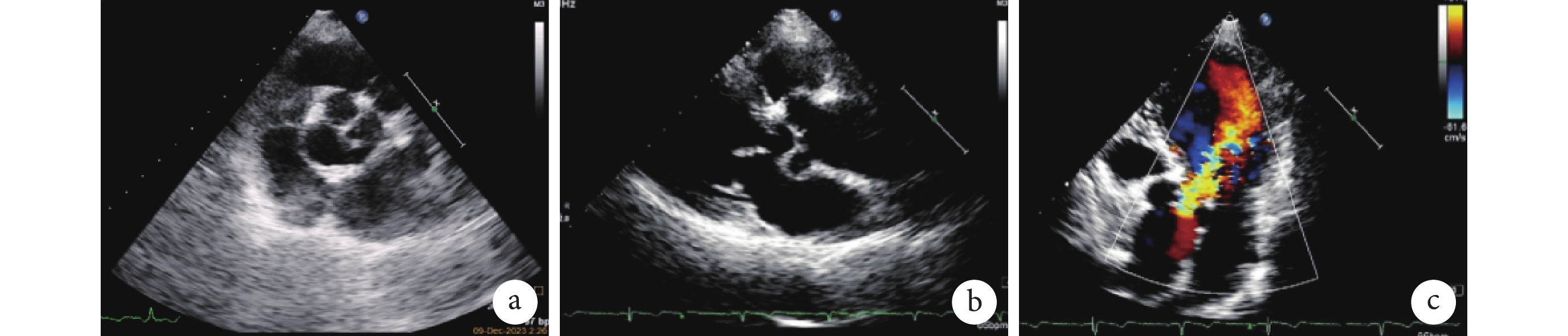 圖1
患者術前心臟彩色多普勒超聲圖像
圖1
患者術前心臟彩色多普勒超聲圖像
a. 四葉式主動脈瓣畸形;b. 主動脈瓣下短小隔膜;c. 主動脈瓣大量反流
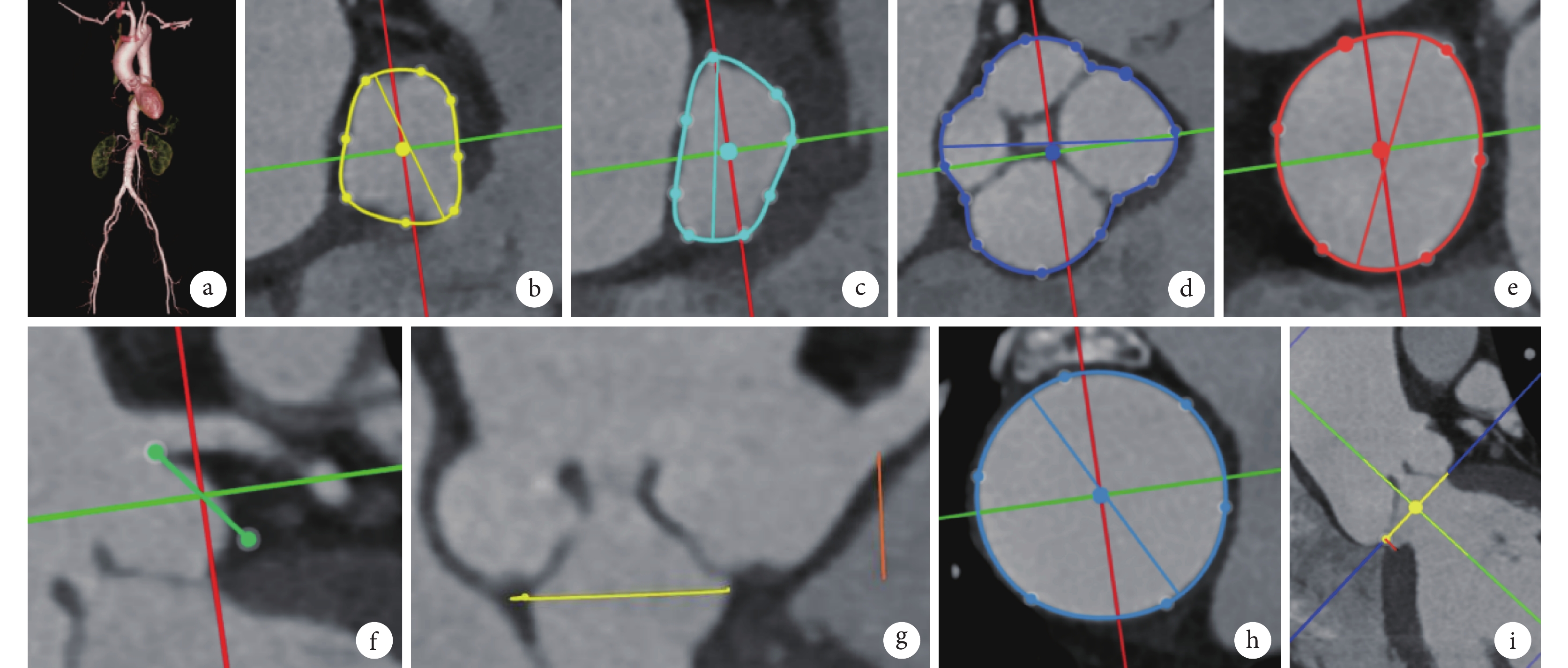
入院后評估顯示,患者美國胸外科醫師協會死亡風險預測評分為 4.213%,虛弱指數 Katz 評分中 5 項不能獨立完成,自理能力為重度依賴。瓣膜團隊在術前對患者進行了詳細的影像評估,心臟增強 CT 測量數據:呈 QAV Hurwitz C 型[1],瓣環周長 75.9 mm,平均內徑 26.8 mm,左心室流出道周長 70.6 mm,乏氏竇周長 121.4 mm,平均徑 33.8 mm,竇管交界周長 101.5 mm,左冠狀動脈高度 13.2 mm,右冠狀動脈高度 11.8 mm,升主動脈最大內徑 40.6 mm,主動脈瓣下小隔膜距離瓣環約 2 mm,鈣化積分為 0(圖2)。術前團隊討論認為患者體格較小,左心室收縮末期指數為 23.37 mm/m2,存在主動脈瓣替換指征,外科手術風險為中危,患者高齡,自理能力為重度依賴,臨床評估為虛弱。心臟增強 CT 提示解剖條件可以行經導管主動脈瓣置換術(transcatheter aortic valve replacement, TAVR),且術前測得瓣下隔膜距離瓣環位置近,可以使用瓣膜支架進行覆蓋。鑒于無鈣化 AR 患者通常瓣膜植入錨定區相對有限,需要選擇更大的過膨脹率(oversize 率)瓣膜,以獲取更大的徑向支撐力,避免瓣膜移位的發生,故選擇 30 mm 直徑、術前估算主動脈瓣環平面 oversize 率為 32%的 VitaFlow Liberty(上海微創心通醫療科技有限公司)可回收系統進行 TAVR 操作,入路為右股動脈。
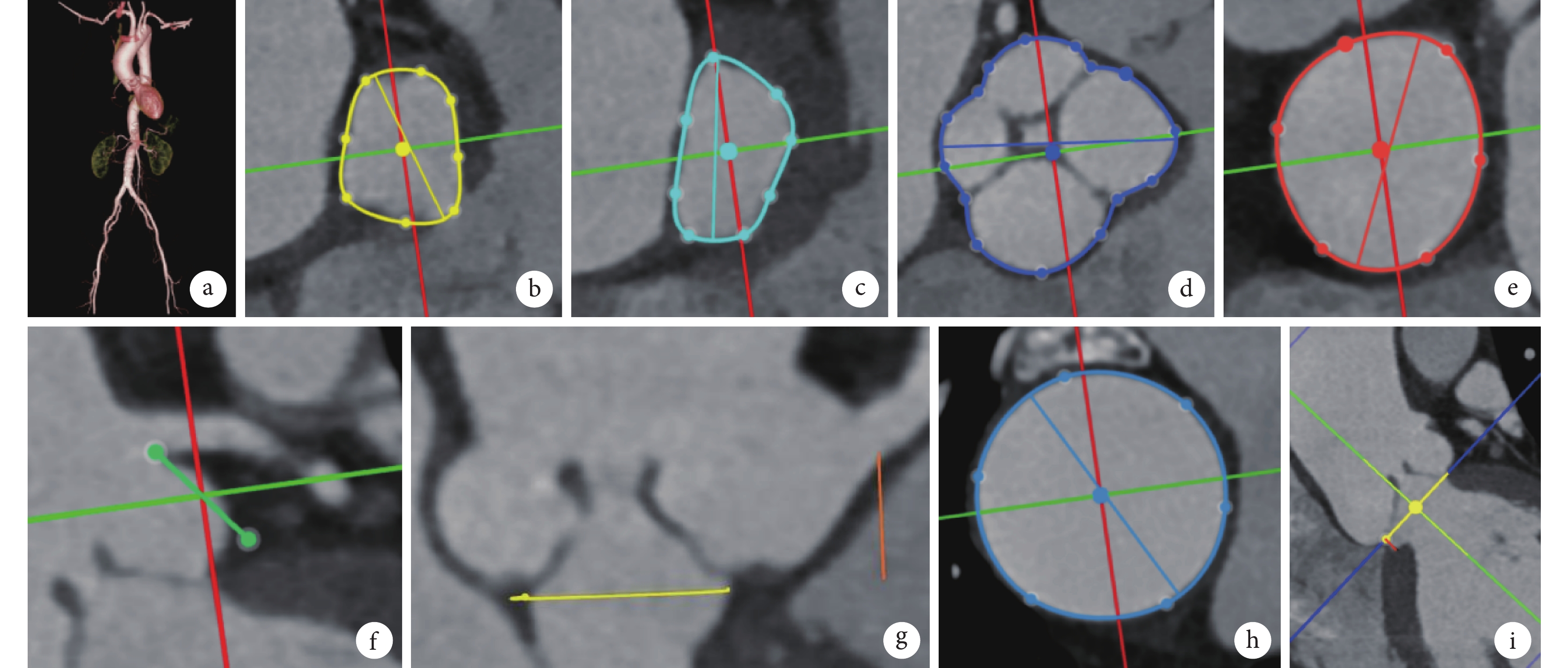 圖2
患者術前影像評估圖像
圖2
患者術前影像評估圖像
a. 外周血管重建圖像;b. 瓣環周長 75.9 mm,面積 427.9 mm2;c. 左心室流出道周長 70.6 mm;d. 四葉式主動脈瓣乏氏竇周長 121.4 mm;e. 竇管交界周長 101.5 mm;f. 左冠狀動脈高度 13.2 mm;g. 右冠狀動脈高度 11.8 mm;h. 升主動脈最大內徑 40.6 mm;i. 主動脈瓣下小隔膜距離瓣環約 2 mm
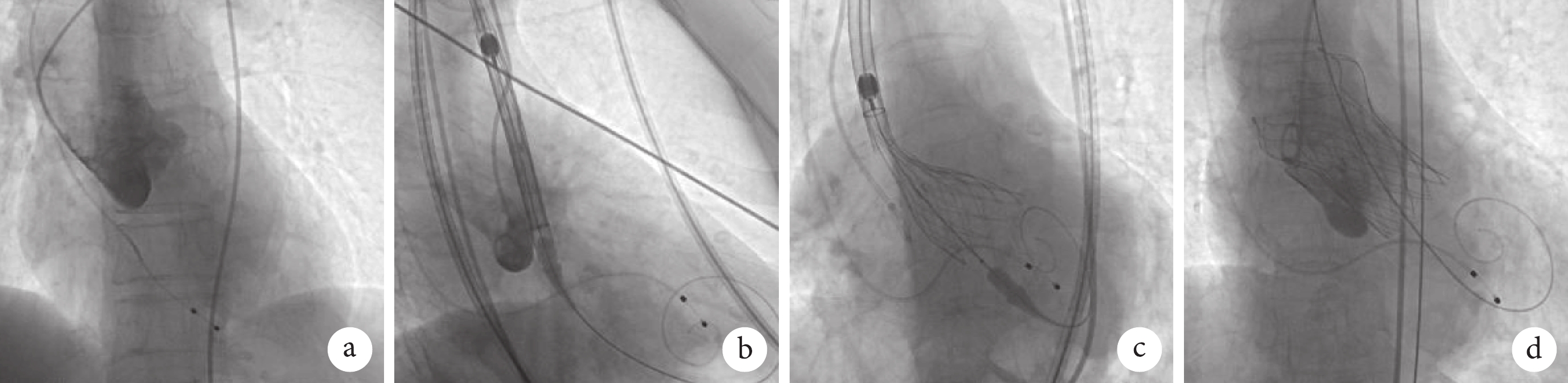
上述介入治療方案取得患者及其家屬的知情同意后,于 2023 年 12 月 12 日進行 TAVR,具體操作過程(圖3):患者常規行清醒鎮靜,頸內靜脈放置血管鞘安置臨時起搏電極。穿刺左側股動脈,置入動脈鞘管,全身肝素化。穿刺右側股動脈,置入鞘管并完成冠狀動脈造影提示左右冠狀動脈均無明顯狹窄,導入豬尾導管,行左心導管評估及左心室造影,測得術前左心室內收縮壓為 144 mm Hg,舒張壓為 1 mm Hg;主動脈收縮壓為 141 mm Hg,舒張壓為 33 mm Hg。建立股動脈至左心室加硬鋼絲軌道,輸送系統裝載瓣膜后,確認瓣膜裝載方向正確。沿傳送軌道送入系統,以主動脈瓣瓣環定位并釋放瓣膜。術后即刻造影提示微量瓣周漏,術后即刻超聲提示人工瓣膜植入效果良好,血流峰值流速為 1.2 m/s,平均跨瓣壓差為 2.0 mmHg。撤出導絲,拔出雙側股動脈鞘,結束手術。術后測得瓣膜植入深度約為 5 mm。術后當天患者心電監護顯示間歇性Ⅲ度房室傳導阻滯,故于 1 d 后安置永久起搏器。之后患者病情基本穩定,于 7 d 后康復出院。
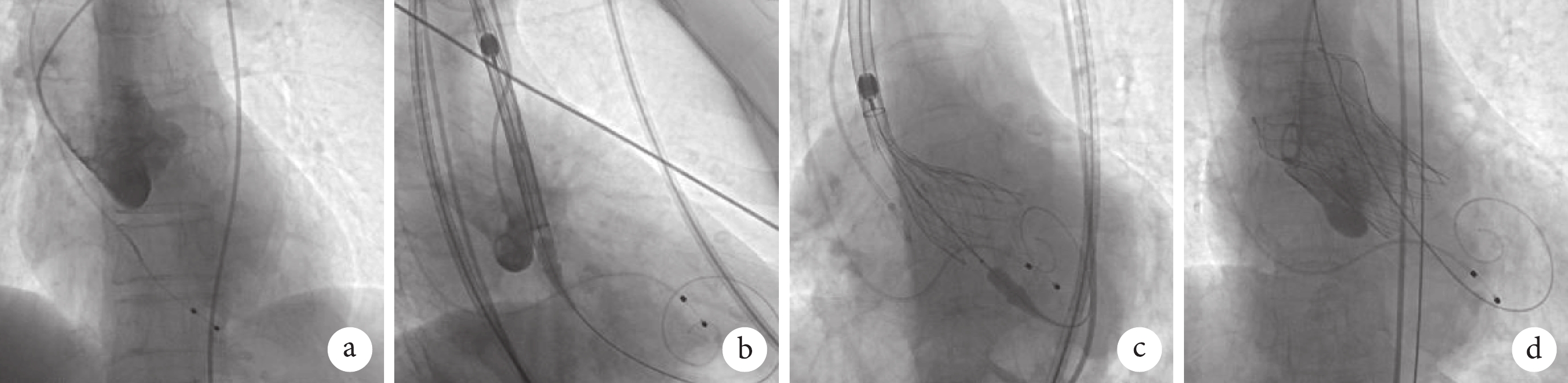 圖3
患者手術相關造影圖像
圖3
患者手術相關造影圖像
a. 主動脈造影可見大量反流;b. 以自身瓣環定位人工瓣膜釋放位置;c. 瓣膜釋放;d. 瓣膜植入后造影未見明顯反流
討論 QAV 為一種罕見的主動脈瓣先天性畸形,最早于 1862 年首次報道,在人群中的檢出率為 0.008%~0.043%[2-3]。QAV 的病因目前尚不明確,是否存在遺傳及相關基因缺陷目前尚無定論。組織胚胎學相關理論認為,QAV 為胚胎期瓣膜發育障礙所致,胚胎早期在瓣葉形成過程中由于動脈干的內膜隆起發育不良,造成瓣葉發育異常,其遠期生存預后與瓣膜的功能以及瓣葉形態和退化程度相關,即使患者出生時便存在這種畸形,也可能直到生命后期瓣膜才會發生功能障礙,從而引發相關癥狀[4]。因此,對于無癥狀患者的監測尤為重要,Tsang 等[5]對所在醫療中心 1975 年-2014 年診斷為 QAV 的 50 例患者進行平均(4.8±5.6)年的隨訪,其中有 8 例患者接受了手術治療,其中有 7 例患者因嚴重 AR 進行手術,1 例患者為中度反流,因合并有瓣膜尖部阻擋左冠狀動脈開口而進行瓣膜修復;其遠期血流動力學障礙以單純性 AR 最為常見,極少為主動脈瓣狹窄(aortic stenosis, AS)。18%~32%的 QAV 患者合并其他先天性心臟畸形,包括冠狀動脈異常、肺動脈狹窄、室間隔缺損、房間隔缺損、肥厚型心肌病以及法洛四聯癥等[6-8]。超聲心動圖是 QAV 的主要診斷手段[9]。當超聲心動圖無法準確識別具體解剖結構時,血管增強 CT 或 MRI 可進一步明確診斷。外科手術是 QAV 的有效治療手段,包括主動脈瓣修復及置換。Idrees 等[10]對所在醫療中心 1989 年-2010 年進行外科手術治療的 31 例 QAV 患者(其中反流性病變者 21 例,狹窄性病變者 5 例,反流合并有狹窄者 4 例)進行回顧性分析,7 例患者進行了瓣膜修復,23 例患者進行了瓣膜置換,手術成功率為 100%;后續隨訪顯示,修復組中僅 1 例患者術后再次出現了狹窄和反流,需要進行二次干預,置換組中也僅 1 例患者因術后出現感染性心內膜炎進行了二次手術,其余患者瓣膜功能均良好。有研究表明,QAV 的手術預后與其他主動脈瓣手術的預后相當[11-12]。
在過去的 20 年里,TAVR 已發展為一項成熟的微創手術方式,已經成為指南推薦的 AS 患者的主流治療方案之一[13-14]。近年來,TAVR 越來越多地應用于單純 AR 患者中。自 Blanke 等[15]第 1 次成功在 QAV 患者中進行 TAVR 手術后的 10 余年,目前 TAVR 應用于 QAV 的病例僅有少量報道[16-18]。本病例中,考慮到 QAV 可能存在潛在的解剖變異,術前針對主動脈根部尤其是瓣環以及乏氏竇平面進行了多角度、更為精細的評估,以保證滿足瓣膜釋放的解剖學條件。本病例為單純性 AR,相比 AS 患者,AR 患者的錨定結構少,植入瓣膜時更易導致術中或術后人工瓣膜移位、瓣中瓣及術后瓣周漏等并發癥的發生,故結合患者術前 CT 測量值,選用了更大 oversize 率的瓣膜以獲得更大的徑向支持力。本病例術前心臟彩超提示有瓣膜下隔膜形成,此類病變介入處理困難。Lake 等[19]報道了 1 例術前誤診為 AS 的病例,其在擬行 TAVR 的圍手術期心臟彩超提示瓣下隔膜遮擋了左心室流出道,而實際該患者的主動脈瓣病變為中度反流,故而被認為不適合進行 TAVR。本病例術前心臟彩超提示僅為主動脈瓣下小隔膜形成,并未遮擋左心室流出道,未導致梗阻發生,且瓣下隔膜距離主動脈瓣環僅 2 mm,通過術中瓣膜支架植入時覆蓋流出道,從而消除瓣下隔膜的影響。對于本病例,考慮到術中瓣膜釋放的穩定性以及對瓣下隔膜的覆蓋,選擇了更大直徑的瓣膜,同時增加了瓣膜的植入深度,因此患者術后仍出現了Ⅲ度房室傳導阻滯。故于 1 d 后安置永久起搏器。之后患者病情基本穩定。
綜上,QAV 患者相對罕見,需要全生命周期管理,其主動脈瓣病變類型以反流為主,其治療策略目前仍然以外科手術為主。TAVR 在這類患者中的應用極其少見,目前仍屬于“超說明書使用”,且本病例合并有瓣下隔膜形成,介入治療難度極大。在本病例中,通過術前影像學評估及心臟團隊討論指導,選擇了合適的手術策略,并在取得患者及其家屬的知情同意后,開創性地使用人工瓣膜支架覆蓋瓣下隔膜并取得成功,最終使患者獲益。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,女,77 歲,因“心悸 3 年余”于 2023 年 12 月 9 日入四川大學華西醫院。入院前 3 年余患者輕微體力活動后心前區出現心悸,每次持續約 1 h,每周發作 3~4 次,休息后可緩解,勞累后癥狀加重,伴有明顯頭暈,無胸悶、氣緊、胸痛,無暈厥、黑矇、心律不齊,無咳嗽、咳痰,無腹痛等不適。于外院就診完善心臟彩色多普勒超聲(彩超)提示主動脈瓣關閉不全,給予對癥處理后癥狀緩解(具體藥物及治療經過不詳)。病程中上述癥狀反復發作,且患者多次于外院行藥物保守治療效果欠佳,為求進一步治療入院。患者家族史、既往史無特殊。
入院體格檢查:體溫 36.6°C,心率 73 次/min,呼吸頻率 20 次/min,血壓 123/56 mm Hg(1 mm Hg=0.133 kPa)。心界向左擴大,心律齊,主動脈瓣第二聽診區可聞及舒張期雜音。肝脾肋下未觸及,雙下肢無水腫。2023 年 12 月 9 日輔助檢查顯示氨基末端腦鈉肽前體 167 ng/L。心臟彩超顯示左心室舒張末期內徑 57 mm,左心室收縮末期內徑 35 mm,升主動脈內徑 40 mm,射血分數 68%;主動脈瓣呈四葉式開閉,瓣下見一長約 4 mm 的短小隔膜樣回聲,前向血流稍加快,血流峰值流速為 2.2 m/s,瓣下大量反流,縮流頸寬度為 6.7 mm(圖1)。診斷為四葉式主動脈瓣(quadricuspid aortic valve, QAV)畸形、重度主動脈瓣反流(aortic regurgitation, AR)、主動脈瓣下短小隔膜(紐約心臟協會心功能分級Ⅱ級)。
 圖1
患者術前心臟彩色多普勒超聲圖像
圖1
患者術前心臟彩色多普勒超聲圖像
a. 四葉式主動脈瓣畸形;b. 主動脈瓣下短小隔膜;c. 主動脈瓣大量反流
入院后評估顯示,患者美國胸外科醫師協會死亡風險預測評分為 4.213%,虛弱指數 Katz 評分中 5 項不能獨立完成,自理能力為重度依賴。瓣膜團隊在術前對患者進行了詳細的影像評估,心臟增強 CT 測量數據:呈 QAV Hurwitz C 型[1],瓣環周長 75.9 mm,平均內徑 26.8 mm,左心室流出道周長 70.6 mm,乏氏竇周長 121.4 mm,平均徑 33.8 mm,竇管交界周長 101.5 mm,左冠狀動脈高度 13.2 mm,右冠狀動脈高度 11.8 mm,升主動脈最大內徑 40.6 mm,主動脈瓣下小隔膜距離瓣環約 2 mm,鈣化積分為 0(圖2)。術前團隊討論認為患者體格較小,左心室收縮末期指數為 23.37 mm/m2,存在主動脈瓣替換指征,外科手術風險為中危,患者高齡,自理能力為重度依賴,臨床評估為虛弱。心臟增強 CT 提示解剖條件可以行經導管主動脈瓣置換術(transcatheter aortic valve replacement, TAVR),且術前測得瓣下隔膜距離瓣環位置近,可以使用瓣膜支架進行覆蓋。鑒于無鈣化 AR 患者通常瓣膜植入錨定區相對有限,需要選擇更大的過膨脹率(oversize 率)瓣膜,以獲取更大的徑向支撐力,避免瓣膜移位的發生,故選擇 30 mm 直徑、術前估算主動脈瓣環平面 oversize 率為 32%的 VitaFlow Liberty(上海微創心通醫療科技有限公司)可回收系統進行 TAVR 操作,入路為右股動脈。
 圖2
患者術前影像評估圖像
圖2
患者術前影像評估圖像
a. 外周血管重建圖像;b. 瓣環周長 75.9 mm,面積 427.9 mm2;c. 左心室流出道周長 70.6 mm;d. 四葉式主動脈瓣乏氏竇周長 121.4 mm;e. 竇管交界周長 101.5 mm;f. 左冠狀動脈高度 13.2 mm;g. 右冠狀動脈高度 11.8 mm;h. 升主動脈最大內徑 40.6 mm;i. 主動脈瓣下小隔膜距離瓣環約 2 mm
上述介入治療方案取得患者及其家屬的知情同意后,于 2023 年 12 月 12 日進行 TAVR,具體操作過程(圖3):患者常規行清醒鎮靜,頸內靜脈放置血管鞘安置臨時起搏電極。穿刺左側股動脈,置入動脈鞘管,全身肝素化。穿刺右側股動脈,置入鞘管并完成冠狀動脈造影提示左右冠狀動脈均無明顯狹窄,導入豬尾導管,行左心導管評估及左心室造影,測得術前左心室內收縮壓為 144 mm Hg,舒張壓為 1 mm Hg;主動脈收縮壓為 141 mm Hg,舒張壓為 33 mm Hg。建立股動脈至左心室加硬鋼絲軌道,輸送系統裝載瓣膜后,確認瓣膜裝載方向正確。沿傳送軌道送入系統,以主動脈瓣瓣環定位并釋放瓣膜。術后即刻造影提示微量瓣周漏,術后即刻超聲提示人工瓣膜植入效果良好,血流峰值流速為 1.2 m/s,平均跨瓣壓差為 2.0 mmHg。撤出導絲,拔出雙側股動脈鞘,結束手術。術后測得瓣膜植入深度約為 5 mm。術后當天患者心電監護顯示間歇性Ⅲ度房室傳導阻滯,故于 1 d 后安置永久起搏器。之后患者病情基本穩定,于 7 d 后康復出院。
 圖3
患者手術相關造影圖像
圖3
患者手術相關造影圖像
a. 主動脈造影可見大量反流;b. 以自身瓣環定位人工瓣膜釋放位置;c. 瓣膜釋放;d. 瓣膜植入后造影未見明顯反流
討論 QAV 為一種罕見的主動脈瓣先天性畸形,最早于 1862 年首次報道,在人群中的檢出率為 0.008%~0.043%[2-3]。QAV 的病因目前尚不明確,是否存在遺傳及相關基因缺陷目前尚無定論。組織胚胎學相關理論認為,QAV 為胚胎期瓣膜發育障礙所致,胚胎早期在瓣葉形成過程中由于動脈干的內膜隆起發育不良,造成瓣葉發育異常,其遠期生存預后與瓣膜的功能以及瓣葉形態和退化程度相關,即使患者出生時便存在這種畸形,也可能直到生命后期瓣膜才會發生功能障礙,從而引發相關癥狀[4]。因此,對于無癥狀患者的監測尤為重要,Tsang 等[5]對所在醫療中心 1975 年-2014 年診斷為 QAV 的 50 例患者進行平均(4.8±5.6)年的隨訪,其中有 8 例患者接受了手術治療,其中有 7 例患者因嚴重 AR 進行手術,1 例患者為中度反流,因合并有瓣膜尖部阻擋左冠狀動脈開口而進行瓣膜修復;其遠期血流動力學障礙以單純性 AR 最為常見,極少為主動脈瓣狹窄(aortic stenosis, AS)。18%~32%的 QAV 患者合并其他先天性心臟畸形,包括冠狀動脈異常、肺動脈狹窄、室間隔缺損、房間隔缺損、肥厚型心肌病以及法洛四聯癥等[6-8]。超聲心動圖是 QAV 的主要診斷手段[9]。當超聲心動圖無法準確識別具體解剖結構時,血管增強 CT 或 MRI 可進一步明確診斷。外科手術是 QAV 的有效治療手段,包括主動脈瓣修復及置換。Idrees 等[10]對所在醫療中心 1989 年-2010 年進行外科手術治療的 31 例 QAV 患者(其中反流性病變者 21 例,狹窄性病變者 5 例,反流合并有狹窄者 4 例)進行回顧性分析,7 例患者進行了瓣膜修復,23 例患者進行了瓣膜置換,手術成功率為 100%;后續隨訪顯示,修復組中僅 1 例患者術后再次出現了狹窄和反流,需要進行二次干預,置換組中也僅 1 例患者因術后出現感染性心內膜炎進行了二次手術,其余患者瓣膜功能均良好。有研究表明,QAV 的手術預后與其他主動脈瓣手術的預后相當[11-12]。
在過去的 20 年里,TAVR 已發展為一項成熟的微創手術方式,已經成為指南推薦的 AS 患者的主流治療方案之一[13-14]。近年來,TAVR 越來越多地應用于單純 AR 患者中。自 Blanke 等[15]第 1 次成功在 QAV 患者中進行 TAVR 手術后的 10 余年,目前 TAVR 應用于 QAV 的病例僅有少量報道[16-18]。本病例中,考慮到 QAV 可能存在潛在的解剖變異,術前針對主動脈根部尤其是瓣環以及乏氏竇平面進行了多角度、更為精細的評估,以保證滿足瓣膜釋放的解剖學條件。本病例為單純性 AR,相比 AS 患者,AR 患者的錨定結構少,植入瓣膜時更易導致術中或術后人工瓣膜移位、瓣中瓣及術后瓣周漏等并發癥的發生,故結合患者術前 CT 測量值,選用了更大 oversize 率的瓣膜以獲得更大的徑向支持力。本病例術前心臟彩超提示有瓣膜下隔膜形成,此類病變介入處理困難。Lake 等[19]報道了 1 例術前誤診為 AS 的病例,其在擬行 TAVR 的圍手術期心臟彩超提示瓣下隔膜遮擋了左心室流出道,而實際該患者的主動脈瓣病變為中度反流,故而被認為不適合進行 TAVR。本病例術前心臟彩超提示僅為主動脈瓣下小隔膜形成,并未遮擋左心室流出道,未導致梗阻發生,且瓣下隔膜距離主動脈瓣環僅 2 mm,通過術中瓣膜支架植入時覆蓋流出道,從而消除瓣下隔膜的影響。對于本病例,考慮到術中瓣膜釋放的穩定性以及對瓣下隔膜的覆蓋,選擇了更大直徑的瓣膜,同時增加了瓣膜的植入深度,因此患者術后仍出現了Ⅲ度房室傳導阻滯。故于 1 d 后安置永久起搏器。之后患者病情基本穩定。
綜上,QAV 患者相對罕見,需要全生命周期管理,其主動脈瓣病變類型以反流為主,其治療策略目前仍然以外科手術為主。TAVR 在這類患者中的應用極其少見,目前仍屬于“超說明書使用”,且本病例合并有瓣下隔膜形成,介入治療難度極大。在本病例中,通過術前影像學評估及心臟團隊討論指導,選擇了合適的手術策略,并在取得患者及其家屬的知情同意后,開創性地使用人工瓣膜支架覆蓋瓣下隔膜并取得成功,最終使患者獲益。
利益沖突:所有作者聲明不存在利益沖突。