引用本文: 羅珊, 劉義琴, 康婷, 吳蔚樺, 李艷, 歐三桃. 鐵調素-鐵輸出蛋白信號通路在腺嘌呤誘導慢性腎臟病大鼠模型中的表達及意義. 華西醫學, 2024, 39(7): 1102-1109. doi: 10.7507/1002-0179.202310075 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
慢性腎臟病(chronic kidney disease, CKD)被認為是一個世界重大公共衛生問題,影響全球約 10%的人口[1]。腎臟纖維化是 CKD 的主要病理表現,其嚴重程度與疾病預后密切相關[2]。鐵死亡作為一種新型細胞死亡方式,參與了單側輸尿管梗阻、腎切除術誘導 CKD、腎積水等腎臟疾病動物模型的病變[3-5]。本研究小組前期研究也發現,在 CKD 腎纖維化大鼠模型中存在鐵死亡相關指標的變化[6],但具體分子機制尚不清楚。人體內鐵穩態的調節主要依賴鐵調素(hepcidin)-鐵輸出蛋白(ferroportin, FPN)軸信號通路。有研究發現 hepcidin 基因(HAMP)過量表達會導致全身鐵缺乏、紅細胞生成減少,與神經系統腫瘤、腎性貧血等疾病的進展密切相關[7-8],但 HAMP-FPN 信號通路與腎纖維化的關系尚不清楚。此外,核因子 κB(nuclear factor kappa-B, NF-κB)信號通路為經典促炎通路,在腎纖維化發病機制中扮演重要角色,研究發現在肺肝纖維化、炎性貧血的動物模型中,NF-κB 通路與 hepcidin 之間具有相互作用[9-10],但在 CKD 腎臟纖維中少見報道。因此,本實驗通過建立腺嘌呤誘導 CKD 大鼠模型,觀察在腎纖維化進程中,是否存在 HAMP-FPN 信號通路的表達激活及其與炎癥的關系,旨在為腎纖維化的防治尋找新靶點。
1 材料與方法
1.1 實驗動物與材料
1.1.1 實驗動物
20 只 6 周齡雄性無特定病原體級 SD 大鼠,體重(170±10)g,購自西南醫科大學實驗動物中心,生產許可證號:SCXK(川)2024-0017,使用許可證號:SYXK(川)2023-0065,遵循 3R 原則。本研究已通過西南醫科大學實驗動物福利倫理審查。
1.1.2 主要試劑與儀器
腺嘌呤(美國默克公司);hepcidin 抗體、FPN1 抗體、白細胞介素-6(interleukin-6, IL-6)抗體、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)抗體、NF-κB P65 抗體(美國親科生物公司);α-平滑肌肌動蛋白(α-smooth muscle actin, α-SMA)抗體(美國賽信通公司);Ⅰ型膠原蛋白(collagen type Ⅰ, Col-Ⅰ)抗體(中國博士德公司);組織鐵測定試劑盒(中國建成生物公司);hepcidin-25 酶聯免疫吸附法(enzyme linked immunosorbent assay, ELISA)試劑盒(中國睿信生物公司);蘇木精-伊紅(hematoxylin-eosin staining, HE)染色試劑盒(中國碧云天公司);馬松(Masson)染色試劑盒(中國珠海貝索公司);兔 SP 試劑盒(中國中杉金橋公司);二氨基聯苯胺法顯色試劑盒(中國索萊寶公司);自動酶標儀(美國伯騰公司);RNA 逆轉錄儀、聚合酶鏈式反應(polymerase chain reaction, PCR)核酸擴增儀(德國艾本德公司);光學顯微鏡(日本尼康公司)。
1.2 研究方法
1.2.1 研究思路
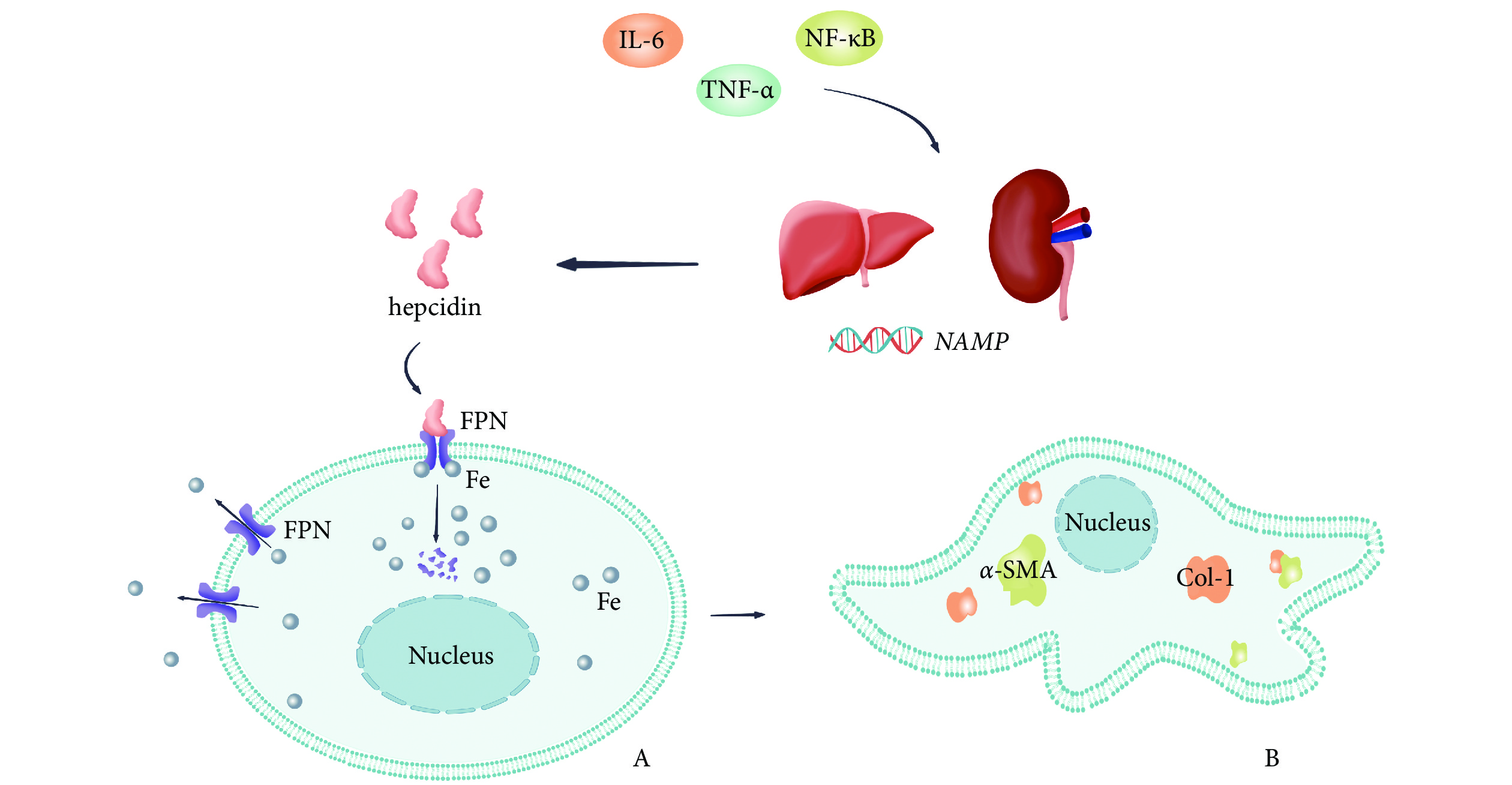
本實驗設計假想的 HAMP-FPN 信號通路機制見圖1。可見,炎癥反應中釋放的炎癥相關因子(IL-6、TNF-α、NF-κB)可能會促進能釋放 hepcidin 的靶器官的 HAMP 表達,進而增加 hepcidin 釋放,激活 HAMP-FPN 信號通路。hepcidin 與 FPN 結合后,可促進 FPN 的內化、降解,細胞內鐵離子外流減少,鐵代謝紊亂,進而導致上皮細胞纖維化表型相關標志物增加(α-SMA、Col-Ⅰ),以此參與 CKD 腎纖維化的進展過程。
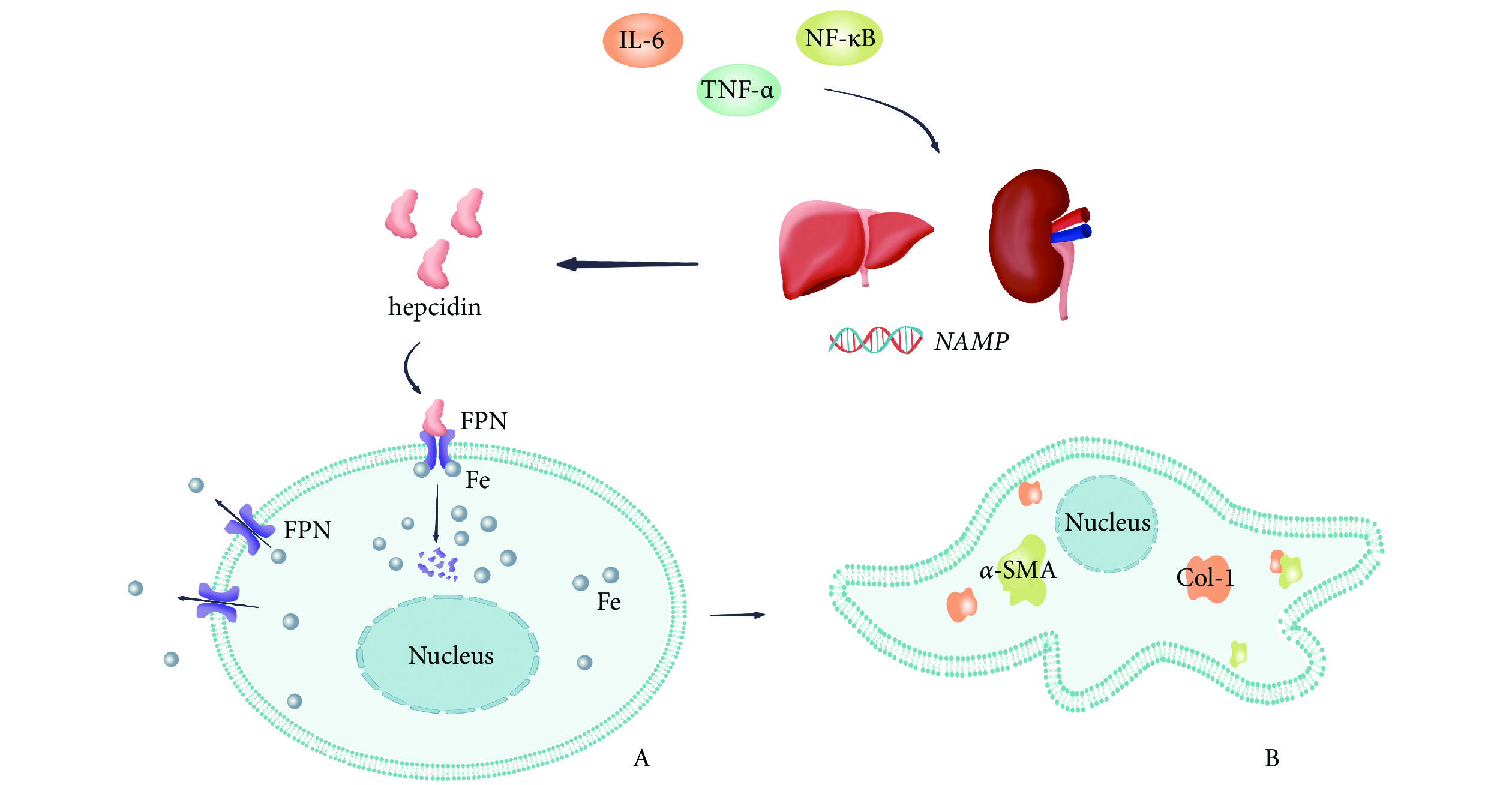 圖1
CKD 中的 HAMP-FPN 信號通路假想圖
圖1
CKD 中的 HAMP-FPN 信號通路假想圖
CKD:慢性腎臟病;IL-6:白細胞介素-6;TNF-α:腫瘤壞死因子-α;NF-κB:核因子κB;
1.2.2 分組與造模
適應性喂養后,將 20 只大鼠通過簡單隨機法分為對照組和 CKD 組,每組各 10 只。CKD 組給予 2.5%腺嘌呤 250 mg/(kg·d)灌胃建模,對照組于同時間點給予同等劑量生理鹽水灌胃。
1.2.3 標本采集
建模第 2、6 周末分別從兩組大鼠中每組隨機挑選出 5 只,用代謝籠收集這些大鼠的 24 h 尿液用于檢測尿蛋白,腹主動脈采血留取選出大鼠的血標本,部分用于檢測血清肌酐(serum creatinine, Scr)、血清尿素氮(blood urea nitrogen, BUN),部分用于 ELISA 檢測大鼠血清 hepcidin-25 水平;并將建模第 2、6 周末分別挑選出的每組 5 只大鼠處死,留取腎組織標本,部分置于 4%多聚甲醛液中,用于制作石蠟塊進行病理染色,部分?80℃凍存,部分用于檢測腎組織信使 RNA(messenger RNA, mRMA)表達,部分用于比色法檢測腎組織鐵含量。
1.2.4 腎組織染色
① HE 染色:石蠟切片經烤片、脫蠟、復水后,蘇木素 8 min 和伊紅 1 min 復染、透明、封片,于光鏡下觀察腎臟的病理學改變。② Masson 染色:石蠟切片經烤片、脫蠟、復水后,鐵蘇木素混合液染 8 min、麗春紅 8 min、磷鉬酸分色 5 min、甲苯胺藍 5 min 染色,脫水、封片,于光鏡下觀察膠原纖維。
1.2.5 腎組織免疫組織化學
4%多聚甲醛液中保存的腎組織石蠟切片經烤片、脫蠟、復水后,于檸檬酸三鈉緩沖液中抗原修復,自然冷卻后滴加 3%過氧化物酶阻斷劑 15 min,10%的山羊血清封閉 20 min,分別滴加一抗:稀釋倍數為 1∶100 的α-SMA、Col-Ⅰ、IL-6、TNF-α、NF-κB P65,稀釋倍數為 1∶200 的 hepcidin、FPN1;4℃過夜后滴加羊抗兔二抗工作液 15 min,辣根標記過氧化物酶 15 min,后使用二氨基聯苯胺法鏡下控制顯色,再進行復染,脫水、脫蠟和封片,最后利用 Image J 軟件進行半定量分析,測量其平均光密度。
1.2.6 腎組織實時定量熒光 PCR
根據試劑盒要求,提取腎臟總 RNA,逆轉錄成 cDNA,后進行 PCR 擴增。α-SMA、Col-Ⅰ、HAMP、FPN1、IL-6、TNF-α、NF-κB P65 及甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)上下游引物由上海生物工程有限公司合成,引物序列見表1。以 GAPDH 為內源性參照物,依據樣本 PCR 反應循環閾值(CT 值),計算 2-△△CT 為目的基因相對表達量。
1.3 統計學方法
采用 GraphPad Prism 8.0 軟件進行統計學分析。符合正態分布的計量資料采用均數±標準差表示,組間比較采用獨立 t 檢驗。計數資料采用只數和百分比表示。血清 hepcidin-25 水平、24 h 尿蛋白定量、BUN、Scr、腎組織鐵含量之間的相關性分析,腎組織 HAMP、FPN1 與α-SMA、IL-6、TNF-α、NF-κB P65 的 mRNA 表達水平之間的相關性分析,均用 Pearson 檢驗。雙側檢驗水準α=0.05。
2 結果
2.1 大鼠生化指標、血清 hepcidin-25 水平和腎組織鐵含量
大鼠生化指標、血清 hepcidin-25 和腎組織鐵含量水平變化見表2。組間比較顯示,建模第 2、6 周末時,CKD 組大鼠的 Scr、BUN、24 h 尿蛋白定量水平以及血清 hepcidin-25 和腎組織鐵含量水平均高于同期對照組(P<0.05)。組內比較顯示,CKD 組大鼠的 Scr、BUN、24 h 尿蛋白定量水平及血清 hepcidin-25 和腎組織鐵含量水平隨著造模時間延長而增加(P<0.05);對照組組內并無變化。
2.2 大鼠腎臟病理改變
2.2.1 HE 染色
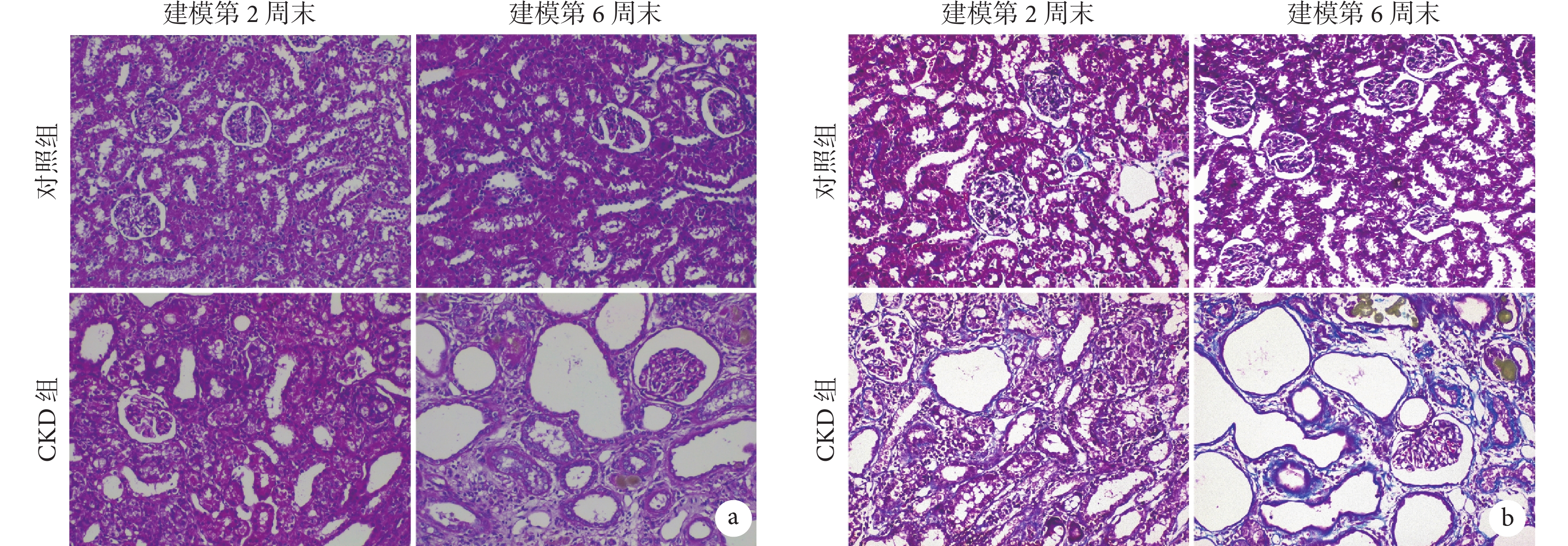
對照組大鼠腎組織結構清晰,無明顯異常;CKD 組可見隨造模時間進展,腎組織結構紊亂、腎小管擴張、腎小球萎縮加重,并逐步出現棕黃色顆粒沉積。見圖2a。
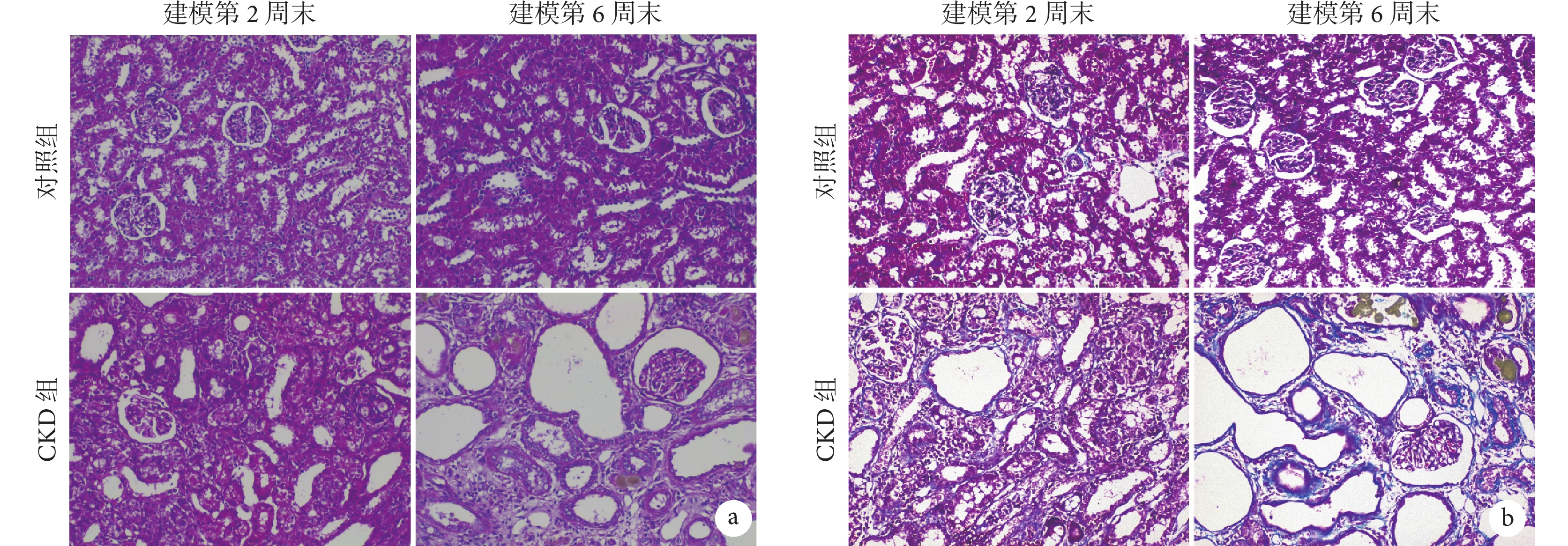 圖2
兩組大鼠腎組織染色彩色像( ×200)
圖2
兩組大鼠腎組織染色彩色像( ×200)
a. HE 染色;b. Masson 染色。CKD:慢性腎臟病
2.2.2 Masson 染色
對照組大鼠腎組織結構正常,無明顯膠原纖維沉積;CKD 組,隨著造模時間的延長,腎小球和腎間質內出現大量的藍色膠原纖維沉積。見圖2b。
2.3 大鼠腎臟纖維化及 HAMP-FPN通路相關蛋白表達
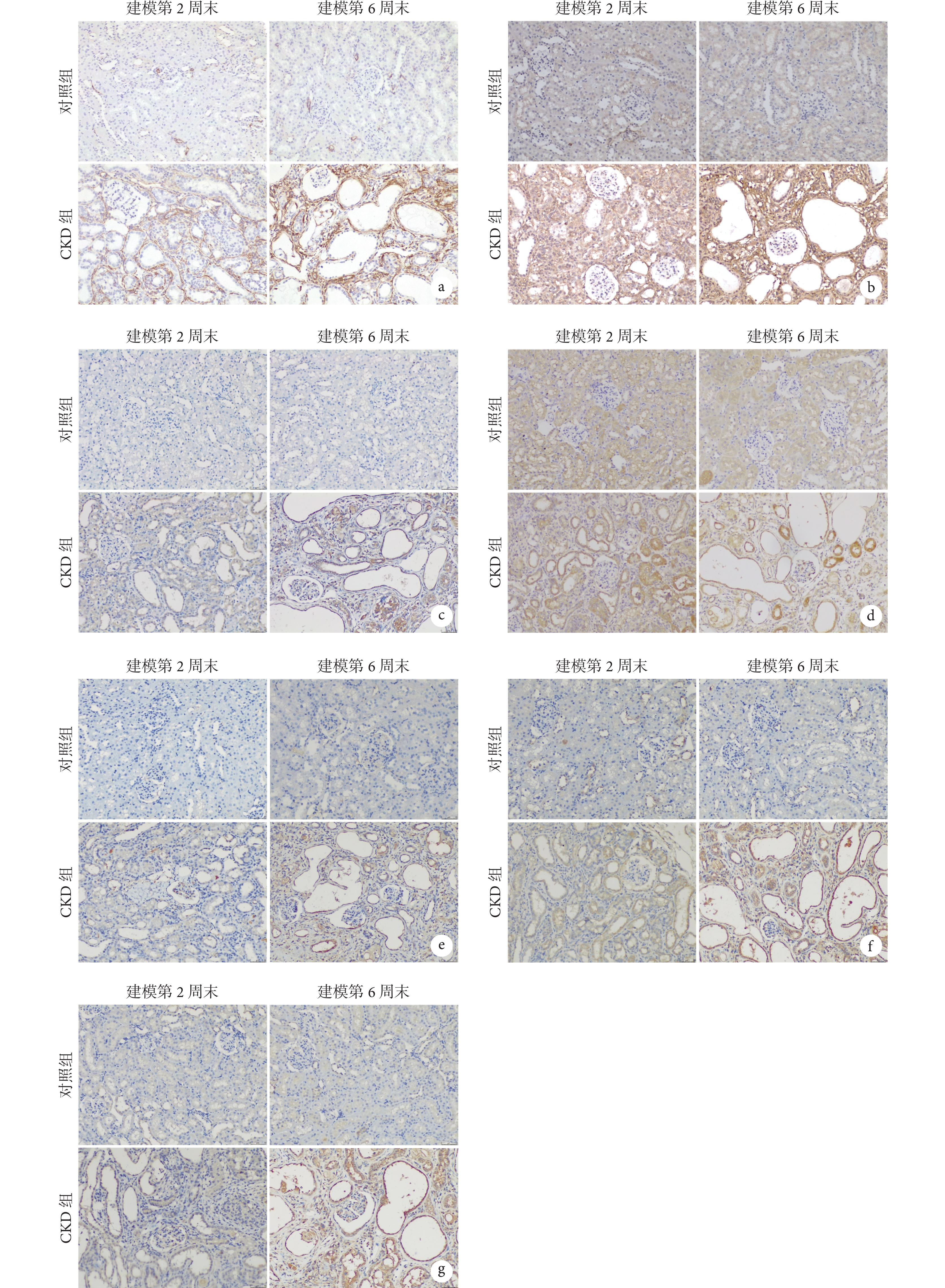
兩組大鼠腎組織免疫組化染色彩色像見圖3。大鼠腎臟纖維化及 HAMP-FPN 通路相關蛋白表達水平見表3。組間比較顯示,在建模第 2、6 周末時,CKD 組大鼠腎組織的 Col-Ⅰ和α-SMA 蛋白表達水平均高于對照組(P<0.05),hepcidin、IL-6、TNF-α 以及 NF-κB P65 蛋白表達水平也高于對照組(P<0.05),而 FPN1 蛋白表達水平較對照組低(P<0.05)。組內比較顯示,在建模第 6 周末時,CKD 組的 Col-Ⅰ、α-SMA、hepcidin、IL-6、TNF-α 以及 NF-κB P65 蛋白表達水平均高于建模第 2 周末(P<0.05),而 FPN1 蛋白表達水平低于建模第 2 周末(P<0.05);對照組組內并無變化。
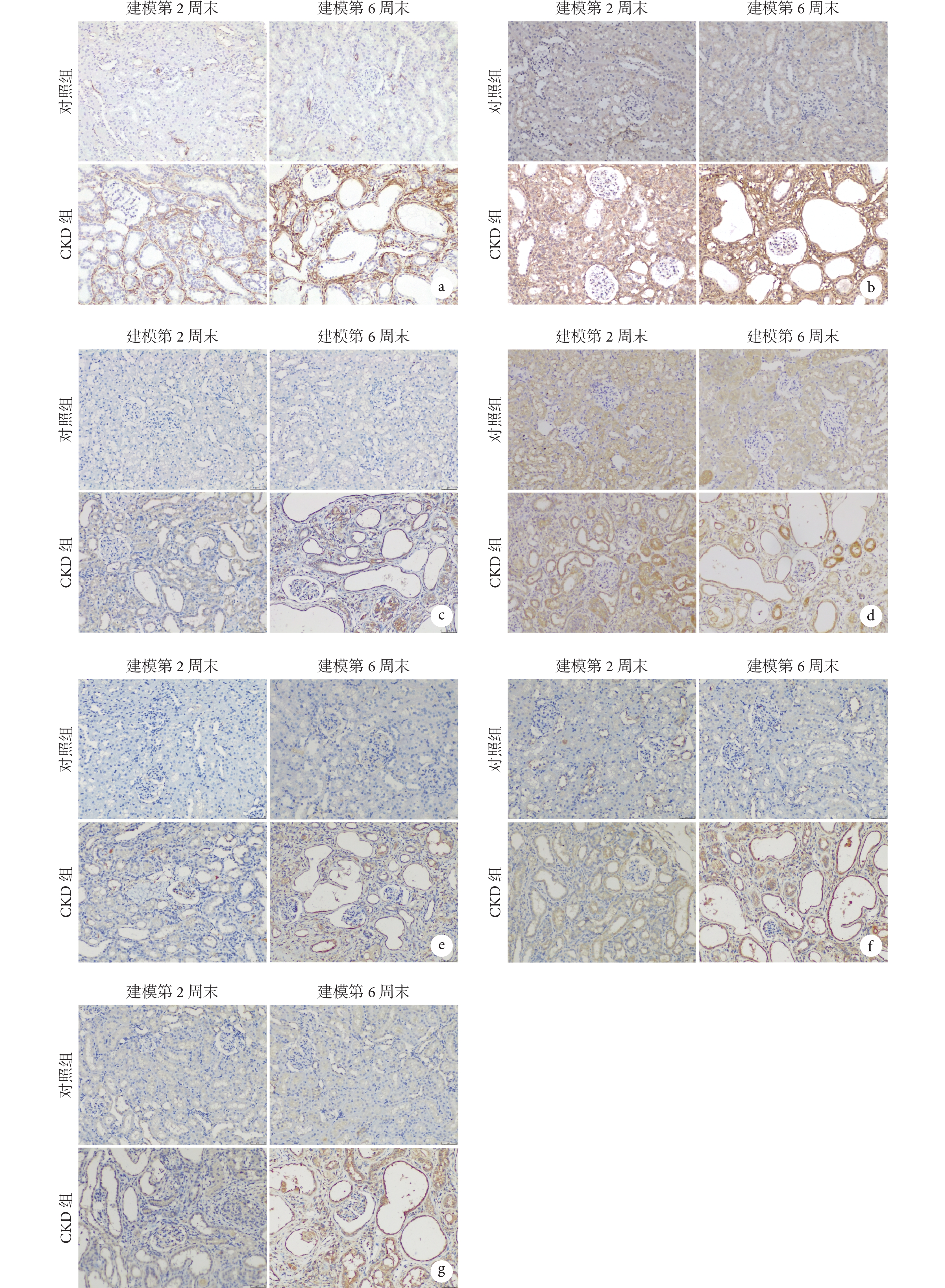 圖3
兩組大鼠腎組織免疫組化染色彩色像( ×200)
圖3
兩組大鼠腎組織免疫組化染色彩色像( ×200)
a. α-SMA;b. Col-Ⅰ;c. hepcidin;d. FPN1;e. IL-6;f. TNF-α;g. NF-κB P65。CKD:慢性腎臟病;α-SMA:α-平滑肌肌動蛋白;Col-Ⅰ:Ⅰ型膠原蛋白;hepcidin:鐵調素;FPN1:鐵輸出蛋白 1;IL-6:白細胞介素-6;TNF-α:腫瘤壞死因子-α;NF-κB:核因子 κB
2.4 大鼠腎臟纖維化及 HAMP-FPN 通路相關指標 mRNA 表達
大鼠腎臟纖維化及 HAMP-FPN 通路相關指標 mRNA 表達水平見表4。與對照組相比,建模第 2、6 周末時的 CKD 組大鼠腎臟α-SMA、Col-Ⅰ、HAMP、IL-6、TNF-α、NF-κB mRNA 表達水平均增加(P<0.05),而 FPN1 mRNA 表達水平降低(P<0.05)。組內比較顯示,CKD 組建模第 6 周末的大鼠腎臟α-SMA、Col-Ⅰ、HAMP、IL-6、TNF-α、NF-κB mRNA 表達水平較建模第 2 周末增加(P<0.05),而 FPN1 mRNA 表達水平較建模第 2 周末降低(P<0.05);對照組組內并無變化。
2.5 大鼠各指標間的相關性分析
2.5.1 大鼠生化指標、血清 hepcidin-25 以及腎組織鐵含量相關性分析
Pearson 相關分析結果顯示,大鼠血清 hepcidin-25 水平與 Scr(r=0.792,P<0.001)、24 h 尿蛋白定量(r=0.716,P<0.001)、BUN(r=0.779,P<0.001)呈正相關;腎組織鐵含量與 Scr(r=0.810,P<0.001)、24 h 尿蛋白定量(r=0.765,P<0.001)、BUN(r=0.773,P<0.001)、血清 hepcidin-25(r=0.767,P<0.001)均呈正相關。
2.5.2 各指標 mRNA 相關性分析
Pearson 相關分析結果顯示,HAMP 與α-SMA(r=0.770,P<0.001)、Col-Ⅰ(r=0.726,P<0.001)、IL-6(r=0.805,P<0.001)、TNF-α(r=0.815,P<0.001)、 NF-κB P65(r=0.785,P<0.001)的 mRNA 表達呈正相關,與 FPN1 的 mRNA 表達呈負相關(r=?0.733,P<0.001);FPN1 與α-SMA(r=?0.933,P<0.001)、Col-Ⅰ(r=?0.843,P<0.001)的 mRNA 表達呈負相關。
3 討論
腎臟纖維化的病理表現主要為膠原蛋白、纖連蛋白等纖維基質在腎小球、腎小管、腎間質的沉積,進而引起腎功能減退,它涉及多種信號通路的參與,例如 轉化生長因子-β/Smad、IL-6/NF-κB 等[11]。目前,臨床上主要通過控制腎功能惡化的危險因素來改善或者延緩腎臟疾病的進展,但沒有逆轉腎纖維化的主要藥物[12]。因此,急需為腎纖維化提供新的研究思路以及為慢性腎臟病患者的診治尋找新切入點。
腺嘌呤灌胃誘導的 CKD 腎纖維化大鼠模型是目前公認簡單有效的、接近于人類 CKD 緩慢進展的模型[13]。本實驗采用該方法建立動物模型。本研究結果顯示,與對照組相比,CKD 組大鼠 Scr、BUN 及 24 h 尿蛋白定量均明顯升高,HE 和 Masson 染色見明顯腎組織結構紊亂及膠原纖維沉積,腎臟α-SMA、Col-Ⅰ蛋白及 mRNA 表達增加,證實 CKD 腎纖維化大鼠模型建立成功。
研究表明,鐵死亡與許多疾病的病理生理過程密切相關,如腫瘤、糖尿病骨質疏松、肝肺纖維化等[14-16]。多項研究在糖尿病腎病、阿奇霉素誘導的腎纖維化等慢性腎病動物模型中證實鐵死亡的存在[17-18]。本實驗中也發現,腺嘌呤誘導的 CKD 大鼠腎組織的鐵含量明顯升高,且與 Scr、BUN、24 h 尿蛋白定量呈正相關。這些研究均表明鐵死亡可能參與 CKD 的進展。目前研究較多的鐵死亡機制主要包括谷胱甘肽/谷胱甘肽過氧化物酶 4 途徑、鐵代謝的調控、脂質代謝相關途徑、線粒體功能障礙等[19]。而人體內主要的鐵穩態調節系統是 HAMP-FPN 軸。hepcidin 主要由肝臟合成分泌,能與 FPN 結合并使其內化、降解,從而抑制細胞內鐵釋放[20],過度沉積的鐵離子易發生氧化,造成組織氧化損傷并誘導鐵死亡發生。本研究發現 CKD 組大鼠的血清 hepcidin-25 表達升高,且隨著病程進展而增加,這一變化趨勢與 Peters 等[21]在一項關于 CKD 患者血清 hepcidin-25 水平與腎小球率過濾相關性的橫斷面研究中相似。同時,本實驗中的相關性分析也表明血清 hepcidin-25 水平與腎組織鐵含量呈正相關,這說明 hepcidin-25 可能與 CKD 腎臟的鐵代謝相關。本研究還發現 CKD 組大鼠的腎組織中,hepcidin 蛋白及 mRNA 表達水平明顯升高,FPN1 蛋白及 mRNA 表達水平有所下降,且 HAMP mRNA 的表達與腎臟纖維化指標α-SMA、Col-Ⅰ的 mRNA 表達呈正相關,而 FPN 的 mRNA 表達則相反,與α-SMA 、Col-Ⅰ的 mRNA 表達呈負相關。這些研究結果說明在 CKD 中可能存在著 HAMP-FPN 通路的激活,且其可能通過調控腎臟鐵代謝狀態參與 CKD 腎纖維化的進展,但具體的分子機制仍需要進一步探討。
研究表明在炎性腸病、肝纖維化、心功能不全等多種疾病中鐵死亡與炎癥反應之間存在相互作用[22-24]。Xiao 等[23]用 Fer-1(人工合成的鐵死亡抑制劑)處理高脂誘導的心功能不全的大鼠后,發現原本升高的 NF-κB、TNF-α、IL-6 較處理前有明顯下降。Gotardo 等[24]在結腸炎大鼠模型中發現 IL-6 可以通過 START3 通路,增加 hepcidin-25 的表達。在 CKD 患者機體內,持續存在的慢性、輕度的炎癥反應發生,此外,炎癥與促紅細胞生成素生成不足、鐵代謝紊亂等還構成腎性貧血發生的重要誘因。炎癥可誘導鐵調素水平升高,抑制鐵的吸收,導致造血細胞鐵利用受限,進而限制血紅蛋白的生物合成,其機制可能與 IL-6、IL-1β及其他炎性因子通過 JAK-STAT3 信號通路等途徑促進鐵調素轉錄,進而介導 FPN 內化有關[25]。腎臟纖維化進程中涉及多種炎癥信號通路,如 NF-κB 信號通路、SIRT1/H2O2 信號通路、TGF-β/Samd 信號通路等[26-27]。但在 CKD 腎臟纖維化的發生機制研究中,鐵死亡與炎癥反應的相互作用關系卻少有報道。本研究發現在 CKD 腎纖維化大鼠中的腎組織中,炎癥因子 IL-6、TNF-α、NF-κB p65 的蛋白及 mRNA 表達水平明顯升高,且 IL-6、TNF-α、NF-κB p65 的 mRNA 變化水平均與 HAMP 呈正相關,這說明在 CKD 腎纖維化中,HAMP-FPN 通路可能與 IL-6、TNF-α、NF-κB p65 存在相互影響,但二者之間具體作用機制以及在促進腎臟纖維化方面是否具有協同作用,仍需要進一步研究。
綜上,本研究發現在腺嘌呤誘導的 CKD 腎纖維化模型中,存在著 HAMP-FPN 通路的激活,且其可能通過誘導腎組織鐵死亡,和/或與腎臟炎癥反應交互作用參與腎纖維化的發生發展,但其具體機制仍需要進行體內外干預實驗進一步探討,以期為 CKD 腎纖維化的防治提供新思路。
作者貢獻:羅珊、劉義琴:論文撰寫、實驗操作;李艷、康婷、吳蔚樺:數據收集與整理、統計學分析;歐三桃:課題設計、論文修改。
利益沖突:所有作者聲明不存在利益沖突。
慢性腎臟病(chronic kidney disease, CKD)被認為是一個世界重大公共衛生問題,影響全球約 10%的人口[1]。腎臟纖維化是 CKD 的主要病理表現,其嚴重程度與疾病預后密切相關[2]。鐵死亡作為一種新型細胞死亡方式,參與了單側輸尿管梗阻、腎切除術誘導 CKD、腎積水等腎臟疾病動物模型的病變[3-5]。本研究小組前期研究也發現,在 CKD 腎纖維化大鼠模型中存在鐵死亡相關指標的變化[6],但具體分子機制尚不清楚。人體內鐵穩態的調節主要依賴鐵調素(hepcidin)-鐵輸出蛋白(ferroportin, FPN)軸信號通路。有研究發現 hepcidin 基因(HAMP)過量表達會導致全身鐵缺乏、紅細胞生成減少,與神經系統腫瘤、腎性貧血等疾病的進展密切相關[7-8],但 HAMP-FPN 信號通路與腎纖維化的關系尚不清楚。此外,核因子 κB(nuclear factor kappa-B, NF-κB)信號通路為經典促炎通路,在腎纖維化發病機制中扮演重要角色,研究發現在肺肝纖維化、炎性貧血的動物模型中,NF-κB 通路與 hepcidin 之間具有相互作用[9-10],但在 CKD 腎臟纖維中少見報道。因此,本實驗通過建立腺嘌呤誘導 CKD 大鼠模型,觀察在腎纖維化進程中,是否存在 HAMP-FPN 信號通路的表達激活及其與炎癥的關系,旨在為腎纖維化的防治尋找新靶點。
1 材料與方法
1.1 實驗動物與材料
1.1.1 實驗動物
20 只 6 周齡雄性無特定病原體級 SD 大鼠,體重(170±10)g,購自西南醫科大學實驗動物中心,生產許可證號:SCXK(川)2024-0017,使用許可證號:SYXK(川)2023-0065,遵循 3R 原則。本研究已通過西南醫科大學實驗動物福利倫理審查。
1.1.2 主要試劑與儀器
腺嘌呤(美國默克公司);hepcidin 抗體、FPN1 抗體、白細胞介素-6(interleukin-6, IL-6)抗體、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)抗體、NF-κB P65 抗體(美國親科生物公司);α-平滑肌肌動蛋白(α-smooth muscle actin, α-SMA)抗體(美國賽信通公司);Ⅰ型膠原蛋白(collagen type Ⅰ, Col-Ⅰ)抗體(中國博士德公司);組織鐵測定試劑盒(中國建成生物公司);hepcidin-25 酶聯免疫吸附法(enzyme linked immunosorbent assay, ELISA)試劑盒(中國睿信生物公司);蘇木精-伊紅(hematoxylin-eosin staining, HE)染色試劑盒(中國碧云天公司);馬松(Masson)染色試劑盒(中國珠海貝索公司);兔 SP 試劑盒(中國中杉金橋公司);二氨基聯苯胺法顯色試劑盒(中國索萊寶公司);自動酶標儀(美國伯騰公司);RNA 逆轉錄儀、聚合酶鏈式反應(polymerase chain reaction, PCR)核酸擴增儀(德國艾本德公司);光學顯微鏡(日本尼康公司)。
1.2 研究方法
1.2.1 研究思路
本實驗設計假想的 HAMP-FPN 信號通路機制見圖1。可見,炎癥反應中釋放的炎癥相關因子(IL-6、TNF-α、NF-κB)可能會促進能釋放 hepcidin 的靶器官的 HAMP 表達,進而增加 hepcidin 釋放,激活 HAMP-FPN 信號通路。hepcidin 與 FPN 結合后,可促進 FPN 的內化、降解,細胞內鐵離子外流減少,鐵代謝紊亂,進而導致上皮細胞纖維化表型相關標志物增加(α-SMA、Col-Ⅰ),以此參與 CKD 腎纖維化的進展過程。
 圖1
CKD 中的 HAMP-FPN 信號通路假想圖
圖1
CKD 中的 HAMP-FPN 信號通路假想圖
CKD:慢性腎臟病;IL-6:白細胞介素-6;TNF-α:腫瘤壞死因子-α;NF-κB:核因子κB;
1.2.2 分組與造模
適應性喂養后,將 20 只大鼠通過簡單隨機法分為對照組和 CKD 組,每組各 10 只。CKD 組給予 2.5%腺嘌呤 250 mg/(kg·d)灌胃建模,對照組于同時間點給予同等劑量生理鹽水灌胃。
1.2.3 標本采集
建模第 2、6 周末分別從兩組大鼠中每組隨機挑選出 5 只,用代謝籠收集這些大鼠的 24 h 尿液用于檢測尿蛋白,腹主動脈采血留取選出大鼠的血標本,部分用于檢測血清肌酐(serum creatinine, Scr)、血清尿素氮(blood urea nitrogen, BUN),部分用于 ELISA 檢測大鼠血清 hepcidin-25 水平;并將建模第 2、6 周末分別挑選出的每組 5 只大鼠處死,留取腎組織標本,部分置于 4%多聚甲醛液中,用于制作石蠟塊進行病理染色,部分?80℃凍存,部分用于檢測腎組織信使 RNA(messenger RNA, mRMA)表達,部分用于比色法檢測腎組織鐵含量。
1.2.4 腎組織染色
① HE 染色:石蠟切片經烤片、脫蠟、復水后,蘇木素 8 min 和伊紅 1 min 復染、透明、封片,于光鏡下觀察腎臟的病理學改變。② Masson 染色:石蠟切片經烤片、脫蠟、復水后,鐵蘇木素混合液染 8 min、麗春紅 8 min、磷鉬酸分色 5 min、甲苯胺藍 5 min 染色,脫水、封片,于光鏡下觀察膠原纖維。
1.2.5 腎組織免疫組織化學
4%多聚甲醛液中保存的腎組織石蠟切片經烤片、脫蠟、復水后,于檸檬酸三鈉緩沖液中抗原修復,自然冷卻后滴加 3%過氧化物酶阻斷劑 15 min,10%的山羊血清封閉 20 min,分別滴加一抗:稀釋倍數為 1∶100 的α-SMA、Col-Ⅰ、IL-6、TNF-α、NF-κB P65,稀釋倍數為 1∶200 的 hepcidin、FPN1;4℃過夜后滴加羊抗兔二抗工作液 15 min,辣根標記過氧化物酶 15 min,后使用二氨基聯苯胺法鏡下控制顯色,再進行復染,脫水、脫蠟和封片,最后利用 Image J 軟件進行半定量分析,測量其平均光密度。
1.2.6 腎組織實時定量熒光 PCR
根據試劑盒要求,提取腎臟總 RNA,逆轉錄成 cDNA,后進行 PCR 擴增。α-SMA、Col-Ⅰ、HAMP、FPN1、IL-6、TNF-α、NF-κB P65 及甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)上下游引物由上海生物工程有限公司合成,引物序列見表1。以 GAPDH 為內源性參照物,依據樣本 PCR 反應循環閾值(CT 值),計算 2-△△CT 為目的基因相對表達量。
1.3 統計學方法
采用 GraphPad Prism 8.0 軟件進行統計學分析。符合正態分布的計量資料采用均數±標準差表示,組間比較采用獨立 t 檢驗。計數資料采用只數和百分比表示。血清 hepcidin-25 水平、24 h 尿蛋白定量、BUN、Scr、腎組織鐵含量之間的相關性分析,腎組織 HAMP、FPN1 與α-SMA、IL-6、TNF-α、NF-κB P65 的 mRNA 表達水平之間的相關性分析,均用 Pearson 檢驗。雙側檢驗水準α=0.05。
2 結果
2.1 大鼠生化指標、血清 hepcidin-25 水平和腎組織鐵含量
大鼠生化指標、血清 hepcidin-25 和腎組織鐵含量水平變化見表2。組間比較顯示,建模第 2、6 周末時,CKD 組大鼠的 Scr、BUN、24 h 尿蛋白定量水平以及血清 hepcidin-25 和腎組織鐵含量水平均高于同期對照組(P<0.05)。組內比較顯示,CKD 組大鼠的 Scr、BUN、24 h 尿蛋白定量水平及血清 hepcidin-25 和腎組織鐵含量水平隨著造模時間延長而增加(P<0.05);對照組組內并無變化。
2.2 大鼠腎臟病理改變
2.2.1 HE 染色
對照組大鼠腎組織結構清晰,無明顯異常;CKD 組可見隨造模時間進展,腎組織結構紊亂、腎小管擴張、腎小球萎縮加重,并逐步出現棕黃色顆粒沉積。見圖2a。
 圖2
兩組大鼠腎組織染色彩色像( ×200)
圖2
兩組大鼠腎組織染色彩色像( ×200)
a. HE 染色;b. Masson 染色。CKD:慢性腎臟病
2.2.2 Masson 染色
對照組大鼠腎組織結構正常,無明顯膠原纖維沉積;CKD 組,隨著造模時間的延長,腎小球和腎間質內出現大量的藍色膠原纖維沉積。見圖2b。
2.3 大鼠腎臟纖維化及 HAMP-FPN通路相關蛋白表達
兩組大鼠腎組織免疫組化染色彩色像見圖3。大鼠腎臟纖維化及 HAMP-FPN 通路相關蛋白表達水平見表3。組間比較顯示,在建模第 2、6 周末時,CKD 組大鼠腎組織的 Col-Ⅰ和α-SMA 蛋白表達水平均高于對照組(P<0.05),hepcidin、IL-6、TNF-α 以及 NF-κB P65 蛋白表達水平也高于對照組(P<0.05),而 FPN1 蛋白表達水平較對照組低(P<0.05)。組內比較顯示,在建模第 6 周末時,CKD 組的 Col-Ⅰ、α-SMA、hepcidin、IL-6、TNF-α 以及 NF-κB P65 蛋白表達水平均高于建模第 2 周末(P<0.05),而 FPN1 蛋白表達水平低于建模第 2 周末(P<0.05);對照組組內并無變化。
 圖3
兩組大鼠腎組織免疫組化染色彩色像( ×200)
圖3
兩組大鼠腎組織免疫組化染色彩色像( ×200)
a. α-SMA;b. Col-Ⅰ;c. hepcidin;d. FPN1;e. IL-6;f. TNF-α;g. NF-κB P65。CKD:慢性腎臟病;α-SMA:α-平滑肌肌動蛋白;Col-Ⅰ:Ⅰ型膠原蛋白;hepcidin:鐵調素;FPN1:鐵輸出蛋白 1;IL-6:白細胞介素-6;TNF-α:腫瘤壞死因子-α;NF-κB:核因子 κB
2.4 大鼠腎臟纖維化及 HAMP-FPN 通路相關指標 mRNA 表達
大鼠腎臟纖維化及 HAMP-FPN 通路相關指標 mRNA 表達水平見表4。與對照組相比,建模第 2、6 周末時的 CKD 組大鼠腎臟α-SMA、Col-Ⅰ、HAMP、IL-6、TNF-α、NF-κB mRNA 表達水平均增加(P<0.05),而 FPN1 mRNA 表達水平降低(P<0.05)。組內比較顯示,CKD 組建模第 6 周末的大鼠腎臟α-SMA、Col-Ⅰ、HAMP、IL-6、TNF-α、NF-κB mRNA 表達水平較建模第 2 周末增加(P<0.05),而 FPN1 mRNA 表達水平較建模第 2 周末降低(P<0.05);對照組組內并無變化。
2.5 大鼠各指標間的相關性分析
2.5.1 大鼠生化指標、血清 hepcidin-25 以及腎組織鐵含量相關性分析
Pearson 相關分析結果顯示,大鼠血清 hepcidin-25 水平與 Scr(r=0.792,P<0.001)、24 h 尿蛋白定量(r=0.716,P<0.001)、BUN(r=0.779,P<0.001)呈正相關;腎組織鐵含量與 Scr(r=0.810,P<0.001)、24 h 尿蛋白定量(r=0.765,P<0.001)、BUN(r=0.773,P<0.001)、血清 hepcidin-25(r=0.767,P<0.001)均呈正相關。
2.5.2 各指標 mRNA 相關性分析
Pearson 相關分析結果顯示,HAMP 與α-SMA(r=0.770,P<0.001)、Col-Ⅰ(r=0.726,P<0.001)、IL-6(r=0.805,P<0.001)、TNF-α(r=0.815,P<0.001)、 NF-κB P65(r=0.785,P<0.001)的 mRNA 表達呈正相關,與 FPN1 的 mRNA 表達呈負相關(r=?0.733,P<0.001);FPN1 與α-SMA(r=?0.933,P<0.001)、Col-Ⅰ(r=?0.843,P<0.001)的 mRNA 表達呈負相關。
3 討論
腎臟纖維化的病理表現主要為膠原蛋白、纖連蛋白等纖維基質在腎小球、腎小管、腎間質的沉積,進而引起腎功能減退,它涉及多種信號通路的參與,例如 轉化生長因子-β/Smad、IL-6/NF-κB 等[11]。目前,臨床上主要通過控制腎功能惡化的危險因素來改善或者延緩腎臟疾病的進展,但沒有逆轉腎纖維化的主要藥物[12]。因此,急需為腎纖維化提供新的研究思路以及為慢性腎臟病患者的診治尋找新切入點。
腺嘌呤灌胃誘導的 CKD 腎纖維化大鼠模型是目前公認簡單有效的、接近于人類 CKD 緩慢進展的模型[13]。本實驗采用該方法建立動物模型。本研究結果顯示,與對照組相比,CKD 組大鼠 Scr、BUN 及 24 h 尿蛋白定量均明顯升高,HE 和 Masson 染色見明顯腎組織結構紊亂及膠原纖維沉積,腎臟α-SMA、Col-Ⅰ蛋白及 mRNA 表達增加,證實 CKD 腎纖維化大鼠模型建立成功。
研究表明,鐵死亡與許多疾病的病理生理過程密切相關,如腫瘤、糖尿病骨質疏松、肝肺纖維化等[14-16]。多項研究在糖尿病腎病、阿奇霉素誘導的腎纖維化等慢性腎病動物模型中證實鐵死亡的存在[17-18]。本實驗中也發現,腺嘌呤誘導的 CKD 大鼠腎組織的鐵含量明顯升高,且與 Scr、BUN、24 h 尿蛋白定量呈正相關。這些研究均表明鐵死亡可能參與 CKD 的進展。目前研究較多的鐵死亡機制主要包括谷胱甘肽/谷胱甘肽過氧化物酶 4 途徑、鐵代謝的調控、脂質代謝相關途徑、線粒體功能障礙等[19]。而人體內主要的鐵穩態調節系統是 HAMP-FPN 軸。hepcidin 主要由肝臟合成分泌,能與 FPN 結合并使其內化、降解,從而抑制細胞內鐵釋放[20],過度沉積的鐵離子易發生氧化,造成組織氧化損傷并誘導鐵死亡發生。本研究發現 CKD 組大鼠的血清 hepcidin-25 表達升高,且隨著病程進展而增加,這一變化趨勢與 Peters 等[21]在一項關于 CKD 患者血清 hepcidin-25 水平與腎小球率過濾相關性的橫斷面研究中相似。同時,本實驗中的相關性分析也表明血清 hepcidin-25 水平與腎組織鐵含量呈正相關,這說明 hepcidin-25 可能與 CKD 腎臟的鐵代謝相關。本研究還發現 CKD 組大鼠的腎組織中,hepcidin 蛋白及 mRNA 表達水平明顯升高,FPN1 蛋白及 mRNA 表達水平有所下降,且 HAMP mRNA 的表達與腎臟纖維化指標α-SMA、Col-Ⅰ的 mRNA 表達呈正相關,而 FPN 的 mRNA 表達則相反,與α-SMA 、Col-Ⅰ的 mRNA 表達呈負相關。這些研究結果說明在 CKD 中可能存在著 HAMP-FPN 通路的激活,且其可能通過調控腎臟鐵代謝狀態參與 CKD 腎纖維化的進展,但具體的分子機制仍需要進一步探討。
研究表明在炎性腸病、肝纖維化、心功能不全等多種疾病中鐵死亡與炎癥反應之間存在相互作用[22-24]。Xiao 等[23]用 Fer-1(人工合成的鐵死亡抑制劑)處理高脂誘導的心功能不全的大鼠后,發現原本升高的 NF-κB、TNF-α、IL-6 較處理前有明顯下降。Gotardo 等[24]在結腸炎大鼠模型中發現 IL-6 可以通過 START3 通路,增加 hepcidin-25 的表達。在 CKD 患者機體內,持續存在的慢性、輕度的炎癥反應發生,此外,炎癥與促紅細胞生成素生成不足、鐵代謝紊亂等還構成腎性貧血發生的重要誘因。炎癥可誘導鐵調素水平升高,抑制鐵的吸收,導致造血細胞鐵利用受限,進而限制血紅蛋白的生物合成,其機制可能與 IL-6、IL-1β及其他炎性因子通過 JAK-STAT3 信號通路等途徑促進鐵調素轉錄,進而介導 FPN 內化有關[25]。腎臟纖維化進程中涉及多種炎癥信號通路,如 NF-κB 信號通路、SIRT1/H2O2 信號通路、TGF-β/Samd 信號通路等[26-27]。但在 CKD 腎臟纖維化的發生機制研究中,鐵死亡與炎癥反應的相互作用關系卻少有報道。本研究發現在 CKD 腎纖維化大鼠中的腎組織中,炎癥因子 IL-6、TNF-α、NF-κB p65 的蛋白及 mRNA 表達水平明顯升高,且 IL-6、TNF-α、NF-κB p65 的 mRNA 變化水平均與 HAMP 呈正相關,這說明在 CKD 腎纖維化中,HAMP-FPN 通路可能與 IL-6、TNF-α、NF-κB p65 存在相互影響,但二者之間具體作用機制以及在促進腎臟纖維化方面是否具有協同作用,仍需要進一步研究。
綜上,本研究發現在腺嘌呤誘導的 CKD 腎纖維化模型中,存在著 HAMP-FPN 通路的激活,且其可能通過誘導腎組織鐵死亡,和/或與腎臟炎癥反應交互作用參與腎纖維化的發生發展,但其具體機制仍需要進行體內外干預實驗進一步探討,以期為 CKD 腎纖維化的防治提供新思路。
作者貢獻:羅珊、劉義琴:論文撰寫、實驗操作;李艷、康婷、吳蔚樺:數據收集與整理、統計學分析;歐三桃:課題設計、論文修改。
利益沖突:所有作者聲明不存在利益沖突。