引用本文: 王曉曼, 趙穎, 朱哲, 郭文來. 左手部多發巨大腱鞘巨細胞瘤一例. 華西醫學, 2024, 39(4): 674-676. doi: 10.7507/1002-0179.202310105 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
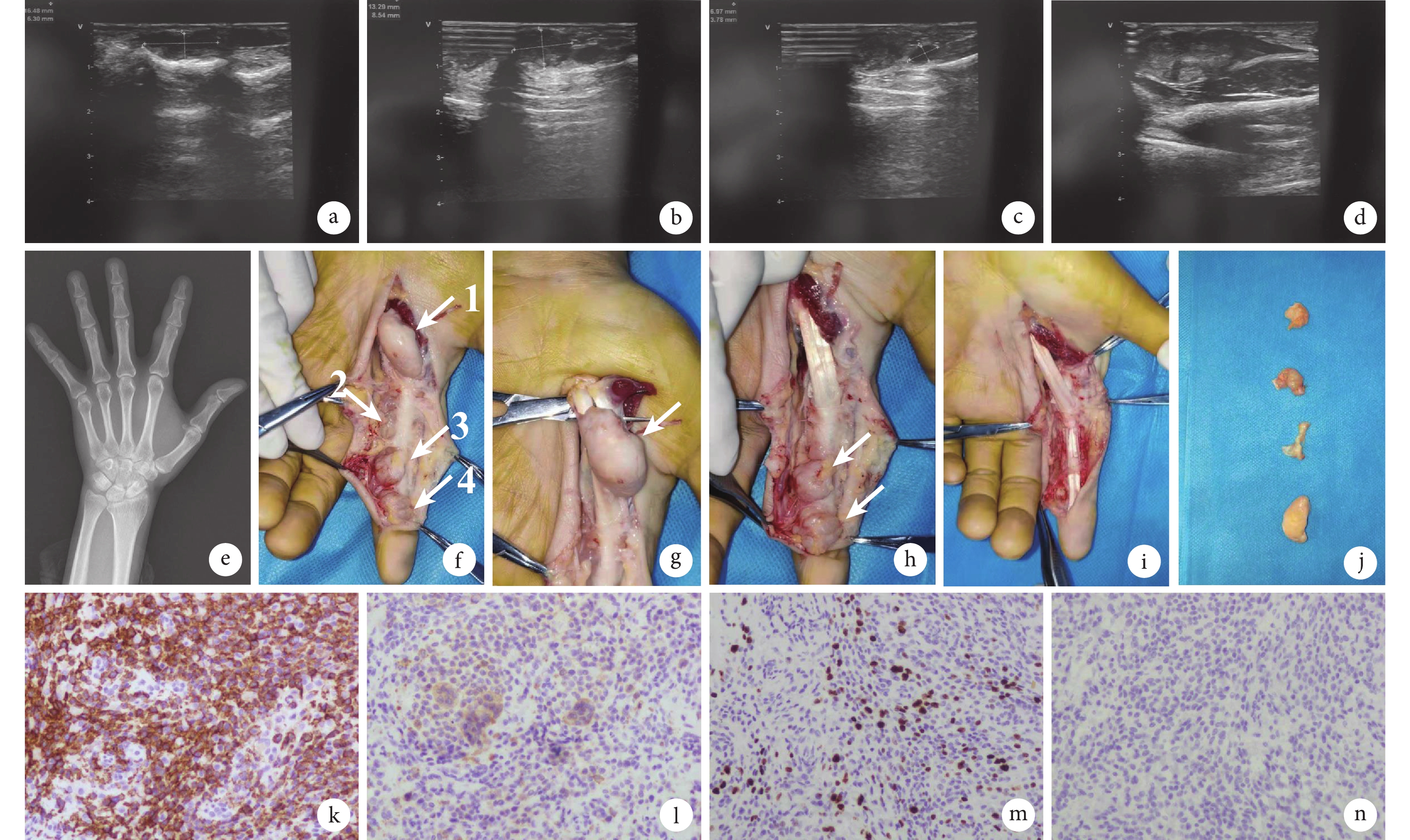
病例介紹 患者,女,44歲,因“發現左示指及左掌側皮下無痛性腫物5年余”于2021年10月18日就診于吉林大學第二醫院(以下簡稱“我院”)手外科。患者自述于5年前發現左示指及左掌側可觸及4處無痛性皮下軟組織腫物,呈串珠樣分布,隨時間逐漸增大。2021年10月15日外院左手彩色多普勒超聲檢查結果示:左手示指肌腱旁可見4處低回聲結節,分別位于左示指近、遠節、左第二掌指關節和左手掌,大小分別為16.5 mm×6.3 mm(圖1a)、13.3 mm×8.5 mm(圖1b)、7.0 mm×3.8 mm(圖1c)和28.8 mm×11.3 mm(圖1d),較大者位于手掌側,形態規則,邊界清晰,內部回聲不均,未見明顯血流信號。患者為求進一步診治,遂于2021年10月18日就診于我院,門診以“左手多發腫物(性質待查)”收入手外科。
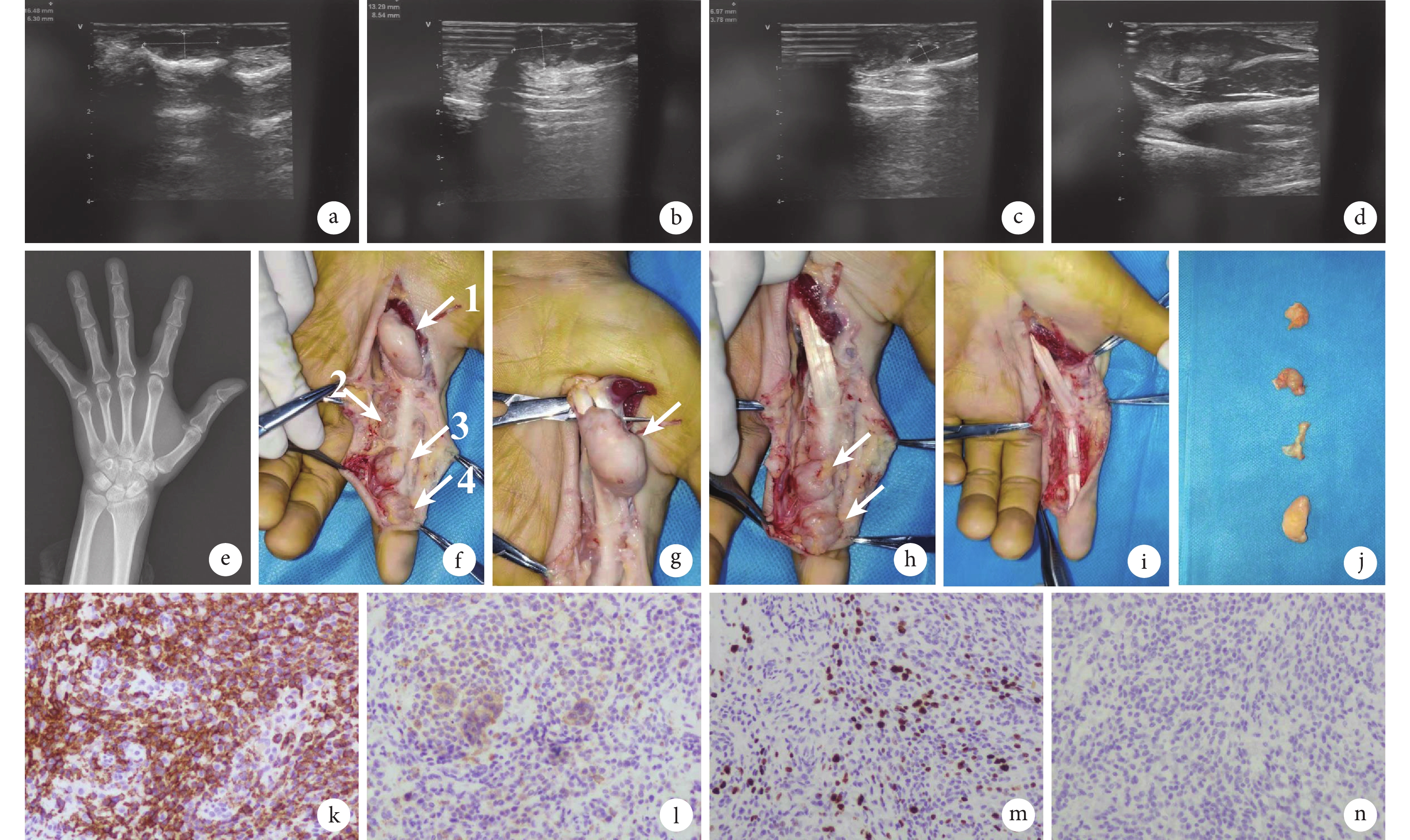 圖1
患者腱鞘巨細胞瘤相關圖像
圖1
患者腱鞘巨細胞瘤相關圖像
a~d. 外院彩色多普勒超聲提示左手示指肌腱旁可見 4 處低回聲結節,分別位于左示指近、遠節、左第二掌指關節和左手掌,較大者位于手掌側,形態規則,邊界清晰,內部回聲不均,未見明顯血流信號;e. X 線片示骨質未見異常,左示指周圍軟組織影增厚;f~j. 術中所見瘤體位置及手術過程(圖 1f 中第 1 個白箭和圖 1g 中白箭為手掌腫物,圖 1f 中第 2 個白箭為左第二掌指關節腫物,圖 1f 中第 3、4 個白箭和圖 1h 中白箭為左示指近節和遠節腫物);k. CD163 免疫組化染色陽性(×200);l. CD68 免疫組化染色陽性(×200);m. Ki67 免疫組化染色陽性(×200);n. 結蛋白免疫組化染色陰性(×200)
入院體格檢查:體溫36.5℃,脈搏80次/min,呼吸頻率20次/min,血壓125/78mm Hg(1 mm Hg=0.133 kPa),身高 163 cm,體重55 kg,體質量指數20.7 kg/m2,營養及發育良好,無貧血貌。專科查體見左手部腫物質軟、界清、活動度差,觸壓痛陰性,示指遠端皮膚感覺稍有麻木,關節活動可。2021年10月19日入院血常規、血生化、肝腎功能、凝血功能無明顯異常。左手正斜位X線片示骨質未見異常,左示指周圍軟組織影增厚(圖1e)。經醫患溝通,患方決定采取手術治療。完善術前準備,排除手術禁忌證后,于10月20日行左手部軟組織病損切除術。術中患者取仰臥位,左手置于外展架,臂叢阻滯滿意后,手術在氣囊止血帶控制下進行。首先于腫物表面、手掌及示指作連續“Z”字切口,逐層切開,見腫物位于肌腱旁,侵及腱鞘。其中手掌腫物(圖1f中第1個白箭)大小約40 mm×35 mm,質硬,表面有包膜但不完整,位于魚際肌遠側,包繞在屈指深淺肌腱且大部分位于表面(圖1g),腱鞘大部分被侵及,指總動脈及神經受擠壓。示指近節屈指肌腱尺側見大小約20 mm×5 mm的縱行腫物(圖1f中第2個白箭),質硬,暗黃色,侵及腱鞘并向屈指肌腱深淺和背側延伸,被纖維組織分隔成多塊狀。近側指間關節尺側見一大小15 mm×15 mm腫物(圖1f中第3個白箭),質硬,暗黃色,位于肌腱表面偏尺側,侵及肌腱,并向肌腱背側長入。遠側指間關節尺側偏近側可見一大小約15 mm×15 mm腫物(圖1f中第4個白箭),位于屈肌腱表面并將其包繞。腫物將尺側指神經血管壓迫并移位。術中仔細分離腫物與周圍組織,并切除腫物粘連的腱鞘等軟組織,注意保護神經血管束,將位于肌腱之間和背側的腫物完整切除,僅留有遠側指間關節掌側、掌指關節掌側部分環形腱鞘(圖1h~1j)。術中組織送快速病理結果顯示為間葉源性腫瘤,考慮為腱鞘巨細胞瘤(giant cell tumor of tendon sheath, GCTTS)。松開止血帶,充分止血后沖洗,使用防粘連膜覆蓋肌腱、神經表面,逐層縫合,置引流條,無菌敷料包扎固定,術畢。10月26日術后常規病理結果顯示為間葉源性腫瘤,腫瘤大部分邊界較清楚,免疫組化染色結果示細胞高表達CD163(圖1k)、CD68(圖1l)和Ki67(圖1m),未表達結蛋白(圖1n),考慮為局限型GCTTS。術后隨訪2年,未見腫物復發。
討論 GCTTS在1852年被首次報道[1],其常表現為位于關節滑膜、滑囊或腱鞘附近、緩慢生長、質韌、多葉、無觸痛的良性軟組織腫塊,直徑多在1~3 cm[2]。GCTTS具有一定的性別傾向,好發于30~50歲女性[3]。根據不同的好發部位、生長方式和生物學特性,GCTTS可分為局限型(L-GCTTS)、彌漫關節外型(D-GCTTS)、彌漫關節內型(色素絨毛結節性滑膜炎)和惡性型(M-GCTTS),其中前2種最常見[4-5]。L-GCTTS好發于手和腳的肌腱腱鞘內,具有清晰的界限。而D-GCTTS常發生在大關節,其生長模式具有侵襲性,且復發率較高[6]。
影像學是診斷GCTTS的重要輔助手段。彩色多普勒超聲通常是軟組織腫瘤的首選影像學檢查,可實時動態觀察腫瘤與鄰近組織的位置關系和血流情況變化[7]。超聲下GCTTS通常表現為實性、界清腫塊,其形態多樣,大部分內部呈均勻、低回聲,少數內部可見點狀、片狀強回聲區或少許無回聲區,伴后方回聲不同程度增強。彩色多普勒血流成像顯示大多數腫塊內部血流豐富,部分腫塊內部僅見點狀血流信號或無明顯血流信號[8]。X線檢查常用于明確是否伴隨潛在的骨質破壞[9]。MRI目前是軟組織腫瘤術前評估腫瘤大小、范圍和鄰近關節和腱鞘間隙的最佳工具,在區分L-GCTTS和D-GCTTS方面準確性很高。Wang等[10]的研究對38例GCTTS患者進行MRI檢查,由于含鐵血黃素的存在,GCTTS通常在T1加權像和T2加權像上表現為低信號。與L-GCTS相比,D-GCTS的異質性更強,在T1加權像和T2加權像上有較大的低密度區域,在造影劑增強的T1加權像上異質性增強,從而能夠很好地區別兩者。本例患者術前外院超聲與上述描述吻合,考慮瘤體增大影響了手部功能,患者因經濟條件問題,未予行術前MRI,術前擬根據術中快速病理判斷瘤體性質和治療方案。
病理檢查是診斷GCTTS的金標準。肉眼可見瘤體呈圓形或卵圓形,結節或分葉狀,界清,多有完整包膜,切面實性,呈棕色、棕褐色、黃色,甚至暗紅色,在大多數情況下,由于含鐵血黃素的沉積,顏色呈棕褐色[11]。顯微鏡下可見腫瘤主要由增生活躍的單核細胞、破骨細胞樣多核巨細胞、數量不等的泡沫細胞和纖維母細胞構成,其中混有以淋巴細胞為主的炎細胞,同時間質有不同程度的纖維化和含量不等的含鐵血黃素[12]。丁洪基等[12]根據GCTTS組織形態的特征,將其分為增生型、纖維組織細胞瘤樣型和纖維化型3種組織學類型,各型之間常有重疊,呈一譜系的變化規律。免疫組化多表達簇集素、CD163、CD68、波形蛋白和Ki-67,而CD34、結蛋白、平滑肌肌動蛋白、雌激素受體和孕激素受體常為陰性[12-13]。本例患者病理檢查符合上述描述。此外,RNA scope顯色原位雜交技術顯示GCTTS中集落刺激因子1 mRNA高表達,其用于診斷GCTTS的靈敏度和特異度分別高達100%和90%,是一種有價值的輔助診斷方法[14]。
發生于手部的L-GCTTS需與以下疾病鑒別:① 腱鞘纖維瘤[15-16]:該病多見于男性,是位于手部肌腱或腱鞘附近的界限清楚的纖維性結節腫瘤,腫瘤內的細胞是成纖維細胞,伴少量梭形纖維母細胞和散在的裂隙狀血管腔隙存在于致密的膠原性間質中,盡管具有與L-GCTS相似的好發部位和組織形態,但少見單核細胞、多核巨細胞和含鐵血黃素。利用超聲和MRI可較好地鑒別兩者,徐小麗等[15]認為GCTTS是包繞肌腱生長的形態不規則、不均勻伴鈣化且有骨侵蝕的包塊,而腱鞘纖維瘤則為肌腱旁或關節旁生長的形態規則、邊界清晰的實性包塊,多無骨侵蝕。此外,腱鞘纖維瘤在MRI下呈結節或腫塊狀,T2加權像上的內部低信號形態多呈細絲或者條帶狀,范圍多大于病灶的1/3,增強掃描顯示有明顯強化,而L-GCTTS多呈分葉狀,鄰近骨質可見吸收,T2加權像周圍可見低信號環,內部的低信號形態呈分隔狀或顆粒狀,范圍多小于病灶的1/3。② 神經鞘瘤[17]:有神經壓迫癥狀的GCTTS應與神經鞘瘤鑒別。神經鞘瘤的瘤體界限清楚,形態規則,部分呈橢圓形,超聲下常顯示實性低回聲,內部回聲欠均勻,常伴有囊變區,彩色多普勒血流成像提示少量血流信號,部分可有“鼠尾”征或“手表”征,是其特征性表現,組織學形態可具有特征性的柵欄樣或束狀排列,可據此進行鑒別。
盡管L-GCTTS是一種良性無痛性腫瘤,但常因瘤體增大影響患者生活和潛在的惡變性需及時治療。顯微外科輔助下行手術切除仍是治療GCTTS的主要手段[18]。腫瘤常與肌腱緊密相連,宜充分暴露瘤體,緊貼肌腱表面行銳性切除,避免不必要的組織殘留[19]。值得注意的是,據文獻報道GCTTS的局部復發率為9%~45%,復發增加了疾病惡變的風險[9, 20]。既往研究顯示,切除不徹底、腫瘤擴散、邊界不清、有衛星灶病變、累及肌腱、關節和骨內等可能導致復發風險較高[21-22]。其中復發主要與切除不徹底和殘留衛星病灶有關,因此,完整的初次手術切除是預防瘤體復發最有效的方法,可將復發率降低到6%[23]。盡管術后放療被報道可有效抑制GCTTS的復發,但是需要特別注意適應證并警惕潛在的不良反應[24-25]。Kotwal等[26]針對切除不充分和有絲分裂活動旺盛的GCTTS患者進行放療,使復發率降低到4%。此外,隨著對GCTTS病因及發病機制的不斷研究,自集落刺激因子1被發現在GCTTS中高度表達起,開發針對集落刺激因子1受體的選擇性酪氨酸激酶抑制劑便成為有治療前景的藥物。培西達替尼于2019年獲美國食品藥品監督管理局批準成為了首個獲準用于治療GCTTS的集落刺激因子1受體抑制劑,主要用于治療有嚴重并發癥且無法手術治療的成年GCTTS患者[27-28]。這一突破性成果為晚期GCTTS患者開辟了新的治療途徑,改善了生存質量。
綜上所述,盡管GCTTS是一種良性病變,但若影響了患者生活,常需及時處理,避免對周圍組織造成進一步的壓迫。對于那些病灶界限清楚,無明顯周圍軟組織破壞的病例,外科手術切除并遠期密切隨訪是首選的治療方式,術中應完整切除瘤體和包膜組織,減少遠期復發的概率。本病例報道旨在提高手外科專科醫師對多發GCTTS的認知,并回顧其臨床表現、影像學及病理學特征,幫助專科醫師優化診療策略。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,女,44歲,因“發現左示指及左掌側皮下無痛性腫物5年余”于2021年10月18日就診于吉林大學第二醫院(以下簡稱“我院”)手外科。患者自述于5年前發現左示指及左掌側可觸及4處無痛性皮下軟組織腫物,呈串珠樣分布,隨時間逐漸增大。2021年10月15日外院左手彩色多普勒超聲檢查結果示:左手示指肌腱旁可見4處低回聲結節,分別位于左示指近、遠節、左第二掌指關節和左手掌,大小分別為16.5 mm×6.3 mm(圖1a)、13.3 mm×8.5 mm(圖1b)、7.0 mm×3.8 mm(圖1c)和28.8 mm×11.3 mm(圖1d),較大者位于手掌側,形態規則,邊界清晰,內部回聲不均,未見明顯血流信號。患者為求進一步診治,遂于2021年10月18日就診于我院,門診以“左手多發腫物(性質待查)”收入手外科。
 圖1
患者腱鞘巨細胞瘤相關圖像
圖1
患者腱鞘巨細胞瘤相關圖像
a~d. 外院彩色多普勒超聲提示左手示指肌腱旁可見 4 處低回聲結節,分別位于左示指近、遠節、左第二掌指關節和左手掌,較大者位于手掌側,形態規則,邊界清晰,內部回聲不均,未見明顯血流信號;e. X 線片示骨質未見異常,左示指周圍軟組織影增厚;f~j. 術中所見瘤體位置及手術過程(圖 1f 中第 1 個白箭和圖 1g 中白箭為手掌腫物,圖 1f 中第 2 個白箭為左第二掌指關節腫物,圖 1f 中第 3、4 個白箭和圖 1h 中白箭為左示指近節和遠節腫物);k. CD163 免疫組化染色陽性(×200);l. CD68 免疫組化染色陽性(×200);m. Ki67 免疫組化染色陽性(×200);n. 結蛋白免疫組化染色陰性(×200)
入院體格檢查:體溫36.5℃,脈搏80次/min,呼吸頻率20次/min,血壓125/78mm Hg(1 mm Hg=0.133 kPa),身高 163 cm,體重55 kg,體質量指數20.7 kg/m2,營養及發育良好,無貧血貌。專科查體見左手部腫物質軟、界清、活動度差,觸壓痛陰性,示指遠端皮膚感覺稍有麻木,關節活動可。2021年10月19日入院血常規、血生化、肝腎功能、凝血功能無明顯異常。左手正斜位X線片示骨質未見異常,左示指周圍軟組織影增厚(圖1e)。經醫患溝通,患方決定采取手術治療。完善術前準備,排除手術禁忌證后,于10月20日行左手部軟組織病損切除術。術中患者取仰臥位,左手置于外展架,臂叢阻滯滿意后,手術在氣囊止血帶控制下進行。首先于腫物表面、手掌及示指作連續“Z”字切口,逐層切開,見腫物位于肌腱旁,侵及腱鞘。其中手掌腫物(圖1f中第1個白箭)大小約40 mm×35 mm,質硬,表面有包膜但不完整,位于魚際肌遠側,包繞在屈指深淺肌腱且大部分位于表面(圖1g),腱鞘大部分被侵及,指總動脈及神經受擠壓。示指近節屈指肌腱尺側見大小約20 mm×5 mm的縱行腫物(圖1f中第2個白箭),質硬,暗黃色,侵及腱鞘并向屈指肌腱深淺和背側延伸,被纖維組織分隔成多塊狀。近側指間關節尺側見一大小15 mm×15 mm腫物(圖1f中第3個白箭),質硬,暗黃色,位于肌腱表面偏尺側,侵及肌腱,并向肌腱背側長入。遠側指間關節尺側偏近側可見一大小約15 mm×15 mm腫物(圖1f中第4個白箭),位于屈肌腱表面并將其包繞。腫物將尺側指神經血管壓迫并移位。術中仔細分離腫物與周圍組織,并切除腫物粘連的腱鞘等軟組織,注意保護神經血管束,將位于肌腱之間和背側的腫物完整切除,僅留有遠側指間關節掌側、掌指關節掌側部分環形腱鞘(圖1h~1j)。術中組織送快速病理結果顯示為間葉源性腫瘤,考慮為腱鞘巨細胞瘤(giant cell tumor of tendon sheath, GCTTS)。松開止血帶,充分止血后沖洗,使用防粘連膜覆蓋肌腱、神經表面,逐層縫合,置引流條,無菌敷料包扎固定,術畢。10月26日術后常規病理結果顯示為間葉源性腫瘤,腫瘤大部分邊界較清楚,免疫組化染色結果示細胞高表達CD163(圖1k)、CD68(圖1l)和Ki67(圖1m),未表達結蛋白(圖1n),考慮為局限型GCTTS。術后隨訪2年,未見腫物復發。
討論 GCTTS在1852年被首次報道[1],其常表現為位于關節滑膜、滑囊或腱鞘附近、緩慢生長、質韌、多葉、無觸痛的良性軟組織腫塊,直徑多在1~3 cm[2]。GCTTS具有一定的性別傾向,好發于30~50歲女性[3]。根據不同的好發部位、生長方式和生物學特性,GCTTS可分為局限型(L-GCTTS)、彌漫關節外型(D-GCTTS)、彌漫關節內型(色素絨毛結節性滑膜炎)和惡性型(M-GCTTS),其中前2種最常見[4-5]。L-GCTTS好發于手和腳的肌腱腱鞘內,具有清晰的界限。而D-GCTTS常發生在大關節,其生長模式具有侵襲性,且復發率較高[6]。
影像學是診斷GCTTS的重要輔助手段。彩色多普勒超聲通常是軟組織腫瘤的首選影像學檢查,可實時動態觀察腫瘤與鄰近組織的位置關系和血流情況變化[7]。超聲下GCTTS通常表現為實性、界清腫塊,其形態多樣,大部分內部呈均勻、低回聲,少數內部可見點狀、片狀強回聲區或少許無回聲區,伴后方回聲不同程度增強。彩色多普勒血流成像顯示大多數腫塊內部血流豐富,部分腫塊內部僅見點狀血流信號或無明顯血流信號[8]。X線檢查常用于明確是否伴隨潛在的骨質破壞[9]。MRI目前是軟組織腫瘤術前評估腫瘤大小、范圍和鄰近關節和腱鞘間隙的最佳工具,在區分L-GCTTS和D-GCTTS方面準確性很高。Wang等[10]的研究對38例GCTTS患者進行MRI檢查,由于含鐵血黃素的存在,GCTTS通常在T1加權像和T2加權像上表現為低信號。與L-GCTS相比,D-GCTS的異質性更強,在T1加權像和T2加權像上有較大的低密度區域,在造影劑增強的T1加權像上異質性增強,從而能夠很好地區別兩者。本例患者術前外院超聲與上述描述吻合,考慮瘤體增大影響了手部功能,患者因經濟條件問題,未予行術前MRI,術前擬根據術中快速病理判斷瘤體性質和治療方案。
病理檢查是診斷GCTTS的金標準。肉眼可見瘤體呈圓形或卵圓形,結節或分葉狀,界清,多有完整包膜,切面實性,呈棕色、棕褐色、黃色,甚至暗紅色,在大多數情況下,由于含鐵血黃素的沉積,顏色呈棕褐色[11]。顯微鏡下可見腫瘤主要由增生活躍的單核細胞、破骨細胞樣多核巨細胞、數量不等的泡沫細胞和纖維母細胞構成,其中混有以淋巴細胞為主的炎細胞,同時間質有不同程度的纖維化和含量不等的含鐵血黃素[12]。丁洪基等[12]根據GCTTS組織形態的特征,將其分為增生型、纖維組織細胞瘤樣型和纖維化型3種組織學類型,各型之間常有重疊,呈一譜系的變化規律。免疫組化多表達簇集素、CD163、CD68、波形蛋白和Ki-67,而CD34、結蛋白、平滑肌肌動蛋白、雌激素受體和孕激素受體常為陰性[12-13]。本例患者病理檢查符合上述描述。此外,RNA scope顯色原位雜交技術顯示GCTTS中集落刺激因子1 mRNA高表達,其用于診斷GCTTS的靈敏度和特異度分別高達100%和90%,是一種有價值的輔助診斷方法[14]。
發生于手部的L-GCTTS需與以下疾病鑒別:① 腱鞘纖維瘤[15-16]:該病多見于男性,是位于手部肌腱或腱鞘附近的界限清楚的纖維性結節腫瘤,腫瘤內的細胞是成纖維細胞,伴少量梭形纖維母細胞和散在的裂隙狀血管腔隙存在于致密的膠原性間質中,盡管具有與L-GCTS相似的好發部位和組織形態,但少見單核細胞、多核巨細胞和含鐵血黃素。利用超聲和MRI可較好地鑒別兩者,徐小麗等[15]認為GCTTS是包繞肌腱生長的形態不規則、不均勻伴鈣化且有骨侵蝕的包塊,而腱鞘纖維瘤則為肌腱旁或關節旁生長的形態規則、邊界清晰的實性包塊,多無骨侵蝕。此外,腱鞘纖維瘤在MRI下呈結節或腫塊狀,T2加權像上的內部低信號形態多呈細絲或者條帶狀,范圍多大于病灶的1/3,增強掃描顯示有明顯強化,而L-GCTTS多呈分葉狀,鄰近骨質可見吸收,T2加權像周圍可見低信號環,內部的低信號形態呈分隔狀或顆粒狀,范圍多小于病灶的1/3。② 神經鞘瘤[17]:有神經壓迫癥狀的GCTTS應與神經鞘瘤鑒別。神經鞘瘤的瘤體界限清楚,形態規則,部分呈橢圓形,超聲下常顯示實性低回聲,內部回聲欠均勻,常伴有囊變區,彩色多普勒血流成像提示少量血流信號,部分可有“鼠尾”征或“手表”征,是其特征性表現,組織學形態可具有特征性的柵欄樣或束狀排列,可據此進行鑒別。
盡管L-GCTTS是一種良性無痛性腫瘤,但常因瘤體增大影響患者生活和潛在的惡變性需及時治療。顯微外科輔助下行手術切除仍是治療GCTTS的主要手段[18]。腫瘤常與肌腱緊密相連,宜充分暴露瘤體,緊貼肌腱表面行銳性切除,避免不必要的組織殘留[19]。值得注意的是,據文獻報道GCTTS的局部復發率為9%~45%,復發增加了疾病惡變的風險[9, 20]。既往研究顯示,切除不徹底、腫瘤擴散、邊界不清、有衛星灶病變、累及肌腱、關節和骨內等可能導致復發風險較高[21-22]。其中復發主要與切除不徹底和殘留衛星病灶有關,因此,完整的初次手術切除是預防瘤體復發最有效的方法,可將復發率降低到6%[23]。盡管術后放療被報道可有效抑制GCTTS的復發,但是需要特別注意適應證并警惕潛在的不良反應[24-25]。Kotwal等[26]針對切除不充分和有絲分裂活動旺盛的GCTTS患者進行放療,使復發率降低到4%。此外,隨著對GCTTS病因及發病機制的不斷研究,自集落刺激因子1被發現在GCTTS中高度表達起,開發針對集落刺激因子1受體的選擇性酪氨酸激酶抑制劑便成為有治療前景的藥物。培西達替尼于2019年獲美國食品藥品監督管理局批準成為了首個獲準用于治療GCTTS的集落刺激因子1受體抑制劑,主要用于治療有嚴重并發癥且無法手術治療的成年GCTTS患者[27-28]。這一突破性成果為晚期GCTTS患者開辟了新的治療途徑,改善了生存質量。
綜上所述,盡管GCTTS是一種良性病變,但若影響了患者生活,常需及時處理,避免對周圍組織造成進一步的壓迫。對于那些病灶界限清楚,無明顯周圍軟組織破壞的病例,外科手術切除并遠期密切隨訪是首選的治療方式,術中應完整切除瘤體和包膜組織,減少遠期復發的概率。本病例報道旨在提高手外科專科醫師對多發GCTTS的認知,并回顧其臨床表現、影像學及病理學特征,幫助專科醫師優化診療策略。
利益沖突:所有作者聲明不存在利益沖突。