引用本文: 陳小梅, 李壹, 王可. 體外膜肺氧合技術在惡性氣道狹窄的介入治療中的應用一例. 華西醫學, 2024, 39(4): 671-673. doi: 10.7507/1002-0179.202307083 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
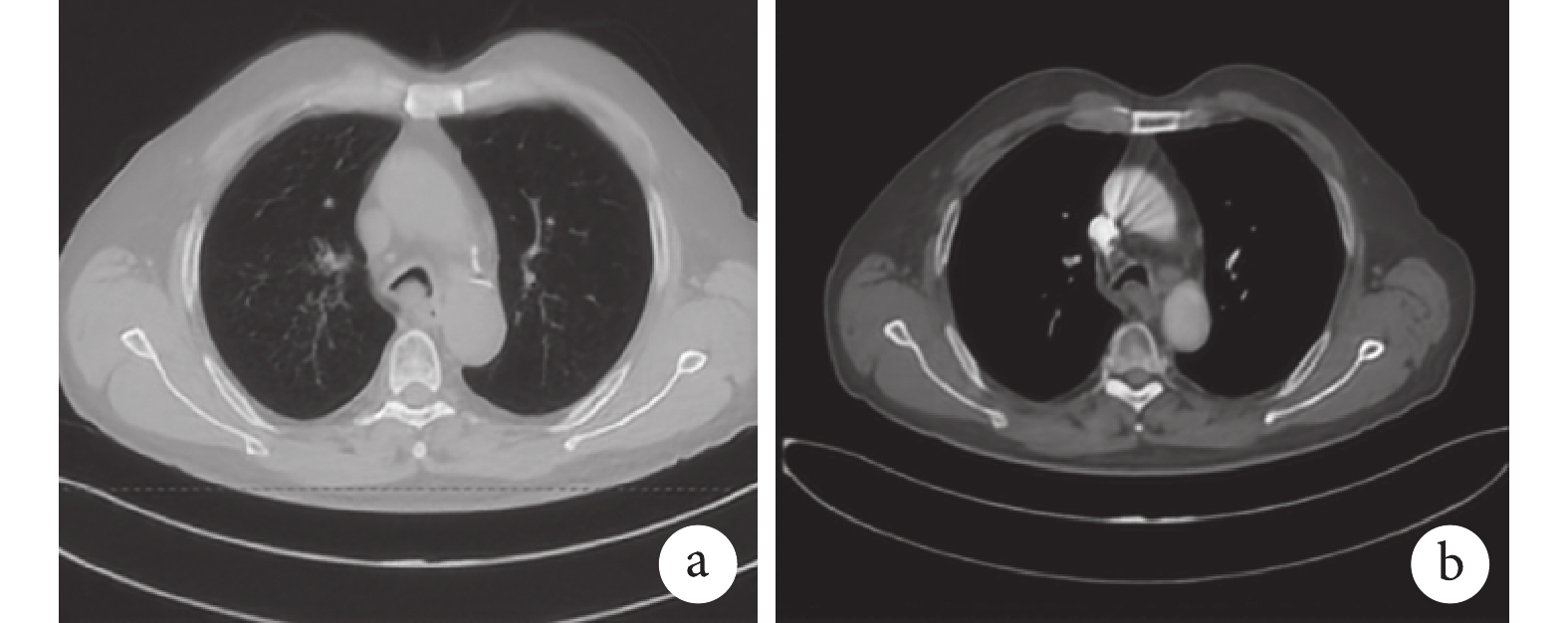
病例介紹 患者,男,67 歲,因“咳嗽、咳痰 6 個月,加重 2 周”于 2022 年 6 月 23 日入四川大學華西醫院(以下簡稱“我院”)呼吸與危重癥科。6 個月前患者冷水浴后出現咳嗽、咳痰,服用止咳藥后癥狀無緩解。2 周前癥狀加重,痰中帶血,伴呼吸困難、喘鳴。2022 年 6 月 21 日我院門診胸部增強 CT 提示:氣管隆突及左右主支氣管起始部壁增厚,腔內可見軟組織影,增強可見強化,與食管分界不清,多系腫瘤性病變;縱隔及雙肺門淋巴結增多、部分增大,以隆突下淋巴結為著。雙肺散在感染,右肺下葉為著(圖1)。
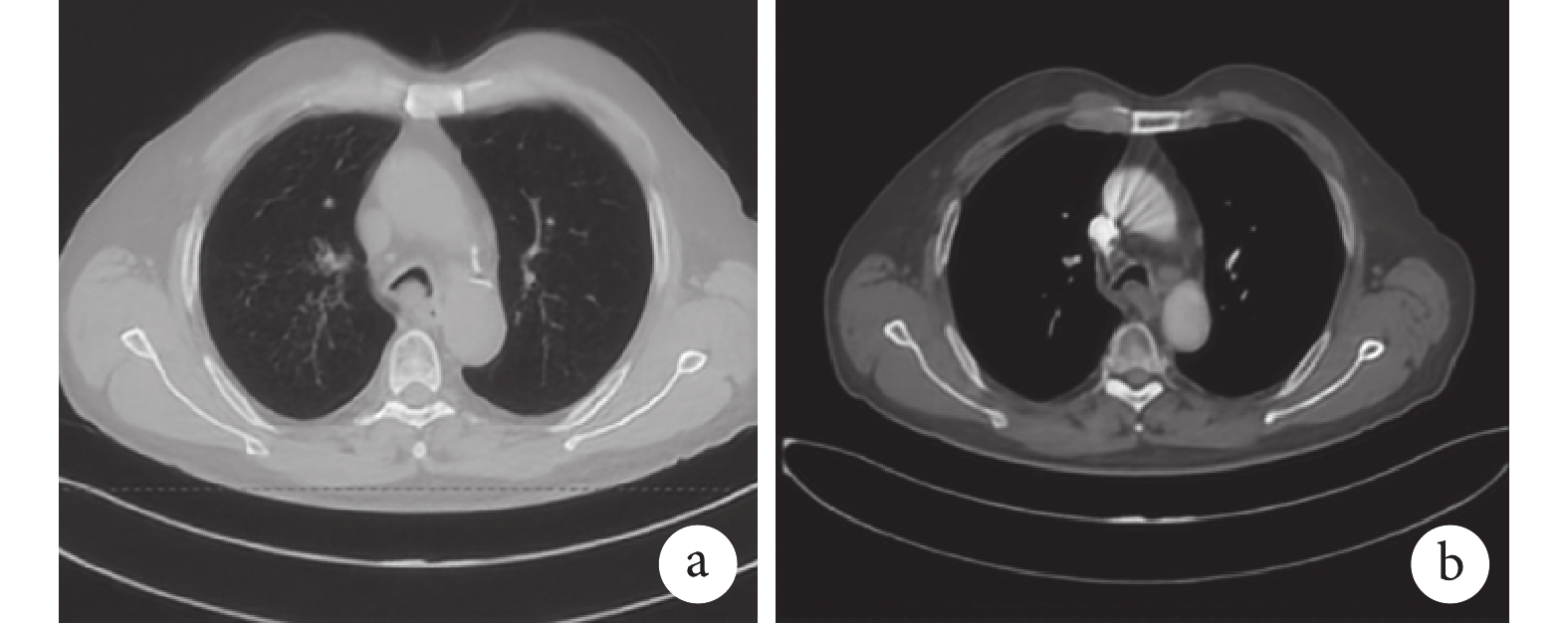 圖1
術前胸部 CT 像
圖1
術前胸部 CT 像
a. 縱隔窗成像;b. 肺窗成像。可見氣管下段左右主支氣管開口重度狹窄
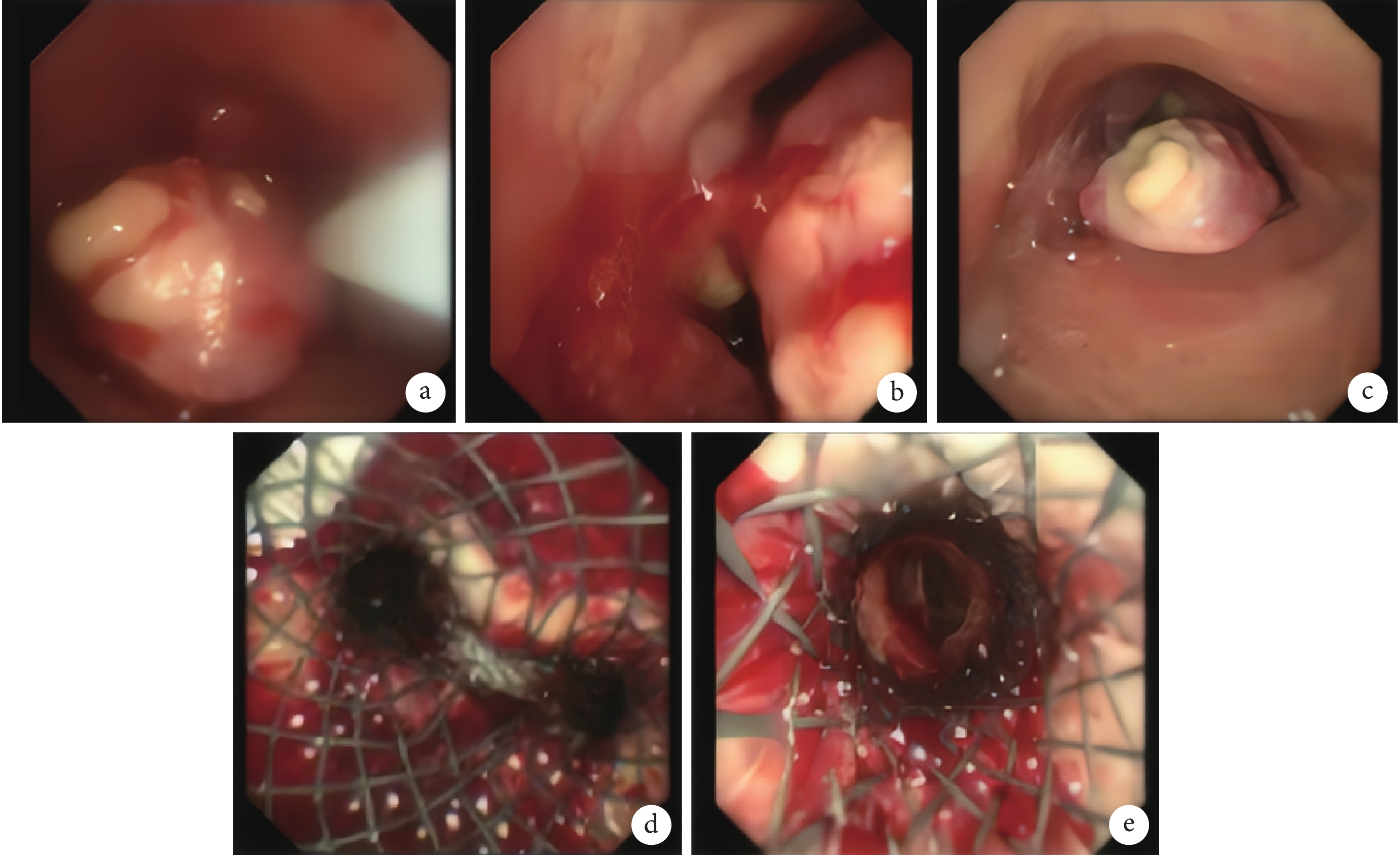
入院診斷:氣道下段腫瘤伴縱隔多發淋巴結轉移;氣道狹窄;肺炎。入院后完善胸部 CT 下肺動脈造影:肺動脈干及左右主干未見確切充盈缺損。2022 年 6 月 28 日在局部麻醉下行支氣管動脈造影及栓塞。2022 年 6 月 29 日轉入重癥監護室,無創呼吸支持,體力狀態評分(performance status, PS)4 分。實驗室檢查:白細胞計數 11.22×109/L、中性粒細胞百分比 86.8%、降鈣素原 5.33 ng/mL。予鹽酸莫西沙星、哌拉西林鈉他唑巴坦鈉抗感染及對癥支持治療。2022 年 7 月 1 日安置體外膜肺氧合技術(extracorporeal membrane oxygenation, ECMO)離心泵設備,實施靜-靜脈 ECMO 模式(veno-venous ECMO, VV-ECMO),情況穩定后在支氣管鏡下行氣道腫物活檢及氣管支架安置術。氣管鏡下表現:氣管下段后壁菜花樣新生物隆起至管腔重度狹窄,氣道被阻塞腔徑超過 70%,前壁浸潤樣結節隆起,直徑 2.8 mm 支氣管鏡可擠越通過,見左主氣管浸潤樣針尖狀狹窄伴膿性分泌物;右主支氣管浸潤樣變窄伴膿性分泌物。硬鏡下高頻圈套圈切氣管下段新生物送病理學檢查。經導鋼絲置入 NiTi 形狀記憶合金網狀支架(型號 MTN-QY-G-18/40-B-8/600,左主支氣管 30 mm、右主支氣管 20 mm)。置入的支架位置佳、擴張良好,與氣管及雙側主支氣管管壁貼附緊密,支架腔內通暢;直徑 4.2 mm 支氣管鏡清理雙側支氣管血跡及分泌物;氣管中上段環狀軟骨結構清晰,黏膜光滑,管腔通暢。隆突浸潤,支架置入后被支架覆蓋(圖2)。
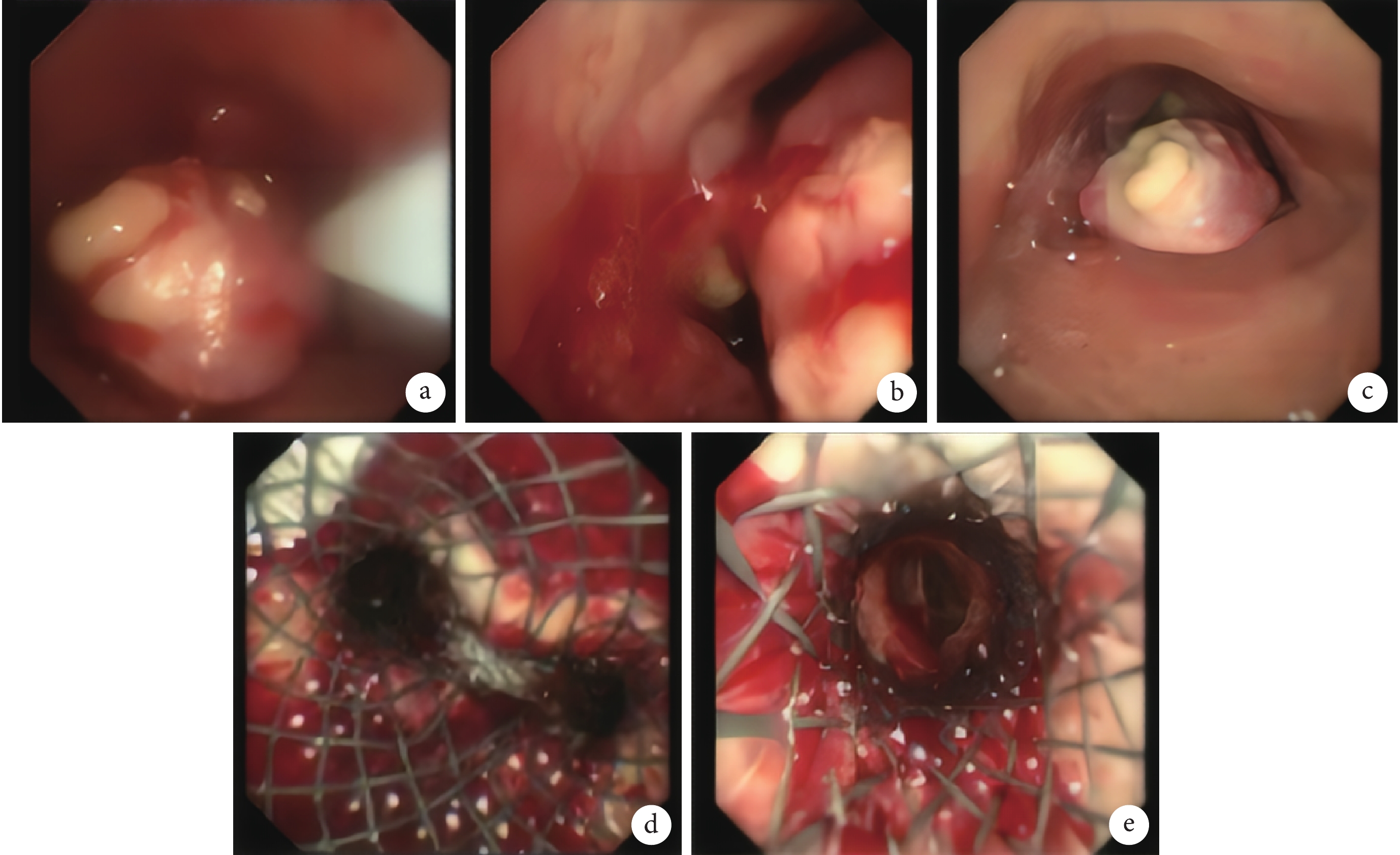 圖2
支氣管鏡下氣管支架安置術彩色像
圖2
支氣管鏡下氣管支架安置術彩色像
a. 氣管下段;b. 支架置入前突隆;c. 圈套電切時;d. 支架置入后突隆;e. 左主支氣管下沿
手術時間持續 2 h,患者術后生命體征平穩。術后 3 h 逐漸下調 ECMO 膜氧濃度,撤機前查血氣:pH 值 7.358,氧飽和度 99.8%,氧分壓 158.9 mm Hg(1 mm Hg=0.133 kPa),二氧化碳分壓 32.9 mm Hg。于 2022 年 7 月 2 日停用 ECMO,共運行 23 h,后續無創呼吸機及鼻導管吸氧治療。病情穩定后于 2022 年 7 月 5 日轉呼吸科普通病房后繼續抗感染。術后第 6 天患者 PS 1 分。氣管下段新生物病理回示:惡性腫瘤伴壞死,免疫組化染色:廣譜細胞角蛋白(+)、上皮膜抗原(+)、p63(?)、CK5/6(?)、p40(?)、CD56(+)、突觸素(+)、嗜鉻素 A(+)、甲狀腺轉錄因子-1(+)、細胞角蛋白 7(+)、BerEp4(+)、S-100(?)、白細胞共同抗原(?)、Ki-67(+,90%),病理結果支持為小細胞癌。2022 年 7 月 8 日完善胸部及全腹增強 CT:縱隔、肺門淋巴結轉移、肝臟多發轉移。2022 年 7 月 8 日全身骨掃描、頭顱增強 CT:未見異常。腫瘤分期:T4N2M1b Ⅳa 期。
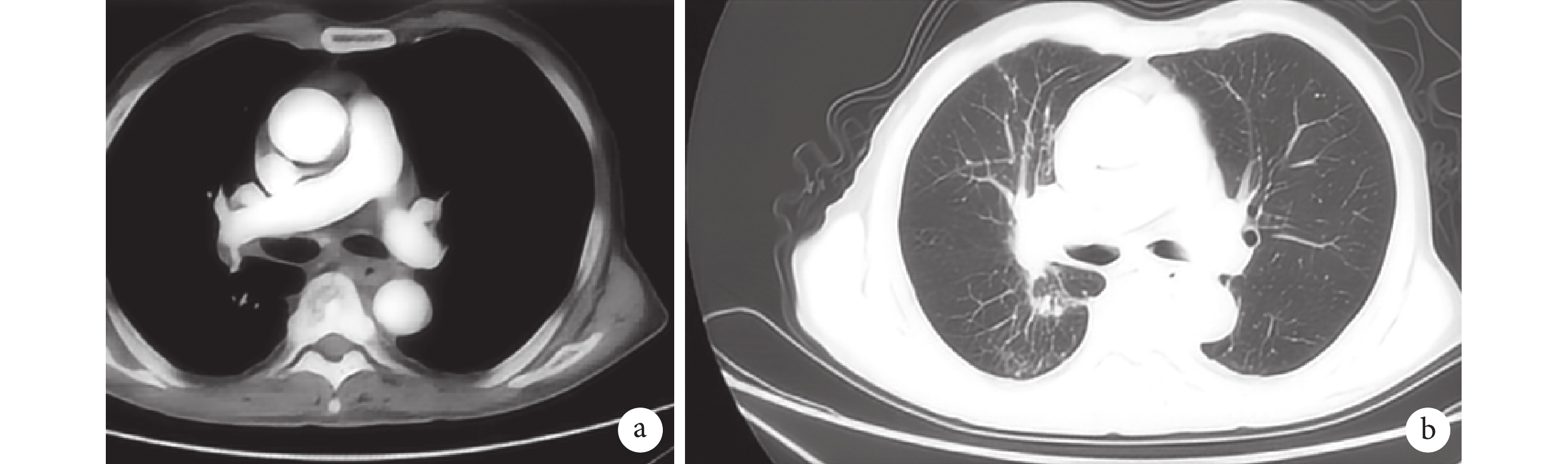
排除禁忌后,患者于 2022 年 7 月 14 日開始行第 1 個周期依托泊苷+卡鉑+度伐尤利單抗化學治療(化療)及免疫治療,過程順利,于 2022 年 7 月 20 日出院。出院后第21 天再次入院行規律化療,同時進行局部放射治療(放療)。術后 1 個月復查支氣管鏡:氣管及雙側主支氣管管壁貼附緊密,支架腔內通暢;隆突浸潤明顯縮小。規律放化療 3 個療程后復查氣道腫物消失,氣道梗阻解除,在纖維支氣管鏡下順利取出支架(圖3)。
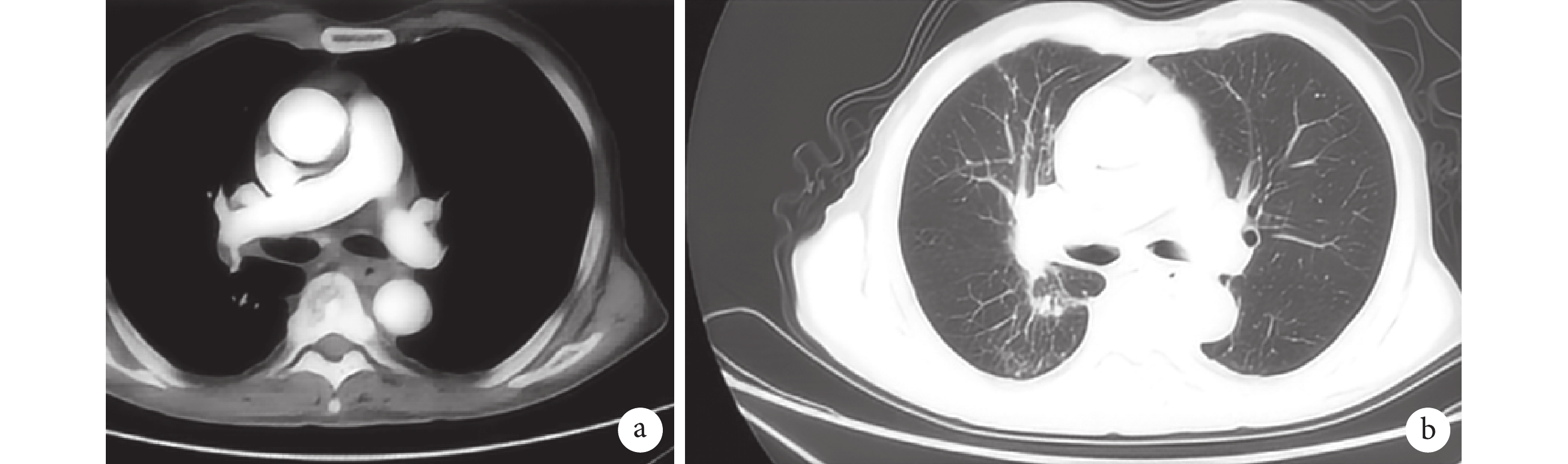 圖3
規律放化療 3 個療程后取出支氣管支架后復查胸部 CT 像
圖3
規律放化療 3 個療程后取出支氣管支架后復查胸部 CT 像
a. 縱隔窗成像;b. 肺窗成像。可見,氣管下段左右主支氣管管腔通暢
討論 惡性中心氣道狹窄是指氣管、主隆突和主支氣管的管腔直徑的縮小,多由原發或轉移的惡性腫瘤引起[1]。癥狀包括喘息、咳嗽、喘鳴、咯血或胸痛,具體取決于氣道狹窄程度。氣管狹窄至<8 mm,患者會出現呼吸困難;直徑<5 mm,會出現呼吸窘迫。惡性中心氣道狹窄早期無癥狀或癥狀輕微,往往被忽視,導致患者失去接受腫瘤治療的機會,影響總體生存期。當患者氣道狹窄程度很重時會出現呼吸困難加重,給臨床治療帶來一定的風險和困難。既往針對中心氣道狹窄可以采取手術治療或局部放療,但如果病變范圍較廣,很難完整切除并且術后容易形成吻合口瘺;而局部放療后組織水腫,可能進一步加重患者的呼吸困難。支氣管鏡介入手術治療是目前治療惡性氣道狹窄最有效的方法之一[2-4]。但介入手術與患者通氣共用 1 條通道,往往會增加介入手術的難度。干預期間擔心氣道大面積堵塞會給患者造成危及生命的情況下,運用短期 ECMO 提供手術過程中的通氣和氧合支持,已經被多中心證實為一種安全可靠的輔助措施[5-7]。
ECMO 以體外循環系統為基礎,采用體外循環技術進行生命支持,其主要目的是提供血液氧合和排除二氧化碳,保障全身有效血供,為心肺功能衰竭的危重癥患者的搶救、復蘇和治療贏取寶貴時間[8]。沒有心功能不全的患者可以接受 VV-ECMO,而有心功能不全的患者可以接受靜動脈 ECMO[9-10]。因此,通過 ECOM 技術,能有效地為患者在氣道介入手術期間提供充分的氧合和排除二氧化碳,力保氣道介入手術的順利完成。
本文報道患者支氣管腫物體積較大,覆蓋面積較廣,血供豐富,氣管壁容易受到損傷而發生破裂導致大咯血。為防止新生物活檢及切除術中患者出現大咯血,同時為介入手術提供清晰的手術視野,本研究小組在局部麻醉下行支氣管動脈造影及栓塞。由于患者就診時已存在嚴重呼吸困難,PS 4 分,無法接受后續的放療、手術等抗腫瘤治療,為保障氧合,選擇在患者右側頸內靜脈置管及右側股靜脈置管的 VV-ECMO 模式,并在其支持下成功地實行了氣管鏡下新生物活檢及新生物部分切除。在 ECMO 支持下,本研究小組成功地經導鋼絲置入 NiTi 形狀記憶合金網狀支架。氣管內支架置入可以緩解患者癥狀,改善患者肺功能,并且支架的機械壓迫作用使殘留的腫瘤組織發生壞死,同時為進一步治療爭取時間。介入手術過程順利,術后患者呼吸通暢,心肺功能穩定正常,23 h 后 ECOM 撤機,患者 PS 1 分,為后續的抗腫瘤治療贏得了時機。術后第 7 天復查,支架位置固定,擴張良好,切口部位無明顯出血及炎性滲出。停止抗感染治療后行小細胞癌的化療聯合免疫治療的輔助治療方案。經過 1 個周期的治療后,患者復查胸部增強 CT 發現殘留腫塊體積明顯縮小,其也不再有呼吸困難、氣緊胸悶等不適。該例患者后續治療方案為依托泊苷+卡鉑聯合度伐利尤單抗免疫治療,1 個周期化療后行同步放療,第 3 個周期化療加放療結束后擇期取出 Y 型支架并繼續免疫治療。
在既往的研究中,有研究報道了其所在的研究中心 3 年期間進行的 19 例 VV-ECOM 作為輔助支持切除惡性腫瘤引起的嚴重氣道狹窄,中位 ECMO 使用時間為 20.9(2.2,113.4)h;1 例患者在切除惡性腫塊后因大出血而死亡,其余 18 例成功撤除 ECMO 治療[11]。VV-ECMO 對中惡性氣道狹窄的患者有用,它可以在執行救生程序的同時提供短期氣道安全[12]。在支氣管惡性腫瘤的切除中,VV-ECOM 除了提供臨時性或者過渡性肺支持,還帶來很多其他方面的益處。首先,與傳統輔助通氣技術相比,ECOM 的運用可以為腫瘤切除手術提供相對寬廣和干凈的區域,從而保證最佳的解剖位置和最精確的縫合并減少術后感染,可以在完全穩定的情況下進行手術,為實現腫瘤完全切除提供幫助。其次,使用 ECMO 的另一個預期好處是防止腫瘤細胞擴散。ECMO 是由一個封閉的循環系統組成,腫瘤細胞以及來自手術區的其他細胞碎片不會被吹入肺內或重新引入血管引起播散[9]。雖然 ECMO 在輔助介入手術的益處顯而易見,但在其使用過程中可能存在的風險也需要被重視。ECMO 運行管理期間面臨著各類并發癥和相關風險,在一項針對 VV-ECMO 的回顧性研究結果顯示,40.2%發生≥1 次出血或血栓事件,其中血栓事件發生率為 54.9%,出血事件發生率為 45.1%[13]。也有報道顯示,使用 ECMO 輔助期間感染的發生率為 5.7%~64.0%。以血流感染和呼吸道感染為主[14-15],這些感染的發生不僅會增加患者的治療費用和住院時間,還會增加患者的病死率。本研究小組充分考慮上述 ECMO 使用中的風險,規范使用抗凝劑及預防性抗感染,運用 ECMO 為患者提供了短期的過渡肺支持,使支氣管鏡下新生物的活檢及切除以及“Y”型支架的置入得以順利進行,成功解除患者的惡性氣道梗阻。在本文中,ECMO 運行 23 h 后成功撤機,患者在撤機后未出現新發感染,全身未見明顯出血或血栓等并發癥。
綜上,ECMO 技術因其強大呼吸循環支持功能和建立快捷、安全性高等優勢,針對嚴重、緊急氣道阻塞患者短期應用 ECMO,能迅速控制病情,緩解呼吸衰竭,為原發病診治爭取時間,為后續惡性腫瘤的治療贏得機會。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,男,67 歲,因“咳嗽、咳痰 6 個月,加重 2 周”于 2022 年 6 月 23 日入四川大學華西醫院(以下簡稱“我院”)呼吸與危重癥科。6 個月前患者冷水浴后出現咳嗽、咳痰,服用止咳藥后癥狀無緩解。2 周前癥狀加重,痰中帶血,伴呼吸困難、喘鳴。2022 年 6 月 21 日我院門診胸部增強 CT 提示:氣管隆突及左右主支氣管起始部壁增厚,腔內可見軟組織影,增強可見強化,與食管分界不清,多系腫瘤性病變;縱隔及雙肺門淋巴結增多、部分增大,以隆突下淋巴結為著。雙肺散在感染,右肺下葉為著(圖1)。
 圖1
術前胸部 CT 像
圖1
術前胸部 CT 像
a. 縱隔窗成像;b. 肺窗成像。可見氣管下段左右主支氣管開口重度狹窄
入院診斷:氣道下段腫瘤伴縱隔多發淋巴結轉移;氣道狹窄;肺炎。入院后完善胸部 CT 下肺動脈造影:肺動脈干及左右主干未見確切充盈缺損。2022 年 6 月 28 日在局部麻醉下行支氣管動脈造影及栓塞。2022 年 6 月 29 日轉入重癥監護室,無創呼吸支持,體力狀態評分(performance status, PS)4 分。實驗室檢查:白細胞計數 11.22×109/L、中性粒細胞百分比 86.8%、降鈣素原 5.33 ng/mL。予鹽酸莫西沙星、哌拉西林鈉他唑巴坦鈉抗感染及對癥支持治療。2022 年 7 月 1 日安置體外膜肺氧合技術(extracorporeal membrane oxygenation, ECMO)離心泵設備,實施靜-靜脈 ECMO 模式(veno-venous ECMO, VV-ECMO),情況穩定后在支氣管鏡下行氣道腫物活檢及氣管支架安置術。氣管鏡下表現:氣管下段后壁菜花樣新生物隆起至管腔重度狹窄,氣道被阻塞腔徑超過 70%,前壁浸潤樣結節隆起,直徑 2.8 mm 支氣管鏡可擠越通過,見左主氣管浸潤樣針尖狀狹窄伴膿性分泌物;右主支氣管浸潤樣變窄伴膿性分泌物。硬鏡下高頻圈套圈切氣管下段新生物送病理學檢查。經導鋼絲置入 NiTi 形狀記憶合金網狀支架(型號 MTN-QY-G-18/40-B-8/600,左主支氣管 30 mm、右主支氣管 20 mm)。置入的支架位置佳、擴張良好,與氣管及雙側主支氣管管壁貼附緊密,支架腔內通暢;直徑 4.2 mm 支氣管鏡清理雙側支氣管血跡及分泌物;氣管中上段環狀軟骨結構清晰,黏膜光滑,管腔通暢。隆突浸潤,支架置入后被支架覆蓋(圖2)。
 圖2
支氣管鏡下氣管支架安置術彩色像
圖2
支氣管鏡下氣管支架安置術彩色像
a. 氣管下段;b. 支架置入前突隆;c. 圈套電切時;d. 支架置入后突隆;e. 左主支氣管下沿
手術時間持續 2 h,患者術后生命體征平穩。術后 3 h 逐漸下調 ECMO 膜氧濃度,撤機前查血氣:pH 值 7.358,氧飽和度 99.8%,氧分壓 158.9 mm Hg(1 mm Hg=0.133 kPa),二氧化碳分壓 32.9 mm Hg。于 2022 年 7 月 2 日停用 ECMO,共運行 23 h,后續無創呼吸機及鼻導管吸氧治療。病情穩定后于 2022 年 7 月 5 日轉呼吸科普通病房后繼續抗感染。術后第 6 天患者 PS 1 分。氣管下段新生物病理回示:惡性腫瘤伴壞死,免疫組化染色:廣譜細胞角蛋白(+)、上皮膜抗原(+)、p63(?)、CK5/6(?)、p40(?)、CD56(+)、突觸素(+)、嗜鉻素 A(+)、甲狀腺轉錄因子-1(+)、細胞角蛋白 7(+)、BerEp4(+)、S-100(?)、白細胞共同抗原(?)、Ki-67(+,90%),病理結果支持為小細胞癌。2022 年 7 月 8 日完善胸部及全腹增強 CT:縱隔、肺門淋巴結轉移、肝臟多發轉移。2022 年 7 月 8 日全身骨掃描、頭顱增強 CT:未見異常。腫瘤分期:T4N2M1b Ⅳa 期。
排除禁忌后,患者于 2022 年 7 月 14 日開始行第 1 個周期依托泊苷+卡鉑+度伐尤利單抗化學治療(化療)及免疫治療,過程順利,于 2022 年 7 月 20 日出院。出院后第21 天再次入院行規律化療,同時進行局部放射治療(放療)。術后 1 個月復查支氣管鏡:氣管及雙側主支氣管管壁貼附緊密,支架腔內通暢;隆突浸潤明顯縮小。規律放化療 3 個療程后復查氣道腫物消失,氣道梗阻解除,在纖維支氣管鏡下順利取出支架(圖3)。
 圖3
規律放化療 3 個療程后取出支氣管支架后復查胸部 CT 像
圖3
規律放化療 3 個療程后取出支氣管支架后復查胸部 CT 像
a. 縱隔窗成像;b. 肺窗成像。可見,氣管下段左右主支氣管管腔通暢
討論 惡性中心氣道狹窄是指氣管、主隆突和主支氣管的管腔直徑的縮小,多由原發或轉移的惡性腫瘤引起[1]。癥狀包括喘息、咳嗽、喘鳴、咯血或胸痛,具體取決于氣道狹窄程度。氣管狹窄至<8 mm,患者會出現呼吸困難;直徑<5 mm,會出現呼吸窘迫。惡性中心氣道狹窄早期無癥狀或癥狀輕微,往往被忽視,導致患者失去接受腫瘤治療的機會,影響總體生存期。當患者氣道狹窄程度很重時會出現呼吸困難加重,給臨床治療帶來一定的風險和困難。既往針對中心氣道狹窄可以采取手術治療或局部放療,但如果病變范圍較廣,很難完整切除并且術后容易形成吻合口瘺;而局部放療后組織水腫,可能進一步加重患者的呼吸困難。支氣管鏡介入手術治療是目前治療惡性氣道狹窄最有效的方法之一[2-4]。但介入手術與患者通氣共用 1 條通道,往往會增加介入手術的難度。干預期間擔心氣道大面積堵塞會給患者造成危及生命的情況下,運用短期 ECMO 提供手術過程中的通氣和氧合支持,已經被多中心證實為一種安全可靠的輔助措施[5-7]。
ECMO 以體外循環系統為基礎,采用體外循環技術進行生命支持,其主要目的是提供血液氧合和排除二氧化碳,保障全身有效血供,為心肺功能衰竭的危重癥患者的搶救、復蘇和治療贏取寶貴時間[8]。沒有心功能不全的患者可以接受 VV-ECMO,而有心功能不全的患者可以接受靜動脈 ECMO[9-10]。因此,通過 ECOM 技術,能有效地為患者在氣道介入手術期間提供充分的氧合和排除二氧化碳,力保氣道介入手術的順利完成。
本文報道患者支氣管腫物體積較大,覆蓋面積較廣,血供豐富,氣管壁容易受到損傷而發生破裂導致大咯血。為防止新生物活檢及切除術中患者出現大咯血,同時為介入手術提供清晰的手術視野,本研究小組在局部麻醉下行支氣管動脈造影及栓塞。由于患者就診時已存在嚴重呼吸困難,PS 4 分,無法接受后續的放療、手術等抗腫瘤治療,為保障氧合,選擇在患者右側頸內靜脈置管及右側股靜脈置管的 VV-ECMO 模式,并在其支持下成功地實行了氣管鏡下新生物活檢及新生物部分切除。在 ECMO 支持下,本研究小組成功地經導鋼絲置入 NiTi 形狀記憶合金網狀支架。氣管內支架置入可以緩解患者癥狀,改善患者肺功能,并且支架的機械壓迫作用使殘留的腫瘤組織發生壞死,同時為進一步治療爭取時間。介入手術過程順利,術后患者呼吸通暢,心肺功能穩定正常,23 h 后 ECOM 撤機,患者 PS 1 分,為后續的抗腫瘤治療贏得了時機。術后第 7 天復查,支架位置固定,擴張良好,切口部位無明顯出血及炎性滲出。停止抗感染治療后行小細胞癌的化療聯合免疫治療的輔助治療方案。經過 1 個周期的治療后,患者復查胸部增強 CT 發現殘留腫塊體積明顯縮小,其也不再有呼吸困難、氣緊胸悶等不適。該例患者后續治療方案為依托泊苷+卡鉑聯合度伐利尤單抗免疫治療,1 個周期化療后行同步放療,第 3 個周期化療加放療結束后擇期取出 Y 型支架并繼續免疫治療。
在既往的研究中,有研究報道了其所在的研究中心 3 年期間進行的 19 例 VV-ECOM 作為輔助支持切除惡性腫瘤引起的嚴重氣道狹窄,中位 ECMO 使用時間為 20.9(2.2,113.4)h;1 例患者在切除惡性腫塊后因大出血而死亡,其余 18 例成功撤除 ECMO 治療[11]。VV-ECMO 對中惡性氣道狹窄的患者有用,它可以在執行救生程序的同時提供短期氣道安全[12]。在支氣管惡性腫瘤的切除中,VV-ECOM 除了提供臨時性或者過渡性肺支持,還帶來很多其他方面的益處。首先,與傳統輔助通氣技術相比,ECOM 的運用可以為腫瘤切除手術提供相對寬廣和干凈的區域,從而保證最佳的解剖位置和最精確的縫合并減少術后感染,可以在完全穩定的情況下進行手術,為實現腫瘤完全切除提供幫助。其次,使用 ECMO 的另一個預期好處是防止腫瘤細胞擴散。ECMO 是由一個封閉的循環系統組成,腫瘤細胞以及來自手術區的其他細胞碎片不會被吹入肺內或重新引入血管引起播散[9]。雖然 ECMO 在輔助介入手術的益處顯而易見,但在其使用過程中可能存在的風險也需要被重視。ECMO 運行管理期間面臨著各類并發癥和相關風險,在一項針對 VV-ECMO 的回顧性研究結果顯示,40.2%發生≥1 次出血或血栓事件,其中血栓事件發生率為 54.9%,出血事件發生率為 45.1%[13]。也有報道顯示,使用 ECMO 輔助期間感染的發生率為 5.7%~64.0%。以血流感染和呼吸道感染為主[14-15],這些感染的發生不僅會增加患者的治療費用和住院時間,還會增加患者的病死率。本研究小組充分考慮上述 ECMO 使用中的風險,規范使用抗凝劑及預防性抗感染,運用 ECMO 為患者提供了短期的過渡肺支持,使支氣管鏡下新生物的活檢及切除以及“Y”型支架的置入得以順利進行,成功解除患者的惡性氣道梗阻。在本文中,ECMO 運行 23 h 后成功撤機,患者在撤機后未出現新發感染,全身未見明顯出血或血栓等并發癥。
綜上,ECMO 技術因其強大呼吸循環支持功能和建立快捷、安全性高等優勢,針對嚴重、緊急氣道阻塞患者短期應用 ECMO,能迅速控制病情,緩解呼吸衰竭,為原發病診治爭取時間,為后續惡性腫瘤的治療贏得機會。
利益沖突:所有作者聲明不存在利益沖突。