引用本文: 吳夢華, 何為民, 王永生, 李林娟, 李艷瑩. 免疫檢查點抑制劑引發甲狀腺功能減退性心肌病一例. 華西醫學, 2024, 39(6): 1000-1002. doi: 10.7507/1002-0179.202401091 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
病例介紹 患者,女,57 歲,因“確診肺癌 17 個月,肺癌術后 9 個月,氣緊 10+ d”于 2022 年 10 月 5 日入四川大學華西醫院胸部腫瘤科。2021 年 4 月患者出現間斷咳嗽、咳黃痰,伴胸悶不適,反復發作。患者于 2021 年 5 月在當地醫院完善胸部 CT 提示:左肺下葉背段腫塊,大小約 5.4 cm×4.5 cm,縱隔淋巴結腫大。行肺穿刺病理活檢提示腺癌。腹部增強 CT、全身骨顯像、頭部 MRI 未見明顯異常。基因檢測:未檢測出敏感突變基因。患者診斷為左下肺腺癌伴縱隔淋巴結轉移(cT3N2M0 Ⅲb 期)。2021 年 6 月—11 月患者在當地醫院行 6 個周期治療:培美曲塞 700 mg 第 1 天(day 1, D1)+卡鉑 550 mg D1+卡瑞利珠單抗 200 mg D1+貝伐珠單抗 400 mg D1,每 3 周 1 次,最佳療效為腫瘤部分緩解。2022 年 1 月患者完善術前檢查,甲狀腺功能、心電圖、心臟彩色多普勒超聲(彩超)等均基本正常,于 2022 年 1 月 5 日在當地醫院行“胸腔鏡下左肺下葉切除術”,術后病理:(左肺下葉)浸潤性腺癌,各組淋巴結均未查見癌轉移。術后 1 個月患者在當地醫院行 1 個周期卡瑞利珠單抗+貝伐珠單抗治療和 1 個周期培美曲塞+卡瑞利珠單抗+貝伐珠單抗治療,之后定期復查 CT。2022 年 6 月患者復查 CT 示雙肺結節,考慮轉移,再次穿刺仍為腺癌。當地醫院給予吉西他濱+順鉑+貝伐珠單抗治療 1 個周期,同時完善組織基因檢測,結果顯示:KRAS G12D、EGFR 19 del。患者化療 1 個周期后復查療效評價為疾病穩定(腫瘤略長大)。2022 年 8 月 4 日患者開始口服奧希替尼 80 mg 1 次/d,2022 年 9 月 8 日復查 CT 療效評價為疾病穩定,繼續服用奧希替尼。
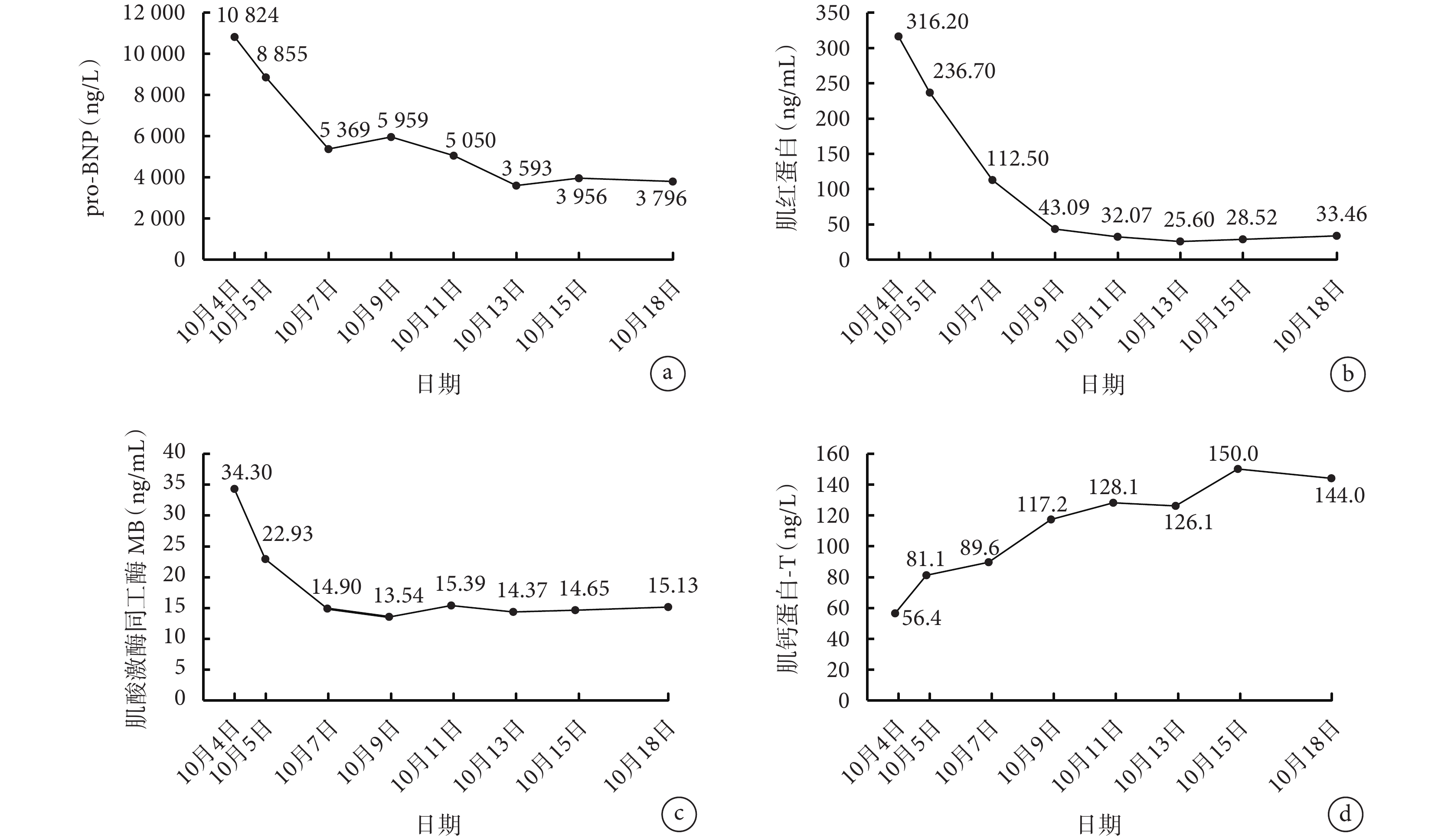
2022 年 9 月下旬患者無明顯誘因出現活動后氣緊、乏力、咳嗽、咳黃痰,逐漸加重,不能平臥。2022 年 10 月 4 日患者至四川大學華西醫院急診科,體格檢查:急性病容,雙下肺叩濁、呼吸音降低,余無明顯異常。實驗室檢查:肌紅蛋白 316.20 ng/mL,肌酸激酶同工酶 MB 質量 34.30 ng/mL,腦鈉肽前體(pro-brain natriuretic peptide, pro-BNP)
患者于 2022 年 10 月 5 日入住四川大學華西醫院胸部腫瘤科。考慮患者存在肺部感染、心力衰竭(心衰),給予達格列凈 10 mg 1 次/d、托拉塞米 5 mg 1 次/d、螺內酯 20 mg 1 次/d、頭孢美唑 1.0 g 2 次/d 治療。10 月 5 日復查心肌標志物和 pro-BNP 均較 10 月 4 日下降。10 月 6 日查甲狀腺激素:促甲狀腺激素(thyroid-stimulating hormone, TSH)>100 mU/L,三碘甲狀腺原氨酸<0.3 nmol/L,游離三碘甲狀腺原氨酸<0.6 pmol/L,甲狀腺素 7.0 nmol/L,游離甲狀腺素(free tetraiodothyronine, FT4)0.69 pmol/L。查胸腔和心包腔彩超:右側胸腔查見最大深度約 4.6 cm 的無回聲區,左側胸腔查見最大深度約 3.7 cm 的無回聲區;心包腔查見片狀無回聲區,最大深度約 0.5 cm。查心電圖為正常心電圖。心臟彩超結果:左心增大,升主動脈稍增寬;射血分數 25%,左心室收縮功能測值明顯減低;二尖瓣反流(中度);主動脈瓣及三尖瓣反流(輕-中度)。患者既往無高血壓、心臟病、糖尿病病史,無反復心悸、胸前區疼痛、活動后氣緊等既往史,且 9+ 個月前(2022 年 1 月)患者心臟彩超射血分數正常,未見明顯異常。考慮患者此次射血分數明顯下降為近期發生的心肌損害所致。國內回顧性分析報道免疫相關性心肌炎的中位發生時間為免疫檢查點抑制劑(immune checkpoint inhibitor, ICI)用藥后 38 d,81.2% 發生在 ICI 用藥的第 1~2 次[1]。患者發生心衰癥狀時距開始 ICI 治療已超過 7 個月,免疫性心肌炎可能性小。患者甲狀腺激素較既往明顯下降,考慮是近期出現的嚴重甲狀腺功能減退(甲減),心臟問題多系甲減性心肌病。于 10 月 7 日給予左甲狀腺素鈉 25 μg 1 次/d,10 月 12 日增至 50 μg 1 次/d,同時行右側胸腔穿刺置管,引流出洗肉水樣胸腔積液,胸腔積液脫落細胞學查見核異型細胞。經抗感染、糾正心衰、糾正甲減、引流胸腔積液等處理后,患者氣緊、乏力、咳嗽咳痰等癥狀逐漸好轉,心肌標志物迅速下降(圖1)。考慮患者在沒有使用激素的情況下心肌標志物明顯好轉,排除了免疫性心肌炎的可能。2022 年 10 月 15 日復查甲狀腺激素,TSH>100 mU/L,FT4 2.08 pmol/L,較前有所好轉。2022 年 10 月 18 日復查心臟彩超,心臟射血分數 29%,較前略有好轉,于 2022 年 10 月 19 日出院。
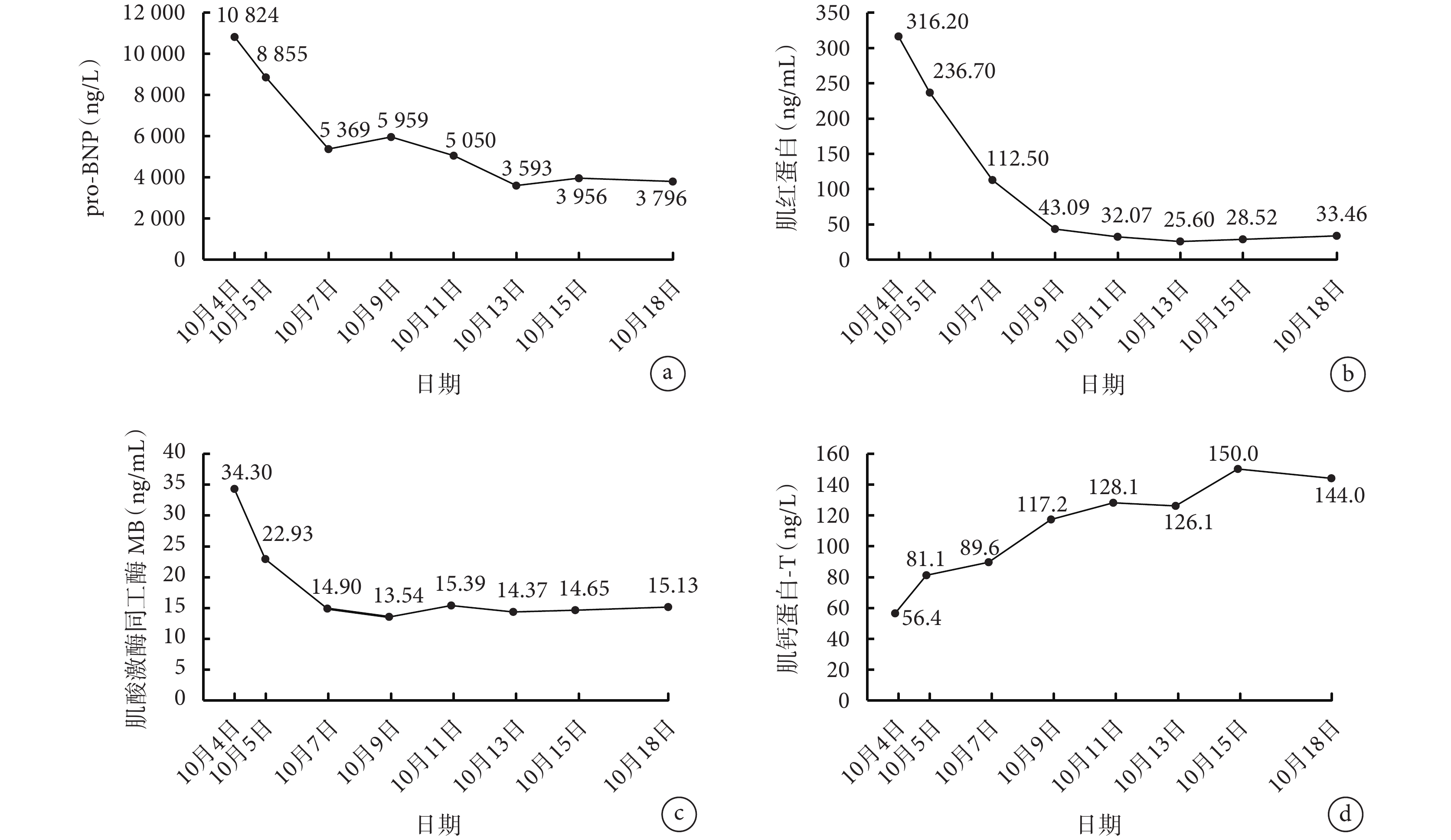 圖1
患者入院治療期間 pro-BNP 及心肌標志物的變化情況
圖1
患者入院治療期間 pro-BNP 及心肌標志物的變化情況
pro-BNP:腦鈉肽前體
出院后患者繼續服用左甲狀腺素鈉、達格列凈、螺內酯、托拉塞米。2022 年 12 月 13 日患者于四川大學華西醫院門診復診,未訴乏力、氣緊,查心肌標志物:肌紅蛋白 33.13 ng/mL,肌酸激酶同工酶 MB 2.03 ng/mL,pro-BNP
討論 ICI 包括程序性死亡受體-1(programmed death-1, PD-1)抑制劑、程序性細胞死亡受體配體-1(programmed death-ligand 1, PD-L1)、細胞毒性 T 淋巴細胞相關蛋白 4 等[2]。ICI 可以恢復免疫系統殺死腫瘤細胞的能力,近年來已成為腫瘤治療和研究領域的熱點,目前在腫瘤的治療中發揮了重要作用[3-4]。此類藥物可能導致類似于自身免疫性疾病的毒性反應,包括皮疹、結腸炎、內分泌毒性及肝炎等[5]。目前已有一些關于 ICI 相關不良反應的報告[6],但我們認為臨床上對發生 ICI 相關不良反應的關注仍然不夠。如本例患者在 ICI 治療后未進行甲狀腺功能監測,最終出現了嚴重的甲減并導致了甲減性心肌病。
內分泌事件是 ICI 最常見的毒性之一,而內分泌事件的發生率因所使用的 ICI 類型而異[7],PD-1/PD-L1 抑制劑所致甲狀腺功能障礙的發生率較高,尤其是甲減[8]。在接受 PD-1/PD-L1 抑制劑治療的患者中,甲減發生率為 2%~10.1%,PD-L1 抑制劑治療的患者中,甲減發生率為 0%~10%[9]。單獨使用帕博利珠單抗時,4%~10.1% 的患者發生了免疫相關性甲減,而當帕博利珠單抗與化療聯合使用時,這一比例為 15%[9]。單獨使用納武利尤單抗的患者中有 2%~8.6% 發生甲減,納武利尤單抗聯合伊匹單抗治療的患者甲減發生率上升到 15%[9]。使用阿替利珠單抗的患者中有 0%~8% 發生甲減,使用度伐利尤單抗的患者中有 0%~5.2% 發生甲減[9]。其中大部分為亞臨床甲減,少部分為臨床甲減[10]。本例患者使用的 ICI 為卡瑞利珠單抗。在一項卡瑞利珠單抗加卡鉑和培美曲塞治療非鱗非小細胞肺癌的Ⅲ期臨床試驗中,接受卡瑞利珠單抗聯合卡鉑和培美曲塞治療的患者中有 22 例(11%)發生了甲減,其中 3 級及以上[通用不良反應事件評價標準(Common Terminology Criteria for Adverse Events, CTCAE)4.03 版]的僅有 1 例;而接受卡鉑和培美曲塞治療的患者中,沒有患者發生甲減[11]。考慮到本例患者既往甲狀腺功能正常,未長期使用過其他藥物,無其他甲減的原因,我們認為,患者此次的甲減與 PD-1 抑制劑有很強的相關性,并且由于沒有監測甲狀腺功能未能及時發現并治療,導致確診時已達到罕見的 4 級(CTCAE 4.03 版)免疫相關性甲減。
有研究報道,免疫相關性甲減發病的中位時間為開始使用 ICI 治療后的 7 周[12],但發病時間相當難以預測,可能在治療過程中的任何時間甚至治療結束后數月內出現。而本例患者在 PD-1 抑制劑治療中及治療結束后均未監測甲狀腺功能,發現甲狀腺激素下降時距開始 ICI 治療已超過 7 個月,我們無法確定其最初發生甲減的時間。
甲減可能表現為淡漠、疲乏、體重增加、抑郁情緒、畏寒、厭食、便秘、心動過緩等,嚴重時可導致心肌病。但許多患者完全或相對無癥狀[13],導致患者自己難以發現。雖然大多數出現甲減的患者癥狀輕微,但是,如果缺乏足夠的臨床意識,可能會導致嚴重甚至致命的后果[14]。本例患者如能定期檢查甲狀腺激素,則可早期發現甲減,不至于發展到心肌病。此外嚴重的甲狀腺毒性會延遲并導致免疫治療停止,使患者面臨腫瘤復發的風險[15]。因此需要醫護人員及時關注并糾正其甲狀腺功能障礙。甲狀腺功能可通過每 8 周測量 1 次 TSH 和 FT4 進行篩查。如果患者出現甲減的臨床表現,則篩查間隔應該更短[16]。
ICI 相關性甲減的 FT4 可降低,但 TSH 是首選且更敏感的檢查。原發性甲減的 TSH 升高,垂體性/丘腦性甲減的 TSH 降低或正常。如果 TSH 顯著升高(>10 μU/mL),則應開始甲狀腺激素替代治療。本例患者在 2022 年 10 月 6 日的甲狀腺激素檢查時 TSH 已超過檢測上限(>100 mU/L)。左甲狀腺素的標準起始劑量為 1.45 μg/(kg·d),每 6 周重新檢測 1 次以進行劑量調整[17]。對于原發性甲減,監測甲減的替代治療是否充分應使用 FT4[13]。本例患者治療 8 d 后 FT4 從 0.69 pmol/L 上升至 2.08 pmol/L,同時癥狀也逐漸緩解。
綜上所述,本例患者在 ICI 治療后未進行嚴格的不良反應管理,未能及時發現甲狀腺激素水平下降,不能進行及時的處理,從而導致了嚴重的甲減性心肌病并危及生命,而這種嚴重的不良反應之前未見報道。我們認為,在使用免疫抑制劑進行抗腫瘤治療時,應當進行嚴格的不良反應管理,否則可能會出現危及患者生命的不良反應。
利益沖突:所有作者聲明不存在利益沖突。
病例介紹 患者,女,57 歲,因“確診肺癌 17 個月,肺癌術后 9 個月,氣緊 10+ d”于 2022 年 10 月 5 日入四川大學華西醫院胸部腫瘤科。2021 年 4 月患者出現間斷咳嗽、咳黃痰,伴胸悶不適,反復發作。患者于 2021 年 5 月在當地醫院完善胸部 CT 提示:左肺下葉背段腫塊,大小約 5.4 cm×4.5 cm,縱隔淋巴結腫大。行肺穿刺病理活檢提示腺癌。腹部增強 CT、全身骨顯像、頭部 MRI 未見明顯異常。基因檢測:未檢測出敏感突變基因。患者診斷為左下肺腺癌伴縱隔淋巴結轉移(cT3N2M0 Ⅲb 期)。2021 年 6 月—11 月患者在當地醫院行 6 個周期治療:培美曲塞 700 mg 第 1 天(day 1, D1)+卡鉑 550 mg D1+卡瑞利珠單抗 200 mg D1+貝伐珠單抗 400 mg D1,每 3 周 1 次,最佳療效為腫瘤部分緩解。2022 年 1 月患者完善術前檢查,甲狀腺功能、心電圖、心臟彩色多普勒超聲(彩超)等均基本正常,于 2022 年 1 月 5 日在當地醫院行“胸腔鏡下左肺下葉切除術”,術后病理:(左肺下葉)浸潤性腺癌,各組淋巴結均未查見癌轉移。術后 1 個月患者在當地醫院行 1 個周期卡瑞利珠單抗+貝伐珠單抗治療和 1 個周期培美曲塞+卡瑞利珠單抗+貝伐珠單抗治療,之后定期復查 CT。2022 年 6 月患者復查 CT 示雙肺結節,考慮轉移,再次穿刺仍為腺癌。當地醫院給予吉西他濱+順鉑+貝伐珠單抗治療 1 個周期,同時完善組織基因檢測,結果顯示:KRAS G12D、EGFR 19 del。患者化療 1 個周期后復查療效評價為疾病穩定(腫瘤略長大)。2022 年 8 月 4 日患者開始口服奧希替尼 80 mg 1 次/d,2022 年 9 月 8 日復查 CT 療效評價為疾病穩定,繼續服用奧希替尼。
2022 年 9 月下旬患者無明顯誘因出現活動后氣緊、乏力、咳嗽、咳黃痰,逐漸加重,不能平臥。2022 年 10 月 4 日患者至四川大學華西醫院急診科,體格檢查:急性病容,雙下肺叩濁、呼吸音降低,余無明顯異常。實驗室檢查:肌紅蛋白 316.20 ng/mL,肌酸激酶同工酶 MB 質量 34.30 ng/mL,腦鈉肽前體(pro-brain natriuretic peptide, pro-BNP)
患者于 2022 年 10 月 5 日入住四川大學華西醫院胸部腫瘤科。考慮患者存在肺部感染、心力衰竭(心衰),給予達格列凈 10 mg 1 次/d、托拉塞米 5 mg 1 次/d、螺內酯 20 mg 1 次/d、頭孢美唑 1.0 g 2 次/d 治療。10 月 5 日復查心肌標志物和 pro-BNP 均較 10 月 4 日下降。10 月 6 日查甲狀腺激素:促甲狀腺激素(thyroid-stimulating hormone, TSH)>100 mU/L,三碘甲狀腺原氨酸<0.3 nmol/L,游離三碘甲狀腺原氨酸<0.6 pmol/L,甲狀腺素 7.0 nmol/L,游離甲狀腺素(free tetraiodothyronine, FT4)0.69 pmol/L。查胸腔和心包腔彩超:右側胸腔查見最大深度約 4.6 cm 的無回聲區,左側胸腔查見最大深度約 3.7 cm 的無回聲區;心包腔查見片狀無回聲區,最大深度約 0.5 cm。查心電圖為正常心電圖。心臟彩超結果:左心增大,升主動脈稍增寬;射血分數 25%,左心室收縮功能測值明顯減低;二尖瓣反流(中度);主動脈瓣及三尖瓣反流(輕-中度)。患者既往無高血壓、心臟病、糖尿病病史,無反復心悸、胸前區疼痛、活動后氣緊等既往史,且 9+ 個月前(2022 年 1 月)患者心臟彩超射血分數正常,未見明顯異常。考慮患者此次射血分數明顯下降為近期發生的心肌損害所致。國內回顧性分析報道免疫相關性心肌炎的中位發生時間為免疫檢查點抑制劑(immune checkpoint inhibitor, ICI)用藥后 38 d,81.2% 發生在 ICI 用藥的第 1~2 次[1]。患者發生心衰癥狀時距開始 ICI 治療已超過 7 個月,免疫性心肌炎可能性小。患者甲狀腺激素較既往明顯下降,考慮是近期出現的嚴重甲狀腺功能減退(甲減),心臟問題多系甲減性心肌病。于 10 月 7 日給予左甲狀腺素鈉 25 μg 1 次/d,10 月 12 日增至 50 μg 1 次/d,同時行右側胸腔穿刺置管,引流出洗肉水樣胸腔積液,胸腔積液脫落細胞學查見核異型細胞。經抗感染、糾正心衰、糾正甲減、引流胸腔積液等處理后,患者氣緊、乏力、咳嗽咳痰等癥狀逐漸好轉,心肌標志物迅速下降(圖1)。考慮患者在沒有使用激素的情況下心肌標志物明顯好轉,排除了免疫性心肌炎的可能。2022 年 10 月 15 日復查甲狀腺激素,TSH>100 mU/L,FT4 2.08 pmol/L,較前有所好轉。2022 年 10 月 18 日復查心臟彩超,心臟射血分數 29%,較前略有好轉,于 2022 年 10 月 19 日出院。
 圖1
患者入院治療期間 pro-BNP 及心肌標志物的變化情況
圖1
患者入院治療期間 pro-BNP 及心肌標志物的變化情況
pro-BNP:腦鈉肽前體
出院后患者繼續服用左甲狀腺素鈉、達格列凈、螺內酯、托拉塞米。2022 年 12 月 13 日患者于四川大學華西醫院門診復診,未訴乏力、氣緊,查心肌標志物:肌紅蛋白 33.13 ng/mL,肌酸激酶同工酶 MB 2.03 ng/mL,pro-BNP
討論 ICI 包括程序性死亡受體-1(programmed death-1, PD-1)抑制劑、程序性細胞死亡受體配體-1(programmed death-ligand 1, PD-L1)、細胞毒性 T 淋巴細胞相關蛋白 4 等[2]。ICI 可以恢復免疫系統殺死腫瘤細胞的能力,近年來已成為腫瘤治療和研究領域的熱點,目前在腫瘤的治療中發揮了重要作用[3-4]。此類藥物可能導致類似于自身免疫性疾病的毒性反應,包括皮疹、結腸炎、內分泌毒性及肝炎等[5]。目前已有一些關于 ICI 相關不良反應的報告[6],但我們認為臨床上對發生 ICI 相關不良反應的關注仍然不夠。如本例患者在 ICI 治療后未進行甲狀腺功能監測,最終出現了嚴重的甲減并導致了甲減性心肌病。
內分泌事件是 ICI 最常見的毒性之一,而內分泌事件的發生率因所使用的 ICI 類型而異[7],PD-1/PD-L1 抑制劑所致甲狀腺功能障礙的發生率較高,尤其是甲減[8]。在接受 PD-1/PD-L1 抑制劑治療的患者中,甲減發生率為 2%~10.1%,PD-L1 抑制劑治療的患者中,甲減發生率為 0%~10%[9]。單獨使用帕博利珠單抗時,4%~10.1% 的患者發生了免疫相關性甲減,而當帕博利珠單抗與化療聯合使用時,這一比例為 15%[9]。單獨使用納武利尤單抗的患者中有 2%~8.6% 發生甲減,納武利尤單抗聯合伊匹單抗治療的患者甲減發生率上升到 15%[9]。使用阿替利珠單抗的患者中有 0%~8% 發生甲減,使用度伐利尤單抗的患者中有 0%~5.2% 發生甲減[9]。其中大部分為亞臨床甲減,少部分為臨床甲減[10]。本例患者使用的 ICI 為卡瑞利珠單抗。在一項卡瑞利珠單抗加卡鉑和培美曲塞治療非鱗非小細胞肺癌的Ⅲ期臨床試驗中,接受卡瑞利珠單抗聯合卡鉑和培美曲塞治療的患者中有 22 例(11%)發生了甲減,其中 3 級及以上[通用不良反應事件評價標準(Common Terminology Criteria for Adverse Events, CTCAE)4.03 版]的僅有 1 例;而接受卡鉑和培美曲塞治療的患者中,沒有患者發生甲減[11]。考慮到本例患者既往甲狀腺功能正常,未長期使用過其他藥物,無其他甲減的原因,我們認為,患者此次的甲減與 PD-1 抑制劑有很強的相關性,并且由于沒有監測甲狀腺功能未能及時發現并治療,導致確診時已達到罕見的 4 級(CTCAE 4.03 版)免疫相關性甲減。
有研究報道,免疫相關性甲減發病的中位時間為開始使用 ICI 治療后的 7 周[12],但發病時間相當難以預測,可能在治療過程中的任何時間甚至治療結束后數月內出現。而本例患者在 PD-1 抑制劑治療中及治療結束后均未監測甲狀腺功能,發現甲狀腺激素下降時距開始 ICI 治療已超過 7 個月,我們無法確定其最初發生甲減的時間。
甲減可能表現為淡漠、疲乏、體重增加、抑郁情緒、畏寒、厭食、便秘、心動過緩等,嚴重時可導致心肌病。但許多患者完全或相對無癥狀[13],導致患者自己難以發現。雖然大多數出現甲減的患者癥狀輕微,但是,如果缺乏足夠的臨床意識,可能會導致嚴重甚至致命的后果[14]。本例患者如能定期檢查甲狀腺激素,則可早期發現甲減,不至于發展到心肌病。此外嚴重的甲狀腺毒性會延遲并導致免疫治療停止,使患者面臨腫瘤復發的風險[15]。因此需要醫護人員及時關注并糾正其甲狀腺功能障礙。甲狀腺功能可通過每 8 周測量 1 次 TSH 和 FT4 進行篩查。如果患者出現甲減的臨床表現,則篩查間隔應該更短[16]。
ICI 相關性甲減的 FT4 可降低,但 TSH 是首選且更敏感的檢查。原發性甲減的 TSH 升高,垂體性/丘腦性甲減的 TSH 降低或正常。如果 TSH 顯著升高(>10 μU/mL),則應開始甲狀腺激素替代治療。本例患者在 2022 年 10 月 6 日的甲狀腺激素檢查時 TSH 已超過檢測上限(>100 mU/L)。左甲狀腺素的標準起始劑量為 1.45 μg/(kg·d),每 6 周重新檢測 1 次以進行劑量調整[17]。對于原發性甲減,監測甲減的替代治療是否充分應使用 FT4[13]。本例患者治療 8 d 后 FT4 從 0.69 pmol/L 上升至 2.08 pmol/L,同時癥狀也逐漸緩解。
綜上所述,本例患者在 ICI 治療后未進行嚴格的不良反應管理,未能及時發現甲狀腺激素水平下降,不能進行及時的處理,從而導致了嚴重的甲減性心肌病并危及生命,而這種嚴重的不良反應之前未見報道。我們認為,在使用免疫抑制劑進行抗腫瘤治療時,應當進行嚴格的不良反應管理,否則可能會出現危及患者生命的不良反應。
利益沖突:所有作者聲明不存在利益沖突。