引用本文: 李杰, 陳雷, 陳秋洪, 胡德慶, 林建華. 粒細胞集落刺激因子動員 BMSCs 歸巢治療大鼠脊髓損傷的療效觀察. 中國修復重建外科雜志, 2019, 33(1): 93-100. doi: 10.7507/1002-1892.201806127 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷一直是國內外神經生物學者關注的熱點。由脊髓損傷導致的患者截癱,不僅給患者本人和家屬造成了極大打擊,也給社會造成了極大負擔。近年來出現了大量細胞移植以及帶基因修飾的細胞移植的實驗研究。但移植細胞存活及增殖環境差,加上倫理因素和安全性問題,目前其推廣應用受到阻礙。如何將人體內富含的大量內源性干細胞動員、歸巢至脊髓損傷部位發揮治療作用,引起了人們的思考。有研究提示粒細胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)具有抗凋亡、神經保護的作用[1-4],能治療脊髓損傷;G-CSF 與 BMSCs 在大鼠脊髓損傷治療中具有協同作用[5];且 G-CSF 已經作為一種干細胞動員劑,治療心肌梗死、側索硬化、腦梗死等疾病[6-9]。因此我們設計本實驗,觀察大鼠注射 G-CSF 能否通過動員 BMSCs 遷移、歸巢,進而促進脊髓損傷的修復,并對機制進行一些初步探索。
1 材料與方法
1.1 實驗動物與主要試劑、儀器
成年健康雌性 SD 大鼠 24 只,體質量 220~250 g,購自北京維通利華實驗動物技術有限公司。所有動物實驗均經福建醫科大學動物福利倫理委員會批準,實驗動物使用許可證號:SYXK(閩)2014-0003。
穩定表達綠色熒光蛋白(green fluorescence protein,GFP)基因的大鼠 BMSCs(GFP-BMSCs;廣州賽業生物科技有限公司);G-CSF(商品名:瑞白;山東齊魯制藥公司);抗膠質原纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體、抗神經元核抗原(neuronal nuclei,NeuN)抗體、抗基質細胞衍生因子 1(stromal cell-derived factor 1,SDF-1)抗體及兔抗 SDF-1、BDNF、VEGF 和 TNF-α 細胞因子抗體(Abcam 公司,英國);原位細胞凋亡檢測試劑盒(Roche 公司,瑞士);大鼠 SDF-1 ELISA 檢測試劑盒(Abbexa 公司,英國);大鼠 TNF-α ELISA 檢測試劑盒(R&D Systems 公司,美國);L-DMEM 培養液、FBS、雙抗(GIBCO 公司,美國);DMSO(Sigma 公司,美國);Cy3-共價偶聯的二抗(Life technologies 公司,美國),辣根過氧化物酶共價偶聯二抗(Jackson lab 公司,美國)。SP-1 倒置熒光顯微鏡(Leica 公司,德國);細胞恒溫培養箱(Thermo 公司,美國)。
1.2 大鼠 BMSCs 培養和移植
取 GFP-BMSCs,以含 10%FBS、雙抗和 L-谷氨酰胺的 1640 培養基進行常規培養和傳代。當細胞密度達 90% 時,用 0.25% 胰蛋白酶消化傳代,置于預鋪明膠處理的培養皿中進行培養。傳至第 3 代時,以離心半徑 10 cm、1 000 r/min 離心 5 min,PBS 重懸細胞,調整細胞濃度達 1×106個/mL,備用。取 24 只 SD 大鼠,經鼠尾靜脈緩慢推注 GFP-BMSCs,每只 1 mL。
1.3 實驗分組及方法
細胞移植后 24 h,將 24 只 SD 大鼠隨機分為假手術組(A 組)、假手術+G-CSF 組(B 組)、脊髓損傷組(C 組)、脊髓損傷+G-CSF 組(D 組),每組 6 只。所有大鼠以水合氯醛(3 mL/kg)腹腔注射麻醉,備皮,固定。定位 T8~10 棘突,取背部正中切口,逐層分離組織,暴露椎板和棘突,咬除棘突,顯微鑷夾除椎板暴露 T10 脊髓。A 組僅行椎板切除,不損傷脊髓,術后 1 h 大鼠腹部皮下注射生理鹽水 200 μL,連續 3 d;B 組于切除椎板后 1 h,大鼠腹部皮下注射 G-CSF 10 μg/(kg·d),連續 3 d;C 組以脊髓背部正中血管為標志,沿水平方向切斷右側半脊髓,確保完全橫斷,術后 1 h 大鼠腹部皮下注射生理鹽水 200 μL,連續 3 d;D 組同 C 組方法于脊髓損傷后 1 h,大鼠腹部皮下注射 G-CSF 10 μg/(kg·d),連續 3 d。逐層縫合肌肉、皮膚,大鼠術后每天肌注青霉素 1 萬 U,連續 3 d。將飼料、飲水置于動物可及范圍;膀胱按壓輔助排尿每天 2 次,至可自主排尿;保持墊料干燥。
1.4 觀測指標
1.4.1 大鼠神經功能 BBB 評分
術后 1、3、7、14、21、28 d 采用 BBB 評分行大鼠雙后肢神經功能評估。
1.4.2 ELISA 檢測 TNF-α 和 SDF-1 表達
術后 1、3、7、14、21、28 d 每組分別取 3 只大鼠,抽取鼠尾靜脈血,血清分離后進行稀釋,按照 ELISA 檢測試劑盒說明書步驟檢測血清中 SDF-1 和 TNF-α 含量。
1.4.3 免疫組織化學染色觀察
術后 28 d 每組取 3 只大鼠,使用脫頸法處死大鼠并分離手術部位脊髓樣品,4% 多聚甲醛固定過夜,然后行石蠟包埋切片,片厚 5 μm;二甲苯脫蠟,梯度乙醇處理后進行抗原修復,并使用山羊血清封閉非特異性結合。加入兔抗 SDF-1、BDNF、VEGF 和 TNF-α 細胞因子抗體(1∶200),4℃ 孵育過夜。使用預冷 PBS 清洗樣品 3 次后,用辣根過氧化物酶共價偶聯二抗(1∶400)室溫孵育 1 h。使用預冷 PBS 清洗 3 次后,DAB 顯色,倒置熒光顯微鏡 200 倍鏡下觀察。所有樣品中均使用未孵育一抗的樣品作為對照。采用 Image-Pro 圖像分析軟件對圖片中抗體染色強弱程度進行評分,作為各細胞因子表達量。
1.4.4 免疫熒光染色觀察
取上述封閉完成后的切片,每組各 3 張,加入一抗抗 GFAP 抗體或抗 NeuN 抗體(1∶200),4℃ 孵育過夜;預冷 PBS 洗 3 次后,使用 Cy3-共價偶聯二抗(1∶400)室溫孵育 1 h;PBS 清洗后封片,倒置熒光顯微鏡 200 倍鏡下觀察,計算視野內各組 GFP-BMSCs 細胞數,以及雙染熒光黃色的 GFP/NeuN 陽性神經元細胞數和 GFP/GFAP 陽性神經膠質細胞數。
1.4.5 TUNEL 法檢測細胞凋亡
術后 28 d 取上述各組脊髓樣本,4% 多聚甲醛固定過夜,二甲苯脫蠟,梯度乙醇和蛋白酶 K 處理。處理后的樣品按原位細胞凋亡檢測試劑盒說明書步驟進行細胞凋亡檢測,倒置熒光顯微鏡 200 倍鏡下觀察并計數凋亡細胞數。
1.5 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 大鼠神經功能 BBB 評分
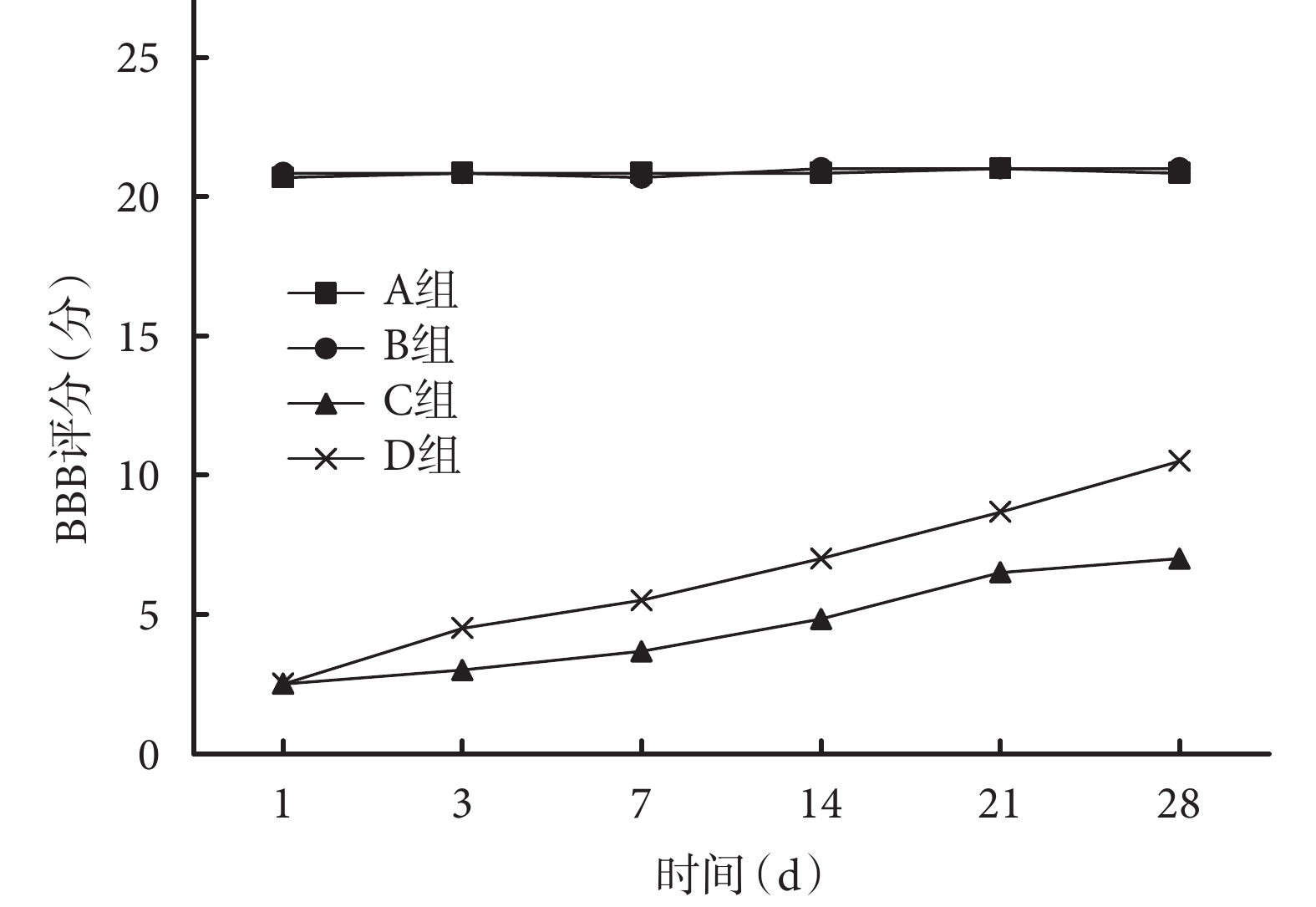
24 只大鼠均無死亡及藥物毒性反應。術前 4 組大鼠雙后肢 BBB 評分均為 21 分,術后各時間點 A、B 組 BBB 評分較術前無明顯變化,均在 21 分左右。術后 1 d,C、D 組 BBB 評分降至最低,后逐漸上升,各時間點 BBB 評分均顯著低于 A、B 組,差異有統計學意義(P<0.05)。除術后 1 d C、D 組 BBB 評分比較差異無統計學意義(P>0.05)外,其余各時間點 D 組 BBB 評分均高于 C 組,差異有統計學意義(P<0.05)。見圖 1。
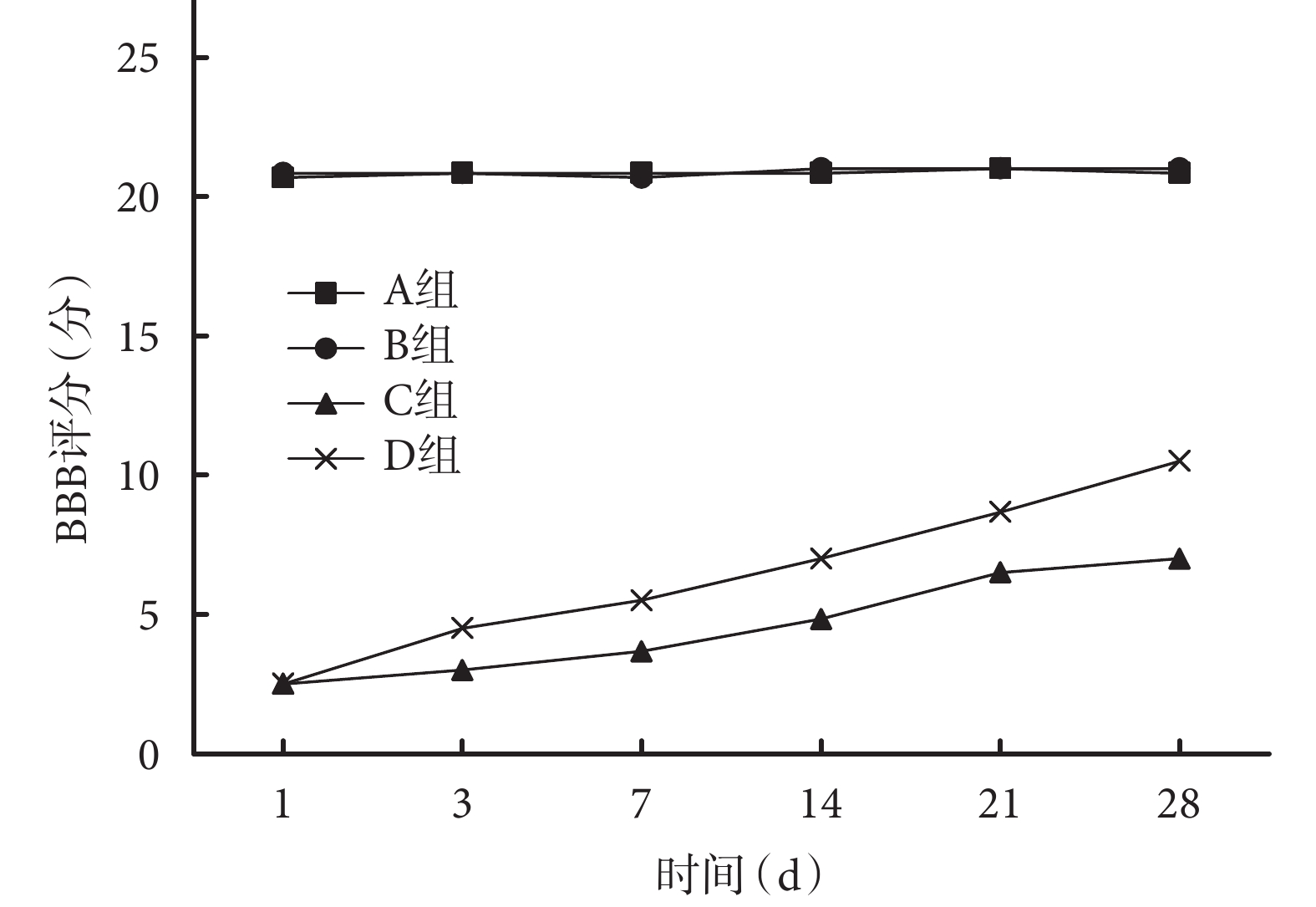 圖1
術后各時間點各組大鼠 BBB 評分
Figure1.
BBB score of rats in each group at different time points after operation
圖1
術后各時間點各組大鼠 BBB 評分
Figure1.
BBB score of rats in each group at different time points after operation
2.2 ELISA 檢測 TNF-α 和 SDF-1 表達
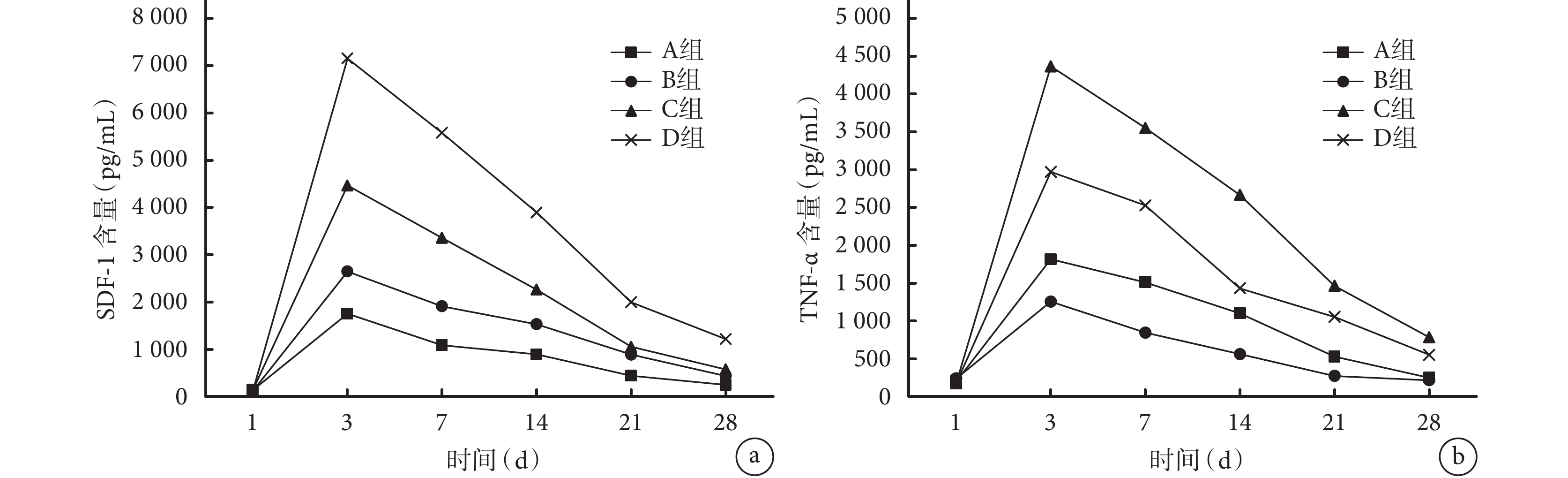
各組大鼠血清中 TNF-α 和 SDF-1 含量均于術后 3 d 達峰值,后逐漸下降。術后 3、7、14、21、28 d,C、D 組 TNF-α 和 SDF-1 含量均明顯高于 A、B 組,差異有統計學意義(P<0.05);但 D 組各時間點 TNF-α 含量顯著低于 C 組,SDF-1 含量顯著高于 C 組,差異均有統計學意義(P<0.05)。見圖 2。
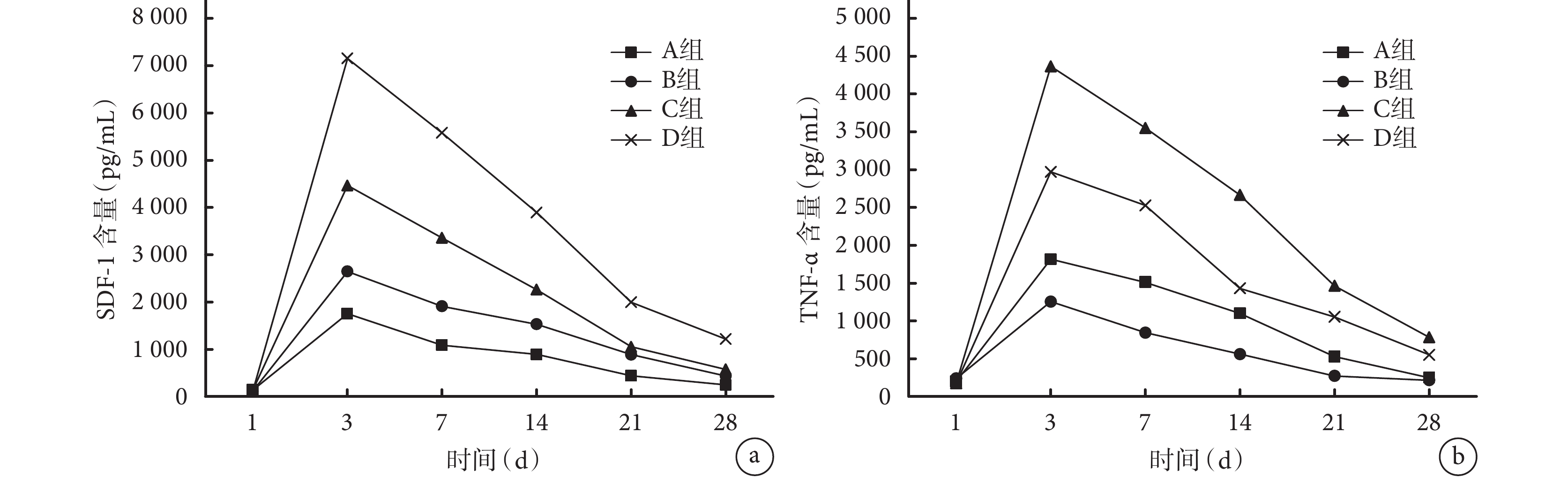 圖2
ELISA 檢測術后各時間點各組大鼠血清中 TNF-α 和 SDF-1 含量
Figure2.
Detection of TNF-α and SDF-1 in serum of rats at different time points after operation by ELISA
圖2
ELISA 檢測術后各時間點各組大鼠血清中 TNF-α 和 SDF-1 含量
Figure2.
Detection of TNF-α and SDF-1 in serum of rats at different time points after operation by ELISA
2.3 免疫組織化學染色觀察
術后各時間點 C、D 組各細胞因子表達均顯著高于 A、B 組,差異有統計學意義(P<0.05)。D 組 SDF-1、BDNF、VEGF 表達顯著高于 C 組,TNF-α 表達顯著低于 C 組,差異均有統計學意義(P<0.05)。見圖 3、表 1。
 )
Table1.
The expressions of cytokines in each group at different time points after operation detected by immunohistochemical staining (n=3,
)
Table1.
The expressions of cytokines in each group at different time points after operation detected by immunohistochemical staining (n=3,  )
)
 圖3
免疫組織化學染色觀察術后 28 d 各組各細胞因子表達(倒置熒光顯微鏡×200)
圖3
免疫組織化學染色觀察術后 28 d 各組各細胞因子表達(倒置熒光顯微鏡×200)
從左至右依次為 A、B、C、D 組 a. SDF-1;b. TNF-α;c. BDNF;d. VEGF
Figure3. Immunohistochemical staining observation of the expression of cytokines at 28 days after operation (Inverted fluorescence microscope×200)From left to right for groups A, B, C, D respectively a. SDF-1; b. TNF-α; c. BDNF; d. VEGF
2.4 免疫熒光染色觀察
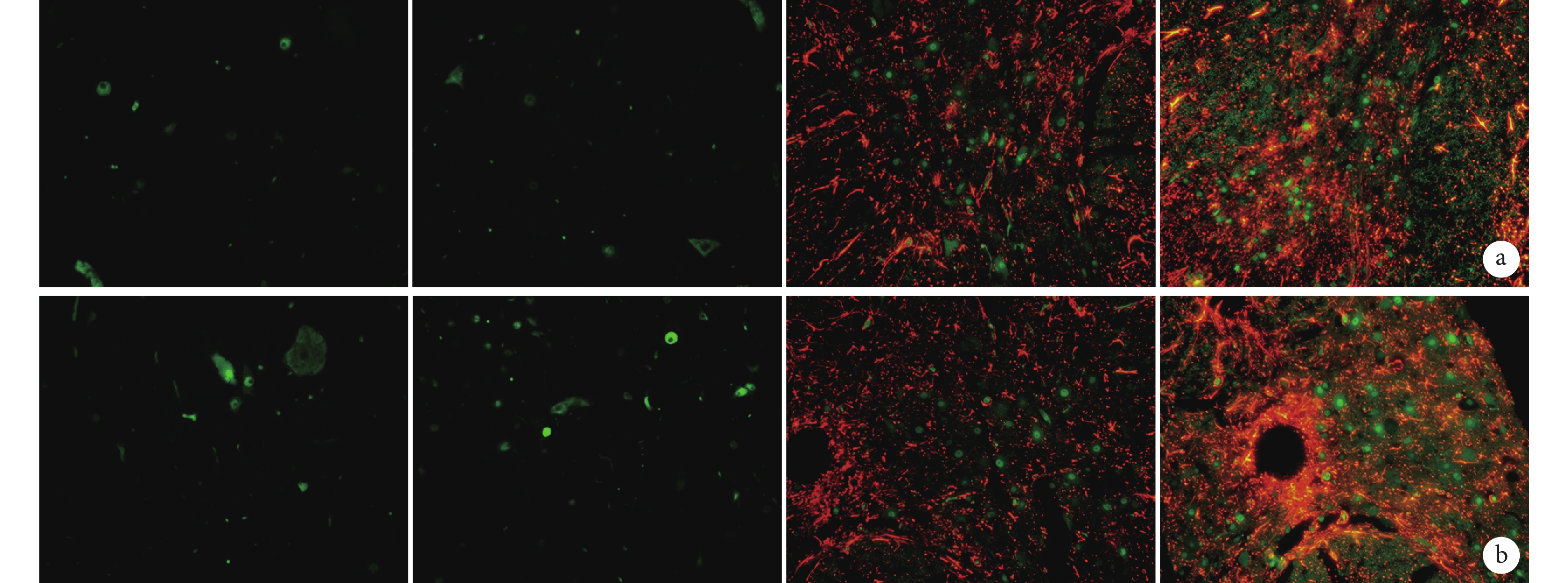
鏡下觀察示,A、B 組可觀察到極少量 GFP-BMSCs 分布,未見雙染熒光黃色的 GFP/NeuN 和 GFP/GFAP 陽性神經細胞。C、D 組 GFP-BMSCs、GFP/NeuN、GFP/GFAP 陽性細胞數均顯著多于 A、B 組,D 組顯著多于 C 組,差異均有統計學意義(P<0.05)。見圖 4、表 2。
 )
Table2.
The number of positive cells in each group at different time points after operation detected by immunofluorescence staining (n=3, cells/field,
)
Table2.
The number of positive cells in each group at different time points after operation detected by immunofluorescence staining (n=3, cells/field,  )
)
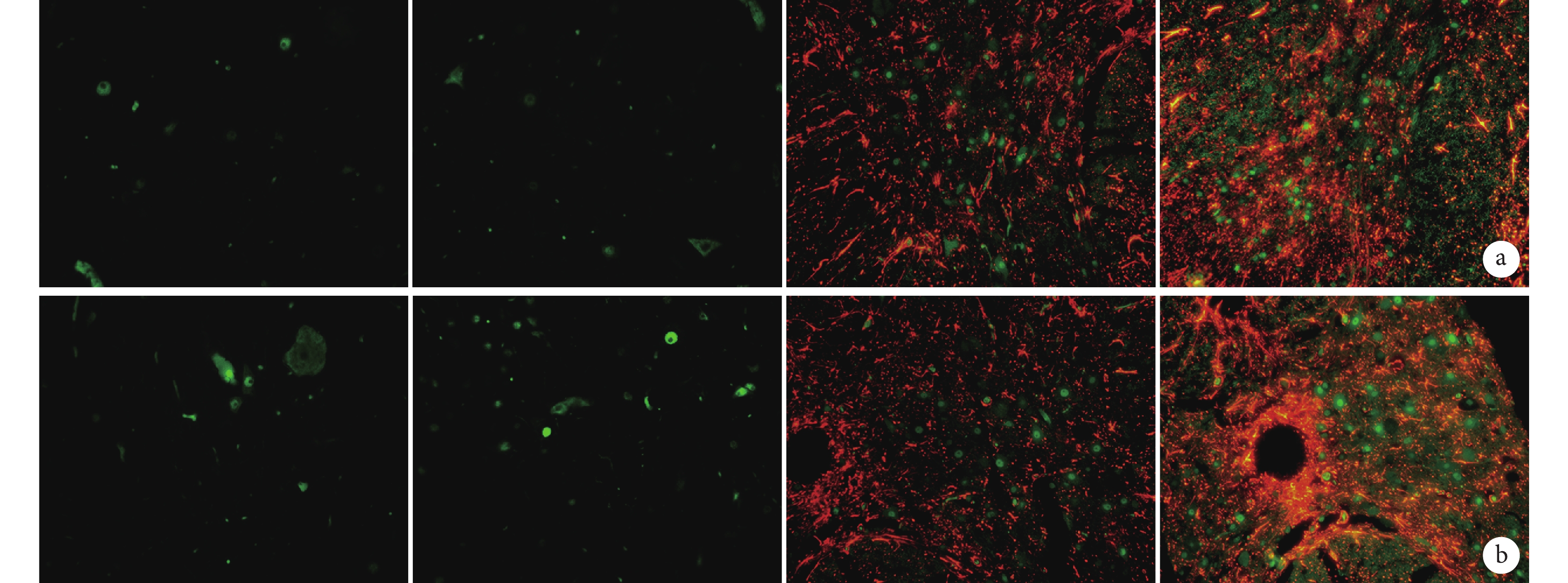 圖4
術后 28 d 各組大鼠脊髓損傷部位各陽性細胞表達觀察(倒置熒光顯微鏡×200)
圖4
術后 28 d 各組大鼠脊髓損傷部位各陽性細胞表達觀察(倒置熒光顯微鏡×200)
從左至右依次為 A、B、C、D 組 a. GFP/NeuN 陽性;b. GFP/GFAP 陽性
Figure4. The expression of positive cells in spinal cord injury site of rats in each group at 28 days after operation (Inverted fluorescence microscope×200)From left to right for groups A, B, C, D respectively a. GFP/NeuN positive; b. GFP/GFAP positive
2.5 TUNEL 法檢測細胞凋亡
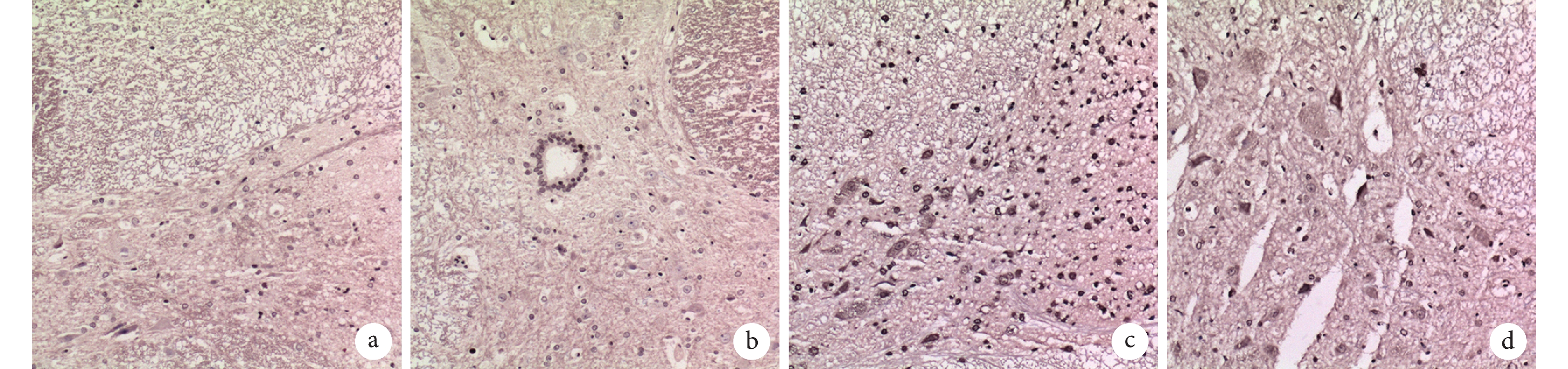
術后 28 d,A、B 組大鼠脊髓損傷部位很少發生細胞凋亡;C 組可觀察到大量細胞凋亡,D 組經 G-CSF 治療后凋亡細胞數少于 C 組。見圖 5。A、B、C、D 組凋亡細胞數分別為(35.00±4.00)、(36.33±5.50)、(264.00±32.51)、(100.67±23.02)個/視野,C、D 組顯著高于 A、B 組,D 組顯著低于 C 組,差異有統計學意義(P<0.01)。
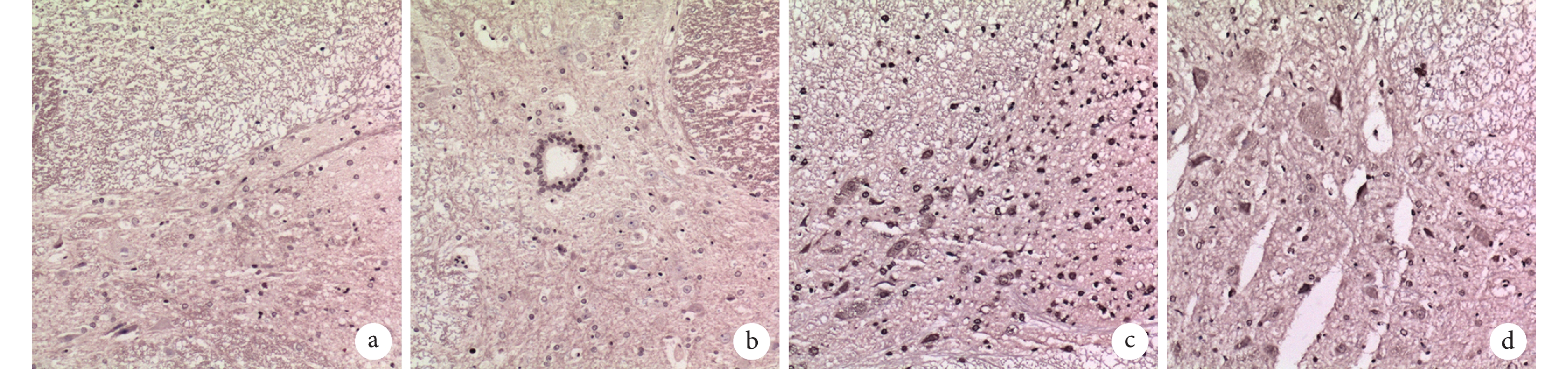 圖5
術后 28 d 各組大鼠脊髓損傷部位細胞凋亡檢測(倒置熒光顯微鏡×200)
圖5
術后 28 d 各組大鼠脊髓損傷部位細胞凋亡檢測(倒置熒光顯微鏡×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure5. Detection of apoptosis cells in spinal cord injury sites in each group at 28 days after operation (Inverted fluorescence microscope×200)a. Group A; b. Group B; c. Group C; d. Group D
3 討論
脊髓損傷一直是神經生物學研究的熱點,患者脊髓損傷后出現的癱瘓,給個人和家庭都造成了極大的經濟和心理負擔。大劑量激素沖擊治療脊髓損傷,時間窗要求高,且常伴有呼吸系統和消化系統等嚴重并發癥[10-11]。近年來大量外源性干細胞、帶基因修飾干細胞以及生物支架的研究出現,在脊髓損傷修復方面取得了一些進展,但是效果不太理想,且受到倫理、安全性等方面制約,難以推廣[12]。
成年人和動物大腦、脊髓的室管膜及膜下存在豐富的內源性干細胞及前體細胞。骨髓基質中的 BMSCs 也具有自我更新、分化增殖、低免疫原性、趨化性等特點,具有神經分化的潛能[13-14]。可惜雖然人體中富含 BMSCs,但是由于細胞凋亡、調控其遷移過程信號通路限制,BMSCs 的歸巢效率很低[15]。因此研究探索 G-CSF 等干細胞的動員劑,觀察干細胞動員治療脊髓損傷的療效,為臨床治療脊髓損傷提供新的理論依據,顯得尤為重要。
G-CSF 在臨床已經被應用于 BMSCs 移植動員,且安全性良好。美國國立骨髓庫報道對 4 015 例 G-CSF 使用者經平均 2.5 年隨訪,未見白血病及淋巴瘤患者[16]。多項研究發現 G-CSF 具有抗凋亡、神經保護的作用,可顯著抑制損傷部位周圍神經細胞和少突細胞的凋亡[17-19]。張慧等[20]的研究中發現,G-CSF 可以通過核仁磷酸蛋白的抗凋亡作用治療小鼠脊髓損傷。Chen 等[2]的研究也發現 G-CSF 對大鼠脊髓損傷具有保護作用。甚至日本千葉大學已經開始對 G-CSF 治療脊髓損傷開始了Ⅰ/Ⅱa 期臨床試驗[4]。有研究發現 G-CSF 對小鼠脊髓損傷的治療,與改善運動能力和感覺功能恢復、增強神經再生有關[21]。本研究的大鼠行為學研究中,C、D 組大鼠 BBB 評分從術后 3 d 就表現出了顯著性差異,D 組術后 7、14、21、28 d 大鼠 BBB 評分均高于 C 組(P<0.05),且術后 28 d TUNEL 實驗中 D 組的凋亡細胞數顯著低于 C 組(P<0.05),說明 G-CSF 能促進大鼠脊髓損傷后運動功能恢復。
張慧等[20]在小鼠脊髓半切模型研究中發現,G-CSF 對神經細胞可能具有抗凋亡作用。然而抗凋亡作用復雜,且目前實驗研究多為脊髓損傷建模后給藥,單純用抗凋亡作用很難完全解釋 G-CSF 治療脊髓損傷的作用機制。這也為我們探索 G-CSF 對脊髓損傷的神經修復機制提出了更多的思考。作為一種可靠的干細胞動員劑,國內已有文獻報道 G-CSF 通過動員內皮祖細胞歸巢,治療患者心肌梗死[6-7]。國外也有關于 G-CSF 治療側索硬化和腦梗死的報道[8-9]。因此,我們希望通過實驗研究,論證 G-CSF 是否可以通過誘導內源性干細胞歸巢到脊髓損傷部位,參與脊髓損傷神經修復。
由于自身干細胞標記困難,我們采用 GFP 標記 BMSCs 及其分化的細胞作為研究對象。Deak 等[22]發現 GFP 轉染的 MSCs 移植后很快就開始歸巢,24 h 后最常見的分布器官分別是肺、肝、腎、皮膚和消化道。所以,我們采用在大鼠脊髓損傷前 24 h 鼠尾靜脈注射大鼠 GFP-BMSCs 的方法,來替代自身內源性干細胞的標記。而本研究的免疫熒光染色結果也表明 D 組與 C 組相比,除了觀測到更多 GFP-BMSCs 分布,還可見大量 GFP/NeuN 陽性和 GFP/GFAP 陽性細胞。其中 NeuN 是神經元的特異性標記抗原,GFAP 是神經膠質細胞的特異性標記抗原。說明 G-CSF 能動員 BMSCs 歸巢到脊髓損傷部位參與神經修復,進而分化為神經元細胞和神經膠質細胞。
既往文獻研究發現干細胞歸巢過程中,SDF-1/趨化因子受體 4(chemokine receptor type 4,CXCR4)通路在 BMSCs 向腦損傷部位歸巢的過程中起到重要作用,當 SDF-1/CXCR4 通路被阻斷或者抑制時,BMSCs 的動員就會停滯[23]。本研究中 ELISA 檢測示,D 組各時間點血清 SDF-1 水平顯著高于 C 組;且免疫組織化學染色顯示,D 組相較于 C 組 SDF-1 陽性表達更高。提示 G-CSF 具有提升 BMSCs 遷移能力的作用。
當然,雖然有文獻認為 BMSCs 對脊髓損傷后的軸突再生有一定作用[24],但是單純的干細胞移植受脊髓損傷后微環境影響以及膠質瘢痕增生的作用,可能效果不佳。近年來關于 G-CSF 在脊髓損傷的研究中,發現 G-CSF 具有減輕凋亡反應[21, 25]、減少軸突髓鞘破壞、增加軸突發芽[2, 26]的作用。此外,Chung 等[27]的研究顯示,G-CSF 可能通過抑制空洞周圍的 GFAP 和硫酸軟骨素蛋白多糖的過量表達,抑制大鼠脊髓損傷后膠質瘢痕的形成,從而促進脊髓損傷的功能恢復。Okuda 等[28]研究發現 BMSCs 能抑制膠質瘢痕的形成,為軸突再生提供一個更良好的微環境。Urdziková 等[29]和 Chen 等[2]的研究也發現 G-CSF 對膠質瘢痕形成有抑制作用。所以 G-CSF 對于脊髓損傷的治療作用,不僅僅體現在動員干細胞歸巢上,可能存在著更多機制。
TNF-α 具有多種生物活性,是脊髓損傷后較早升高的細胞炎性因子,能上調其他細胞因子,參與脊髓繼發損傷[30]。本研究 D 組各時間點的 TNF-α 水平低于 C 組,且免疫組織化學染色結果顯示 D 組較 C 組 TNF-α 陽性表達低。提示 G-CSF 具有減輕大鼠脊髓損傷后炎性反應的作用,可能能改善神經修復的微環境。BDNF、VEGF 在神經修復過程中也扮演著很重要的角色[31]。BDNF 能促進干細胞歸巢,還能改善神經發生的微環境,促進脊髓損傷后的神經修復。VEGF 作為重要的血管生成因子,能通過促進新生血管生成,促進脊髓損傷后的神經修復。本研究中 D 組局部 BDNF 和 VEGF 相對于 C 組高表達,提示 G-CSF 可能能促進神經營養因子分泌,以及脊髓損傷后的新生血管生成。
綜上述,G-CSF 能促進大鼠脊髓損傷后的神經功能恢復,其作用可能與其下調 TNF-α 減少細胞凋亡,上調 SDF-1 促進 BMSCs 遷移,上調 BDNF 和 VEGF 促進神經營養因子分泌和新生血管生成,使 BMSCs 歸巢至脊髓損傷部位并參與損傷的修復有關。但本研究存在一定局限性,有學者認為 G-CSF 治療脊髓損傷的機制除了動員干細胞歸巢,可能還包括免疫調節作用、抗凋亡作用、神經生成(包括神經元和膠質細胞以及軸突發芽和髓鞘再生)以及血管生成[32]。后續我們將對 G-CSF 在脊髓損傷治療過程中的其他功能進行深入探索和研究。
脊髓損傷一直是國內外神經生物學者關注的熱點。由脊髓損傷導致的患者截癱,不僅給患者本人和家屬造成了極大打擊,也給社會造成了極大負擔。近年來出現了大量細胞移植以及帶基因修飾的細胞移植的實驗研究。但移植細胞存活及增殖環境差,加上倫理因素和安全性問題,目前其推廣應用受到阻礙。如何將人體內富含的大量內源性干細胞動員、歸巢至脊髓損傷部位發揮治療作用,引起了人們的思考。有研究提示粒細胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)具有抗凋亡、神經保護的作用[1-4],能治療脊髓損傷;G-CSF 與 BMSCs 在大鼠脊髓損傷治療中具有協同作用[5];且 G-CSF 已經作為一種干細胞動員劑,治療心肌梗死、側索硬化、腦梗死等疾病[6-9]。因此我們設計本實驗,觀察大鼠注射 G-CSF 能否通過動員 BMSCs 遷移、歸巢,進而促進脊髓損傷的修復,并對機制進行一些初步探索。
1 材料與方法
1.1 實驗動物與主要試劑、儀器
成年健康雌性 SD 大鼠 24 只,體質量 220~250 g,購自北京維通利華實驗動物技術有限公司。所有動物實驗均經福建醫科大學動物福利倫理委員會批準,實驗動物使用許可證號:SYXK(閩)2014-0003。
穩定表達綠色熒光蛋白(green fluorescence protein,GFP)基因的大鼠 BMSCs(GFP-BMSCs;廣州賽業生物科技有限公司);G-CSF(商品名:瑞白;山東齊魯制藥公司);抗膠質原纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體、抗神經元核抗原(neuronal nuclei,NeuN)抗體、抗基質細胞衍生因子 1(stromal cell-derived factor 1,SDF-1)抗體及兔抗 SDF-1、BDNF、VEGF 和 TNF-α 細胞因子抗體(Abcam 公司,英國);原位細胞凋亡檢測試劑盒(Roche 公司,瑞士);大鼠 SDF-1 ELISA 檢測試劑盒(Abbexa 公司,英國);大鼠 TNF-α ELISA 檢測試劑盒(R&D Systems 公司,美國);L-DMEM 培養液、FBS、雙抗(GIBCO 公司,美國);DMSO(Sigma 公司,美國);Cy3-共價偶聯的二抗(Life technologies 公司,美國),辣根過氧化物酶共價偶聯二抗(Jackson lab 公司,美國)。SP-1 倒置熒光顯微鏡(Leica 公司,德國);細胞恒溫培養箱(Thermo 公司,美國)。
1.2 大鼠 BMSCs 培養和移植
取 GFP-BMSCs,以含 10%FBS、雙抗和 L-谷氨酰胺的 1640 培養基進行常規培養和傳代。當細胞密度達 90% 時,用 0.25% 胰蛋白酶消化傳代,置于預鋪明膠處理的培養皿中進行培養。傳至第 3 代時,以離心半徑 10 cm、1 000 r/min 離心 5 min,PBS 重懸細胞,調整細胞濃度達 1×106個/mL,備用。取 24 只 SD 大鼠,經鼠尾靜脈緩慢推注 GFP-BMSCs,每只 1 mL。
1.3 實驗分組及方法
細胞移植后 24 h,將 24 只 SD 大鼠隨機分為假手術組(A 組)、假手術+G-CSF 組(B 組)、脊髓損傷組(C 組)、脊髓損傷+G-CSF 組(D 組),每組 6 只。所有大鼠以水合氯醛(3 mL/kg)腹腔注射麻醉,備皮,固定。定位 T8~10 棘突,取背部正中切口,逐層分離組織,暴露椎板和棘突,咬除棘突,顯微鑷夾除椎板暴露 T10 脊髓。A 組僅行椎板切除,不損傷脊髓,術后 1 h 大鼠腹部皮下注射生理鹽水 200 μL,連續 3 d;B 組于切除椎板后 1 h,大鼠腹部皮下注射 G-CSF 10 μg/(kg·d),連續 3 d;C 組以脊髓背部正中血管為標志,沿水平方向切斷右側半脊髓,確保完全橫斷,術后 1 h 大鼠腹部皮下注射生理鹽水 200 μL,連續 3 d;D 組同 C 組方法于脊髓損傷后 1 h,大鼠腹部皮下注射 G-CSF 10 μg/(kg·d),連續 3 d。逐層縫合肌肉、皮膚,大鼠術后每天肌注青霉素 1 萬 U,連續 3 d。將飼料、飲水置于動物可及范圍;膀胱按壓輔助排尿每天 2 次,至可自主排尿;保持墊料干燥。
1.4 觀測指標
1.4.1 大鼠神經功能 BBB 評分
術后 1、3、7、14、21、28 d 采用 BBB 評分行大鼠雙后肢神經功能評估。
1.4.2 ELISA 檢測 TNF-α 和 SDF-1 表達
術后 1、3、7、14、21、28 d 每組分別取 3 只大鼠,抽取鼠尾靜脈血,血清分離后進行稀釋,按照 ELISA 檢測試劑盒說明書步驟檢測血清中 SDF-1 和 TNF-α 含量。
1.4.3 免疫組織化學染色觀察
術后 28 d 每組取 3 只大鼠,使用脫頸法處死大鼠并分離手術部位脊髓樣品,4% 多聚甲醛固定過夜,然后行石蠟包埋切片,片厚 5 μm;二甲苯脫蠟,梯度乙醇處理后進行抗原修復,并使用山羊血清封閉非特異性結合。加入兔抗 SDF-1、BDNF、VEGF 和 TNF-α 細胞因子抗體(1∶200),4℃ 孵育過夜。使用預冷 PBS 清洗樣品 3 次后,用辣根過氧化物酶共價偶聯二抗(1∶400)室溫孵育 1 h。使用預冷 PBS 清洗 3 次后,DAB 顯色,倒置熒光顯微鏡 200 倍鏡下觀察。所有樣品中均使用未孵育一抗的樣品作為對照。采用 Image-Pro 圖像分析軟件對圖片中抗體染色強弱程度進行評分,作為各細胞因子表達量。
1.4.4 免疫熒光染色觀察
取上述封閉完成后的切片,每組各 3 張,加入一抗抗 GFAP 抗體或抗 NeuN 抗體(1∶200),4℃ 孵育過夜;預冷 PBS 洗 3 次后,使用 Cy3-共價偶聯二抗(1∶400)室溫孵育 1 h;PBS 清洗后封片,倒置熒光顯微鏡 200 倍鏡下觀察,計算視野內各組 GFP-BMSCs 細胞數,以及雙染熒光黃色的 GFP/NeuN 陽性神經元細胞數和 GFP/GFAP 陽性神經膠質細胞數。
1.4.5 TUNEL 法檢測細胞凋亡
術后 28 d 取上述各組脊髓樣本,4% 多聚甲醛固定過夜,二甲苯脫蠟,梯度乙醇和蛋白酶 K 處理。處理后的樣品按原位細胞凋亡檢測試劑盒說明書步驟進行細胞凋亡檢測,倒置熒光顯微鏡 200 倍鏡下觀察并計數凋亡細胞數。
1.5 統計學方法
采用 SPSS19.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 t 檢驗;檢驗水準 α=0.05。
2 結果
2.1 大鼠神經功能 BBB 評分
24 只大鼠均無死亡及藥物毒性反應。術前 4 組大鼠雙后肢 BBB 評分均為 21 分,術后各時間點 A、B 組 BBB 評分較術前無明顯變化,均在 21 分左右。術后 1 d,C、D 組 BBB 評分降至最低,后逐漸上升,各時間點 BBB 評分均顯著低于 A、B 組,差異有統計學意義(P<0.05)。除術后 1 d C、D 組 BBB 評分比較差異無統計學意義(P>0.05)外,其余各時間點 D 組 BBB 評分均高于 C 組,差異有統計學意義(P<0.05)。見圖 1。
 圖1
術后各時間點各組大鼠 BBB 評分
Figure1.
BBB score of rats in each group at different time points after operation
圖1
術后各時間點各組大鼠 BBB 評分
Figure1.
BBB score of rats in each group at different time points after operation
2.2 ELISA 檢測 TNF-α 和 SDF-1 表達
各組大鼠血清中 TNF-α 和 SDF-1 含量均于術后 3 d 達峰值,后逐漸下降。術后 3、7、14、21、28 d,C、D 組 TNF-α 和 SDF-1 含量均明顯高于 A、B 組,差異有統計學意義(P<0.05);但 D 組各時間點 TNF-α 含量顯著低于 C 組,SDF-1 含量顯著高于 C 組,差異均有統計學意義(P<0.05)。見圖 2。
 圖2
ELISA 檢測術后各時間點各組大鼠血清中 TNF-α 和 SDF-1 含量
Figure2.
Detection of TNF-α and SDF-1 in serum of rats at different time points after operation by ELISA
圖2
ELISA 檢測術后各時間點各組大鼠血清中 TNF-α 和 SDF-1 含量
Figure2.
Detection of TNF-α and SDF-1 in serum of rats at different time points after operation by ELISA
2.3 免疫組織化學染色觀察
術后各時間點 C、D 組各細胞因子表達均顯著高于 A、B 組,差異有統計學意義(P<0.05)。D 組 SDF-1、BDNF、VEGF 表達顯著高于 C 組,TNF-α 表達顯著低于 C 組,差異均有統計學意義(P<0.05)。見圖 3、表 1。
 )
Table1.
The expressions of cytokines in each group at different time points after operation detected by immunohistochemical staining (n=3,
)
Table1.
The expressions of cytokines in each group at different time points after operation detected by immunohistochemical staining (n=3,  )
)
 圖3
免疫組織化學染色觀察術后 28 d 各組各細胞因子表達(倒置熒光顯微鏡×200)
圖3
免疫組織化學染色觀察術后 28 d 各組各細胞因子表達(倒置熒光顯微鏡×200)
從左至右依次為 A、B、C、D 組 a. SDF-1;b. TNF-α;c. BDNF;d. VEGF
Figure3. Immunohistochemical staining observation of the expression of cytokines at 28 days after operation (Inverted fluorescence microscope×200)From left to right for groups A, B, C, D respectively a. SDF-1; b. TNF-α; c. BDNF; d. VEGF
2.4 免疫熒光染色觀察
鏡下觀察示,A、B 組可觀察到極少量 GFP-BMSCs 分布,未見雙染熒光黃色的 GFP/NeuN 和 GFP/GFAP 陽性神經細胞。C、D 組 GFP-BMSCs、GFP/NeuN、GFP/GFAP 陽性細胞數均顯著多于 A、B 組,D 組顯著多于 C 組,差異均有統計學意義(P<0.05)。見圖 4、表 2。
 )
Table2.
The number of positive cells in each group at different time points after operation detected by immunofluorescence staining (n=3, cells/field,
)
Table2.
The number of positive cells in each group at different time points after operation detected by immunofluorescence staining (n=3, cells/field,  )
)
 圖4
術后 28 d 各組大鼠脊髓損傷部位各陽性細胞表達觀察(倒置熒光顯微鏡×200)
圖4
術后 28 d 各組大鼠脊髓損傷部位各陽性細胞表達觀察(倒置熒光顯微鏡×200)
從左至右依次為 A、B、C、D 組 a. GFP/NeuN 陽性;b. GFP/GFAP 陽性
Figure4. The expression of positive cells in spinal cord injury site of rats in each group at 28 days after operation (Inverted fluorescence microscope×200)From left to right for groups A, B, C, D respectively a. GFP/NeuN positive; b. GFP/GFAP positive
2.5 TUNEL 法檢測細胞凋亡
術后 28 d,A、B 組大鼠脊髓損傷部位很少發生細胞凋亡;C 組可觀察到大量細胞凋亡,D 組經 G-CSF 治療后凋亡細胞數少于 C 組。見圖 5。A、B、C、D 組凋亡細胞數分別為(35.00±4.00)、(36.33±5.50)、(264.00±32.51)、(100.67±23.02)個/視野,C、D 組顯著高于 A、B 組,D 組顯著低于 C 組,差異有統計學意義(P<0.01)。
 圖5
術后 28 d 各組大鼠脊髓損傷部位細胞凋亡檢測(倒置熒光顯微鏡×200)
圖5
術后 28 d 各組大鼠脊髓損傷部位細胞凋亡檢測(倒置熒光顯微鏡×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure5. Detection of apoptosis cells in spinal cord injury sites in each group at 28 days after operation (Inverted fluorescence microscope×200)a. Group A; b. Group B; c. Group C; d. Group D
3 討論
脊髓損傷一直是神經生物學研究的熱點,患者脊髓損傷后出現的癱瘓,給個人和家庭都造成了極大的經濟和心理負擔。大劑量激素沖擊治療脊髓損傷,時間窗要求高,且常伴有呼吸系統和消化系統等嚴重并發癥[10-11]。近年來大量外源性干細胞、帶基因修飾干細胞以及生物支架的研究出現,在脊髓損傷修復方面取得了一些進展,但是效果不太理想,且受到倫理、安全性等方面制約,難以推廣[12]。
成年人和動物大腦、脊髓的室管膜及膜下存在豐富的內源性干細胞及前體細胞。骨髓基質中的 BMSCs 也具有自我更新、分化增殖、低免疫原性、趨化性等特點,具有神經分化的潛能[13-14]。可惜雖然人體中富含 BMSCs,但是由于細胞凋亡、調控其遷移過程信號通路限制,BMSCs 的歸巢效率很低[15]。因此研究探索 G-CSF 等干細胞的動員劑,觀察干細胞動員治療脊髓損傷的療效,為臨床治療脊髓損傷提供新的理論依據,顯得尤為重要。
G-CSF 在臨床已經被應用于 BMSCs 移植動員,且安全性良好。美國國立骨髓庫報道對 4 015 例 G-CSF 使用者經平均 2.5 年隨訪,未見白血病及淋巴瘤患者[16]。多項研究發現 G-CSF 具有抗凋亡、神經保護的作用,可顯著抑制損傷部位周圍神經細胞和少突細胞的凋亡[17-19]。張慧等[20]的研究中發現,G-CSF 可以通過核仁磷酸蛋白的抗凋亡作用治療小鼠脊髓損傷。Chen 等[2]的研究也發現 G-CSF 對大鼠脊髓損傷具有保護作用。甚至日本千葉大學已經開始對 G-CSF 治療脊髓損傷開始了Ⅰ/Ⅱa 期臨床試驗[4]。有研究發現 G-CSF 對小鼠脊髓損傷的治療,與改善運動能力和感覺功能恢復、增強神經再生有關[21]。本研究的大鼠行為學研究中,C、D 組大鼠 BBB 評分從術后 3 d 就表現出了顯著性差異,D 組術后 7、14、21、28 d 大鼠 BBB 評分均高于 C 組(P<0.05),且術后 28 d TUNEL 實驗中 D 組的凋亡細胞數顯著低于 C 組(P<0.05),說明 G-CSF 能促進大鼠脊髓損傷后運動功能恢復。
張慧等[20]在小鼠脊髓半切模型研究中發現,G-CSF 對神經細胞可能具有抗凋亡作用。然而抗凋亡作用復雜,且目前實驗研究多為脊髓損傷建模后給藥,單純用抗凋亡作用很難完全解釋 G-CSF 治療脊髓損傷的作用機制。這也為我們探索 G-CSF 對脊髓損傷的神經修復機制提出了更多的思考。作為一種可靠的干細胞動員劑,國內已有文獻報道 G-CSF 通過動員內皮祖細胞歸巢,治療患者心肌梗死[6-7]。國外也有關于 G-CSF 治療側索硬化和腦梗死的報道[8-9]。因此,我們希望通過實驗研究,論證 G-CSF 是否可以通過誘導內源性干細胞歸巢到脊髓損傷部位,參與脊髓損傷神經修復。
由于自身干細胞標記困難,我們采用 GFP 標記 BMSCs 及其分化的細胞作為研究對象。Deak 等[22]發現 GFP 轉染的 MSCs 移植后很快就開始歸巢,24 h 后最常見的分布器官分別是肺、肝、腎、皮膚和消化道。所以,我們采用在大鼠脊髓損傷前 24 h 鼠尾靜脈注射大鼠 GFP-BMSCs 的方法,來替代自身內源性干細胞的標記。而本研究的免疫熒光染色結果也表明 D 組與 C 組相比,除了觀測到更多 GFP-BMSCs 分布,還可見大量 GFP/NeuN 陽性和 GFP/GFAP 陽性細胞。其中 NeuN 是神經元的特異性標記抗原,GFAP 是神經膠質細胞的特異性標記抗原。說明 G-CSF 能動員 BMSCs 歸巢到脊髓損傷部位參與神經修復,進而分化為神經元細胞和神經膠質細胞。
既往文獻研究發現干細胞歸巢過程中,SDF-1/趨化因子受體 4(chemokine receptor type 4,CXCR4)通路在 BMSCs 向腦損傷部位歸巢的過程中起到重要作用,當 SDF-1/CXCR4 通路被阻斷或者抑制時,BMSCs 的動員就會停滯[23]。本研究中 ELISA 檢測示,D 組各時間點血清 SDF-1 水平顯著高于 C 組;且免疫組織化學染色顯示,D 組相較于 C 組 SDF-1 陽性表達更高。提示 G-CSF 具有提升 BMSCs 遷移能力的作用。
當然,雖然有文獻認為 BMSCs 對脊髓損傷后的軸突再生有一定作用[24],但是單純的干細胞移植受脊髓損傷后微環境影響以及膠質瘢痕增生的作用,可能效果不佳。近年來關于 G-CSF 在脊髓損傷的研究中,發現 G-CSF 具有減輕凋亡反應[21, 25]、減少軸突髓鞘破壞、增加軸突發芽[2, 26]的作用。此外,Chung 等[27]的研究顯示,G-CSF 可能通過抑制空洞周圍的 GFAP 和硫酸軟骨素蛋白多糖的過量表達,抑制大鼠脊髓損傷后膠質瘢痕的形成,從而促進脊髓損傷的功能恢復。Okuda 等[28]研究發現 BMSCs 能抑制膠質瘢痕的形成,為軸突再生提供一個更良好的微環境。Urdziková 等[29]和 Chen 等[2]的研究也發現 G-CSF 對膠質瘢痕形成有抑制作用。所以 G-CSF 對于脊髓損傷的治療作用,不僅僅體現在動員干細胞歸巢上,可能存在著更多機制。
TNF-α 具有多種生物活性,是脊髓損傷后較早升高的細胞炎性因子,能上調其他細胞因子,參與脊髓繼發損傷[30]。本研究 D 組各時間點的 TNF-α 水平低于 C 組,且免疫組織化學染色結果顯示 D 組較 C 組 TNF-α 陽性表達低。提示 G-CSF 具有減輕大鼠脊髓損傷后炎性反應的作用,可能能改善神經修復的微環境。BDNF、VEGF 在神經修復過程中也扮演著很重要的角色[31]。BDNF 能促進干細胞歸巢,還能改善神經發生的微環境,促進脊髓損傷后的神經修復。VEGF 作為重要的血管生成因子,能通過促進新生血管生成,促進脊髓損傷后的神經修復。本研究中 D 組局部 BDNF 和 VEGF 相對于 C 組高表達,提示 G-CSF 可能能促進神經營養因子分泌,以及脊髓損傷后的新生血管生成。
綜上述,G-CSF 能促進大鼠脊髓損傷后的神經功能恢復,其作用可能與其下調 TNF-α 減少細胞凋亡,上調 SDF-1 促進 BMSCs 遷移,上調 BDNF 和 VEGF 促進神經營養因子分泌和新生血管生成,使 BMSCs 歸巢至脊髓損傷部位并參與損傷的修復有關。但本研究存在一定局限性,有學者認為 G-CSF 治療脊髓損傷的機制除了動員干細胞歸巢,可能還包括免疫調節作用、抗凋亡作用、神經生成(包括神經元和膠質細胞以及軸突發芽和髓鞘再生)以及血管生成[32]。后續我們將對 G-CSF 在脊髓損傷治療過程中的其他功能進行深入探索和研究。