引用本文: 鄭勝武, 杜子婧, 黃雄梅, 莊兢, 林根輝, 楊宇, 丁昕, 昝濤. 去鐵胺促進BMSCs靶向歸巢和血管新生的實驗研究. 中國修復重建外科雜志, 2019, 33(1): 85-92. doi: 10.7507/1002-1892.201809065 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
缺血性疾病如心肌缺血、腦缺血、肢體缺血、慢性創面不愈合等是一類嚴重危害人類健康的疾病,干細胞移植可以誘導血管新生、參與受損組織的再生,是解決缺血性疾病最有前景的治療方法[1-3]。但是,干細胞體內移植后僅少數細胞參與到修復組織中,嚴重制約了細胞治療的療效[1]。BMSCs 在組織修復的血管新生和血管生成過程中起重要作用[2],可以向損傷處遷移,對缺氧發出的信號做出回應[3]。本研究擬應用去鐵胺(desferrioxamine,DFO)作為低氧模擬劑調控靶器官局部微環境,誘導 BMSCs 歸巢,增加靶向組織中干細胞的數量,以期改進細胞移植治療效果。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
SPF 級 4 周齡 Lewis 雄性大鼠 40 只,體質量 75~95 g,由上海斯萊克實驗動物有限公司提供。1 周齡、3 周齡熒光素酶轉基因 Lewis 雄性大鼠各 5 只,體質量分別為 18~22 g 和 55~65 g,由日本 Jichi 醫學院提供。所有動物實驗經上海交通大學醫學院附屬第九人民醫院醫學實驗動物倫理委員會批準,實驗動物使用許可證號 SYXK(滬)2015-0002。
淋巴細胞分離液(Sigma-Aldrich 公司,美國);小鼠抗 CD34 抗體(Santa Cruze 公司,美國);小鼠抗 CD31 抗體(DAKO 公司,美國);小鼠抗 CD29、小鼠抗 CD45、小鼠抗 CD90、兔抗 Ki67、兔抗熒光素酶抗體(Abcam 公司,美國);熒光素酶底物(Promega 公司,美國);山羊抗兔 555、山羊抗兔 488、山羊抗小鼠 555、山羊抗小鼠 488 抗體(Invitrogen 公司,美國)。CO2 培養箱(Beckman 公司,美國);倒置相差顯微鏡、熒光顯微鏡(Nikon 公司,日本);IVIS Imaging System 活體成像系統(Xenogen 公司,美國);激光散斑血流成像儀(Moor Instrument 公司,英國)。
1.2 細胞分離培養
1.2.1 BMSCs 分離培養及鑒定
取 5 只 3 周齡熒光素酶轉基因 Lewis 雄性大鼠,用 10% 水合氯醛過量麻醉處死。分離出股骨、脛骨和肱骨,沖出骨髓;200 目篩網過濾,以半徑 10 cm、1 500 r/min 離心 5 min;收集管底細胞,加入 3 mL 工作液(PBS+5%FBS)重懸混勻。15 mL 離心管底部加入 3 mL 淋巴細胞分離液(1.083 g/mL),上層加入骨髓細胞混懸液,以半徑 10 cm、2 200 r/min 離心 30 min,吸取中間混濁帶細胞,加入 PBS 液,以半徑 10 cm、1 500 r/min 離心 5 min;所得細胞團用含 10%FBS 的 DMEM 重懸,接種于 10 cm 培養皿中,37℃、5%CO2 培養箱內培養;原代細胞 3 d 換液,去除未貼壁細胞,待長滿后傳代。倒置相差顯微鏡觀察細胞形態,并采用流式細胞儀檢測細胞表面標記物,包括 CD29、CD45、CD90 和 CD34[4-5],并用 FCS express 4 軟件分析結果。
1.2.2 成纖維細胞(fibroblast,FB)分離與培養
取 5 只 1 周齡熒光素酶轉基因 Lewis 雄性大鼠,用 10% 水合氯醛過量麻醉處死。取大鼠軀干處皮膚,利用組織貼塊法分離和培養皮膚 FB,用酶消化法進行細胞傳代培養。
1.3 動物模型制備及分組
取 SPF 級 4 周齡 Lewis 雄性大鼠 40 只,以戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,背部皮膚剃毛備皮。依據調整的 McFarlane 皮瓣模型[6],設計以尾部為蒂、大小為 10 cm×3 cm 的矩形皮瓣,皮瓣上緣為肩胛下角水平,下緣為髂嵴下 2 cm。按照皮瓣設計掀起皮瓣:切開皮膚、皮下組織,沿深筋膜表面掀開,保留皮瓣肉膜層;3-0 絲線全層間斷縫合,制備缺血隨意皮瓣動物模型。
細胞移植前,用 0.25% 胰蛋白酶消化細胞,以半徑 10 cm、1 500 r/min 離心 5 min,棄上清,10 mL PBS 重懸;取 10 μL 細胞懸液和 10 μL 錐蟲藍充分混合,滴于細胞計數板上,計數細胞總數,調整細胞濃度為 1×106個/mL。
將造模后動物隨機分成 4 組,每組 10 只。造模后 30 min,A 組于大鼠球后靜脈叢注射 200 μL PBS,注射器沿大鼠眼部內眥處刺入,回抽有回血后緩慢注射;B、C 組同上法分別注射濃度為 1×106個/mL 的 FB 和 BMSCs 200 μL;D 組同 C 組方法注射 BMSCs 后,腹腔注射 DFO[100 mg/(kg·d)],連續 7 d。
1.4 觀測指標
1.4.1 皮瓣成活率檢測
術后 7 d 每組取 6 只大鼠,由 2 名觀察者采用雙盲法判斷皮瓣成活情況,皮瓣壞死標準為質硬、色深或壞死形成創面。拍照后將圖像輸入計算機,應用 Image-Pro Plus 6.0 圖像分析系統處理數據,按以下公式計算皮瓣成活率:皮瓣成活面積/皮瓣總面積×100%。
1.4.2 激光散斑血流成像儀檢測皮瓣血流
術后 7 d 每組取 6 只大鼠,以戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,靜置 10 min;待呼吸平穩后將皮瓣掀開,反向展開后用激光散斑血流成像儀監測皮瓣血流,觀察皮瓣的血流灌注范圍及強度(紅色表示血流較強區域,藍色表示血流較少區域)。通過 moorFLPI 2.0 軟件處理分析數據,將皮瓣分為近端、中部和遠端 3 個部分,計算比較各組不同區域血流值[單位采用單位血流灌注量(blood perfusion units,BPU)]的差異。
1.4.3 生物發光成像檢測移植細胞在體內分布情況
分別在細胞移植術后 30 min 及 1、4、7、14 d 時,取 B、C、D 3 組大鼠各 4 只,于每只大鼠腹腔注射 D-熒光素(300 mg/kg);10 min 后將大鼠置于麻醉箱內,2.5% 異氟烷吸入麻醉;然后將大鼠置于成像的 CCD 暗室中,成像時間 2 min;通過 Caliper Life Sciences 軟件分析大鼠體表絕對發光量,光子強度單位為 phontons/(sec·cm2·sr),即單位時間單位面積單位弧度從動物體表發出的絕對光子數。在生物發光獲得的圖片中,紅色代表光子信號最強,藍色代表光子信號最弱。
1.4.4 免疫熒光染色觀察
術后 7 d 每組取 6 只大鼠,以戊巴比妥鈉(200 mg/kg)腹腔注射過量麻醉致死。取壞死和成活交界處附近皮瓣組織,4% 多聚甲醛固定 4 h,30% 蔗糖脫水過夜,OCT 包埋組織,冰凍切片,片厚 7 μm。將切片置于 0.25%Triton X-100 溶液中 5 min,破膜,PBS 清洗 3 次;將切片置于濕盒中,滴加 20% 羊血清封閉液室溫孵化 1 h,甩去血清,勿洗;分別滴加一抗:小鼠抗 CD31、兔抗基質細胞衍生因子 1(stromal cell derived factor 1,SDF-1)、小鼠抗 FGF、兔抗 EGF、兔抗 Ki67 和熒光素酶抗體(0.1% 牛血清白蛋白稀釋抗體,均為 1∶50);放置至室溫,PBS 沖洗 3 次,每次 5 min;滴加熒光二抗:山羊抗兔 555、山羊抗兔 488、山羊抗小鼠 555、山羊抗小鼠 488(1∶500),37℃ 放置 1 h;PBS 搖床晃洗 3 次,每次 15 min;DAPI 1∶1 000 稀釋滴加于切片上,染色 5 s;PBS 清洗 5 min×3 次,熒光封片劑封片,–20℃ 保存;熒光顯微鏡拍照,Image-Pro Plus 6.0 圖像分析軟件分析。其中 CD31 特異性染色可以標記小血管和微血管,經過 200 倍視野下計數 CD31 陽性染色情況計算毛細血管密度;檢測組織中 SDF-1、EGF、FGF 等以明確促血管生成因子的表達情況;檢測組織中 Ki67 的表達以明確細胞增殖情況;利用熒光素酶抗體標記移植的 BMSCs,免疫熒光染色觀察其是否參與損傷組織的修復。
1.5 統計學方法
采用 SPSS16.0 統計軟件進行分析。數據以均數±標準差表示,方差齊時,組間比較采用單因素方差分析,兩兩比較采用 LSD-t 檢驗;方差不齊時,兩兩比較采用 Mann-Whitney U 檢驗,多重檢驗校正采用 Bonferroni 校正;檢驗水準 α=0.05。
2 結果
2.1 BMSCs 分離培養與鑒定
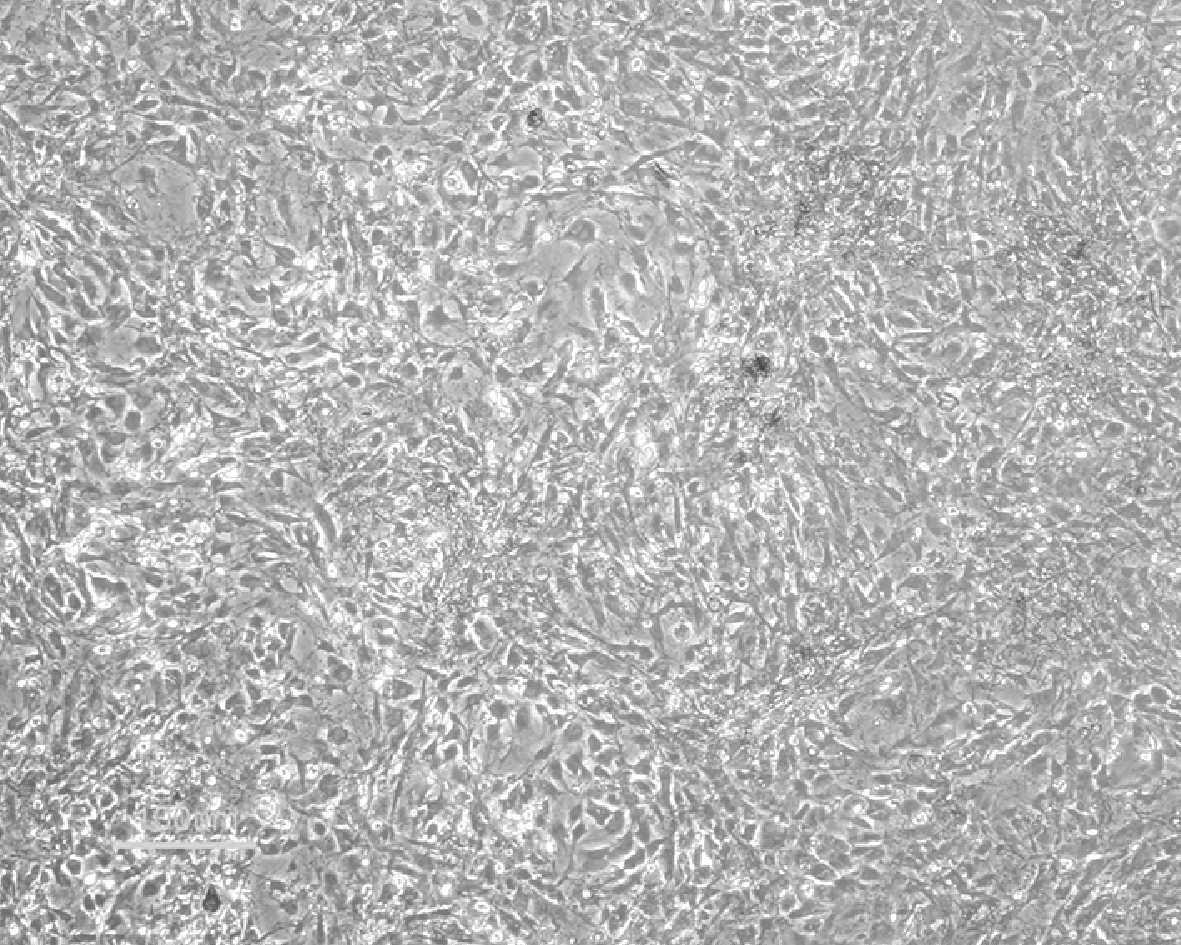
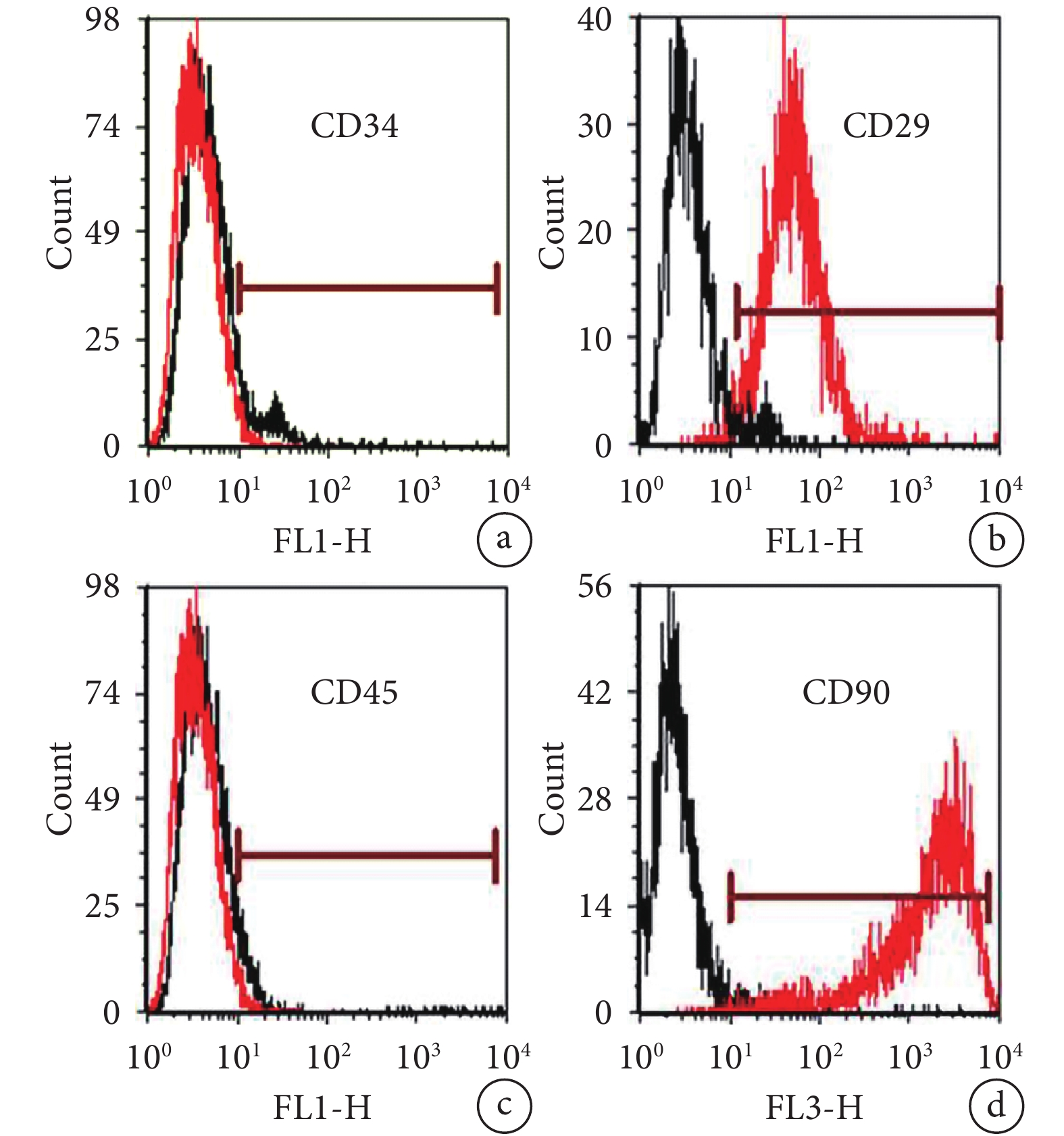
倒置相差顯微鏡觀察示,轉基因大鼠 BMSCs 接種于培養皿培養 7 d 時,細胞呈典型的梭形。見圖 1。培養 7 d 流式細胞儀分析示,細胞表面標記物 CD29、CD90 表達陽性,CD34、CD45 表達陰性,鑒定培養細胞為 BMSCs。見圖 2。
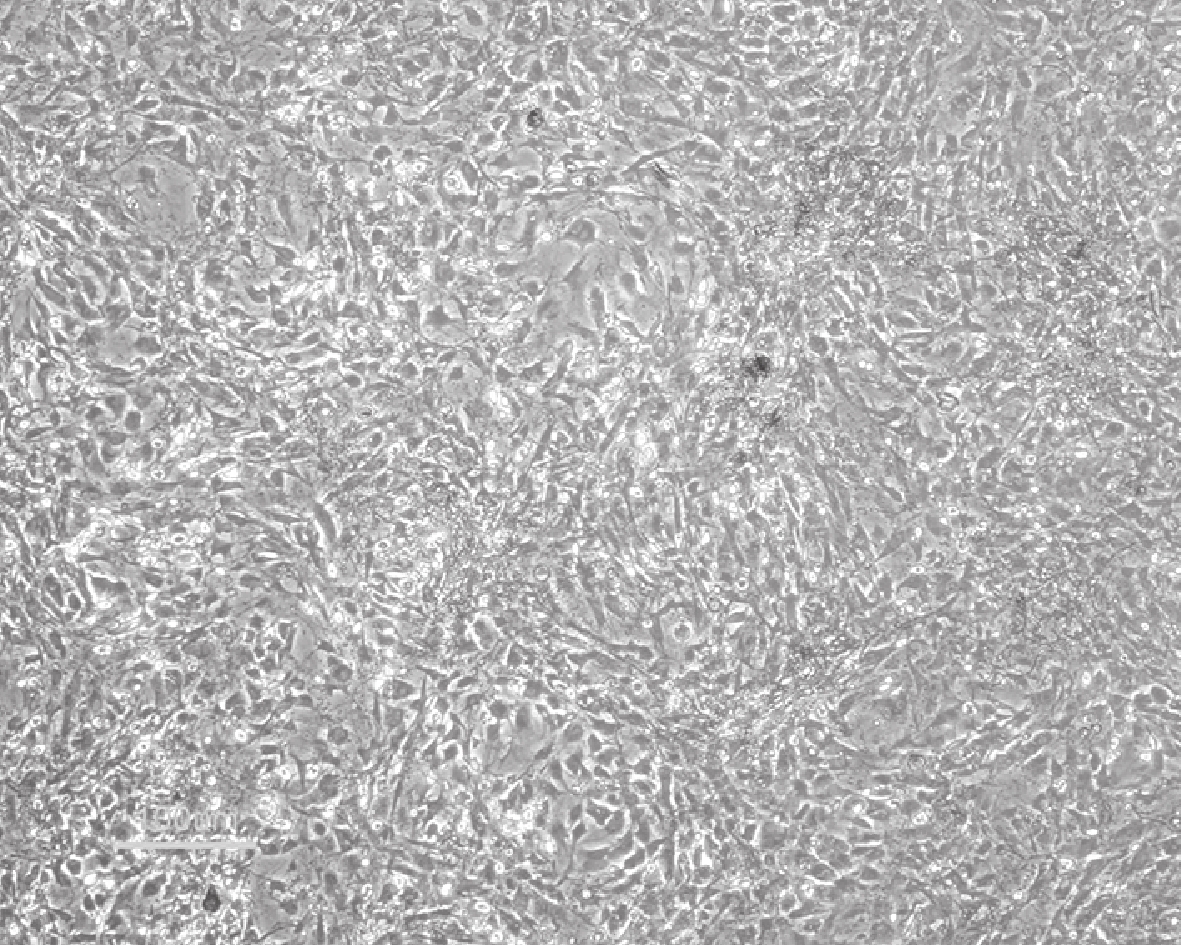 圖1
培養 7 d BMSCs 形態觀察(倒置相差顯微鏡×200)
Figure1.
Morphology observation of BMSCs cultured for 7 days (Inverted phase contrast microscope×200)
圖1
培養 7 d BMSCs 形態觀察(倒置相差顯微鏡×200)
Figure1.
Morphology observation of BMSCs cultured for 7 days (Inverted phase contrast microscope×200)
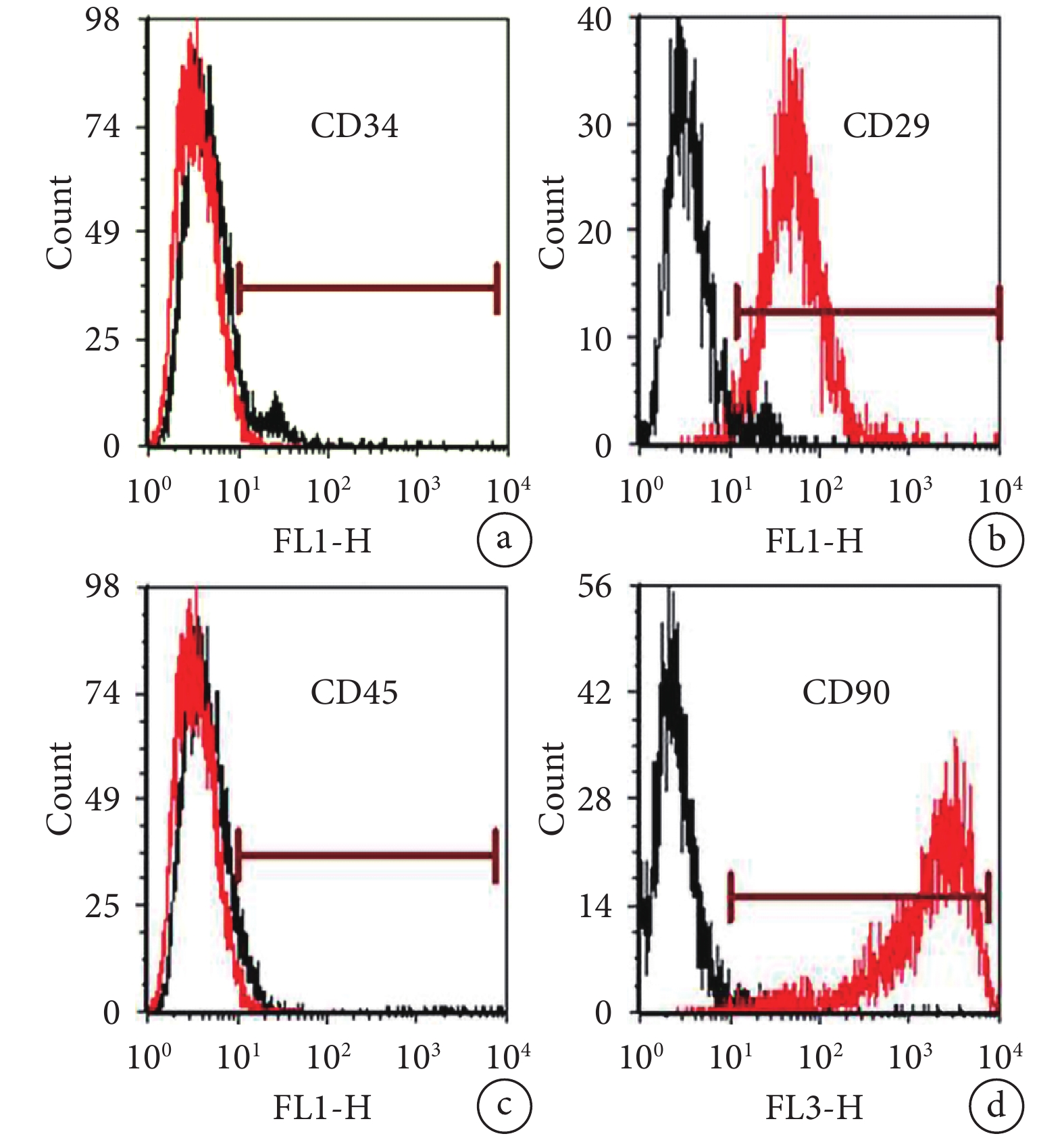 圖2
培養 7 d 流式細胞儀分析細胞表面標記物表達
圖2
培養 7 d 流式細胞儀分析細胞表面標記物表達
a. CD34;b. CD29;c. CD45;d. CD90
Figure2. Expression of cell surface markers detected by flow cytometry at 7 days after culturinga. CD34; b. CD29; c. CD45; d. CD90
2.2 皮瓣成活率檢測
術后 7 d 各組缺血皮瓣壞死邊界已明確,C、D 組皮瓣成活質量和面積明顯高于 A、B 組。A、B、C、D 組皮瓣成活率分別為 62.83%±1.51%、65.08%±1.26%、76.52%±2.56%、84.48%±1.41%,C、D 組明顯高于 A、B 組,D 組高于 C 組,差異有統計學意義(P<0.05);A、B 組間差異無統計學意義(P>0.05)。
2.3 激光散斑血流成像儀檢測皮瓣血流
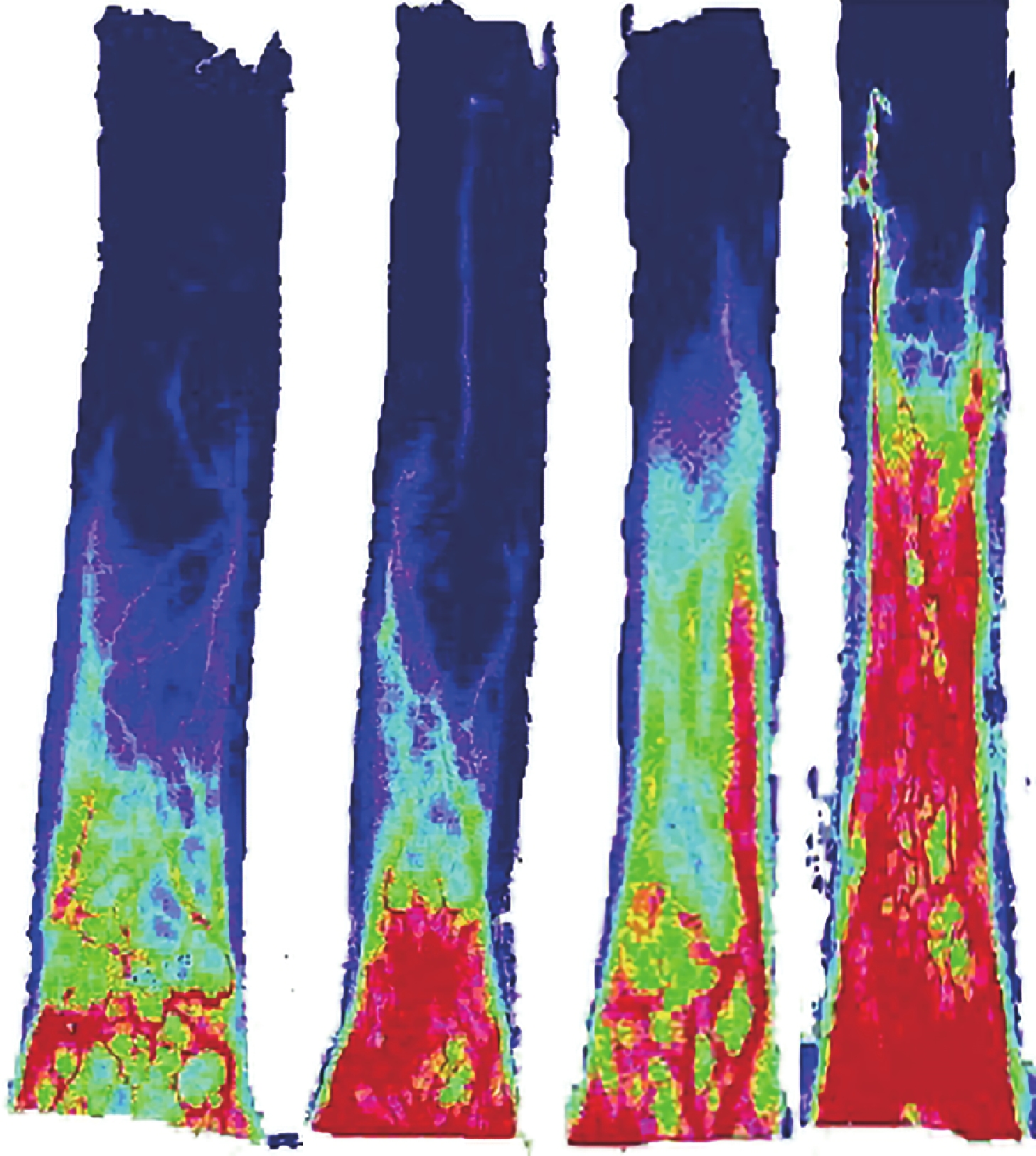
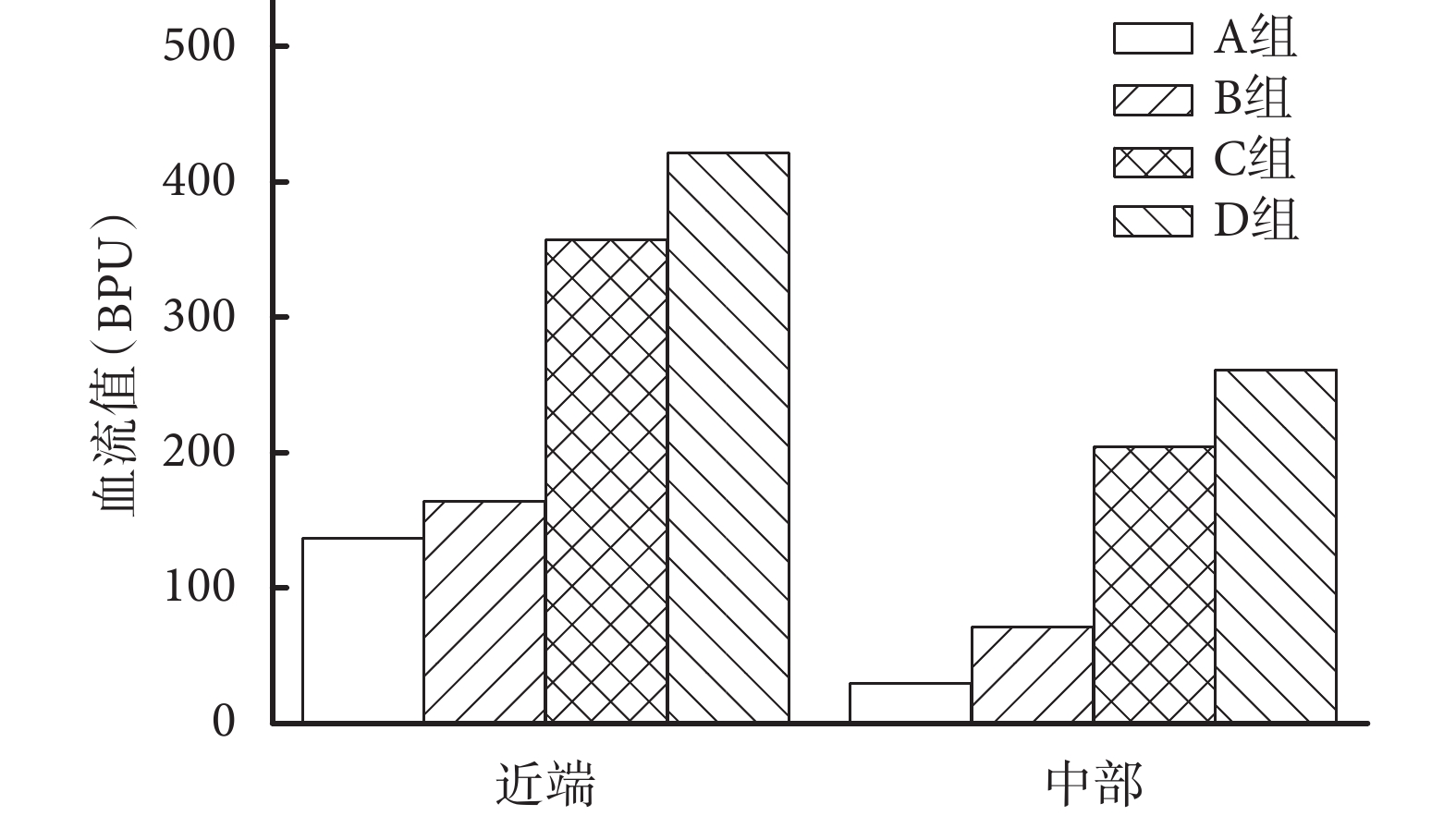
術后 7 d C、D 組皮瓣缺血區的血流灌注范圍和強度均明顯大于 A、B 組,D 組大于 C 組。見圖 3。各組皮瓣遠端基本都壞死,未進行遠端的血流分析。C、D 組皮瓣近端和中部的血流值均顯著高于 A、B 組,D 組高于 C 組,差異有統計學意義(P<0.05);A、B 組間差異無統計學意義(P>0.05)。見圖 4。
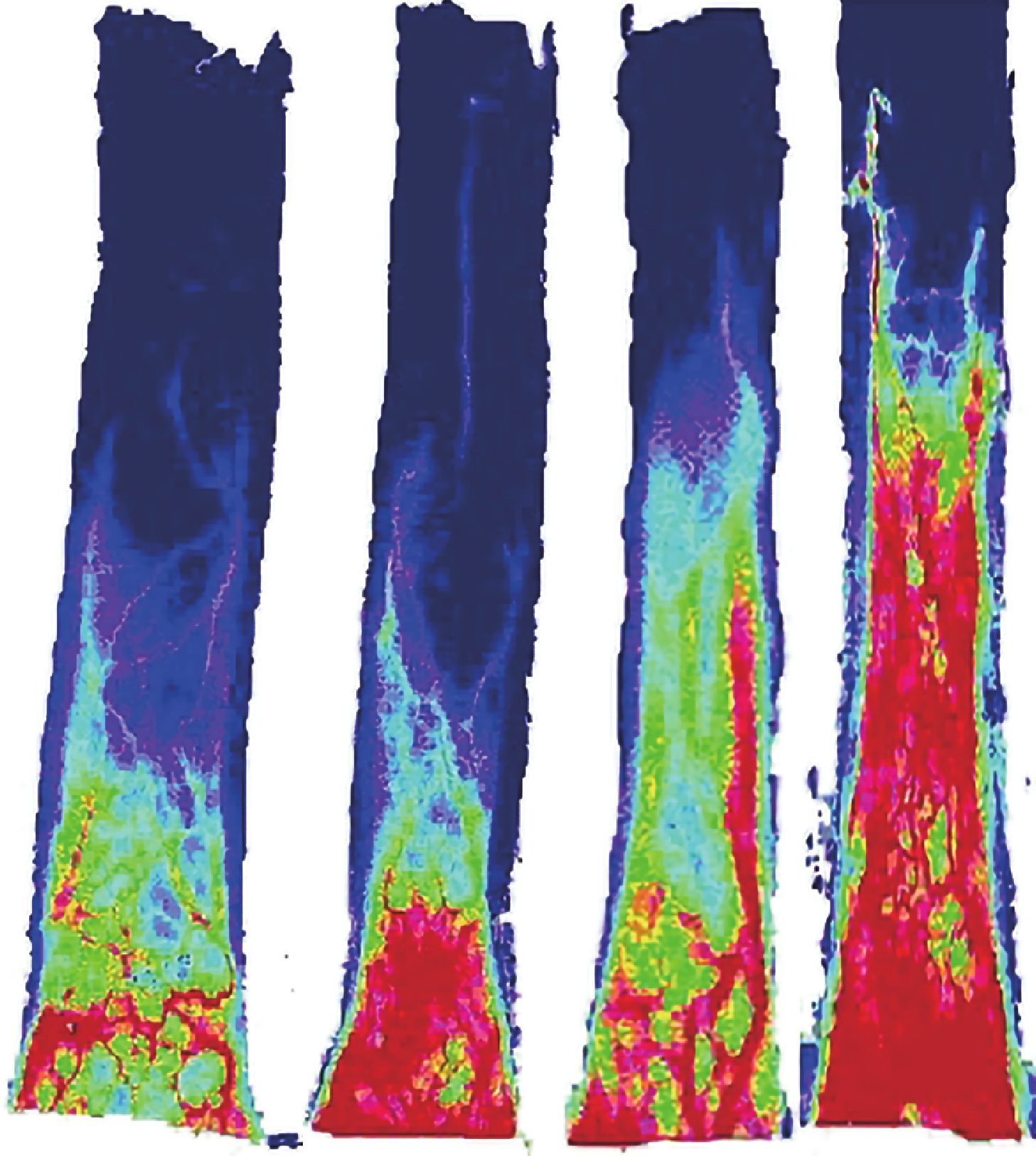 圖3
術后 7 d 各組皮瓣血流成像圖
圖3
術后 7 d 各組皮瓣血流成像圖
從左至右依次為 A、B、C、D 組
Figure3. Blood flow imaging of flaps in each group at 7 days after operationFrom left to right for groups A, B, C, and D respectively
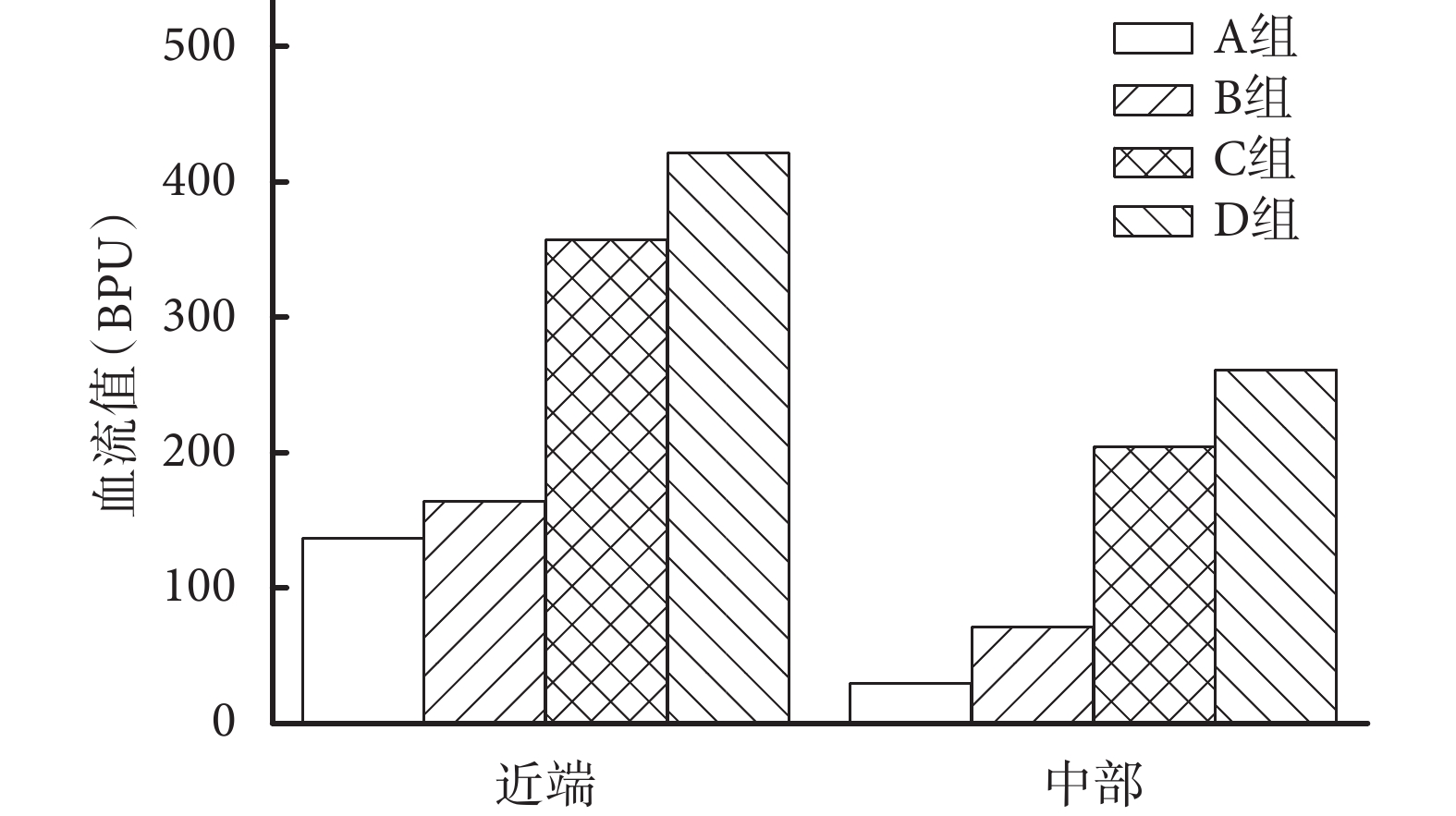 圖4
術后 7 d 各組皮瓣近端和中部血流值比較
Figure4.
Comparison of blood perfusion units in the proximal and middle parts of flaps in different group at 7 days after operation
圖4
術后 7 d 各組皮瓣近端和中部血流值比較
Figure4.
Comparison of blood perfusion units in the proximal and middle parts of flaps in different group at 7 days after operation
2.4 生物發光成像檢測移植細胞在體內分布情況
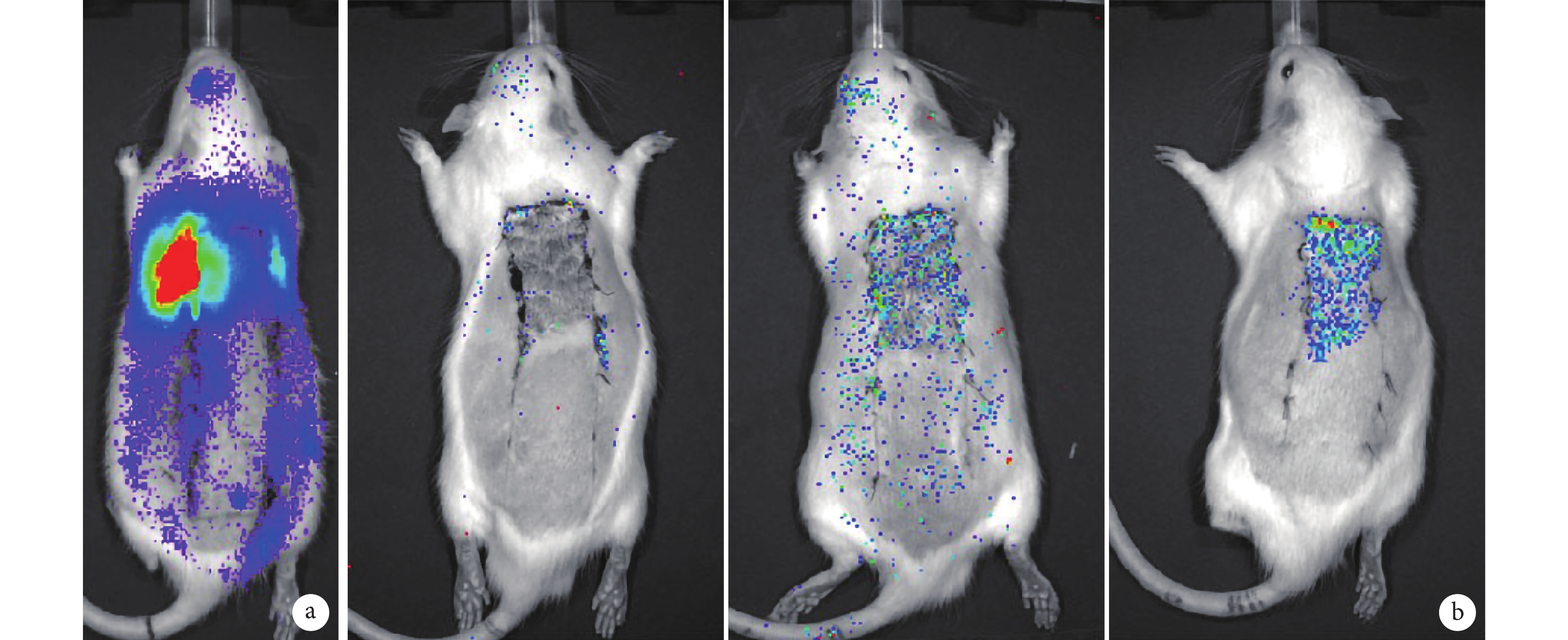
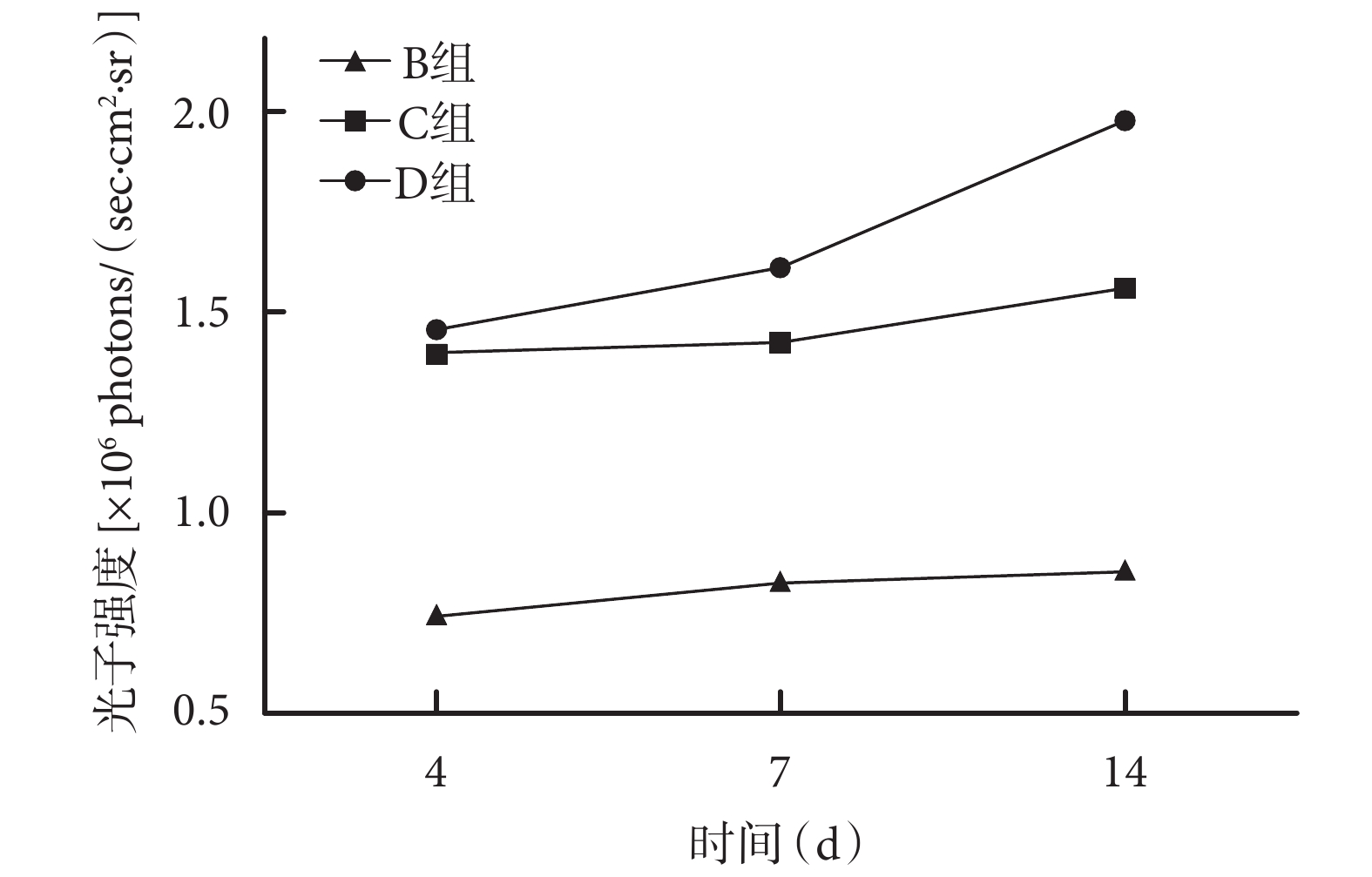
細胞移植術后 30 min C、D 組移植細胞主要聚集在大鼠肺內,隨時間延長肺內信號逐漸減弱;術后 7 d,D 組有少量細胞聚集于缺血缺氧區域,在非缺氧區域很少聚集;術后 14 d,D 組損傷和正常組織交界處有明顯的信號聚集,C 組損傷和正常組織交界處也有信號聚集,但信號明顯弱于 D 組。B 組損傷和正常組織交界處在術后觀察時間段內均未發現明顯的信號聚集。見圖 5。術后各時間點 C、D 組大鼠體表對生物發光信號的光子強度顯著大于 B 組,D 組大于 C 組,差異均有統計學意義(P<0.05)。見圖 6。
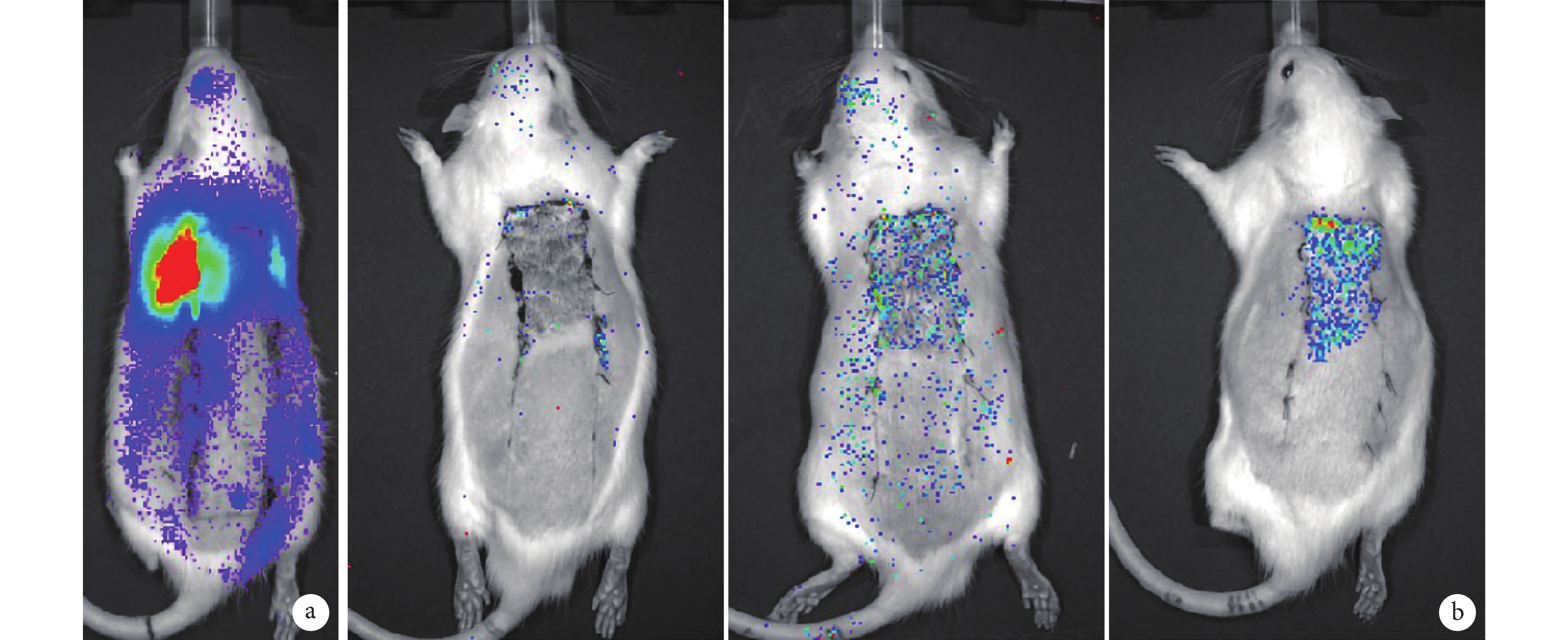 圖5
術后各時間點各組生物發光成像觀察
圖5
術后各時間點各組生物發光成像觀察
a. D 組術后 30 min ;b. 術后 14 d(從左至右依次為 B、C、D 組)
Figure5. Bioluminescence imaging at different time points after operation in defferent groupsa. At 30 minutes after operation in group D; b. At 14 days after operation (From left to right for groups B, C, and D respectively)
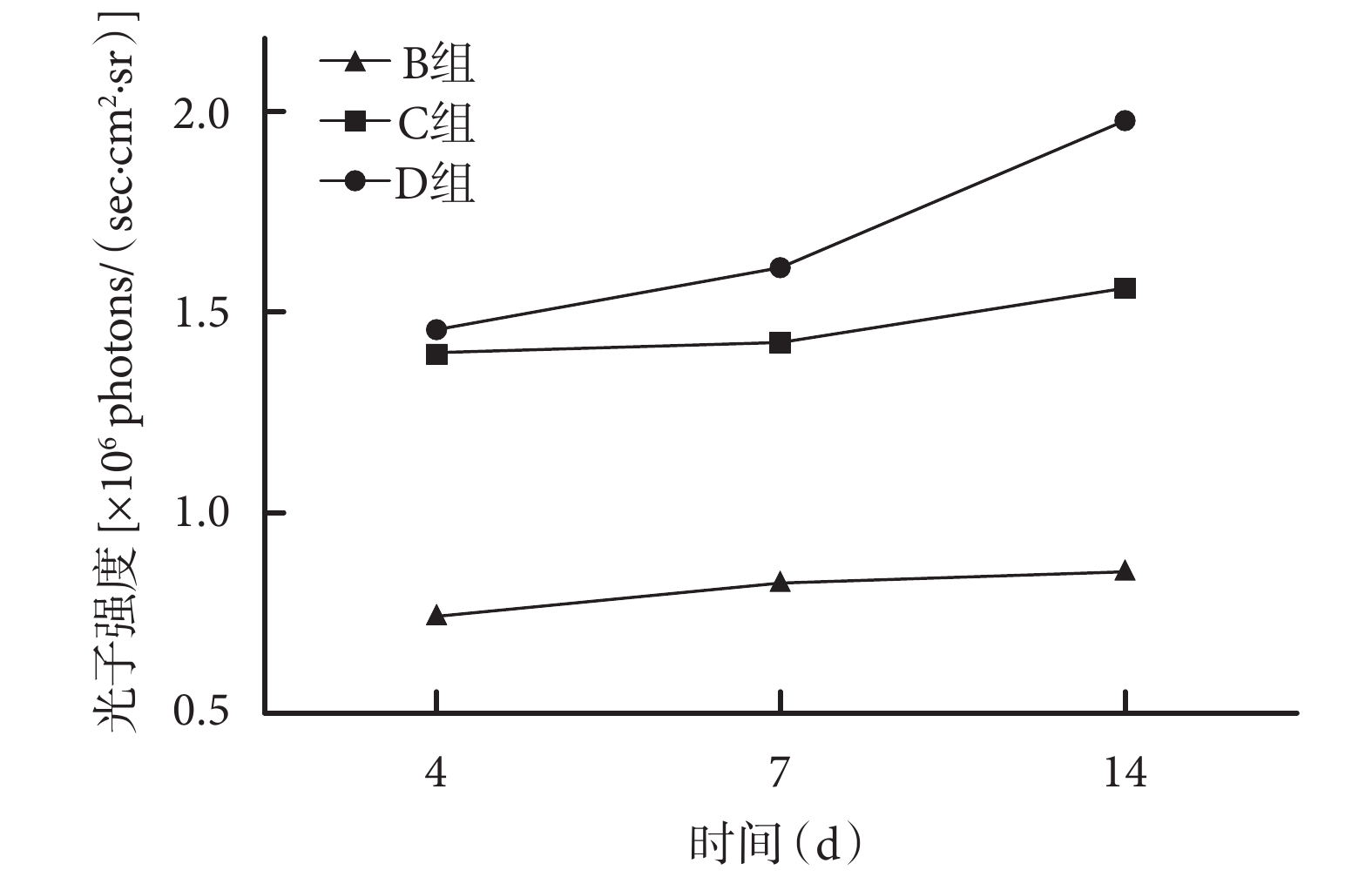 圖6
術后各時間點各組生物發光成像觀察
Figure6.
Quantification of bioluminescence imaging signals at different time points after operation in different groups
圖6
術后各時間點各組生物發光成像觀察
Figure6.
Quantification of bioluminescence imaging signals at different time points after operation in different groups
2.5 免疫熒光染色觀察
2.5.1 毛細血管密度計數
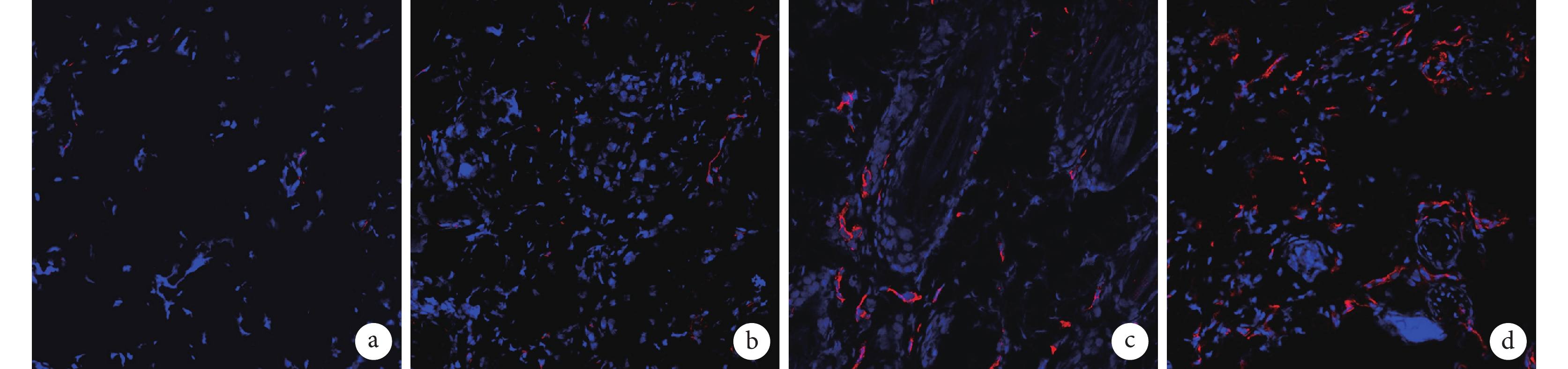
熒光顯微鏡觀察示,術后 7 d C、D 組毛細血管密度明顯高于 A、B 組,見圖 7。A、B、C、D 組毛細血管密度分別為(94.41±11.71)、(134.30±5.74)、(243.22±8.83)、(349.37±8.77)個/mm2,C、D 組顯著高于 A、B 組,D 組顯著高于 C 組,差異均有統計學意義(P<0.05)。
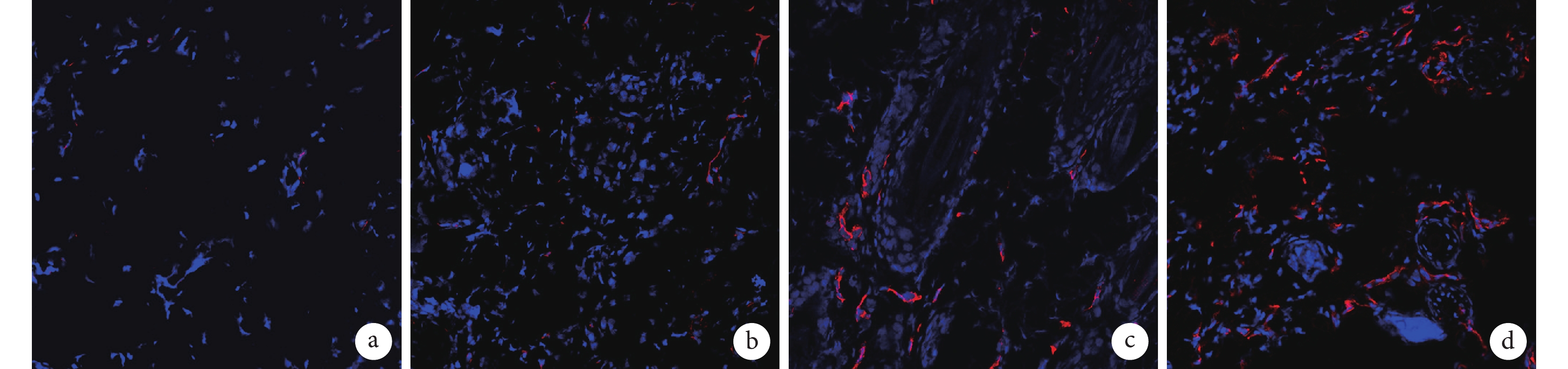 圖7
術后 7 d 各組 CD31 免疫熒光染色觀察微血管情況(熒光顯微鏡×200)
圖7
術后 7 d 各組 CD31 免疫熒光染色觀察微血管情況(熒光顯微鏡×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure7. CD31 immunofluorescent staining showed microvessel in different groups at 7 days after operation (Fluorescence microscopy×200)a. Group A; b. Group B; c. Group C; d. Group D2.5.2 細胞因子檢測
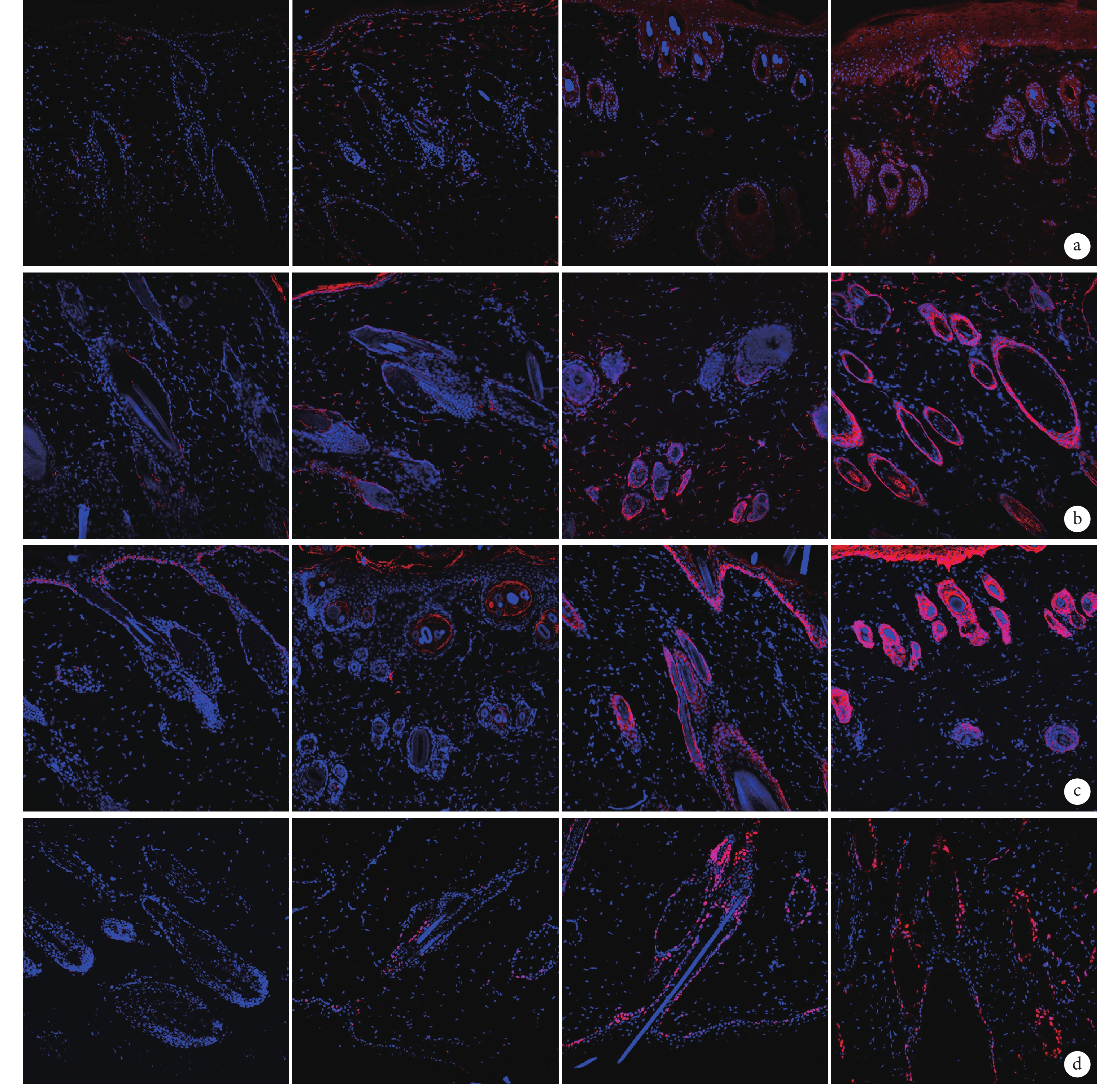
熒光顯微鏡觀察示,術后 7 d C、D 組組織中 SDF-1、EGF、FGF 及 Ki67 表達均明顯強于 A、B 組,D 組強于 C 組;A、B 組各因子表達均很弱,差異不明顯。見圖 8。
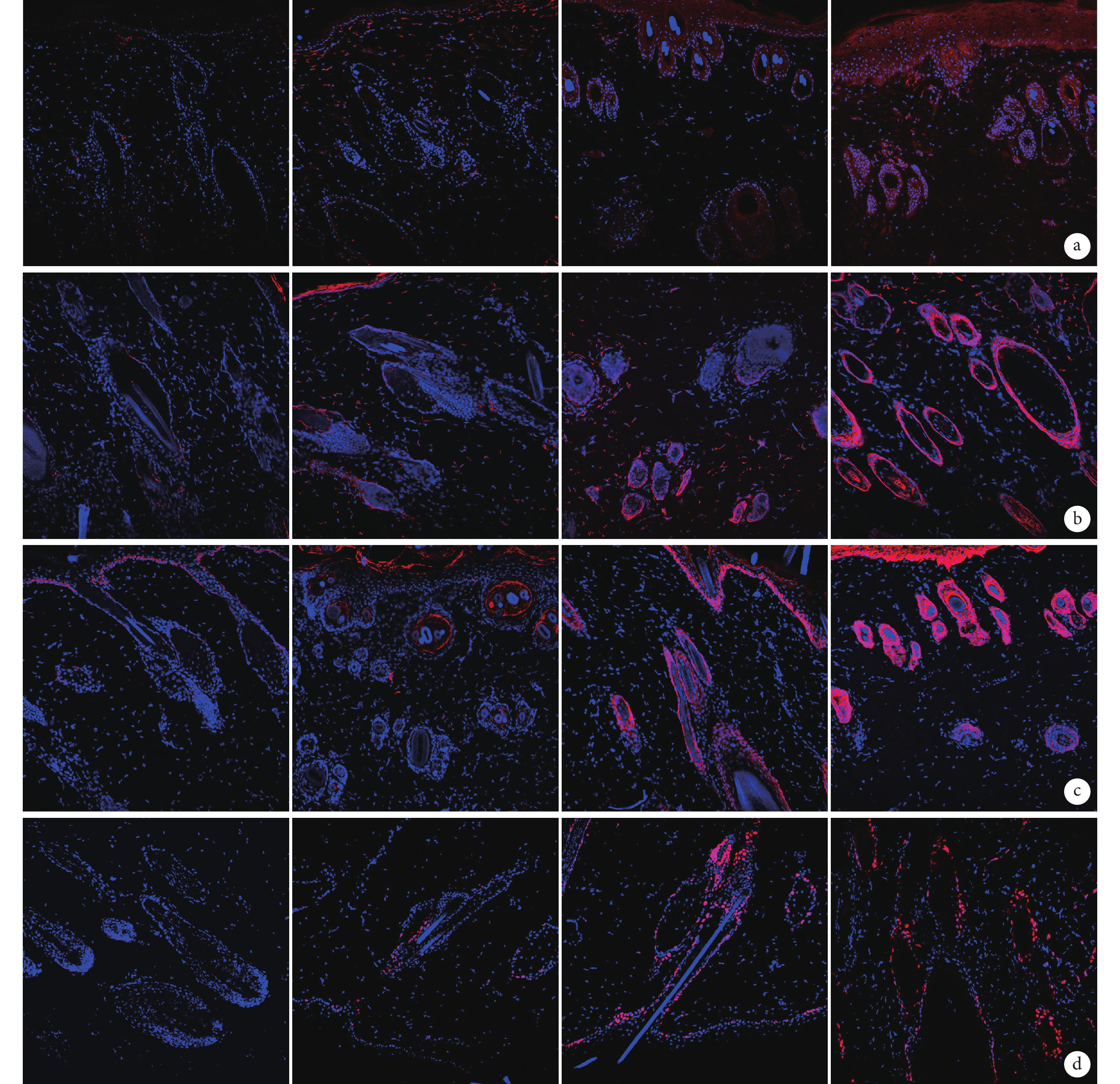 圖8
術后 7 d 各組免疫熒光染色觀察各因子表達情況(熒光顯微鏡×200)
圖8
術后 7 d 各組免疫熒光染色觀察各因子表達情況(熒光顯微鏡×200)
從左至右依次為 A、B、C、D 組 a. EGF;b. FGF;c. SDF-1;d. Ki67
Figure8. Expression of EGF, FGF, SDF-1, and Ki67 in different groups by immunofluorescence staining at 7 days after operation (Fluorescence microscopy×200)From left to right for groups B, C, and D respectively a. EGF; b. FGF; c. SDF-1; d. Ki67
2.5.3 移植的 BMSCs 轉歸檢測
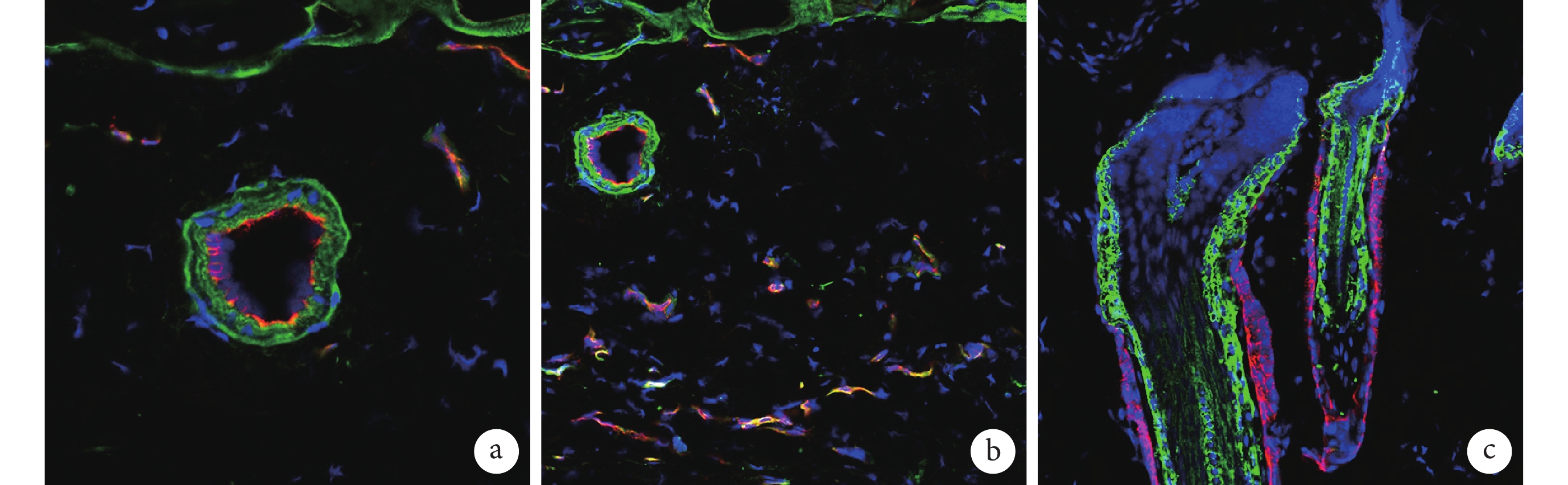
熒光顯微鏡觀察示,術后 7 d D 組移植的熒光素酶標記 BMSCs 表達于組織的動脈彈力層、毛細血管處和毛囊處。見圖 9。
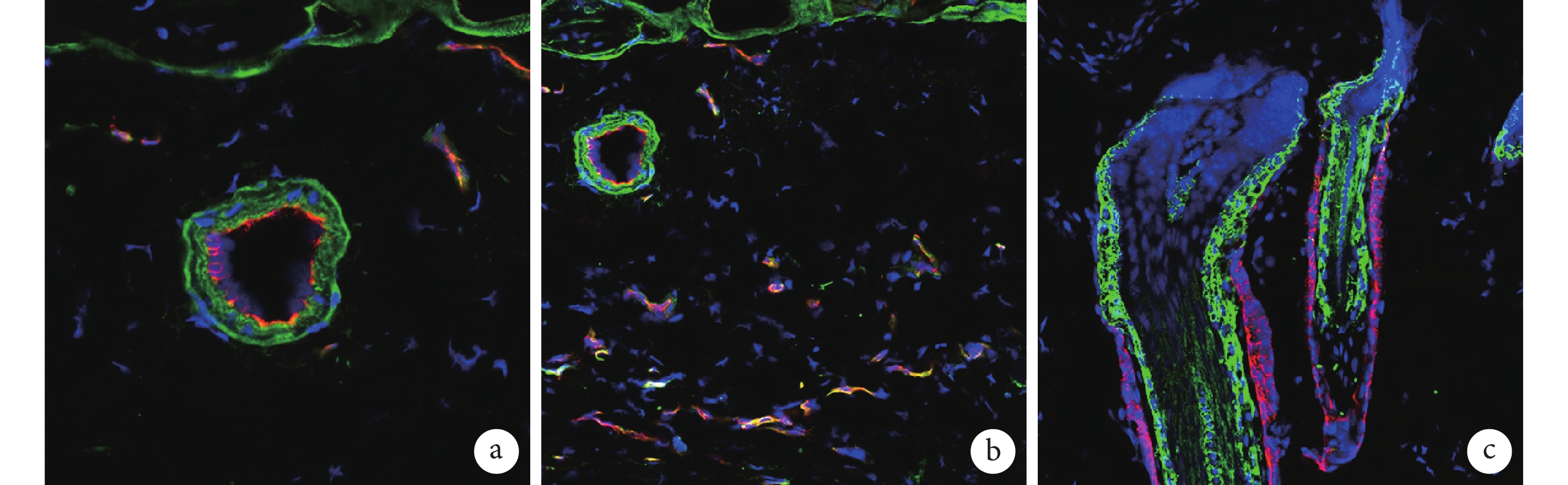 圖9
熒光素酶抗體標記移植的 BMSCs 在各部位表達情況(熒光顯微鏡×200)
圖9
熒光素酶抗體標記移植的 BMSCs 在各部位表達情況(熒光顯微鏡×200)
a. 表達于動脈的彈力層;b. 表達于毛細血管處;c. 表達于毛囊處(綠色示熒光素酶,紅色示 K14,藍色示細胞核)
Figure9. Expression of luciferase-BMSCs with antibody in different parts (Fluorescence microscopy×200)a. Expression in the elastic layer of the artery; b. Expression in capillaries; c. Expression in the hair follicle (Green indicated luciferase, red indicated K14, and blue indicated nuclei)
3 討論
MSCs 是一種低免疫原性的成體干細胞,具有多向分化潛能,而取材來源于成年骨髓組織的 BMSCs,因不涉及道德和倫理方面的問題,目前已獲批準作為干細胞治療藥物試用于臨床,但仍有許多問題有待進一步深入研究[7]。BMSCs 歸巢于靶向組織是其作為種子細胞應用于臨床的前提,只有保證一定的歸巢率,才能保證 MSCs 的應用療效。因此,如何促進干細胞歸巢是目前干細胞研究領域的熱點之一。
目前 MSCs 歸巢的機制仍不能完全明確,主要的分子機制包括 SDF-1/CXCR4 信號軸、HGF/c-met 信號軸、MCP-3/CCR1,3,5 信號軸以及黏附因子等[8]。其中 SDF-1/CXCR4 信號軸通路是目前研究最多的一種機制,研究者使用了多種方法來增強該通路的功能,以達到提高干細胞歸巢效率的目的。一方面可以提高靶組織 SDF-1 的含量,另一方面可以上調 CXCR4 在 MSCs 的表達[9-10]。在既往研究中發現,外源性的細胞移植到皮瓣模型中,隨著氧濃度的降低,歸巢的細胞數量越多,在非缺氧區域較難發現干細胞的停留[11]。低氧是組織和器官缺血的第一病理生理反應,研究表明低氧環境可以誘導 SDF-1 和 VEGF 的表達,從而促進缺血組織血管化以回應缺氧[11-12]。低氧模擬劑可以通過穩定 HIF-1α,抑制降解,模擬缺氧環境[13-14]。DFO 是一種鐵離子螯合劑,目前臨床上主要用于重金屬中毒的治療,在實驗中常被用為低氧模擬劑。在下肢缺血實驗中,DFO 的應用促進了血管內皮祖細胞歸巢,改善了缺血下肢的血流,促進了缺血組織的血管新生[15-16]。在本實驗中,我們檢測了 DFO 對 BMSCs 遷移歸巢及分化的影響,以及對缺血組織血管新生的影響。
在皮瓣模型和創傷模型中移植 BMSCs 可加速創傷愈合速度,熒光顯微鏡下觀察到外源性 BMSCs 整合于血管壁的結構中[17-18]。同時 BMSCs 也有旁分泌功能,可以分泌 VEGF、EGF、FGF 等細胞因子,這些細胞因子對血管化也有重要作用[19-20],與組織修復和再生相關[21-23]。在本研究中,我們觀察到 BMSCs 參與到了缺血組織的修復中,術后 7~14 d 生物發光成像信號觀察到外源性細胞聚集于缺血損傷處;同樣,免疫熒光染色觀察到移植的 BMSCs 出現于血管壁結構中以及毛囊的部分結構中,同時細胞因子的染色也高于 A、B 組。這些結果表明 BMSCs 參與到了損傷皮瓣的修復,增加了皮瓣缺血缺氧處細胞因子的表達,從而改善血流。
應用生物發光成像技術可動態觀察細胞遷移和分布情況,本研究結果顯示,生物發光信號在 BMSCs 移植早期主要聚集于肺內,術后 7 d 時 D 組有少量細胞聚集于缺血缺氧區域,在非缺氧區域很少聚集,術后 14 d 時缺血區域信號進一步增加;免疫熒光染色顯示 D 組有更多的外源性細胞整合到了損傷組織中。這些結果表明 DFO 的使用促進了 BMSCs 的遷移歸巢以及分化。免疫熒光染色檢測組織結果表明,DFO 的應用促進了組織中 SDF-1 的表達,說明 DFO 可以通過增強 SDF-1/CXCR4 信號軸通路功能促進 BMSCs 靶向歸巢。
本研究中 D 組皮瓣成活率明顯高于其他組,激光散斑血流成像結果顯示 D 組的血流量明顯高于其他組,CD31 免疫熒光染色結果顯示 D 組進一步增加了損傷處的毛細血管密度。這些結果表明 DFO 的使用促進了缺血皮瓣的血管新生。
綜上述,BMSCs 可以促進缺血皮瓣血管化,改善局部血流,減少壞死面積,有助于損傷組織的修復。DFO 作為低氧模擬劑,模擬缺氧環境,刺激組織血管化,同時是一種有效的促進 BMSCs 向損傷處遷移歸巢、參與組織修復的方法。皮瓣的缺血壞死仍是臨床經常遇到的并發癥,DFO 給我們提供了一個解決該問題的新思路。
缺血性疾病如心肌缺血、腦缺血、肢體缺血、慢性創面不愈合等是一類嚴重危害人類健康的疾病,干細胞移植可以誘導血管新生、參與受損組織的再生,是解決缺血性疾病最有前景的治療方法[1-3]。但是,干細胞體內移植后僅少數細胞參與到修復組織中,嚴重制約了細胞治療的療效[1]。BMSCs 在組織修復的血管新生和血管生成過程中起重要作用[2],可以向損傷處遷移,對缺氧發出的信號做出回應[3]。本研究擬應用去鐵胺(desferrioxamine,DFO)作為低氧模擬劑調控靶器官局部微環境,誘導 BMSCs 歸巢,增加靶向組織中干細胞的數量,以期改進細胞移植治療效果。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
SPF 級 4 周齡 Lewis 雄性大鼠 40 只,體質量 75~95 g,由上海斯萊克實驗動物有限公司提供。1 周齡、3 周齡熒光素酶轉基因 Lewis 雄性大鼠各 5 只,體質量分別為 18~22 g 和 55~65 g,由日本 Jichi 醫學院提供。所有動物實驗經上海交通大學醫學院附屬第九人民醫院醫學實驗動物倫理委員會批準,實驗動物使用許可證號 SYXK(滬)2015-0002。
淋巴細胞分離液(Sigma-Aldrich 公司,美國);小鼠抗 CD34 抗體(Santa Cruze 公司,美國);小鼠抗 CD31 抗體(DAKO 公司,美國);小鼠抗 CD29、小鼠抗 CD45、小鼠抗 CD90、兔抗 Ki67、兔抗熒光素酶抗體(Abcam 公司,美國);熒光素酶底物(Promega 公司,美國);山羊抗兔 555、山羊抗兔 488、山羊抗小鼠 555、山羊抗小鼠 488 抗體(Invitrogen 公司,美國)。CO2 培養箱(Beckman 公司,美國);倒置相差顯微鏡、熒光顯微鏡(Nikon 公司,日本);IVIS Imaging System 活體成像系統(Xenogen 公司,美國);激光散斑血流成像儀(Moor Instrument 公司,英國)。
1.2 細胞分離培養
1.2.1 BMSCs 分離培養及鑒定
取 5 只 3 周齡熒光素酶轉基因 Lewis 雄性大鼠,用 10% 水合氯醛過量麻醉處死。分離出股骨、脛骨和肱骨,沖出骨髓;200 目篩網過濾,以半徑 10 cm、1 500 r/min 離心 5 min;收集管底細胞,加入 3 mL 工作液(PBS+5%FBS)重懸混勻。15 mL 離心管底部加入 3 mL 淋巴細胞分離液(1.083 g/mL),上層加入骨髓細胞混懸液,以半徑 10 cm、2 200 r/min 離心 30 min,吸取中間混濁帶細胞,加入 PBS 液,以半徑 10 cm、1 500 r/min 離心 5 min;所得細胞團用含 10%FBS 的 DMEM 重懸,接種于 10 cm 培養皿中,37℃、5%CO2 培養箱內培養;原代細胞 3 d 換液,去除未貼壁細胞,待長滿后傳代。倒置相差顯微鏡觀察細胞形態,并采用流式細胞儀檢測細胞表面標記物,包括 CD29、CD45、CD90 和 CD34[4-5],并用 FCS express 4 軟件分析結果。
1.2.2 成纖維細胞(fibroblast,FB)分離與培養
取 5 只 1 周齡熒光素酶轉基因 Lewis 雄性大鼠,用 10% 水合氯醛過量麻醉處死。取大鼠軀干處皮膚,利用組織貼塊法分離和培養皮膚 FB,用酶消化法進行細胞傳代培養。
1.3 動物模型制備及分組
取 SPF 級 4 周齡 Lewis 雄性大鼠 40 只,以戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,背部皮膚剃毛備皮。依據調整的 McFarlane 皮瓣模型[6],設計以尾部為蒂、大小為 10 cm×3 cm 的矩形皮瓣,皮瓣上緣為肩胛下角水平,下緣為髂嵴下 2 cm。按照皮瓣設計掀起皮瓣:切開皮膚、皮下組織,沿深筋膜表面掀開,保留皮瓣肉膜層;3-0 絲線全層間斷縫合,制備缺血隨意皮瓣動物模型。
細胞移植前,用 0.25% 胰蛋白酶消化細胞,以半徑 10 cm、1 500 r/min 離心 5 min,棄上清,10 mL PBS 重懸;取 10 μL 細胞懸液和 10 μL 錐蟲藍充分混合,滴于細胞計數板上,計數細胞總數,調整細胞濃度為 1×106個/mL。
將造模后動物隨機分成 4 組,每組 10 只。造模后 30 min,A 組于大鼠球后靜脈叢注射 200 μL PBS,注射器沿大鼠眼部內眥處刺入,回抽有回血后緩慢注射;B、C 組同上法分別注射濃度為 1×106個/mL 的 FB 和 BMSCs 200 μL;D 組同 C 組方法注射 BMSCs 后,腹腔注射 DFO[100 mg/(kg·d)],連續 7 d。
1.4 觀測指標
1.4.1 皮瓣成活率檢測
術后 7 d 每組取 6 只大鼠,由 2 名觀察者采用雙盲法判斷皮瓣成活情況,皮瓣壞死標準為質硬、色深或壞死形成創面。拍照后將圖像輸入計算機,應用 Image-Pro Plus 6.0 圖像分析系統處理數據,按以下公式計算皮瓣成活率:皮瓣成活面積/皮瓣總面積×100%。
1.4.2 激光散斑血流成像儀檢測皮瓣血流
術后 7 d 每組取 6 只大鼠,以戊巴比妥鈉(50 mg/kg)腹腔注射麻醉,靜置 10 min;待呼吸平穩后將皮瓣掀開,反向展開后用激光散斑血流成像儀監測皮瓣血流,觀察皮瓣的血流灌注范圍及強度(紅色表示血流較強區域,藍色表示血流較少區域)。通過 moorFLPI 2.0 軟件處理分析數據,將皮瓣分為近端、中部和遠端 3 個部分,計算比較各組不同區域血流值[單位采用單位血流灌注量(blood perfusion units,BPU)]的差異。
1.4.3 生物發光成像檢測移植細胞在體內分布情況
分別在細胞移植術后 30 min 及 1、4、7、14 d 時,取 B、C、D 3 組大鼠各 4 只,于每只大鼠腹腔注射 D-熒光素(300 mg/kg);10 min 后將大鼠置于麻醉箱內,2.5% 異氟烷吸入麻醉;然后將大鼠置于成像的 CCD 暗室中,成像時間 2 min;通過 Caliper Life Sciences 軟件分析大鼠體表絕對發光量,光子強度單位為 phontons/(sec·cm2·sr),即單位時間單位面積單位弧度從動物體表發出的絕對光子數。在生物發光獲得的圖片中,紅色代表光子信號最強,藍色代表光子信號最弱。
1.4.4 免疫熒光染色觀察
術后 7 d 每組取 6 只大鼠,以戊巴比妥鈉(200 mg/kg)腹腔注射過量麻醉致死。取壞死和成活交界處附近皮瓣組織,4% 多聚甲醛固定 4 h,30% 蔗糖脫水過夜,OCT 包埋組織,冰凍切片,片厚 7 μm。將切片置于 0.25%Triton X-100 溶液中 5 min,破膜,PBS 清洗 3 次;將切片置于濕盒中,滴加 20% 羊血清封閉液室溫孵化 1 h,甩去血清,勿洗;分別滴加一抗:小鼠抗 CD31、兔抗基質細胞衍生因子 1(stromal cell derived factor 1,SDF-1)、小鼠抗 FGF、兔抗 EGF、兔抗 Ki67 和熒光素酶抗體(0.1% 牛血清白蛋白稀釋抗體,均為 1∶50);放置至室溫,PBS 沖洗 3 次,每次 5 min;滴加熒光二抗:山羊抗兔 555、山羊抗兔 488、山羊抗小鼠 555、山羊抗小鼠 488(1∶500),37℃ 放置 1 h;PBS 搖床晃洗 3 次,每次 15 min;DAPI 1∶1 000 稀釋滴加于切片上,染色 5 s;PBS 清洗 5 min×3 次,熒光封片劑封片,–20℃ 保存;熒光顯微鏡拍照,Image-Pro Plus 6.0 圖像分析軟件分析。其中 CD31 特異性染色可以標記小血管和微血管,經過 200 倍視野下計數 CD31 陽性染色情況計算毛細血管密度;檢測組織中 SDF-1、EGF、FGF 等以明確促血管生成因子的表達情況;檢測組織中 Ki67 的表達以明確細胞增殖情況;利用熒光素酶抗體標記移植的 BMSCs,免疫熒光染色觀察其是否參與損傷組織的修復。
1.5 統計學方法
采用 SPSS16.0 統計軟件進行分析。數據以均數±標準差表示,方差齊時,組間比較采用單因素方差分析,兩兩比較采用 LSD-t 檢驗;方差不齊時,兩兩比較采用 Mann-Whitney U 檢驗,多重檢驗校正采用 Bonferroni 校正;檢驗水準 α=0.05。
2 結果
2.1 BMSCs 分離培養與鑒定
倒置相差顯微鏡觀察示,轉基因大鼠 BMSCs 接種于培養皿培養 7 d 時,細胞呈典型的梭形。見圖 1。培養 7 d 流式細胞儀分析示,細胞表面標記物 CD29、CD90 表達陽性,CD34、CD45 表達陰性,鑒定培養細胞為 BMSCs。見圖 2。
 圖1
培養 7 d BMSCs 形態觀察(倒置相差顯微鏡×200)
Figure1.
Morphology observation of BMSCs cultured for 7 days (Inverted phase contrast microscope×200)
圖1
培養 7 d BMSCs 形態觀察(倒置相差顯微鏡×200)
Figure1.
Morphology observation of BMSCs cultured for 7 days (Inverted phase contrast microscope×200)
 圖2
培養 7 d 流式細胞儀分析細胞表面標記物表達
圖2
培養 7 d 流式細胞儀分析細胞表面標記物表達
a. CD34;b. CD29;c. CD45;d. CD90
Figure2. Expression of cell surface markers detected by flow cytometry at 7 days after culturinga. CD34; b. CD29; c. CD45; d. CD90
2.2 皮瓣成活率檢測
術后 7 d 各組缺血皮瓣壞死邊界已明確,C、D 組皮瓣成活質量和面積明顯高于 A、B 組。A、B、C、D 組皮瓣成活率分別為 62.83%±1.51%、65.08%±1.26%、76.52%±2.56%、84.48%±1.41%,C、D 組明顯高于 A、B 組,D 組高于 C 組,差異有統計學意義(P<0.05);A、B 組間差異無統計學意義(P>0.05)。
2.3 激光散斑血流成像儀檢測皮瓣血流
術后 7 d C、D 組皮瓣缺血區的血流灌注范圍和強度均明顯大于 A、B 組,D 組大于 C 組。見圖 3。各組皮瓣遠端基本都壞死,未進行遠端的血流分析。C、D 組皮瓣近端和中部的血流值均顯著高于 A、B 組,D 組高于 C 組,差異有統計學意義(P<0.05);A、B 組間差異無統計學意義(P>0.05)。見圖 4。
 圖3
術后 7 d 各組皮瓣血流成像圖
圖3
術后 7 d 各組皮瓣血流成像圖
從左至右依次為 A、B、C、D 組
Figure3. Blood flow imaging of flaps in each group at 7 days after operationFrom left to right for groups A, B, C, and D respectively
 圖4
術后 7 d 各組皮瓣近端和中部血流值比較
Figure4.
Comparison of blood perfusion units in the proximal and middle parts of flaps in different group at 7 days after operation
圖4
術后 7 d 各組皮瓣近端和中部血流值比較
Figure4.
Comparison of blood perfusion units in the proximal and middle parts of flaps in different group at 7 days after operation
2.4 生物發光成像檢測移植細胞在體內分布情況
細胞移植術后 30 min C、D 組移植細胞主要聚集在大鼠肺內,隨時間延長肺內信號逐漸減弱;術后 7 d,D 組有少量細胞聚集于缺血缺氧區域,在非缺氧區域很少聚集;術后 14 d,D 組損傷和正常組織交界處有明顯的信號聚集,C 組損傷和正常組織交界處也有信號聚集,但信號明顯弱于 D 組。B 組損傷和正常組織交界處在術后觀察時間段內均未發現明顯的信號聚集。見圖 5。術后各時間點 C、D 組大鼠體表對生物發光信號的光子強度顯著大于 B 組,D 組大于 C 組,差異均有統計學意義(P<0.05)。見圖 6。
 圖5
術后各時間點各組生物發光成像觀察
圖5
術后各時間點各組生物發光成像觀察
a. D 組術后 30 min ;b. 術后 14 d(從左至右依次為 B、C、D 組)
Figure5. Bioluminescence imaging at different time points after operation in defferent groupsa. At 30 minutes after operation in group D; b. At 14 days after operation (From left to right for groups B, C, and D respectively)
 圖6
術后各時間點各組生物發光成像觀察
Figure6.
Quantification of bioluminescence imaging signals at different time points after operation in different groups
圖6
術后各時間點各組生物發光成像觀察
Figure6.
Quantification of bioluminescence imaging signals at different time points after operation in different groups
2.5 免疫熒光染色觀察
2.5.1 毛細血管密度計數
熒光顯微鏡觀察示,術后 7 d C、D 組毛細血管密度明顯高于 A、B 組,見圖 7。A、B、C、D 組毛細血管密度分別為(94.41±11.71)、(134.30±5.74)、(243.22±8.83)、(349.37±8.77)個/mm2,C、D 組顯著高于 A、B 組,D 組顯著高于 C 組,差異均有統計學意義(P<0.05)。
 圖7
術后 7 d 各組 CD31 免疫熒光染色觀察微血管情況(熒光顯微鏡×200)
圖7
術后 7 d 各組 CD31 免疫熒光染色觀察微血管情況(熒光顯微鏡×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure7. CD31 immunofluorescent staining showed microvessel in different groups at 7 days after operation (Fluorescence microscopy×200)a. Group A; b. Group B; c. Group C; d. Group D2.5.2 細胞因子檢測
熒光顯微鏡觀察示,術后 7 d C、D 組組織中 SDF-1、EGF、FGF 及 Ki67 表達均明顯強于 A、B 組,D 組強于 C 組;A、B 組各因子表達均很弱,差異不明顯。見圖 8。
 圖8
術后 7 d 各組免疫熒光染色觀察各因子表達情況(熒光顯微鏡×200)
圖8
術后 7 d 各組免疫熒光染色觀察各因子表達情況(熒光顯微鏡×200)
從左至右依次為 A、B、C、D 組 a. EGF;b. FGF;c. SDF-1;d. Ki67
Figure8. Expression of EGF, FGF, SDF-1, and Ki67 in different groups by immunofluorescence staining at 7 days after operation (Fluorescence microscopy×200)From left to right for groups B, C, and D respectively a. EGF; b. FGF; c. SDF-1; d. Ki67
2.5.3 移植的 BMSCs 轉歸檢測
熒光顯微鏡觀察示,術后 7 d D 組移植的熒光素酶標記 BMSCs 表達于組織的動脈彈力層、毛細血管處和毛囊處。見圖 9。
 圖9
熒光素酶抗體標記移植的 BMSCs 在各部位表達情況(熒光顯微鏡×200)
圖9
熒光素酶抗體標記移植的 BMSCs 在各部位表達情況(熒光顯微鏡×200)
a. 表達于動脈的彈力層;b. 表達于毛細血管處;c. 表達于毛囊處(綠色示熒光素酶,紅色示 K14,藍色示細胞核)
Figure9. Expression of luciferase-BMSCs with antibody in different parts (Fluorescence microscopy×200)a. Expression in the elastic layer of the artery; b. Expression in capillaries; c. Expression in the hair follicle (Green indicated luciferase, red indicated K14, and blue indicated nuclei)
3 討論
MSCs 是一種低免疫原性的成體干細胞,具有多向分化潛能,而取材來源于成年骨髓組織的 BMSCs,因不涉及道德和倫理方面的問題,目前已獲批準作為干細胞治療藥物試用于臨床,但仍有許多問題有待進一步深入研究[7]。BMSCs 歸巢于靶向組織是其作為種子細胞應用于臨床的前提,只有保證一定的歸巢率,才能保證 MSCs 的應用療效。因此,如何促進干細胞歸巢是目前干細胞研究領域的熱點之一。
目前 MSCs 歸巢的機制仍不能完全明確,主要的分子機制包括 SDF-1/CXCR4 信號軸、HGF/c-met 信號軸、MCP-3/CCR1,3,5 信號軸以及黏附因子等[8]。其中 SDF-1/CXCR4 信號軸通路是目前研究最多的一種機制,研究者使用了多種方法來增強該通路的功能,以達到提高干細胞歸巢效率的目的。一方面可以提高靶組織 SDF-1 的含量,另一方面可以上調 CXCR4 在 MSCs 的表達[9-10]。在既往研究中發現,外源性的細胞移植到皮瓣模型中,隨著氧濃度的降低,歸巢的細胞數量越多,在非缺氧區域較難發現干細胞的停留[11]。低氧是組織和器官缺血的第一病理生理反應,研究表明低氧環境可以誘導 SDF-1 和 VEGF 的表達,從而促進缺血組織血管化以回應缺氧[11-12]。低氧模擬劑可以通過穩定 HIF-1α,抑制降解,模擬缺氧環境[13-14]。DFO 是一種鐵離子螯合劑,目前臨床上主要用于重金屬中毒的治療,在實驗中常被用為低氧模擬劑。在下肢缺血實驗中,DFO 的應用促進了血管內皮祖細胞歸巢,改善了缺血下肢的血流,促進了缺血組織的血管新生[15-16]。在本實驗中,我們檢測了 DFO 對 BMSCs 遷移歸巢及分化的影響,以及對缺血組織血管新生的影響。
在皮瓣模型和創傷模型中移植 BMSCs 可加速創傷愈合速度,熒光顯微鏡下觀察到外源性 BMSCs 整合于血管壁的結構中[17-18]。同時 BMSCs 也有旁分泌功能,可以分泌 VEGF、EGF、FGF 等細胞因子,這些細胞因子對血管化也有重要作用[19-20],與組織修復和再生相關[21-23]。在本研究中,我們觀察到 BMSCs 參與到了缺血組織的修復中,術后 7~14 d 生物發光成像信號觀察到外源性細胞聚集于缺血損傷處;同樣,免疫熒光染色觀察到移植的 BMSCs 出現于血管壁結構中以及毛囊的部分結構中,同時細胞因子的染色也高于 A、B 組。這些結果表明 BMSCs 參與到了損傷皮瓣的修復,增加了皮瓣缺血缺氧處細胞因子的表達,從而改善血流。
應用生物發光成像技術可動態觀察細胞遷移和分布情況,本研究結果顯示,生物發光信號在 BMSCs 移植早期主要聚集于肺內,術后 7 d 時 D 組有少量細胞聚集于缺血缺氧區域,在非缺氧區域很少聚集,術后 14 d 時缺血區域信號進一步增加;免疫熒光染色顯示 D 組有更多的外源性細胞整合到了損傷組織中。這些結果表明 DFO 的使用促進了 BMSCs 的遷移歸巢以及分化。免疫熒光染色檢測組織結果表明,DFO 的應用促進了組織中 SDF-1 的表達,說明 DFO 可以通過增強 SDF-1/CXCR4 信號軸通路功能促進 BMSCs 靶向歸巢。
本研究中 D 組皮瓣成活率明顯高于其他組,激光散斑血流成像結果顯示 D 組的血流量明顯高于其他組,CD31 免疫熒光染色結果顯示 D 組進一步增加了損傷處的毛細血管密度。這些結果表明 DFO 的使用促進了缺血皮瓣的血管新生。
綜上述,BMSCs 可以促進缺血皮瓣血管化,改善局部血流,減少壞死面積,有助于損傷組織的修復。DFO 作為低氧模擬劑,模擬缺氧環境,刺激組織血管化,同時是一種有效的促進 BMSCs 向損傷處遷移歸巢、參與組織修復的方法。皮瓣的缺血壞死仍是臨床經常遇到的并發癥,DFO 給我們提供了一個解決該問題的新思路。