引用本文: 蔣昇源, 鄧博文, 劉港, 范筱, 白惠中, 趙毅, 徐林, 穆曉紅. 攜載川芎嗪緩釋微粒導電水凝膠修復脊髓損傷實驗研究. 中國修復重建外科雜志, 2023, 37(1): 65-73. doi: 10.7507/1002-1892.202209013 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷是一類致殘性極強的疾病,目前臨床常用的激素沖擊療法效果有限,探尋新的治療手段已成為研究關注焦點[1]。中樞神經系統組織自我修復能力較差,脊髓損傷后病灶局部聚集大量膠質細胞和炎癥細胞,分泌抑制神經元、軸突和髓鞘再生的相關因子,進而形成抑制神經組織生長的微環境,限制了脊髓損傷后神經功能修復[2-3]。
川芎嗪具有擴張血管、抑制炎癥反應、調控神經細胞凋亡等多種功效[4],相關研究已證實其能夠促進脊髓損傷后神經功能修復[5-6]。然而,傳統制劑存在體內半衰期短、局部利用率低、需多次大劑量給藥等局限性,臨床應用受限[7]。因此,探索并制備一種安全有效的組織工程材料作為川芎嗪的載體,實現其在損傷局部靶向緩釋,對于脊髓損傷修復具有重要意義。
近年來,源自細胞外基質的導電性水凝膠逐步應用于脊髓損傷的治療,水凝膠特有的三維網狀結構有利于軸突、微血管等組織再生[8-9]。水凝膠在損傷局部不僅能起到“橋梁”連接作用,還能作為“載體”攜載多種有利于修復的要素[10]。同時,導電材料的加入可使神經細胞膜電位發生改變,從而產生生物電現象,有助于神經的發育、成熟和再生[11]。研究證明,經單寧酸改性的導電聚吡咯水凝膠兼具生物相容性、可降解性、導電性等優勢,可作為川芎嗪緩釋的良好載體[12]。本研究通過建立大鼠脊髓完全橫斷模型,于損傷局部植入攜載川芎嗪緩釋微粒導電水凝膠(以下簡稱“TGTP水凝膠”),探討其修復脊髓損傷的作用與機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
雌性8周齡SD大鼠48只,體質量220~240 g,由中國中醫科學院骨傷研究所提供。造模前,大鼠統一于標準動物實驗環境(溫度22℃,濕度40%~50%,12 h光/暗循環)下適應性喂養1周,4只/籠,不限制飲食、活動。
甲基丙烯酰化明膠、光引發劑(Irgacure2959)、導電聚吡咯由華南理工大學提供;PBS溶液(Sigma公司,美國);DAPI封固劑、TNF-α抗體、抗鼠/兔通用型免疫組織化學檢測試劑盒(Abcam公司,英國);Nissl染色液(北京索萊寶科技有限公司);神經絲蛋白200(neurofilament 200,NF200)抗體、NF-κB、IL-10抗體(武漢三鷹生物技術有限公司);鹽酸川芎嗪注射液(哈爾濱三聯藥業股份有限公司);戊巴比妥鈉(北京普博斯生物科技有限公司);注射用青霉素鈉(華北制藥股份有限公司)。UV點光源固化機(珠海皓云光電科技有限公司);倒置相差顯微鏡、RM2315石蠟切片機、激光掃描共聚焦顯微鏡(Leica公司,德國);掃描電鏡(FEI公司,德國)。
1.2 TGTP水凝膠制備及表征
1.2.1 TGTP水凝膠的制備
配置500 μg/mL鹽酸川芎嗪溶液,于避光條件下將0.01 g光引發劑(Irgacure2959)溶于1 mL川芎嗪溶液,60℃水浴加熱5~10 min,待顆粒完全溶解后,添加0.1 g甲基丙烯酰化明膠和0.03 g導電聚吡咯及適量單寧酸。超聲波振蕩器充分混勻后,置于60℃水浴加熱10 min。使用移液槍吸取10 μL混合液于自制模具中,暗室內紫外線光源照射10 s即可成膠。TGTP水凝膠制作完成后,將其浸泡于75%乙醇溶液中12 h,每隔3 h更換1次乙醇,4℃保存。使用前置于PBS溶液沖洗3次。
1.2.2 TGTP水凝膠理化表征檢測
① 掃描電鏡觀察:實驗前冷凍干燥水凝膠樣品,將凍干樣品置于液氮中20 s進行淬斷,斷面朝上黏附于樣品臺上,噴金60 s增強水凝膠樣品的導電性能,在加速電壓10.0 kV條件下觀察其微觀形貌。
② 藥物體外緩釋實驗:根據川芎嗪的吸收光譜確定最大吸收波長,隨后使用川芎嗪標準溶液制作工作曲線,明確藥物含量與吸光度(A)值的線性關系。將1 g TGTP水凝膠置于50 mL、pH7.4的PBS溶液中孵育,37℃下輕輕搖動孵育系統。每隔24 h收集上清液,共收集14 d上清液,根據上清液在川芎嗪最大吸收波長處的A值確定上清液中川芎嗪含量,從而計算藥物釋放率。
1.3 動物分組及造模方法
采用隨機數字表法將48只大鼠分為4組:假手術組(A組)、模型組(B組)、導電水凝膠組(C組)、TGTP水凝膠組(D組),每組12只。
術前所有大鼠禁飲食12 h,經腹腔注射0.3%戊巴比妥(30 mg/kg)麻醉后,備皮消毒,俯臥位固定于操作臺上。以T9、T10骨性標志點為中心,使用15號尖刀片沿棘突縱形切開皮膚、筋膜,剝離并用撐開器撐開兩側椎旁肌,咬骨鉗咬除T9、T10棘突,暴露椎板骨面及關節突關節內側緣,深入椎板間隙咬除T9、T10椎板,暴露脊髓。A組僅行T10椎板切除;其余3組使用自制顯微雙刃剪離斷脊髓,離斷長度2 mm,C、D組分別于損傷部位植入導電水凝膠和TGTP水凝膠。生理鹽水沖洗切口,依次縫合各層組織。術后每天20萬U青霉素皮下注射,連續3 d。大鼠4只/籠飼養,室溫保持22℃,術后每日早、中、晚3次按摩膀胱排尿,術后1周改為早、晚各1次。
1.4 觀測指標
1.4.1 BBB評分
造模前及造模后1、3、7、14、28 d每組隨機選取6只大鼠,采用BBB評分法評估大鼠后肢運動功能恢復情況。
1.4.2 Nissl染色觀察
造模后28 d每組分別取6只大鼠,0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,行多聚甲醛心臟灌注,待大鼠全身僵硬后,以脊髓損傷處為中心,取約1.5 cm長脊髓組織,標注頭尾端。固定于4%多聚甲醛溶液中,經脫水、石蠟包埋后,制成5 μm厚石蠟切片。切片脫蠟至水,于0.5%甲苯胺藍水溶液56℃溫箱中浸染40 min,95%乙醇溶液鏡下控制分色,封片后于光鏡下觀察。
1.4.3 勞克堅牢藍(luxol fast blue,LFB)染色觀察
取上述部分切片脫蠟至水,65℃條件下固藍染液中浸染過夜,水洗分色,無水乙醇快速浸染1次,伊紅染液浸染2 min,水洗后鏡下觀察灰白質清晰,依次經梯度乙醇、二甲苯浸泡,封片后于光鏡下觀察。
1.4.4 免疫組織化學染色觀察
取上述部分切片,PBS沖洗3次,每次5 min;抗原修復液修復15 min,冷卻至室溫;3%雙氧水阻斷室溫孵育30 min,PBS沖洗2次,每次5 min;3%牛血清白蛋白室溫孵育30 min。分別滴加NF-кB(1∶100)、TNF-α(1∶200)、IL-10(1∶50)一抗,4℃過夜;滴加適當比例稀釋的二抗,37℃孵育30 min;PBS水洗后DAB顯色3 min,蘇木素染色5 min,鹽酸乙醇分化、返藍后,透明封片,光鏡下觀察。采用Image J軟件對結果進行定量分析,分別計算各組平均A值。
1.4.5 免疫熒光染色觀察
造模后28 d每組分別取3只大鼠,0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,行多聚甲醛心臟灌注,取材。次日從4%多聚甲醛溶液中取出部分組織,15%、30%蔗糖梯度脫水過夜后,OCT包埋,制作冰凍切片,片厚15 μm。3%Triton X-100溶液透膜10 min,PBS洗滌3次,1%牛血清白蛋白封閉;棄血清,滴加鼠源NF200單抗(1∶400)一抗,4℃孵育過夜。滴加相應二抗Alexa Fluor?山羊抗小鼠IgG抗體(1∶400),室溫孵育1 h,PBS洗滌3次,DAPI染核,封片后于激光共聚焦顯微鏡下觀察。
1.4.6 Western blot檢測
造模后28 d每組各取3只大鼠,0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,于冰面迅速取出損傷部位脊髓,長約1 cm,?80℃冰箱儲存備用。脊髓組織研磨后加入適量RAPI裂解液裂解,提取組織總蛋白上清液,采用BCA法測定蛋白濃度。每組取等量蛋白上樣,電泳轉膜后,5%脫脂奶粉室溫封閉1 h。一抗4℃孵育過夜,PBS漂洗后二抗室溫孵育1 h,ECL發光法行膠片曝光,利用Photoshop圖像處理軟件進行灰度值測定,以NF200蛋白與GAPDH比值作為其相對表達量。
1.5 統計學方法
采用SPSS25.0統計軟件進行分析。計量資料行正態性檢驗,NF-кB A值和NF200蛋白表達量符合正態分布,以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;TNF-α和IL-10 A值不符合正態分布,以M( Q1,Q3)表示,組間比較采用Kruskal-Wallis H檢驗;各組不同時間點BBB評分比較采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser法進行校正,同一組別不同時間點比較采用 Bonferroni 法,同一時間點不同組別間比較采用多因素方差分析。檢驗水準α=0.05。
2 結果
2.1 TGTP水凝膠理化表征
新合成的TGTP水凝膠能夠牢固附著于瓶底,提示該凝膠已從溶膠狀態轉變為凝膠狀態。掃描電鏡觀察示,TGTP水凝膠內部出現明顯孔隙樣結構,為神經軸突及微血管的長入提供了保障。TGTP水凝膠具有良好的藥物緩釋功能,第14天釋放率可達80%左右。見圖1。
 圖1
TGTP水凝膠理化性質檢測
圖1
TGTP水凝膠理化性質檢測
a. 紫外光源照射下合成TGTP水凝膠;b. 掃描電鏡觀察(×200);c. TGTP水凝膠體外緩釋川芎嗪微粒檢測
Figure1. Detection of physicochemical properties of TGTP hydrogela. The TGTP hydrogel was synthesized under UV irradiation; b. Scanning electron microscope observation (×200); c.
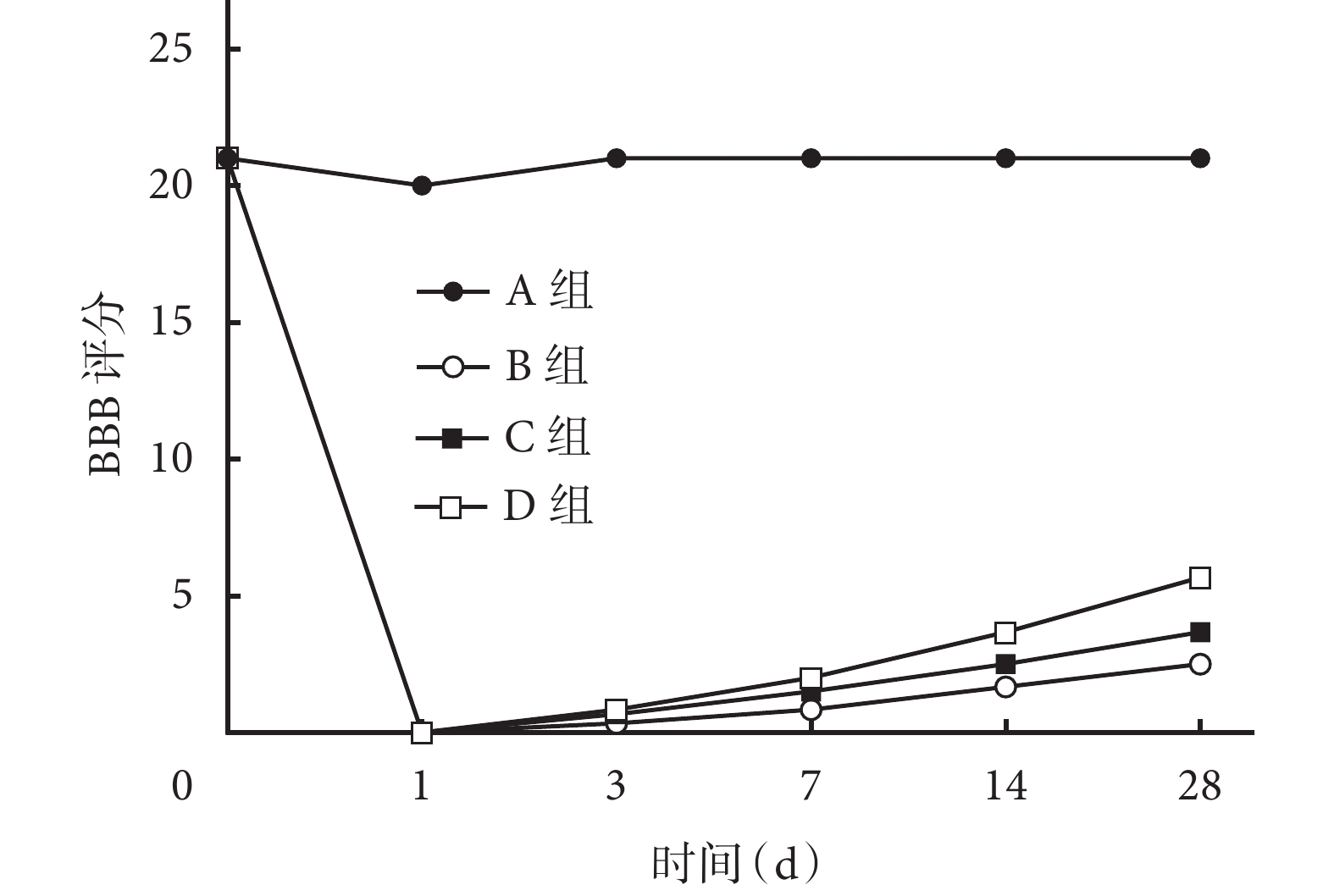
2.2 BBB評分觀察
造模前各組大鼠BBB評分均為21分。造模后各時間點,A組大鼠BBB評分均高于其余3組,差異有統計學意義(P<0.05);造模后1、3、7 d,B、C、D組BBB評分差異均無統計學意義(P>0.05);14、28 d C、D組BBB評分差異無統計學意義(P>0.05),但D組BBB評分明顯高于B組,差異有統計學意義(P<0.05)。見表1、圖2。
 )
Table1.
BBB score of rats in each group at different time points before and after modeling (n=6,
)
Table1.
BBB score of rats in each group at different time points before and after modeling (n=6,  )
)
 圖2
各組造模前后各時間點BBB評分變化趨勢
Figure2.
Variation trend of BBB score at each time point before and after modeling in each group
圖2
各組造模前后各時間點BBB評分變化趨勢
Figure2.
Variation trend of BBB score at each time point before and after modeling in each group
2.3 Nissl染色觀察
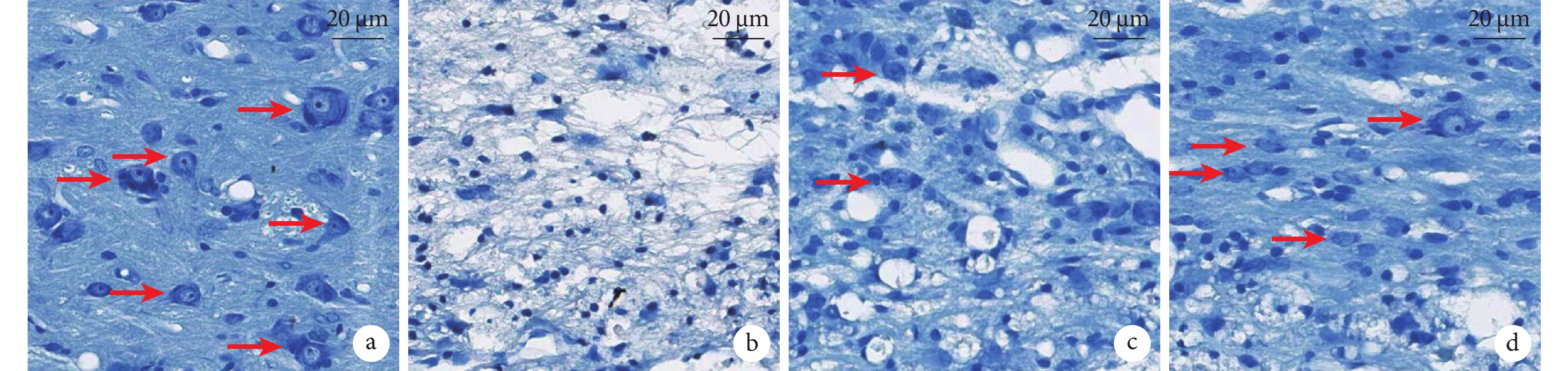
A組脊髓結構完整,灰質、白質界限清晰,灰質內大量神經元存在,尼氏體呈虎斑狀,形態規則;B組脊髓缺損周圍組織溶解,幾乎無神經元存在;C組灰質內僅可見少量殘留神經元,尼氏體形態欠完整;D組神經元數量較B組多,可見到部分未凋亡的神經元。見圖3。
 圖3
造模后28 d脊髓組織Nissl染色觀察(×20)
圖3
造模后28 d脊髓組織Nissl染色觀察(×20)
紅色箭頭示神經元尼氏體 a. A組;b. B組;c. C組;d. D組
Figure3. Nissl staining of spinal cord at 28 days after modeling (×20)Red arrow incicated the neuronal nissomes a. Group A; b. Group B; c. Group C; d. Group D
2.4 LFB染色觀察
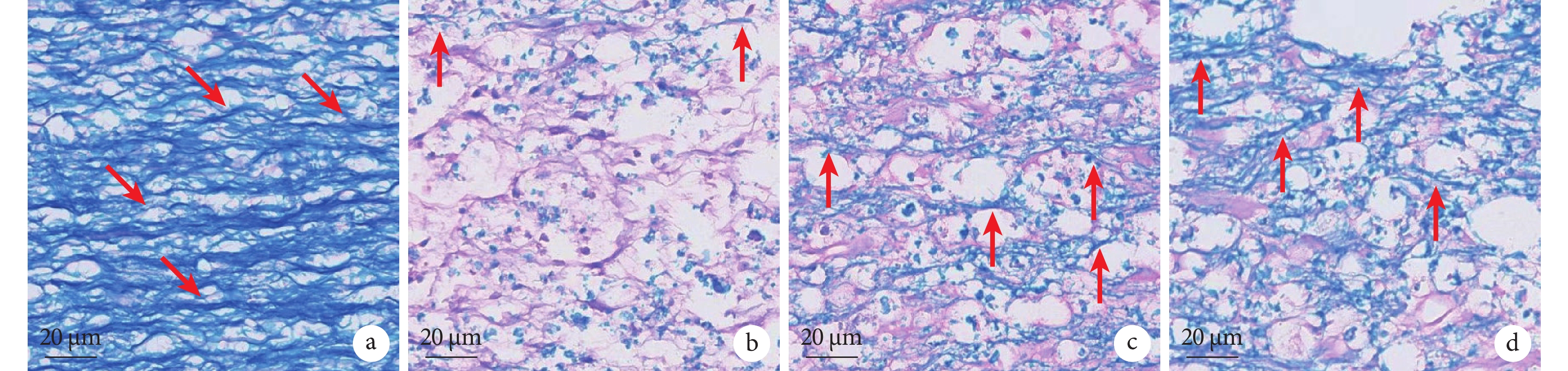
A組脊髓組織髓鞘為亮藍色,白質連續完整,排列致密有序;B組出現神經纖維缺損,損傷周邊組織出現溶解性空洞;C、D組白質內髓鞘完整性有所改善,D組空洞面積減小,組織連續性好,髓鞘結構相對完整、致密。見圖4。
 圖4
造模后28 d脊髓組織LFB染色觀察(×20)
圖4
造模后28 d脊髓組織LFB染色觀察(×20)
紅色箭頭示髓鞘結構 a. A組;b. B組;c. C組;d. D組
Figure4. LFB staining of spinal cord at 28 days after modeling (×20)Red arrow incicated the myelin sheath a. Group A; b. Group B; c. Group C; d. Group D
2.5 免疫組織化學染色觀察
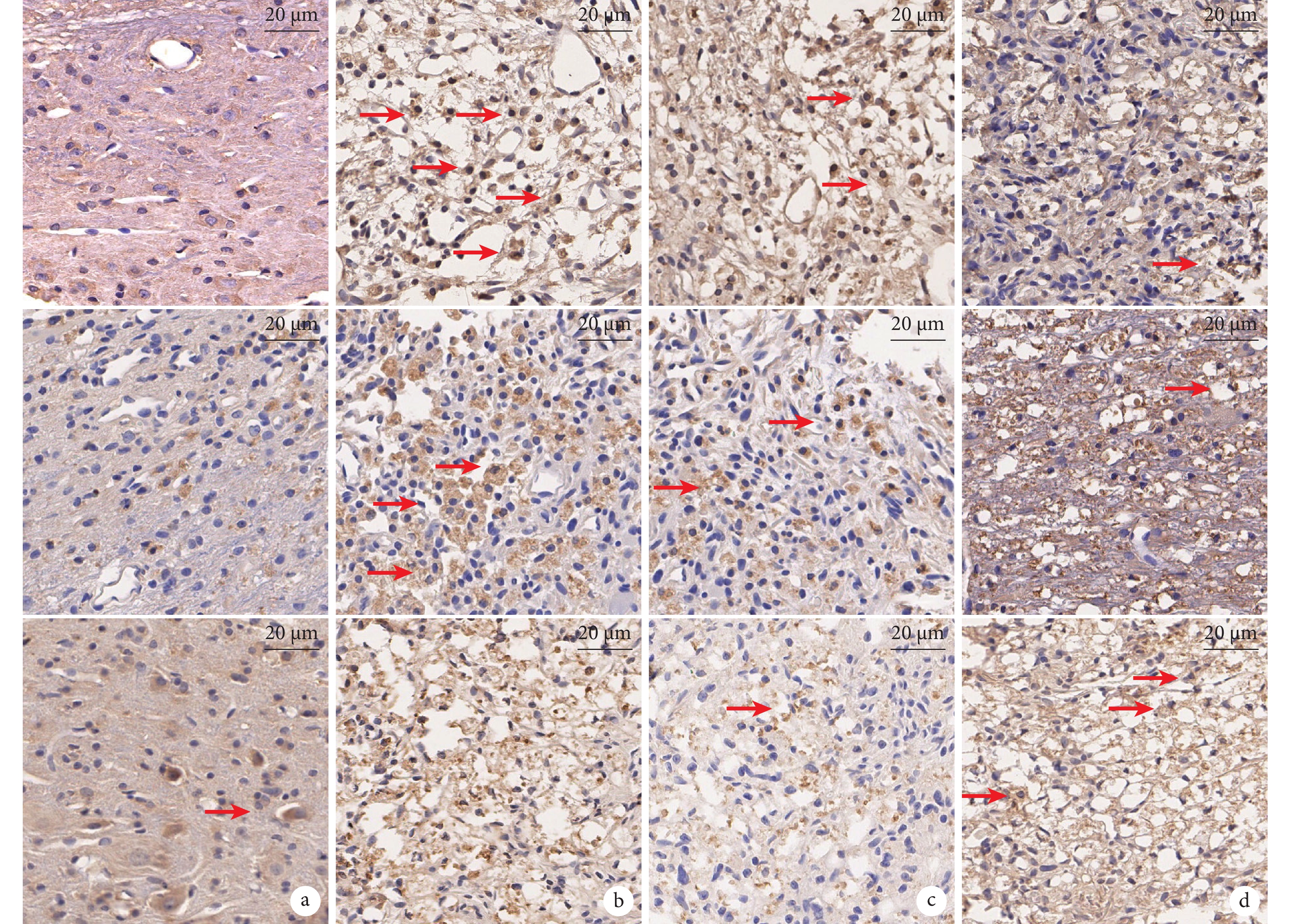
鏡下見NF-кB、TNF-α、IL-10彌散性散在分布于損傷周圍組織,陽性表達呈棕褐色。A、D組NF-кB A值明顯低于B、C組,A組低于D組,差異均有統計學意義(P<0.05)。A組TNF-α A值明顯低于B、C組,D組低于B組,差異有統計學意義(P<0.05);其余各組間TNF-α A值比較差異均無統計學意義(P>0.05)。A組IL-10 A值明顯高于其余3組,C、D組高于B組,差異均有統計學意義(P<0.05);其余各組間IL-10 A值比較差異均無統計學意義(P>0.05)。見圖5及表2。
 圖5
造模后28 d各組脊髓組織各炎癥因子免疫組織化學染色觀察(×20)
圖5
造模后28 d各組脊髓組織各炎癥因子免疫組織化學染色觀察(×20)
紅色箭頭示蛋白陽性表達,從上至下依次為NF-κB、TNF-α、IL-10 a. A組;b. B組;c. C組;d. D組
Figure5. Immunohistochemical staining of inflammatory factors in spinal cord at 28 days after modeling (×20)Red arrow indicated positive protein expression, from top to bottom for NF-κB, TNF-α, and IL-10, respectively a. Group A; b. Group B; c. Group C; d. Group D
2.6 免疫熒光染色觀察
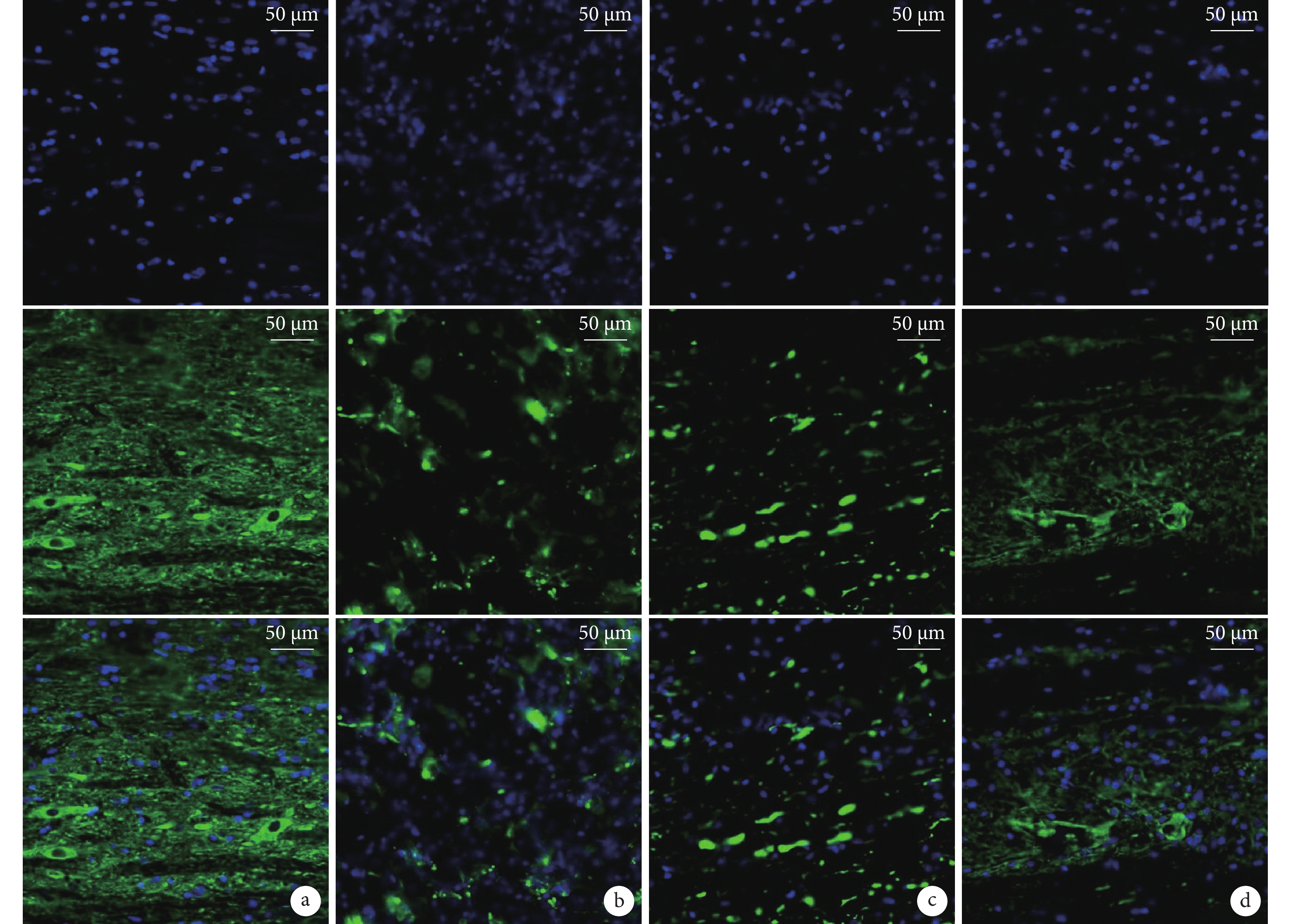
A組神經纖維結構完整,連續性好,灰質內可見形態規整神經元;B組神經纖維呈點狀存在,未見完整神經元;C組神經纖維數量較B組多,D組神經纖維與神經元數量顯著多于B、C組,但與A組相比,神經元形態仍欠規則、核固縮。見圖6。
 圖6
造模后28 d各組NF200免疫熒光染色觀察(激光共聚焦顯微鏡×20)
圖6
造模后28 d各組NF200免疫熒光染色觀察(激光共聚焦顯微鏡×20)
從上至下依次為DAPI、NF200、二者重疊 a. A組;b. B組;c. C組;d. D組
Figure6. NF200 immunofluorescence staining in each group at 28 days after modeling (Laser confocal microscope×20)From top to bottom for DAPI, NF200, and merge, respectively a. Group A; b. Group B; c. Group C; d. Group D
2.7 Western blot檢測
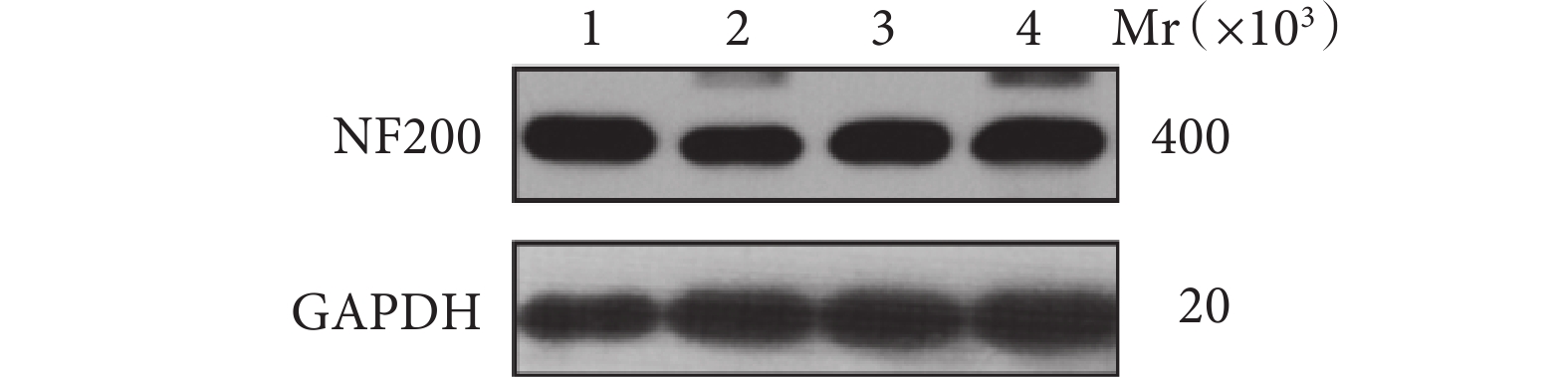
A、B、C、D組脊髓組織中NF200蛋白相對表達量分別為1.44±0.01、0.76±0.03、0.95±0.02、1.23±0.02。A組脊髓組織中NF200蛋白相對表達量明顯高于其余3組,差異有統計學意義(P<0.05);C、D組高于B組,D組高于C組,差異均有統計學意義(P<0.05)。見圖7。
 圖7
Western blot檢測各組NF200蛋白表達
圖7
Western blot檢測各組NF200蛋白表達
Mr:相對分子質量 1:A組 2:B組 3:C組 4:D組
Figure7. The expression of NF200 protein in each group detected by Western blot assayMr: Relative molecular mass 1: Group A 2: Group B 3: Group C 4: Group D
3 討論
脊髓損傷后炎癥反應、膠質瘢痕形成等一系列繼發性級聯反應限制了神經再生與修復[13]。在傳統手術與藥物等治療手段效果欠佳的情況下,組織工程材料攜載藥物、細胞或生長因子成為修復脊髓損傷的新手段[14]。水凝膠由于軟組織力學特性可控,不僅能夠填補脊髓原發性缺損,還能使攜載的藥物形成局部富集與緩釋[15-16]。導電水凝膠的應用能加強細胞間生物電信號交流,恢復因損傷中斷的傳導性神經通路,維持神經再生所需的電學微環境[17]。基于上述背景,本研究首先在體外合成TGTP水凝膠,掃描電鏡及體外藥物緩釋實驗提示其具有良好組織生長空間,鹽酸川芎嗪微粒也能夠逐步緩釋,優良的組織工程材料學特性為后續體內實驗研究奠定了基礎。
當前,組織工程材料修復脊髓損傷的基礎研究多選擇脊髓半切或全切大鼠模型,考慮到脊髓半切無法做到定量切除脊髓組織、實驗一致性無法實現的劣勢,本團隊自主研發了顯微雙刃剪,該器材可實現定量、精準切除脊髓組織[18]。導電水凝膠雖然能夠填補原發性創傷所致空腔,但其自身在誘導神經細胞再生方面療效有限;干細胞移植雖能有效補充壞死、凋亡的神經細胞,但受限于其自身無法模擬脊髓局部復雜的微環境,存活率大大降低[19]。中醫藥治療脊髓損傷具有“多途徑、多靶點”的優勢,可特異性地針對脊髓損傷病理機制的復雜特點[20]。因此,本研究將具備改善微循環、保護神經細胞作用的鹽酸川芎嗪微粒添加至導電水凝膠中,制備TGTP水凝膠并植入大鼠脊髓缺損處,以期通過緩釋川芎嗪微粒,使藥物直接通過血腦屏障在體內長久起效,提高藥物體內利用率,避免體外長期給藥、藥物半衰期短的缺點。
BBB評分是公認的評估脊髓損傷大鼠后肢運動功能的方法[21]。本研究通過評估造模后不同時間點4組大鼠BBB評分,發現D組自造模后14 d起,BBB評分即優于B組。雖然D組改善脊髓損傷大鼠后肢運動療效明顯,但仍未觀察到大鼠后足掌面著地的現象,分析原因可能在于脊髓全橫斷模型創傷過大,短時間內神經功能恢復受限。另外,本研究還采用Nissl染色與LFB染色分別評估了各組大鼠脊髓組織神經元存活、髓鞘再生等情況,結果顯示D組脊髓缺損處周圍仍可見少量殘存神經元,且組織溶解率降低,神經纖維排列也相對有序,髓鞘密集,這進一步說明了TGTP水凝膠能夠發揮保護神經細胞、抑制脫髓鞘的作用,最大程度地保護軸突,協助生物電信號跳躍式傳遞,維持并保護神經元的正常功能。脊髓修復過程中軸突再生至關重要[22],NF200作為構成神經元的基本骨架結構之一,主要存在于軸突中[23]。我們分別通過免疫熒光染色和Western blot檢測了各組NF200的表達,結果顯示D組NF200表達量明顯高于B、C組,說明TGTP水凝膠能夠促進神經元結構的修復,并生成軸突進行正常生理活動,一定程度促進了脊髓損傷神經功能修復。該結果也對前述行為學、組織形態學染色結果做出了解釋,如果缺少神經元及神經軸突的存在,勢必無法完成運動功能的恢復。
在明確TGTP水凝膠療效的基礎上,本研究初步探索了其修復脊髓損傷的機制。脊髓原發性損傷后,包括中性粒細胞、巨噬細胞等炎癥細胞向損傷區域浸潤,并激活常駐小膠質細胞,釋放大量炎癥因子,促炎與抗炎因子穩態被破壞,進一步誘導神經元壞死、凋亡[24-25]。NF-кB廣泛存在于真核細胞胞質內,該通路可調控多種參與炎癥反應的細胞因子,如TNF-α、IL-10等,影響細胞增殖、分化及凋亡[26-27]。維持脊髓組織內促炎/抗炎因子的平衡,對于促進脊髓損傷恢復具有重要意義。本研究通過免疫組織化學染色檢測發現,脊髓損傷后B組NF-кB、TNF-α表達量明顯增多,IL-10表達量極低,而D組能夠有效降低 NF-кB、TNF-α的表達,促進IL-10表達。因此,本研究暫且可以得出結論,TGTP水凝膠可以減輕脊髓損傷后炎癥反應,抑制NF-кB信號通路及促炎因子分泌,促進抗炎因子表達,維持脊髓損傷微環境穩態,保護神經細胞。
綜上述,TGTP水凝膠可以改善脊髓損傷大鼠的神經功能,抑制炎癥反應,減輕脊髓組織結構破壞。但由于本研究僅為體外及動物實驗,存在一定局限性,關于TGTP水凝膠是否存在細胞毒性作用,以及修復脊髓損傷的具體分子機制尚待進一步研究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
倫理聲明 研究方案經北京中醫藥大學實驗動物倫理委員會批準(BUCM-4-2021040802-2021);實驗動物生產許可證號:SCXK(京)2017-0005,實驗動物使用許可證號:SYXK(京)2020-0013
作者貢獻聲明 蔣昇源、鄧博文、徐林、穆曉紅:研究設計及協助研究開展;蔣昇源、鄧博文、劉港、白惠中:研究實施及文章撰寫;范筱、趙毅:數據收集整理及統計分析
脊髓損傷是一類致殘性極強的疾病,目前臨床常用的激素沖擊療法效果有限,探尋新的治療手段已成為研究關注焦點[1]。中樞神經系統組織自我修復能力較差,脊髓損傷后病灶局部聚集大量膠質細胞和炎癥細胞,分泌抑制神經元、軸突和髓鞘再生的相關因子,進而形成抑制神經組織生長的微環境,限制了脊髓損傷后神經功能修復[2-3]。
川芎嗪具有擴張血管、抑制炎癥反應、調控神經細胞凋亡等多種功效[4],相關研究已證實其能夠促進脊髓損傷后神經功能修復[5-6]。然而,傳統制劑存在體內半衰期短、局部利用率低、需多次大劑量給藥等局限性,臨床應用受限[7]。因此,探索并制備一種安全有效的組織工程材料作為川芎嗪的載體,實現其在損傷局部靶向緩釋,對于脊髓損傷修復具有重要意義。
近年來,源自細胞外基質的導電性水凝膠逐步應用于脊髓損傷的治療,水凝膠特有的三維網狀結構有利于軸突、微血管等組織再生[8-9]。水凝膠在損傷局部不僅能起到“橋梁”連接作用,還能作為“載體”攜載多種有利于修復的要素[10]。同時,導電材料的加入可使神經細胞膜電位發生改變,從而產生生物電現象,有助于神經的發育、成熟和再生[11]。研究證明,經單寧酸改性的導電聚吡咯水凝膠兼具生物相容性、可降解性、導電性等優勢,可作為川芎嗪緩釋的良好載體[12]。本研究通過建立大鼠脊髓完全橫斷模型,于損傷局部植入攜載川芎嗪緩釋微粒導電水凝膠(以下簡稱“TGTP水凝膠”),探討其修復脊髓損傷的作用與機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
雌性8周齡SD大鼠48只,體質量220~240 g,由中國中醫科學院骨傷研究所提供。造模前,大鼠統一于標準動物實驗環境(溫度22℃,濕度40%~50%,12 h光/暗循環)下適應性喂養1周,4只/籠,不限制飲食、活動。
甲基丙烯酰化明膠、光引發劑(Irgacure2959)、導電聚吡咯由華南理工大學提供;PBS溶液(Sigma公司,美國);DAPI封固劑、TNF-α抗體、抗鼠/兔通用型免疫組織化學檢測試劑盒(Abcam公司,英國);Nissl染色液(北京索萊寶科技有限公司);神經絲蛋白200(neurofilament 200,NF200)抗體、NF-κB、IL-10抗體(武漢三鷹生物技術有限公司);鹽酸川芎嗪注射液(哈爾濱三聯藥業股份有限公司);戊巴比妥鈉(北京普博斯生物科技有限公司);注射用青霉素鈉(華北制藥股份有限公司)。UV點光源固化機(珠海皓云光電科技有限公司);倒置相差顯微鏡、RM2315石蠟切片機、激光掃描共聚焦顯微鏡(Leica公司,德國);掃描電鏡(FEI公司,德國)。
1.2 TGTP水凝膠制備及表征
1.2.1 TGTP水凝膠的制備
配置500 μg/mL鹽酸川芎嗪溶液,于避光條件下將0.01 g光引發劑(Irgacure2959)溶于1 mL川芎嗪溶液,60℃水浴加熱5~10 min,待顆粒完全溶解后,添加0.1 g甲基丙烯酰化明膠和0.03 g導電聚吡咯及適量單寧酸。超聲波振蕩器充分混勻后,置于60℃水浴加熱10 min。使用移液槍吸取10 μL混合液于自制模具中,暗室內紫外線光源照射10 s即可成膠。TGTP水凝膠制作完成后,將其浸泡于75%乙醇溶液中12 h,每隔3 h更換1次乙醇,4℃保存。使用前置于PBS溶液沖洗3次。
1.2.2 TGTP水凝膠理化表征檢測
① 掃描電鏡觀察:實驗前冷凍干燥水凝膠樣品,將凍干樣品置于液氮中20 s進行淬斷,斷面朝上黏附于樣品臺上,噴金60 s增強水凝膠樣品的導電性能,在加速電壓10.0 kV條件下觀察其微觀形貌。
② 藥物體外緩釋實驗:根據川芎嗪的吸收光譜確定最大吸收波長,隨后使用川芎嗪標準溶液制作工作曲線,明確藥物含量與吸光度(A)值的線性關系。將1 g TGTP水凝膠置于50 mL、pH7.4的PBS溶液中孵育,37℃下輕輕搖動孵育系統。每隔24 h收集上清液,共收集14 d上清液,根據上清液在川芎嗪最大吸收波長處的A值確定上清液中川芎嗪含量,從而計算藥物釋放率。
1.3 動物分組及造模方法
采用隨機數字表法將48只大鼠分為4組:假手術組(A組)、模型組(B組)、導電水凝膠組(C組)、TGTP水凝膠組(D組),每組12只。
術前所有大鼠禁飲食12 h,經腹腔注射0.3%戊巴比妥(30 mg/kg)麻醉后,備皮消毒,俯臥位固定于操作臺上。以T9、T10骨性標志點為中心,使用15號尖刀片沿棘突縱形切開皮膚、筋膜,剝離并用撐開器撐開兩側椎旁肌,咬骨鉗咬除T9、T10棘突,暴露椎板骨面及關節突關節內側緣,深入椎板間隙咬除T9、T10椎板,暴露脊髓。A組僅行T10椎板切除;其余3組使用自制顯微雙刃剪離斷脊髓,離斷長度2 mm,C、D組分別于損傷部位植入導電水凝膠和TGTP水凝膠。生理鹽水沖洗切口,依次縫合各層組織。術后每天20萬U青霉素皮下注射,連續3 d。大鼠4只/籠飼養,室溫保持22℃,術后每日早、中、晚3次按摩膀胱排尿,術后1周改為早、晚各1次。
1.4 觀測指標
1.4.1 BBB評分
造模前及造模后1、3、7、14、28 d每組隨機選取6只大鼠,采用BBB評分法評估大鼠后肢運動功能恢復情況。
1.4.2 Nissl染色觀察
造模后28 d每組分別取6只大鼠,0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,行多聚甲醛心臟灌注,待大鼠全身僵硬后,以脊髓損傷處為中心,取約1.5 cm長脊髓組織,標注頭尾端。固定于4%多聚甲醛溶液中,經脫水、石蠟包埋后,制成5 μm厚石蠟切片。切片脫蠟至水,于0.5%甲苯胺藍水溶液56℃溫箱中浸染40 min,95%乙醇溶液鏡下控制分色,封片后于光鏡下觀察。
1.4.3 勞克堅牢藍(luxol fast blue,LFB)染色觀察
取上述部分切片脫蠟至水,65℃條件下固藍染液中浸染過夜,水洗分色,無水乙醇快速浸染1次,伊紅染液浸染2 min,水洗后鏡下觀察灰白質清晰,依次經梯度乙醇、二甲苯浸泡,封片后于光鏡下觀察。
1.4.4 免疫組織化學染色觀察
取上述部分切片,PBS沖洗3次,每次5 min;抗原修復液修復15 min,冷卻至室溫;3%雙氧水阻斷室溫孵育30 min,PBS沖洗2次,每次5 min;3%牛血清白蛋白室溫孵育30 min。分別滴加NF-кB(1∶100)、TNF-α(1∶200)、IL-10(1∶50)一抗,4℃過夜;滴加適當比例稀釋的二抗,37℃孵育30 min;PBS水洗后DAB顯色3 min,蘇木素染色5 min,鹽酸乙醇分化、返藍后,透明封片,光鏡下觀察。采用Image J軟件對結果進行定量分析,分別計算各組平均A值。
1.4.5 免疫熒光染色觀察
造模后28 d每組分別取3只大鼠,0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,行多聚甲醛心臟灌注,取材。次日從4%多聚甲醛溶液中取出部分組織,15%、30%蔗糖梯度脫水過夜后,OCT包埋,制作冰凍切片,片厚15 μm。3%Triton X-100溶液透膜10 min,PBS洗滌3次,1%牛血清白蛋白封閉;棄血清,滴加鼠源NF200單抗(1∶400)一抗,4℃孵育過夜。滴加相應二抗Alexa Fluor?山羊抗小鼠IgG抗體(1∶400),室溫孵育1 h,PBS洗滌3次,DAPI染核,封片后于激光共聚焦顯微鏡下觀察。
1.4.6 Western blot檢測
造模后28 d每組各取3只大鼠,0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,于冰面迅速取出損傷部位脊髓,長約1 cm,?80℃冰箱儲存備用。脊髓組織研磨后加入適量RAPI裂解液裂解,提取組織總蛋白上清液,采用BCA法測定蛋白濃度。每組取等量蛋白上樣,電泳轉膜后,5%脫脂奶粉室溫封閉1 h。一抗4℃孵育過夜,PBS漂洗后二抗室溫孵育1 h,ECL發光法行膠片曝光,利用Photoshop圖像處理軟件進行灰度值測定,以NF200蛋白與GAPDH比值作為其相對表達量。
1.5 統計學方法
采用SPSS25.0統計軟件進行分析。計量資料行正態性檢驗,NF-кB A值和NF200蛋白表達量符合正態分布,以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;TNF-α和IL-10 A值不符合正態分布,以M( Q1,Q3)表示,組間比較采用Kruskal-Wallis H檢驗;各組不同時間點BBB評分比較采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser法進行校正,同一組別不同時間點比較采用 Bonferroni 法,同一時間點不同組別間比較采用多因素方差分析。檢驗水準α=0.05。
2 結果
2.1 TGTP水凝膠理化表征
新合成的TGTP水凝膠能夠牢固附著于瓶底,提示該凝膠已從溶膠狀態轉變為凝膠狀態。掃描電鏡觀察示,TGTP水凝膠內部出現明顯孔隙樣結構,為神經軸突及微血管的長入提供了保障。TGTP水凝膠具有良好的藥物緩釋功能,第14天釋放率可達80%左右。見圖1。
 圖1
TGTP水凝膠理化性質檢測
圖1
TGTP水凝膠理化性質檢測
a. 紫外光源照射下合成TGTP水凝膠;b. 掃描電鏡觀察(×200);c. TGTP水凝膠體外緩釋川芎嗪微粒檢測
Figure1. Detection of physicochemical properties of TGTP hydrogela. The TGTP hydrogel was synthesized under UV irradiation; b. Scanning electron microscope observation (×200); c.
2.2 BBB評分觀察
造模前各組大鼠BBB評分均為21分。造模后各時間點,A組大鼠BBB評分均高于其余3組,差異有統計學意義(P<0.05);造模后1、3、7 d,B、C、D組BBB評分差異均無統計學意義(P>0.05);14、28 d C、D組BBB評分差異無統計學意義(P>0.05),但D組BBB評分明顯高于B組,差異有統計學意義(P<0.05)。見表1、圖2。
 )
Table1.
BBB score of rats in each group at different time points before and after modeling (n=6,
)
Table1.
BBB score of rats in each group at different time points before and after modeling (n=6,  )
)
 圖2
各組造模前后各時間點BBB評分變化趨勢
Figure2.
Variation trend of BBB score at each time point before and after modeling in each group
圖2
各組造模前后各時間點BBB評分變化趨勢
Figure2.
Variation trend of BBB score at each time point before and after modeling in each group
2.3 Nissl染色觀察
A組脊髓結構完整,灰質、白質界限清晰,灰質內大量神經元存在,尼氏體呈虎斑狀,形態規則;B組脊髓缺損周圍組織溶解,幾乎無神經元存在;C組灰質內僅可見少量殘留神經元,尼氏體形態欠完整;D組神經元數量較B組多,可見到部分未凋亡的神經元。見圖3。
 圖3
造模后28 d脊髓組織Nissl染色觀察(×20)
圖3
造模后28 d脊髓組織Nissl染色觀察(×20)
紅色箭頭示神經元尼氏體 a. A組;b. B組;c. C組;d. D組
Figure3. Nissl staining of spinal cord at 28 days after modeling (×20)Red arrow incicated the neuronal nissomes a. Group A; b. Group B; c. Group C; d. Group D
2.4 LFB染色觀察
A組脊髓組織髓鞘為亮藍色,白質連續完整,排列致密有序;B組出現神經纖維缺損,損傷周邊組織出現溶解性空洞;C、D組白質內髓鞘完整性有所改善,D組空洞面積減小,組織連續性好,髓鞘結構相對完整、致密。見圖4。
 圖4
造模后28 d脊髓組織LFB染色觀察(×20)
圖4
造模后28 d脊髓組織LFB染色觀察(×20)
紅色箭頭示髓鞘結構 a. A組;b. B組;c. C組;d. D組
Figure4. LFB staining of spinal cord at 28 days after modeling (×20)Red arrow incicated the myelin sheath a. Group A; b. Group B; c. Group C; d. Group D
2.5 免疫組織化學染色觀察
鏡下見NF-кB、TNF-α、IL-10彌散性散在分布于損傷周圍組織,陽性表達呈棕褐色。A、D組NF-кB A值明顯低于B、C組,A組低于D組,差異均有統計學意義(P<0.05)。A組TNF-α A值明顯低于B、C組,D組低于B組,差異有統計學意義(P<0.05);其余各組間TNF-α A值比較差異均無統計學意義(P>0.05)。A組IL-10 A值明顯高于其余3組,C、D組高于B組,差異均有統計學意義(P<0.05);其余各組間IL-10 A值比較差異均無統計學意義(P>0.05)。見圖5及表2。
 圖5
造模后28 d各組脊髓組織各炎癥因子免疫組織化學染色觀察(×20)
圖5
造模后28 d各組脊髓組織各炎癥因子免疫組織化學染色觀察(×20)
紅色箭頭示蛋白陽性表達,從上至下依次為NF-κB、TNF-α、IL-10 a. A組;b. B組;c. C組;d. D組
Figure5. Immunohistochemical staining of inflammatory factors in spinal cord at 28 days after modeling (×20)Red arrow indicated positive protein expression, from top to bottom for NF-κB, TNF-α, and IL-10, respectively a. Group A; b. Group B; c. Group C; d. Group D
2.6 免疫熒光染色觀察
A組神經纖維結構完整,連續性好,灰質內可見形態規整神經元;B組神經纖維呈點狀存在,未見完整神經元;C組神經纖維數量較B組多,D組神經纖維與神經元數量顯著多于B、C組,但與A組相比,神經元形態仍欠規則、核固縮。見圖6。
 圖6
造模后28 d各組NF200免疫熒光染色觀察(激光共聚焦顯微鏡×20)
圖6
造模后28 d各組NF200免疫熒光染色觀察(激光共聚焦顯微鏡×20)
從上至下依次為DAPI、NF200、二者重疊 a. A組;b. B組;c. C組;d. D組
Figure6. NF200 immunofluorescence staining in each group at 28 days after modeling (Laser confocal microscope×20)From top to bottom for DAPI, NF200, and merge, respectively a. Group A; b. Group B; c. Group C; d. Group D
2.7 Western blot檢測
A、B、C、D組脊髓組織中NF200蛋白相對表達量分別為1.44±0.01、0.76±0.03、0.95±0.02、1.23±0.02。A組脊髓組織中NF200蛋白相對表達量明顯高于其余3組,差異有統計學意義(P<0.05);C、D組高于B組,D組高于C組,差異均有統計學意義(P<0.05)。見圖7。
 圖7
Western blot檢測各組NF200蛋白表達
圖7
Western blot檢測各組NF200蛋白表達
Mr:相對分子質量 1:A組 2:B組 3:C組 4:D組
Figure7. The expression of NF200 protein in each group detected by Western blot assayMr: Relative molecular mass 1: Group A 2: Group B 3: Group C 4: Group D
3 討論
脊髓損傷后炎癥反應、膠質瘢痕形成等一系列繼發性級聯反應限制了神經再生與修復[13]。在傳統手術與藥物等治療手段效果欠佳的情況下,組織工程材料攜載藥物、細胞或生長因子成為修復脊髓損傷的新手段[14]。水凝膠由于軟組織力學特性可控,不僅能夠填補脊髓原發性缺損,還能使攜載的藥物形成局部富集與緩釋[15-16]。導電水凝膠的應用能加強細胞間生物電信號交流,恢復因損傷中斷的傳導性神經通路,維持神經再生所需的電學微環境[17]。基于上述背景,本研究首先在體外合成TGTP水凝膠,掃描電鏡及體外藥物緩釋實驗提示其具有良好組織生長空間,鹽酸川芎嗪微粒也能夠逐步緩釋,優良的組織工程材料學特性為后續體內實驗研究奠定了基礎。
當前,組織工程材料修復脊髓損傷的基礎研究多選擇脊髓半切或全切大鼠模型,考慮到脊髓半切無法做到定量切除脊髓組織、實驗一致性無法實現的劣勢,本團隊自主研發了顯微雙刃剪,該器材可實現定量、精準切除脊髓組織[18]。導電水凝膠雖然能夠填補原發性創傷所致空腔,但其自身在誘導神經細胞再生方面療效有限;干細胞移植雖能有效補充壞死、凋亡的神經細胞,但受限于其自身無法模擬脊髓局部復雜的微環境,存活率大大降低[19]。中醫藥治療脊髓損傷具有“多途徑、多靶點”的優勢,可特異性地針對脊髓損傷病理機制的復雜特點[20]。因此,本研究將具備改善微循環、保護神經細胞作用的鹽酸川芎嗪微粒添加至導電水凝膠中,制備TGTP水凝膠并植入大鼠脊髓缺損處,以期通過緩釋川芎嗪微粒,使藥物直接通過血腦屏障在體內長久起效,提高藥物體內利用率,避免體外長期給藥、藥物半衰期短的缺點。
BBB評分是公認的評估脊髓損傷大鼠后肢運動功能的方法[21]。本研究通過評估造模后不同時間點4組大鼠BBB評分,發現D組自造模后14 d起,BBB評分即優于B組。雖然D組改善脊髓損傷大鼠后肢運動療效明顯,但仍未觀察到大鼠后足掌面著地的現象,分析原因可能在于脊髓全橫斷模型創傷過大,短時間內神經功能恢復受限。另外,本研究還采用Nissl染色與LFB染色分別評估了各組大鼠脊髓組織神經元存活、髓鞘再生等情況,結果顯示D組脊髓缺損處周圍仍可見少量殘存神經元,且組織溶解率降低,神經纖維排列也相對有序,髓鞘密集,這進一步說明了TGTP水凝膠能夠發揮保護神經細胞、抑制脫髓鞘的作用,最大程度地保護軸突,協助生物電信號跳躍式傳遞,維持并保護神經元的正常功能。脊髓修復過程中軸突再生至關重要[22],NF200作為構成神經元的基本骨架結構之一,主要存在于軸突中[23]。我們分別通過免疫熒光染色和Western blot檢測了各組NF200的表達,結果顯示D組NF200表達量明顯高于B、C組,說明TGTP水凝膠能夠促進神經元結構的修復,并生成軸突進行正常生理活動,一定程度促進了脊髓損傷神經功能修復。該結果也對前述行為學、組織形態學染色結果做出了解釋,如果缺少神經元及神經軸突的存在,勢必無法完成運動功能的恢復。
在明確TGTP水凝膠療效的基礎上,本研究初步探索了其修復脊髓損傷的機制。脊髓原發性損傷后,包括中性粒細胞、巨噬細胞等炎癥細胞向損傷區域浸潤,并激活常駐小膠質細胞,釋放大量炎癥因子,促炎與抗炎因子穩態被破壞,進一步誘導神經元壞死、凋亡[24-25]。NF-кB廣泛存在于真核細胞胞質內,該通路可調控多種參與炎癥反應的細胞因子,如TNF-α、IL-10等,影響細胞增殖、分化及凋亡[26-27]。維持脊髓組織內促炎/抗炎因子的平衡,對于促進脊髓損傷恢復具有重要意義。本研究通過免疫組織化學染色檢測發現,脊髓損傷后B組NF-кB、TNF-α表達量明顯增多,IL-10表達量極低,而D組能夠有效降低 NF-кB、TNF-α的表達,促進IL-10表達。因此,本研究暫且可以得出結論,TGTP水凝膠可以減輕脊髓損傷后炎癥反應,抑制NF-кB信號通路及促炎因子分泌,促進抗炎因子表達,維持脊髓損傷微環境穩態,保護神經細胞。
綜上述,TGTP水凝膠可以改善脊髓損傷大鼠的神經功能,抑制炎癥反應,減輕脊髓組織結構破壞。但由于本研究僅為體外及動物實驗,存在一定局限性,關于TGTP水凝膠是否存在細胞毒性作用,以及修復脊髓損傷的具體分子機制尚待進一步研究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
倫理聲明 研究方案經北京中醫藥大學實驗動物倫理委員會批準(BUCM-4-2021040802-2021);實驗動物生產許可證號:SCXK(京)2017-0005,實驗動物使用許可證號:SYXK(京)2020-0013
作者貢獻聲明 蔣昇源、鄧博文、徐林、穆曉紅:研究設計及協助研究開展;蔣昇源、鄧博文、劉港、白惠中:研究實施及文章撰寫;范筱、趙毅:數據收集整理及統計分析