引用本文: 曾輝, 郭芳, 黃碩, 劉寧, 郭亞媛, 劉昌奎. NaOH改善3D打印聚左旋乳酸網狀支架表面形貌的實驗研究. 中國修復重建外科雜志, 2024, 38(3): 348-355. doi: 10.7507/1002-1892.202311089 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
近年來,骨組織工程支架已成為治療因感染、創傷、腫瘤等因素導致骨缺損的重要手段。理想支架要求具有合適力學性能、可降解性及良好生物安全性,以及三維多孔結構,為細胞營養滲入、產物代謝提供物質交換通道[1-4]。聚左旋乳酸(poly-L-lactic acid,PLLA)是一種人工合成高分子有機化合物,原料來源廣泛且降解產物無污染,是高分子生物可降解材料中具有發展前景的材料之一[5-6]。近年研究證實支架表面形貌可直接影響細胞增殖、分化行為,表面粗糙的網狀支架對于細胞成骨分化具有促進作用[7-8]。而PLLA不具有生物活性且表面光滑、疏水性強,如作為植入物直接使用,不利于細胞生長[9]。
研究發現用堿性溶液水解聚合物材料表面可以改善材料表面性能,從而促進細胞黏附和增殖[10-11]。Gupta等[12]采用NaOH處理聚己內酯(polycaprolactone,PCL)支架,結果顯示支架直徑隨處理時間增加而減小,但仍能保持完整纖維網狀結構,并有效改善細胞黏附。另外,有大量研究將NaOH處理作為制作支架表面涂層的第一步,且該步驟對涂層成功制備至關重要[13-17]。Jaidev等[18]的研究采用3D打印技術制備聚乳酸支架,并將其浸入5.0 mol/L NaOH中1 h,結果顯示該處理有利于聚乙烯亞胺偶聯至支架表面。但目前對NaOH處理PLLA支架時具體水解過程的了解尚不充分,且缺少聚合物水解過程中NaOH濃度、時間參數參考。為此,本研究深入分析不同濃度NaOH及處理時間對3D打印PLLA網狀支架微觀形貌、能譜元素、表面粗糙度、親水性、壓縮強度及細胞黏附、增殖等方面的影響,以期為在機械強度損失較小情況下獲得最理想NaOH反應參數提供參考。
1 材料與方法
1.1 主要試劑與儀器
PLLA(吉林省科瑞斯生物科技有限公司);NaOH(國藥集團化學試劑有限公司);DMEM/F12培養基、青霉素、鏈霉素(HyClone公司,美國);FBS(GIBCO公司,美國);細胞活性與細胞毒性檢測試劑盒(上海碧云天生物技術有限公司)。SD大鼠BMSCs為本實驗室凍存。
Professor 300 3D打印機(陜西聚康高博醫療科技有限公司);掃描電鏡(Zeiss公司,德國);JY-82接觸角測量儀(Dataphysics公司,德國);電動液壓伺服機械測試機(MTS公司,美國);原子力顯微鏡(Bruker公司,德國);激光共聚焦顯微鏡(Leica公司,德國)。
1.2 3D打印PLLA網狀支架制備及觀測
采用熔融沉積成型技術制備PLLA網狀支架。支架設計及打印參數如下:孔徑500 μm,纖維直徑400 μm,打印速度20 mm/s,纖維夾角90°,噴嘴溫度180℃,平鋪掃描。于掃描電鏡下觀察支架微觀形貌。
1.3 實驗方法
1.3.1 分組方法
利用NaOH溶液對3D打印PLLA網狀支架表面進行蝕刻處理。處理條件:NaOH溶液濃度分別為0.01、0.1、0.5、1.0、3.0 mol/L,處理時間分別為1、3、6、9、12 h,共25種濃度/時間組合。處理方法:樣本經去離子水清洗后加入3 mL NaOH溶液,確保溶液沒過支架,置于室溫至相應處理時間后取出,流水徹底沖洗12 h,用去離子水以離心半徑12 cm、1 000 r/min 離心清洗3次,40℃烘箱內烘干備用。以未經NaOH溶液處理的正常支架作為對照(未處理組)。
1.3.2 觀測指標
① 支架表面形貌表征及能譜分析:將經NaOH溶液處理的各組樣本黏在樣品臺導電膠上,噴金處理后掃描電鏡拍攝樣品形貌、能量色散光譜(energy dispersive spectrum,EDS)對樣品表面元素進行分析。形貌拍攝時加速電壓為3 kV,EDS拍攝時加速電壓為15 kV,探測器為SE2二次電子探測器。
根據觀察結果,篩選形成穩定、典型且支架表面形貌未塌陷樣本,以對應NaOH處理參數組合處理支架后進行后續支架表面粗糙度、親水性、壓縮性能觀測。
② 支架表面粗糙度檢測:采用原子力顯微鏡分析樣品表面粗糙度。取尺寸為10 mm×10 mm×3 mm經NaOH溶液處理及未處理的樣品,用雙面膠帶固定于載玻片,采用氮化硅懸臂探針在輕敲模式下對樣品進行掃描,掃描面積為20 μm×20 μm。
③ 支架親水性檢測:取尺寸為10 mm×10 mm×3 mm經NaOH溶液處理及未處理樣品,置于接觸角測量儀測試平臺,利用設備自動滴定系統滴上水滴,拍攝測試照片,用量角法測量接觸角。每組測量3個樣品。
④ 支架壓縮性能測試:使用電動液壓伺服機械測試機參照GB/T1041-2008方法,對NaOH溶液處理及未處理樣品行單軸壓縮試驗。樣品尺寸為10 mm×10 mm×4 mm,測試25%應變對應的壓縮強度,壓縮速率1 mm/min。每組測量3個樣品。
結合粗糙度、親水性、壓縮性能相關指標測量結果,篩選表現較優的支架,以對應NaOH處理參數組合進行后續細胞培養觀測。
⑤ 支架表面細胞培養觀察:取BMSCs采用含10%FBS和1%青霉素/鏈霉素的DMEM/F12培養基,于37℃、5%CO2培養箱中培養。待細胞貼壁生長至融合70%~80%時傳代,取第3~5代細胞進行后續實驗。
取尺寸為10 mm×10 mm×3 mm、經NaOH溶液處理(處理組)及未處理(未處理組)的樣品,經60Co輻照滅菌處理后放入24孔板,每孔1塊。將BMSCs以5×104個/mL密度滴加于支架表面,置于37℃、5%CO2培養箱內孵育。培養后6、24 h移除培養基,PBS清洗后以2.5%戊二醛固定細胞4 h,無水乙醇梯度脫水;樣品噴金后掃描電鏡觀察細胞黏附及增殖情況。培養后1、3、5 d取出孔板,常規活/死細胞染色,激光共聚焦顯微鏡下觀察細胞成活情況,活、死細胞分別標記為綠色、紅色熒光。
1.4 統計學方法
采用SPSS13.0統計軟件進行分析。計量資料行Shapiro-Wilk正態性檢驗,均符合正態分布,以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準α=0.05。
2 結果
2.1 3D打印PLLA網狀支架微觀形貌觀測
掃描電鏡觀察3D打印PLLA網狀支架孔徑為500 μm、纖維直徑400 μm,支架孔隙均勻,纖維走向筆直,支架表面光滑。見圖1。
 圖1
3D打印PLLA網狀支架觀察
圖1
3D打印PLLA網狀支架觀察
a. 大體觀察;b、c. 掃描電鏡觀察,放大倍數分別為50、5 000倍
Figure1. Observation of 3D printed PLLA mesh scaffolda. General observation; b, c. Scanning electron microscope observation with magnification of 50 and 5 000 times, respectively
2.2 支架表面形貌及能譜分析
掃描電鏡觀察示,經NaOH溶液處理后支架表面粗糙或形成不規則大小孔洞。相同處理時間,隨著NaOH濃度增加,支架表面孔徑、孔密度增大。其中,處理時間為12 h時,NaOH濃度為0.01 mol/L支架表面僅略有褶皺,未見明顯孔洞;濃度逐漸增加至1.0 mol/L后,支架表面逐漸出現孔洞且孔徑、密度增大。相同處理濃度,隨著處理時間增加,支架表面孔洞增多并增大。其中,NaOH濃度為1.0 mol/L時,隨處理時間延長支架表面孔密度逐漸增加;濃度為3.0 mol/L時,隨處理時間延長支架表面孔洞增多并增大,3 h時達高密度大孔洞結構,處理時間>6 h時支架表面則轉變為表面塌陷形態,提示支架廣泛水解。見圖2。
 圖2
NaOH處理后3D打印PLLA網狀支架表面形貌(掃描電鏡×5 000)
圖2
NaOH處理后3D打印PLLA網狀支架表面形貌(掃描電鏡×5 000)
a. 0.01 mol/L/12 h;b. 0.1 mol/L/12 h;c. 0.5 mol/L/12 h;d. 1.0 mol/L/3 h;e. 1.0 mol/L/6 h;f. 1.0 mol/L/12 h;g. 3.0 mol/L/3 h;h. 3.0 mol/L/6 h;i. 3.0 mol/L/12 h
Figure2. Surface morphology of 3D printed PLLA mesh scaffold after NaOH treatment (Scanning electron microscope×5 000)a. 0.01 mol/L/12 h; b. 0.1 mol/L/12 h; c. 0.5 mol/L/12 h; d. 1.0 mol/L/3 h; e. 1.0 mol/L/6 h; f. 1.0 mol/L/12 h; g. 3.0 mol/L/3 h; h. 3.0 mol/L/6 h; i. 3.0 mol/L/12 h
掃描電鏡觀察示晶體分布在聚合物表面;EDS對樣品進行表征顯示晶體含有Na、O兩種元素,為NaOH晶體。見圖3。
 圖3
NaOH處理后3D打印PLLA網狀支架表面成分分析
圖3
NaOH處理后3D打印PLLA網狀支架表面成分分析
a. 掃描電鏡觀察(×1 000);b. EDS分層圖像;c. 能譜元素映射示Na、C和O電子圖像
Figure3. Analysis of composition of 3D printed PLLA mesh scaffold surface after NaOH treatmenta. Scanning electron microscope observation (×1 000); b. EDS layered image; c. Spectral element mapping showed the electron images of Na, C, and O, respectively
根據上述觀察結果選擇經以下參數組合處理后支架進行后續粗糙度、親水性、壓縮性能觀測,包括0.1 mol/L/12 h、0.5 mol/L/12 h、1.0 mol/L/3 h、1.0 mol/L/6 h、1.0 mol/L/12 h、3.0 mol/L/3 h。
2.3 支架表面粗糙度檢測
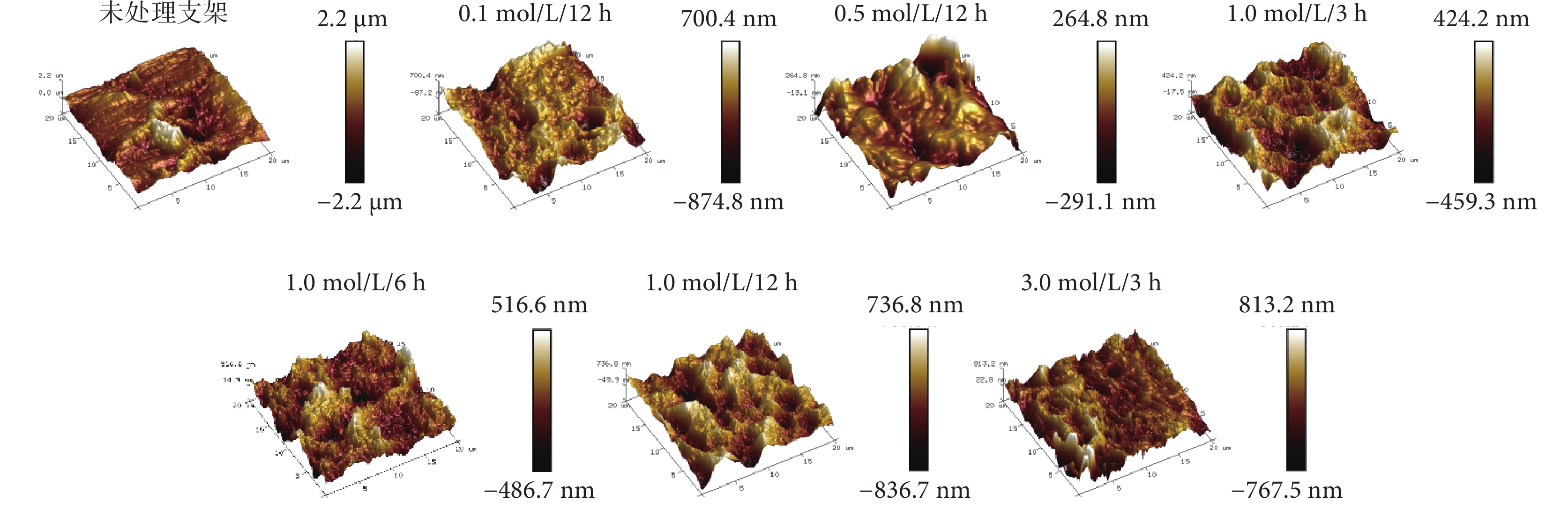
與未處理支架光滑表面相比,NaOH處理后支架呈梯度且更復雜的表面微形貌改變。進一步對其表面粗糙度進行定量分析發現,各處理支架表面粗糙度均較未處理支架增加,差異有統計學意義(P<0.05);處理支架中除1.0 mol/L/6 h與3.0 mol/L/3 h組間差異無統計學意義(P>0.05)外,其余組間差異均有統計學意義(P<0.05)。見圖4及表1。
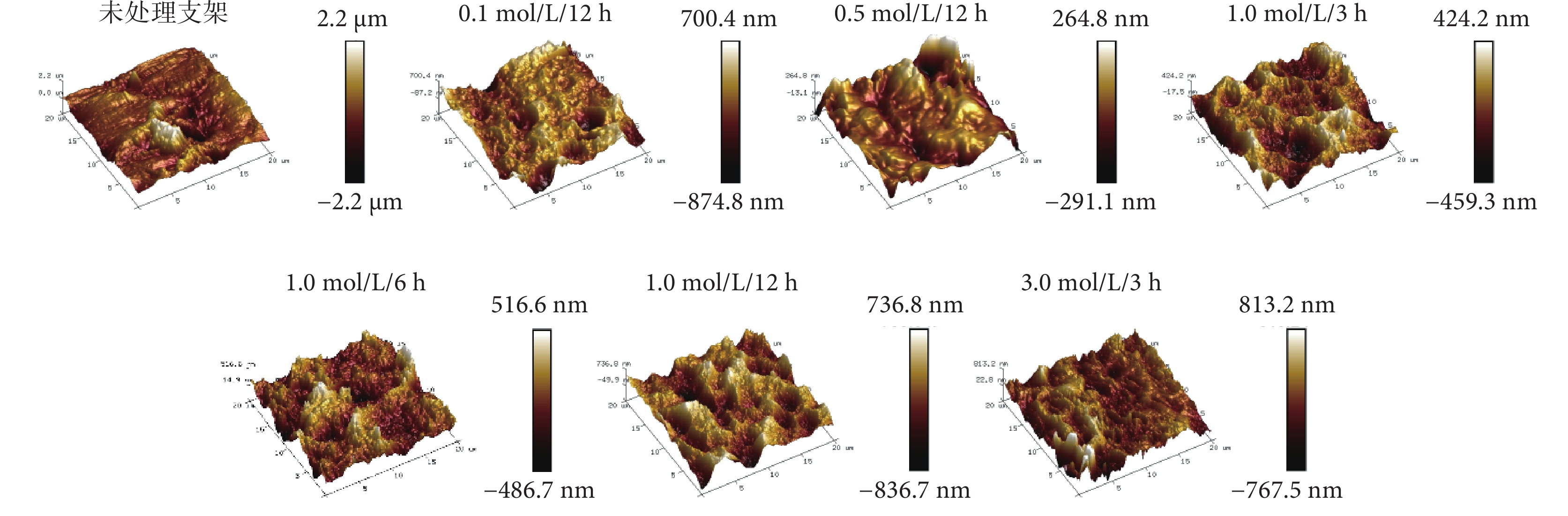 圖4
NaOH處理前后3D打印PLLA網狀支架原子力顯微鏡觀測粗糙度
Figure4.
Roughness of 3D printed PLLA mesh scaffold before and after NaOH treatment by using atomic force microscopy
圖4
NaOH處理前后3D打印PLLA網狀支架原子力顯微鏡觀測粗糙度
Figure4.
Roughness of 3D printed PLLA mesh scaffold before and after NaOH treatment by using atomic force microscopy
 )
Table1.
Comparison of surface roughness, contact angle, and compressive strength between groups (n=3,
)
Table1.
Comparison of surface roughness, contact angle, and compressive strength between groups (n=3,  )
)
2.4 支架親水性檢測
未處理支架表面接觸角最大,3.0 mol/L/3 h處理支架最小。各處理支架表面接觸角均低于未處理支架,差異有統計學意義(P<0.05)。處理支架中除1.0 mol/L/12 h與3.0 mol/L/3 h組間差異無統計學意義(P>0.05)外,其余組間差異均有統計學意義(P<0.05)。見圖5及表1。
 圖5
NaOH處理前后3D打印PLLA網狀支架表面接觸角觀察
Figure5.
Contact angle of 3D printed PLLA mesh scaffold before and after NaOH treatment
圖5
NaOH處理前后3D打印PLLA網狀支架表面接觸角觀察
Figure5.
Contact angle of 3D printed PLLA mesh scaffold before and after NaOH treatment
2.5 支架壓縮強度檢測
未處理支架表面壓縮強度最大,3.0 mol/L/3 h處理支架最小。其中,0.1 mol/L/12 h與1.0 mol/L/3 h處理支架壓縮強度與未處理支架差異無統計學意義(P>0.05);其余處理支架壓縮強度均明顯小于未處理支架(P<0.05)。見表1。
2.6 支架表面細胞培養觀察
結合粗糙度、親水性、壓縮性能相關指標測量結果,選擇1.0 mol/L/3 h NaOH處理支架進行細胞培養觀察。掃描電鏡見培養6 h后,未處理組支架表面細胞產生細胞質片狀結構,纖維狀突起較少;處理組支架表面細胞產生絲狀延伸,錨定在粗糙表面凸起和凹陷內,支架黏附細胞伸出的突觸更多。24 h后,未處理組支架表面細胞伸出少許纖維狀突起;處理組支架表面黏附細胞的“接觸誘導”效應更明顯,呈“拉伸”狀態,與未處理組相比細胞增多、細胞鋪展面積增大。見圖6。
 圖6
未處理組(左)及處理組(右)支架表面BMSCs觀察(掃描電鏡×3 000)
圖6
未處理組(左)及處理組(右)支架表面BMSCs觀察(掃描電鏡×3 000)
a. 培養6 h;b. 培養24 h
Figure6. Observation of BMSCs on the scaffold surface of the untreated group (left) and treated group (right) (Scanning electron microscope×3 000)a. Cultured for 6 hours; b. Cultured for 24 hours
激光共聚焦顯微鏡下觀察兩組支架未見明顯死細胞。培養后1 d可見處理組支架表面細胞多于未處理組;3、5 d時處理組支架表面不僅較對照組有更多細胞,且細胞逐漸鋪展,呈現多邊形或纖維狀,提示支架促進細胞增殖和黏附。見圖7。
 圖7
未處理組(上)及處理組(下)活/死細胞染色觀察(激光共聚焦顯微鏡×50)
圖7
未處理組(上)及處理組(下)活/死細胞染色觀察(激光共聚焦顯微鏡×50)
從左至右分別為培養1、3、5 d
Figure7. Live/dead cell staining observation of the untreated group (top) and the treated group (bottom) (Laser confocal microscope×50)From left to right for 1, 3, and 5 days of culture, respectively
3 討論
NaOH對PLLA網狀支架表面蝕刻是通過兩種途徑實現。一是PLLA主鏈上的酯鍵發生皂化反應,其中NaOH中的OH– 破壞其主鏈,形成羥基和羧基,這些官能團與水相互作用,從而增強材料親水性[19-20];二是固相NaOH晶體戳入PLLA表面,從而在表面產生凹陷和孔洞[21]。本研究結果顯示當NaOH處理濃度一致時,隨著處理時間延長,支架表面孔密度增加;當NaOH處理時間一致時,隨著處理濃度增加,支架表面不僅表現孔洞數量增加,還表現為體積增大。分析可能是因為低濃度NaOH處理時,僅存在聚合物鏈斷裂而導致的表面粗糙、多孔;隨著NaOH濃度增大,高濃度NaOH聚集并形成針簇戳入PLLA表面,與PLLA主鏈的水解斷裂作用相結合,從而導致聚合物表面形成更大、更深的孔洞。這與Sochacka等[22]的報道類似,NaOH低濃度處理復合材料表面僅顯示材料表面粗糙,隨著濃度增加表面形成小孔結構。本研究篩選出形成穩定、典型且未塌陷支架表面形貌的NaOH處理參數組合,并進行后續粗糙度、親水性、壓縮性能觀測。由于NaOH晶體聚集在材料表面,測試之前均需要徹底清洗支架。
微結構粗糙度和接觸角的改變可影響材料表面潤濕性,從而影響材料表面蛋白黏附,進而影響細胞黏附[23-24]。通常表面越粗糙,比表面積越大,表面能也越高,從而更有利于細胞(如成骨細胞)黏附和增殖[25-27]。Du等[28]的研究通過將絲膠素接枝至熱塑性聚氨酯表面,增加聚氨酯表面粗糙度,從而更有利于材料表面細胞生長,擴大了該材料的臨床應用范圍。本研究結果表明,3D打印PLLA網狀支架經NaOH處理后,表面粗糙度顯著增加。根據潤濕性的定義,接觸角在>90°/<90° 時,材料表現為疏水性/親水性。適度親水的表面(與水的接觸角為40°~80°)比過度疏水和親水的表面更有利于細胞黏附和增殖[29-30]。測試結果示NaOH處理支架均表現為親水性增強,其中0.5 mol/L/12 h、1.0 mol/L/3 h、1.0 mol/L/6 h、1.0 mol/L/12 h、3.0 mol/L/3 h處理支架接觸角在40°~80° 之間,可能更有利于細胞黏附、增殖。
理想的支架材料力學強度應適中,能承受生理壓力,為新生組織提供較好力學支撐[31]。壓縮試驗結果表明,支架壓縮強度隨NaOH處理濃度增加而不斷降低,經0.1 mol/L/12 h、1.0 mol/L/3 h處理后支架壓縮強度和未處理支架相比,差異無統計學意義。介于本課題后期將該支架作為骨組織工程支架,對支架力學強度有一定要求,本研究旨在探討機械強度損失較小情況下的最理想NaOH反應參數,因此初步篩選出在接觸角和力學性能方面表現均較優的1.0 mol/L/3 h NaOH處理支架作為后續細胞黏附及增殖實驗樣件。
為了評估支架生物相容性,進一步研究細胞在蝕刻支架表面的黏附與增殖,本研究利用活/死細胞染色觀察細胞接種于支架后1、3、5 d細胞生長情況,并利用掃描電鏡觀察細胞接種后6、24 h與底物立即相互作用后的細胞反應。活/死細胞染色實驗結果顯示整個培養期間,細胞生長狀況良好,較少觀察到死細胞,間接表明3D打印PLLA網狀支架幾乎沒有細胞毒性,較安全。培養1 d可見經過蝕刻后的支架表面較未處理組有更多細胞,這與粗糙表面增加了細胞黏附相關;3、5 d時蝕刻后的支架表面可見更多細胞,且細胞也逐漸鋪展,呈現多邊形或纖維狀,可見NaOH處理有利于改善PLLA支架表面生物相容性。掃描電鏡觀察結果顯示,經NaOH處理后的支架上細胞增加,細胞鋪展面積增大,支架黏附細胞伸出的突觸也更多。接種細胞24 h后黏附的“接觸誘導”效應更為明顯,呈現“拉伸”狀態。以上結果說明NaOH蝕刻促進了細胞的增殖、黏附和伸展,這一點和Voisin等[32]報道結果一致。
綜上述,本研究通過NaOH蝕刻方法構建了3D打印PLLA網狀支架表面的粗糙或孔洞狀形態,改善了支架表面親水性,顯著增加了其用于細胞附著和基質沉積的表面積與體積比,為BMSCs在支架上生長提供了條件。但是,本研究仍存在一些不足,比如未探究NaOH對PLLA兩種蝕刻途徑在親水性改善方面的作用比例;在細胞實驗中也僅篩選了一種濃度/時間參數組合,后續研究需進一步完善,以期得到更全面的研究結論。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究經西安醫學院實驗動物倫理委員會批準(XYLS2020137)
作者貢獻聲明 曾輝:實驗實施、撰寫文章;郭芳:實驗數據收集整理及分析;黃碩、劉寧、郭亞媛:參與實驗并收集數據;劉昌奎:提供實驗思路、對文章進行審閱和修改
近年來,骨組織工程支架已成為治療因感染、創傷、腫瘤等因素導致骨缺損的重要手段。理想支架要求具有合適力學性能、可降解性及良好生物安全性,以及三維多孔結構,為細胞營養滲入、產物代謝提供物質交換通道[1-4]。聚左旋乳酸(poly-L-lactic acid,PLLA)是一種人工合成高分子有機化合物,原料來源廣泛且降解產物無污染,是高分子生物可降解材料中具有發展前景的材料之一[5-6]。近年研究證實支架表面形貌可直接影響細胞增殖、分化行為,表面粗糙的網狀支架對于細胞成骨分化具有促進作用[7-8]。而PLLA不具有生物活性且表面光滑、疏水性強,如作為植入物直接使用,不利于細胞生長[9]。
研究發現用堿性溶液水解聚合物材料表面可以改善材料表面性能,從而促進細胞黏附和增殖[10-11]。Gupta等[12]采用NaOH處理聚己內酯(polycaprolactone,PCL)支架,結果顯示支架直徑隨處理時間增加而減小,但仍能保持完整纖維網狀結構,并有效改善細胞黏附。另外,有大量研究將NaOH處理作為制作支架表面涂層的第一步,且該步驟對涂層成功制備至關重要[13-17]。Jaidev等[18]的研究采用3D打印技術制備聚乳酸支架,并將其浸入5.0 mol/L NaOH中1 h,結果顯示該處理有利于聚乙烯亞胺偶聯至支架表面。但目前對NaOH處理PLLA支架時具體水解過程的了解尚不充分,且缺少聚合物水解過程中NaOH濃度、時間參數參考。為此,本研究深入分析不同濃度NaOH及處理時間對3D打印PLLA網狀支架微觀形貌、能譜元素、表面粗糙度、親水性、壓縮強度及細胞黏附、增殖等方面的影響,以期為在機械強度損失較小情況下獲得最理想NaOH反應參數提供參考。
1 材料與方法
1.1 主要試劑與儀器
PLLA(吉林省科瑞斯生物科技有限公司);NaOH(國藥集團化學試劑有限公司);DMEM/F12培養基、青霉素、鏈霉素(HyClone公司,美國);FBS(GIBCO公司,美國);細胞活性與細胞毒性檢測試劑盒(上海碧云天生物技術有限公司)。SD大鼠BMSCs為本實驗室凍存。
Professor 300 3D打印機(陜西聚康高博醫療科技有限公司);掃描電鏡(Zeiss公司,德國);JY-82接觸角測量儀(Dataphysics公司,德國);電動液壓伺服機械測試機(MTS公司,美國);原子力顯微鏡(Bruker公司,德國);激光共聚焦顯微鏡(Leica公司,德國)。
1.2 3D打印PLLA網狀支架制備及觀測
采用熔融沉積成型技術制備PLLA網狀支架。支架設計及打印參數如下:孔徑500 μm,纖維直徑400 μm,打印速度20 mm/s,纖維夾角90°,噴嘴溫度180℃,平鋪掃描。于掃描電鏡下觀察支架微觀形貌。
1.3 實驗方法
1.3.1 分組方法
利用NaOH溶液對3D打印PLLA網狀支架表面進行蝕刻處理。處理條件:NaOH溶液濃度分別為0.01、0.1、0.5、1.0、3.0 mol/L,處理時間分別為1、3、6、9、12 h,共25種濃度/時間組合。處理方法:樣本經去離子水清洗后加入3 mL NaOH溶液,確保溶液沒過支架,置于室溫至相應處理時間后取出,流水徹底沖洗12 h,用去離子水以離心半徑12 cm、1 000 r/min 離心清洗3次,40℃烘箱內烘干備用。以未經NaOH溶液處理的正常支架作為對照(未處理組)。
1.3.2 觀測指標
① 支架表面形貌表征及能譜分析:將經NaOH溶液處理的各組樣本黏在樣品臺導電膠上,噴金處理后掃描電鏡拍攝樣品形貌、能量色散光譜(energy dispersive spectrum,EDS)對樣品表面元素進行分析。形貌拍攝時加速電壓為3 kV,EDS拍攝時加速電壓為15 kV,探測器為SE2二次電子探測器。
根據觀察結果,篩選形成穩定、典型且支架表面形貌未塌陷樣本,以對應NaOH處理參數組合處理支架后進行后續支架表面粗糙度、親水性、壓縮性能觀測。
② 支架表面粗糙度檢測:采用原子力顯微鏡分析樣品表面粗糙度。取尺寸為10 mm×10 mm×3 mm經NaOH溶液處理及未處理的樣品,用雙面膠帶固定于載玻片,采用氮化硅懸臂探針在輕敲模式下對樣品進行掃描,掃描面積為20 μm×20 μm。
③ 支架親水性檢測:取尺寸為10 mm×10 mm×3 mm經NaOH溶液處理及未處理樣品,置于接觸角測量儀測試平臺,利用設備自動滴定系統滴上水滴,拍攝測試照片,用量角法測量接觸角。每組測量3個樣品。
④ 支架壓縮性能測試:使用電動液壓伺服機械測試機參照GB/T1041-2008方法,對NaOH溶液處理及未處理樣品行單軸壓縮試驗。樣品尺寸為10 mm×10 mm×4 mm,測試25%應變對應的壓縮強度,壓縮速率1 mm/min。每組測量3個樣品。
結合粗糙度、親水性、壓縮性能相關指標測量結果,篩選表現較優的支架,以對應NaOH處理參數組合進行后續細胞培養觀測。
⑤ 支架表面細胞培養觀察:取BMSCs采用含10%FBS和1%青霉素/鏈霉素的DMEM/F12培養基,于37℃、5%CO2培養箱中培養。待細胞貼壁生長至融合70%~80%時傳代,取第3~5代細胞進行后續實驗。
取尺寸為10 mm×10 mm×3 mm、經NaOH溶液處理(處理組)及未處理(未處理組)的樣品,經60Co輻照滅菌處理后放入24孔板,每孔1塊。將BMSCs以5×104個/mL密度滴加于支架表面,置于37℃、5%CO2培養箱內孵育。培養后6、24 h移除培養基,PBS清洗后以2.5%戊二醛固定細胞4 h,無水乙醇梯度脫水;樣品噴金后掃描電鏡觀察細胞黏附及增殖情況。培養后1、3、5 d取出孔板,常規活/死細胞染色,激光共聚焦顯微鏡下觀察細胞成活情況,活、死細胞分別標記為綠色、紅色熒光。
1.4 統計學方法
采用SPSS13.0統計軟件進行分析。計量資料行Shapiro-Wilk正態性檢驗,均符合正態分布,以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準α=0.05。
2 結果
2.1 3D打印PLLA網狀支架微觀形貌觀測
掃描電鏡觀察3D打印PLLA網狀支架孔徑為500 μm、纖維直徑400 μm,支架孔隙均勻,纖維走向筆直,支架表面光滑。見圖1。
 圖1
3D打印PLLA網狀支架觀察
圖1
3D打印PLLA網狀支架觀察
a. 大體觀察;b、c. 掃描電鏡觀察,放大倍數分別為50、5 000倍
Figure1. Observation of 3D printed PLLA mesh scaffolda. General observation; b, c. Scanning electron microscope observation with magnification of 50 and 5 000 times, respectively
2.2 支架表面形貌及能譜分析
掃描電鏡觀察示,經NaOH溶液處理后支架表面粗糙或形成不規則大小孔洞。相同處理時間,隨著NaOH濃度增加,支架表面孔徑、孔密度增大。其中,處理時間為12 h時,NaOH濃度為0.01 mol/L支架表面僅略有褶皺,未見明顯孔洞;濃度逐漸增加至1.0 mol/L后,支架表面逐漸出現孔洞且孔徑、密度增大。相同處理濃度,隨著處理時間增加,支架表面孔洞增多并增大。其中,NaOH濃度為1.0 mol/L時,隨處理時間延長支架表面孔密度逐漸增加;濃度為3.0 mol/L時,隨處理時間延長支架表面孔洞增多并增大,3 h時達高密度大孔洞結構,處理時間>6 h時支架表面則轉變為表面塌陷形態,提示支架廣泛水解。見圖2。
 圖2
NaOH處理后3D打印PLLA網狀支架表面形貌(掃描電鏡×5 000)
圖2
NaOH處理后3D打印PLLA網狀支架表面形貌(掃描電鏡×5 000)
a. 0.01 mol/L/12 h;b. 0.1 mol/L/12 h;c. 0.5 mol/L/12 h;d. 1.0 mol/L/3 h;e. 1.0 mol/L/6 h;f. 1.0 mol/L/12 h;g. 3.0 mol/L/3 h;h. 3.0 mol/L/6 h;i. 3.0 mol/L/12 h
Figure2. Surface morphology of 3D printed PLLA mesh scaffold after NaOH treatment (Scanning electron microscope×5 000)a. 0.01 mol/L/12 h; b. 0.1 mol/L/12 h; c. 0.5 mol/L/12 h; d. 1.0 mol/L/3 h; e. 1.0 mol/L/6 h; f. 1.0 mol/L/12 h; g. 3.0 mol/L/3 h; h. 3.0 mol/L/6 h; i. 3.0 mol/L/12 h
掃描電鏡觀察示晶體分布在聚合物表面;EDS對樣品進行表征顯示晶體含有Na、O兩種元素,為NaOH晶體。見圖3。
 圖3
NaOH處理后3D打印PLLA網狀支架表面成分分析
圖3
NaOH處理后3D打印PLLA網狀支架表面成分分析
a. 掃描電鏡觀察(×1 000);b. EDS分層圖像;c. 能譜元素映射示Na、C和O電子圖像
Figure3. Analysis of composition of 3D printed PLLA mesh scaffold surface after NaOH treatmenta. Scanning electron microscope observation (×1 000); b. EDS layered image; c. Spectral element mapping showed the electron images of Na, C, and O, respectively
根據上述觀察結果選擇經以下參數組合處理后支架進行后續粗糙度、親水性、壓縮性能觀測,包括0.1 mol/L/12 h、0.5 mol/L/12 h、1.0 mol/L/3 h、1.0 mol/L/6 h、1.0 mol/L/12 h、3.0 mol/L/3 h。
2.3 支架表面粗糙度檢測
與未處理支架光滑表面相比,NaOH處理后支架呈梯度且更復雜的表面微形貌改變。進一步對其表面粗糙度進行定量分析發現,各處理支架表面粗糙度均較未處理支架增加,差異有統計學意義(P<0.05);處理支架中除1.0 mol/L/6 h與3.0 mol/L/3 h組間差異無統計學意義(P>0.05)外,其余組間差異均有統計學意義(P<0.05)。見圖4及表1。
 圖4
NaOH處理前后3D打印PLLA網狀支架原子力顯微鏡觀測粗糙度
Figure4.
Roughness of 3D printed PLLA mesh scaffold before and after NaOH treatment by using atomic force microscopy
圖4
NaOH處理前后3D打印PLLA網狀支架原子力顯微鏡觀測粗糙度
Figure4.
Roughness of 3D printed PLLA mesh scaffold before and after NaOH treatment by using atomic force microscopy
 )
Table1.
Comparison of surface roughness, contact angle, and compressive strength between groups (n=3,
)
Table1.
Comparison of surface roughness, contact angle, and compressive strength between groups (n=3,  )
)
2.4 支架親水性檢測
未處理支架表面接觸角最大,3.0 mol/L/3 h處理支架最小。各處理支架表面接觸角均低于未處理支架,差異有統計學意義(P<0.05)。處理支架中除1.0 mol/L/12 h與3.0 mol/L/3 h組間差異無統計學意義(P>0.05)外,其余組間差異均有統計學意義(P<0.05)。見圖5及表1。
 圖5
NaOH處理前后3D打印PLLA網狀支架表面接觸角觀察
Figure5.
Contact angle of 3D printed PLLA mesh scaffold before and after NaOH treatment
圖5
NaOH處理前后3D打印PLLA網狀支架表面接觸角觀察
Figure5.
Contact angle of 3D printed PLLA mesh scaffold before and after NaOH treatment
2.5 支架壓縮強度檢測
未處理支架表面壓縮強度最大,3.0 mol/L/3 h處理支架最小。其中,0.1 mol/L/12 h與1.0 mol/L/3 h處理支架壓縮強度與未處理支架差異無統計學意義(P>0.05);其余處理支架壓縮強度均明顯小于未處理支架(P<0.05)。見表1。
2.6 支架表面細胞培養觀察
結合粗糙度、親水性、壓縮性能相關指標測量結果,選擇1.0 mol/L/3 h NaOH處理支架進行細胞培養觀察。掃描電鏡見培養6 h后,未處理組支架表面細胞產生細胞質片狀結構,纖維狀突起較少;處理組支架表面細胞產生絲狀延伸,錨定在粗糙表面凸起和凹陷內,支架黏附細胞伸出的突觸更多。24 h后,未處理組支架表面細胞伸出少許纖維狀突起;處理組支架表面黏附細胞的“接觸誘導”效應更明顯,呈“拉伸”狀態,與未處理組相比細胞增多、細胞鋪展面積增大。見圖6。
 圖6
未處理組(左)及處理組(右)支架表面BMSCs觀察(掃描電鏡×3 000)
圖6
未處理組(左)及處理組(右)支架表面BMSCs觀察(掃描電鏡×3 000)
a. 培養6 h;b. 培養24 h
Figure6. Observation of BMSCs on the scaffold surface of the untreated group (left) and treated group (right) (Scanning electron microscope×3 000)a. Cultured for 6 hours; b. Cultured for 24 hours
激光共聚焦顯微鏡下觀察兩組支架未見明顯死細胞。培養后1 d可見處理組支架表面細胞多于未處理組;3、5 d時處理組支架表面不僅較對照組有更多細胞,且細胞逐漸鋪展,呈現多邊形或纖維狀,提示支架促進細胞增殖和黏附。見圖7。
 圖7
未處理組(上)及處理組(下)活/死細胞染色觀察(激光共聚焦顯微鏡×50)
圖7
未處理組(上)及處理組(下)活/死細胞染色觀察(激光共聚焦顯微鏡×50)
從左至右分別為培養1、3、5 d
Figure7. Live/dead cell staining observation of the untreated group (top) and the treated group (bottom) (Laser confocal microscope×50)From left to right for 1, 3, and 5 days of culture, respectively
3 討論
NaOH對PLLA網狀支架表面蝕刻是通過兩種途徑實現。一是PLLA主鏈上的酯鍵發生皂化反應,其中NaOH中的OH– 破壞其主鏈,形成羥基和羧基,這些官能團與水相互作用,從而增強材料親水性[19-20];二是固相NaOH晶體戳入PLLA表面,從而在表面產生凹陷和孔洞[21]。本研究結果顯示當NaOH處理濃度一致時,隨著處理時間延長,支架表面孔密度增加;當NaOH處理時間一致時,隨著處理濃度增加,支架表面不僅表現孔洞數量增加,還表現為體積增大。分析可能是因為低濃度NaOH處理時,僅存在聚合物鏈斷裂而導致的表面粗糙、多孔;隨著NaOH濃度增大,高濃度NaOH聚集并形成針簇戳入PLLA表面,與PLLA主鏈的水解斷裂作用相結合,從而導致聚合物表面形成更大、更深的孔洞。這與Sochacka等[22]的報道類似,NaOH低濃度處理復合材料表面僅顯示材料表面粗糙,隨著濃度增加表面形成小孔結構。本研究篩選出形成穩定、典型且未塌陷支架表面形貌的NaOH處理參數組合,并進行后續粗糙度、親水性、壓縮性能觀測。由于NaOH晶體聚集在材料表面,測試之前均需要徹底清洗支架。
微結構粗糙度和接觸角的改變可影響材料表面潤濕性,從而影響材料表面蛋白黏附,進而影響細胞黏附[23-24]。通常表面越粗糙,比表面積越大,表面能也越高,從而更有利于細胞(如成骨細胞)黏附和增殖[25-27]。Du等[28]的研究通過將絲膠素接枝至熱塑性聚氨酯表面,增加聚氨酯表面粗糙度,從而更有利于材料表面細胞生長,擴大了該材料的臨床應用范圍。本研究結果表明,3D打印PLLA網狀支架經NaOH處理后,表面粗糙度顯著增加。根據潤濕性的定義,接觸角在>90°/<90° 時,材料表現為疏水性/親水性。適度親水的表面(與水的接觸角為40°~80°)比過度疏水和親水的表面更有利于細胞黏附和增殖[29-30]。測試結果示NaOH處理支架均表現為親水性增強,其中0.5 mol/L/12 h、1.0 mol/L/3 h、1.0 mol/L/6 h、1.0 mol/L/12 h、3.0 mol/L/3 h處理支架接觸角在40°~80° 之間,可能更有利于細胞黏附、增殖。
理想的支架材料力學強度應適中,能承受生理壓力,為新生組織提供較好力學支撐[31]。壓縮試驗結果表明,支架壓縮強度隨NaOH處理濃度增加而不斷降低,經0.1 mol/L/12 h、1.0 mol/L/3 h處理后支架壓縮強度和未處理支架相比,差異無統計學意義。介于本課題后期將該支架作為骨組織工程支架,對支架力學強度有一定要求,本研究旨在探討機械強度損失較小情況下的最理想NaOH反應參數,因此初步篩選出在接觸角和力學性能方面表現均較優的1.0 mol/L/3 h NaOH處理支架作為后續細胞黏附及增殖實驗樣件。
為了評估支架生物相容性,進一步研究細胞在蝕刻支架表面的黏附與增殖,本研究利用活/死細胞染色觀察細胞接種于支架后1、3、5 d細胞生長情況,并利用掃描電鏡觀察細胞接種后6、24 h與底物立即相互作用后的細胞反應。活/死細胞染色實驗結果顯示整個培養期間,細胞生長狀況良好,較少觀察到死細胞,間接表明3D打印PLLA網狀支架幾乎沒有細胞毒性,較安全。培養1 d可見經過蝕刻后的支架表面較未處理組有更多細胞,這與粗糙表面增加了細胞黏附相關;3、5 d時蝕刻后的支架表面可見更多細胞,且細胞也逐漸鋪展,呈現多邊形或纖維狀,可見NaOH處理有利于改善PLLA支架表面生物相容性。掃描電鏡觀察結果顯示,經NaOH處理后的支架上細胞增加,細胞鋪展面積增大,支架黏附細胞伸出的突觸也更多。接種細胞24 h后黏附的“接觸誘導”效應更為明顯,呈現“拉伸”狀態。以上結果說明NaOH蝕刻促進了細胞的增殖、黏附和伸展,這一點和Voisin等[32]報道結果一致。
綜上述,本研究通過NaOH蝕刻方法構建了3D打印PLLA網狀支架表面的粗糙或孔洞狀形態,改善了支架表面親水性,顯著增加了其用于細胞附著和基質沉積的表面積與體積比,為BMSCs在支架上生長提供了條件。但是,本研究仍存在一些不足,比如未探究NaOH對PLLA兩種蝕刻途徑在親水性改善方面的作用比例;在細胞實驗中也僅篩選了一種濃度/時間參數組合,后續研究需進一步完善,以期得到更全面的研究結論。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究經西安醫學院實驗動物倫理委員會批準(XYLS2020137)
作者貢獻聲明 曾輝:實驗實施、撰寫文章;郭芳:實驗數據收集整理及分析;黃碩、劉寧、郭亞媛:參與實驗并收集數據;劉昌奎:提供實驗思路、對文章進行審閱和修改