引用本文: 蔣寧, 徐桂軍, 李浩民, 楊錦明, 王佳, 申琳, 曾憲鐵. 距骨骨軟骨損傷的外科治療進展. 中國修復重建外科雜志, 2024, 38(3): 373-379. doi: 10.7507/1002-1892.202311097 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
距骨骨軟骨損傷(osteochondral lesion of the talus,OLT)主要涉及距骨關節面及軟骨下骨,可分為原發性及非原發性(初次手術治療失敗)兩種類型。由于距骨表面沒有軟組織附著,70%原發性OLT與踝關節損傷有關,如扭傷和骨折[1]。此外,血管疾病、感染、激素紊亂和骨化障礙等因素也會導致OLT[2]。疾病早期患者通常無癥狀,容易被漏診,隨著疾病發展會逐漸出現負重活動時間歇性疼痛、僵硬、彈響以及交鎖等癥狀[3]。由于OLT往往伴隨踝關節慢性不穩定,對于前抽屜試驗陽性患者應注意是否存在OLT。此外,如患者存在踝關節背伸狀態下深壓痛以及距骨內、外翻試驗陽性,也提示存在OLT。因距骨骨軟骨血供缺乏,損傷后自愈能力有限,保守治療常無法達到預期療效,最終只能手術治療。OLT手術術式選擇主要基于Hepple分型[4]結果,然而僅依據分型不能滿足患者個性化治療需求,且目前OLT最佳手術治療方法尚無共識[5]。現查閱近年相關文獻,對目前臨床常用的OLT術式及其優勢、局限性作一綜述,為臨床治療提供參考。
1 骨髓刺激術(bone marrow stimulation,BMS)
BMS是通過手術使BMSCs浸潤于軟骨缺損部位,誘導缺損處纖維軟骨形成,包括微骨折術和鉆孔術兩種術式,是治療原發性OLT最常用術式,一般應用于直徑<15 mm、非囊性、原發性病變[5-6]。
1.1 微骨折術
微骨折術是采用微骨折器以3~4 mm間隔在軟骨下骨鉆孔,使骨髓和血液從孔中滲出,形成血凝塊填充缺損部位誘導纖維軟骨形成。研究證明微骨折術治療病變直徑<15 mm的OLT可獲得良好早期療效[6],但中、遠期療效存在爭議。Fu等[7]的一項長期隨訪研究顯示,患者術后軟骨修復組織磁共振觀察評分(MOCART)、美國矯形足踝協會(AOFAS)踝-后足評分和足踝結局評分(FAOS)均呈下降趨勢。一項系統評價報道微骨折術治療原發性OLT后,患者經平均71.9個月隨訪,AOFAS評分、疼痛視覺模擬評分(VAS)以及FAOS評分等均較術前顯著改善,然而影像學表現不滿意[8]。分析原因可能為纖維軟骨主要由Ⅰ型膠原組成,踝關節腔隙內軟骨細胞較少、再生能力較差,難以實現纖維軟骨與原生軟骨完全融合,并且纖維軟骨在結構和生物力學上均不如透明軟骨[9]。隨著時間推移,纖維軟骨發生退化,加之負重期間軟骨會承受持續壓力,軟骨下骨神經受到刺激,最終導致疼痛復發[10]。首次治療方式為微骨折術的患者,疼痛復發時往往需行翻修手術。Dahmen 等[11]發現微骨折術治療非原發性OLT的成功率低(61%)、翻修率高(27%),因此不推薦將其作為翻修術式。此外,微骨折術的一個缺點是術中可能會產生松散軟骨顆粒,如果這些顆粒沒有徹底清除,會引發交鎖癥狀和軟骨損傷。
1.2 鉆孔術
鉆孔術與微骨折術原理相似,但因鉆孔更深,形成的軟骨下血腫較大且進入孔中的BMSCs數量增加,所以理論上鉆孔術后軟骨缺損處愈合能力高于微骨折術。鉆孔術分為順行鉆孔和逆行鉆孔兩種。其中,順行鉆孔通常采用前外側入路,可能干擾跗骨竇血管和神經,導致距骨頸和距骨體血供障礙以及足部感覺障礙;并且經該入路鉆孔需經過致密皮質骨,不僅會產生熱量造成不可逆轉的骨壞死、損害骨髓,還會沿鉆孔隧道引發醫源性骨囊變且在軟骨表面留下較大鉆孔[12]。Choi等[13]提出低速+沖洗的順行鉆孔術以最大程度減少熱量,但也無法完全解決上述問題,臨床應用也顯示該技術未表現出優于微骨折術的臨床結局。為此,臨床應謹慎使用順行鉆孔術治療OLT,與之相比,更推薦使用微骨折術,因為后者不僅能避免熱量產生和鉆孔問題,操作也較簡便。
逆行鉆孔術通常采用后外側入路,經此入路僅對附近的末梢血管產生微弱影響,且鉆孔通路距離腓腸神經和隱靜脈較遠,對血管和神經損傷較小,安全性較高;又因鉆孔經過質地疏松松質骨,大多數情況下也避免了熱量產生和關節面損傷,臨床應用顯示可獲得良好中期療效[13-15]。但逆行鉆孔術中對鉆孔深度的控制具有一定難度,應至少達距骨軟骨下5~10 mm區域,因為此區域血管密度較大,能有效地刺激軟骨下骨重塑[16]。Jungesblut等[17]基于電磁導航系統提出了一種新技術,通過監視器實時觀察鉆孔位置,以確保正確角度和方向。與傳統X線透視比較,此技術不僅能縮短手術時間、降低感染率,還能減少術中輻射量。對于表面軟骨完整的軟骨下骨病變,逆行鉆孔術與順行鉆孔術相比更具有優勢。它能保持表面軟骨完整性,也不會因為熱量問題造成骨壞死。但術中需要注意控制鉆頭位置以及鉆孔深度,以期在避免損傷表面軟骨的同時達到最佳深度。
2 骨軟骨移植術
2.1 自體骨軟骨移植(autologous osteochondral transplantation,AOT)
AOT是從膝關節、髂骨或距骨非承重區域獲取自體骨軟骨塞修復OLT,優點是用透明軟骨和軟骨下骨塞替代病變距骨。與微骨折術相比,AOT適用于較大面積軟骨表面損傷及存在較大軟骨下骨囊變的OLT。 Shim等[18]的研究結果顯示AOT在VAS評分及AOFAS評分方面均優于微骨折術。自體移植物不僅具有長期存活的潛力,還能恢復天然關節環境。目前臨床研究報道AOT治療可獲得較好的早、中、遠期療效[19],但也有手術失敗(1%)以及術后軟骨下骨囊變(平均發生率達50%)的發生[20],分析原因可能是移植物結合不良引起。雖然軟骨下骨囊變造成的臨床影響在術后早期并不顯著,但可能是導致移植失敗或遠期預后不良的危險因素之一,需要進一步研究明確。
AOT存在術后供區并發癥風險,進而影響臨床療效。有研究發現供區切取骨軟骨塞超過3個或單個骨軟骨塞直徑較大時,會破壞供區表面軟骨一致性,進而影響軟骨下骨血供,導致供區疼痛、僵硬及積液發生風險增加[21-22]。然而,也有研究發現供區并發癥發生率會隨著時間推移而降低。Winkler等[23]對35例AOT患者進行長達20年隨訪,末次隨訪時患者均無供區疼痛或不適。因此,他們認為對于供區的早期疼痛可不采取治療措施。
2.2 同種異體骨軟骨移植(osteochondral allograft transplantation,OAT)
OAT可用于治療病變較大的OLT,優點是通過單次手術即可治療軟骨表面及軟骨下骨缺損大的病變,而且避免了供區并發癥問題。手術需要注意移植物尺寸與受區必須匹配,不僅要求關節表面吻合,還要求移植骨塊與軟骨下骨獲得更大骨接觸面積。回顧OAT治療OLT文獻,大多數研究報道獲得滿意臨床療效。Gaul等[24]的中期隨訪結果示,OAT移植物5年生存率為88.7%,10年生存率為81.3%;Chu等[25]的平均4年隨訪結果示,患者疼痛評分和功能評分均顯著改善。
與AOT相比,OAT移植物在影像學方面表現出較高的軟骨磨損率和囊變率,臨床失敗率和翻修率也相對較高[26]。分析原因可能為:① 雖然同種異體移植物已有專用培養基處理,能保持大部分軟骨細胞活力,但即使小部分軟骨細胞損失也可能產生不良結果;② 同種異體移植物血供相對缺乏。然而OAT也具有一定優勢,更適合供區存在創傷、骨關節炎和骨質疏松患者。
此外,AOT或OAT術中部分患者需截骨暴露病變部位[18]。盡管目前尚無內、外踝截骨患者術后截骨部位并發癥報道[27-28],但截骨處畸形愈合率高達30%[29]。為了降低截骨部位畸形愈合率,Zhang等[30]提出內踝三平面截骨聯合AOT,臨床應用結果顯示該截骨方式截骨時間縮短、創傷減少且便于解剖復位和加強內固定,早期臨床結果和影像學表現均滿意。目前大多數文獻僅報道了截骨部位畸形愈合率,缺乏對其發生機制的深入探究。我們分析截骨部位畸形愈合可能與截骨平面是否解剖復位以及內固定穩定性有關,與截骨大小無關。因此,在行內、外踝截骨輔助手術時,應注意確保截骨部位準確解剖復位并實現內固定穩定。
3 同種異體幼年軟骨微粒移植(particulated juvenile cartilage allograft transplantation,PJCAT)
PJCAT是采用幼年軟骨組成的顆粒軟骨塊填充缺損部位,可在透明軟骨中輸送有活力的軟骨細胞。與成年軟骨相比,幼年軟骨能產生更多細胞外基質蛋白,合成與天然軟骨相同的Ⅱ型膠原[31]。一項基礎研究分別將兩種軟骨移植至小豬體內,3個月后免疫組織化學染色檢查發現,幼年軟骨在修復透明軟骨中的Ki-67蛋白和Lin28蛋白表達水平優于成年軟骨,表明幼年軟骨修復透明軟骨的能力更優[32]。此外,臨床應用研究顯示PJCAT具有良好早期療效[33]。然而,Aldawsari等[34]的一項薈萃分析顯示,PJCAT治療后影像學檢查見患者軟骨下骨和板層骨仍未修復,提示盡管患者功能評分改善,但在細胞水平上尚未完全恢復為正常關節透明軟骨。因此,相關研究報道遠期各項評分均出現下降趨勢[35]。與OAT、AOT相比,PJCAT的優勢主要表現在操作簡便,還可行關節鏡或微創手術,避免額外截骨,無供區并發癥問題[31]。
4 細胞移植術
細胞移植術包括自體軟骨細胞移植、基質誘導的自體軟骨細胞移植(matrix-induced autologous chondrocyte implantation,MACI)、骨膜自體軟骨細胞移植(periosteal autologous chondrocyte implantation,PACI),上述術式治療OLT的效果已獲得大量研究證明。細胞移植術需分兩步進行:第1步,采集非負重區域200~300 mg健康軟骨組織,在體外培養獲得軟骨細胞;第2步,在軟骨缺損處按照100萬個/cm2密度植入軟骨細胞。Hu等[36]的一項薈萃分析納入6項PACI研究和17項MACI研究,總體成功率達89%。López-Alcorocho等[37]使用了一項新技術——高密度MACI,在病變區域按照500萬個/cm2密度植入軟骨細胞,2年隨訪時所有患者VAS評分、AOFAS評分和踝關節活動度均較術前顯著改善。上述研究結果提示無論是低密度還是高密度植入軟骨細胞,均能改善OLT患者癥狀。
細胞移植術的原理為通過移植與自體組織細胞相似的軟骨細胞,使修復后的組織結構和生物力學特性更接近于天然關節組織,是一種可靠且安全的治療OLT選擇,在治療大面積損傷時也獲得了滿意遠期療效[38]。但該技術需兩次手術,增加了治療費用,并且對術者技術水平要求較高,因此不推薦作為OLT初次治療首選方案,可作為初次治療失敗后補救措施。
5 自體基質誘導軟骨形成(autologous matrix-induced chondrogenesis,AMIC)技術
AMIC技術是在微骨折術基礎上使用Ⅰ/Ⅲ型膠原膜覆蓋病變部位,以產生富含干細胞的血凝塊[39]。一項薈萃分析納入21項研究,結果顯示AMIC技術可以有效緩解疼痛并增強踝關節功能[40]。AMIC技術治療原發性OLT有良好臨床療效,作為首次治療失敗后的補救措施治療非原發性OLT也能取得令人滿意的結果。但對于單純微骨折術,是否需要添加Ⅰ/Ⅲ型膠原膜仍然存在爭議。Becher等[41]比較了關節鏡下單純微骨折術與關節鏡下AMIC技術治療OLT的療效, 術后5年隨訪顯示兩者在功能、疼痛和患者滿意度方面并無差異。但也有研究顯示AMIC技術中期療效優于單純微骨折術[42],以及在治療大面積OLT時也顯示出優于單純微骨折術的臨床療效[43-45]。分析上述研究中兩種技術療效出現顯著差異的原因,可能是微骨折術形成的纖維蛋白凝塊脆弱、不具有機械穩定性,而植入的外源性支架(Ⅰ/Ⅲ型膠原膜)不僅能增加機械穩定性,還能刺激軟骨分化。但目前有關AMIC技術與單純微骨折術療效的研究較少且大多質量不高,缺少遠期療效隨訪,因此上述結論有待高質量研究進一步驗證。
6 生物制劑
生物制劑作為一種新型治療手段已廣泛用于骨軟骨病治療,臨床常用類型包括富血小板血漿(platelet-rich plasma,PRP)、骨髓抽吸濃縮物(bone marrow aspirate concentrate,BMAC)等。PRP是一種含有濃縮血小板的生物活性成分,對局部炎癥反應、干細胞募集和增殖、細胞黏附和血管生成具有促進作用,以實現骨和軟組織的愈合[46]。關于PRP的臨床研究表明,無論單獨應用或聯合其他治療方法均對OLT安全、有效[47],尚無與PRP干預相關的不良事件報道[48]。但目前研究以早期療效為主,缺少遠期療效的報道。此外,PRP制備方法、濃度和使用劑量等因素均會對結果產生影響,但也沒有統一標準[49]。因此,未來需要進一步研究解決上述問題。
與PRP相似,BMAC含有血小板,因此也含有生長因子,但濃度較低。使用BMAC治療OLT的主要目的是將BMSCs引入該部位。BMSCs不僅具有分化成軟骨細胞和成骨祖細胞的能力,還具有重要的旁分泌作用,可以改變病變部位微環境,更有利于軟骨愈合、修復和再生。雖然與PRP相比,BMAC臨床應用相對較晚,但在動物實驗和臨床研究中均表現出良好效果[50-51],尤其是在治療軟骨病變方面。綜合目前研究報道,無論是PRP還是BMAC,均可作為OLT輔助治療方法,但兩者療效以及最佳使用劑量、濃度等有待高質量研究進一步明確。
7 總結
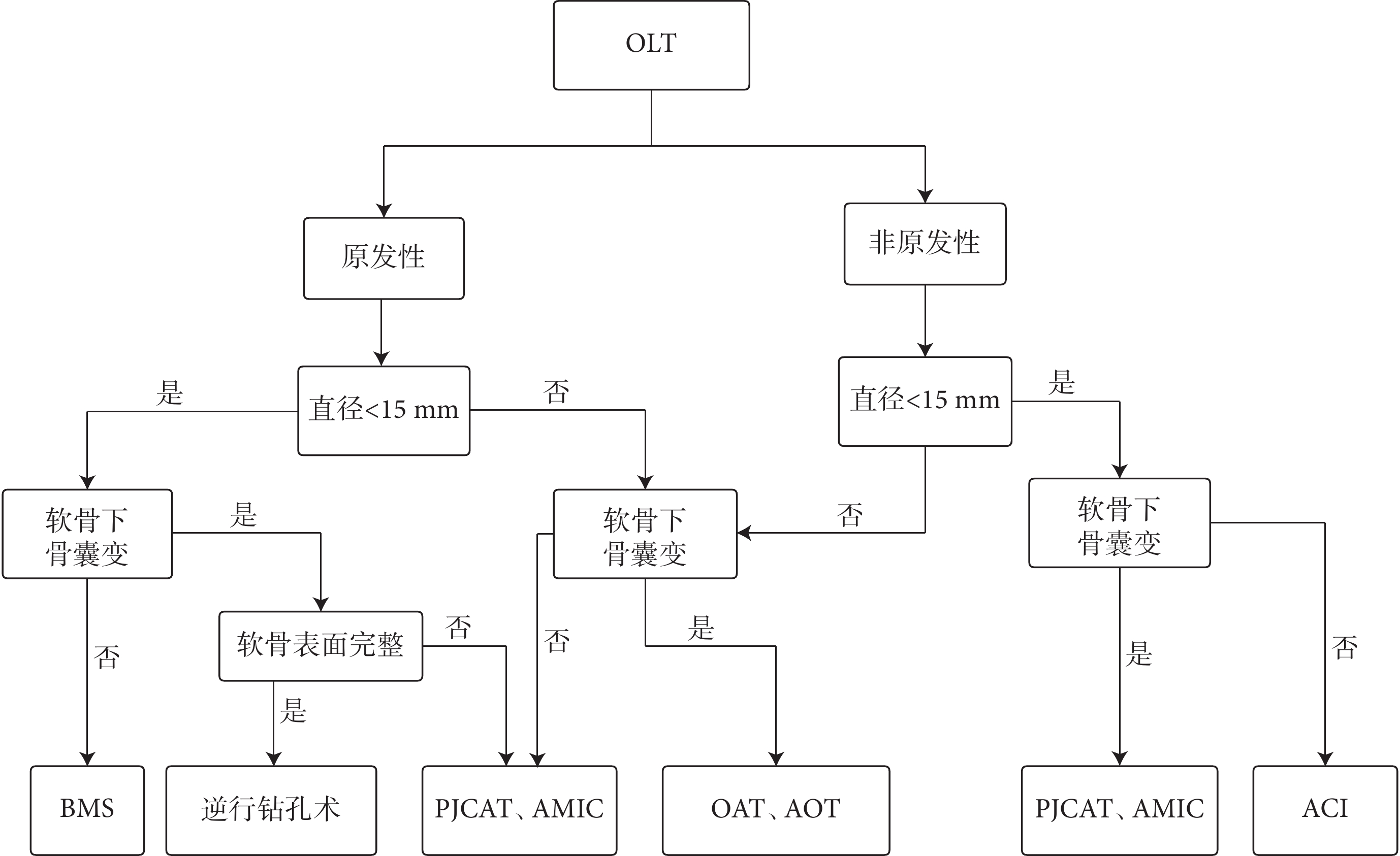
目前臨床用于OLT的手術方式較多,均能獲得良好療效,但也各有利弊。BMS操作簡便,治療直徑<15 mm的OLT能在短期內改善癥狀,但BMS術后形成的纖維軟骨機械彈性較差,隨著時間推移會出現退化。對于缺損面積較大并伴有軟骨下骨囊變的OLT或經BMS治療失敗的患者,可以考慮AOT、OAT,兩者臨床療效相似。然而,除AOT存在供區并發癥問題外,AOT、OAT骨軟骨移植時,如骨與骨之間不完全解剖匹配,會形成新的軟骨下骨囊變,而這些囊變是導致移植失敗與長期預后不良的潛在因素。與AOT、OAT不同,PJCAT無需進行額外截骨術,而且幼年軟骨能向軟骨缺損部位輸送有活力的軟骨細胞,修復透明軟骨的能力優于成年軟骨。細胞移植術療效滿意,但考慮到需兩次手術、價格昂貴等問題,不推薦作為首選治療方式。AMIC技術治療非原發性OLT和伴有軟骨下骨囊變的OLT均表現出滿意效果,但尚無充足證據證明其優于單純微骨折術。生物制劑輔助治療是治療OLT的新方式,但由于沒有高質量研究支持,對比傳統治療手段也無明顯優勢,遠期療效也未明確,因此應慎重選擇。對于OLT的治療,外科治療方式的選擇不僅取決于OLT性質、大小、形態,還應考慮醫療技術水平以及患者接受程度、經濟狀況等因素,以提供個性化治療(圖1)。
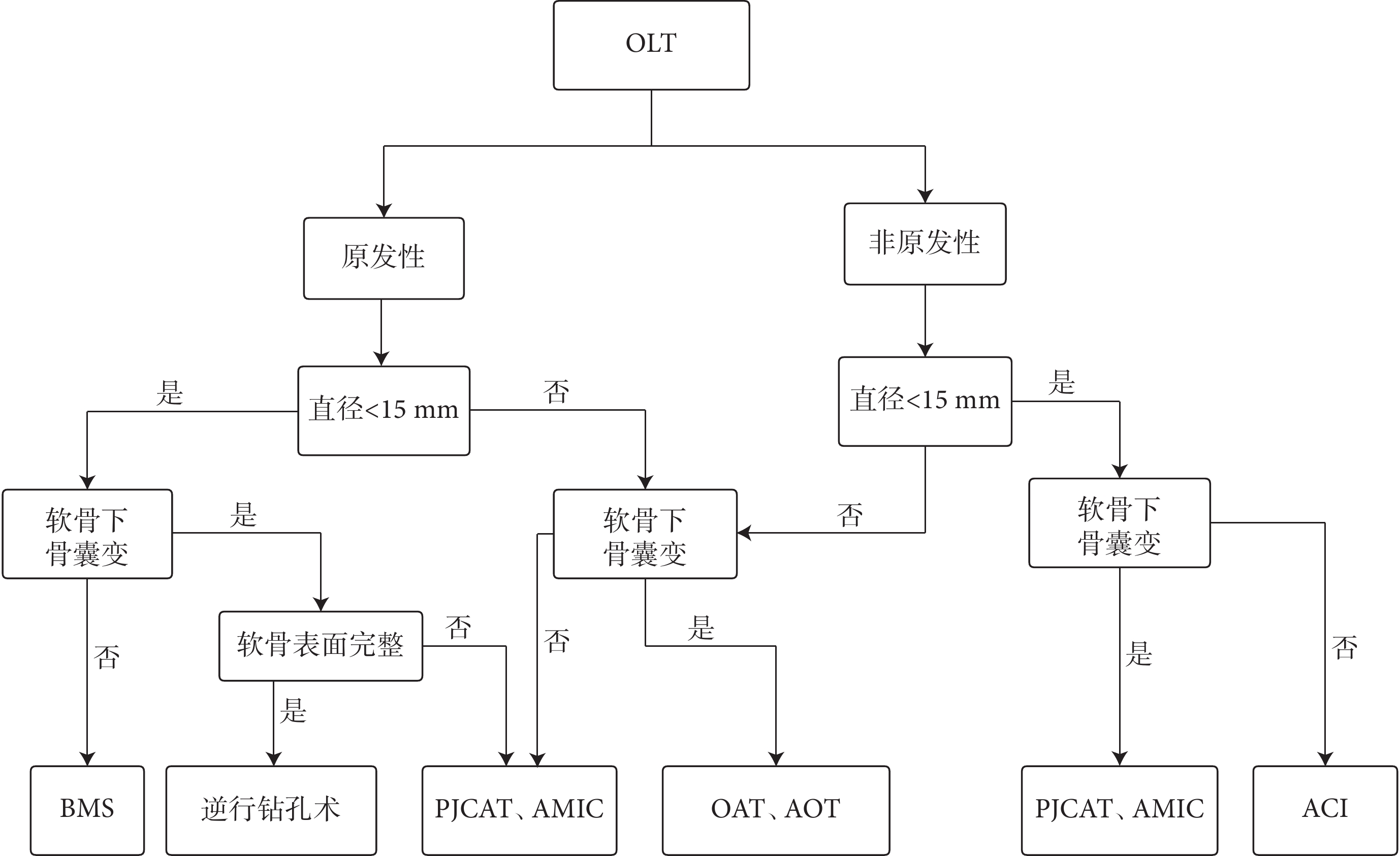 圖1
OLT手術方式選擇流程圖
Figure1.
Flowchart for selecting OLT surgical treatment
圖1
OLT手術方式選擇流程圖
Figure1.
Flowchart for selecting OLT surgical treatment
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
作者貢獻聲明 蔣寧:綜述構思及設計、文章撰寫、資料收集;楊錦明:輔助文獻收集;徐桂軍、李浩民:對文章修改提出意見及資料收集;王佳、申琳、曾憲鐵:審閱文章并對學術內容進行指導修改
距骨骨軟骨損傷(osteochondral lesion of the talus,OLT)主要涉及距骨關節面及軟骨下骨,可分為原發性及非原發性(初次手術治療失敗)兩種類型。由于距骨表面沒有軟組織附著,70%原發性OLT與踝關節損傷有關,如扭傷和骨折[1]。此外,血管疾病、感染、激素紊亂和骨化障礙等因素也會導致OLT[2]。疾病早期患者通常無癥狀,容易被漏診,隨著疾病發展會逐漸出現負重活動時間歇性疼痛、僵硬、彈響以及交鎖等癥狀[3]。由于OLT往往伴隨踝關節慢性不穩定,對于前抽屜試驗陽性患者應注意是否存在OLT。此外,如患者存在踝關節背伸狀態下深壓痛以及距骨內、外翻試驗陽性,也提示存在OLT。因距骨骨軟骨血供缺乏,損傷后自愈能力有限,保守治療常無法達到預期療效,最終只能手術治療。OLT手術術式選擇主要基于Hepple分型[4]結果,然而僅依據分型不能滿足患者個性化治療需求,且目前OLT最佳手術治療方法尚無共識[5]。現查閱近年相關文獻,對目前臨床常用的OLT術式及其優勢、局限性作一綜述,為臨床治療提供參考。
1 骨髓刺激術(bone marrow stimulation,BMS)
BMS是通過手術使BMSCs浸潤于軟骨缺損部位,誘導缺損處纖維軟骨形成,包括微骨折術和鉆孔術兩種術式,是治療原發性OLT最常用術式,一般應用于直徑<15 mm、非囊性、原發性病變[5-6]。
1.1 微骨折術
微骨折術是采用微骨折器以3~4 mm間隔在軟骨下骨鉆孔,使骨髓和血液從孔中滲出,形成血凝塊填充缺損部位誘導纖維軟骨形成。研究證明微骨折術治療病變直徑<15 mm的OLT可獲得良好早期療效[6],但中、遠期療效存在爭議。Fu等[7]的一項長期隨訪研究顯示,患者術后軟骨修復組織磁共振觀察評分(MOCART)、美國矯形足踝協會(AOFAS)踝-后足評分和足踝結局評分(FAOS)均呈下降趨勢。一項系統評價報道微骨折術治療原發性OLT后,患者經平均71.9個月隨訪,AOFAS評分、疼痛視覺模擬評分(VAS)以及FAOS評分等均較術前顯著改善,然而影像學表現不滿意[8]。分析原因可能為纖維軟骨主要由Ⅰ型膠原組成,踝關節腔隙內軟骨細胞較少、再生能力較差,難以實現纖維軟骨與原生軟骨完全融合,并且纖維軟骨在結構和生物力學上均不如透明軟骨[9]。隨著時間推移,纖維軟骨發生退化,加之負重期間軟骨會承受持續壓力,軟骨下骨神經受到刺激,最終導致疼痛復發[10]。首次治療方式為微骨折術的患者,疼痛復發時往往需行翻修手術。Dahmen 等[11]發現微骨折術治療非原發性OLT的成功率低(61%)、翻修率高(27%),因此不推薦將其作為翻修術式。此外,微骨折術的一個缺點是術中可能會產生松散軟骨顆粒,如果這些顆粒沒有徹底清除,會引發交鎖癥狀和軟骨損傷。
1.2 鉆孔術
鉆孔術與微骨折術原理相似,但因鉆孔更深,形成的軟骨下血腫較大且進入孔中的BMSCs數量增加,所以理論上鉆孔術后軟骨缺損處愈合能力高于微骨折術。鉆孔術分為順行鉆孔和逆行鉆孔兩種。其中,順行鉆孔通常采用前外側入路,可能干擾跗骨竇血管和神經,導致距骨頸和距骨體血供障礙以及足部感覺障礙;并且經該入路鉆孔需經過致密皮質骨,不僅會產生熱量造成不可逆轉的骨壞死、損害骨髓,還會沿鉆孔隧道引發醫源性骨囊變且在軟骨表面留下較大鉆孔[12]。Choi等[13]提出低速+沖洗的順行鉆孔術以最大程度減少熱量,但也無法完全解決上述問題,臨床應用也顯示該技術未表現出優于微骨折術的臨床結局。為此,臨床應謹慎使用順行鉆孔術治療OLT,與之相比,更推薦使用微骨折術,因為后者不僅能避免熱量產生和鉆孔問題,操作也較簡便。
逆行鉆孔術通常采用后外側入路,經此入路僅對附近的末梢血管產生微弱影響,且鉆孔通路距離腓腸神經和隱靜脈較遠,對血管和神經損傷較小,安全性較高;又因鉆孔經過質地疏松松質骨,大多數情況下也避免了熱量產生和關節面損傷,臨床應用顯示可獲得良好中期療效[13-15]。但逆行鉆孔術中對鉆孔深度的控制具有一定難度,應至少達距骨軟骨下5~10 mm區域,因為此區域血管密度較大,能有效地刺激軟骨下骨重塑[16]。Jungesblut等[17]基于電磁導航系統提出了一種新技術,通過監視器實時觀察鉆孔位置,以確保正確角度和方向。與傳統X線透視比較,此技術不僅能縮短手術時間、降低感染率,還能減少術中輻射量。對于表面軟骨完整的軟骨下骨病變,逆行鉆孔術與順行鉆孔術相比更具有優勢。它能保持表面軟骨完整性,也不會因為熱量問題造成骨壞死。但術中需要注意控制鉆頭位置以及鉆孔深度,以期在避免損傷表面軟骨的同時達到最佳深度。
2 骨軟骨移植術
2.1 自體骨軟骨移植(autologous osteochondral transplantation,AOT)
AOT是從膝關節、髂骨或距骨非承重區域獲取自體骨軟骨塞修復OLT,優點是用透明軟骨和軟骨下骨塞替代病變距骨。與微骨折術相比,AOT適用于較大面積軟骨表面損傷及存在較大軟骨下骨囊變的OLT。 Shim等[18]的研究結果顯示AOT在VAS評分及AOFAS評分方面均優于微骨折術。自體移植物不僅具有長期存活的潛力,還能恢復天然關節環境。目前臨床研究報道AOT治療可獲得較好的早、中、遠期療效[19],但也有手術失敗(1%)以及術后軟骨下骨囊變(平均發生率達50%)的發生[20],分析原因可能是移植物結合不良引起。雖然軟骨下骨囊變造成的臨床影響在術后早期并不顯著,但可能是導致移植失敗或遠期預后不良的危險因素之一,需要進一步研究明確。
AOT存在術后供區并發癥風險,進而影響臨床療效。有研究發現供區切取骨軟骨塞超過3個或單個骨軟骨塞直徑較大時,會破壞供區表面軟骨一致性,進而影響軟骨下骨血供,導致供區疼痛、僵硬及積液發生風險增加[21-22]。然而,也有研究發現供區并發癥發生率會隨著時間推移而降低。Winkler等[23]對35例AOT患者進行長達20年隨訪,末次隨訪時患者均無供區疼痛或不適。因此,他們認為對于供區的早期疼痛可不采取治療措施。
2.2 同種異體骨軟骨移植(osteochondral allograft transplantation,OAT)
OAT可用于治療病變較大的OLT,優點是通過單次手術即可治療軟骨表面及軟骨下骨缺損大的病變,而且避免了供區并發癥問題。手術需要注意移植物尺寸與受區必須匹配,不僅要求關節表面吻合,還要求移植骨塊與軟骨下骨獲得更大骨接觸面積。回顧OAT治療OLT文獻,大多數研究報道獲得滿意臨床療效。Gaul等[24]的中期隨訪結果示,OAT移植物5年生存率為88.7%,10年生存率為81.3%;Chu等[25]的平均4年隨訪結果示,患者疼痛評分和功能評分均顯著改善。
與AOT相比,OAT移植物在影像學方面表現出較高的軟骨磨損率和囊變率,臨床失敗率和翻修率也相對較高[26]。分析原因可能為:① 雖然同種異體移植物已有專用培養基處理,能保持大部分軟骨細胞活力,但即使小部分軟骨細胞損失也可能產生不良結果;② 同種異體移植物血供相對缺乏。然而OAT也具有一定優勢,更適合供區存在創傷、骨關節炎和骨質疏松患者。
此外,AOT或OAT術中部分患者需截骨暴露病變部位[18]。盡管目前尚無內、外踝截骨患者術后截骨部位并發癥報道[27-28],但截骨處畸形愈合率高達30%[29]。為了降低截骨部位畸形愈合率,Zhang等[30]提出內踝三平面截骨聯合AOT,臨床應用結果顯示該截骨方式截骨時間縮短、創傷減少且便于解剖復位和加強內固定,早期臨床結果和影像學表現均滿意。目前大多數文獻僅報道了截骨部位畸形愈合率,缺乏對其發生機制的深入探究。我們分析截骨部位畸形愈合可能與截骨平面是否解剖復位以及內固定穩定性有關,與截骨大小無關。因此,在行內、外踝截骨輔助手術時,應注意確保截骨部位準確解剖復位并實現內固定穩定。
3 同種異體幼年軟骨微粒移植(particulated juvenile cartilage allograft transplantation,PJCAT)
PJCAT是采用幼年軟骨組成的顆粒軟骨塊填充缺損部位,可在透明軟骨中輸送有活力的軟骨細胞。與成年軟骨相比,幼年軟骨能產生更多細胞外基質蛋白,合成與天然軟骨相同的Ⅱ型膠原[31]。一項基礎研究分別將兩種軟骨移植至小豬體內,3個月后免疫組織化學染色檢查發現,幼年軟骨在修復透明軟骨中的Ki-67蛋白和Lin28蛋白表達水平優于成年軟骨,表明幼年軟骨修復透明軟骨的能力更優[32]。此外,臨床應用研究顯示PJCAT具有良好早期療效[33]。然而,Aldawsari等[34]的一項薈萃分析顯示,PJCAT治療后影像學檢查見患者軟骨下骨和板層骨仍未修復,提示盡管患者功能評分改善,但在細胞水平上尚未完全恢復為正常關節透明軟骨。因此,相關研究報道遠期各項評分均出現下降趨勢[35]。與OAT、AOT相比,PJCAT的優勢主要表現在操作簡便,還可行關節鏡或微創手術,避免額外截骨,無供區并發癥問題[31]。
4 細胞移植術
細胞移植術包括自體軟骨細胞移植、基質誘導的自體軟骨細胞移植(matrix-induced autologous chondrocyte implantation,MACI)、骨膜自體軟骨細胞移植(periosteal autologous chondrocyte implantation,PACI),上述術式治療OLT的效果已獲得大量研究證明。細胞移植術需分兩步進行:第1步,采集非負重區域200~300 mg健康軟骨組織,在體外培養獲得軟骨細胞;第2步,在軟骨缺損處按照100萬個/cm2密度植入軟骨細胞。Hu等[36]的一項薈萃分析納入6項PACI研究和17項MACI研究,總體成功率達89%。López-Alcorocho等[37]使用了一項新技術——高密度MACI,在病變區域按照500萬個/cm2密度植入軟骨細胞,2年隨訪時所有患者VAS評分、AOFAS評分和踝關節活動度均較術前顯著改善。上述研究結果提示無論是低密度還是高密度植入軟骨細胞,均能改善OLT患者癥狀。
細胞移植術的原理為通過移植與自體組織細胞相似的軟骨細胞,使修復后的組織結構和生物力學特性更接近于天然關節組織,是一種可靠且安全的治療OLT選擇,在治療大面積損傷時也獲得了滿意遠期療效[38]。但該技術需兩次手術,增加了治療費用,并且對術者技術水平要求較高,因此不推薦作為OLT初次治療首選方案,可作為初次治療失敗后補救措施。
5 自體基質誘導軟骨形成(autologous matrix-induced chondrogenesis,AMIC)技術
AMIC技術是在微骨折術基礎上使用Ⅰ/Ⅲ型膠原膜覆蓋病變部位,以產生富含干細胞的血凝塊[39]。一項薈萃分析納入21項研究,結果顯示AMIC技術可以有效緩解疼痛并增強踝關節功能[40]。AMIC技術治療原發性OLT有良好臨床療效,作為首次治療失敗后的補救措施治療非原發性OLT也能取得令人滿意的結果。但對于單純微骨折術,是否需要添加Ⅰ/Ⅲ型膠原膜仍然存在爭議。Becher等[41]比較了關節鏡下單純微骨折術與關節鏡下AMIC技術治療OLT的療效, 術后5年隨訪顯示兩者在功能、疼痛和患者滿意度方面并無差異。但也有研究顯示AMIC技術中期療效優于單純微骨折術[42],以及在治療大面積OLT時也顯示出優于單純微骨折術的臨床療效[43-45]。分析上述研究中兩種技術療效出現顯著差異的原因,可能是微骨折術形成的纖維蛋白凝塊脆弱、不具有機械穩定性,而植入的外源性支架(Ⅰ/Ⅲ型膠原膜)不僅能增加機械穩定性,還能刺激軟骨分化。但目前有關AMIC技術與單純微骨折術療效的研究較少且大多質量不高,缺少遠期療效隨訪,因此上述結論有待高質量研究進一步驗證。
6 生物制劑
生物制劑作為一種新型治療手段已廣泛用于骨軟骨病治療,臨床常用類型包括富血小板血漿(platelet-rich plasma,PRP)、骨髓抽吸濃縮物(bone marrow aspirate concentrate,BMAC)等。PRP是一種含有濃縮血小板的生物活性成分,對局部炎癥反應、干細胞募集和增殖、細胞黏附和血管生成具有促進作用,以實現骨和軟組織的愈合[46]。關于PRP的臨床研究表明,無論單獨應用或聯合其他治療方法均對OLT安全、有效[47],尚無與PRP干預相關的不良事件報道[48]。但目前研究以早期療效為主,缺少遠期療效的報道。此外,PRP制備方法、濃度和使用劑量等因素均會對結果產生影響,但也沒有統一標準[49]。因此,未來需要進一步研究解決上述問題。
與PRP相似,BMAC含有血小板,因此也含有生長因子,但濃度較低。使用BMAC治療OLT的主要目的是將BMSCs引入該部位。BMSCs不僅具有分化成軟骨細胞和成骨祖細胞的能力,還具有重要的旁分泌作用,可以改變病變部位微環境,更有利于軟骨愈合、修復和再生。雖然與PRP相比,BMAC臨床應用相對較晚,但在動物實驗和臨床研究中均表現出良好效果[50-51],尤其是在治療軟骨病變方面。綜合目前研究報道,無論是PRP還是BMAC,均可作為OLT輔助治療方法,但兩者療效以及最佳使用劑量、濃度等有待高質量研究進一步明確。
7 總結
目前臨床用于OLT的手術方式較多,均能獲得良好療效,但也各有利弊。BMS操作簡便,治療直徑<15 mm的OLT能在短期內改善癥狀,但BMS術后形成的纖維軟骨機械彈性較差,隨著時間推移會出現退化。對于缺損面積較大并伴有軟骨下骨囊變的OLT或經BMS治療失敗的患者,可以考慮AOT、OAT,兩者臨床療效相似。然而,除AOT存在供區并發癥問題外,AOT、OAT骨軟骨移植時,如骨與骨之間不完全解剖匹配,會形成新的軟骨下骨囊變,而這些囊變是導致移植失敗與長期預后不良的潛在因素。與AOT、OAT不同,PJCAT無需進行額外截骨術,而且幼年軟骨能向軟骨缺損部位輸送有活力的軟骨細胞,修復透明軟骨的能力優于成年軟骨。細胞移植術療效滿意,但考慮到需兩次手術、價格昂貴等問題,不推薦作為首選治療方式。AMIC技術治療非原發性OLT和伴有軟骨下骨囊變的OLT均表現出滿意效果,但尚無充足證據證明其優于單純微骨折術。生物制劑輔助治療是治療OLT的新方式,但由于沒有高質量研究支持,對比傳統治療手段也無明顯優勢,遠期療效也未明確,因此應慎重選擇。對于OLT的治療,外科治療方式的選擇不僅取決于OLT性質、大小、形態,還應考慮醫療技術水平以及患者接受程度、經濟狀況等因素,以提供個性化治療(圖1)。
 圖1
OLT手術方式選擇流程圖
Figure1.
Flowchart for selecting OLT surgical treatment
圖1
OLT手術方式選擇流程圖
Figure1.
Flowchart for selecting OLT surgical treatment
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
作者貢獻聲明 蔣寧:綜述構思及設計、文章撰寫、資料收集;楊錦明:輔助文獻收集;徐桂軍、李浩民:對文章修改提出意見及資料收集;王佳、申琳、曾憲鐵:審閱文章并對學術內容進行指導修改