引用本文: 殷渠東, 毛棟, 芮永軍. Masquelet技術誘導膜自發成骨原因實驗研究. 中國修復重建外科雜志, 2024, 38(10): 1254-1260. doi: 10.7507/1002-1892.202403021 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
Masquelet技術,又稱誘導膜技術,是臨床常用的一種骨缺損修復方法。但是,目前對于該技術促進骨愈合的作用機制尚未完全明確,主要有以下3種理論:① 誘導膜具有保護性物理屏障,防止自體骨吸收作用;② 誘導膜含豐富的細胞(包括MSCs)以及與骨形成相關的營養因子;③ 誘導膜含豐富血管網,可侵入骨缺損區,從而避免骨吸收和壞死[1-6]。后兩種理論提示誘導膜具有成骨活性,而且相關研究發現聚甲基丙烯酸甲酯骨水泥間隔填塞動物股骨缺損后,在靠近骨端的誘導膜膜內形成了少量唇狀新骨[7-9]。本課題組前期動物實驗中也觀察到誘導膜內新骨形成現象,在臨床采用Masquelet技術治療的患者中亦發現一期骨水泥植入手術后出現不同程度成骨,甚至修復部分骨缺損現象[10]。我們將未植骨但在誘導膜膜內形成新骨的現象稱為“誘導膜自發成骨”,利用該現象有可能在不植骨或少量植骨條件下通過Masquelet技術修復骨缺損。然而,目前缺少誘導膜自發成骨原因的研究,為此我們基于大鼠模型進行探討,以期為該技術應用奠定實驗基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
7~9周齡SPF級雄性SD大鼠42只,體質量225~280 g,平均253 g,由蘇州佰盛生物技術有限公司提供。術前大鼠適應性飼養1周,溫度20~23℃,晝夜光照循環時間1∶1,濕度60%~80%。
萬古霉素(浙江醫藥股份有限公司新昌制藥廠);醫用級聚甲基丙烯酸甲酯(商品名:CMW 3;DePuy公司,英國);小鼠抗大鼠STRO-1單克隆抗體 [賽默飛世爾科技(中國)有限公司];辣根過氧化物酶標記羊抗鼠二抗(武漢塞維爾生物科技有限公司)。
硅膠模具(上海黑焰醫療科技有限公司);6孔小鋼板(商品名:寵物ALPS純鈦合金鎖定重建骨板;廣州市華創醫療器械有限公司);光學顯微鏡(Nikon公司,日本);Image J軟件(美國國立衛生院);游標卡尺(安徽碭山縣通和量具有限公司)。
1.2 實驗方法
1.2.1 骨水泥間隔制備
將萬古霉素與醫用級聚甲基丙烯酸甲酯固體粉劑以1∶20比例混勻,然后與液劑混合,待呈“膠狀”后倒入硅膠模具中成型。根據預實驗結果成年大鼠股骨中段直徑平均4 mm,本研究制備長度10 mm、直徑4 mm的空心圓柱狀骨水泥間隔,環氧乙烷滅菌備用。
1.2.2 動物模型制備及分組
取42只大鼠制備右后肢股骨中段臨界骨缺損模型[11-12]。腹腔注射5%戊巴比妥(40 mg/kg)麻醉后,右后肢剃毛備皮,從股骨大轉子至股骨外髁縱向切開皮膚、筋膜,切口長度約2.5 cm;在肌間隙分離顯露股骨,在骨膜外將股骨中段與周圍肌肉分離后牽開。使用搖擺鋸在股骨中段截骨,截骨長度10 mm,移除中間骨干和骨膜。
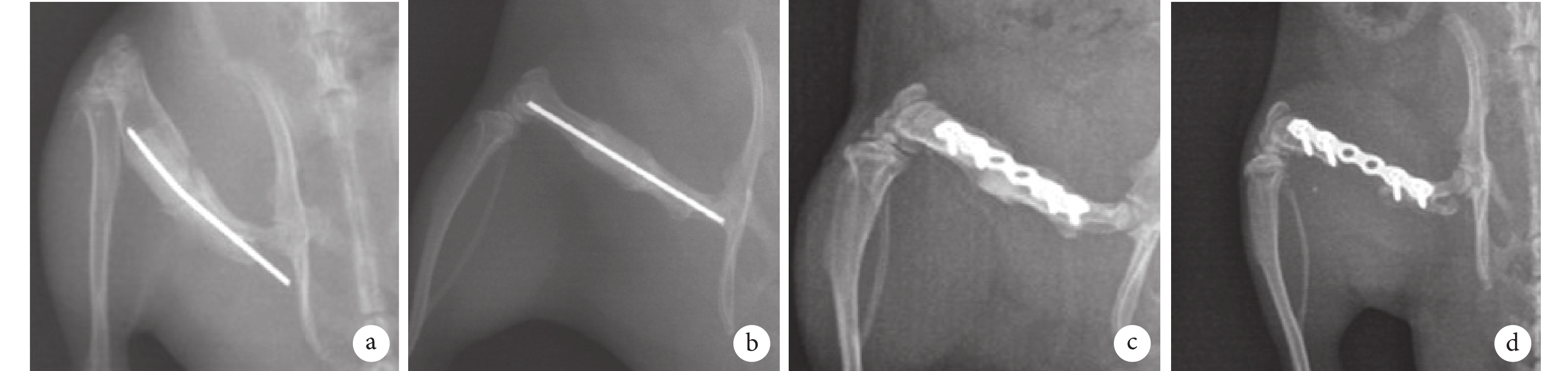
將大鼠股骨缺損模型隨機分為4組,其中A~C組各12只、D組6 只。A、B組:將骨水泥間隔以直徑1.4 mm克氏針貫穿固定于兩截骨端髓腔內,其中A組截骨端不作處理,B組用負載萬古霉素的骨水泥包裹骨水泥間隔與截骨端連接處、封閉截骨端髓腔;C組:將骨水泥間隔用縫線捆綁于6孔小鋼板上,然后鋼板固定兩截骨端;D組:骨缺損曠置,僅以6孔小鋼板固定兩截骨端。沖洗切口,可吸收縫線逐層縫合肌肉、淺筋膜和皮膚。見圖1。術后3 d內每天肌肉注射青霉素鈉4×104 U以防止感染,單籠飼養至切口愈合后混籠飼養。
 圖1
各組模型制備
圖1
各組模型制備
a. 股骨截骨;b~e. A~D組骨缺損處理;f~i. A~D組骨缺損處理后X線片
Figure1. Preparation of models in each groupa. Femoral osteotomy; b-e. Bone defect treatment in groups A-D, respectively; f-i. X-ray films after bone defect treatment in groups A-D, respectively
1.3 觀測指標
1.3.1 一般情況
術后觀察各組大鼠存活及術后肢體活動恢復情況。
1.3.2 誘導膜MSCs含量觀測
采用STRO-1免疫組織化學染色評估誘導膜中MSCs含量。術后5周,A~C組各取6只大鼠腹腔注射3%戊巴比妥(120 mg/kg)處死后,按照原切口入路取誘導膜。為避免切取時損傷截骨端骨膜,均統一取誘導膜中段6 mm長組織進行觀測。
將誘導膜置于10%甲醛中固定24 h后取出,制備5 μm厚切片。按照常規操作處理后,滴加STRO-1抗體(1∶200),4℃避光過夜孵育;滴加辣根過氧化物酶標記羊抗鼠二抗(1∶1 000),37℃孵育1 h;滴加DAB染色液,室溫孵育10 min;蘇木素染色液室溫孵育30 s;脫水、透明、封片后光鏡下觀察,黃褐色染色細胞即為STRO-1陽性細胞。于400倍鏡下每張切片選擇3個視野,采用Image J軟件行吸光度(A)值分析,記錄陽性細胞所占百分比,作為MSCs含量,取均值。
1.3.3 誘導膜自發成骨觀測
術后12周,取各組剩余大鼠同上法處死后進行以下觀測。 ① X線片觀察:攝正位X線片觀察有無新骨形成,利用自帶直尺測量新骨長度。② 大體觀察:按照原切口入路顯露股骨,取出內固定物和骨水泥間隔,觀察誘導膜和成骨情況,并用游標卡尺測量誘導膜厚度。 ③ 組織學觀察:取骨缺損段組織,其中未骨化組織經石蠟包埋、切片(厚3 μm)后常規HE染色;骨化組織按順序置于4%多聚甲醛固定48 h、脫鈣液浸泡1個月后,石蠟包埋、切片(厚度4 μm)后行番紅O-固綠染色。光鏡下觀察組織構成。
1.4 統計學方法
采用SPSS26.0統計軟件進行分析。計量資料經Shapiro-Wilk檢驗均符合正態分布,數據以均數±標準表示,多組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;檢驗水準α=0.05。
2 結果
2.1 一般情況
術后4組大鼠均存活至實驗完成。術后切口均順利愈合,大鼠恢復后肢運動功能。但D組4只大鼠于術后8~12周出現內固定物松動或失效,患肢活動減少,未作特殊處理。
2.2 誘導膜MSCs含量觀測
術后5周免疫組織化學染色示B組呈陰性,A、C組均可見STRO-1陽性細胞, MSCs含量分別14.20%±1.92%和5.00%±0.71%,組間差異有統計學意義(P<0.05)。見圖2。
 圖2
A~C組術后5周免疫組織化學染色觀察
圖2
A~C組術后5周免疫組織化學染色觀察
a. A組(×400); b. B組(×40);c. C組(×400)
Figure2. Immunohistochemical staining observation of groups A-C at 5 weeks after operationa. Group A (×400); b. Group B (×40); c. Group C (×400)
2.3 誘導膜自發成骨觀測
2.3.1 X線片檢查
A組:截骨端與骨水泥間隔之間的間隙消失,新骨自截骨端向骨缺損中央生長并超過骨缺損中線,形成唇狀包裹骨水泥間隔,一側新骨長度為2~7 mm,平均3.1 mm。B組:截骨端未見新骨形成。C組:截骨端與骨水泥間隔之間的間隙部分消失,少量新骨形成,一側新骨長度為0~3 mm,平均0.7 mm。D組:截骨端未見新骨形成且有骨萎縮。見圖3。
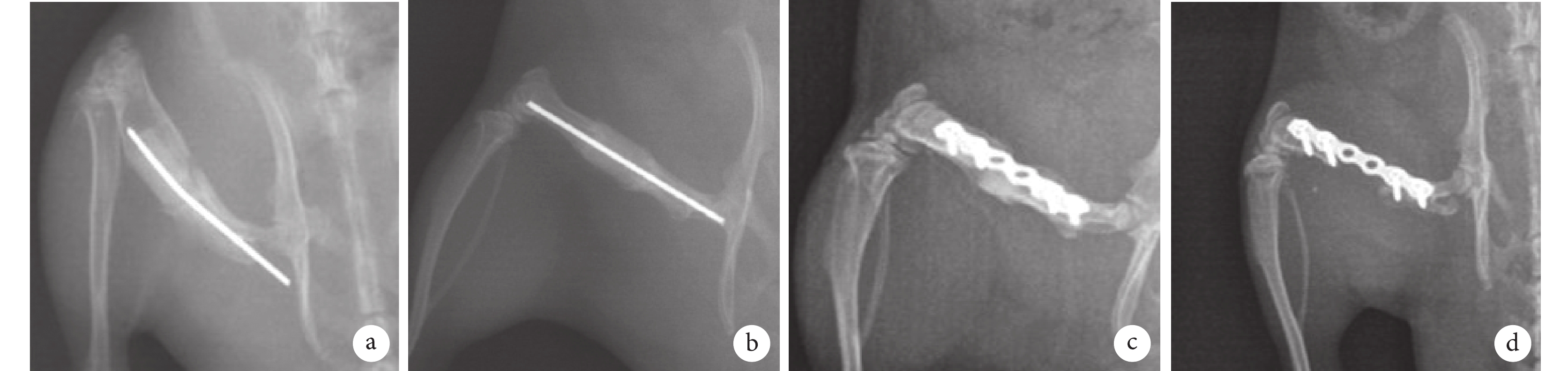 圖3
A~D組術后12周X線片觀察
圖3
A~D組術后12周X線片觀察
a. A組;b. B組;c. C組;d. D組
Figure3. X-ray films of groups A-D at 12 weeks after operationa. Group A; b. Group B; c. Group C; d. Group D
2.3.2 大體觀察
A組:中段誘導膜厚度約1 mm,兩端誘導膜質地較硬,均有不同程度唇狀新骨沿誘導膜生長,其中骨缺損近端和切口深部側形成的新骨較多。B組:誘導膜厚度均勻,約1 mm,質地較軟,截骨端見骨萎縮。C組:誘導膜厚度約1 mm,靠近截骨端的誘導膜質地較硬、稍厚,并有少許新骨。D組:截骨端被軟組織包裹,并發生骨吸收、骨萎縮,其中4只大鼠內固定物松動。見圖4。
 圖4
A~D組術后12周大體觀察
圖4
A~D組術后12周大體觀察
a. A組; b. B組; c. C組;d. D組
Figure4. Gross observation of groups A-D at 12 weeks after operationa. Group A; b. Group B; c. Group C; d. Group D
2.3.3 組織學觀察
4組中僅A、C組有新骨形成,取骨化組織行番紅O-固綠染色,鏡下見誘導膜中均含骨與軟骨。HE染色示A~C組誘導膜中含少量新生血管和纖維組織;D組膠原纖維增生,可見較多成纖維細胞和少量新生血管。見圖5。
 圖5
A~D組術后12周組織學觀察(×200)
圖5
A~D組術后12周組織學觀察(×200)
a、b. A、C組番紅O-固綠染色; c~f. A~D組HE染色
Figure5. Histological observation of groups A-D at 12 weeks after operation (×200)a, b. Safranin O-green staining of groups A and C, respectively; c-f. HE staining of groups A-D, respectively
3 討論
3.1 誘導膜作用
采用Masquelet技術修復骨缺損時形成的誘導膜具有以下作用:① 誘導膜和骨水泥間隔起到防止生長速度較快的軟組織長入骨缺損部位作用。Klaue等[8]研究顯示如果骨缺損處沒有誘導膜和骨水泥間隔,纖維組織將向骨缺損處生長,骨端被纖維組織包裹,發生骨吸收和骨萎縮。本研究D組也觀察到類似結果。② 誘導膜能分泌BMP-2、VEGF和TGF-β等成骨或成血管因子[13-18],從而促進骨再生。③ 誘導膜和骨水泥間隔共同維持合適的膜下空間,在膜引導性骨再生和膜自發性成骨中發揮重要作用[10, 19];同時,誘導膜起到吸引細胞和骨生長因子附著的生物支架作用,有利于血管長入和新骨形成。④ 誘導膜表面有豐富的微血管,可以增加骨移植部位的血運[2,11]。⑤ 誘導膜含骨形成細胞或骨祖細胞,主要是MSCs,可分化成成骨細胞[4,12-13]。
3.2 誘導膜自發成骨原因分析
對于影響骨缺損修復的關鍵要素,有學者提出了“鉆石理論”,即骨缺損的成功修復需要骨誘導介質、骨形成細胞、骨傳導基質(支架)、最佳機械環境、充足血運,以及解決宿主合并疾病,任何要素均不能缺乏[20]。
本研究大體觀察見A組新骨形成最多,其次為C組,B組無自發成骨;而免疫組織化學染色結果亦提示A組誘導膜中MSCs含量最高,C組較少,B組誘導膜無MSCs,與大體觀察成骨結果相對應。Mathieu等[4]、Henrich等[12]、Pélissier等[13]的研究發現只有位于骨缺損處的誘導膜才含MSCs,皮下形成的誘導膜不含MSCs。張浩等[21]的動物實驗結果顯示,與不堵塞組相比,髓腔堵塞組膜內形成新骨明顯延遲且更少,提示膜引導性骨再生自發成骨的MSCs主要來自骨髓,該觀點得到其他研究認同[19]。本研究A、B組均采用克氏針髓腔內固定,隨著術后肢體活動,克氏針激發髓腔內骨髓溢出,故A組誘導膜中的MSCs多于鋼板內固定的C組;而B組髓腔封閉,故沒有骨髓溢出,誘導膜中則未見MSCs。所以A組有明顯自發成骨現象,C組僅骨端少許新骨,B組沒有新骨形成。本研究觀測結果與上述研究一致,進一步明確截骨端骨髓溢出并提供MSCs,對誘導膜自發成骨起關鍵作用。
綜上述,我們認為靠近截骨端的誘導膜具備上述“鉆石理論”的關鍵要素,骨誘導介質、骨形成細胞(主要MSCs)、骨傳導基質、較佳的機械環境(由內固定或外固定提供)和充足血運,所以可形成新骨(自發成骨)。
3.3 誘導膜自發成骨特點及影響因素
由于只有靠近截骨端才有骨髓中的MSCs溢出,誘導膜才有自發成骨現象,所以自發成骨呈現沿誘導膜自截骨端向骨缺損中央生長,在骨端形成明顯唇狀或尖齒狀新骨,是其最明顯特點。
誘導膜自發成骨另一特點是新骨形成呈現不均勻性,這與自發成骨影響因素有關,影響因素主要有溢出骨髓數量、誘導膜與骨缺損大小匹配度、誘導膜和截骨端的穩定性等。Wang等[11]研究顯示截骨近端尤其是下方的誘導膜活性高于截骨遠端和上方,因該部位殘余骨髓和骨膜較多,所以在切口深部新骨較多;通常股骨近端位置較高,髓腔內骨髓容易溢出,所以近端新骨形成多于遠端。因此,骨端骨髓溢出量是影響自發成骨的主要因素。
臨床上骨水泥間隔多采用體內制作成型方式,即制作實心結構的骨水泥間隔,甚至早期學者提倡制作骨水泥間隔的“領子”包裹截骨端[2],骨水泥很容易堵塞髓腔或截骨端。其次,骨水泥體內成型釋放高熱,導致截骨端熱損傷、破壞活性[5, 22]。再者,臨床采用Masquelet技術時骨水泥間隔包裹截骨端或過大、過小,沒有維持適當的膜下空間。且該技術多用于開放性和感染性骨缺損,患者骨端骨膜剝離較多,而且術中反復行髓腔沖洗和術后負壓吸引,雖然截骨端較干凈,但活性較弱。加之髓內釘固定較少,不能激發髓腔內骨髓溢出。上述多方面原因最終導致臨床罕見誘導膜自發成骨現象。
3.4 誘導膜自發成骨方式
本研究組織學檢查示,誘導膜自發成骨的新骨中骨與軟骨同時存在。Gruber等[9]在靠近截骨端誘導膜形成的少量唇狀新骨中,也發現內層為軟骨組織,外層為骨組織。源自骨端的骨膜和骨髓含骨形成細胞,其在誘導膜貼附、增殖分化為成骨細胞和成軟骨細胞,并沿膜管向骨缺損中央方向爬行,不斷形成新骨并礦化。多數學者認為膜引導性骨再生的新骨主要為軟骨內成骨[4,19,21]。因此,Masquelet技術誘導膜自發成骨與其他合成膜材料引導的自發成骨一樣,也屬于軟骨內成骨方式形成新骨。
綜上述,盡管誘導膜具有成骨活性,但骨端髓腔內骨髓溢出提供MSCs才是誘導膜自發成骨的關鍵;誘導膜自發成骨屬于軟骨內成骨。臨床有望利用誘導膜自發成骨現象的改良誘導膜技術修復骨缺損,但其發生機制需要進一步研究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經蘇州大學附屬無錫市第九人民醫院醫學倫理委員會批準(JY-KT20210132);實驗動物使用許可證批準號:SYXK-(蘇)2021-0006
作者貢獻聲明 殷渠東:研究設計和實施、數據收集整理及統計分析、文章撰寫、經費支持;毛棟:研究實施、數據收集整理及統計分析;芮永軍:研究指導、論文修改及經費支持
Masquelet技術,又稱誘導膜技術,是臨床常用的一種骨缺損修復方法。但是,目前對于該技術促進骨愈合的作用機制尚未完全明確,主要有以下3種理論:① 誘導膜具有保護性物理屏障,防止自體骨吸收作用;② 誘導膜含豐富的細胞(包括MSCs)以及與骨形成相關的營養因子;③ 誘導膜含豐富血管網,可侵入骨缺損區,從而避免骨吸收和壞死[1-6]。后兩種理論提示誘導膜具有成骨活性,而且相關研究發現聚甲基丙烯酸甲酯骨水泥間隔填塞動物股骨缺損后,在靠近骨端的誘導膜膜內形成了少量唇狀新骨[7-9]。本課題組前期動物實驗中也觀察到誘導膜內新骨形成現象,在臨床采用Masquelet技術治療的患者中亦發現一期骨水泥植入手術后出現不同程度成骨,甚至修復部分骨缺損現象[10]。我們將未植骨但在誘導膜膜內形成新骨的現象稱為“誘導膜自發成骨”,利用該現象有可能在不植骨或少量植骨條件下通過Masquelet技術修復骨缺損。然而,目前缺少誘導膜自發成骨原因的研究,為此我們基于大鼠模型進行探討,以期為該技術應用奠定實驗基礎。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
7~9周齡SPF級雄性SD大鼠42只,體質量225~280 g,平均253 g,由蘇州佰盛生物技術有限公司提供。術前大鼠適應性飼養1周,溫度20~23℃,晝夜光照循環時間1∶1,濕度60%~80%。
萬古霉素(浙江醫藥股份有限公司新昌制藥廠);醫用級聚甲基丙烯酸甲酯(商品名:CMW 3;DePuy公司,英國);小鼠抗大鼠STRO-1單克隆抗體 [賽默飛世爾科技(中國)有限公司];辣根過氧化物酶標記羊抗鼠二抗(武漢塞維爾生物科技有限公司)。
硅膠模具(上海黑焰醫療科技有限公司);6孔小鋼板(商品名:寵物ALPS純鈦合金鎖定重建骨板;廣州市華創醫療器械有限公司);光學顯微鏡(Nikon公司,日本);Image J軟件(美國國立衛生院);游標卡尺(安徽碭山縣通和量具有限公司)。
1.2 實驗方法
1.2.1 骨水泥間隔制備
將萬古霉素與醫用級聚甲基丙烯酸甲酯固體粉劑以1∶20比例混勻,然后與液劑混合,待呈“膠狀”后倒入硅膠模具中成型。根據預實驗結果成年大鼠股骨中段直徑平均4 mm,本研究制備長度10 mm、直徑4 mm的空心圓柱狀骨水泥間隔,環氧乙烷滅菌備用。
1.2.2 動物模型制備及分組
取42只大鼠制備右后肢股骨中段臨界骨缺損模型[11-12]。腹腔注射5%戊巴比妥(40 mg/kg)麻醉后,右后肢剃毛備皮,從股骨大轉子至股骨外髁縱向切開皮膚、筋膜,切口長度約2.5 cm;在肌間隙分離顯露股骨,在骨膜外將股骨中段與周圍肌肉分離后牽開。使用搖擺鋸在股骨中段截骨,截骨長度10 mm,移除中間骨干和骨膜。
將大鼠股骨缺損模型隨機分為4組,其中A~C組各12只、D組6 只。A、B組:將骨水泥間隔以直徑1.4 mm克氏針貫穿固定于兩截骨端髓腔內,其中A組截骨端不作處理,B組用負載萬古霉素的骨水泥包裹骨水泥間隔與截骨端連接處、封閉截骨端髓腔;C組:將骨水泥間隔用縫線捆綁于6孔小鋼板上,然后鋼板固定兩截骨端;D組:骨缺損曠置,僅以6孔小鋼板固定兩截骨端。沖洗切口,可吸收縫線逐層縫合肌肉、淺筋膜和皮膚。見圖1。術后3 d內每天肌肉注射青霉素鈉4×104 U以防止感染,單籠飼養至切口愈合后混籠飼養。
 圖1
各組模型制備
圖1
各組模型制備
a. 股骨截骨;b~e. A~D組骨缺損處理;f~i. A~D組骨缺損處理后X線片
Figure1. Preparation of models in each groupa. Femoral osteotomy; b-e. Bone defect treatment in groups A-D, respectively; f-i. X-ray films after bone defect treatment in groups A-D, respectively
1.3 觀測指標
1.3.1 一般情況
術后觀察各組大鼠存活及術后肢體活動恢復情況。
1.3.2 誘導膜MSCs含量觀測
采用STRO-1免疫組織化學染色評估誘導膜中MSCs含量。術后5周,A~C組各取6只大鼠腹腔注射3%戊巴比妥(120 mg/kg)處死后,按照原切口入路取誘導膜。為避免切取時損傷截骨端骨膜,均統一取誘導膜中段6 mm長組織進行觀測。
將誘導膜置于10%甲醛中固定24 h后取出,制備5 μm厚切片。按照常規操作處理后,滴加STRO-1抗體(1∶200),4℃避光過夜孵育;滴加辣根過氧化物酶標記羊抗鼠二抗(1∶1 000),37℃孵育1 h;滴加DAB染色液,室溫孵育10 min;蘇木素染色液室溫孵育30 s;脫水、透明、封片后光鏡下觀察,黃褐色染色細胞即為STRO-1陽性細胞。于400倍鏡下每張切片選擇3個視野,采用Image J軟件行吸光度(A)值分析,記錄陽性細胞所占百分比,作為MSCs含量,取均值。
1.3.3 誘導膜自發成骨觀測
術后12周,取各組剩余大鼠同上法處死后進行以下觀測。 ① X線片觀察:攝正位X線片觀察有無新骨形成,利用自帶直尺測量新骨長度。② 大體觀察:按照原切口入路顯露股骨,取出內固定物和骨水泥間隔,觀察誘導膜和成骨情況,并用游標卡尺測量誘導膜厚度。 ③ 組織學觀察:取骨缺損段組織,其中未骨化組織經石蠟包埋、切片(厚3 μm)后常規HE染色;骨化組織按順序置于4%多聚甲醛固定48 h、脫鈣液浸泡1個月后,石蠟包埋、切片(厚度4 μm)后行番紅O-固綠染色。光鏡下觀察組織構成。
1.4 統計學方法
采用SPSS26.0統計軟件進行分析。計量資料經Shapiro-Wilk檢驗均符合正態分布,數據以均數±標準表示,多組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;檢驗水準α=0.05。
2 結果
2.1 一般情況
術后4組大鼠均存活至實驗完成。術后切口均順利愈合,大鼠恢復后肢運動功能。但D組4只大鼠于術后8~12周出現內固定物松動或失效,患肢活動減少,未作特殊處理。
2.2 誘導膜MSCs含量觀測
術后5周免疫組織化學染色示B組呈陰性,A、C組均可見STRO-1陽性細胞, MSCs含量分別14.20%±1.92%和5.00%±0.71%,組間差異有統計學意義(P<0.05)。見圖2。
 圖2
A~C組術后5周免疫組織化學染色觀察
圖2
A~C組術后5周免疫組織化學染色觀察
a. A組(×400); b. B組(×40);c. C組(×400)
Figure2. Immunohistochemical staining observation of groups A-C at 5 weeks after operationa. Group A (×400); b. Group B (×40); c. Group C (×400)
2.3 誘導膜自發成骨觀測
2.3.1 X線片檢查
A組:截骨端與骨水泥間隔之間的間隙消失,新骨自截骨端向骨缺損中央生長并超過骨缺損中線,形成唇狀包裹骨水泥間隔,一側新骨長度為2~7 mm,平均3.1 mm。B組:截骨端未見新骨形成。C組:截骨端與骨水泥間隔之間的間隙部分消失,少量新骨形成,一側新骨長度為0~3 mm,平均0.7 mm。D組:截骨端未見新骨形成且有骨萎縮。見圖3。
 圖3
A~D組術后12周X線片觀察
圖3
A~D組術后12周X線片觀察
a. A組;b. B組;c. C組;d. D組
Figure3. X-ray films of groups A-D at 12 weeks after operationa. Group A; b. Group B; c. Group C; d. Group D
2.3.2 大體觀察
A組:中段誘導膜厚度約1 mm,兩端誘導膜質地較硬,均有不同程度唇狀新骨沿誘導膜生長,其中骨缺損近端和切口深部側形成的新骨較多。B組:誘導膜厚度均勻,約1 mm,質地較軟,截骨端見骨萎縮。C組:誘導膜厚度約1 mm,靠近截骨端的誘導膜質地較硬、稍厚,并有少許新骨。D組:截骨端被軟組織包裹,并發生骨吸收、骨萎縮,其中4只大鼠內固定物松動。見圖4。
 圖4
A~D組術后12周大體觀察
圖4
A~D組術后12周大體觀察
a. A組; b. B組; c. C組;d. D組
Figure4. Gross observation of groups A-D at 12 weeks after operationa. Group A; b. Group B; c. Group C; d. Group D
2.3.3 組織學觀察
4組中僅A、C組有新骨形成,取骨化組織行番紅O-固綠染色,鏡下見誘導膜中均含骨與軟骨。HE染色示A~C組誘導膜中含少量新生血管和纖維組織;D組膠原纖維增生,可見較多成纖維細胞和少量新生血管。見圖5。
 圖5
A~D組術后12周組織學觀察(×200)
圖5
A~D組術后12周組織學觀察(×200)
a、b. A、C組番紅O-固綠染色; c~f. A~D組HE染色
Figure5. Histological observation of groups A-D at 12 weeks after operation (×200)a, b. Safranin O-green staining of groups A and C, respectively; c-f. HE staining of groups A-D, respectively
3 討論
3.1 誘導膜作用
采用Masquelet技術修復骨缺損時形成的誘導膜具有以下作用:① 誘導膜和骨水泥間隔起到防止生長速度較快的軟組織長入骨缺損部位作用。Klaue等[8]研究顯示如果骨缺損處沒有誘導膜和骨水泥間隔,纖維組織將向骨缺損處生長,骨端被纖維組織包裹,發生骨吸收和骨萎縮。本研究D組也觀察到類似結果。② 誘導膜能分泌BMP-2、VEGF和TGF-β等成骨或成血管因子[13-18],從而促進骨再生。③ 誘導膜和骨水泥間隔共同維持合適的膜下空間,在膜引導性骨再生和膜自發性成骨中發揮重要作用[10, 19];同時,誘導膜起到吸引細胞和骨生長因子附著的生物支架作用,有利于血管長入和新骨形成。④ 誘導膜表面有豐富的微血管,可以增加骨移植部位的血運[2,11]。⑤ 誘導膜含骨形成細胞或骨祖細胞,主要是MSCs,可分化成成骨細胞[4,12-13]。
3.2 誘導膜自發成骨原因分析
對于影響骨缺損修復的關鍵要素,有學者提出了“鉆石理論”,即骨缺損的成功修復需要骨誘導介質、骨形成細胞、骨傳導基質(支架)、最佳機械環境、充足血運,以及解決宿主合并疾病,任何要素均不能缺乏[20]。
本研究大體觀察見A組新骨形成最多,其次為C組,B組無自發成骨;而免疫組織化學染色結果亦提示A組誘導膜中MSCs含量最高,C組較少,B組誘導膜無MSCs,與大體觀察成骨結果相對應。Mathieu等[4]、Henrich等[12]、Pélissier等[13]的研究發現只有位于骨缺損處的誘導膜才含MSCs,皮下形成的誘導膜不含MSCs。張浩等[21]的動物實驗結果顯示,與不堵塞組相比,髓腔堵塞組膜內形成新骨明顯延遲且更少,提示膜引導性骨再生自發成骨的MSCs主要來自骨髓,該觀點得到其他研究認同[19]。本研究A、B組均采用克氏針髓腔內固定,隨著術后肢體活動,克氏針激發髓腔內骨髓溢出,故A組誘導膜中的MSCs多于鋼板內固定的C組;而B組髓腔封閉,故沒有骨髓溢出,誘導膜中則未見MSCs。所以A組有明顯自發成骨現象,C組僅骨端少許新骨,B組沒有新骨形成。本研究觀測結果與上述研究一致,進一步明確截骨端骨髓溢出并提供MSCs,對誘導膜自發成骨起關鍵作用。
綜上述,我們認為靠近截骨端的誘導膜具備上述“鉆石理論”的關鍵要素,骨誘導介質、骨形成細胞(主要MSCs)、骨傳導基質、較佳的機械環境(由內固定或外固定提供)和充足血運,所以可形成新骨(自發成骨)。
3.3 誘導膜自發成骨特點及影響因素
由于只有靠近截骨端才有骨髓中的MSCs溢出,誘導膜才有自發成骨現象,所以自發成骨呈現沿誘導膜自截骨端向骨缺損中央生長,在骨端形成明顯唇狀或尖齒狀新骨,是其最明顯特點。
誘導膜自發成骨另一特點是新骨形成呈現不均勻性,這與自發成骨影響因素有關,影響因素主要有溢出骨髓數量、誘導膜與骨缺損大小匹配度、誘導膜和截骨端的穩定性等。Wang等[11]研究顯示截骨近端尤其是下方的誘導膜活性高于截骨遠端和上方,因該部位殘余骨髓和骨膜較多,所以在切口深部新骨較多;通常股骨近端位置較高,髓腔內骨髓容易溢出,所以近端新骨形成多于遠端。因此,骨端骨髓溢出量是影響自發成骨的主要因素。
臨床上骨水泥間隔多采用體內制作成型方式,即制作實心結構的骨水泥間隔,甚至早期學者提倡制作骨水泥間隔的“領子”包裹截骨端[2],骨水泥很容易堵塞髓腔或截骨端。其次,骨水泥體內成型釋放高熱,導致截骨端熱損傷、破壞活性[5, 22]。再者,臨床采用Masquelet技術時骨水泥間隔包裹截骨端或過大、過小,沒有維持適當的膜下空間。且該技術多用于開放性和感染性骨缺損,患者骨端骨膜剝離較多,而且術中反復行髓腔沖洗和術后負壓吸引,雖然截骨端較干凈,但活性較弱。加之髓內釘固定較少,不能激發髓腔內骨髓溢出。上述多方面原因最終導致臨床罕見誘導膜自發成骨現象。
3.4 誘導膜自發成骨方式
本研究組織學檢查示,誘導膜自發成骨的新骨中骨與軟骨同時存在。Gruber等[9]在靠近截骨端誘導膜形成的少量唇狀新骨中,也發現內層為軟骨組織,外層為骨組織。源自骨端的骨膜和骨髓含骨形成細胞,其在誘導膜貼附、增殖分化為成骨細胞和成軟骨細胞,并沿膜管向骨缺損中央方向爬行,不斷形成新骨并礦化。多數學者認為膜引導性骨再生的新骨主要為軟骨內成骨[4,19,21]。因此,Masquelet技術誘導膜自發成骨與其他合成膜材料引導的自發成骨一樣,也屬于軟骨內成骨方式形成新骨。
綜上述,盡管誘導膜具有成骨活性,但骨端髓腔內骨髓溢出提供MSCs才是誘導膜自發成骨的關鍵;誘導膜自發成骨屬于軟骨內成骨。臨床有望利用誘導膜自發成骨現象的改良誘導膜技術修復骨缺損,但其發生機制需要進一步研究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經蘇州大學附屬無錫市第九人民醫院醫學倫理委員會批準(JY-KT20210132);實驗動物使用許可證批準號:SYXK-(蘇)2021-0006
作者貢獻聲明 殷渠東:研究設計和實施、數據收集整理及統計分析、文章撰寫、經費支持;毛棟:研究實施、數據收集整理及統計分析;芮永軍:研究指導、論文修改及經費支持