引用本文: 張明浩, 賀唯, 于素香, 邸運濤, 李曉明. 殼聚糖水凝膠/聚丙烯網片復合材料修復大鼠腹壁缺損的實驗研究. 中國修復重建外科雜志, 2024, 38(10): 1261-1268. doi: 10.7507/1002-1892.202404042 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
外傷、疝氣、腫瘤等都會導致腹壁缺損,腹壁缺損修復一直是外科手術中的難題之一[1]。使用外科手術網片進行腹壁缺損修復是恢復肌肉筋膜層完整性的臨床常規方法;然而,傳統聚合物編織網片的粗糙表面容易摩擦內臟組織,導致與腹腔臟器粘連[2-4],并且因粘連、網片收縮引起的疼痛和細菌感染等并發癥,可導致愈合不良甚至復發[5-7]。為了解決這些問題,研究者們探索了多種方法以最大限度減小手術網片修復腹壁的副作用,其中在網片外包裹一層水凝膠是一種有效方法[8-10]。水凝膠在防止細胞黏附同時促進組織愈合方面表現出優異性能[11-14]。水凝膠不僅在腹壁修復時形成一層固態屏障,還可保證水分和氧氣的透過性,具有類似細胞外基質的結構,可以支持細胞向內生長,其表面的高度親水性減少了細胞黏附位點,不利于成纖維細胞等在水凝膠表面黏附[15],因而用于腹壁修復具有一定抗粘連效果。
殼聚糖(chitosan,CS)作為一種天然多糖,可以從各種海鮮廢棄物中提取和分離,其生物醫學應用已得到廣泛研究[16-19]。CS具有良好的生物相容性、生物降解性以及抗菌性,是制作水凝膠的常用材料之一。CS的降解產物是氨基糖,可以完全被生物體吸收,且體內植入后炎癥反應和毒性小。CS水凝膠在組織工程領域已有廣泛應用,而在腹壁修復領域其具有廣闊應用前景,有望在抗粘連和傷口愈合方面提供新的策略[20-21]。
本研究通過物理交聯方式制備CS水凝膠,并將其與臨床上廣泛使用的聚丙烯(polypropylene,PP)網片復合,制備了CS水凝膠/PP網片復合材料(以下簡稱“復合材料”)。本研究在材料表征的基礎上,通過體外和體內生物學實驗評價復合材料的生物相容性和修復效果,探討CS水凝膠抗粘連和促進傷口愈合的積極作用,為其進一步臨床應用提供實驗依據。
1 材料與方法
1.1 實驗動物及主要材料、儀器
8~10周齡SD雄性大鼠18只,體質量200~250 g,購自北京維通利華實驗動物技術有限公司。于溫度20℃、相對濕度50%±5%環境下合籠飼養,每籠3~4只大鼠,飼養期間大鼠自由進食、水并及時更換飼養墊料,保持籠內衛生環境,從購買至手術前保證4~7 d適應期。
CS(脫乙酰度≥95%)、碳酸鈉(≥99.5%,上海阿拉丁生化科技股份有限公司);PP網片 [強生(上海)醫療器材有限公司];冰乙酸(≥99.5%,天津市致遠化學試劑有限公司);小鼠胚胎成纖維細胞(NIH-3T3;北京鼎國昌盛生物技術有限責任公司);人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs;北京大學人民醫院);Matrigel基質膠(Corning公司,美國);4%組織細胞固定液、抗熒光衰減封片(含DAPI)、改良HE染色試劑盒、改良Masson三色染色試劑盒(北京索萊寶科技有限公司)。
Nikon Eclipse E100光學顯微鏡、LV100ND正置金相顯微鏡 [尼康儀器(上海)有限公司)];JSM-5600LV掃描電鏡(JEOL公司,日本);JC2000FM接觸角測量儀(上海中晨數字技術設備有限公司);FREEZONE 12冷凍干燥機(LABCONCO公司,美國);LSM800熒光顯微鏡(Zeiss公司,德國); AE20熒光倒置顯微鏡(南京瞭望光電技術有限公司)。
1.2 材料制備和表征
用乙酸溶液將CS溶液(4wt%)的pH值調節至5.5~5.8,然后加入飽和碳酸鈉溶液,直至pH值達6.5~7.0;攪拌15 min后,將CS溶液靜置,直至形成CS水凝膠。
將PP網片切割成大小為20 mm×15 mm的矩形塊,并置于直徑6 cm培養皿中。將制備的pH 6.5~7.0并攪拌好的CS溶液緩慢倒入培養皿中,確保溶液均勻分布于PP網片周圍。然后室溫保持24 h,制得復合材料。
大體觀察復合材料外觀,并于正置金相顯微鏡下分別觀察PP網片和復合材料的微觀結構;使用掃描電鏡分別對冷凍干燥處理的CS水凝膠以及復合材料的孔隙微觀形貌進行表征,并通過接觸角測量儀分別測量CS水凝膠和PP網片的表面接觸角來檢測材料的親水性。
1.3 體外細胞培養實驗
① 成纖維細胞浸潤實驗:將滅菌后的復合材料(5 mm×5 mm)和300 μL NIH-3T3細胞懸液(濃度1×105個/mL)加入48孔板中(實驗組),以單純NIH-3T3細胞作為對照組。于37℃、5%CO2條件下培養1、3 d,分別取出行DAPI染色,熒光顯微鏡觀察細胞陽性染色情況。
② HUVECs管形成實驗:將復合材料(5 mm×5 mm)置于預涂有Matrigel基質膠的48孔板中,將1×105個/mL HUVECs接種至樣品上(實驗組),以單純HUVECs作為對照組,于37℃、5%CO2條件下培養6 h,光鏡觀察細胞形態,以探索復合材料的血管生成潛力。
1.4 大鼠腹壁缺損修復實驗
取18只SD大鼠,用0.3%戊巴比妥溶液(40~45 mg/kg)腹膜內注射麻醉。沿中線切開腹部皮膚,于腹部左、右兩側切除腹壁肌肉,以創建1.5 cm×1.0 cm的雙側全厚腹壁缺損。每只大鼠腹壁缺損區一側植入復合材料(實驗組),另一側植入PP網片(對照組),將材料牢固縫合至附近腹部肌肉上,用縫線縫合腹部皮膚。于1、2、4周分別處死6只大鼠,取材進行以下觀測:① 大體觀察腹壁和腹腔內組織之間粘連及缺損傷口愈合情況。② 組織學觀察:將材料置入4%組織細胞固定液中,石蠟包埋固定,切片,片厚4~5 μm。常規行HE染色觀察組織結構和細胞形態學特征;每組隨機選10個視野,使用Image J軟件定量分析材料和腹壁接觸部位處的細胞密度,以檢測植入部位細胞浸潤程度。同時常規行Masson染色觀察組織中膠原纖維的分布、密度和結構變化;每組隨機選10個視野,使用Image J軟件對膠原含量進行定量分析,即陽性染色面積占整體面積的百分比。③ 免疫組織化學染色:術后2、4周取上述部分切片,常規行CD31(血管生成標志物)和CD68(巨噬細胞浸潤標志物)免疫組織化學染色,觀察陽性染色情況;每組隨機選10個視野,使用Image J軟件定量分析陽性細胞密度。
1.5 統計學方法
采用SPSS19.0統計軟件進行分析。計量資料經Sharpiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間及組內兩個時間點間比較采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 材料的表征
大體觀察示,復合材料中的水凝膠薄膜呈淺黃色透明固態,厚度2~3 mm,PP網片被包裹在水凝膠內部,不易剝離。正置金相顯微鏡觀察示,PP網片具有編織形成的網絡結構;而復合材料中的水凝膠包裹著PP網片,且二者結合緊密。掃描電鏡觀察示,CS水凝膠具有大小不一的連通孔隙,孔徑100~300 μm;復合材料中的PP網片在水凝膠中牢固包裹,水凝膠穿透PP網片,形成多孔結構。接觸角測量示,CS水凝膠表面接觸角為(39.2±0.3)°,且水滴滴加于水凝膠表面后數秒內鋪展、消失,說明其具有強烈的吸水性和親水性;而PP網片表面接觸角為(125.9±0.4)°,且水滴滴加于材料表面后可維持較長時間,說明其表面高度疏水。見圖1。
 圖1
CS水凝膠、PP網片及復合材料的表征
圖1
CS水凝膠、PP網片及復合材料的表征
a. 復合材料大體形貌;b. PP網片(左)和復合材料(右)微觀結構(正置金相顯微鏡×2);c. 掃描電鏡觀察CS水凝膠(左,×100)和復合材料(右,×200)橫截面微觀形貌;d. CS水凝膠(左)和PP網片(右)表面接觸角檢測
Figure1. Characterization of CS hydrogel, PP mesh, and compositea. Macroscopic morphology of the composite; b. Microscopic structure of PP mesh (left) and composites (right) (Upright metallographic microscope×2); c. Cross-sectional microscopic morphology of CS hydrogel (left, ×100) and composite (right, ×200) observed by scanning electron microscopy; d. Contact angle measurement of CS hydrogel (left) and PP mesh (right)
2.2 體外細胞培養實驗
DAPI染色示,培養1 d,實驗組陽性細胞數量較少,而對照組陽性細胞長滿整個孔板底部。培養3 d,實驗組可見層次不一的熒光,與水凝膠表面接觸的細胞呈球形,而對照組中細胞則呈梭形。見圖2。
 圖2
復合材料成纖維細胞浸潤實驗(熒光顯微鏡×50)
圖2
復合材料成纖維細胞浸潤實驗(熒光顯微鏡×50)
從左至右依次為培養1、3 d a. 實驗組;b. 對照組
Figure2. Fibroblast infiltration experiment of composites (Fluorescence microscopy×50)From left to right for 1 and 3 days after culture, respectively a. Experimental group; b. Control group
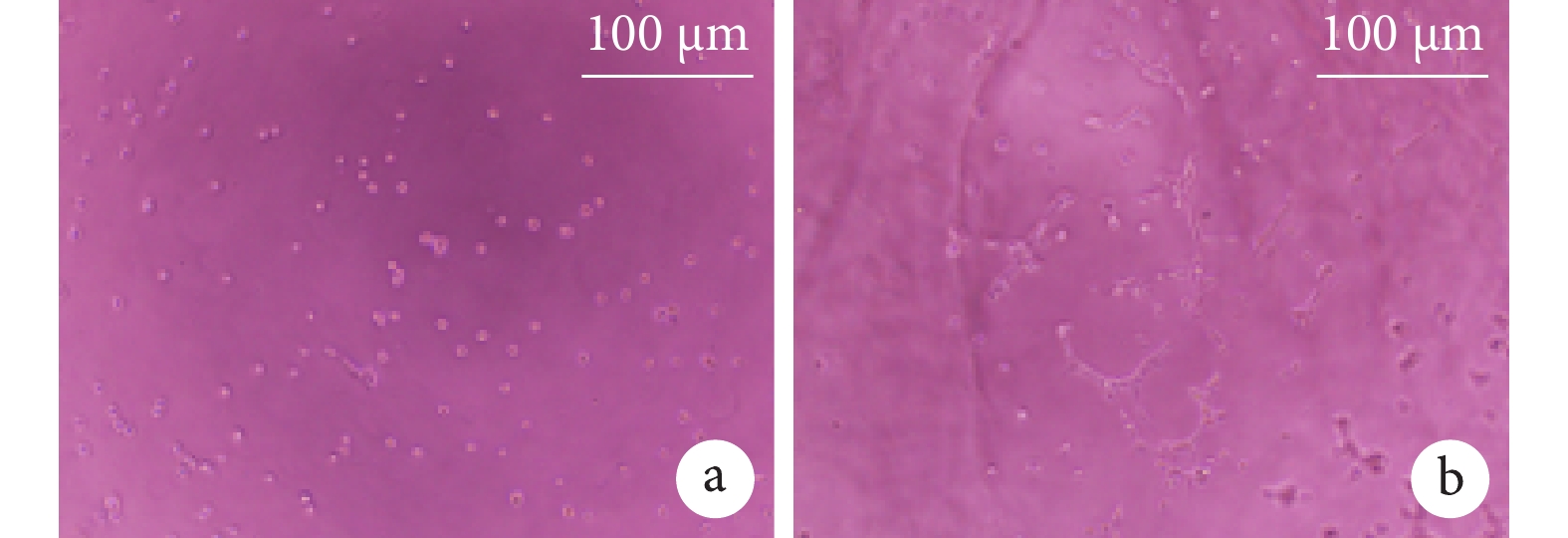
HUVECs管形成實驗結果示,實驗組HUVECs數量增多,且遷移聚攏,有形成管的趨勢;而對照組細胞呈稀疏排布,無遷移趨勢。見圖3。
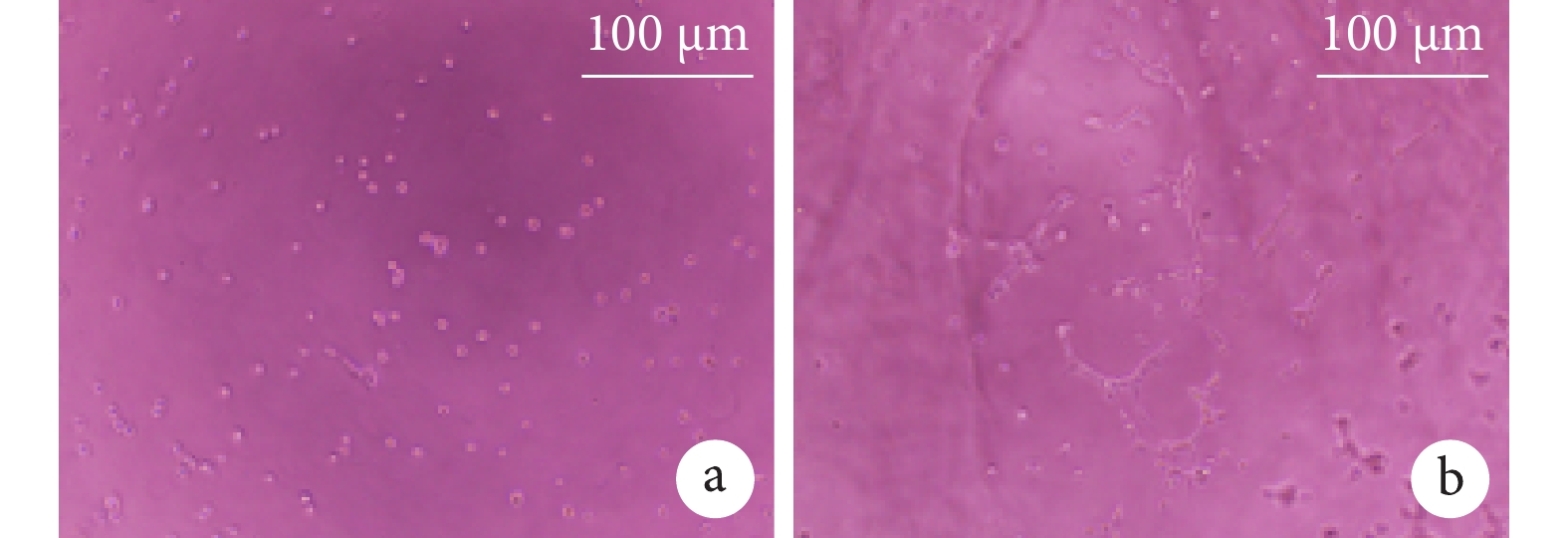 圖3
復合材料HUVECs管形成實驗(×100)
圖3
復合材料HUVECs管形成實驗(×100)
a. 對照組;b. 實驗組
Figure3. HUVECs tube formation experiments of composites (×100)a. Control group; b. Experimental group
2.3 大鼠腹壁缺損修復實驗
2.3.1 大體觀察
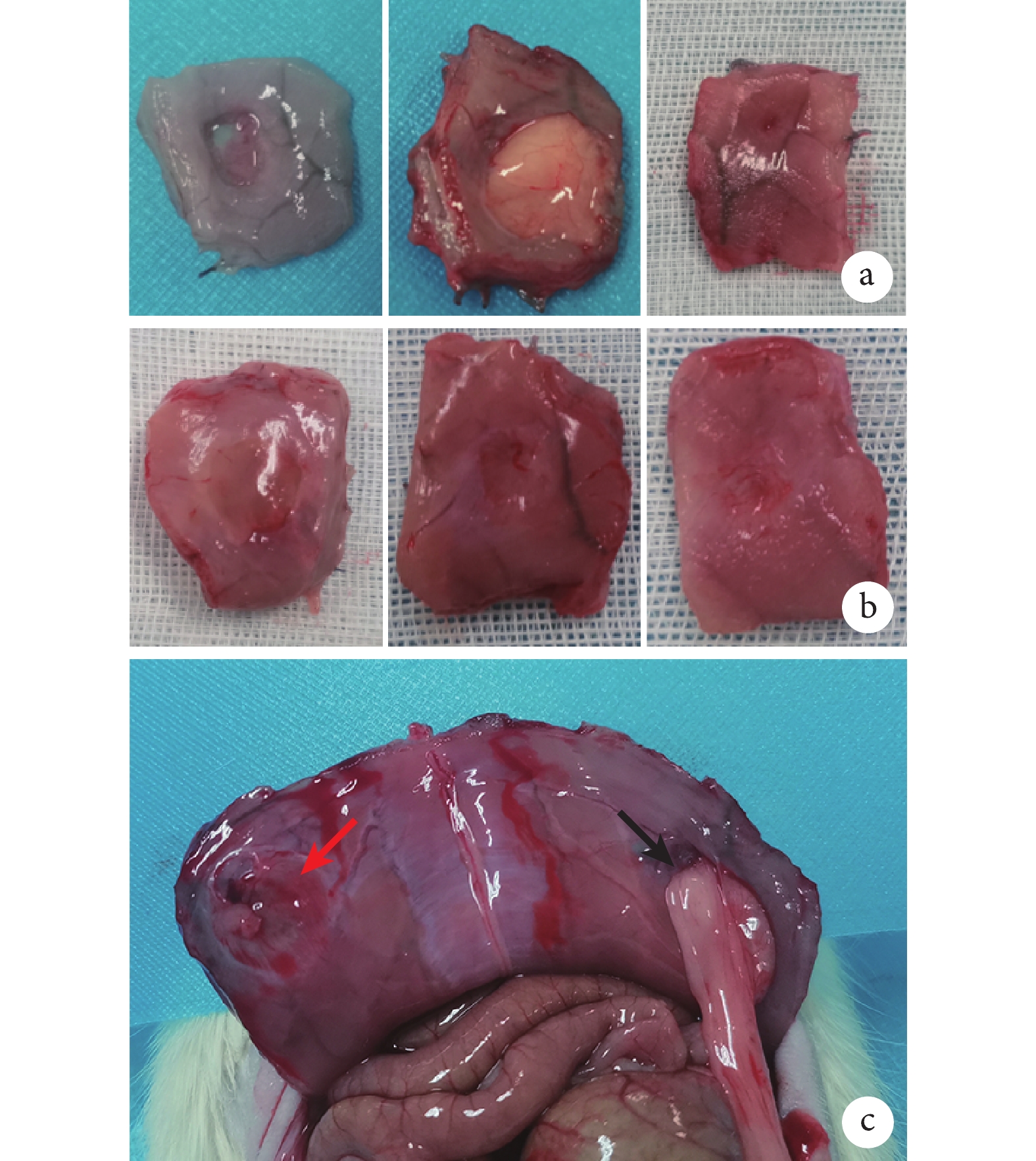
術后1周,對照組無組織長入,部分黏膜覆蓋;實驗組已有組織和血管長入,開始再生。術后2周,對照組腹壁與脂肪組織粘連,無法分離;實驗組無粘連,缺損處有大量新生組織和微血管。術后4周,對照組傷口部分愈合,新生組織向缺損內部生長,腹壁未完全恢復;實驗組腹壁完整性恢復,組織無粘連,肌肉和血管再生,腹壁解剖結構基本重建。見圖4。
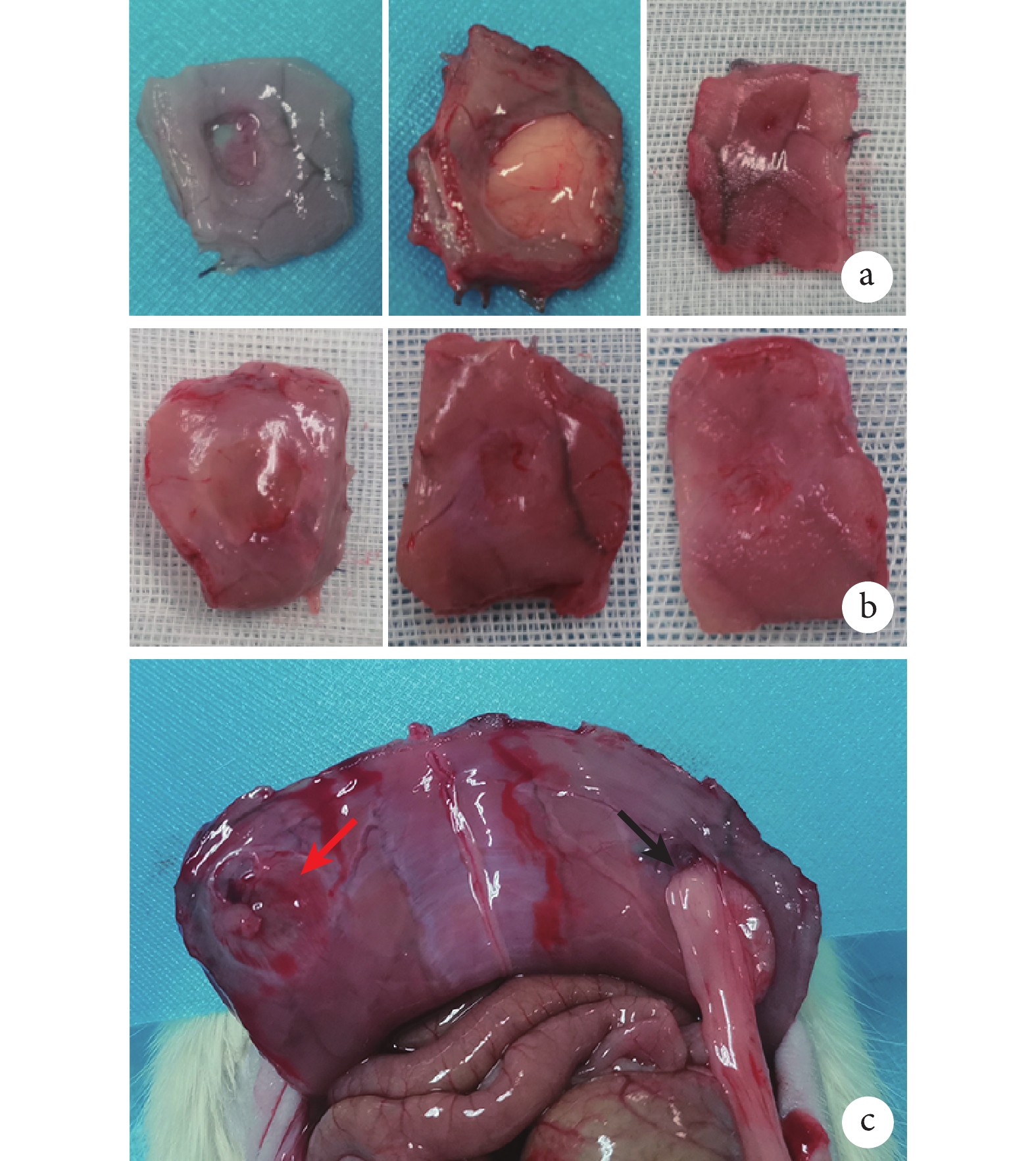 圖4
大鼠腹壁缺損修復大體觀察
圖4
大鼠腹壁缺損修復大體觀察
a. 對照組(從左至右依次為術后1、2、4周);b. 實驗組(從左至右依次為術后1、2、4周);c. 術后2周腹壁內側(紅箭頭示實驗組,黑箭頭示對照組)
Figure4. Macroscopic observation of rat abdominal wall defect repaira. Control group (From left to right for postoperative 1, 2, and 4 weeks, respectively); b. Experimental group (From left to right for postoperative 1, 2, and 4 weeks, respectively); c. Inner abdominal wall at postoperative 2 weeks (red arrow indicated experimental group, black arrow indicated control group)
2.3.2 HE染色觀察
術后1周,兩組均有大量細胞浸潤,炎癥反應均較明顯,且有纖維囊包覆。術后2、4周,兩組纖維囊仍存在,細胞浸潤減少,可見新生血管形成及新生的腹壁肌肉細胞,炎癥反應減少;對照組細胞均在內部,實驗組細胞在內部浸潤較弱,集中在水凝膠和肌肉組織之間。見圖5a。
 圖5
兩組大鼠體內植入材料各時間點HE染色觀察
圖5
兩組大鼠體內植入材料各時間點HE染色觀察
a. 對照組(上)和實驗組(下)HE染色(×5) 黑色虛線示PP網片區域,紅色虛線示未降解的水凝膠 從左至右依次為術后1、2、4周;b. 兩組材料和腹壁接觸部位處細胞密度比較
Figure5. HE staining observation of implanted materials in both groups of rats at different time pointsa. HE staining of control group (top) and experimental group (bottom) (×5) The black dashed line indicated the PP mesh area, and the red dashed line indicated the undegraded hydrogel From left to right for postoperative 1, 2, and 4 weeks, respectively; b. Comparison of cell density at the interface between the materials and the abdominal wall in both groups
定量分析示,隨時間延長,兩組材料和腹壁接觸部位處細胞密度均有所下降,對照組下降趨勢大于實驗組。除術后1周兩組細胞密度比較差異無統計學意義(P>0.05)外,術后2、4周實驗組細胞密度均高于對照組,差異有統計學意義(P<0.05)。見圖5b。
2.3.3 Masson染色觀察
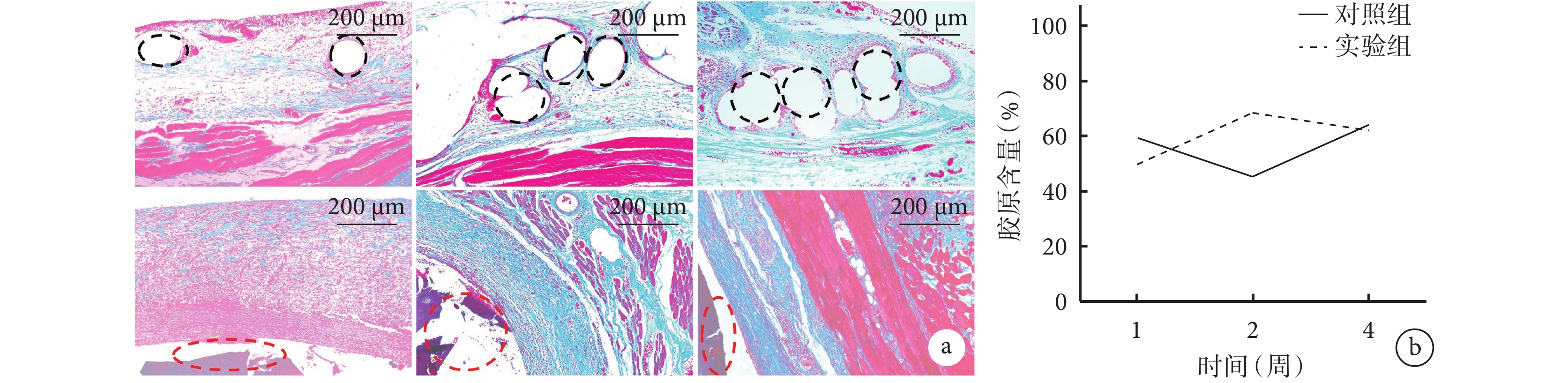
術后1周,兩組植入部位周圍纖維化明顯,產生大量膠原纖維,膠原排布均不具有取向性,隨機度、混亂度大;術后2周,對照組膠原取向性不明顯,4周時有一定取向性,但PP網片中間被松散的結締組織所填充;術后2、4周,實驗組膠原纖維排布整齊,有較大的定向排列度。定量分析示,術后2周,實驗組膠原含量顯著大于對照組(P<0.05);術后1、4周,兩組植入部位的膠原含量接近,差異無統計學意義(P>0.05)。見圖6。
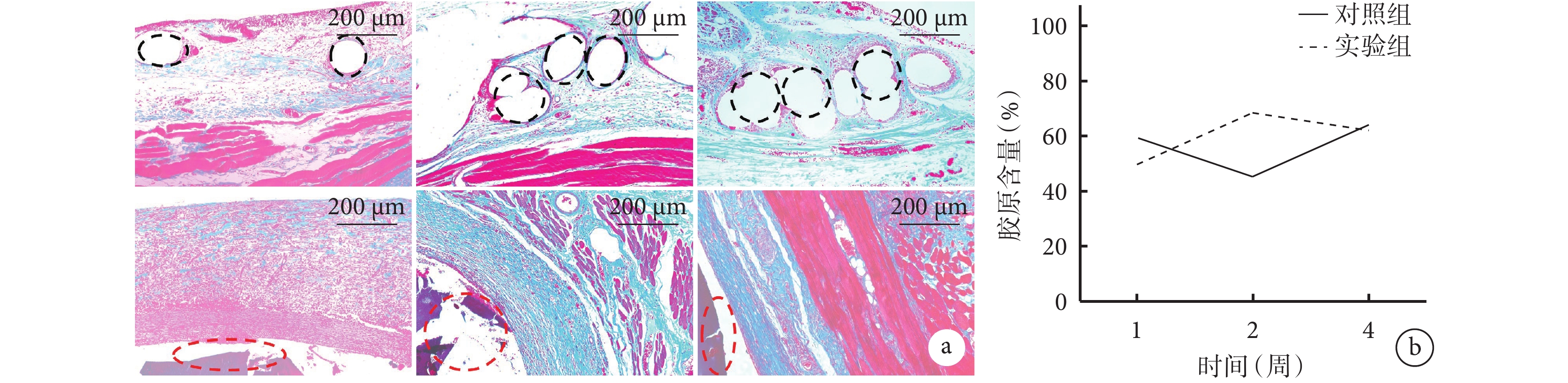 圖6
兩組大鼠體內植入材料各時間點Masson染色觀察
圖6
兩組大鼠體內植入材料各時間點Masson染色觀察
a. 對照組(上)和實驗組(下)Masson染色(×5) 黑色虛線示PP網片區域,紅色虛線示未降解的水凝膠 從左至右依次為術后1、2、4周;b. 兩組膠原含量比較
Figure6. Masson staining observation of implanted materials in both groups of rats at different time pointsa. Masson staining of control group (top) and experimental group (bottom) (×5) The black dashed line indicated the PP mesh area, and the red dashed line indicated the undegraded hydrogel From left to right for postoperative 1, 2, and 4 weeks, respectively; b. Comparison of collagen content between the two groups
2.3.4 免疫組織化學染色觀察
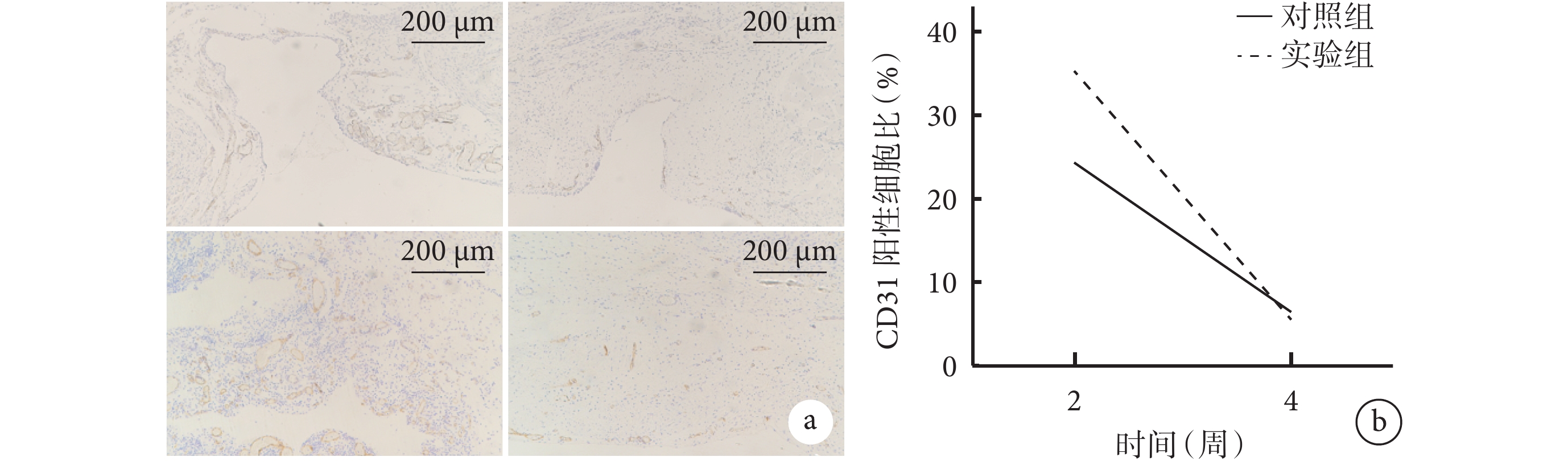
術后2周,對照組仍存在較大缺損,CD31陽性細胞集中于缺損處;實驗組CD31陽性細胞分布于新生肌肉層之間,腹壁缺損處的細胞已初步完成增殖重建過程。術后4周,兩組CD31陽性細胞不再集中分布,部分陽性細胞出現在肌肉層之間和腹壁內表面。定量分析示,術后4周兩組CD31陽性細胞比較術后2周明顯減少,差異有統計學意義(P<0.05);術后2周實驗組CD31陽性細胞比顯著高于對照組(P<0.05)。見圖7。
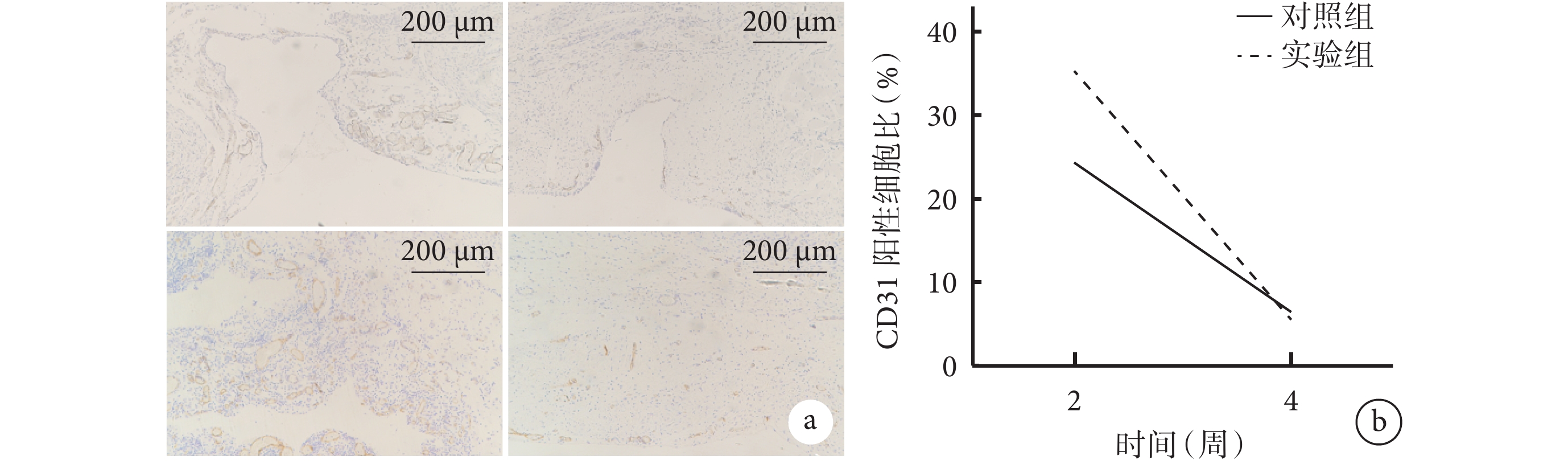 圖7
兩組大鼠體內植入材料各時間點CD31免疫組織化學染色觀察
圖7
兩組大鼠體內植入材料各時間點CD31免疫組織化學染色觀察
a. 對照組(上)和實驗組(下)CD31免疫組織化學染色(×5) 從左至右依次為術后2、4周;b. 兩組CD31陽性細胞比比較
Figure7. CD31 immunohistochemical staining observation of implanted materials in both groups of rats at different time pointsa. CD31 immunohistochemical staining of control group (top) and experimental group (bottom) (×5) From left to right for postoperative 2 and 4 weeks, respectively; b. Comparison of CD31-positive cell ratios between the two groups
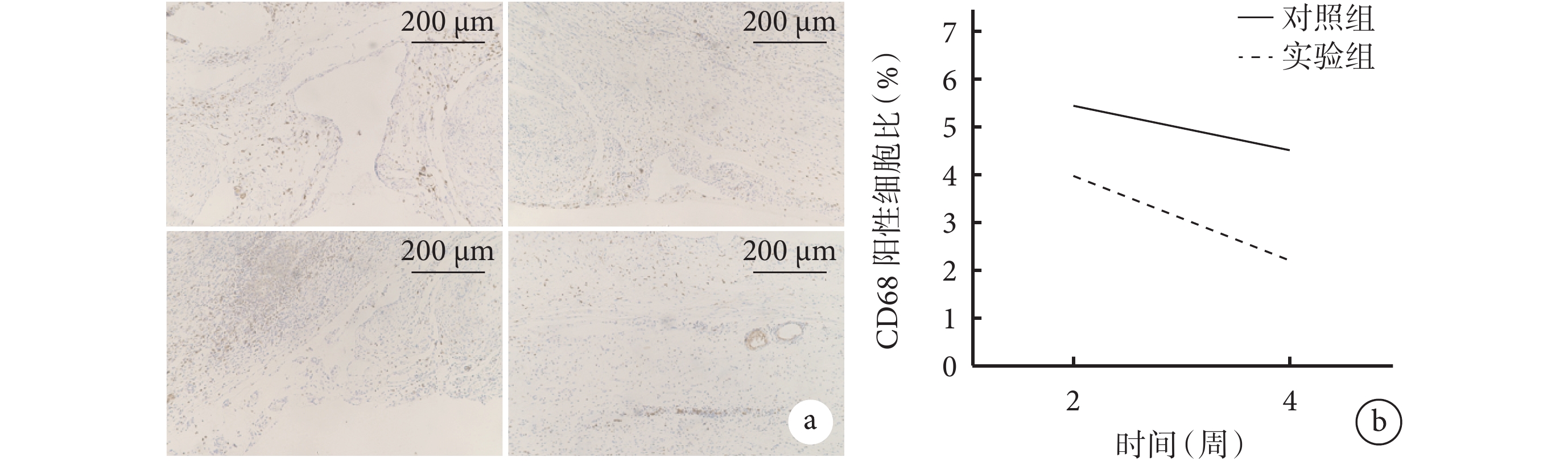
術后2周,兩組均可觀察到大量炎癥細胞,CD68陽性細胞密集聚集于腹壁缺損部位及材料與缺損部位接觸處。術后4周,兩組CD68陽性細胞集中于腹壁內膜和新生肌肉組織層之間。定量分析示,術后4周兩組CD68陽性細胞比與術后2周相比無明顯變化,差異無統計學意義(P>0.05);術后2、4周實驗組CD68陽性細胞比均顯著低于對照組(P<0.05)。見圖8。
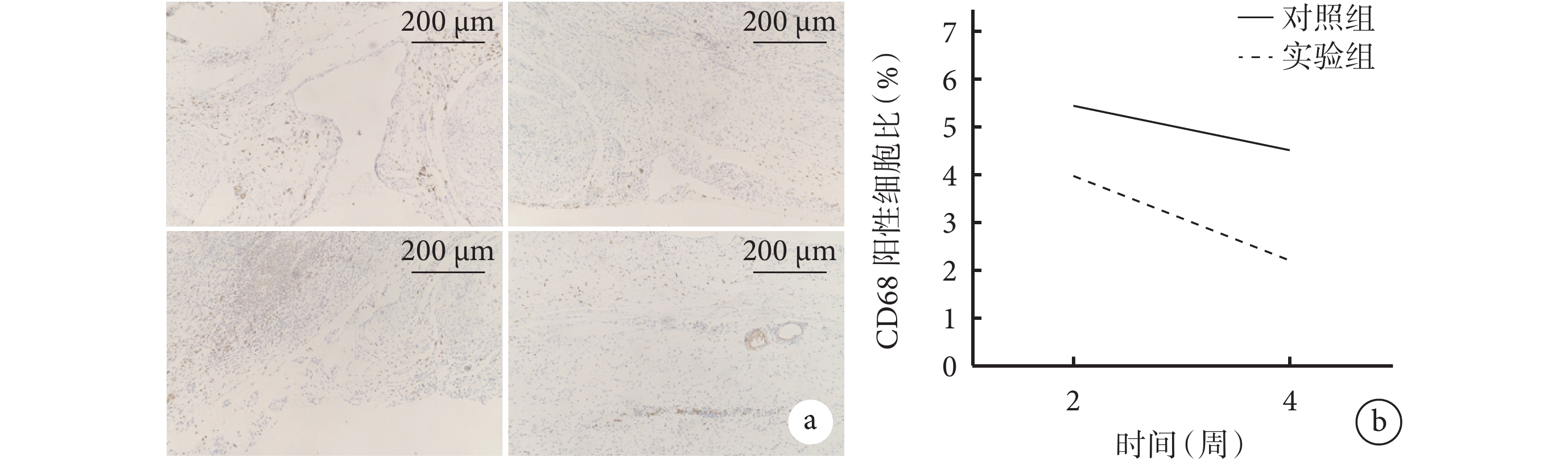 圖8
兩組大鼠體內植入材料各時間點CD68免疫組織化學染色觀察
圖8
兩組大鼠體內植入材料各時間點CD68免疫組織化學染色觀察
a. 對照組(上)和實驗組(下)CD68免疫組織化學染色(×5) 從左至右依次為術后2、4周;b. 兩組CD68陽性細胞比比較
Figure8. CD68 immunohistochemical staining observation of implanted materials in both groups of rats at different time pointsa. CD68 immunohistochemical staining of control group (top) and experimental group (bottom) (×5) From left to right for postoperative 2 and 4 weeks, respectively; b. Comparison of CD68-positive cell ratios between the two groups
3 討論
3.1 CS水凝膠的凝膠化機制
在酸性條件下,CS通常呈可溶狀態,而在中性或堿性環境中,CS鏈之間的靜電相互作用增強,促進凝膠形成。具體而言,當CS溶液調至堿性時,其胺基帶正電荷,導致CS鏈之間的靜電排斥,從而形成凝膠,這一過程被稱為“離子凝膠化”。本研究通過將PP網片浸入pH 6.5~7.0的CS溶液中,實現了PP網片的水凝膠包裹,成功制備了CS水凝膠/PP網片復合材料。大體和顯微鏡觀察結果表明,CS水凝膠緊密包裹PP網片的微結構,有效防止水凝膠在植入后脫落,便于縫合于組織缺損處。
3.2 CS水凝膠的結構特性
掃描電鏡觀察示,CS水凝膠中的孔隙是由于冷凍干燥過程中水分揮發而形成的,這種多孔結構有助于細胞向水凝膠內部生長。雖然由于水凝膠較厚,PP網片的突起在表面不可見,但其側面可見到PP纖維的延伸。部分裂紋是由于冷凍干燥過程中的收縮造成,但這并不影響其在體內的應用。PP網片的堅固結構確保了復合材料的穩定性,而水凝膠的多孔性能保持不變。
3.3 抗粘連和組織修復能力
將PP網片包裹在水凝膠內部解決了其過于疏水的問題,使其更適合組織修復,能有效吸收植入過程中的血液和組織液。DAPI染色結果示,親水性水凝膠表面對細胞黏附有一定阻礙作用,這可能在體內發揮抗粘連的效果。此外,HUVECs管形成實驗結果表明,CS水凝膠顯著促進了內皮細胞的遷移和增殖,形成初步的血管網絡,有助于組織修復。
在大鼠腹壁缺損修補實驗中,復合材料組表現出優于僅使用PP網片組的愈合性能和組織再生能力。水凝膠適當地促進了組織生長,防止粘連并促進了腹壁結構恢復。研究表明,PP網片在植入后可能刺激周圍組織,誘發粘連[22],而CS水凝膠的復合減少了這種刺激,使腹部肌肉組織能夠正常再生。此外,水凝膠在術后2、4周時均促進了缺損處傷口愈合。
3.4 細胞浸潤與膠原沉積
HE染色結果示,水凝膠的植入刺激了細胞的招募,持續促進后續組織再生。膠原沉積方面,水凝膠的植入顯著促進了膠原的有序排列,表明CS在傷口愈合過程中的重要調節作用。這種膠原纖維的定向排列對改善細胞外基質的構建至關重要[23-24]。
3.5 巨噬細胞的作用
在傷口修復過程中,巨噬細胞在組織重塑中起著重要作用[25-27]。CD68免疫組織化學染色示,植入后2周兩組均有大量炎癥細胞,CD68陽性細胞密集聚集在腹壁缺損和材料之間的接觸區域,這可能歸因于腹壁損傷后身體啟動的傷口愈合過程。巨噬細胞的出現有助于清除凋亡細胞和雜質,并為血管生成做準備。有研究表明,巨噬細胞還可以將成纖維細胞和平滑肌細胞吸引到傷口部位,促進膠原基質沉積和傷口組織愈合[28-30]。4周后,復合材料組的CD68陽性細胞比例較低,表明炎癥反應得到了更好的控制。
綜上述,本研究制備的CS水凝膠/PP網片復合材料顯示出良好的生物相容性和親水性,提供了細胞生長的理想支架。通過體外和體內實驗,驗證了該復合材料在抗粘連和促進傷口愈合方面的能力,表明CS水凝膠在愈合過程中具有抗炎和促進血管生成的潛力,為腹壁修復提供了新的見解和策略。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經北京航空航天大學動物實驗倫理審查委員會批準(BM201900117);實驗動物使用許可證批準號:SYXK(京)2019-0017
作者貢獻聲明 張明浩:制作腹壁缺損模型,數據收集;賀唯:修復材料的制備和基本表征,數據分析,文章撰寫;于素香:制作組織切片與染色;邸運濤:指導動物體內植入實驗;李曉明:整體實驗設計和指導,觀點補充及文章修改
外傷、疝氣、腫瘤等都會導致腹壁缺損,腹壁缺損修復一直是外科手術中的難題之一[1]。使用外科手術網片進行腹壁缺損修復是恢復肌肉筋膜層完整性的臨床常規方法;然而,傳統聚合物編織網片的粗糙表面容易摩擦內臟組織,導致與腹腔臟器粘連[2-4],并且因粘連、網片收縮引起的疼痛和細菌感染等并發癥,可導致愈合不良甚至復發[5-7]。為了解決這些問題,研究者們探索了多種方法以最大限度減小手術網片修復腹壁的副作用,其中在網片外包裹一層水凝膠是一種有效方法[8-10]。水凝膠在防止細胞黏附同時促進組織愈合方面表現出優異性能[11-14]。水凝膠不僅在腹壁修復時形成一層固態屏障,還可保證水分和氧氣的透過性,具有類似細胞外基質的結構,可以支持細胞向內生長,其表面的高度親水性減少了細胞黏附位點,不利于成纖維細胞等在水凝膠表面黏附[15],因而用于腹壁修復具有一定抗粘連效果。
殼聚糖(chitosan,CS)作為一種天然多糖,可以從各種海鮮廢棄物中提取和分離,其生物醫學應用已得到廣泛研究[16-19]。CS具有良好的生物相容性、生物降解性以及抗菌性,是制作水凝膠的常用材料之一。CS的降解產物是氨基糖,可以完全被生物體吸收,且體內植入后炎癥反應和毒性小。CS水凝膠在組織工程領域已有廣泛應用,而在腹壁修復領域其具有廣闊應用前景,有望在抗粘連和傷口愈合方面提供新的策略[20-21]。
本研究通過物理交聯方式制備CS水凝膠,并將其與臨床上廣泛使用的聚丙烯(polypropylene,PP)網片復合,制備了CS水凝膠/PP網片復合材料(以下簡稱“復合材料”)。本研究在材料表征的基礎上,通過體外和體內生物學實驗評價復合材料的生物相容性和修復效果,探討CS水凝膠抗粘連和促進傷口愈合的積極作用,為其進一步臨床應用提供實驗依據。
1 材料與方法
1.1 實驗動物及主要材料、儀器
8~10周齡SD雄性大鼠18只,體質量200~250 g,購自北京維通利華實驗動物技術有限公司。于溫度20℃、相對濕度50%±5%環境下合籠飼養,每籠3~4只大鼠,飼養期間大鼠自由進食、水并及時更換飼養墊料,保持籠內衛生環境,從購買至手術前保證4~7 d適應期。
CS(脫乙酰度≥95%)、碳酸鈉(≥99.5%,上海阿拉丁生化科技股份有限公司);PP網片 [強生(上海)醫療器材有限公司];冰乙酸(≥99.5%,天津市致遠化學試劑有限公司);小鼠胚胎成纖維細胞(NIH-3T3;北京鼎國昌盛生物技術有限責任公司);人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs;北京大學人民醫院);Matrigel基質膠(Corning公司,美國);4%組織細胞固定液、抗熒光衰減封片(含DAPI)、改良HE染色試劑盒、改良Masson三色染色試劑盒(北京索萊寶科技有限公司)。
Nikon Eclipse E100光學顯微鏡、LV100ND正置金相顯微鏡 [尼康儀器(上海)有限公司)];JSM-5600LV掃描電鏡(JEOL公司,日本);JC2000FM接觸角測量儀(上海中晨數字技術設備有限公司);FREEZONE 12冷凍干燥機(LABCONCO公司,美國);LSM800熒光顯微鏡(Zeiss公司,德國); AE20熒光倒置顯微鏡(南京瞭望光電技術有限公司)。
1.2 材料制備和表征
用乙酸溶液將CS溶液(4wt%)的pH值調節至5.5~5.8,然后加入飽和碳酸鈉溶液,直至pH值達6.5~7.0;攪拌15 min后,將CS溶液靜置,直至形成CS水凝膠。
將PP網片切割成大小為20 mm×15 mm的矩形塊,并置于直徑6 cm培養皿中。將制備的pH 6.5~7.0并攪拌好的CS溶液緩慢倒入培養皿中,確保溶液均勻分布于PP網片周圍。然后室溫保持24 h,制得復合材料。
大體觀察復合材料外觀,并于正置金相顯微鏡下分別觀察PP網片和復合材料的微觀結構;使用掃描電鏡分別對冷凍干燥處理的CS水凝膠以及復合材料的孔隙微觀形貌進行表征,并通過接觸角測量儀分別測量CS水凝膠和PP網片的表面接觸角來檢測材料的親水性。
1.3 體外細胞培養實驗
① 成纖維細胞浸潤實驗:將滅菌后的復合材料(5 mm×5 mm)和300 μL NIH-3T3細胞懸液(濃度1×105個/mL)加入48孔板中(實驗組),以單純NIH-3T3細胞作為對照組。于37℃、5%CO2條件下培養1、3 d,分別取出行DAPI染色,熒光顯微鏡觀察細胞陽性染色情況。
② HUVECs管形成實驗:將復合材料(5 mm×5 mm)置于預涂有Matrigel基質膠的48孔板中,將1×105個/mL HUVECs接種至樣品上(實驗組),以單純HUVECs作為對照組,于37℃、5%CO2條件下培養6 h,光鏡觀察細胞形態,以探索復合材料的血管生成潛力。
1.4 大鼠腹壁缺損修復實驗
取18只SD大鼠,用0.3%戊巴比妥溶液(40~45 mg/kg)腹膜內注射麻醉。沿中線切開腹部皮膚,于腹部左、右兩側切除腹壁肌肉,以創建1.5 cm×1.0 cm的雙側全厚腹壁缺損。每只大鼠腹壁缺損區一側植入復合材料(實驗組),另一側植入PP網片(對照組),將材料牢固縫合至附近腹部肌肉上,用縫線縫合腹部皮膚。于1、2、4周分別處死6只大鼠,取材進行以下觀測:① 大體觀察腹壁和腹腔內組織之間粘連及缺損傷口愈合情況。② 組織學觀察:將材料置入4%組織細胞固定液中,石蠟包埋固定,切片,片厚4~5 μm。常規行HE染色觀察組織結構和細胞形態學特征;每組隨機選10個視野,使用Image J軟件定量分析材料和腹壁接觸部位處的細胞密度,以檢測植入部位細胞浸潤程度。同時常規行Masson染色觀察組織中膠原纖維的分布、密度和結構變化;每組隨機選10個視野,使用Image J軟件對膠原含量進行定量分析,即陽性染色面積占整體面積的百分比。③ 免疫組織化學染色:術后2、4周取上述部分切片,常規行CD31(血管生成標志物)和CD68(巨噬細胞浸潤標志物)免疫組織化學染色,觀察陽性染色情況;每組隨機選10個視野,使用Image J軟件定量分析陽性細胞密度。
1.5 統計學方法
采用SPSS19.0統計軟件進行分析。計量資料經Sharpiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間及組內兩個時間點間比較采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 材料的表征
大體觀察示,復合材料中的水凝膠薄膜呈淺黃色透明固態,厚度2~3 mm,PP網片被包裹在水凝膠內部,不易剝離。正置金相顯微鏡觀察示,PP網片具有編織形成的網絡結構;而復合材料中的水凝膠包裹著PP網片,且二者結合緊密。掃描電鏡觀察示,CS水凝膠具有大小不一的連通孔隙,孔徑100~300 μm;復合材料中的PP網片在水凝膠中牢固包裹,水凝膠穿透PP網片,形成多孔結構。接觸角測量示,CS水凝膠表面接觸角為(39.2±0.3)°,且水滴滴加于水凝膠表面后數秒內鋪展、消失,說明其具有強烈的吸水性和親水性;而PP網片表面接觸角為(125.9±0.4)°,且水滴滴加于材料表面后可維持較長時間,說明其表面高度疏水。見圖1。
 圖1
CS水凝膠、PP網片及復合材料的表征
圖1
CS水凝膠、PP網片及復合材料的表征
a. 復合材料大體形貌;b. PP網片(左)和復合材料(右)微觀結構(正置金相顯微鏡×2);c. 掃描電鏡觀察CS水凝膠(左,×100)和復合材料(右,×200)橫截面微觀形貌;d. CS水凝膠(左)和PP網片(右)表面接觸角檢測
Figure1. Characterization of CS hydrogel, PP mesh, and compositea. Macroscopic morphology of the composite; b. Microscopic structure of PP mesh (left) and composites (right) (Upright metallographic microscope×2); c. Cross-sectional microscopic morphology of CS hydrogel (left, ×100) and composite (right, ×200) observed by scanning electron microscopy; d. Contact angle measurement of CS hydrogel (left) and PP mesh (right)
2.2 體外細胞培養實驗
DAPI染色示,培養1 d,實驗組陽性細胞數量較少,而對照組陽性細胞長滿整個孔板底部。培養3 d,實驗組可見層次不一的熒光,與水凝膠表面接觸的細胞呈球形,而對照組中細胞則呈梭形。見圖2。
 圖2
復合材料成纖維細胞浸潤實驗(熒光顯微鏡×50)
圖2
復合材料成纖維細胞浸潤實驗(熒光顯微鏡×50)
從左至右依次為培養1、3 d a. 實驗組;b. 對照組
Figure2. Fibroblast infiltration experiment of composites (Fluorescence microscopy×50)From left to right for 1 and 3 days after culture, respectively a. Experimental group; b. Control group
HUVECs管形成實驗結果示,實驗組HUVECs數量增多,且遷移聚攏,有形成管的趨勢;而對照組細胞呈稀疏排布,無遷移趨勢。見圖3。
 圖3
復合材料HUVECs管形成實驗(×100)
圖3
復合材料HUVECs管形成實驗(×100)
a. 對照組;b. 實驗組
Figure3. HUVECs tube formation experiments of composites (×100)a. Control group; b. Experimental group
2.3 大鼠腹壁缺損修復實驗
2.3.1 大體觀察
術后1周,對照組無組織長入,部分黏膜覆蓋;實驗組已有組織和血管長入,開始再生。術后2周,對照組腹壁與脂肪組織粘連,無法分離;實驗組無粘連,缺損處有大量新生組織和微血管。術后4周,對照組傷口部分愈合,新生組織向缺損內部生長,腹壁未完全恢復;實驗組腹壁完整性恢復,組織無粘連,肌肉和血管再生,腹壁解剖結構基本重建。見圖4。
 圖4
大鼠腹壁缺損修復大體觀察
圖4
大鼠腹壁缺損修復大體觀察
a. 對照組(從左至右依次為術后1、2、4周);b. 實驗組(從左至右依次為術后1、2、4周);c. 術后2周腹壁內側(紅箭頭示實驗組,黑箭頭示對照組)
Figure4. Macroscopic observation of rat abdominal wall defect repaira. Control group (From left to right for postoperative 1, 2, and 4 weeks, respectively); b. Experimental group (From left to right for postoperative 1, 2, and 4 weeks, respectively); c. Inner abdominal wall at postoperative 2 weeks (red arrow indicated experimental group, black arrow indicated control group)
2.3.2 HE染色觀察
術后1周,兩組均有大量細胞浸潤,炎癥反應均較明顯,且有纖維囊包覆。術后2、4周,兩組纖維囊仍存在,細胞浸潤減少,可見新生血管形成及新生的腹壁肌肉細胞,炎癥反應減少;對照組細胞均在內部,實驗組細胞在內部浸潤較弱,集中在水凝膠和肌肉組織之間。見圖5a。
 圖5
兩組大鼠體內植入材料各時間點HE染色觀察
圖5
兩組大鼠體內植入材料各時間點HE染色觀察
a. 對照組(上)和實驗組(下)HE染色(×5) 黑色虛線示PP網片區域,紅色虛線示未降解的水凝膠 從左至右依次為術后1、2、4周;b. 兩組材料和腹壁接觸部位處細胞密度比較
Figure5. HE staining observation of implanted materials in both groups of rats at different time pointsa. HE staining of control group (top) and experimental group (bottom) (×5) The black dashed line indicated the PP mesh area, and the red dashed line indicated the undegraded hydrogel From left to right for postoperative 1, 2, and 4 weeks, respectively; b. Comparison of cell density at the interface between the materials and the abdominal wall in both groups
定量分析示,隨時間延長,兩組材料和腹壁接觸部位處細胞密度均有所下降,對照組下降趨勢大于實驗組。除術后1周兩組細胞密度比較差異無統計學意義(P>0.05)外,術后2、4周實驗組細胞密度均高于對照組,差異有統計學意義(P<0.05)。見圖5b。
2.3.3 Masson染色觀察
術后1周,兩組植入部位周圍纖維化明顯,產生大量膠原纖維,膠原排布均不具有取向性,隨機度、混亂度大;術后2周,對照組膠原取向性不明顯,4周時有一定取向性,但PP網片中間被松散的結締組織所填充;術后2、4周,實驗組膠原纖維排布整齊,有較大的定向排列度。定量分析示,術后2周,實驗組膠原含量顯著大于對照組(P<0.05);術后1、4周,兩組植入部位的膠原含量接近,差異無統計學意義(P>0.05)。見圖6。
 圖6
兩組大鼠體內植入材料各時間點Masson染色觀察
圖6
兩組大鼠體內植入材料各時間點Masson染色觀察
a. 對照組(上)和實驗組(下)Masson染色(×5) 黑色虛線示PP網片區域,紅色虛線示未降解的水凝膠 從左至右依次為術后1、2、4周;b. 兩組膠原含量比較
Figure6. Masson staining observation of implanted materials in both groups of rats at different time pointsa. Masson staining of control group (top) and experimental group (bottom) (×5) The black dashed line indicated the PP mesh area, and the red dashed line indicated the undegraded hydrogel From left to right for postoperative 1, 2, and 4 weeks, respectively; b. Comparison of collagen content between the two groups
2.3.4 免疫組織化學染色觀察
術后2周,對照組仍存在較大缺損,CD31陽性細胞集中于缺損處;實驗組CD31陽性細胞分布于新生肌肉層之間,腹壁缺損處的細胞已初步完成增殖重建過程。術后4周,兩組CD31陽性細胞不再集中分布,部分陽性細胞出現在肌肉層之間和腹壁內表面。定量分析示,術后4周兩組CD31陽性細胞比較術后2周明顯減少,差異有統計學意義(P<0.05);術后2周實驗組CD31陽性細胞比顯著高于對照組(P<0.05)。見圖7。
 圖7
兩組大鼠體內植入材料各時間點CD31免疫組織化學染色觀察
圖7
兩組大鼠體內植入材料各時間點CD31免疫組織化學染色觀察
a. 對照組(上)和實驗組(下)CD31免疫組織化學染色(×5) 從左至右依次為術后2、4周;b. 兩組CD31陽性細胞比比較
Figure7. CD31 immunohistochemical staining observation of implanted materials in both groups of rats at different time pointsa. CD31 immunohistochemical staining of control group (top) and experimental group (bottom) (×5) From left to right for postoperative 2 and 4 weeks, respectively; b. Comparison of CD31-positive cell ratios between the two groups
術后2周,兩組均可觀察到大量炎癥細胞,CD68陽性細胞密集聚集于腹壁缺損部位及材料與缺損部位接觸處。術后4周,兩組CD68陽性細胞集中于腹壁內膜和新生肌肉組織層之間。定量分析示,術后4周兩組CD68陽性細胞比與術后2周相比無明顯變化,差異無統計學意義(P>0.05);術后2、4周實驗組CD68陽性細胞比均顯著低于對照組(P<0.05)。見圖8。
 圖8
兩組大鼠體內植入材料各時間點CD68免疫組織化學染色觀察
圖8
兩組大鼠體內植入材料各時間點CD68免疫組織化學染色觀察
a. 對照組(上)和實驗組(下)CD68免疫組織化學染色(×5) 從左至右依次為術后2、4周;b. 兩組CD68陽性細胞比比較
Figure8. CD68 immunohistochemical staining observation of implanted materials in both groups of rats at different time pointsa. CD68 immunohistochemical staining of control group (top) and experimental group (bottom) (×5) From left to right for postoperative 2 and 4 weeks, respectively; b. Comparison of CD68-positive cell ratios between the two groups
3 討論
3.1 CS水凝膠的凝膠化機制
在酸性條件下,CS通常呈可溶狀態,而在中性或堿性環境中,CS鏈之間的靜電相互作用增強,促進凝膠形成。具體而言,當CS溶液調至堿性時,其胺基帶正電荷,導致CS鏈之間的靜電排斥,從而形成凝膠,這一過程被稱為“離子凝膠化”。本研究通過將PP網片浸入pH 6.5~7.0的CS溶液中,實現了PP網片的水凝膠包裹,成功制備了CS水凝膠/PP網片復合材料。大體和顯微鏡觀察結果表明,CS水凝膠緊密包裹PP網片的微結構,有效防止水凝膠在植入后脫落,便于縫合于組織缺損處。
3.2 CS水凝膠的結構特性
掃描電鏡觀察示,CS水凝膠中的孔隙是由于冷凍干燥過程中水分揮發而形成的,這種多孔結構有助于細胞向水凝膠內部生長。雖然由于水凝膠較厚,PP網片的突起在表面不可見,但其側面可見到PP纖維的延伸。部分裂紋是由于冷凍干燥過程中的收縮造成,但這并不影響其在體內的應用。PP網片的堅固結構確保了復合材料的穩定性,而水凝膠的多孔性能保持不變。
3.3 抗粘連和組織修復能力
將PP網片包裹在水凝膠內部解決了其過于疏水的問題,使其更適合組織修復,能有效吸收植入過程中的血液和組織液。DAPI染色結果示,親水性水凝膠表面對細胞黏附有一定阻礙作用,這可能在體內發揮抗粘連的效果。此外,HUVECs管形成實驗結果表明,CS水凝膠顯著促進了內皮細胞的遷移和增殖,形成初步的血管網絡,有助于組織修復。
在大鼠腹壁缺損修補實驗中,復合材料組表現出優于僅使用PP網片組的愈合性能和組織再生能力。水凝膠適當地促進了組織生長,防止粘連并促進了腹壁結構恢復。研究表明,PP網片在植入后可能刺激周圍組織,誘發粘連[22],而CS水凝膠的復合減少了這種刺激,使腹部肌肉組織能夠正常再生。此外,水凝膠在術后2、4周時均促進了缺損處傷口愈合。
3.4 細胞浸潤與膠原沉積
HE染色結果示,水凝膠的植入刺激了細胞的招募,持續促進后續組織再生。膠原沉積方面,水凝膠的植入顯著促進了膠原的有序排列,表明CS在傷口愈合過程中的重要調節作用。這種膠原纖維的定向排列對改善細胞外基質的構建至關重要[23-24]。
3.5 巨噬細胞的作用
在傷口修復過程中,巨噬細胞在組織重塑中起著重要作用[25-27]。CD68免疫組織化學染色示,植入后2周兩組均有大量炎癥細胞,CD68陽性細胞密集聚集在腹壁缺損和材料之間的接觸區域,這可能歸因于腹壁損傷后身體啟動的傷口愈合過程。巨噬細胞的出現有助于清除凋亡細胞和雜質,并為血管生成做準備。有研究表明,巨噬細胞還可以將成纖維細胞和平滑肌細胞吸引到傷口部位,促進膠原基質沉積和傷口組織愈合[28-30]。4周后,復合材料組的CD68陽性細胞比例較低,表明炎癥反應得到了更好的控制。
綜上述,本研究制備的CS水凝膠/PP網片復合材料顯示出良好的生物相容性和親水性,提供了細胞生長的理想支架。通過體外和體內實驗,驗證了該復合材料在抗粘連和促進傷口愈合方面的能力,表明CS水凝膠在愈合過程中具有抗炎和促進血管生成的潛力,為腹壁修復提供了新的見解和策略。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經北京航空航天大學動物實驗倫理審查委員會批準(BM201900117);實驗動物使用許可證批準號:SYXK(京)2019-0017
作者貢獻聲明 張明浩:制作腹壁缺損模型,數據收集;賀唯:修復材料的制備和基本表征,數據分析,文章撰寫;于素香:制作組織切片與染色;邸運濤:指導動物體內植入實驗;李曉明:整體實驗設計和指導,觀點補充及文章修改