引用本文: 賀湘眉, 侯蘭, 王東輝, 楊柳, 李丹璽, 秦元, 張明坤, 趙戈, 張歡, 張聚良. 腔鏡下乳腺癌根治術并全胸肌后乳房植入物重建的臨床應用. 中國修復重建外科雜志, 2024, 38(7): 786-792. doi: 10.7507/1002-1892.202403102 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
乳腺癌是女性常見惡性腫瘤,也是導致癌癥相關死亡的第二大原因,對女性的身心健康構成嚴重威脅[1-3]。隨著綜合治療的不斷進步,乳腺癌治愈率也大幅提升,患者對生活質量的需求越來越高。對于無法保乳的患者,乳房重建成為新的選擇[4-5]。相較于自體重建,基于植入物的乳房重建術具有無供體部位并發癥、恢復時間短的優勢,已成為主流技術[6]。腔鏡下乳腺癌根治術并胸肌后乳房植入物重建作為一種新的手術方式,具有切口隱蔽、創傷小、皮膚血供更好等優點,逐漸引起關注[7-8]。胸肌后乳房植入物重建依靠自體筋膜組織包裹假體完成,無需額外應用補片,費用低廉,且亞洲女性與西方女性相比,乳房體積更小,下垂程度輕,更適用于此術式,便于各級醫院開展[9-11]。 然而,該術式的安全性、治療效果及技術要點等仍存在爭議。本研究回顧分析2019年4月—2023年12月行腔鏡下乳腺癌根治術并全胸肌后乳房植入物重建手術的安全性、腫瘤安全性和患者滿意度,旨在為該術式的臨床應用提供參考。報告如下。
1 臨床資料
1.1 患者選擇標準
納入標準:① 年齡18~65歲女性患者;② 術前經空芯針穿刺活檢病理檢查證實為乳腺惡性腫瘤;③ 經檢查證實腫瘤未侵及皮膚、皮下組織、胸壁及乳頭乳暈復合體(nipple-areola complex,NAC);④ 因存在禁忌證無法行保乳手術或患者主動要求行乳房全切術;⑤ 患者預計生存時間≥6個月。
排除標準:① 行二期乳房重建手術;② 嚴重心肺功能障礙;③ 未保留NAC;④ 有嚴重精神疾病;⑤ 本次術前曾接受乳房整形手術;⑥ 吸煙患者;⑦ 糖尿病患者;⑧ 炎性乳腺癌。
2019年4月—2023年12月共138例患者符合選擇標準納入研究。
1.2 一般資料
患者年齡27~61歲,平均43.8歲;身體質量指數17.58~30.11 kg/m2,平均23.00 kg/m2;腫瘤最長徑1.00~7.10 cm,平均2.70 cm。手術側別:左側66例、右側60例、雙側12例。乳房罩杯為B罩杯128例,C罩杯及以上10例。依據Apodaca分類評價,乳房輕度下垂29例,中度下垂109例。本組患者均無家族史,6例有過敏史,9例有慢性病史,11例有手術史(剖宮產手術9例,子宮內膜癌手術1例,肺癌手術1例),16例已絕經。病理學檢查示雌激素受體陽性108例,孕激素受體陽性108例,人表皮生長因子受體2陽性40例。術前53例患者行新輔助化療。
1.3 手術方法
術前于站立位勾畫患者下皺壁輪廓線。全身麻醉后患者取仰臥位,患側上肢外展約70°,以避免置入腔鏡時外展角度過大影響操作;肩下墊軟枕,常規消毒、鋪單、貼手術貼膜。沿腋窩皮紋作一長約5 cm切口, 對術前超聲檢查提示無腋窩淋巴結轉移,術前淋巴結穿刺未發現癌細胞或新輔助治療后腋窩淋巴結消失者,行前哨淋巴結活檢,結果為陽性者隨后行腋窩淋巴結清掃;術前腋窩淋巴結穿刺提示有淋巴結轉移者,則直接行腋窩淋巴結清掃。前哨淋巴結活檢選擇亞甲藍單示蹤法,注射部位適當遠離NAC,避免由此導致的NAC壞死。
完成腋窩手術后,采用逆序法進行建腔及乳房切除。首先于胸大肌外側緣找到胸大、小肌肌間隙,向內下適當游離;預建腔后,置入80 mm切口保護器,外套無菌手套,并于中指及拇指末端剪一小口,分別置入10 mm、5 mm Trocar,構建單孔腔鏡操作環境。建立氣腔,流量20 L/min,壓力1.33 kPa。以電凝鉤在鏡下完成胸大、小肌間的游離,將乳房下方的胸大肌起點全部離斷,內側游離至平乳頭水平,外側于前鋸肌表面,游離至背闊肌水平;下方胸大肌起點離斷后,繼續沿胸壁表面向下方游離,直至下皺壁輪廓線下方1~2 cm。取出切口保護套,直視下沿胸大肌表面稍游離乳房后間隙,再次置入切口保護套,以電凝鉤游離乳房后間隙,直至下皺壁輪廓線處;在乳房外側及下方注意保留部分筋膜組織,用以包裹假體,小心尋找層次,避免破壞此筋膜層;取出切口保護套,直視下游離乳房皮下皮瓣,部分建腔后再次置入切口保護套,選擇小指末端再剪一小口,置入長柄電刀,原拇指末端置入腔鏡抓鉗,繼續游離皮瓣。靠近NAC區時,首先將NAC兩側皮下組織充分游離,使NAC區下方的乳腺組織呈蒂狀,便于電刀游離;適當遠離NAC皮膚,可保留少量腺體組織與NAC區,防止灼傷致皮膚壞死。繼續游離至乳房周邊界限,將腺體完整切除。以剪刀剪除NAC區后方少許腺體組織,僅保留真皮血管網,將乳頭內大導管牽出,剪除并送快速病理檢查,若切緣陽性則切除NAC區。徹底沖洗切口,充分止血后于胸壁及腋窩處放置引流管,將MENTOR假體(強生公司,美國)由胸大、小肌肌間隙置入,縫合外上間隙,使得假體處于相對封閉的腔隙內,逐層縫合皮膚。
1.4 術后處理及療效評價指標
記錄患者手術時間、術中出血量、假體大小,以及NAC缺血、皮瓣缺血、感染及包膜攣縮等情況。術后常規給予全身化療或內分泌治療,方案遵循美國國家綜合癌癥網絡(NCCN)指南等推薦。34例行術后放療。術后每半年隨訪1次,通過復查乳腺B超、腹部超聲、骨掃描等判斷患者復發轉移情況,使用Breast-Q2.0評分量表行乳房美學、滿意度及生活質量評估(包括乳房滿意度評分、社會心理健康評分和胸部疼痛評分)。根據本組手術在該技術開展后實施的時間,將患者分為第1年內手術組(A組25例)和1年后手術組(B組113例),比較兩組上述結局指標;根據術后隨訪時間將患者分為短期組(隨訪時間<1年)和長期組(隨訪時間≥1年),比較兩組基線資料及術后Breast-Q2.0評分。
1.5 統計學方法
采用SPSS27.0統計軟件進行分析。計量資料經Sharpiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;計數資料組間比較采用連續或校正四格表卡方檢驗或Fisher確切概率法;等級資料組間比較采用Mann-Whitney U 秩和檢驗;檢驗水準α=0.05。
2 結果
138例患者均順利完成手術,無腔鏡轉開放手術患者。手術時間 75~435 min,平均120.76 min;術中出血量5~100 mL,平均23.77 mL;假體大小140~395 mL,平均218.37 mL。術后發生NAC缺血21例(15.22%),皮瓣缺血30例(21.74%),感染23例(16.67%),包膜攣縮33例(23.91%),假體取出2例(1.45%)。除A組手術時間顯著長于B組,差異有統計學意義(P<0.05)外,兩組術中出血量、假體大小及相關并發癥發生情況比較差異均無統計學意義(P>0.05)。見表1。
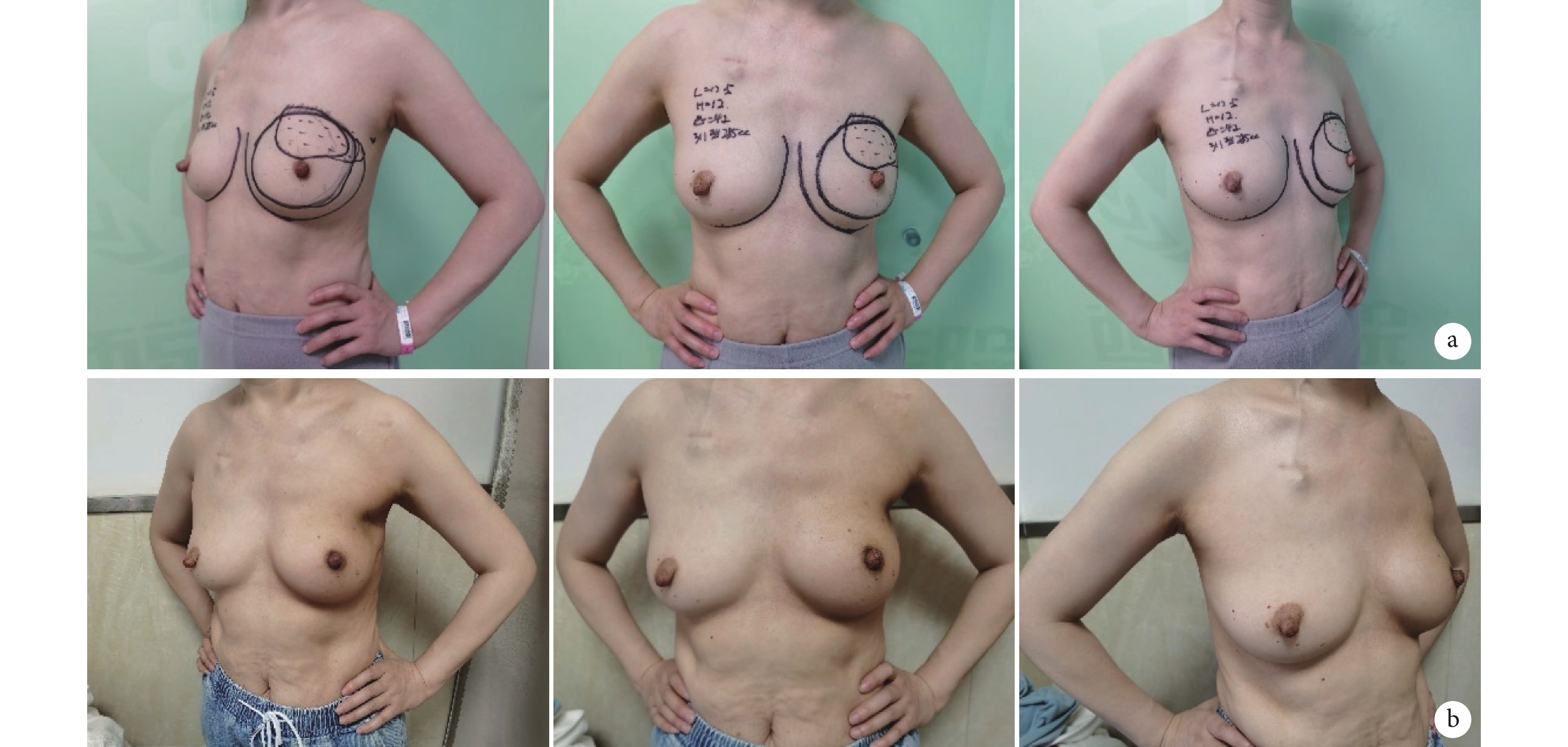
所有患者均獲隨訪,隨訪時間3~48個月,平均20個月;其中短期組33 例,長期組105 例,兩組患者年齡、身體質量指數、絕經例數、新輔助化療例數、腋窩淋巴結清掃例數、乳房罩杯、乳房下垂程度及術后放療構成比等基線資料比較差異均無統計學意義(P>0.05)。末次隨訪時,患者Breast-Q2.0評分中乳房滿意度評分為33~100分,平均60.9分;社會心理健康評分為38~100分,平均71.3分;胸部疼痛評分為20~80分,平均47.3分。其中長期組患者社會心理健康評分高于短期組,差異有統計學意義(P<0.05);兩組乳房滿意度評分及胸部疼痛評分比較差異無統計學意義(P>0.05)。見表2、3。隨訪期間無患者死亡,2例患者復發,其中1例于術后649 d復發,病理類型為雌激素受體和孕激素受體陽性、人表皮生長因子受體2陰性;另1例于術后689 d復發,病理類型為雌激素受體和孕激素受體陰性、人表皮生長因子受體2陽性。本組隨訪期間無復發生存率為98.62%。見圖1。
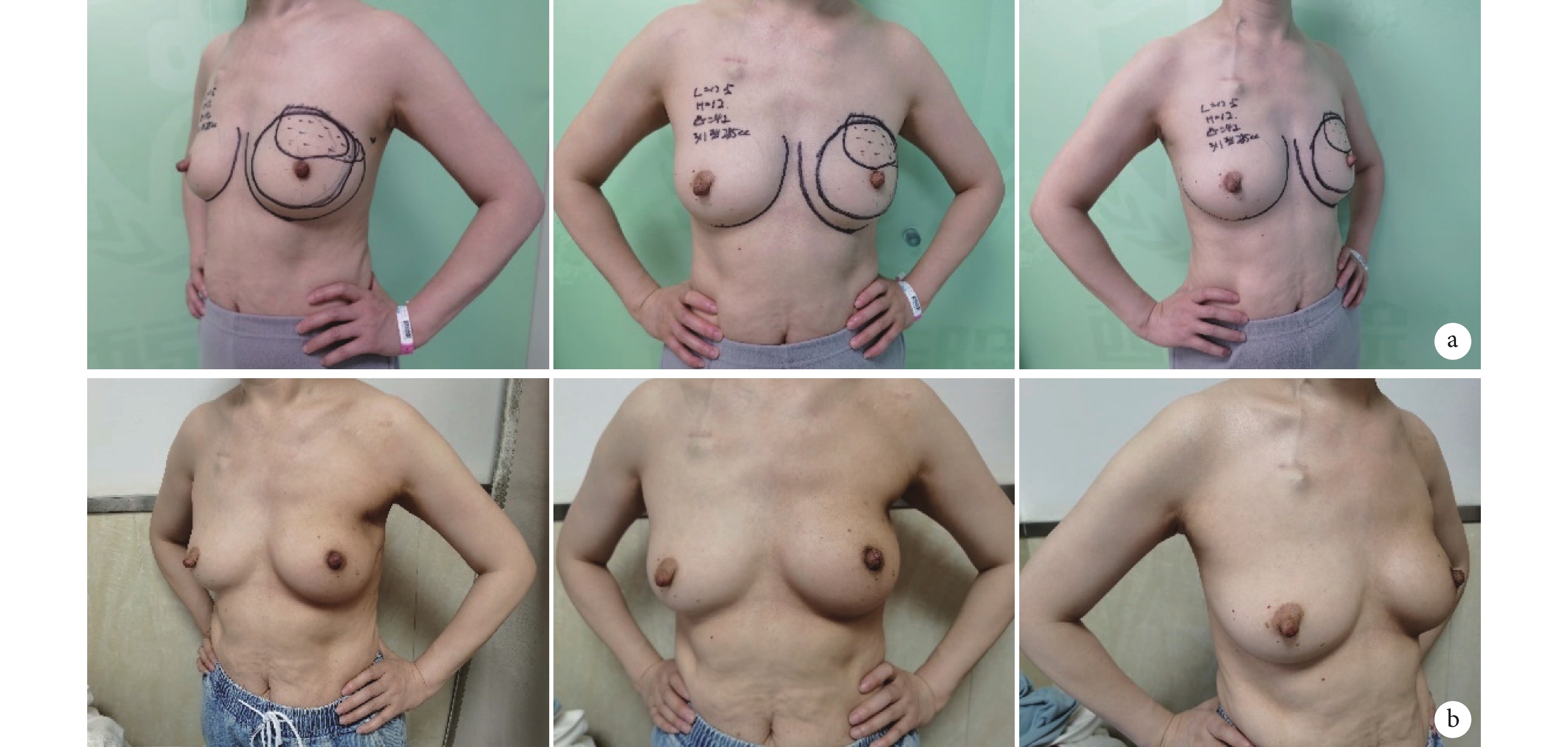 圖1
B組患者,女,48歲,左側乳腺浸潤癌
圖1
B組患者,女,48歲,左側乳腺浸潤癌
從左至右依次為左側位、正位、右側位 a. 術前;b. 術后3個月
Figure1. A 48-year-old female patient with left breast invasive carcinoma in group BFrom left to right for left lateral, frontal, and right lateral position, respectively a. Preoperative; b. At 3 months after operation
3 討論
歐洲腫瘤醫學學會(ESMO)早期乳腺癌患者的診斷、治療和隨訪臨床實踐指南中,明確指出對所有接受乳房全切術的患者均應告知其可進行乳房重建[12]。而乳頭保留乳房切除術并一期植入物乳房重建術是最常用手術方式,近年廣泛應用于臨床,選擇這一術式的比例逐年升高。
相比傳統改良根治手術,乳頭保留乳房切除術并一期植入物乳房重建術由于需要保留NAC區,并考慮美容效果,切口相對較小且隱蔽,常采用外上放射狀切口、下皺壁切口及外側弧形切口等[13]。然而,這些切口方式在不同程度上存在顯露困難,特別是在切除內下方乳腺組織和保留筋膜時。而腔鏡技術提供了更好的視野顯露,放大的視野對于組織結構顯露及相關韌帶保留更具優勢。本研究結果也顯示,因腔鏡下視野更清晰,便于操作,術中出血量少;在經歷一定手術例數的學習曲線后,腔鏡下乳頭保留乳房切除術并一期植入物乳房重建術手術時間大幅縮短,切口更隱蔽且遠離NAC區,NAC缺血發生率較低。
全胸肌后乳房重建手術與胸肌前及胸肌后聯合補片進行的植入物乳房重建不同,通過離斷胸大肌位于乳房下方的起點后,保留乳房后間隙中胸大肌延續筋膜,以此包裹假體,無需使用補片,使假體完全置于自體組織包裹內。因皮瓣下方并非直接接觸植入物,而是與胸肌筋膜組織貼合,因此可快速建立血供,顯著降低皮瓣壞死風險。本研究結果表明,盡管有21.74%患者出現不同程度的皮瓣缺血,但無壞死發生,血供均可逐漸恢復,尤其適用于皮下脂肪薄、腫瘤邊緣距離皮膚較近、切除腺體后可能出現大面積皮瓣壞死的患者。
Warren等[14]的研究發現,乳房切除術后重建患者比僅切除乳房的患者術后感染發生率更高。Azouz等[15]的一項系統回顧研究發現,乳房重建術后最常見的并發癥是感染,發生率為1%~43%。文獻報道的感染發生率異質性較大,主要是由于不同研究者對感染的定義不同。本研究中感染發生率為16.67%,感染率較高的原因可能包括以下三方面:① 本研究中對感染的定義是患者局部皮膚出現發紅、發熱、化膿,需要應用抗生素進行處理,該定義較寬泛,主觀性較強。② 感染發生率數據是根據電話隨訪所得,存在一定偏倚。③ 假體植入較使用自體組織增加了感染風險。采用全胸肌后乳房重建,由于假體被自體組織包裹,即使切口有感染,也很少累及假體,避免了因感染導致的假體取出。部分患者因皮瓣缺血局部破潰伴有感染,但假體因處于胸肌組織或自體筋膜保護中,經局部換藥后均成功愈合。
由于胸肌筋膜組織的局限性,無法和補片一樣更好地適應乳腺外形輪廓,全胸肌后植入物乳房重建無法實現較大下垂度,更適合輕度下垂的乳腺癌患者。研究表明,隨著時間推移,因植入物被更多組織包被,乳腺外形輪廓更趨于自然,滿意度較重建早期更高。對于中重度下垂患者,則會出現雙側不對稱、健側明顯下垂等情況,如追求更高滿意度,常需進行健側乳房上提調整。
由于自體筋膜的局限,全胸肌后植入物乳房重建更容易導致包膜攣縮發生。本研究顯示有23.91%患者出現不同程度包膜攣縮,接受術后輔助放療者比例更高。Bavaro等[16]研究表明,乳房重建術后包膜攣縮發生率超過40%,高于隆胸手術的2%~15%[17]。包膜攣縮的原因包括:① 假體腔游離不充分,尤其是胸大肌起點離斷不徹底;② 假體型號選擇偏大;③ 部分患者存在瘢痕增生的個體差異;④ 術后輔助放療可能對滑膜形成及組織修復產生不同程度影響。因此,手術時需徹底離斷胸大肌下方及部分側方起點,一般至平乳頭水平;離斷胸肌后繼續沿肋間肌淺面向下游離1~2 cm,充分游離腔隙;在相鄰假體型號中選擇偏小的假體,盡可能減少包膜攣縮發生。
全胸肌后植入物乳房重建需要保留胸肌筋膜及部分乳房后間隙組織,而在傳統改良根治手術中,這些組織通常被切除,因此該術式的腫瘤安全性需要關注。本研究平均隨訪時間20個月,乳房重建術后同側乳腺局部復發率為1.45%(2/138),與文獻報道的改良根治術局部復發率約2%相當,顯示出良好安全性[18-19]。有研究顯示,乳腺癌患者行保留乳頭乳暈皮下腺體切除術后,NAC區有更高的局部復發風險,通常是由于為避免NAC區缺血,保留了過多乳腺組織導致[20]。全胸肌后植入物重建因NAC區與深面胸肌組織或自體筋膜組織貼合,不增加缺血壞死風險,同時可更精細地去除腺體組織,包括乳頭內的乳腺導管,腫瘤安全性得到更好保證。
全胸肌后植入物乳房重建因不需要補片,具有更好的經濟性,尤其適合無法獲取補片的醫院開展。但該術式需要離斷胸大肌起點,無法保留胸大肌的部分功能,創傷較大,同時保留胸肌延續筋膜也增加了手術難度,且具有較高包膜攣縮發生率,不適合乳房中重度下垂患者。因此,在臨床實踐中需根據腫瘤特征、健側乳房形態及個人意愿選擇合適的患者實施該術式。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經空軍軍醫大學第一附屬醫院醫學倫理委員會批準(KY20232134-F-1)
作者貢獻聲明 賀湘眉:文章撰寫、患者隨訪、資料收集及整理、統計學分析;侯蘭、楊柳、張歡:數據收集及分析、手術操作;王東輝、李丹璽:患者隨訪、資料收集及整理;秦元、趙戈、張明坤:數據收集及整理、手術操作;張聚良:研究設計、手術操作、論文指導及修改
乳腺癌是女性常見惡性腫瘤,也是導致癌癥相關死亡的第二大原因,對女性的身心健康構成嚴重威脅[1-3]。隨著綜合治療的不斷進步,乳腺癌治愈率也大幅提升,患者對生活質量的需求越來越高。對于無法保乳的患者,乳房重建成為新的選擇[4-5]。相較于自體重建,基于植入物的乳房重建術具有無供體部位并發癥、恢復時間短的優勢,已成為主流技術[6]。腔鏡下乳腺癌根治術并胸肌后乳房植入物重建作為一種新的手術方式,具有切口隱蔽、創傷小、皮膚血供更好等優點,逐漸引起關注[7-8]。胸肌后乳房植入物重建依靠自體筋膜組織包裹假體完成,無需額外應用補片,費用低廉,且亞洲女性與西方女性相比,乳房體積更小,下垂程度輕,更適用于此術式,便于各級醫院開展[9-11]。 然而,該術式的安全性、治療效果及技術要點等仍存在爭議。本研究回顧分析2019年4月—2023年12月行腔鏡下乳腺癌根治術并全胸肌后乳房植入物重建手術的安全性、腫瘤安全性和患者滿意度,旨在為該術式的臨床應用提供參考。報告如下。
1 臨床資料
1.1 患者選擇標準
納入標準:① 年齡18~65歲女性患者;② 術前經空芯針穿刺活檢病理檢查證實為乳腺惡性腫瘤;③ 經檢查證實腫瘤未侵及皮膚、皮下組織、胸壁及乳頭乳暈復合體(nipple-areola complex,NAC);④ 因存在禁忌證無法行保乳手術或患者主動要求行乳房全切術;⑤ 患者預計生存時間≥6個月。
排除標準:① 行二期乳房重建手術;② 嚴重心肺功能障礙;③ 未保留NAC;④ 有嚴重精神疾病;⑤ 本次術前曾接受乳房整形手術;⑥ 吸煙患者;⑦ 糖尿病患者;⑧ 炎性乳腺癌。
2019年4月—2023年12月共138例患者符合選擇標準納入研究。
1.2 一般資料
患者年齡27~61歲,平均43.8歲;身體質量指數17.58~30.11 kg/m2,平均23.00 kg/m2;腫瘤最長徑1.00~7.10 cm,平均2.70 cm。手術側別:左側66例、右側60例、雙側12例。乳房罩杯為B罩杯128例,C罩杯及以上10例。依據Apodaca分類評價,乳房輕度下垂29例,中度下垂109例。本組患者均無家族史,6例有過敏史,9例有慢性病史,11例有手術史(剖宮產手術9例,子宮內膜癌手術1例,肺癌手術1例),16例已絕經。病理學檢查示雌激素受體陽性108例,孕激素受體陽性108例,人表皮生長因子受體2陽性40例。術前53例患者行新輔助化療。
1.3 手術方法
術前于站立位勾畫患者下皺壁輪廓線。全身麻醉后患者取仰臥位,患側上肢外展約70°,以避免置入腔鏡時外展角度過大影響操作;肩下墊軟枕,常規消毒、鋪單、貼手術貼膜。沿腋窩皮紋作一長約5 cm切口, 對術前超聲檢查提示無腋窩淋巴結轉移,術前淋巴結穿刺未發現癌細胞或新輔助治療后腋窩淋巴結消失者,行前哨淋巴結活檢,結果為陽性者隨后行腋窩淋巴結清掃;術前腋窩淋巴結穿刺提示有淋巴結轉移者,則直接行腋窩淋巴結清掃。前哨淋巴結活檢選擇亞甲藍單示蹤法,注射部位適當遠離NAC,避免由此導致的NAC壞死。
完成腋窩手術后,采用逆序法進行建腔及乳房切除。首先于胸大肌外側緣找到胸大、小肌肌間隙,向內下適當游離;預建腔后,置入80 mm切口保護器,外套無菌手套,并于中指及拇指末端剪一小口,分別置入10 mm、5 mm Trocar,構建單孔腔鏡操作環境。建立氣腔,流量20 L/min,壓力1.33 kPa。以電凝鉤在鏡下完成胸大、小肌間的游離,將乳房下方的胸大肌起點全部離斷,內側游離至平乳頭水平,外側于前鋸肌表面,游離至背闊肌水平;下方胸大肌起點離斷后,繼續沿胸壁表面向下方游離,直至下皺壁輪廓線下方1~2 cm。取出切口保護套,直視下沿胸大肌表面稍游離乳房后間隙,再次置入切口保護套,以電凝鉤游離乳房后間隙,直至下皺壁輪廓線處;在乳房外側及下方注意保留部分筋膜組織,用以包裹假體,小心尋找層次,避免破壞此筋膜層;取出切口保護套,直視下游離乳房皮下皮瓣,部分建腔后再次置入切口保護套,選擇小指末端再剪一小口,置入長柄電刀,原拇指末端置入腔鏡抓鉗,繼續游離皮瓣。靠近NAC區時,首先將NAC兩側皮下組織充分游離,使NAC區下方的乳腺組織呈蒂狀,便于電刀游離;適當遠離NAC皮膚,可保留少量腺體組織與NAC區,防止灼傷致皮膚壞死。繼續游離至乳房周邊界限,將腺體完整切除。以剪刀剪除NAC區后方少許腺體組織,僅保留真皮血管網,將乳頭內大導管牽出,剪除并送快速病理檢查,若切緣陽性則切除NAC區。徹底沖洗切口,充分止血后于胸壁及腋窩處放置引流管,將MENTOR假體(強生公司,美國)由胸大、小肌肌間隙置入,縫合外上間隙,使得假體處于相對封閉的腔隙內,逐層縫合皮膚。
1.4 術后處理及療效評價指標
記錄患者手術時間、術中出血量、假體大小,以及NAC缺血、皮瓣缺血、感染及包膜攣縮等情況。術后常規給予全身化療或內分泌治療,方案遵循美國國家綜合癌癥網絡(NCCN)指南等推薦。34例行術后放療。術后每半年隨訪1次,通過復查乳腺B超、腹部超聲、骨掃描等判斷患者復發轉移情況,使用Breast-Q2.0評分量表行乳房美學、滿意度及生活質量評估(包括乳房滿意度評分、社會心理健康評分和胸部疼痛評分)。根據本組手術在該技術開展后實施的時間,將患者分為第1年內手術組(A組25例)和1年后手術組(B組113例),比較兩組上述結局指標;根據術后隨訪時間將患者分為短期組(隨訪時間<1年)和長期組(隨訪時間≥1年),比較兩組基線資料及術后Breast-Q2.0評分。
1.5 統計學方法
采用SPSS27.0統計軟件進行分析。計量資料經Sharpiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;計數資料組間比較采用連續或校正四格表卡方檢驗或Fisher確切概率法;等級資料組間比較采用Mann-Whitney U 秩和檢驗;檢驗水準α=0.05。
2 結果
138例患者均順利完成手術,無腔鏡轉開放手術患者。手術時間 75~435 min,平均120.76 min;術中出血量5~100 mL,平均23.77 mL;假體大小140~395 mL,平均218.37 mL。術后發生NAC缺血21例(15.22%),皮瓣缺血30例(21.74%),感染23例(16.67%),包膜攣縮33例(23.91%),假體取出2例(1.45%)。除A組手術時間顯著長于B組,差異有統計學意義(P<0.05)外,兩組術中出血量、假體大小及相關并發癥發生情況比較差異均無統計學意義(P>0.05)。見表1。
所有患者均獲隨訪,隨訪時間3~48個月,平均20個月;其中短期組33 例,長期組105 例,兩組患者年齡、身體質量指數、絕經例數、新輔助化療例數、腋窩淋巴結清掃例數、乳房罩杯、乳房下垂程度及術后放療構成比等基線資料比較差異均無統計學意義(P>0.05)。末次隨訪時,患者Breast-Q2.0評分中乳房滿意度評分為33~100分,平均60.9分;社會心理健康評分為38~100分,平均71.3分;胸部疼痛評分為20~80分,平均47.3分。其中長期組患者社會心理健康評分高于短期組,差異有統計學意義(P<0.05);兩組乳房滿意度評分及胸部疼痛評分比較差異無統計學意義(P>0.05)。見表2、3。隨訪期間無患者死亡,2例患者復發,其中1例于術后649 d復發,病理類型為雌激素受體和孕激素受體陽性、人表皮生長因子受體2陰性;另1例于術后689 d復發,病理類型為雌激素受體和孕激素受體陰性、人表皮生長因子受體2陽性。本組隨訪期間無復發生存率為98.62%。見圖1。
 圖1
B組患者,女,48歲,左側乳腺浸潤癌
圖1
B組患者,女,48歲,左側乳腺浸潤癌
從左至右依次為左側位、正位、右側位 a. 術前;b. 術后3個月
Figure1. A 48-year-old female patient with left breast invasive carcinoma in group BFrom left to right for left lateral, frontal, and right lateral position, respectively a. Preoperative; b. At 3 months after operation
3 討論
歐洲腫瘤醫學學會(ESMO)早期乳腺癌患者的診斷、治療和隨訪臨床實踐指南中,明確指出對所有接受乳房全切術的患者均應告知其可進行乳房重建[12]。而乳頭保留乳房切除術并一期植入物乳房重建術是最常用手術方式,近年廣泛應用于臨床,選擇這一術式的比例逐年升高。
相比傳統改良根治手術,乳頭保留乳房切除術并一期植入物乳房重建術由于需要保留NAC區,并考慮美容效果,切口相對較小且隱蔽,常采用外上放射狀切口、下皺壁切口及外側弧形切口等[13]。然而,這些切口方式在不同程度上存在顯露困難,特別是在切除內下方乳腺組織和保留筋膜時。而腔鏡技術提供了更好的視野顯露,放大的視野對于組織結構顯露及相關韌帶保留更具優勢。本研究結果也顯示,因腔鏡下視野更清晰,便于操作,術中出血量少;在經歷一定手術例數的學習曲線后,腔鏡下乳頭保留乳房切除術并一期植入物乳房重建術手術時間大幅縮短,切口更隱蔽且遠離NAC區,NAC缺血發生率較低。
全胸肌后乳房重建手術與胸肌前及胸肌后聯合補片進行的植入物乳房重建不同,通過離斷胸大肌位于乳房下方的起點后,保留乳房后間隙中胸大肌延續筋膜,以此包裹假體,無需使用補片,使假體完全置于自體組織包裹內。因皮瓣下方并非直接接觸植入物,而是與胸肌筋膜組織貼合,因此可快速建立血供,顯著降低皮瓣壞死風險。本研究結果表明,盡管有21.74%患者出現不同程度的皮瓣缺血,但無壞死發生,血供均可逐漸恢復,尤其適用于皮下脂肪薄、腫瘤邊緣距離皮膚較近、切除腺體后可能出現大面積皮瓣壞死的患者。
Warren等[14]的研究發現,乳房切除術后重建患者比僅切除乳房的患者術后感染發生率更高。Azouz等[15]的一項系統回顧研究發現,乳房重建術后最常見的并發癥是感染,發生率為1%~43%。文獻報道的感染發生率異質性較大,主要是由于不同研究者對感染的定義不同。本研究中感染發生率為16.67%,感染率較高的原因可能包括以下三方面:① 本研究中對感染的定義是患者局部皮膚出現發紅、發熱、化膿,需要應用抗生素進行處理,該定義較寬泛,主觀性較強。② 感染發生率數據是根據電話隨訪所得,存在一定偏倚。③ 假體植入較使用自體組織增加了感染風險。采用全胸肌后乳房重建,由于假體被自體組織包裹,即使切口有感染,也很少累及假體,避免了因感染導致的假體取出。部分患者因皮瓣缺血局部破潰伴有感染,但假體因處于胸肌組織或自體筋膜保護中,經局部換藥后均成功愈合。
由于胸肌筋膜組織的局限性,無法和補片一樣更好地適應乳腺外形輪廓,全胸肌后植入物乳房重建無法實現較大下垂度,更適合輕度下垂的乳腺癌患者。研究表明,隨著時間推移,因植入物被更多組織包被,乳腺外形輪廓更趨于自然,滿意度較重建早期更高。對于中重度下垂患者,則會出現雙側不對稱、健側明顯下垂等情況,如追求更高滿意度,常需進行健側乳房上提調整。
由于自體筋膜的局限,全胸肌后植入物乳房重建更容易導致包膜攣縮發生。本研究顯示有23.91%患者出現不同程度包膜攣縮,接受術后輔助放療者比例更高。Bavaro等[16]研究表明,乳房重建術后包膜攣縮發生率超過40%,高于隆胸手術的2%~15%[17]。包膜攣縮的原因包括:① 假體腔游離不充分,尤其是胸大肌起點離斷不徹底;② 假體型號選擇偏大;③ 部分患者存在瘢痕增生的個體差異;④ 術后輔助放療可能對滑膜形成及組織修復產生不同程度影響。因此,手術時需徹底離斷胸大肌下方及部分側方起點,一般至平乳頭水平;離斷胸肌后繼續沿肋間肌淺面向下游離1~2 cm,充分游離腔隙;在相鄰假體型號中選擇偏小的假體,盡可能減少包膜攣縮發生。
全胸肌后植入物乳房重建需要保留胸肌筋膜及部分乳房后間隙組織,而在傳統改良根治手術中,這些組織通常被切除,因此該術式的腫瘤安全性需要關注。本研究平均隨訪時間20個月,乳房重建術后同側乳腺局部復發率為1.45%(2/138),與文獻報道的改良根治術局部復發率約2%相當,顯示出良好安全性[18-19]。有研究顯示,乳腺癌患者行保留乳頭乳暈皮下腺體切除術后,NAC區有更高的局部復發風險,通常是由于為避免NAC區缺血,保留了過多乳腺組織導致[20]。全胸肌后植入物重建因NAC區與深面胸肌組織或自體筋膜組織貼合,不增加缺血壞死風險,同時可更精細地去除腺體組織,包括乳頭內的乳腺導管,腫瘤安全性得到更好保證。
全胸肌后植入物乳房重建因不需要補片,具有更好的經濟性,尤其適合無法獲取補片的醫院開展。但該術式需要離斷胸大肌起點,無法保留胸大肌的部分功能,創傷較大,同時保留胸肌延續筋膜也增加了手術難度,且具有較高包膜攣縮發生率,不適合乳房中重度下垂患者。因此,在臨床實踐中需根據腫瘤特征、健側乳房形態及個人意愿選擇合適的患者實施該術式。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經空軍軍醫大學第一附屬醫院醫學倫理委員會批準(KY20232134-F-1)
作者貢獻聲明 賀湘眉:文章撰寫、患者隨訪、資料收集及整理、統計學分析;侯蘭、楊柳、張歡:數據收集及分析、手術操作;王東輝、李丹璽:患者隨訪、資料收集及整理;秦元、趙戈、張明坤:數據收集及整理、手術操作;張聚良:研究設計、手術操作、論文指導及修改